Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Очистка биотинилированных клеточных поверхностных белков от
В этой статье
Резюме
Методика, основанная на модифицированном градиенте плотности центрифугирования, была использована для выделения эпителиальных клеток из ткани кишечника Ripicephalus microplus . Поверхностные белки биотинилировали и очищали с помощью стрептовидиновых магнитных гранул для использования в нисходящих приложениях.
Аннотация
Rhipicephalus microplus - клещ крупного рогатого скота - является самым значительным эктопаразитом с точки зрения экономического воздействия на скот в качестве вектора нескольких патогенов. Усилия были направлены на контроль клеща крупного рогатого скота, чтобы уменьшить его пагубные последствия, с упором на открытие кандидатов на вакцины, таких как BM86, расположенных на поверхности эпителиальных клеток кишечника. В текущих исследованиях основное внимание уделяется использованию кДНК и геномных библиотек для скрининга других кандидатов на вакцины. Выделение клеток клещей кишки является важным преимуществом при исследовании состава поверхностных белков на мембране клеток клещей. Эта статья представляет собой новый и осуществимый метод выделения эпителиальных клеток, из содержимого кишечника в виде полупоглощенного R. microplus. В этом протоколе используются TCEP и EDTA для высвобождения эпителиальных клеток из субэпителиальных опорных тканей и градиента дискретной плотности центрифугированияNt для отделения эпителиальных клеток от других типов клеток. Белки клеточной поверхности были биотинилированы и выделены из эпителиальных клеток тикового кишечника, используя магнитные гранулы, связанные с стрептавидином, что позволяет использовать последующие приложения в FACS или LC-MS / MS-анализе.
Введение
Rhipicephalus microplus , крупный рогатый скот, является самым значительным эктопаразитом с точки зрения экономического воздействия на крупный рогатый скот в тропических и субтропических регионах, поскольку он переносит лихорадку крупного рогатого скота (бабезиоз), анаплазмоз и конский пироплазмоз 1 , 2 , 3 , 4 . Усилия были направлены на контроль крупного рогатого скота, чтобы уменьшить пагубный эффект, однако обычные методы, такие как использование химических акарицидов, имеют скрытые недостатки, такие как наличие химических остатков в молоке и мясе, а также увеличение распространенности химически устойчивых клещей 5 , 6 , 7 . Следовательно, были изучены разработки альтернативных методов контроля тика, такие как использование натурального скота, биологический контроль (биопестициды) и вакцинация4 , 5 , 6 , 7 , 8 , 9 .
В погоне за белками, которые могут быть использованы в качестве кандидатов на вакцины, текущие исследования сосредоточены на кишке. Стена средней кишки построена из одного слоя эпителиальных клеток, опирающегося на тонкую базальную пластинку, а наружная базальная пластинка образует сеть мышц. Наблюдения света и электронного микроскопа показывают, что средняя кишка состоит из трех типов клеток: резервной (недифференцированной), секреторной и пищеварительной. Количество типов клеток значительно варьируется в зависимости от физиологической фазы. Секреторные и пищеварительные клетки происходят из резервных клеток 18 , 19 , 20 .
Построение библиотек кДНКДля изучения состава клещей кишки привело к идентификации антигенных белков, таких как Bm86, в качестве потенциальных кандидатов вакцины 2 , 3 , 4 . Гликопротеин Bm86 локализуется на поверхности клеток кишечника клещей и индуцирует защитный иммунный ответ против клеща крупного рогатого скота ( R. microplus ) у вакцинированного крупного рогатого скота. Анти-Bm86 IgG, продуцируемые иммунизированным хозяином, проглатываются клещей, распознают этот антиген на поверхности клеток кишечника клеща и впоследствии нарушают функцию и целостность ткани кишечника. Вакцины, основанные на антигенах Bm86, показали эффективный контроль R. microplus и Rhipicephalus annulatus за счет сокращения числа, веса и репродуктивной способности сыпучих самок, что привело к снижению личиночной инвазии в последующих клеточных поколениях 4 . Однако вакцины на основе Bm86 не эффективны против всех этапов тика и имеютПродемонстрировали неудовлетворительную эффективность против некоторых географических штаммов R. microplus , поэтому говядина и молочная промышленность плохо приняли эти вакцины 2 , 4 .
Способность изолировать эпителиальные клетки от клещей кишечника является важным новшеством, которое позволило бы прогрессировать исследования для определения состава белковой мембраны, включая морфологию и физиологию в различных условиях окружающей среды. Описанный здесь способ использует хелатирующий агент этилендиаминтетрауксусную кислоту (ЭДТА) и восстановитель трис (2-карбоксиэтил) фосфин (TCEP) для высвобождения эпителия из его субэпителиальных поддерживающих тканей 10 . Эпителий восстанавливается после механического разрушения тканей путем встряхивания с последующим центрифугированием с разрывом градиента в Percoll. В этой статье описывается возможный и новый метод изоляции клещей кишечника epiТеалиальные клетки. Биотинилированные клеточные поверхностные белки, выделенные с поверхности этих эпителиальных клеток, могут впоследствии анализироваться в нисходящих приложениях, таких как FACS и / или LC-MS / MS-анализ.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Рассечение кишечного эпителия от R. microplus
- Собирайте полупоглощенные клещи от крупного рогатого скота в день эксперимента. Просеивать тики в течение 24 часов после удаления с хозяина.
- Прикрепите полоску клейкой ленты к нижней части чашки Петри размером 92 мм x 16 мм. Добавьте каплю супер клея на ленту. Поместите тик, вентральную сторону вниз на супер клей, дайте высохнуть в течение 2 мин.
- Налейте 100 мл фосфатно-буферного солевого раствора (PBS) в чашку Петри или до тех пор, пока тик не будет полностью погружен в воду.
- С помощью скальпеля размером 11, вырезанного с верхней части глаз до нижнего фестона, с обеих сторон клеща.
- С помощью стерильного пинцета, полностью удалить Щит и alloscutum, чтобы выставить внутренние органы.
- Удалите мелкие белые нитевидные органы (трахею) и другие мембраны, чтобы предотвратить загрязнение.
- Удалите кишку, используя щипцы, зажав верхнюю область и вытащив ее изтушки. Удалите все оставшиеся ткани кишечника, гарантируя, что никакие другие ткани не будут расчленены.
- Хранить кишечник в ледяном солевом растворе Хэнкса (HBSS) без хлорида кальция и сульфата магния с коктейлем ингибитора протеиназы (ПОС). Snap заморозить кишки в сухом льду и хранить при -20 ° C.
Примечание: для оказания помощи при расщеплении кишечника и деталях клеточных внутренних органов см. Главу 3.1 Д. Sonenshine, «Biology of Ticks» 19 .
2. Диссоциация эпителиальных клеток
- Вылейте расчлененную кишку на сетчатый фильтр размером 70 мкм внутри трубки объемом 50 мл.
- Промойте ткань кишечника 50 мл ледяного HBSS с помощью PIC, пока раствор не станет прозрачным, и кишки приобретают белый / прозрачный вид.
- Повторно суспендируйте кишки в 30 мл ледяной HBSS с помощью PIC, осторожно перемешайте и центрифугируйте при 500 × g при 4 ° C в течение 10 минут, чтобы осадить кишечник. Удалите супернатант и повторите процесс стирки три раза.
- Чтобы выбить эпителиальные кишечные клетки, повторно суспендировать кишечник в 10 мл среды культивирования клеток Дульбекко, модифицированную среду орла (DMEM), 2% фетальной телячьей сыворотки (FCS), 0,5 мМ этилендиаминтетрауксусной кислоты (EDTA), 1 мМ Трис (2 -карбоксиэтил) фосфина (TCEP), ПОС и инкубируют в течение 60 мин при 37 ° С при медленном вращении с использованием ролика при 6 об / мин.
- Отфильтруйте суспензию через сетчатый фильтр размером 250 мкм, прокрутите проточный фильтр и процедите через сетчатый фильтр размером 70 мкм, собирая оставшийся сквозной поток.
- Центрифугируйте суспензию при 500 × g при 4 ° C в течение 20 минут, чтобы осадить отдельные клетки.
3. Выделение одиночных эпителиальных клеток с использованием градиента центрифугирования плотности
- Подготовьте градиент центрифугирования плотности ( например , Percoll) путем фильтрации через предварительно фильтрующую бумагу AP15. Подготовьте 40% и 20% Percoll в mqH 2 0 (об. / Об.) И охладите при 4 ° C в течение 1 часа перед расслоением градиента.
- Использование перистальтикиНасос на минимальной скорости, слой 3 мл градиента центрифугирования плотности 40% в пробирку для ультрацентрифугирования емкостью 16 мл, позволяя ему оседать на льду в течение 15 мин. Скорость насоса должна приводить к скорости потока <1 мл на мин.
- Наклоняя трубку под углом 45 °, используйте перистальтический насос для выравнивания градиента центрифугирования плотности 20% поверх слоя 40%. Скорость насоса должна составлять менее 1 мл на минуту. Дайте слоям оседать на льду в течение 15 мин.
- Используйте перистальтический насос со скоростью <1 мл на минуту до слоя 3 мл среды DMEM, содержащей клетки клещевого кишки, с градиентом центрифугирования с концентрацией 20-40%.
- Запрограммируйте центрифугу для максимального ускорения и минимального замедления. Центрифуга при 600 мкг в течение 10 мин. Собирайте интерфазы между градиентом центрифугирования плотности DMEM: 20% и градиентами центрифугирования плотности 20%: 40% для выделения эпителиальных отдельных клеток. Храните собранные интерфазы при 4 ° C для последующего анализа.
4. Оценка изоляции клеток
- гомоцитометр
- Очистите гемацитометр слайдом со спиртом.
- . Подвесить клетки, осторожно пипеткой клеток вверх и вниз. Пипеткой 100 мкл клеточной суспензии и помещают в 1,5 мл микроцентрифужную пробирку.
- Добавить 400 мкл 0,4% трипанового синего. Аккуратно перемешайте трубку.
- Внесите 100 мкл суспензии клеток, обработанной Trypan Blue, для медленного заполнения обеих камер гемоцитометра.
- Поместите гемоцитометр под световым микроскопом, сосредоточив внимание на линиях сетки гемоцитометра с объективом 10X.
- Используя ручной счетчик счетчиков, подсчитайте живые незакрашенные ячейки в пределах набора из 16 квадратов. В пределах одной и той же площади подсчитайте синие мертвые клетки. Продолжайте считать до четырех наборов из 16 квадратов.
- Рассчитайте общее количество клеток на мл, используя формулу:
47eq1.jpg "/> - Вычислите процентную жизнеспособность клеток, используя формулу:
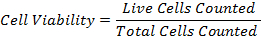
- Визуализация изолятов клеток
- Разбавьте 1 мкл изолированных клеток в 9 мкл HBSS в 1,5 мл микроцентрифужной пробирке. Протрите микроцентрифужную пробирку мягко, чтобы перемешать.
- Внесите 5 мкл изолированных клеток в HBSS в середину стеклянного слайда. Нанесите три капли монтажной среды с помощью 4 ', 6-диамидино-2-фенилиндола (DAPI).
- Инкубируйте слайд при комнатной температуре в течение 5 мин. Осторожно поместите крышку над препаратом, избегая пузырьков воздуха.
- Визуализируйте клетки, окрашенные DAPI при возбуждении 360 нм, и излучение при 460 нм под флуоресцентным микроскопом.
5. Биотинилирование поверхностных белков клеток
- Биотинилируют 100 мкл одноклеточных эпителиальных клеток с использованием конъюгации биотина (типа А)Комплект, при молярном отношении поверхностного белка 1: 1 к конъюгату, согласно инструкциям производителя
- Для лизиса клеток добавьте 100 мкл PBS, 1% Triton X-100, 10% глицерина, 100 мкМ окисленного глутатиона и PIC в биотинилированные клетки. Инкубируйте на льду в течение 1 ч с осторожным перемешиванием каждые 10 мин.
- Центрифугируют биотинилированные клетки при 20 000 × g при 4 ° C в течение 20 минут до нерастворимого в гранулах материала. Собирают супернатант, содержащий цитоплазматические и биотинилированные мембранные белки.
- Определите концентрацию белка, используя анализ Брэдфорда.
6. Выделение биотинилированных поверхностных белков
- Добавить 50 мкл магнитных шариков Стрептавидина в 1,5 мл микроцентрифужную пробирку.
- Поместите трубу в магнитную подставку, собирая бусины сбоку от трубки. Удалите и выбросьте супернатант.
- Добавить 1000 мкл TBS, 0,1% Tween-20 в пробирку. Аккуратно перемешайте и соберите бусины с магнитной стойкойд. Удалите и выбросьте супернатант.
- Объединить 40 мкг биотинилированных поверхностных белков клеток, разведенных до 300 мкл в 1х PBS с промытыми магнитными шариками. Инкубируйте в течение 2 ч при комнатной температуре при перемешивании.
- Соберите бусины с магнитной подставкой, удалите и выбросьте супернатант.
- Добавить 300 мкл TBS, 0,1% Tween-20 в пробирку, осторожно перемешивая для повторного суспендирования гранул. Соберите бусинки, удалите и выбросьте надосадочную жидкость. Повторите эту операцию промывки дважды.
- Добавьте 100 мкл 0,1 М глицина pH 2,0 к магнитным гранулам и инкубируйте при комнатной температуре в течение 5 мин. Соберите гранулы и удалите супернатант, содержащий элюированные биотинилированные поверхностные белки.
- Визуализируйте изолированные поверхностные белки на 4-20% гель Tris-MOPS SDS-PAGE.
7. Оценка биотинилированного поверхностного белка
- Dot Blot
- Отрежьте полосу нитроцеллюлозы размером 7 см х 3 см.
- Примените 10 мкг общего тика гу(От 1,8 выше) и 10 мкг биотинилированного поверхностного белка к мембране. Разрешить сушку в течение 15 мин при комнатной температуре.
- Перенесите в контейнер и погрузите в 100 мл блокирующего буфера. Инкубируйте при комнатной температуре с перемешиванием в течение часа. Отменить блокирующий буфер.
- Промыть нитроцеллюлозную мембрану в 100 мкл PBS, 0,05% Tween-20 в течение 5 мин при перемешивании. Откажитесь от промывочного буфера и повторите промывки три раза.
- Инкубируйте в 1/5000 пероксидазы стрептавидин-хрена (HRP) в 100 мкл PBS, 0,05% Tween-20 в течение 2 часов при перемешивании при комнатной температуре и отбрасывают любой оставшийся раствор.
- Промыть нитроцеллюлозную мембрану в 100 мкл PBS, 0,05% Tween-20 в течение 5 мин при перемешивании. Удалите промывочный буфер и повторите промывку три раза.
- Для обнаружения растворите 1 таблетку 4-хлор-1-наптола в 10 мл ледяного метанола. Добавьте 4 мл метанола в 20 мл TBS. Добавьте 10 мкл свежего 30% перекиси водорода и немедленноПрименяются к нитроцеллюлозной мембране.
- Инкубируйте при перемешивании при комнатной температуре, пока субстрат не образует нерастворимый синий конечный продукт. Это может занять от 2 до 15 минут.
- Откажитесь от раствора для обнаружения и промойте мембрану три раза в 100 мкл mqH 2 O.
- Анализ ELISA
- Разбавьте 200 нг каждого образца 400 мкл 100 мМ буфера для карбонатного покрытия и слоем 2 полосы первого ряда (A #) пластины ELISA (плоские дно)
- Добавьте 100 мкл 100 мМ буфера для карбонатного покрытия во все другие соответствующие лунки в рядах (BH).
- Подготовьте серийные разведения каждого образца путем пипетирования 100 мкл из каждой лунки в ряду А и переноса в ряд В. Смешайте осторожно путем пипетирования и избегайте образования пузырьков. Повторите разведения вниз по каждой строке, отбросив окончательные 100 мкл от каждой лунки в ряду H.
- Накройте пластину парафильмом и инкубируйте при 4 ° C в течение ночи.
- Вымойте плитуС 200 мкл PBS, 0,05% Tween-20 на лунку три раза.
- Добавьте 200 мкл блокирующего буфера в покрытые лунки, накройте Parafilm и инкубируйте при 4 ° C в течение ночи.
- Разбавьте 1/15 000 стрептавидин-HRP в блокирующем буфере и добавьте 100 мкл в каждую лунку планшета. Накрыть парафильмом и инкубировать при 4 ° C в течение ночи.
- Промойте планшет в 200 мкл PBS, 0,05% Tween-20 на лунку пять раз.
- Чтобы обнаружить, добавьте 100 мкл реагента ТМБ на лунку. После достаточного развития цвета, обычно между 10-15 мин, добавьте 100 мкл 1 М фосфорной кислоты, чтобы остановить реакцию.
- Прочтите поглощение каждой лунки при λ = 450 нм.
Access restricted. Please log in or start a trial to view this content.
Результаты
Эпителиальные клетки были выделены из тканей кишечника R. microplus в соответствии с схемой, представленной на рисунке 1 . Репрезентативные снимки флуоресцентной микроскопии эпителиальных клеток кишечника, полученные с использованием этог?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Население крупного рогатого скота представляет собой серьезную проблему для крупного рогатого скота в тропических и субтропических регионах мира, причем наиболее распространенный метод контроля зависит от использования акарицидов 1 , 4 . Bm86 ранее был и?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить биозащищенности Tick колонию (Квинсленд Департамент сельского хозяйства и рыболовство, Австралия) для предоставления Rhipicephalus MicroPlus клещи , используемой для данного исследования, и Лукас Karbanowicz за помощью видеосъемки.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | ThermoFisher Scientific | 15250061 | |
| 1.5 mL microcentrifuge tube | Eppendorf | 3322 | |
| 100mM Carbonate Buffer | 3.03 g Na2CO3, 6.0 g NaHCO3 1000 ml distilled water pH 9.6 | ||
| 16 mL centrifuge tubes with sealing cap | Thermo Scientific | 3138-0016 | Cool in ice prior to gradient |
| 250 µM cell strainer | Thermo Fisher | 87791 | |
| 3,3′,5,5′-Tetramethylbenzidine (TMB) Liquid Substrate System for ELISA | Sigma | T0440 | Stored at 4C |
| 30% Hydrogen Peroxide | Labscene | BSPA5.500 | |
| 4-20% Tris-MOPS Gel | Gen Script | M42015 | |
| 4-Chloro-1-naphthol tablet | Sigma-Aldrich | C6788 | |
| 50 mL Falcon Tube | Corning Blue | 30 x 115mm style. Polyproplyene conical tube. | |
| 70 µM cell strainer | BD Falcon | 352350 | |
| AP15 filter paper | Millipore | AO1504200 | |
| Biotin (Type A) Conjugation Kit | Abcam | Ab102865 | |
| Dissection microscope | Olympus | SZX7 | |
| DP Manager | Olympus | 2.2.1.195 | Cell imagery software |
| Duct Tape | Home Handyman | 48mm x 25mm Duct Tape | |
| Dulbecco’s Modified Eagle Medium | Gibco | 11995-065 | DMEM - ice cold for protocol |
| EDTA | Amresco | 0105-500G | |
| F96 Maxisorp Immuno Plate | Nunc | 439454 | |
| Fetal Bovine Serum | Sigma-Aldrich | 12003C | FCS |
| Fluorescence microscope | Olympus | BX51 | |
| Fluoroshield with DAPI | Sigma-Aldrich | F6057-20ML | DAPI |
| Forceps | Dumont | #9 Dumont - Switerzland | |
| Glycerol | Sigma-Aldrich | G5516 | Glycerol for molecular biology >99% |
| Glycine | Sigma-Aldrich | 410225 | |
| Hand-Held Counter | Officeworks | JA0376230 | |
| Hank’s Balanced Salt Solution | Sigma Life Sciences | H9394 | HBSS – ice cold for protocol |
| Hemacytometer | Optik Lakor | - | - |
| L-Glutathione oxidized | Sigma-Aldrich | G4376 | |
| Magnetic Separation Stand | Novagen | - | 4-Tube Magnetic Separation Rack |
| Methanol | Sigma-Aldrich | 179337 | |
| Milli-Q Water | Millipore | ZRXQ003WW | Integral Water Purification System for Ultrapure Water |
| Nitrocellulose Membrane | Life Sciences | 66485 | 30cm x 3M pure nitrocellulose membrane |
| PageRuler Prestained protein Ladder | Thermo-Fisher | SM0671 | |
| PBS | 1.16 g Na2HPO4, 0.1 g KCl, 0.1 g K3PO4, 4.0 g NaCl (500 ml distilled water) pH 7.4 | ||
| Percoll | Sigma-Aldrich | P1644-500ML | |
| Peristaltic Pump | Masterflex | 7518-10 | |
| Phosphoric Acid | Sigma-Aldrich | P6560 | |
| Pierce Protein-Free T20 PBS Blocking Buffer | Thermo-Scientific | 37573 | Stored at 4C. Blocking Buffer |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P8215-5ML | PIC – stored at -20 °C |
| Quick Start Bradford Dye Reagent 1x | Biorad | 500-0205 | For Bradford Assay |
| Quick Start BSA Standards | Biorad | 500-0207 | BSA standards for Bradford Assay |
| Scalpel | Lab. Co | Size 11 Scalpel | |
| SilverQuest TM Staining Kit | Invitrogen | LC6070 | |
| Simply Blue TM Safe Stain | Invitrogen | LC6060 | |
| Sorvall C6+ Ultracentrifuge | Thermo Scientific | 46910 | |
| Streptavidin (HRP) | Abcam | AB7403 | |
| Streptavidin Magnetic Beads | New England Biolabs | S1420S | |
| Super Glue - Ultra Fast Mini | UHU | UHU Super Glue 1mg. Ultra Fast mini | |
| Table-top Centrifuge | Eppendorf | 22331 | |
| TCEP | Thermo Fisher | 20490 | |
| Triton X-100 | Biorad | 161-0407 | |
| Tween-20 | Sigma | P2287-500ML | |
| Vortex Mixer | Ratek | VM1 | |
| Water Bath | Grant | GD100 |
Ссылки
- Rodriguez-Valle, M., et al. Efficacy of Rhipicephalus (Boophilus) microplus Bm86 against Hyalomma dromedarii and Amblyomma cajennense tick infestations in camels and cattle. Vaccine. 30, 3453-3458 (2012).
- De Rose, R., et al. Bm86 antigen induces a protective immune-response against Boophilus microplus following DNA and protein vaccination in sheep. Vet. Immunol. Immunopathol. 71, 151-160 (1999).
- García-García, J. C., et al. Sequence variations in the Boophilus microplus Bm86 locus and implications for immunoprotection in cattle vaccinated with this antigen. Exp. Appl. Acarol. 23, 883-895 (1999).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: The state of play. Vet. Parasitol. 203, 6-20 (2014).
- Kearney, S. Acaricide (chemical) resistance in cattle ticks. , AgNote No. K58. (2013).
- Foil, L. D., et al. Factors that influence the prevalence of acaricide resistance and tick-borne diseases. Vet. Parasitol. 125, 163-181 (2004).
- Rodriguez, M., et al. High level expression of the B. microplus Bm86 antigen in the yeast Pichia pastoris forming highly immunogenic particles for cattle. J Biotechnol. 33, 135-146 (1994).
- Rodriguez, M., et al. Effect of vaccination with a recombinant Bm86 antigen preparation on natural infestations of Boophilus microplus in grazing dairy and beef pure and cross-bred cattle in Brazil. Vaccine. 13 (18), 1804-1808 (1995).
- Lew-Tabor, A. E., Rodriguez Valle, M. A review of reverse vaccinology approaches for the development of vaccines against ticks and tick borne diseases. Ticks Tick Borne Dis. 7, 573-585 (2016).
- Capella, A. N., Terra, W. R., Ribeiro, A. F., Ferreira, C. Cytoskeleton removal and characterization of the microvillar membranes isolated from two midgut regions of Spodoptera frugiperda (Lepidoptera). Insect Biochem. Mol. Biol. 27, 793-801 (1997).
- Cioffi, M., Wolfersberger, M. G. Isolation of separate apical, lateral and basal plasma membrane from cells of an insect epithelium. A procedure based on tissue organization and ultrastructure. Tissue Cell. 15, 781-803 (1983).
- Koefoed, B. M. A simple mechanical method to isolate the basal lamina of insect midgut epithelial cells. Tissue Cell. 17, 763-768 (1985).
- Roche, J. K. Isolation of a purified epithelial cell population from human colon. Methods Mol. Med. 50, 15-20 (2001).
- Terra, W. R., Costa, R. H., Ferreira, C. Plasma membranes from insect midgut cells. An. Acad. Bras. Ciênc. 78, 255-269 (2006).
- Vargas, A. E., Markoski, M. M., Cañedo, A. D., Helena, F., Nardi, N. B. Identification, isolation and culture of intestinal epithelial stem cells from murine intestine. Stem Cells. 879, 479-490 (2012).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. Eur. J. Microbiol. Immunol. 2, 112-120 (2012).
- Karhemo, P. R., et al. An optimized isolation of biotinylated cell surface proteins reveals novel players in cancer metastasis. J. Proteomics. 77, 87-100 (2012).
- Obenchain, F. R., Galun, R. Physiology of Ticks. Current Themes in Tropical Science Volume 1. , Pergamon Press. 201-205 (1982).
- Sonenshine, D., Roe, R. Chapter 3.1. "Biology of Ticks". 1, Two, Oxford University Press. (2014).
- Raikhel, A. S., Balashov, Y. S. "An Atlas of Ixodid Tick Ultrastructure" (English Translation). , Entomology Society of America Entomological Society of America. (1983).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены