A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
טיהור של biotinylated Cell חלבונים משטח מ
In This Article
Summary
צפיפות שונה צנטריפוגה מבוססי מתודולוגיה שיפוע מבוסס נוצל לבודד תאים אפיתל מ רקמה Rhipicephalus רקמת microplus . משטח חלבונים הקשורים היו biotinylated ו מטוהרים באמצעות חרוזים מגנטיים streptavidin עבור יישומים במורד הזרם.
Abstract
Rhipicephalus microplus - תווית בקר - הוא ectoparasite משמעותי ביותר במונחים של השפעה כלכלית על בעלי חיים כמו וקטור של מספר פתוגנים. המאמצים הוקדשו לשלוט בקר בקר כדי להפחית את ההשפעות המזיקות שלה, עם דגש על גילוי של מועמדים חיסון, כגון BM86, הממוקם על פני השטח של תאים מעיים לתאי אפיתל. המחקר הנוכחי מתמקד בשימוש של cDNA וגנום ספריות, כדי המסך עבור מועמדים חיסון אחרים. הבידוד של תאים מעיים לתקתק מהווה יתרון חשוב בחקירת הרכב של חלבונים פני השטח על קרום תאים בטן קרום. מאמר זה מהווה שיטה חדשנית וראוי לבידוד של תאי אפיתל, מן התוכן מעיים לתקתק של מיקרופלוס חצי רתומה למחצה . פרוטוקול זה מנצל TCEP ו EDTA לשחרר את התאים אפיתל מן הרקמות תמיכה subepithelial ו צפיפות רציפה צנטריפוגה gradieNt לתאי אפיתל נפרדים מסוגי תאים אחרים. חלבונים משטח התא היו biotinylated ומבודדים מן התאים בטן אפיתל בטן, באמצעות חרוזים מגנטיים streptavidin מקושר המאפשר עבור יישומים במורד FACS או LC-MS / MS- ניתוח.
Introduction
Rhipicephalus microplus , סמן בקר, הוא ectoparasite משמעותי ביותר במונחים של השפעה כלכלית על תעשיית הבקר של אזורים טרופיים תת טרופיים כפי שהוא נוקט קדחת הבקר קדחת (babesiosis), anaplasmosis ו piroplasmosis סוס 1 , 2 , 3 , 4 . המאמצים הוקדשו לבקרת סמן בקר, כדי להפחית את ההשפעה המזיקה, אולם לשיטות קונבנציונליות כגון שימוש בחומרי אקריצידים כימיים יש חסרונות משתמעים, כגון נוכחות של שאריות כימיות בחלב ובבשר, ועלייה בשכיחות של קרציות עמידות כימית 5 , 6 , 7 . כתוצאה מכך, פיתוח שיטות חלופיות של בקרת טיקים נחקרו, כגון שימוש בבקר התנגדות טבעי, בקרה ביולוגית (biopesticides) וחיסוןInes 4 , 5 , 6 , 7 , 8 , 9 .
במרדף אחר חלבונים המסוגלים לשמש מועמדים לחיסונים, המחקר הנוכחי מתמקד במעי הגס. קיר midgut בנוי משכבה אחת של תאים אפיתל מנוחה על לאמידה בסיסית דקה, עם החיצוני של הלמידה הבסיסית להרכיב רשת של שרירים. אור ותצפיות מיקרוסקופ אלקטרונים מציינות כי midgut מורכב משלושה סוגים של תאים: מילואים (לא מובחנים), הפרשה, ומערכת העיכול. מספר סוגי התאים משתנה במידה ניכרת בהתאם לשלב הפיזיולוגי. תאי הפרשה ותאי העיכול מקורם בתאי מילואים 18 , 19 , 20 .
בניית ספריות cDNAכדי לבחון את ההרכב של המעיים סמן גרמה לזיהוי של חלבונים אנטיגניים, כגון Bm86, כמו מועמדים חיסונים פוטנציאליים 2 , 3 , 4 . Glycoprotein Bm86 הוא מקומי על פני השטח של תאים מעיים לתקתק וגורם תגובה חיסונית מגן נגד סמן בקר ( ר microplus ) בבקר מחוסן. Anti-Bm86 IgGs המיוצר על ידי המארח החוסן הם ingested על ידי סמן, לזהות אנטיגן זה על פני השטח של תאים מעיים לתקתק, ולאחר מכן להפריע לתפקוד רקמות המעיים ואת היושרה. חיסונים המבוססים על אנטיגנים Bm86 הראו שליטה אפקטיבית של ר ' microplus ו Rhipicephalus annulatus, על ידי הקטנת מספר, משקל ויכולת הרבייה של נקבות נקבות, וכתוצאה מכך הפחתת הזחל מופחת בדורות דלקת הבאים 4 . עם זאת, חיסונים המבוססים על Bm86 אינם יעילים כנגד כל שלבי הסימוןהוכיחו יעילות משביעת רצון נגד כמה זנים גיאוגרפיים של ר 'microplus , וכתוצאה מכך את בשר בקר תעשיות חלב אימצו כראוי חיסונים אלה 2 , 4 .
היכולת לבודד תאים אפיתל מן המעיים סמן הוא חידוש משמעותי אשר יאפשר את התקדמות המחקר כדי לקבוע הרכב חלבון חלבון כולל מורפולוגיה ופיזיולוגיה בתנאים סביבתיים שונים. השיטה המתוארת כאן מנצל את הסוכן chelating ethylenediaminetetraacetic חומצה (EDTA) ואת הסוכן הפחתת tris (2-carboxyethyl) פוספין (TCEP) לשחרר את האפיתל מן הרקמות תמיכה תת אפיתל שלה 10 . אפיתל הוא התאושש בעקבות שיבוש מכני של הרקמות על ידי רועד, ואחריו צנטריפוגה שיפוע רציפה Percoll. מאמר זה מתאר טכניקה ריאלי ו אפשרי לבידוד של מעי גס epiהתאים. חלבונים משטח התא biotinylated, מבודדים מפני השטח של תאים אלה אפיתל ניתח לאחר מכן ביישומים במורד הזרם כגון FACS ו / או LC-MS / MS- ניתוח.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. דיסקציה של אפיתל גוט מ ר microplus
- איסוף קרציות חצי מבושל מן הבקר ביום הניסוי. לנתח מתקתק בתוך 24 שעות לאחר הסרת מן המארח.
- לדבוק רצועת סרט דביק לתחתית של צלחת פטרי 92 מ"מ x 16 מ"מ פטרי. הוסף טיפה של דבק סופר לקלטת. מניחים את סמן, בצד הגחון על הדבק סופר, לאפשר יבש במשך 2 דקות.
- יוצקים 100 מ"ל של פוספט שנאגרו מלוחים (PBS) לתוך צלחת פטרי, או עד הקופסה הוא שקוע לחלוטין.
- ניצול בגודל 11 אזמל, לחתוך מן החלק העליון של העיניים אל התחתונים התחתונים, משני צידי הקופסה.
- בעזרת מלקחיים סטרילית, להסיר לחלוטין את כיח ואת alloscutum , כדי לחשוף את האיברים הפנימיים.
- הסר את החוט הלבן כמו אברים (קנה הנשימה) ו ממברנות אחרות כדי למנוע זיהום.
- הסר את המעיים באמצעות מלקחיים, על ידי צובט את האזור העליון ומשוך מפֶּגֶר. הסר את כל רקמות הבטן הנותרים, להבטיח כי לא רקמות אחרות כבר גזור.
- חנות gut ב קר קרח קר של תמיסת מלח מאוזן (HBSS) ללא סידן כלורי ו מגנזיום גופרתי עם קוקטייל מעכב proteinase (PIC). הצמד להקפיא את האומץ בקרח יבש לאחסן ב -20 מעלות צלזיוס.
הערה: כדי לסייע לנתיחה בטן ופרטים של האיברים הפנימיים של תפר עיין בפרק 3.1 של ד 'Sonenshine, "ביולוגיה של קרציות" 19 .
2. דיסוציאציה תא אפיתל
- יוצקים את המעיים גזור על מסנן תא 70 מיקרומטר בתוך צינור 50 מ"ל.
- שטפו את רקמת הבטן עם 50 מ"ל קר HBSS קר עם PIC עד הפתרון פועל ברור, ואת האומץ לקחת על המראה לבן / ברור.
- Re- להשעות האומץ ב 30 מ"ל קר HBSS קר עם PIC, מערבבים בעדינות צנטריפוגה ב XG 500 ב 4 מעלות צלזיוס למשך 10 דקות כדי גלולה המעיים. הסר את supernatant וחזור על תהליך לשטוף שלוש פעמים.
- כדי לעקור תאי המעיים אפיתל, מחדש להשעות את המעיים ב 10 מ"ל של תרבית תאים בינוני בינוני Dulbecco שונה הנשר (DMEM), 2% עגל בסרום (FCS), 0.5 mM ethylenediaminetetraacetic חומצה (EDTA), 1 מ"מ טריס (2 Carboxyethyl) פוספין (TCEP), PIC ו דגירה של 60 דקות על 37 מעלות צלזיוס תחת סיבוב איטי באמצעות רולר ב 6 סל"ד.
- מסנן את ההשעיה באמצעות מסננת תא 250 מיקרומטר, מערבולת הזרימה דרך ומסנן דרך מסננת 70 מיקרומטר התא לאסוף את זרימת הנותרים דרך.
- צנטריפוגה ההשעיה ב XG 500 ב 4 מעלות צלזיוס למשך 20 דקות כדי גלולה תאים בודדים.
3. בידוד של תאים אפיתל יחיד באמצעות שיפוע צנטריפוגה שיפוע
- הכן צפיפות צנטריפוגה שיפוע ( למשל , Percoll) על ידי סינון באמצעות נייר AP15 מראש מסנן. הכן 40% ו Percoll 20% ב mqH 2 0 (V / V) ו מגניב על 4 מעלות צלזיוס למשך 1 שעות לפני שכבת שיפוע.
- שימוש peristalticהמשאבה להגדיר את המהירות הנמוכה ביותר, שכבת 3 מ"ל של 40% צפיפות צנטריפוגה צנטריפוגה צינור 16 ultracentrifuge, ומאפשר לה להתיישב על קרח במשך 15 דקות. המהירות של המשאבה צריכה להוביל <1 מ"ל לכל שיעור הזרימה המינימלית.
- הטיית הצינור ל זווית 45 °, להשתמש המשאבה peristaltic שכבת 20% צפיפות צנטריפוגה שיפוע על גבי השכבה 40%. מהירות המשאבה צריכה להוביל ל <1 מ"ל לכל שיעור הזרימה המינימלית. אפשר השכבות להתיישב על קרח במשך 15 דקות.
- השתמש המשאבה peristaltic ב <1 מ"ל לכל שיעור הזרימה המינימלית לשכבה 3 מ"ל של DMEM בינוני המכיל תאים בטן לתקתק מעל 20-40% צפיפות צנטריפוגה שיפוע.
- תוכנית צנטריפוגה להאצת מקסימלית האטה מינימלית. צנטריפוגה ב XG 600 במשך 10 דקות. איסוף interphases בין DMEM: 20% צפיפות צנטריפוגה שיפוע, ואת 20%: 40% צפיפות צנטריפוגה gradients לבודד תאים בודדים אפיתל. חנות שנאספו interphases ב 4 מעלות צלזיוס עבור ניתוחים הבאים.
4. הערכת בידוד התא
- המיאצטומטר
- לנקות את שקופית hemacytometer עם אלכוהול.
- . Re- להשעות את התאים על ידי pipetting בעדינות את התאים למעלה ולמטה. פיפטה 100 μL ההשעיה התא במקום צינור microcentrifuge 1.5 מ"ל.
- הוסף 400 μL של 0.4% Trypan כחול. בעדינות לערבב על ידי לחיצה על הצינור.
- פיפטה 100 μL של ההשעיה תא כחול Trypan מטופלים לאט למלא שני החדרים של hemocytometer.
- מניחים את hemocytometer תחת מיקרוסקופ אור, תוך התמקדות קווי הרשת של hemocytometer עם מטרה 10X.
- באמצעות מונה ידית יד, לספור את התאים חיים ללא כתם בתוך קבוצה של 16 ריבועים. בתוך אותו ריבוע, ספור את התאים הכחולים המתים. המשך לספור עד שייספרו ארבע קבוצות של 16 ריבועים.
- חישוב התאים הכולל לכל מ"ל באמצעות הנוסחה:
47eq1.jpg "/> - חישוב אחוז הכדאיות התא באמצעות הנוסחה:
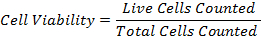
- תא מבודד ויזואליזציה
- לדלל 1 μL של תאים מבודדים μL 9 של HBSS בצינור microcentrifuge 1.5 מ"ל. קפיצי microcentrifuge את הצינור בעדינות כדי לערבב.
- פיפטה 5 μL של תאים מבודדים ב HBSS באמצע שקופית זכוכית. החל שלוש טיפות של המדיום גובר עם 4 ', 6-diamidino-2-phenylindole (DAPI).
- דגירה את השקופית בטמפרטורת החדר למשך 5 דקות. בזהירות במקום להחליק להחליק על ההכנה, הימנעות בועות אוויר.
- דמיינו תאים מוכתמים DAPI ב עירור 360 ננומטר פליטה ב 460 ננומטר תחת מיקרוסקופ פלואורסצנטי.
5. Cell Cell חלבון Biotinylation
- Biotinylate 100 μL של תאים תא אפיתל יחיד באמצעות Biotin (סוג A) הצמידהKit, על יחס טוחנת של 1: 1 חלבון פני השטח כדי מצומד, בהתאם להוראות היצרן
- עבור תמוגה התא, להוסיף 100 μL של PBS, 1% Triton X-100, גליצרול 10%, 100 מיקרומטר גלוטתיון חמצון PIC לתאים biotinylated. דגירה על קרח במשך 1 שעות עם ערבוב עדין כל 10 דקות.
- צנטריפוגה תאים biotinylated ב XG 20,000 ב 4 מעלות צלזיוס למשך 20 דקות כדי גלולה חומר מסיס. איסוף supernatant המכיל cytoplasmic, חלבונים הממברנה biotinylated.
- לקבוע את ריכוז החלבון באמצעות assay Bradford.
6. בידוד של חלבונים פנימיים Biotinylated
- הוסף 50 μL של חרוזים מגנטיים Streptavidin לתוך צינור microcentrifuge 1.5 מ"ל.
- מניחים את הצינור לתוך מעמד מגנטי, איסוף חרוזים כנגד הצד של הצינור. הסר וזורקים את supernatant.
- הוסף 1000 μL של TBS, 0.1% Tween-20 לצינור. מערבבים בעדינות ולאסוף את החרוזים עם סטן מגנטיד. הסר וזורקים את supernatant.
- שלב 40 מיקרוגרם של חלבונים משטח התא biotinylated, מדולל μL 300 ב 1x PBS עם חרוזים מגנטיים שטף. לדגור על 2 שעות בטמפרטורת החדר עם תסיסה.
- לאסוף את החרוזים עם מעמד מגנטי, להסיר ולזנוח supernatant.
- הוסף 300 μL של TBS, 0.1% Tween-20 לצינור, בעדינות ערבוב כדי להשעות מחדש את החרוזים. איסוף חרוזים, להסיר ולזנוח supernatant. חזור על צעד זה לשטוף פעמיים.
- הוסף 100 μL של 0.1 M גליצין pH 2.0 חרוזים מגנטיים, ו דגירה בטמפרטורת החדר למשך 5 דקות. איסוף חרוזים ולהסיר supernatant המכיל eluted biotinylated חלבונים פני השטח.
- דמיינו חלבונים משטח מבודד על ג'ל 4-20% Tris-MOPS SDS-PAGE.
7. הערכה של חלבונים פנימיים Biotinylated
- נקודה כתם
- חותכים 7 ס"מ x 3 ס"מ רצועה של קרום nitrocellulose.
- החל 10 מיקרוגרם סך הכל סמןתוכן (מ 1.8 לעיל), ו 10 מיקרוגרם של חלבון פני השטח biotinylated על הממברנה. אפשר ייבוש במשך 15 דקות בטמפרטורת החדר.
- העברה למכל ו לצלול ב 100 מ"ל של חיץ חסימה. דגירה בטמפרטורת החדר עם תסיסה במשך שעה. מחק חסימת חיץ.
- לשטוף nitrocellulose קרום μL 100 μL, 0.05% Tween-20 במשך 5 דקות עם תסיסה. בטל לשטוף חיץ לחזור על שוטף שלוש פעמים.
- דגירה ב 1/5000 Streptavidin חזרת peroxidase (HRP) ב 100 μL PBS, 0.05% Tween-20 עבור 2 שעות עם תסיסה בטמפרטורת החדר, ולבטל כל פתרון שנותר.
- לשטוף nitrocellulose קרום μL 100 של PBS, 0.05% Tween-20 במשך 5 דקות עם תסיסה. מחק חיץ לשטוף וחזור לשטוף שלוש פעמים.
- לזיהוי, להמיס 1 טבליה של 4-chloro-1-napthol ב 10 מ"ל של מתנול קר כקרח. הוסף 4 מ"ל של מלאי מתנול ל 20 מ"ל של כפות. הוסף 10 μL של מי חמצן טריים 30% ו immediaTely להחיל על קרום nitrocellulose.
- דגירה עם תסיסה בטמפרטורת החדר עד המצע מייצר מוצר סוף כחול מסיס. פעולה זו עשויה להימשך בין 2-15 דקות.
- מחק פתרון איתור לשטוף את הממברנה שלוש פעמים μl 100 μL 2 O.
- אסאי ELISA
- לדלל 200 ng של כל מדגם עם 400 μL של 100 מ"מ חיץ ציפוי קרבונט מעיל 2 נתיבים של השורה הראשונה (A #) של צלחת אליסה (בארות תחתית שטוחה)
- הוסף 100 μL של חיץ ציפוי 100 מ"מ קרבונט לכל בארות המתאימים אחרים בשורות (BH).
- הכנת דילולים סדרתי של כל מדגם על ידי pipetting 100 μL מכל טוב בשורה A, והעברת לתוך שורה ב לערבב בעדינות על ידי pipetting ולהימנע בייצור בועות. חזור על דילולים למטה כל שורה, להשליך את 100 μL הסופי מכל טוב בשורה H.
- מכסים את הצלחת עם parafilm ו דגירה על 4 מעלות צלזיוס למשך הלילה.
- לשטוף את platדואר עם 200 μL PBS, 0.05% Tween-20 לכל טוב שלוש פעמים.
- הוסף 200 μL של חיץ חסימת על בארות מצופה, לכסות עם Parafilm ו דגירה על 4 מעלות צלזיוס למשך הלילה.
- לדלל 1 / 15,000 Streptavidin-HRP לחסום חיץ ולהוסיף 100 μL היטב כל צלחת. כיסוי עם parafilm ו דגירה על 4 מעלות צלזיוס למשך הלילה.
- לשטוף את הצלחת 200 μL PBS, 0.05% Tween-20 לכל טוב חמש פעמים.
- כדי לזהות, להוסיף 100 μL של מגיב TMB לכל טוב. לאחר פיתוח צבע מספיק, בדרך כלל בין 10-15 דקות, להוסיף 100 μL של 1 M חומצה זרחתית לעצור את התגובה.
- קרא את ספיגת כל טוב ב λ = 450nm.
Access restricted. Please log in or start a trial to view this content.
תוצאות
תאים אפיתל היו מבודדים מרקמות המעיים של ר microplus לפי סכימה הציג באיור 1 . נציג מיקרוסקופ פלואורסצנטי הקרינה של תאים מעיים לתאי אפיתל מוכן באמצעות פרוטוקול זה מוצגים בתרשים 2A ו 2 ב.
Access restricted. Please log in or start a trial to view this content.
Discussion
התפשטות בקר קרים מהווים בעיה רצינית עבור תעשיית הבקר באזורים טרופיים וסובטרופיים של העולם, עם השיטה הנפוצה ביותר של שליטה להסתמך על שימוש אקריצידים 1 , 4 . Bm86 זוהה בעבר בתוך השטח האפיתל במעיים לתקתק כמו אנטיגן המגן נגד ר microplus שריצה ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מבקשים להודות ל Biosecurity המושבה הטיקאית (מחלקת קווינסלנד לחקלאות ודיג באוסטרליה) על אספקת Rhipicephalus microplus קרציות מנוצל עבור מחקר זה, ו לוקאס Karbanowicz לעזרה עם צילומי וידאו.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | ThermoFisher Scientific | 15250061 | |
| 1.5 mL microcentrifuge tube | Eppendorf | 3322 | |
| 100mM Carbonate Buffer | 3.03 g Na2CO3, 6.0 g NaHCO3 1000 ml distilled water pH 9.6 | ||
| 16 mL centrifuge tubes with sealing cap | Thermo Scientific | 3138-0016 | Cool in ice prior to gradient |
| 250 µM cell strainer | Thermo Fisher | 87791 | |
| 3,3′,5,5′-Tetramethylbenzidine (TMB) Liquid Substrate System for ELISA | Sigma | T0440 | Stored at 4C |
| 30% Hydrogen Peroxide | Labscene | BSPA5.500 | |
| 4-20% Tris-MOPS Gel | Gen Script | M42015 | |
| 4-Chloro-1-naphthol tablet | Sigma-Aldrich | C6788 | |
| 50 mL Falcon Tube | Corning Blue | 30 x 115mm style. Polyproplyene conical tube. | |
| 70 µM cell strainer | BD Falcon | 352350 | |
| AP15 filter paper | Millipore | AO1504200 | |
| Biotin (Type A) Conjugation Kit | Abcam | Ab102865 | |
| Dissection microscope | Olympus | SZX7 | |
| DP Manager | Olympus | 2.2.1.195 | Cell imagery software |
| Duct Tape | Home Handyman | 48mm x 25mm Duct Tape | |
| Dulbecco’s Modified Eagle Medium | Gibco | 11995-065 | DMEM - ice cold for protocol |
| EDTA | Amresco | 0105-500G | |
| F96 Maxisorp Immuno Plate | Nunc | 439454 | |
| Fetal Bovine Serum | Sigma-Aldrich | 12003C | FCS |
| Fluorescence microscope | Olympus | BX51 | |
| Fluoroshield with DAPI | Sigma-Aldrich | F6057-20ML | DAPI |
| Forceps | Dumont | #9 Dumont - Switerzland | |
| Glycerol | Sigma-Aldrich | G5516 | Glycerol for molecular biology >99% |
| Glycine | Sigma-Aldrich | 410225 | |
| Hand-Held Counter | Officeworks | JA0376230 | |
| Hank’s Balanced Salt Solution | Sigma Life Sciences | H9394 | HBSS – ice cold for protocol |
| Hemacytometer | Optik Lakor | - | - |
| L-Glutathione oxidized | Sigma-Aldrich | G4376 | |
| Magnetic Separation Stand | Novagen | - | 4-Tube Magnetic Separation Rack |
| Methanol | Sigma-Aldrich | 179337 | |
| Milli-Q Water | Millipore | ZRXQ003WW | Integral Water Purification System for Ultrapure Water |
| Nitrocellulose Membrane | Life Sciences | 66485 | 30cm x 3M pure nitrocellulose membrane |
| PageRuler Prestained protein Ladder | Thermo-Fisher | SM0671 | |
| PBS | 1.16 g Na2HPO4, 0.1 g KCl, 0.1 g K3PO4, 4.0 g NaCl (500 ml distilled water) pH 7.4 | ||
| Percoll | Sigma-Aldrich | P1644-500ML | |
| Peristaltic Pump | Masterflex | 7518-10 | |
| Phosphoric Acid | Sigma-Aldrich | P6560 | |
| Pierce Protein-Free T20 PBS Blocking Buffer | Thermo-Scientific | 37573 | Stored at 4C. Blocking Buffer |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P8215-5ML | PIC – stored at -20 °C |
| Quick Start Bradford Dye Reagent 1x | Biorad | 500-0205 | For Bradford Assay |
| Quick Start BSA Standards | Biorad | 500-0207 | BSA standards for Bradford Assay |
| Scalpel | Lab. Co | Size 11 Scalpel | |
| SilverQuest TM Staining Kit | Invitrogen | LC6070 | |
| Simply Blue TM Safe Stain | Invitrogen | LC6060 | |
| Sorvall C6+ Ultracentrifuge | Thermo Scientific | 46910 | |
| Streptavidin (HRP) | Abcam | AB7403 | |
| Streptavidin Magnetic Beads | New England Biolabs | S1420S | |
| Super Glue - Ultra Fast Mini | UHU | UHU Super Glue 1mg. Ultra Fast mini | |
| Table-top Centrifuge | Eppendorf | 22331 | |
| TCEP | Thermo Fisher | 20490 | |
| Triton X-100 | Biorad | 161-0407 | |
| Tween-20 | Sigma | P2287-500ML | |
| Vortex Mixer | Ratek | VM1 | |
| Water Bath | Grant | GD100 |
References
- Rodriguez-Valle, M., et al. Efficacy of Rhipicephalus (Boophilus) microplus Bm86 against Hyalomma dromedarii and Amblyomma cajennense tick infestations in camels and cattle. Vaccine. 30, 3453-3458 (2012).
- De Rose, R., et al. Bm86 antigen induces a protective immune-response against Boophilus microplus following DNA and protein vaccination in sheep. Vet. Immunol. Immunopathol. 71, 151-160 (1999).
- García-García, J. C., et al. Sequence variations in the Boophilus microplus Bm86 locus and implications for immunoprotection in cattle vaccinated with this antigen. Exp. Appl. Acarol. 23, 883-895 (1999).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: The state of play. Vet. Parasitol. 203, 6-20 (2014).
- Kearney, S. Acaricide (chemical) resistance in cattle ticks. , AgNote No. K58. (2013).
- Foil, L. D., et al. Factors that influence the prevalence of acaricide resistance and tick-borne diseases. Vet. Parasitol. 125, 163-181 (2004).
- Rodriguez, M., et al. High level expression of the B. microplus Bm86 antigen in the yeast Pichia pastoris forming highly immunogenic particles for cattle. J Biotechnol. 33, 135-146 (1994).
- Rodriguez, M., et al. Effect of vaccination with a recombinant Bm86 antigen preparation on natural infestations of Boophilus microplus in grazing dairy and beef pure and cross-bred cattle in Brazil. Vaccine. 13 (18), 1804-1808 (1995).
- Lew-Tabor, A. E., Rodriguez Valle, M. A review of reverse vaccinology approaches for the development of vaccines against ticks and tick borne diseases. Ticks Tick Borne Dis. 7, 573-585 (2016).
- Capella, A. N., Terra, W. R., Ribeiro, A. F., Ferreira, C. Cytoskeleton removal and characterization of the microvillar membranes isolated from two midgut regions of Spodoptera frugiperda (Lepidoptera). Insect Biochem. Mol. Biol. 27, 793-801 (1997).
- Cioffi, M., Wolfersberger, M. G. Isolation of separate apical, lateral and basal plasma membrane from cells of an insect epithelium. A procedure based on tissue organization and ultrastructure. Tissue Cell. 15, 781-803 (1983).
- Koefoed, B. M. A simple mechanical method to isolate the basal lamina of insect midgut epithelial cells. Tissue Cell. 17, 763-768 (1985).
- Roche, J. K. Isolation of a purified epithelial cell population from human colon. Methods Mol. Med. 50, 15-20 (2001).
- Terra, W. R., Costa, R. H., Ferreira, C. Plasma membranes from insect midgut cells. An. Acad. Bras. Ciênc. 78, 255-269 (2006).
- Vargas, A. E., Markoski, M. M., Cañedo, A. D., Helena, F., Nardi, N. B. Identification, isolation and culture of intestinal epithelial stem cells from murine intestine. Stem Cells. 879, 479-490 (2012).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. Eur. J. Microbiol. Immunol. 2, 112-120 (2012).
- Karhemo, P. R., et al. An optimized isolation of biotinylated cell surface proteins reveals novel players in cancer metastasis. J. Proteomics. 77, 87-100 (2012).
- Obenchain, F. R., Galun, R. Physiology of Ticks. Current Themes in Tropical Science Volume 1. , Pergamon Press. 201-205 (1982).
- Sonenshine, D., Roe, R. Chapter 3.1. "Biology of Ticks". 1, Two, Oxford University Press. (2014).
- Raikhel, A. S., Balashov, Y. S. "An Atlas of Ixodid Tick Ultrastructure" (English Translation). , Entomology Society of America Entomological Society of America. (1983).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved