Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Biyotinile Hücre Yüzey Proteinlerinin Arındırılması
Bu Makalede
Özet
Rhipicephalus microplus bağırsak dokusundan epitel hücrelerini izole etmek için modifiye bir yoğunluk santrifüj gradyan tabanlı metodoloji kullanıldı. Yüzeye bağlı proteinler, biyotinlenmiş ve streptavidin manyetik boncuklarla arıtılmış uygulamalarda kullanılmak üzere saflaştırılmıştır.
Özet
Rhipicephalus microplus - sığır kene - birçok patojen vektörü olarak hayvancılık üzerindeki ekonomik etki açısından en önemli ektoparazitedir. Damla bağırsak epitel hücrelerinin yüzeyinde bulunan BM86 gibi aşı adaylarının bulunmasına odaklanarak, zararlı etkilerini azaltmak için sığır kene kontrolüne yönelik çalışmalar yapılmıştır. Mevcut araştırmalar, diğer aşı adaylarını taramak için cDNA ve genomik kütüphanelerin kullanımına odaklanmaktadır. Dişi bağırsak hücrelerinin izolasyonu, kenet hücresi zarı üzerine yüzey proteinlerinin kompozisyonunun araştırılmasında önemli bir avantaj teşkil eder. Bu yazı, yarı-sıkışmış R. microplus'un bağırsak içeriğinden epitel hücrelerinin izolasyonu için yeni ve uygulanabilir bir yöntem teşkil etmektedir . Bu protokol, subepitelyal destek dokularından epitel hücrelerini serbest bırakmak için TCEP ve EDTA'yı ve süreksiz yoğunluk santrifüj gradyanını kullanmaktadırNt, epitel hücrelerini diğer hücre türlerinden ayırır. Hücre yüzey proteinleri biyotinile edildi ve FACS veya LC-MS / MS analizinde aşağı akış uygulamaları için streptavidin bağlantılı manyetik boncuklar kullanarak kene bağırsak epitel hücrelerinden izole edildi.
Giriş
Sığır kenesi Rhipicephalus microplus , sığır kene humması (babesiosis), anaplasmosis ve equine piroplasmosis 1 , 2 , 3 , 4'ü vektörelleştirdiği için tropik ve subtropikal bölgelerdeki sığır endüstrisi üzerindeki ekonomik etki açısından en önemli ektoparazitedir. Zararlı etkiyi azaltmak için sığır kene kontrolüne yönelik çalışmalar yapılmıştır ancak kimyasal akarisitlerin kullanımı gibi geleneksel yöntemlerin süt ve ette kimyasal kalıntıların varlığı ve kimyasal olarak dirençli kenelerin yaygınlığı gibi örtük dezavantajları vardır 5 , 6 , 7 . Sonuç olarak, doğal dirençli sığırların kullanımı, biyolojik mücadele (biyoparestisitler) ve aşı gibi alternatif kene kontrol yöntemlerinin geliştirilmesi incelenmiştirInes 4 , 5 , 6 , 7 , 8 , 9 .
Aşı adayları olarak kullanılabilecek proteinlerin peşinde, mevcut araştırma kene bağırsağına odaklanmaktadır. Orta bacak duvarları, ince bir bazal tabakaya dayanan, tek katlı epitelyal hücrelerden oluşur; bazal laminanın dış kısmı kas ağını oluşturur. Işık ve elektron mikroskopu gözlemleri, orta bağırsağın üç tip hücreden oluştuğunu göstermektedir: rezerv (ayırt edilmemiş), sekresyon ve sindirim. Hücre tiplerinin sayısı, fizyolojik faza bağlı olarak önemli ölçüde değişir. Sekretuar ve sindirim hücreleri, hem rezerv hücreler 18 , 19 , 20'den kaynaklanır .
CDNA kütüphanelerinin inşasıKene bağırsağının bileşimini incelemek potansiyel aşı adayları olan Bm86 gibi antijenik proteinlerin tanımlanmasına yol açtı 2 , 3 , 4 . Glikoprotein Bm86, kenarı bağırsak hücrelerinin yüzeyinde lokalizedir ve aşılanmış sığırlarda sığır kenesine ( R. microplus ) karşı koruyucu bir bağışıklık tepkisi oluşturmaktadır. Bağışıklık kazandırılmış konak tarafından üretilen anti-Bm86 IgG'leri kene tarafından alınır, bu antijeni tene bağırsak hücrelerinin yüzeyinde tanır ve sonra da bağırsak dokusunun işlevi ve bütünlüğünü bozmaktadır. Bm86 antijenlere dayanan aşılar sayısı, ağırlık ve daha sonra kene kuşak 4 düşük bir larva istila sonuçlanan kadın engorging üreme kapasitesini azaltarak, R. microplus ve Rhipicephalus annulatus etkin biçimde kontrol göstermiştir. Bununla birlikte, Bm86 esaslı aşılar tüm kene aşamalarına karşı etkili değildir veBazı coğrafi R. microplus suşlarına karşı yetersiz etkinlik gösterdiğinden, sığır ve süt endüstrileri bu aşıları 2 , 4'ü kötü şekilde benimsemişlerdir.
Epitel hücrelerini kan bağı bağından ayırma yeteneği, farklı çevre koşullarında morfoloji ve fizyoloji de dahil olmak üzere protein membran kompozisyonunu belirlemek için araştırmanın ilerlemesini sağlayacak önemli bir yeniliktir. Burada tarif edilen metot, alt epitel destek dokularından epitelyumu 10 serbest bırakmak için kenetleme maddesi etilendiamintetraasetik asit (EDTA) ve indirgeyici ajan tris (2-karboksietil) fosfin (TCEP) kullanmaktadır. Epitel, dokuların mekanik olarak parçalanması sonrasında sallayarak, ardından Percoll'da süreksiz gradyent santrifüjlemeyle toparlanır. Bu makale, kene gut epi'sinin izolasyonu için uygulanabilir ve yeni bir teknik tanımlamaktadırHücre hücreleri. Bu epitelyal hücrelerin yüzeyinden izole edilen biyotinlenmiş hücre yüzeyi proteinleri, daha sonra FACS ve / veya LC-MS / MS analizi gibi aşağı akım uygulamaları ile analiz edilebilir.
Protokol
1. Bağırsak epitelinin R. microplus'tan diseksiyonu
- Deney günü sığırlardan yarı-sıkıştırılmış kene toplayın. Kene ortasından kaldırıldıktan 24 saat sonra parçalara ayırın.
- 92 mm x 16 mm Petri kabının tabanına bir şerit bandı yapıştırın. Kasete süper yapışkan bir damla ekleyin. Kene, ventral tarafı süper tutkal üzerine indirin, 2 dakika kurumaya bırakın.
- Petri kabı içine 100 mL fosfat tamponlu salin (PBS) dökün veya kene tamamen su altına alıncaya kadar.
- 11 numaralı bir neşter kullanarak, kene her iki yanında da gözlerin üstünden alttaki festo parçalarına kadar kesilir.
- Steril forseps kullanarak, tamamen iç organları açığa, Kalkan ve alloscutum çıkarın.
- Kirlenmeyi önlemek için ince beyaz iplik benzeri organları (trakea) ve diğer membranları çıkarın.
- Bağırsağı, forseps kullanarak, üst bölgeyi sıkarak vekarkas. Kalan tüm bağırsak dokularını çıkarın, böylece başka dokuların parçalanmadığından emin olun.
- Bağırsak proteinaz inhibitörü kokteyli (PIC) ile kalsiyum klorür ve magnezyum sülfat içermeyen buz soğukluğundaki Hank Dengeli Tuz Çözeltisi (HBSS) içinde saklayın. Bağırsakları kuru buzda dondurun ve -20 ° C'de saklayın.
Not: Bağırsak diseksiyonu ve iç organların kene detaylarına yardımcı olmak için, D. Sonenshine'in Bölüm 3.1'ine, "Kenların Biyolojisi" na bakın. 19 .
2. Epitelyal Hücre Ayrışımı
- 50 ml tüp içinde 70 mikron hücre süzgeçine disseke bağırsak dökün.
- Çözelti berraklaşıncaya ve bağırsaklar beyaz / berrak bir görünüm alıncaya kadar bağırsak dokusunu PIC ile 50 mL buz soğukluğundaki HBSS ile yıkayın.
- PIC ile 30 mL buz soğukluğunda HBSS bağırsaklarını yeniden süspanse edin, hafifçe karıştırın ve bağırsaklarını pelet haline getirmek için 10 dakika boyunca 4 ° C'de 500 xg'de santrifüjleyin. Süpernatanı çıkarın ve yıkama işlemini üç kez tekrarlayın.
- Epitel bağırsak hücrelerini çıkarmak için bağırsağın 10 mL hücre kültürü ortamında Dulbecco'nun modifiye kartal ortamı (DMEM),% 2 fetal buzağı serumu (FCS), 0.5 mM etilendiamintetraasetik asit (EDTA), 1 mM Tris Karboksietil) fosfin (TCEP), PIC ile karıştırın ve 6 rpm'de bir silindir kullanılarak yavaş döndürme altında 37 ° C'de 60 dakika inkübe edin.
- Süspansiyonu 250 um'lik bir hücre süzgeci ile filtre edin, akış yolu ile girdaplayın ve kalan akış akışını toplayan 70 μm'lik hücre süzgeci ile filtreleyin.
- Süspansiyonu 500 xg'de 4 ° C'de 20 dakika boyunca santrifüjleyerek tek hücrelerin pelet haline getirin.
3. Bir yoğunluk santrifüj gradyanı kullanarak Tek Epitelyal Hücrelerin İzolasyonu
- Bir AP15 ön filtre kağıdından süzerek yoğunluk santrifüj gradyanını ( örn . Percoll) hazırlayın. Degrade katmanlamadan önce 1 saat süreyle% 40 ve% 20 Percoll'u mqH 2 0 (v / v) içinde hazırlayın ve 4 ° C'de soğutun.
- Bir peristaltik kullanmaEn düşük hızda ayarlanan pompa, 3 mL'lik% 40 yoğunluklu santrifüj gradyanı, 16 mL'lik ultra santrifüj tüpüne yerleştirilerek 15 dakika boyunca buzda kalmasına izin verilir. Pompanın hızı dakikada bir <1 mL'ye ulaşmalıdır.
- Tüpü 45 ° 'lik bir açıyla eğinmek için% 40 tabakanın üzerine% 20 yoğunlukta santrifüj gradyanını katmak için peristaltik pompayı kullanın. Pompanın hızı, dakikada 1 mL'den az akış hızına ulaşmalıdır. Katmanların 15 dakika boyunca buzda kalmasına izin verin.
- % 20-40 yoğunluklu santrifüj gradyanı üzerinde kan bağı hücreleri içeren 3 mL DMEM ortamı katmak için dakikada 1 mL'den daha düşük peristaltik pompa kullanın.
- Azami hızlanma ve minimum hızlanma için santrifüj programlayın. 10 dakika 600 x g'de santrifüjleyin. Epitel tek hücrelerini izole etmek için DMEM ile interfazları toplayın:% 20 yoğunlukta santrifüj gradyanı ve% 20:% 40 yoğunlukta santrifüj gradyanları. Sonraki analizler için toplanan ara fazları 4 ° C'de saklayın.
4. Hücre İzolasyonunun Değerlendirilmesi
- hemasitometre
- Hematitometre slaydını alkolle temizleyin.
- Yavaşça hücreleri yukarıya ve aşağıya pipetleyerek hücreleri erteleyin. 1.5 mL mikrosantrifüj tüpünde hücre süspansiyonundan 100 μL pipetleyin.
- 0.4% Trypan Blue 400 μL ekleyin. Tüpü hafifçe oynatarak hafifçe karıştırın.
- Hemocytometer'in her iki haznesini yavaşça doldurmak için Trypan Blue ile işlenmiş hücre süspansiyonundan 100 μL pipetleyin.
- Hemositometreyi, 10X'lik bir hedefle hemositometrenin ızgara çizgilerine odaklanarak, hafif bir mikroskop altında yerleştirin.
- Elde taşınan bir çarpıcı sayaç kullanarak, canlı olmayan lekelenmemiş hücreleri 16 kareden oluşan bir kümede sayın. Aynı meydanın içinde mavi ölü hücreleri sayın. 16 kareden oluşan dört set sayılana kadar saymaya devam edin.
- Formül kullanarak mL başına toplam hücre sayısını hesaplayın:
47eq1.jpg "/> - Aşağıdaki formülle hücre yaşayabilirliğini hesaplayın:
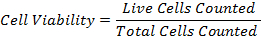
- Hücre İzolat Görselleştirme
- 1,5 mL'lik bir mikrosantrifüj tüpünde 9 μL HBSS'de izole hücrelerin 1 μL'sini seyreltin. Mikro santrifüj tüpünü nazikçe karıştırmak için kullanın.
- Bir cam slayt ortasına HBSS izole hücrelerin 5 mcL Pipet. 4 ', 6-diamidino-2-fenilindol (DAPI) ile üç damla montaj aracı uygulayın.
- Slayt 5 dakika boyunca oda sıcaklığında inkübe edin. Hava kabarcıkları önleyerek preparatın üzerine bir kapak kayışı yerleştirin.
- Floresan mikroskop altında 360 nm uyarımda DAPI ile lekelenmiş hücreleri ve 460 nm'de emisyonu görselleştir.
5. Hücre Yüzey Proteini Biyotinilasyonu
- Biotinat 100 uL tek hücreli epitel hücrelerinin Biotin (Tip A) KonjugasyonuKiti, üreticinin talimatlarına göre 1: 1 yüzey proteininin konjuge edilecek molar bir oranda
- Hücre lizisi için, biyotinlenmiş hücrelere 100 μL PBS,% 1 Triton X-100,% 10 gliserol, 100 uM oksitlenmiş glutatyon ve PIC ekleyin. 10 dakikada bir hafifçe karıştırarak buz üzerinde 1 saat inkübe edin.
- Çözünmeyen maddeyi pelet haline getirmek için 20 dakika boyunca 4 ° C'de 20,000 xg'de biyotinlenmiş hücreleri santrifüjleyin. Sitoplazmik ve biyotinlenmiş zar proteinleri içeren süpernatantı toplayın.
- Bradford tahlili ile protein konsantrasyonunu belirleyin.
6. Biyotinlenmiş Yüzey Proteinlerin İzolasyonu
- 1.5 mL mikrosantrifüj tüpüne 50 μL Streptavidin Manyetik Boncuk ekleyin.
- Boruyu manyetik bir standa yerleştirin, boncukları tüpün yanına toplayın. Süpernatanı çıkarın ve atın.
- Tüpe 1000 μL TBS,% 0.1 Tween-20 ekleyin. Nazikçe karıştırın ve manyetik kütlesi ile boncukları toplayınd. Süpernatanı çıkarın ve atın.
- Yıkanmış manyetik boncuklar ile 1x PBS'de 300 μL'ye seyreltilmiş 40 μg biyotinlenmiş hücre yüzeyi proteinlerini birleştirin. Çalkalayarak oda sıcaklığında 2 saat inkübe edin.
- Boncukları manyetik bir ayakla toplayın, yüzen maddeyi çıkarın ve atın.
- Boncukları tekrar askıya almak için hafifçe karıştırarak 300 μL TBS,% 0.1 Tween-20 tüp ekleyin. Boncuk toplayın, süpernatanı çıkarın ve atın. Bu yıkama adımı iki kez tekrarlayın.
- Manyetik boncuklara 0.1 M glisin pH 2.0'dan 100 uL ekleyin ve oda sıcaklığında 5 dakika inkübe edin. Boncuk toplayın ve elüt edilen biyotinlenmiş yüzey proteinleri içeren süpernatantı çıkarın.
- İzole edilmiş yüzey proteinlerini% 4-20 Tris-MOPS SDS-PAGE jelinde canlandırabilirsiniz.
7. Biyotinlenmiş Yüzey Proteininin Değerlendirilmesi
- Nokta leke
- Nitroselüloz zarın 7 cm x 3 cm şeridini kesin.
- 10 μg total tick gu uygulayınT içerikleri (yukarıdaki 1.8'den) ve membrana 10 ug biyotinlenmiş yüzey proteini. Oda sıcaklığında 15 dakika kurumaya bırakın.
- Bir kutuya aktarın ve 100 mL bloke edici tampon içine batırın. Bir saat çalkalanarak oda sıcaklığında inkübe edin. Engelleme tamponunu atın.
- Çalkalamayla 5 dakika boyunca 100 μL PBS,% 0.05 Tween-20 içinde nitroselüloz zar yıkayın. Yıkama tamponunu atın ve yıkamaları ç kez tekrarlayın.
- Oda sıcaklığında ajitasyon ile 2 saat süreyle 100 uL PBS,% 0.05 Tween-20'de 1/5000 Streptavidin-yaban turbu peroksidazı (HRP) içinde inkübe edin ve kalan solüsyonu atın.
- Nitroselüloz membranı 100 μL PBS,% 0.05 Tween-20 ile çalkalamayla 5 dakika yıkayın. Yıkama tamponunu atın ve yıkamayı üç kez tekrarlayın.
- Tespit için 1 tablet 4-kloro-1-napthol 10 mL buz soğukluğunda metanol içinde çözülür. 20 mL TBS'e 4 mL metanol stok ekleyin. 10 μL taze% 30 hidrojen peroksit ve immedi ekleyinNitroselüloz membrana uygulayınız.
- Oda sıcaklığında ajite çözünmeyen bir mavi son ürün üretene kadar çalkalayarak inkübe edin. Bu işlem 2-15 dakika sürebilir.
- Tespit solüsyonu atın ve 100 uL MQH 2 O., membran üç defa yıkamak
- ELISA Testi
- Her bir numunenin 200 ng'si 400 mcL 100 mM Karbonat kaplama tamponu ile inceltin ve ELISA plakasının (düz alt kuyular) birinci sıranın (A #) 2 katını kaplayın.
- Sıradaki diğer karşılık gelen oyuklara (BH) 100 mM'lik karbonat kaplama tamponu 100 uL ekleyin.
- Her bir numunenin seri seyreltmelerini, A sırasındaki her kuyudan 100 mcL pipetle alınarak ve B sırasına aktararak hazırlayın. Pipetleme ile hafifçe karıştırın ve kabarcıklar üretmekten kaçının. Satır H'deki her bir kuyudaki son 100 mcL'yi atarak, her satıra kadar seyreltmeleri tekrarlayın.
- Plakayı parafilm ile örtün ve gece boyunca 4 ° C'de inkübe edin.
- Tablayı yıkaE başına 200 μL PBS,% 0.05 Tween-20 ile üç kez.
- Kaplanmış oyuklara 200 uL engelleyici tampon ekleyin, Parafilm ile kaplayın ve gece boyunca 4 ° C'de inkübe edin.
- 1 / 15,000 Streptavidin-HRP'yi blokaj tamponunda seyreltin ve plakanın her oyuğuna 100 uL ekleyin. Parafilm ile kaplayın ve gece boyunca 4 ° C'de inkübe edin.
- Plakayı, beş kez 200 uL PBS,% 0.05 Tween-20 oranında yıkayın.
- Tespit etmek için, göz başına 100 μL TMB reaktif ekleyin. Yeterli renk gelişiminden sonra, genellikle 10-15 dakika arasında, reaksiyonu durdurmak için 100 uL 1 M fosforik asit ekleyin.
- Λ = 450 nm'de her kuyunun absorbansını okuyun.
Sonuçlar
Epitelyal hücreler, Şekil 1'de sunulan şematik gibi R. microplus'un bağırsak dokularından izole edildi. Bu protokolü kullanarak hazırlanan kene bağırsak epitel hücrelerinin temsili floresan mikroskopi görüntüleri Şekil 2A'da gösterilmektedir Ve 2B. Hücre izolasyonu, yarı-tıkanmış R. microplus üzerinde yap...
Tartışmalar
Sığır istilası, akarisitlerin 1 , 4 kullanımına bağlı en yaygın kontrol yöntemiyle dünyanın tropik ve subtropikal bölgelerinde sığır endüstrisi için büyük bir problem teşkil etmektedir. Bm86, daha önce Bm86 coğrafi dizilim varyasyonu ve düzenli boostlama gereksinimi 4 nedeniyle, bir aşı stratejisi olarak sınırlı başarı ile, R. microplus istila 10'a karşı koruyucu bir an...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, bu çalışma için kullanılan Rhipicephalus microplus kenelerinin sağlanması için Biosecurity Tick Colony'ye (Queensland Tarım ve Balıkçılık, Avustralya) ve Lucas Karbanowicz'e video çekimi için yardım etmekten dolayı teşekkür etmek istiyorlar.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | ThermoFisher Scientific | 15250061 | |
| 1.5 mL microcentrifuge tube | Eppendorf | 3322 | |
| 100mM Carbonate Buffer | 3.03 g Na2CO3, 6.0 g NaHCO3 1000 ml distilled water pH 9.6 | ||
| 16 mL centrifuge tubes with sealing cap | Thermo Scientific | 3138-0016 | Cool in ice prior to gradient |
| 250 µM cell strainer | Thermo Fisher | 87791 | |
| 3,3′,5,5′-Tetramethylbenzidine (TMB) Liquid Substrate System for ELISA | Sigma | T0440 | Stored at 4C |
| 30% Hydrogen Peroxide | Labscene | BSPA5.500 | |
| 4-20% Tris-MOPS Gel | Gen Script | M42015 | |
| 4-Chloro-1-naphthol tablet | Sigma-Aldrich | C6788 | |
| 50 mL Falcon Tube | Corning Blue | 30 x 115mm style. Polyproplyene conical tube. | |
| 70 µM cell strainer | BD Falcon | 352350 | |
| AP15 filter paper | Millipore | AO1504200 | |
| Biotin (Type A) Conjugation Kit | Abcam | Ab102865 | |
| Dissection microscope | Olympus | SZX7 | |
| DP Manager | Olympus | 2.2.1.195 | Cell imagery software |
| Duct Tape | Home Handyman | 48mm x 25mm Duct Tape | |
| Dulbecco’s Modified Eagle Medium | Gibco | 11995-065 | DMEM - ice cold for protocol |
| EDTA | Amresco | 0105-500G | |
| F96 Maxisorp Immuno Plate | Nunc | 439454 | |
| Fetal Bovine Serum | Sigma-Aldrich | 12003C | FCS |
| Fluorescence microscope | Olympus | BX51 | |
| Fluoroshield with DAPI | Sigma-Aldrich | F6057-20ML | DAPI |
| Forceps | Dumont | #9 Dumont - Switerzland | |
| Glycerol | Sigma-Aldrich | G5516 | Glycerol for molecular biology >99% |
| Glycine | Sigma-Aldrich | 410225 | |
| Hand-Held Counter | Officeworks | JA0376230 | |
| Hank’s Balanced Salt Solution | Sigma Life Sciences | H9394 | HBSS – ice cold for protocol |
| Hemacytometer | Optik Lakor | - | - |
| L-Glutathione oxidized | Sigma-Aldrich | G4376 | |
| Magnetic Separation Stand | Novagen | - | 4-Tube Magnetic Separation Rack |
| Methanol | Sigma-Aldrich | 179337 | |
| Milli-Q Water | Millipore | ZRXQ003WW | Integral Water Purification System for Ultrapure Water |
| Nitrocellulose Membrane | Life Sciences | 66485 | 30cm x 3M pure nitrocellulose membrane |
| PageRuler Prestained protein Ladder | Thermo-Fisher | SM0671 | |
| PBS | 1.16 g Na2HPO4, 0.1 g KCl, 0.1 g K3PO4, 4.0 g NaCl (500 ml distilled water) pH 7.4 | ||
| Percoll | Sigma-Aldrich | P1644-500ML | |
| Peristaltic Pump | Masterflex | 7518-10 | |
| Phosphoric Acid | Sigma-Aldrich | P6560 | |
| Pierce Protein-Free T20 PBS Blocking Buffer | Thermo-Scientific | 37573 | Stored at 4C. Blocking Buffer |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P8215-5ML | PIC – stored at -20 °C |
| Quick Start Bradford Dye Reagent 1x | Biorad | 500-0205 | For Bradford Assay |
| Quick Start BSA Standards | Biorad | 500-0207 | BSA standards for Bradford Assay |
| Scalpel | Lab. Co | Size 11 Scalpel | |
| SilverQuest TM Staining Kit | Invitrogen | LC6070 | |
| Simply Blue TM Safe Stain | Invitrogen | LC6060 | |
| Sorvall C6+ Ultracentrifuge | Thermo Scientific | 46910 | |
| Streptavidin (HRP) | Abcam | AB7403 | |
| Streptavidin Magnetic Beads | New England Biolabs | S1420S | |
| Super Glue - Ultra Fast Mini | UHU | UHU Super Glue 1mg. Ultra Fast mini | |
| Table-top Centrifuge | Eppendorf | 22331 | |
| TCEP | Thermo Fisher | 20490 | |
| Triton X-100 | Biorad | 161-0407 | |
| Tween-20 | Sigma | P2287-500ML | |
| Vortex Mixer | Ratek | VM1 | |
| Water Bath | Grant | GD100 |
Referanslar
- Rodriguez-Valle, M., et al. Efficacy of Rhipicephalus (Boophilus) microplus Bm86 against Hyalomma dromedarii and Amblyomma cajennense tick infestations in camels and cattle. Vaccine. 30, 3453-3458 (2012).
- De Rose, R., et al. Bm86 antigen induces a protective immune-response against Boophilus microplus following DNA and protein vaccination in sheep. Vet. Immunol. Immunopathol. 71, 151-160 (1999).
- García-García, J. C., et al. Sequence variations in the Boophilus microplus Bm86 locus and implications for immunoprotection in cattle vaccinated with this antigen. Exp. Appl. Acarol. 23, 883-895 (1999).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: The state of play. Vet. Parasitol. 203, 6-20 (2014).
- Kearney, S. . Acaricide (chemical) resistance in cattle ticks. , (2013).
- Foil, L. D., et al. Factors that influence the prevalence of acaricide resistance and tick-borne diseases. Vet. Parasitol. 125, 163-181 (2004).
- Rodriguez, M., et al. High level expression of the B. microplus Bm86 antigen in the yeast Pichia pastoris forming highly immunogenic particles for cattle. J Biotechnol. 33, 135-146 (1994).
- Rodriguez, M., et al. Effect of vaccination with a recombinant Bm86 antigen preparation on natural infestations of Boophilus microplus in grazing dairy and beef pure and cross-bred cattle in Brazil. Vaccine. 13 (18), 1804-1808 (1995).
- Lew-Tabor, A. E., Rodriguez Valle, M. A review of reverse vaccinology approaches for the development of vaccines against ticks and tick borne diseases. Ticks Tick Borne Dis. 7, 573-585 (2016).
- Capella, A. N., Terra, W. R., Ribeiro, A. F., Ferreira, C. Cytoskeleton removal and characterization of the microvillar membranes isolated from two midgut regions of Spodoptera frugiperda (Lepidoptera). Insect Biochem. Mol. Biol. 27, 793-801 (1997).
- Cioffi, M., Wolfersberger, M. G. Isolation of separate apical, lateral and basal plasma membrane from cells of an insect epithelium. A procedure based on tissue organization and ultrastructure. Tissue Cell. 15, 781-803 (1983).
- Koefoed, B. M. A simple mechanical method to isolate the basal lamina of insect midgut epithelial cells. Tissue Cell. 17, 763-768 (1985).
- Roche, J. K. Isolation of a purified epithelial cell population from human colon. Methods Mol. Med. 50, 15-20 (2001).
- Terra, W. R., Costa, R. H., Ferreira, C. Plasma membranes from insect midgut cells. An. Acad. Bras. Ciênc. 78, 255-269 (2006).
- Vargas, A. E., Markoski, M. M., Cañedo, A. D., Helena, F., Nardi, N. B. Identification, isolation and culture of intestinal epithelial stem cells from murine intestine. Stem Cells. 879, 479-490 (2012).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. Eur. J. Microbiol. Immunol. 2, 112-120 (2012).
- Karhemo, P. R., et al. An optimized isolation of biotinylated cell surface proteins reveals novel players in cancer metastasis. J. Proteomics. 77, 87-100 (2012).
- Obenchain, F. R., Galun, R. Physiology of Ticks. Current Themes in Tropical Science Volume 1. , 201-205 (1982).
- Sonenshine, D., Roe, R. Chapter 3.1. "Biology of Ticks". 1, (2014).
- Raikhel, A. S., Balashov, Y. S. . "An Atlas of Ixodid Tick Ultrastructure" (English Translation). , (1983).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır