需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种单片机操作装置, 用于生成传统卷烟烟雾和电子烟气溶胶中的液体萃取物
摘要
在这里, 我们描述一个可编程的实验室设备, 可用于创建传统卷烟烟雾和电子香烟气溶胶提取物。这种方法为直接比较传统卷烟和电子卷烟提供了一个有用的工具, 是电子卷烟研究中一个容易进入的切入点。
摘要
电子卷烟是中、高中学生最受欢迎的烟草产品, 是成人中最受欢迎的替代烟草产品。对电子卷烟使用的后果进行高质量、重复性的研究, 对于了解新出现的公共卫生问题和制定基于证据的监管政策至关重要。虽然越来越多的论文讨论电子卷烟, 但在各组的方法上几乎没有一致性, 对结果的共识也很少。在这里, 我们描述一个可编程的实验室设备, 可用于创建传统卷烟烟雾和电子香烟气溶胶提取物。本协议详细说明了该设备的组装和操作, 并演示了在两个示例应用程序中使用生成的提取物: 一个体外细胞活力测定和气相色谱质谱。该方法提供了一种直接比较传统卷烟和电子卷烟的工具, 是电子卷烟研究中一个容易进入的切入点。
引言
尽管保健组织作出了集中的努力, 但烟草产品的使用仍然是全世界可预防死亡的主要原因, 其中大多数死亡归因于吸烟的1。自2003年进入市场以来, 电子卷烟在烟草产品用户中的知名度越来越高。目前, 电子香烟是最流行的替代传统香烟在美国成年人 (〜 5%)2和最流行的尼古丁传递系统中间 (〜 5.3%) 和高中生 (〜 16%)3。如果目前的趋势继续下去, 电子卷烟有望取代传统的香烟, 为子孙后代。然而, 电子卷烟使用的健康后果仍不清楚。
电子卷烟的研究直到 2013年3,4的电子卷烟普及程度迅速增加, 才开始认真。自那时以来, 采用了一些不同的模式来解决其毒性问题。然而, 许多研究的结果是相互矛盾的, 虽然电子卷烟的毒性一般低于传统卷烟, 但目前没有就电子香烟的健康后果达成共识使用5,6,7. 我们以前的研究表明, 电子卷烟对血管内皮的毒性要比传统的香烟低得多, 尽管它们有能力引起 DNA 损伤和诱导氧化应激和细胞死亡,8.然而, 在我们得出关于电子卷烟使用的健康后果的确切结论之前, 需要进行更多的研究。
由于常规卷烟是可预防的血管疾病的主要病因9, 因此对电子卷烟使用的血管健康风险的兴趣与日俱增, 如10、11、12。为了研究电子香烟对血管系统的影响, 我们的实验室开发了一个单片机操作的冒烟/vaping 设备 (图 1)8。该装置能够在水或有机溶剂中产生传统卷烟烟雾或电子香烟气溶胶的液体萃取物。由于气流由可调式气流调节器和 PBASIC 定时程序的组合控制, 因此该装置可根据任意数量的用户定义的协议来生成提取物。在这里, 我们详细介绍了该设备的组装和操作以及两个潜在的应用:体外细胞活力评估和气相色谱质谱。
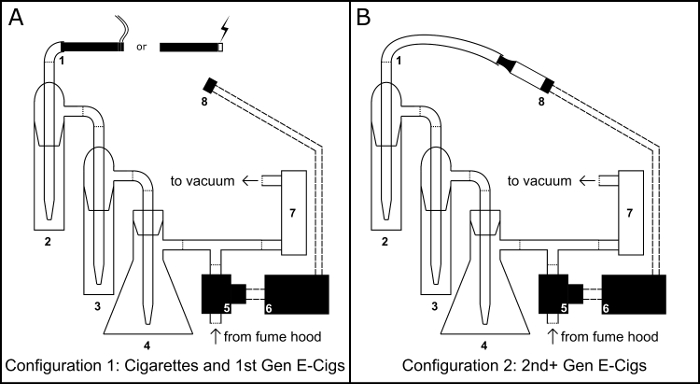
图 1: 吸烟/Vaping 设备.为吸烟/vaping 装置的物理装配示意图在香烟或香烟象电子香烟 (电子烟) 配置 (A) 和坦克电子香烟配置 (B)。组件键: 1) 吸入口;2) 初级收藏器;3) 溢流器;4) 傅书礼瓶真空疏水阀;5) 一般开式电磁阀;6) BS1 单片机;7) 气流调节器;8) 510 螺纹电子烟罐底座。请单击此处查看此图的较大版本.
研究方案
1. 装置的装配
- 将100毫升傅书礼烧瓶 (图 1, #4) 固定在钢制圆环架上, 并通过填充50克氯化钙来形成一个真空阱, 作为干燥剂。用橡胶通孔塞子密封烧瓶, 用石蜡膜包裹塞子接合处, 并在孔中运行吸管。
- 使用乙烯基油管, 将吸管从塞子延伸到 t 形交叉软管连接器。
- 使用乙烯基油管, 连接两个器 (图 1, #2 & #3), 并将第二个器的输出连接到 t 形交叉管接头。
- 使用乙烯基油管, 连接第一个器的输入端口作为吸入端口 (图 1, #1)。
- 使用乙烯基油管, 将傅书礼烧瓶的侧臂连接到气流调节器 (图 1, #7) 的输入端口和气流调节器的出口端到真空泵。
- 根据图 2A中的示意图组装电路。
- 通过串行适配器和制造商的软件, 将 PBASIC 程序诚 bs1 (图 2B, 也可在 https://github.com/ChastainAnderson/SVL) 上载到 BS1 微控制器 (图 1, #6)。
- 将510螺纹底座 (图 1 #8) 置于环形支架夹具中。
- 使用乙烯基油管, 将电磁阀 (图 1, #5) 连接到 t 型交叉管接头的自由端。
注: 该设备应完整, 并准备运行, 检查所有接头, 以确保他们是空气紧张, 并应用软管钳和真空润滑脂的需要。
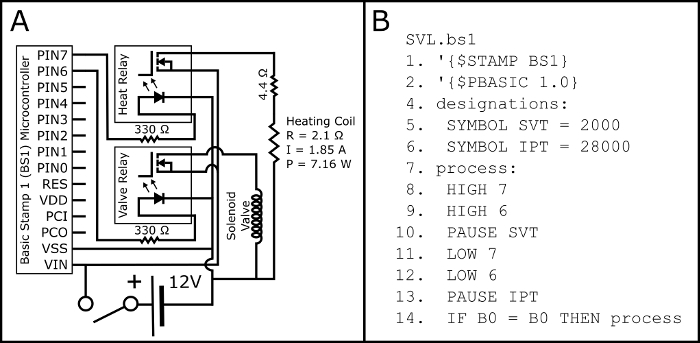
图 2: 电气示意图和 PBASIC 代码.图 2A显示用于装配所需电路的电气示意图, 以激活正常打开的电磁阀和按钮激活电子烟的加热线圈 (通过510螺纹电子烟罐底座)。加热线圈的电气参数 (P: 功率;R: 电阻;和 I: 电流) 的预测, 并应经验验证用万用表后组装。图 2B显示了在图 2A中控制电路所需的 PBASIC 计时程序 (也可在 https://github.com/ChastainAnderson/SVL 中使用)。定时常数 SVT & 间隙 (#5 & #6) 是以 ms 为单位, 并设置为2秒的激活时间, 并在二十八年代停机.请单击此处查看此图的较大版本.
2. 样品贮存和制备
- 在室温下, 将所有未开封的传统和电子卷烟样品存放在密闭的塑料袋中。
- 一旦打开, 在 4 c 的密闭塑料袋中储存样品, 用纸巾吸收多余的水分。
- 预平衡所有样品在室温下盒60% 湿度至少30分钟前使用。
3. 卷烟烟雾/电子烟气溶胶萃取装置的一般操作
- 使用分析天平确定每个电子烟 cartomizer/罐前 vaping 的质量。前/后 vaping 重量的差异将用于确定适当的剂量。
注: 3R4F 参考卷烟被假定含有0.7 毫克的尼古丁, 而商业卷烟品牌的尼古丁含量可以用传统的分析方法13来确定。 - 对于样品应用 1, 用4.3 毫升内皮细胞培养基填充原器的储层。样品应用 2, 用5毫升丙酮填充油层。
-
准备用于提取的电子香烟或常规香烟:
- 如果使用传统的卷烟, 在过滤器周围应用一条清晰的胶带, 并在卷烟纸加入过滤器的地方放置一个容易看到的标记。
- 如果使用香烟, 如电子烟, 确保电池是很好的充电和 cartomizer 紧拧到电池。
- 如果使用电子香烟罐, 确保在油箱内装上适当数量的电子香烟液体, 并将油箱拧到510螺纹底座上。
- 将常规或电子卷烟的尖端插入吸入式端口 (图 1, #1), 并用软管钳固定。
- 打开真空泵。
- 调整流量计, 以拉动1.65 升/分钟, 以确保55毫升粉扑超过2秒。
- 打开微控制器。如果使用传统的香烟, 点燃香烟的第一个粉扑。
- 运行, 直到预计的预期浓度 (在部分每百万或% 重量/体积) 达到。
-
使用分析天平确定每个电子烟 cartomizer/罐在汽化后的质量。将此测量与步骤3.1 中所采取的测量值进行比较, 以确定所消耗的总质量。计算溶剂的消耗质量/体积的浓度。使用所消耗的尼古丁的摩尔浓度, 使产品正常化。
- 如果消耗的质量不足, 则将电子卷烟退回设备并进一步消耗。
- 如果消耗了足够或过剩的质量, 请继续。
4. 过滤和贮存
- 如果提取物是用于细胞培养, 过滤通过0.22 µm PES 注射器过滤器。
- 立即使用提取物或存储在-80 c。作为准备安德森的一部分, et al.8, 电子烟气雾剂被证明是稳定的至少两个星期, 和两年的香烟烟雾的稳定性已建立由骗子, et al.13。
5. 清洗设备
- 每次提取后, 用70% 乙醇和去离子水冲洗该装置的油管和储油层, 以防止样品之间的携带。
- 在漂洗之后, 简要地运行空的设备允许气流帮助烘干线。
6. 样品应用 1: 中性红吸收细胞活力测定
- 以4.3 毫升的内皮细胞生长培养基进行提取。
- 一天前, 种子人脐静脉内皮细胞进入96井板, 密度为 1 x 104细胞/在100µL 内皮细胞生长培养基。
- 用100µL 的新鲜内皮细胞培养基取代原有的内皮细胞培养基来治疗细胞, 以作为对照或75µL 的内皮细胞生长培养基, 混合25µL 2 毫米消耗的尼古丁浓度提取物 (1.4 毫克将尼古丁消耗到4.3 毫升内皮细胞生长培养基中), 最终浓度为500µM, 作为治疗。
- 由于香烟烟雾和电子烟气溶胶中的许多成分都是挥发性的, 所以使用铝箔密封来保持油井的密闭。
- 孵育板 24个 h 在37° c 和 5% CO2。
-
准备中性红染色溶液:
- 创建一个100x 中性红股票解决方案, 溶解33毫克的中性红色染料到10毫升的缓冲盐溶液。
- 使用前不久, 稀释100x 库存溶液1:100 在细胞培养基中创建1x 中性红染色液。
- 孵育中性红染色液在37° c 至少30分钟之前使用和立即使用。
注意: 有些晶体在孵化过程中沉淀是正常的。应注意避免将这些晶体应用于细胞培养井。如果需要, 22 µm 过滤器可用于过滤中性红色股票和染色解决方案。
- 去除提取物, 并添加100µL 中性红染色溶液每井, 使用过量创造至少三空白井为适当的量化。
- 在37° c 和 5% CO2的 2-4 h 处孵育盘。
- 去除中性红染色液, 在 PBS 中浸泡3x 冲洗。
- 应用中性红脱污液 (50% 去离子水, 49% 乙醇, 1% 乙酸)。
- 室温下至少孵育10分钟。
- 读取 540 nm 的吸光度。
- 通过将空白井的平均值减去平均值和正则化到空白调整控制井值的平均值来分析数据。
7. 样品应用 2: 气相色谱质谱
- 在5毫升丙酮中进行提取。
- 运行的设备, 以达到最终的浓度为100分之每百万 (重量的 e 液体消耗/丙酮体积) 的样品。
- 使用精密玻璃注射器, 注入1µL 到注射器的 GC-MS 装置。在250° c 的条件下注入1:20 分裂比例的气相色谱/四极谱仪系统, 配有带有以下烤箱协议的 ZB-5 柱: 1 分钟在50° c;斜坡10° c/分至140° c;舷梯20° c/分钟到300° c 并且举行10分钟。
- 将产生的质量谱与目标库相匹配, 以确定气溶胶成分。
结果
在24小时内, 人类脐静脉内皮细胞暴露于传统的卷烟烟雾提取物 (EAE) 或电子香烟气溶胶提取物 (的), 有一个显着的 (控制与...... 控件 vs. EAE p< 0.01;n = 6) 细胞存活率降低 (图 3A)。提取物产生的膨化轮廓为 2, 2 秒, 55 毫升喷泡每分钟和正常化的基础上的摩尔浓度尼古丁的设备。暴露于500µM 消耗的尼古丁当量的学会极大地减少了活细胞到11.06 ±...
讨论
本协议最关键的元素是确保设备在每次提取的开始和结束时都是干净的, 并确保所有的密封都保持稳定, 以使气流保持一致。如果设备没有被正确地清洗, 有风险在样品之间运载。此外, 如果设备在长时间内不洁, 凝结气溶胶和干溶剂就会堵塞系统。请注意, 这是正常的, 有一个压力下降时, 膨化一个传统的卷烟和气流表应调整, 以提供所需的气流期间的粉扑, 而不是当设备是拉动房间空气。该方法的?...
披露声明
由杜兰大学管理的烟草产品管理科学研究金项目由奥客户服务管理事务处提供资金。
致谢
作者感谢杜兰大学细胞和分子生物学系的 Dr. 罗伯特. Dotson 协助编辑杜兰大学化学系的手稿和 Dr. 詹姆斯. 布林协助采用质谱法设计。作者进一步承认杜兰大学细胞和分子生物学系和杜兰大学化学系的支持和使用空间和设备。这项工作得到了烟草产品管理科学研究金和杜兰大学科学与工程学院安德森的支持。
材料
| Name | Company | Catalog Number | Comments |
| 12 V AC/DC Wall Mount Adaptor | Digi-Key | T1099-P5P-ND | |
| 2.2 Ohm Resistors | Digi-Key | A105635-ND | Used in tandem to generate the 4.4 Ohm resistance in Figure 2A |
| 330 Ohm Resistors | Digi-Key | 330QBK-ND | |
| 510 Threaded Base | NJoy | N/A | Recovered by dismantalling a second generation NJoy electronic cigarette |
| Acetic Acid, Glacial | Sigma-Aldritch | A6283 | |
| Acetone (Chromatography Grade) | Sigma-Aldritch | 34850 | |
| Basic Stamp Project Board | Digi-Key | 27112-ND | This board contains the BS1 Microcontroller, serial adaptor, power switch, and a barrel pin connector for the AC/DC Wall Mount Adaptor |
| Basic Stamp USB to Serial Adapter | Digi-Key | 28030-ND | An optional component to allow the BS1 serial adaptor to communicate through USB |
| Buchner Flask (Vacuum Flask) 250 mL | VWR | 10545-854 | |
| Clear Tape | 3M | S-9783 | |
| Clear Vinyl Tubing, 3/8" ID | Watts | 443064 | |
| EGM-2 Endothelial Cell Culture Medium | Lonza | CC-3162 | |
| Ethanol | Pharmco-Aaper | 111000200 | |
| Flow Regulator | Dwyer | VFA-23-BV | |
| Gas Chromatograph | Varian | 450-GC | |
| Glass Syringe, 10 mL | Sigma-Aldritch | Z314552 | |
| Glass Syringe, 10 µL | Hamilton | 80300 | |
| High Vacuum Silicon Grease | Dow Corning | 146355D | |
| Hose Clamp | Precision Brand | 35125 | |
| Human Umbilical Vein Endothelial Cells | ATCC | PCS-100-013 | |
| Mass Spectrometer | Varian | 300-MS | |
| Midget Impinger | Chemglass | CG-1820-01 | |
| Neutral Red | Sigma-Aldritch | N4638 | |
| Paraffin Film | 3M | PM-992 | |
| Plate Seal Roller | BioRad | MSR0001 | |
| Plate Seal; Foil | Thermo | 276014 | |
| Ring Stand 20" | American Educational Products | 7-G15-A | |
| Solenoid Valve (normally open) | US Solid | USS2-00081 | |
| Solid State Relay | Digi-Key | CLA279-ND | |
| Stand Clamp | Eisco | CH0688 | |
| Syringe Filter, PES, 0.22 um | Millipore | SLGP033RS | |
| Syringe, 10 mL | BD Syringe | 309604 | |
| Through Hole Stopper, Size 6 | VWR | 59581-287 | |
| Vacuum Pump | KNF Neuberger | N86KTP |
参考文献
- World Health Organization. . WHO Report on the Global Tobacco Epidemic, 2011. , (2011).
- Weaver, S. R., Majeed, B. A., Pechacek, T. F., Nyman, A. L., Gregory, K. R., Eriksen, M. P. Use of electronic nicotine delivery systems and other tobacco products among USA adults, 2014: results from a national survey. Int. J. Public Health. 61 (2), 177-188 (2016).
- Singh, T., et al. Tobacco Use Among Middle and High School Students - United States, 2011–2015. MMWR Morb. Mortal. Wkly. Rep. 65 (14), 361-367 (2016).
- Corey, C. G., Ambrose, B. K., Apelberg, B. J., King, B. A. Flavored Tobacco Product Use Among Middle and High School Students--United States, 2014. MMWR Morb. Mortal. Wkly. Rep. 64 (38), 1066-1070 (2015).
- Pisinger, C., Døssing, M. A systematic review of health effects of electronic cigarettes. Prev. Med. 69, 248-260 (2014).
- Callahan-Lyon, P. Electronic cigarettes: human health effects. Tob. Control. 23 (Suppl 2), ii36-ii40 (2014).
- Dinakar, C., O'Connor, G. T. The Health Effects of Electronic Cigarettes. N. Engl. J. Med. 375 (14), 1372-1381 (2016).
- Anderson, C., Majeste, A., Hanus, J., Wang, S. E-cigarette aerosol exposure induces reactive oxygen species, DNA damage, and cell death in vascular endothelial cells. Toxicol. Sci. Off. J. Soc. Toxicol. , (2016).
- U.S. Department of Health and Human Services. . The Health Consequences of Smoking: 50 Years of Progress. A Report of the Surgeon General. , (2014).
- Farsalinos, K., et al. Comparison of the Cytotoxic Potential of Cigarette Smoke and Electronic Cigarette Vapour Extract on Cultured Myocardial Cells. Int. J. Environ. Res. Public. Health. 10 (10), 5146-5162 (2013).
- Schweitzer, K. S., et al. Endothelial disruptive proinflammatory effects of nicotine and e-cigarette vapor exposures. Am. J. Physiol. - Lung Cell. Mol. Physiol. 309 (2), L175-L187 (2015).
- Putzhammer, R., et al. Vapours of US and EU Market Leader Electronic Cigarette Brands and Liquids Are Cytotoxic for Human Vascular Endothelial Cells. PLOS ONE. 11 (6), e0157337 (2016).
- Crooks, I., Dillon, D. M., Scott, J. K., Ballantyne, M., Meredith, C. The effect of long term storage on tobacco smoke particulate matter in in vitro genotoxicity and cytotoxicity assays. Regul. Toxicol. Pharmacol. 65 (2), 196-200 (2013).
- Roemer, E., et al. Mainstream Smoke Chemistry and in Vitro and In Vivo Toxicity of the Reference Cigarettes 3R4F and 2R4F. Beitr. Zur Tab. Contrib. Tob. Res. 25 (1), (2014).
- International Organization for Standards. . ISO 3088:2012 Routine analytical cigarette smoking machine – Definitions and standard conditions. , (2012).
- World Health Organization. . Standard Operating Procedure for Intense Smoking of Cigarettes. , (2012).
- Brown, C. J., Cheng, J. M. Electronic cigarettes: product characterisation and design considerations. Tob. Control. 23 (Suppl 2), ii4-ii10 (2014).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 81 - Routine Analytical Machine for E-Cigarette Aerosol Generation and Collection - Definitions and Standard Conditions. , (2015).
- Thorne, D., Adamson, J. A review of in vitro cigarette smoke exposure systems. Exp. Toxicol. Pathol. 65 (7-8), 1183-1193 (2013).
- Klus, H., Boenke-Nimphius, B., Müller, L. Cigarette Mainstream Smoke: The Evolution of Methods and Devices for Generation, Exposure and Collection. Beitr. Zur Tab. Contrib. Tob. Res. 27 (4), (2016).
- Baker, R. The Development and Significance of Standards for Smoking-Machine Methodology. Beitr. Zur Tab. Contrib. Tob. Res. 20 (1), (2014).
- Thorne, D., Crooks, I., Hollings, M., Seymour, A., Meredith, C., Gaca, M. The mutagenic assessment of an electronic-cigarette and reference cigarette smoke using the Ames assay in strains TA98 and TA100. Mutat. Res. Toxicol. Environ. Mutagen. 812, 29-38 (2016).
- Thorne, D., Larard, S., Baxter, A., Meredith, C., Gaҫa, M. The comparative in vitro assessment of e-cigarette and cigarette smoke aerosols using the γH2AX assay and applied dose measurements. Toxicol. Lett. 265, 170-178 (2017).
- Herrington, J. S., Myers, C. Electronic cigarette solutions and resultant aerosol profiles. J. Chromatogr. A. 1418, 192-199 (2015).
- Yu, V., et al. Electronic cigarettes induce DNA strand breaks and cell death independently of nicotine in cell lines. Oral Oncol. 52, 58-65 (2016).
- Ji, E. H., et al. Characterization of Electronic Cigarette Aerosol and Its Induction of Oxidative Stress Response in Oral Keratinocytes. PLOS ONE. 11 (5), e0154447 (2016).
- Morgan, D. L., et al. Chemical Reactivity and Respiratory Toxicity of the -Diketone Flavoring Agents: 2,3-Butanedione, 2,3-Pentanedione, and 2,3-Hexanedione. Toxicol. Pathol. 44 (5), 763-783 (2016).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 84 - Determination of Glycerin, Propylene Glycol, Water, and Nicotine in the Aerosol of E-Cigarettes by Gas Chromatographic Analysis. , (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。