Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein Mikrocontroller betrieben Gerät zur Erzeugung von flüssige Extrakte aus herkömmlichen Zigarette Rauch und elektronische Zigarette Aerosol
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine programmierbare Laborgerät, das verwendet werden kann, um Auszüge der herkömmlichen Zigarette Rauch und elektronische Zigarette Aerosol zu erstellen. Diese Methode bietet ein nützliches Werkzeug, um direkte Vergleiche zwischen herkömmlichen Zigaretten und e-Zigaretten und ist zugänglich Einstiegspunkt in die elektronische Zigarette-Forschung.
Zusammenfassung
Elektronische Zigaretten sind das beliebteste Tabakprodukt unter Mittel- und Oberschüler und das beliebteste alternative Tabakprodukt unter Erwachsenen. Hohe Qualität, reproduzierbare Forschung über die Folgen der Nutzung der elektronischen Zigarette ist unerlässlich für Verständnis entstehen öffentliche Gesundheit und crafting-Beweise Regulierungspolitik basiert. Während eine wachsende Anzahl von Papieren elektronische Zigaretten diskutieren, gibt es wenig Übereinstimmung in Methoden über Gruppen und sehr wenig Konsens über die Ergebnisse. Hier beschreiben wir eine programmierbare Laborgerät, das verwendet werden kann, um Auszüge der herkömmlichen Zigarette Rauch und elektronische Zigarette Aerosol zu erstellen. Dieses Protokoll beschreibt Anweisungen für den Zusammenbau und Betrieb des besagten Gerät und veranschaulicht die Verwendung des generierten Extraktes in zwei Beispielanwendungen: eine in-vitro- Zelle Lebensfähigkeit Assay und Gaschromatographie Massenspektrometrie. Diese Methode ist ein Werkzeug für direkte Vergleiche zwischen herkömmlichen Zigaretten und e-Zigaretten und ist zugänglich Einstiegspunkt in die elektronische Zigarette-Forschung.
Einleitung
Tabakkonsum Produkt bleibt trotz Bemühungen von Organisationen des Gesundheitswesens die Hauptursache für vermeidbare Todesfälle weltweit, die meisten dieser Todesfälle zugeschrieben Zigarette rauchen1. Seit dem Markteintritt im Jahr 2003, sind elektronische Zigaretten in der Popularität unter Tabakkonsumenten Produkt gewachsen. Elektronische Zigaretten sind derzeit die beliebteste Alternative zu herkömmlichen Zigaretten unter amerikanischen Erwachsenen (~ 5 %)2 und die beliebtesten Nikotin-Delivery-System unter Mitte (~ 5,3 %) und Oberschüler (~ 16 %)3. Wenn der gegenwärtige Trend anhält, können elektronische Zigaretten voraussichtlich herkömmliche Zigaretten für künftige Generationen zu ersetzen. Die gesundheitlichen Folgen der Verwendung der elektronischen Zigarette bleiben jedoch unklar.
Forschung auf elektronische Zigaretten begann nicht im Ernst, bis elektronische Zigarette Popularität schnell in 20133,4erhöht. Seit dieser Zeit haben eine Reihe von verschiedenen Modellen eingesetzt, um die Frage der Toxizität. Jedoch die Ergebnisse vieler Studien sind widersprüchlich, und während es scheint, dass elektronische Zigaretten sind in der Regel weniger toxisch als herkömmliche Zigaretten gibt es keine aktuellen Konsens über die gesundheitlichen Folgen der elektronischen Zigarette verwenden5, 6 , 7. unserer bisherigen Forschung zeigt, dass elektronische Zigaretten wesentlich weniger toxisch für das vaskuläre Endothel als herkömmliche Zigaretten, trotz ihrer Fähigkeit sind, DNA-Schäden und die Induktion von oxidativem Stress und Zelle Tod8 verursachen . Jedoch ist mehr Forschung notwendig, bevor wir Schlussfolgerungen über die gesundheitlichen Folgen der Nutzung der elektronischen Zigarette ziehen können.
Wie herkömmliche Zigaretten eine Hauptursache für vermeidbare arterielle Verschlusskrankheit9 sind, gibt es ein wachsendes Interesse an der vaskulären Gesundheitsgefährdung der elektronischen Zigarette verwenden10,11,12. Zur Untersuchung der Auswirkungen von e-Zigaretten auf das Gefäßsystem entwickelt unser Labor ein Mikrocontroller betrieben Rauchen/dampfen Gerät (Abbildung 1)8. Dieses Gerät ist in der Lage, flüssige Extrakte entweder herkömmliche Zigarette Rauch oder elektronische Zigarette Aerosol in wässrigen oder organischen Lösungsmitteln zu erzeugen. Da Luftstrom durch die Kombination von eine verstellbare Durchflussregler und ein PBASIC Zeitprogramm gesteuert wird, ist das Gerät einsetzbar, Extrakte nach einer beliebigen Anzahl von benutzerdefinierten Protokolle zu generieren. Hier wir ausführlich, Montage und Betrieb dieses Gerätes sowie zwei Anwendungsmöglichkeiten: in-vitro- Zelle Lebensfähigkeit Bewertung und Gaschromatographie Massenspektrometrie.
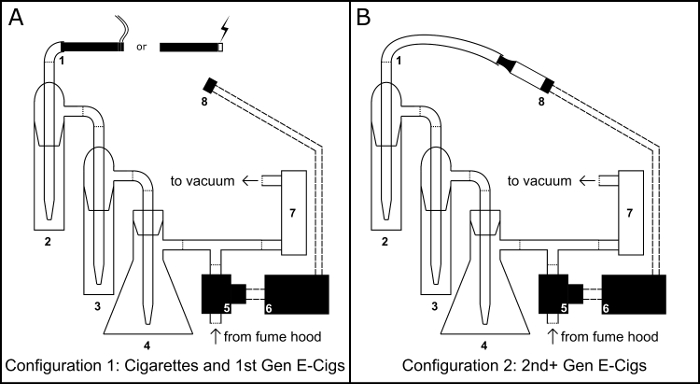
Abbildung 1: Rauchen/dampfen Gerät. Schaltplan für die physische Montage des Gerätes in die Zigarette/Zigarette wie elektronische Zigarette (e-Cig)-Konfiguration (A) und der Tank-elektronische Zigarette-Konfiguration (B) Rauchen/dampfen. Komponente-Taste: 1) Inhalation Port; (2) primäre Sammlung Ausbeute; (3) Überlauf Ausbeute; (4) Buchner Kolben Vakuum Falle; (5) Schließer Magnetventil; (6) BS1 Mikrocontroller; (7) Luft Durchflussregler; (8) 510 Gewinde elektronische Zigarette Tank Basis. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protokoll
1. Montage des Gerätes
- Sichern Sie eine 100 mL Buchner Kolben (Abbildung 1, #4) zu einem Stahlring stehen und schaffen eine Vakuum Falle durch füllen mit 50 g Kalzium-Chlorid als ein Trockenmittel dienen. Die Küvette mit Durchgangsbohrung Gummistopfen verschließen, wickeln Sie die Stopper Kreuzung mit Paraffin Film und Ausführen einer Pipette durch das Loch.
- Mit Vinyl-Schlauch verbinden Sie die Pipette erstreckt sich von der Stopper zu einer t-Kreuzung Schlauchanschluss.
- Mit Vinyl-Schlauch, verbinden Sie der zwei Ausbeute (Abbildung 1, #2 und #3) miteinander und verbinden Sie den Ausgang des zweiten Ausbeute an der t-Kreuzung Schlauchanschluss.
- Mit Vinyl-Schlauch verbinden Sie den Eingangs-Port der ersten Ausbeute, als Inhalation Hafen (Abbildung 1, #1) zu dienen.
- Vinyl Schlauch mit Seitenarm des Kolbens Buchner an den Eingang von einem Luftstrom-Regler (Abbildung 1, #7) anschließen und die Ausgangsöffnung des Reglers Luftstrom mit einer Vakuumpumpe.
- Montieren Sie die Schaltung nach dem Schaltplan in Abbildung 2A.
- Laden Sie die PBASIC Programm SVL.bs1 (Abb. 2 b, auch bei https://github.com/ChastainAnderson/SVL erhältlich) an den BS1 Mikrocontroller (Abbildung 1, #6) mittels eines seriellen Adapter und die Software des Herstellers.
- Ort der 510 Gewinde Basis (Abbildung 1 #8) in einem Ring stehen Klemme.
- Mit Vinyl-Schlauch, schließen Sie das Magnetventil (Abbildung 1, #5) an das freie Ende des t-Kreuzung-Schlauchanschluss.
Hinweis: Sollte das Gerät vollständig und betriebsbereit sein, überprüfen Sie alle Verbindungen, um sicherzustellen, dass sie luftdicht sind und Schlauchschellen und Vakuum Fett nach Bedarf anwenden.
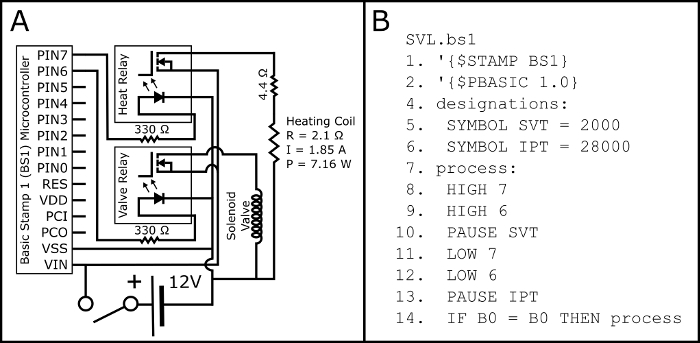
Abbildung 2: Schaltplan und PBASIC Code. Abbildung 2A zeigt den Schaltplan für die Montage der elektrischen Schaltung erforderlich, beide Schließer Magnetventil zu aktivieren und die Heizwendel Knopfdruck aktiviert elektronische Zigaretten (durch den 510 Gewinde elektronische Zigarette Tank Basis). Die elektrischen Parameter der Heizwendel (P: macht; R: Widerstand; und I: Current) werden projiziert und mit einem multimeter-Pfosten-Montage empirisch überprüft werden. Abbildung 2 b zeigt die PBASIC Zeitprogramm notwendig, um die Schaltung in Abb. 2A (auch abrufbar unter https://github.com/ChastainAnderson/SVL) zu steuern. Die Timing-konstanten SVT & IPT (#5 und #6) sind in Einheiten von ms und werden eine Einschaltzeit von 2 Sekunden und eine Ausfallzeit von 28 s. Klicken Sie bitte hier, um eine größere Version dieser Figur.
2. Probieren Sie Lagerung und Zubereitung
- Speichern Sie alle ungeöffneten konventionelle und elektronische Zigarette Proben in der Dunkelheit in luftdichten Plastikbeutel bei Raumtemperatur.
- Nach dem Öffnen Speichern Sie Proben in luftdichten Plastiktüten bei 4 ° c, mit einem Papiertuch, überschüssige Feuchtigkeit aufzunehmen.
- Pre-equilibrate alle Proben im Humidor bei ~ 60 % Luftfeuchtigkeit Raumtemperatur für mindestens 30 Minuten vor dem Gebrauch.
3. Allgemeine Bedienung der Zigarette Rauch/elektronische Zigarette Aerosol Absaugvorrichtung
- Bestimmen Sie die Masse der einzelnen e-Zigarette Cartomizer/Tank Pre-Dampfen mit Hilfe einer Analysenwaage. Der Gewichtsunterschied Pre/post post dampfen werden zur entsprechenden Dosierung zu bestimmen.
Hinweis: 3R4F Referenz Zigaretten wird angenommen, dass 0,7 mg Nikotin enthalten und der Nikotingehalt von kommerziellen Zigarettenmarken von konventionellen Analysemethoden13ermittelt werden. - Beispielanwendung 1 füllen Sie das Reservoir an die primäre Ausbeute mit 4,3 mL Kulturmedium Endothelzellen. Beispielanwendung 2 füllen Sie das Reservoir mit 5 mL Aceton.
-
Vorbereitung der elektronischen Zigarette oder herkömmliche Zigarette für Extraktion:
- Bei einer herkömmlichen Zigarette ein Stück durchsichtigem Klebeband um den Filter und setzen eine gut sichtbare Markierung wo das Zigarettenpapier verbindet den Filter.
- Wenn Sie eine Zigarette wie e-Zigarette verwenden, stellen Sie sicher der Akku ist gut und die Cartomizer fest verschraubt an der Batterie.
- Wenn einen elektronische Zigarette Tank verwenden, stellen Sie sicher, dass eine entsprechende Volumen der elektronischen Zigarette Flüssigkeit im Behälter geladen wird und Schrauben Sie den Tank auf 510 Gewinde.
- Stecken Sie die Spitze der konventionellen oder elektronischen Zigarette in die Inhalation Anschluss (Abbildung 1, #1) und mit einer Schlauchschelle sichern.
- Schalten Sie die Vakuumpumpe.
- Passen Sie den Durchflussmesser ziehen 1,65 L/Minute, um einen Zug 55 mL über 2 Sekunden zu gewährleisten.
- Schalten Sie den Mikrocontroller. Bei Verwendung eine herkömmliche Zigarette anzünden Sie die Zigarette auf dem ersten Zug.
- Läuft-bis-projiziert auf Wunsch Konzentration (in Teilen pro Million oder % Gewicht/Volumen) ist erreicht.
-
Ermitteln Sie die Masse der einzelnen e-Zigarette Cartomizer/Tank nach Verdampfung mit Hilfe einer Analysenwaage. Vergleichen Sie dieses Maß auf die Messung im Schritt 3.1 zu bestimmen, die gesamte Masse verbraucht. Berechnen Sie die Konzentration der verbrauchte Masse/Volumen des Lösungsmittels. Verwenden Sie die molare Konzentration der verbrauchten Nikotin zwischen Produkten zu normalisieren.
- Wenn eine unzureichende Masse verbraucht wurde, die elektronische Zigarette an das Gerät zurück und weiter konsumieren.
- Wenn eine ausreichende oder überschüssige Masse verbraucht wurde, fahren Sie fort.
4. Filterung und Lagerung
- Wenn Extrakt für die Zellkultur verwendet werden soll, durch einen 0,22 µm PES Spritze Filter filtern.
- Verwenden Sie die Extrakte sofort oder bei-80 ° c lagern. Als Teil der Vorbereitung für Anderson, Et al. 8, elektronische Zigarette Aerosol zeigte sich für mindestens zwei Wochen stabil zu sein, und die Stabilität von Zigarettenrauch bis zu zwei Jahre lang wurde von Gauner, Et al. 13.
5. Reinigung des Gerätes
- Nach jeder Extraktion spülen Sie den Schlauch und Stauseen des Gerätes mit 70 % Ethanol und deionisiertes Wasser zu verhindern, dass Übertrag zwischen Proben.
- Im Anschluss spülen, kurz laufen die leere Gerät um Luftstrom zu unterstützen, die Trocknung der Linien zu ermöglichen.
6. Beispielanwendung 1: Neutrale rote Aufnahme Zelle Lebensfähigkeit Assay
- Durchführen Sie Extrakt in 4,3 mL Endothelzellen Wachstumsmedium wie oben beschrieben.
- Samen Sie eines Tages vor, menschlichen Nabelader Endothelzellen in 96-well-Platten bei einer Dichte von 1 x 104 Zellen/Naturfreunde 100 µL der Endothelzellen Wachstumsmedium.
- Behandeln Sie die Zellen durch das Ersetzen der alten Endothelzellen Kulturmedium mit entweder 100 µL frische Endothelzellen Kulturmedium als Kontrolle dienen oder 75 µL Endothelzellen Wachstumsmedium gemischt mit 25 µL ein 2 mM konsumiert Nikotin Konzentration Extrakt (1,4 mg Nikotin in 4,3 mL Endothelzellen Wachstumsmedium verbraucht) für eine Endkonzentration von 500 µM als Behandlung dienen.
- Da viele Komponenten der beiden Zigarette Rauch und elektronische Zigarette Aerosol flüchtig sind, verwenden Sie ein Folienversiegelung, um die Brunnen luftdicht zu halten.
- Platte 18 – 24 h Inkubation bei 37 ° C und 5 % CO2.
-
Bereiten Sie neutral rot Färbelösung:
- Erstellen einer 100 X neutral rot Vorratslösung durch 33 mg des neutralen roten Farbstoff in 10 mL gepufferte Salzlösung auflösen.
- Kurz vor Gebrauch verdünnen Sie 100 x-Stammlösung 1: 100 im Zellkulturmedium, 1 x neutral rot Färbelösung zu schaffen.
- Inkubieren Sie neutral rot Färbelösung bei 37 ° C für mindestens 30 min vor Gebrauch und Verwendung sofort.
Hinweis: Es ist normal, dass einige Kristalle, während der Inkubation auszufällen. Darauf sollte geachtet werden, um zu vermeiden, diese Kristalle auf die Zelle Kultur Brunnen anwenden. Bei Bedarf kann ein.22 µm-Filter zum Filtern der neutralen roten Lager und befleckenden Lösungen verwendet werden.
- Entfernen Sie Auszug zu und fügen Sie 100 µL neutral rot Färbelösung pro darüber hinaus Verwendung Überschuss um mindestens drei leere Brunnen für korrekte Quantifizierung zu erstellen hinzu.
- Inkubieren Sie die Platte auf 2 – 4 h bei 37 ° C und 5 % CO2.
- Entfernen Sie neutral rot Färbelösung und waschen Sie 3 X durch Untertauchen in PBS.
- Gelten neutral rot de-färben Lösung (50 % entionisiertem Wasser, 49 % Ethanol, 1 % Essigsäure).
- Inkubieren Sie mindestens 10 min bei Raumtemperatur mit schütteln.
- Lesen Sie die Extinktion bei 540 nm.
- Analysieren von Daten durch Subtrahieren, der durchschnittliche Wert der leeren Brunnen und dem Durchschnitt der leere bereinigte gut Kontrollwert normalisieren.
(7) Beispielanwendung 2: Gaschromatographie-Massenspektrometrie
- Führen Sie die Extraktion als oben in 5 mL Aceton.
- Führen Sie das Gerät um eine Endkonzentration von ~ 100 ppm zu erreichen Millionen (Gewicht der e-Flüssigkeit verbraucht/Volumen Aceton) Ihrer Probe.
- Mit einer Präzision Glasspritze, 1 µL injizieren Sie in den Injektor eines GC-MS-Gerätes. Spritzen bei 250 ° C mit einer 01:20 ein gekoppelter Gaschromatographen/Quadrupol Spektrometer System ausgestattet mit einer ZB-5 Spalte mit dem folgenden Ofen Protokoll Verhältnis aufgeteilt: 1 min bei 50 ° C; Rampe 10 ° C/min auf 140 ° C; Rampe 20 ° C/min bis 300 ° C und 10 min warten.
- Übereinstimmen Sie, daraus resultierende Massenspektren, Zielbibliothek, Aerosol-Komponenten zu identifizieren.
Ergebnisse
Innerhalb von 24 Stunden nach der Exposition des menschlichen Nabelader Endothelzellen zu konventionellen Zigarettenrauch Extrakt (CSE) oder elektronische Zigarette Aerosol extrahieren (EAE), gibt es eine erhebliche (Kontrolle vs. CSE P < 0,001; Kontrolle vs. EAE P < 0,01; n = 6) Reduktion im Zellviabilität (Abb. 3A). Auszüge mit einem puffing Profil von 2, 2 Sekunden, 55 mL Züge pro Minute erzeugt wurden und normalisiert basierend auf mo...
Diskussion
Die wichtigsten Elemente dieses Protokolls sind, sicherzustellen ist das Gerät sauber zu Beginn und Ende jeder Extraktion, und sicherstellen, dass alle Dichtungen sind so gewährleistet, dass Luftstrom konsistent. Wenn das Gerät nicht richtig gereinigt wird, gibt es ein Risiko tragen über zwischen Proben. Außerdem, wenn das Gerät ist über einen längeren Zeitraum der Zeit verkürzte Aerosol unrein und getrocknet kann Lösungsmittel das System blockieren. Beachten Sie, dass es normal ist, denn es um einen Druckabfal...
Offenlegungen
Der Tabak Produkt Regulatory Science Research Fellowship-Programm von Tulane University verwaltet wird von Altria Client Services Regulatory Affairs finanziert.
Danksagungen
Die Autoren erkennen die Hilfe von Dr. Robert Dotson der Tulane Universität Institut für Zell- und Molekularbiologie für seine Hilfe bei der Bearbeitung des Manuskripts und Dr. James Bollinger an der Tulane Universität Fakultät für Chemie für seine Unterstützung mit Massenspektrometrie-Protokoll-Design. Die Autoren weiter erkennen Tulane Universität Institut für Zell- und Molekularbiologie und der Tulane Universität Fakultät für Chemie für ihre Unterstützung und die Nutzung des Weltraums und Ausrüstung. Diese Arbeit wurde von einem Tabak Produkt Regulatory Science Research Fellowship C. Anderson von der Tulane University School of Science and Engineering unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 12 V AC/DC Wall Mount Adaptor | Digi-Key | T1099-P5P-ND | |
| 2.2 Ohm Resistors | Digi-Key | A105635-ND | Used in tandem to generate the 4.4 Ohm resistance in Figure 2A |
| 330 Ohm Resistors | Digi-Key | 330QBK-ND | |
| 510 Threaded Base | NJoy | N/A | Recovered by dismantalling a second generation NJoy electronic cigarette |
| Acetic Acid, Glacial | Sigma-Aldritch | A6283 | |
| Acetone (Chromatography Grade) | Sigma-Aldritch | 34850 | |
| Basic Stamp Project Board | Digi-Key | 27112-ND | This board contains the BS1 Microcontroller, serial adaptor, power switch, and a barrel pin connector for the AC/DC Wall Mount Adaptor |
| Basic Stamp USB to Serial Adapter | Digi-Key | 28030-ND | An optional component to allow the BS1 serial adaptor to communicate through USB |
| Buchner Flask (Vacuum Flask) 250 mL | VWR | 10545-854 | |
| Clear Tape | 3M | S-9783 | |
| Clear Vinyl Tubing, 3/8" ID | Watts | 443064 | |
| EGM-2 Endothelial Cell Culture Medium | Lonza | CC-3162 | |
| Ethanol | Pharmco-Aaper | 111000200 | |
| Flow Regulator | Dwyer | VFA-23-BV | |
| Gas Chromatograph | Varian | 450-GC | |
| Glass Syringe, 10 mL | Sigma-Aldritch | Z314552 | |
| Glass Syringe, 10 µL | Hamilton | 80300 | |
| High Vacuum Silicon Grease | Dow Corning | 146355D | |
| Hose Clamp | Precision Brand | 35125 | |
| Human Umbilical Vein Endothelial Cells | ATCC | PCS-100-013 | |
| Mass Spectrometer | Varian | 300-MS | |
| Midget Impinger | Chemglass | CG-1820-01 | |
| Neutral Red | Sigma-Aldritch | N4638 | |
| Paraffin Film | 3M | PM-992 | |
| Plate Seal Roller | BioRad | MSR0001 | |
| Plate Seal; Foil | Thermo | 276014 | |
| Ring Stand 20" | American Educational Products | 7-G15-A | |
| Solenoid Valve (normally open) | US Solid | USS2-00081 | |
| Solid State Relay | Digi-Key | CLA279-ND | |
| Stand Clamp | Eisco | CH0688 | |
| Syringe Filter, PES, 0.22 um | Millipore | SLGP033RS | |
| Syringe, 10 mL | BD Syringe | 309604 | |
| Through Hole Stopper, Size 6 | VWR | 59581-287 | |
| Vacuum Pump | KNF Neuberger | N86KTP |
Referenzen
- World Health Organization. . WHO Report on the Global Tobacco Epidemic, 2011. , (2011).
- Weaver, S. R., Majeed, B. A., Pechacek, T. F., Nyman, A. L., Gregory, K. R., Eriksen, M. P. Use of electronic nicotine delivery systems and other tobacco products among USA adults, 2014: results from a national survey. Int. J. Public Health. 61 (2), 177-188 (2016).
- Singh, T., et al. Tobacco Use Among Middle and High School Students - United States, 2011–2015. MMWR Morb. Mortal. Wkly. Rep. 65 (14), 361-367 (2016).
- Corey, C. G., Ambrose, B. K., Apelberg, B. J., King, B. A. Flavored Tobacco Product Use Among Middle and High School Students--United States, 2014. MMWR Morb. Mortal. Wkly. Rep. 64 (38), 1066-1070 (2015).
- Pisinger, C., Døssing, M. A systematic review of health effects of electronic cigarettes. Prev. Med. 69, 248-260 (2014).
- Callahan-Lyon, P. Electronic cigarettes: human health effects. Tob. Control. 23 (Suppl 2), ii36-ii40 (2014).
- Dinakar, C., O'Connor, G. T. The Health Effects of Electronic Cigarettes. N. Engl. J. Med. 375 (14), 1372-1381 (2016).
- Anderson, C., Majeste, A., Hanus, J., Wang, S. E-cigarette aerosol exposure induces reactive oxygen species, DNA damage, and cell death in vascular endothelial cells. Toxicol. Sci. Off. J. Soc. Toxicol. , (2016).
- U.S. Department of Health and Human Services. . The Health Consequences of Smoking: 50 Years of Progress. A Report of the Surgeon General. , (2014).
- Farsalinos, K., et al. Comparison of the Cytotoxic Potential of Cigarette Smoke and Electronic Cigarette Vapour Extract on Cultured Myocardial Cells. Int. J. Environ. Res. Public. Health. 10 (10), 5146-5162 (2013).
- Schweitzer, K. S., et al. Endothelial disruptive proinflammatory effects of nicotine and e-cigarette vapor exposures. Am. J. Physiol. - Lung Cell. Mol. Physiol. 309 (2), L175-L187 (2015).
- Putzhammer, R., et al. Vapours of US and EU Market Leader Electronic Cigarette Brands and Liquids Are Cytotoxic for Human Vascular Endothelial Cells. PLOS ONE. 11 (6), e0157337 (2016).
- Crooks, I., Dillon, D. M., Scott, J. K., Ballantyne, M., Meredith, C. The effect of long term storage on tobacco smoke particulate matter in in vitro genotoxicity and cytotoxicity assays. Regul. Toxicol. Pharmacol. 65 (2), 196-200 (2013).
- Roemer, E., et al. Mainstream Smoke Chemistry and in Vitro and In Vivo Toxicity of the Reference Cigarettes 3R4F and 2R4F. Beitr. Zur Tab. Contrib. Tob. Res. 25 (1), (2014).
- International Organization for Standards. . ISO 3088:2012 Routine analytical cigarette smoking machine – Definitions and standard conditions. , (2012).
- World Health Organization. . Standard Operating Procedure for Intense Smoking of Cigarettes. , (2012).
- Brown, C. J., Cheng, J. M. Electronic cigarettes: product characterisation and design considerations. Tob. Control. 23 (Suppl 2), ii4-ii10 (2014).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 81 - Routine Analytical Machine for E-Cigarette Aerosol Generation and Collection - Definitions and Standard Conditions. , (2015).
- Thorne, D., Adamson, J. A review of in vitro cigarette smoke exposure systems. Exp. Toxicol. Pathol. 65 (7-8), 1183-1193 (2013).
- Klus, H., Boenke-Nimphius, B., Müller, L. Cigarette Mainstream Smoke: The Evolution of Methods and Devices for Generation, Exposure and Collection. Beitr. Zur Tab. Contrib. Tob. Res. 27 (4), (2016).
- Baker, R. The Development and Significance of Standards for Smoking-Machine Methodology. Beitr. Zur Tab. Contrib. Tob. Res. 20 (1), (2014).
- Thorne, D., Crooks, I., Hollings, M., Seymour, A., Meredith, C., Gaca, M. The mutagenic assessment of an electronic-cigarette and reference cigarette smoke using the Ames assay in strains TA98 and TA100. Mutat. Res. Toxicol. Environ. Mutagen. 812, 29-38 (2016).
- Thorne, D., Larard, S., Baxter, A., Meredith, C., Gaҫa, M. The comparative in vitro assessment of e-cigarette and cigarette smoke aerosols using the γH2AX assay and applied dose measurements. Toxicol. Lett. 265, 170-178 (2017).
- Herrington, J. S., Myers, C. Electronic cigarette solutions and resultant aerosol profiles. J. Chromatogr. A. 1418, 192-199 (2015).
- Yu, V., et al. Electronic cigarettes induce DNA strand breaks and cell death independently of nicotine in cell lines. Oral Oncol. 52, 58-65 (2016).
- Ji, E. H., et al. Characterization of Electronic Cigarette Aerosol and Its Induction of Oxidative Stress Response in Oral Keratinocytes. PLOS ONE. 11 (5), e0154447 (2016).
- Morgan, D. L., et al. Chemical Reactivity and Respiratory Toxicity of the -Diketone Flavoring Agents: 2,3-Butanedione, 2,3-Pentanedione, and 2,3-Hexanedione. Toxicol. Pathol. 44 (5), 763-783 (2016).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 84 - Determination of Glycerin, Propylene Glycol, Water, and Nicotine in the Aerosol of E-Cigarettes by Gas Chromatographic Analysis. , (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten