É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um microcontrolador operado dispositivo para a geração de extratos líquidos de aerossol de cigarro eletrônico e fumo cigarro convencional
Neste Artigo
Resumo
Aqui, descrevemos um aparelho de laboratório programáveis que pode ser usado para criar extratos de aerossol de cigarro eletrônico e fumaça de cigarro convencional. Este método fornece uma ferramenta útil para fazer comparações diretas entre cigarros convencionais e cigarros eletrônicos e é um ponto de entrada acessível para pesquisa de cigarro eletrônico.
Resumo
Cigarros eletrônicos são o produto de tabaco mais popular entre os estudantes do ensino médio e médio e o produto de tabaco alternativo mais popular entre os adultos. Alta qualidade, reprodutível pesquisas sobre as consequências do uso de cigarro eletrônico é essencial para compreensão emergentes preocupações de saúde pública e elaboração de provas com base política reguladora. Enquanto um número crescente de jornais discutem os cigarros eletrônicos, há pouca consistência nos métodos através de grupos e muito pouco consenso sobre os resultados. Aqui, descrevemos um aparelho de laboratório programáveis que pode ser usado para criar extratos de aerossol de cigarro eletrônico e fumaça de cigarro convencional. Este protocolo detalha instruções para a montagem e a operação do referido dispositivo e demonstra o uso do extrato gerado em dois aplicativos de exemplo: um em vitro ensaio da viabilidade celular e cromatografia gasosa-espectrometria de massa. Este método fornece uma ferramenta para fazer comparações diretas entre cigarros convencionais e cigarros eletrônicos e é um ponto de entrada acessível para pesquisa de cigarro eletrônico.
Introdução
Apesar de um esforço concentrado por organizações de saúde, uso do produto do tabaco continua a ser a principal causa de morte evitável em todo o mundo, com a maioria destas mortes atribuídas ao cigarro fumar1. Desde que entrou no mercado em 2003, os cigarros eletrônicos têm crescido em popularidade entre os usuários de produtos de tabaco. Atualmente, os cigarros eletrônicos são a alternativa mais popular de cigarros convencionais entre adultos americanos (~ 5%)2 e o mais popular sistema de entrega de nicotina entre médio (~ 5,3%) e estudantes do ensino médio (~ 16%)3. Se as tendências atuais continuarem, cigarros eletrônicos podem ser esperados para substituir cigarros convencionais para as gerações futuras. No entanto, as consequências do uso de cigarro eletrônico saúde permanecem obscuros.
Pesquisa sobre cigarros eletrônicos não começou a sério até cigarro eletrônico popularidade rapidamente aumentou em 20133,4. Desde aquela época, um número de diferentes modelos têm sido empregado para abordar a questão da sua toxicidade. No entanto, os resultados de muitos estudos são conflitantes, e enquanto parece que os cigarros eletrônicos são geralmente menos tóxicos do que cigarros convencionais, não há nenhum consenso atual sobre as consequências do cigarro eletrônico saúde usar5, 6 , 7. nossa pesquisa anterior indica que os cigarros eletrônicos são significativamente menos tóxicos para o endotélio vascular do que cigarros convencionais, apesar de sua capacidade de causar danos ao DNA e a indução da morte de stress e célula oxidativa8 . No entanto, mais pesquisa é necessária, antes podemos tirar conclusões firmes sobre as consequências para a saúde do uso de cigarro eletrônico.
Como os cigarros convencionais são das principais causas de doença vascular evitável9, há um crescente interesse no risco para a saúde vascular do cigarro eletrônico usar10,11,12. A fim de estudar os efeitos dos cigarros eletrônicos no sistema vascular, nosso laboratório desenvolveu um microcontrolador operado fumar/vaping dispositivo (Figura 1)8. Este dispositivo é capaz de gerar extratos líquidos de aerossol de cigarro eletrônico ou fumo qualquer cigarro convencional em solventes aquosos ou orgânicos. Como o fluxo de ar é controlado pela combinação de um regulador de fluxo de ar ajustável e um programa de sincronismo PBASIC, o dispositivo pode ser usado para gerar extratos de acordo com qualquer número de protocolos definidos pelo usuário. Aqui detalhamos a montagem e operação deste dispositivo, bem como duas aplicações potenciais: em vitro avaliação da viabilidade celular e cromatografia gasosa-espectrometria de massa.
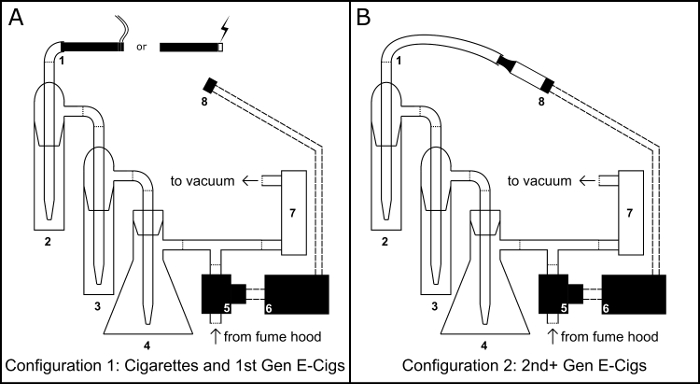
Figura 1: dispositivo de fumar/Vaping. Esquema para a montagem física do dispositivo fumar/vaping em tanto o cigarro como cigarro eletrônico (e-cig) configuração (A) e a configuração de cigarro eletrônico do tanque (B). Componente chave: 1) porto de inalação; 2) impactor coleção principal; 3) impactor de estouro; 4) armadilha vácuo do balão Buchner; 5) válvula solenoide normalmente aberto; 6) BS1 microcontrolador; 7) regulador de fluxo de ar; 8) 510 rosca base tanque de cigarro eletrônico. Clique aqui para ver uma versão maior desta figura.
Protocolo
1. montagem do dispositivo
- Fixe um 100 mL frasco de Buchner (Figura 1, #4) para um anel de aço ficar e criar uma armadilha vácuo enchendo-o com 50 g de cloreto de cálcio para servir como um dessecante. Feche o frasco com uma rolha do através de-furo de borracha, enrole a junção de rolha com película de parafina e executar uma pipeta através do orifício.
- Usando o tubo de vinil, conectar-se a pipeta, estendendo-se desde a rolha para um conector de mangueira t-interseção.
- Usando o tubo de vinil, ligue o impactor dois (Figura 1, #2 e #3) uns aos outros e a saída da segunda impactor ao conector de mangueira t-interseção.
- Usando o tubo de vinil, conecte a porta de entrada da primeira impinger para servir como uma porta de inalação (Figura 1, #1).
- Usando o tubo de vinil, conectar o lado do braço do recipiente de Buchner a porta de entrada de um regulador de fluxo de ar (Figura 1, #7) e a porta de saída do regulador de fluxo de ar para uma bomba de vácuo.
- Monte o circuito de acordo com o esquema na Figura 2A.
- Fazer o upload o PBASIC programa SVL.bs1 (Figura 2B, também disponível em https://github.com/ChastainAnderson/SVL) para o microcontrolador BS1 (Figura 1, #6) por meio de um adaptador serial e software do fabricante.
- Lugar a 510 rosca base (Figura 1 #8) em um anel stand braçadeira.
- Com tubo de vinil, ligue a válvula de solenoide (Figura 1, #5) a extremidade livre do conector de mangueira de interseção de t.
Nota: O dispositivo deve ser concluído e pronto para operação, verificar todas as juntas, para certificar-se que eles são ar apertado e aplicam abraçadeiras e graxa vácuo conforme necessário.
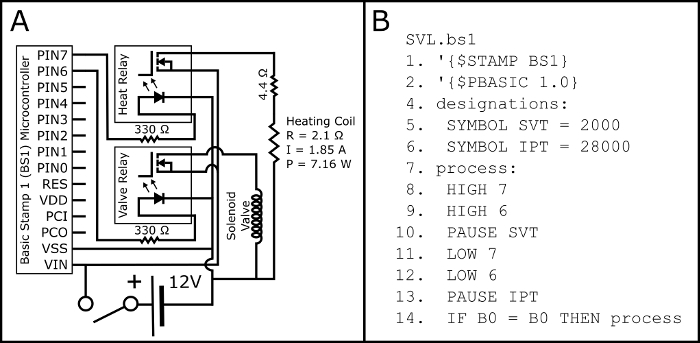
Figura 2: diagrama esquemático elétrico e PBASIC código. Figura 2A mostra o esquema elétrico para montar o circuito elétrico necessário activar ambos a válvula de solenoide normalmente aberta e a bobina de aquecimento de botão ativado cigarros eletrônicos (através de 510 rosca eletrônica cigarro tanque base). Os parâmetros elétricos da bobina do aquecimento (p: potência; R: resistência; e i: corrente) são projetadas e deve ser verificada empiricamente com um multímetro post assembly. Figura 2B exibe o programa de sincronismo PBASIC necessário para controlar o circuito na Figura 2A (também disponível em https://github.com/ChastainAnderson/SVL). As constantes de tempo SVT & IPT (#5 e #6) estão em unidades de ms e são definidas para fornecer um tempo de ativação de 2 segundos e um tempo de inatividade de 28 s. , por favor clique aqui para ver uma versão maior desta figura.
2. armazenamento e preparação da amostra
- Armazene todas as amostras do cigarro convencional e eletrônico fechado às escuras em sacos de plástico herméticos em temperatura ambiente.
- Uma vez aberto, armazene as amostras em sacos de plástico herméticos a 4 ° c, com um papel toalha para absorver o excesso de umidade.
- Pre-equilibrar todas as amostras em um humidor de temperatura no ~ 60% de umidade pelo menos 30 minutos antes de usar.
3. general operação do dispositivo de aspiração de aerossol de cigarro eletrônico/fumo cigarro
- Determine a massa de cada cigarro pre-vaping cartomizer/tanque usando uma balança analítica. A diferença de peso vaping pre/post post será usada para determinar a dosagem apropriada.
Nota: 3R4F cigarros de referência são assumidos como para conter 0,7 mg de nicotina, e o teor de nicotina de marcas de cigarros comerciais pode ser determinado por métodos analíticos convencionais13. - Aplicativo de exemplo 1, encha o reservatório do impactor primário com 4,3 mL de meio de cultura de células endoteliais. Aplicativo de exemplo 2, encha o reservatório com 5 mL de acetona.
-
Prepare o cigarro eletrônico ou cigarro convencional para extração:
- Se usar um cigarro convencional, aplique um pedaço de fita transparente em torno do filtro e colocar uma marca facilmente visível onde o papel de cigarro junta-se o filtro.
- Se usando um cigarro como cigarro, verifique se a bateria está bem carregada e o cartomizer firmemente parafusado à bateria.
- Se usando um tanque do cigarro eletrônico, certifique-se que um volume adequado de líquido cigarro eletrônico é carregado no tanque e Dane-se o tanque na base rosqueada 510.
- Insira a ponta do cigarro eletrônico ou convencional na porta de inalação (Figura 1, #1) e prenda com um grampo.
- Ligue a bomba de vácuo.
- Ajuste o medidor de vazão para puxar 1,65 L/minuto para garantir uma baforada de 55 mL mais de 2 segundos.
- Ligue o microcontrolador. Se usando um cigarro convencional, acenda o cigarro sobre a primeira tragada.
- Executar até projetada desejada concentração (em partes por milhão ou % peso/volume) é alcançado.
-
Determine a massa de cada cigarro cartomizer/tanque após vaporização usando uma balança analítica. Compare essa medida para a medida tomada em passo 3.1 para determinar o total consumido em massa. Calcule a concentração de massa/volume consumido de solvente. Use a concentração molar de nicotina consumida para normalizar entre produtos.
- Se uma massa insuficiente foi consumida, retornar o cigarro eletrônico para o dispositivo e consumir mais.
- Se uma massa suficiente ou excesso foi consumida, prossiga.
4. filtração e armazenamento
- Se o extrato vai ser utilizada para cultura celular, filtre com um filtro de seringa PES de 0,22 µm.
- Usar os extratos imediatamente ou armazenar a-80 ° c. Como parte da preparação para Anderson, et al 8, aerossol de cigarro eletrônico foi demonstrado ser estável pelo menos duas semanas, e a estabilidade do cigarro por até dois anos foi estabelecida por bandidos, et al 13.
5. limpeza do dispositivo
- Após cada extracção, enxágue a tubulação e reservatórios do dispositivo com 70% de etanol e água deionizada para evitar transportam entre as amostras.
- Após enxaguar, brevemente, executar o dispositivo vazio para permitir o fluxo de ar auxiliar a secagem das linhas.
6. exemplo de aplicação 1: Captação de vermelho neutro ensaio de viabilidade de células
- Execute o extrato como acima em 4,3 mL de meio de cultura de células endoteliais.
- Um dia antes, propagar as células endoteliais da veia umbilical humana em 96 placas bem em uma densidade de 1 x 104 células/wellin 100 µ l de meio de cultura de células endoteliais.
- Tratar as células, substituindo o velho meio de cultura de célula endotelial com qualquer 100 µ l de meio de cultura fresco endothelial da pilha para servir como um controle ou 75 µ l do meio de crescimento de células endoteliais misturado com 25 µ l de um extrato de concentração de nicotina consumida de 2mm (1,4 mg consumido nicotina em meio de cultura de células endoteliais de 4,3 mL) para uma concentração final de 500 µM para servir como tratamento.
- Como muitos dos componentes de ambos aerossol de cigarro eletrônico e fumaça de cigarro são voláteis, use um selo de alumínio para manter os poços hermético.
- Incubar a placa de 18 – 24 h a 37 ° C e 5% de CO2.
-
Prepare o vermelho neutro solução de coloração:
- Crie 100 x vermelho estoque solução neutra dissolvendo 33 mg de corante vermelho neutro em 10 mL de solução salina tamponada.
- Pouco antes de usar, dilua 100 x solução 1: 100 em meio de cultura celular para criar 1 x vermelho neutro solução de coloração.
- Incube vermelho neutro, manchando a 37 ° C durante pelo menos 30 min antes da utilização e uso imediato.
Nota: É normal que alguns cristais que precipitam durante a incubação. Deve ter cuidado para evitar a aplicação destes cristais nos poços de cultura de células. Se necessário, um calibre 22 µm filtro pode ser usado para filtrar o caldo vermelho neutro e soluções de coloração.
- Extrato de remover e adicionar 100 µ l de vermelho neutro, manchando a solução por bem, excesso de uso para criar pelo menos três poços em branco para a quantificação adequada.
- Incube a placa a 2 – 4 h a 37 ° C e 5% de CO2.
- Remover o vermelho neutro, manchando a solução e lavar 3x por submersão em PBS.
- Aplicar o vermelho neutro de manchar a solução (50% desionisada água, etanol de 49%, 1% de ácido acético).
- Incube a pelo menos 10 min à temperatura ambiente com agitação.
- Ler a absorbância a 540 nm.
- Analise dados por subtraindo o valor médio dos poços em branco e normalizar a média do valor bem controle ajustado em branco.
7. exemplo de aplicação 2: cromatografia em fase gasosa espectrometria de massa
- Realize a extração como acima em 5 mL de acetona.
- Executar o dispositivo para obter uma concentração final de ~ 100 partes por milhão (peso do e-líquido consumido/volume de acetona) de sua amostra.
- Utilizando uma seringa de vidro de precisão, Injete 1 µ l do injector de um dispositivo de GC-MS. Injetar a 250 ° C, com um 01:20 dividir a relação em um sistema de espectrômetro de cromatógrafo a gás acoplado/quadrupolo equipado com uma coluna de ZB-5 com o seguinte protocolo de forno: 1 min a 50 ° C; rampa de 10 ° C/min até 140 ° C; rampa de 20 ° C/min até 300 ° C e mantenha durante 10 min.
- Coincidir com os espectros de massa resultantes para biblioteca de destino para identificar componentes de aerossol.
Resultados
24 horas depois da exposição da veia umbilical humana células endoteliais para extrato de fumaça de cigarro convencional (CSE) ou aerossol de cigarro eletrônico extrato (EAE), há uma significativa (controle vs CSE P < 0,001; controle vs EAE P < 0,01; n = 6) redução da viabilidade celular (Figura 3A). Extratos foram gerados com um perfil de sopro de 2, 2 segundos, sopros de 55 mL por minuto e normalizada com base na concentração mol...
Discussão
Os elementos mais críticos do presente protocolo são assegurar que o dispositivo é limpo no início e fim de cada extração, e garantindo que todos os selos são mantidos assim que o fluxo de ar permanece consistente. Se o dispositivo não é devidamente limpos, há um risco de transportar sobre entre amostras. Além disso, se o dispositivo é deixado impuro por um período prolongado de aerosol condensado tempo e secas solvente pode bloquear o sistema. Nota que é normal para lá para ser uma queda de pressão quand...
Divulgações
O programa de bolsa de pesquisa do tabaco produto regulamentar ciência administrado pela Universidade de Tulane é financiado pelos assuntos regulatórios da Altria cliente serviços.
Agradecimentos
Os autores reconhecem a ajuda do Dr. Robert Dotson da Tulane University departamento de célula e Biologia Molecular, por sua assistência em editar o manuscrito e Dr. James Bollinger de Tulane University departamento de química por sua assistência com projeto de protocolo de espectrometria de massa. Os autores mais reconhecem a Tulane University departamento de célula e Biologia Molecular e Tulane University departamento de química por seu apoio e o uso do espaço e equipamento. Este trabalho foi financiado por uma bolsa de pesquisa do tabaco produto regulamentar ciência para C. Anderson, da escola da Universidade de Tulane da ciência e engenharia.
Materiais
| Name | Company | Catalog Number | Comments |
| 12 V AC/DC Wall Mount Adaptor | Digi-Key | T1099-P5P-ND | |
| 2.2 Ohm Resistors | Digi-Key | A105635-ND | Used in tandem to generate the 4.4 Ohm resistance in Figure 2A |
| 330 Ohm Resistors | Digi-Key | 330QBK-ND | |
| 510 Threaded Base | NJoy | N/A | Recovered by dismantalling a second generation NJoy electronic cigarette |
| Acetic Acid, Glacial | Sigma-Aldritch | A6283 | |
| Acetone (Chromatography Grade) | Sigma-Aldritch | 34850 | |
| Basic Stamp Project Board | Digi-Key | 27112-ND | This board contains the BS1 Microcontroller, serial adaptor, power switch, and a barrel pin connector for the AC/DC Wall Mount Adaptor |
| Basic Stamp USB to Serial Adapter | Digi-Key | 28030-ND | An optional component to allow the BS1 serial adaptor to communicate through USB |
| Buchner Flask (Vacuum Flask) 250 mL | VWR | 10545-854 | |
| Clear Tape | 3M | S-9783 | |
| Clear Vinyl Tubing, 3/8" ID | Watts | 443064 | |
| EGM-2 Endothelial Cell Culture Medium | Lonza | CC-3162 | |
| Ethanol | Pharmco-Aaper | 111000200 | |
| Flow Regulator | Dwyer | VFA-23-BV | |
| Gas Chromatograph | Varian | 450-GC | |
| Glass Syringe, 10 mL | Sigma-Aldritch | Z314552 | |
| Glass Syringe, 10 µL | Hamilton | 80300 | |
| High Vacuum Silicon Grease | Dow Corning | 146355D | |
| Hose Clamp | Precision Brand | 35125 | |
| Human Umbilical Vein Endothelial Cells | ATCC | PCS-100-013 | |
| Mass Spectrometer | Varian | 300-MS | |
| Midget Impinger | Chemglass | CG-1820-01 | |
| Neutral Red | Sigma-Aldritch | N4638 | |
| Paraffin Film | 3M | PM-992 | |
| Plate Seal Roller | BioRad | MSR0001 | |
| Plate Seal; Foil | Thermo | 276014 | |
| Ring Stand 20" | American Educational Products | 7-G15-A | |
| Solenoid Valve (normally open) | US Solid | USS2-00081 | |
| Solid State Relay | Digi-Key | CLA279-ND | |
| Stand Clamp | Eisco | CH0688 | |
| Syringe Filter, PES, 0.22 um | Millipore | SLGP033RS | |
| Syringe, 10 mL | BD Syringe | 309604 | |
| Through Hole Stopper, Size 6 | VWR | 59581-287 | |
| Vacuum Pump | KNF Neuberger | N86KTP |
Referências
- World Health Organization. . WHO Report on the Global Tobacco Epidemic, 2011. , (2011).
- Weaver, S. R., Majeed, B. A., Pechacek, T. F., Nyman, A. L., Gregory, K. R., Eriksen, M. P. Use of electronic nicotine delivery systems and other tobacco products among USA adults, 2014: results from a national survey. Int. J. Public Health. 61 (2), 177-188 (2016).
- Singh, T., et al. Tobacco Use Among Middle and High School Students - United States, 2011–2015. MMWR Morb. Mortal. Wkly. Rep. 65 (14), 361-367 (2016).
- Corey, C. G., Ambrose, B. K., Apelberg, B. J., King, B. A. Flavored Tobacco Product Use Among Middle and High School Students--United States, 2014. MMWR Morb. Mortal. Wkly. Rep. 64 (38), 1066-1070 (2015).
- Pisinger, C., Døssing, M. A systematic review of health effects of electronic cigarettes. Prev. Med. 69, 248-260 (2014).
- Callahan-Lyon, P. Electronic cigarettes: human health effects. Tob. Control. 23 (Suppl 2), ii36-ii40 (2014).
- Dinakar, C., O'Connor, G. T. The Health Effects of Electronic Cigarettes. N. Engl. J. Med. 375 (14), 1372-1381 (2016).
- Anderson, C., Majeste, A., Hanus, J., Wang, S. E-cigarette aerosol exposure induces reactive oxygen species, DNA damage, and cell death in vascular endothelial cells. Toxicol. Sci. Off. J. Soc. Toxicol. , (2016).
- U.S. Department of Health and Human Services. . The Health Consequences of Smoking: 50 Years of Progress. A Report of the Surgeon General. , (2014).
- Farsalinos, K., et al. Comparison of the Cytotoxic Potential of Cigarette Smoke and Electronic Cigarette Vapour Extract on Cultured Myocardial Cells. Int. J. Environ. Res. Public. Health. 10 (10), 5146-5162 (2013).
- Schweitzer, K. S., et al. Endothelial disruptive proinflammatory effects of nicotine and e-cigarette vapor exposures. Am. J. Physiol. - Lung Cell. Mol. Physiol. 309 (2), L175-L187 (2015).
- Putzhammer, R., et al. Vapours of US and EU Market Leader Electronic Cigarette Brands and Liquids Are Cytotoxic for Human Vascular Endothelial Cells. PLOS ONE. 11 (6), e0157337 (2016).
- Crooks, I., Dillon, D. M., Scott, J. K., Ballantyne, M., Meredith, C. The effect of long term storage on tobacco smoke particulate matter in in vitro genotoxicity and cytotoxicity assays. Regul. Toxicol. Pharmacol. 65 (2), 196-200 (2013).
- Roemer, E., et al. Mainstream Smoke Chemistry and in Vitro and In Vivo Toxicity of the Reference Cigarettes 3R4F and 2R4F. Beitr. Zur Tab. Contrib. Tob. Res. 25 (1), (2014).
- International Organization for Standards. . ISO 3088:2012 Routine analytical cigarette smoking machine – Definitions and standard conditions. , (2012).
- World Health Organization. . Standard Operating Procedure for Intense Smoking of Cigarettes. , (2012).
- Brown, C. J., Cheng, J. M. Electronic cigarettes: product characterisation and design considerations. Tob. Control. 23 (Suppl 2), ii4-ii10 (2014).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 81 - Routine Analytical Machine for E-Cigarette Aerosol Generation and Collection - Definitions and Standard Conditions. , (2015).
- Thorne, D., Adamson, J. A review of in vitro cigarette smoke exposure systems. Exp. Toxicol. Pathol. 65 (7-8), 1183-1193 (2013).
- Klus, H., Boenke-Nimphius, B., Müller, L. Cigarette Mainstream Smoke: The Evolution of Methods and Devices for Generation, Exposure and Collection. Beitr. Zur Tab. Contrib. Tob. Res. 27 (4), (2016).
- Baker, R. The Development and Significance of Standards for Smoking-Machine Methodology. Beitr. Zur Tab. Contrib. Tob. Res. 20 (1), (2014).
- Thorne, D., Crooks, I., Hollings, M., Seymour, A., Meredith, C., Gaca, M. The mutagenic assessment of an electronic-cigarette and reference cigarette smoke using the Ames assay in strains TA98 and TA100. Mutat. Res. Toxicol. Environ. Mutagen. 812, 29-38 (2016).
- Thorne, D., Larard, S., Baxter, A., Meredith, C., Gaҫa, M. The comparative in vitro assessment of e-cigarette and cigarette smoke aerosols using the γH2AX assay and applied dose measurements. Toxicol. Lett. 265, 170-178 (2017).
- Herrington, J. S., Myers, C. Electronic cigarette solutions and resultant aerosol profiles. J. Chromatogr. A. 1418, 192-199 (2015).
- Yu, V., et al. Electronic cigarettes induce DNA strand breaks and cell death independently of nicotine in cell lines. Oral Oncol. 52, 58-65 (2016).
- Ji, E. H., et al. Characterization of Electronic Cigarette Aerosol and Its Induction of Oxidative Stress Response in Oral Keratinocytes. PLOS ONE. 11 (5), e0154447 (2016).
- Morgan, D. L., et al. Chemical Reactivity and Respiratory Toxicity of the -Diketone Flavoring Agents: 2,3-Butanedione, 2,3-Pentanedione, and 2,3-Hexanedione. Toxicol. Pathol. 44 (5), 763-783 (2016).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 84 - Determination of Glycerin, Propylene Glycol, Water, and Nicotine in the Aerosol of E-Cigarettes by Gas Chromatographic Analysis. , (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados