È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un microcontrollore azionato il dispositivo per la generazione di estratti liquidi da Aerosol elettronico e fumo di sigaretta sigaretta convenzionale
In questo articolo
Riepilogo
Qui, descriviamo un dispositivo di laboratorio programmabile che può essere utilizzato per creare estratti di aerosol di sigaretta elettronica e fumo di sigaretta convenzionale. Questo metodo fornisce un utile strumento per effettuare confronti diretti tra sigarette convenzionali e sigarette elettroniche ed è un punto di ingresso accessibile in ricerca di sigaretta elettronica.
Abstract
Sigarette elettroniche sono il prodotto più popolare di tabacco tra medie e liceali e sono il prodotto di tabacco alternativi più popolare tra gli adulti. Alta qualità, ricerca riproducibile sulle conseguenze dell'uso della sigaretta elettronica è essenziale per la comprensione emergenti preoccupazioni di sanità pubblica e la lavorazione di prova basato su politica di regolamentazione. Mentre un numero crescente di documenti discutere sigarette elettroniche, c'è poca coerenza nei metodi attraverso gruppi e molto poco consenso sui risultati. Qui, descriviamo un dispositivo di laboratorio programmabile che può essere utilizzato per creare estratti di aerosol di sigaretta elettronica e fumo di sigaretta convenzionale. Questo protocollo dettagli istruzioni per il montaggio e il funzionamento di detto dispositivo e viene illustrato l'utilizzo dell'Estratto generato in due applicazioni di esempio: un'analisi di attuabilità in vitro delle cellule e la gas-cromatografia spettrometria di massa. Questo metodo fornisce uno strumento per effettuare confronti diretti tra sigarette convenzionali e sigarette elettroniche ed è un punto di ingresso accessibile in ricerca di sigaretta elettronica.
Introduzione
Nonostante uno sforzo concentrato dalle organizzazioni di salute, l'uso del tabacco prodotto rimane la principale causa di morte prevenibile in tutto il mondo, con la maggior parte di questi decessi attribuiti a sigaretta fumatori1. Da quando è entrata sul mercato nel 2003, sigarette elettroniche stanno crescendo in popolarità tra gli utenti dei prodotti del tabacco. Attualmente, le sigarette elettroniche sono l'alternativa più popolare di sigarette convenzionali tra adulti americani (~ 5%)2 e il sistema di consegna di nicotina più popolare tra medio (~ 5,3%) e liceali (~ 16%)3. Se le tendenze attuali continuano, sigarette elettroniche possono essere previsto per sostituire sigarette convenzionali per le generazioni future. Tuttavia, le conseguenze sulla salute dell'uso della sigaretta elettronica rimangono poco chiare.
Ricerca sulle sigarette elettroniche non è stato avviato sul serio fino a quando la sigaretta elettronica popolarità è aumentato rapidamente nel 20133,4. Da quel momento, un numero di modelli differenti è stato impiegato per affrontare la questione della loro tossicità. Tuttavia, i risultati di molti studi sono contrastanti, e mentre sembra che le sigarette elettroniche sono generalmente meno tossiche rispetto alle sigarette convenzionali non c'è nessun consenso corrente relativo alle conseguenze di salute della sigaretta elettronica utilizza5, 6 , 7. la nostra ricerca precedente indica che le sigarette elettroniche sono significativamente meno tossiche per l'endotelio vascolare rispetto alle sigarette convenzionali, nonostante la loro capacità di causare danni al DNA e l'induzione della morte delle cellule e lo stress ossidativa8 . Tuttavia, più ricerca è necessaria prima che possiamo trarre conclusioni definitive circa le conseguenze sulla salute dell'uso della sigaretta elettronica.
Come le sigarette convenzionali sono delle cause principali di malattia vascolare prevenibile9, c'è un crescente interesse per il rischio di salute vascolare della sigaretta elettronica utilizza10,11,12. Al fine di studiare gli effetti delle sigarette elettroniche sul sistema vascolare, il nostro laboratorio ha sviluppato un microcontrollore operati fumatori/vaping dispositivo (Figura 1)8. Questo dispositivo è in grado di generare gli estratti liquidi di entrambi aerosol di fumo o elettronica sigaretta sigaretta convenzionale in solventi o acquose o organiche. Come flusso d'aria è controllato tramite la combinazione di un regolatore di flusso aria regolabile e un programma di temporizzazione PBASIC, il dispositivo può essere utilizzato per generare estratti secondo qualsiasi numero di protocolli definiti dall'utente. Qui dettagliamo il montaggio e il funzionamento di questo dispositivo, come pure due potenziali applicazioni: in vitro valutazione della vitalità cellulare e gas-cromatografia-spettrometria di massa.
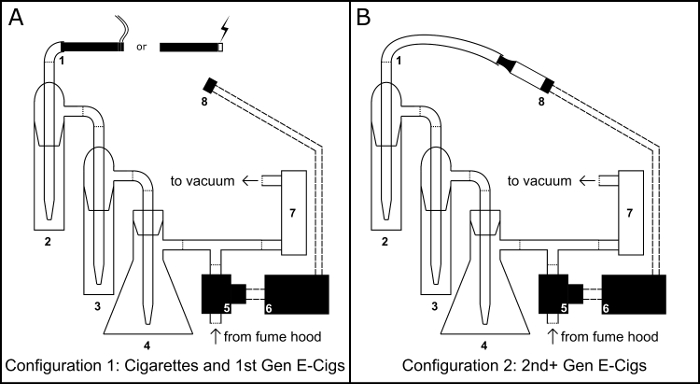
Figura 1: dispositivo di fumatori/Vaping. Schema per il montaggio fisico del dispositivo fumatori/vaping sia la sigaretta come sigaretta elettronica (e-cig) configurazione (A) e la configurazione di sigaretta elettronica del serbatoio (B). Componente chiave: 1) porta di inalazione; 2) gorgogliatore insieme primario; 3) gorgogliatore overflow; 4) trappola per vuoto pallone Buchner; 5) elettrovalvola normalmente aperto; 6) BS1 microcontrollore; 7) regolatore di flusso aria; 8) 510 filettato serbatoio sigaretta elettronica base. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
1. montaggio del dispositivo
- Fissare un 100ml Buchner boccetta (Figura 1, #4) ad un anello in acciaio stand e creare una trappola vuoto riempiendolo con 50 g di cloruro di calcio per servire come diseccante. Tappare con un tappo di gomma attraverso-foro, avvolgere la giunzione di tappo con film di paraffina ed eseguire una pipetta attraverso il foro.
- Utilizzando la tubazione del vinile, collegare la pipetta che si estende dal tappo a un connettore del tubo flessibile di intersezione a t.
- Utilizzando la tubazione del vinile, collegare tra loro i due gorgogliatore (Figura 1, #2 e #3) e collegare l'uscita del gorgogliatore secondo per il connettore del tubo t-intersezione.
- Utilizzando la tubazione del vinile, collegare la porta di ingresso del gorgogliatore prima di servire come una porta di inalazione (Figura 1, #1).
- Tubazione del vinile, collegare il braccio laterale del pallone Buchner alla porta di ingresso di un regolatore di flusso d'aria (Figura 1, #7) e la porta di uscita del regolatore del flusso d'aria per una pompa a vuoto.
- Assemblare il circuito secondo lo schema in Figura 2A.
- Caricare il programma PBASIC SVL.bs1 (Figura 2B, disponibile anche presso https://github.com/ChastainAnderson/SVL) al microcontrollore BS1 (Figura 1, #6) per mezzo di un adattatore seriale e il software del produttore.
- Posto il 510 base filettata (Figura 1 #8) in un anello stand morsetto.
- Utilizzando la tubazione del vinile, collegare l'elettrovalvola (Figura 1, #5) all'estremità libera del connettore del tubo flessibile di intersezione a t.
Nota: Il dispositivo dovrebbe essere completo e pronto per il funzionamento, controllare tutti i giunti per assicurarsi che sono tenuta d'aria e applicare fascette e grasso per vuoto come necessario.
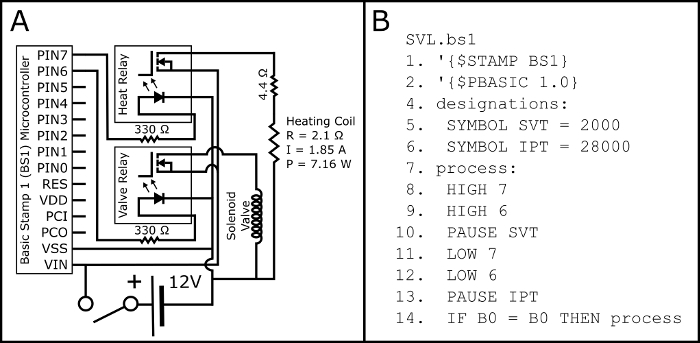
Figura 2: schema elettrico e il codice PBASIC. Figura 2A Mostra lo schema elettrico per il montaggio del circuito elettrico necessario attivare sia la valvola solenoide normalmente aperta e la serpentina di riscaldamento di pulsante attivato sigarette elettroniche (attraverso il 510 filettato elettronico carro armato della sigaretta base). I parametri elettrici della bobina di riscaldamento (p: potenza; R: resistenza; e I: corrente) sono proiettati e dovrebbe essere verificata empiricamente con un multimetro post montaggio. Figura 2B Visualizza il programma di temporizzazione PBASIC necessario per controllare il circuito in Figura 2A (anche disponibile a https://github.com/ChastainAnderson/SVL). Le costanti di temporizzazione SVT & IPT (#5 e #6) sono espressi in unità di ms e sono impostate per fornire un tempo di attivazione di 2 secondi e un tempo di inattività di 28 s. Clicca qui per visualizzare una versione più grande di questa figura.
2. conservazione e preparazione del campione
- Conservare tutti i campioni di sigarette convenzionali ed elettronici non aperto al buio in sacchetti di plastica chiusi ermeticamente, a temperatura ambiente.
- Una volta aperto, conservare i campioni in sacchetti di plastica chiusi ermeticamente a 4 ° c, con un tovagliolo di carta per assorbire l'umidità in eccesso.
- Pre-equilibrare tutti i campioni in un humidor di temperatura ambiente a ~ 60% di umidità per almeno 30 minuti prima dell'uso.
3. generale funzionamento del dispositivo di estrazione di sigaretta sigaretta fumo/elettronica Aerosol
- Determinare la massa di ogni e-sigaretta cartomizer/serbatoio pre-vaping utilizzando una bilancia analitica. La differenza di peso di pre/post post vaping utilizzerà per determinare il dosaggio appropriato.
Nota: le sigarette di riferimento di 3R4F si suppone per contenere 0,7 mg di nicotina, e il contenuto di nicotina delle marche di sigarette commerciali può essere determinato da metodi analitici convenzionali13. - Per applicazione di esempio 1, riempire il serbatoio del gorgogliatore primario con 4,3 mL di terreno di coltura delle cellule endoteliali. Per applicazione di esempio 2, riempire il serbatoio con 5 mL di acetone.
-
Preparare la sigaretta elettronica o sigaretta convenzionale per l'estrazione:
- Se si utilizza una sigaretta convenzionale, applicare un pezzo di nastro adesivo trasparente intorno al filtro e mettere un segno facilmente visibile dove la carta delle sigarette si unisce il filtro.
- Se si utilizza una sigaretta come e-sigaretta, assicurarsi che la batteria sia ben carica e il cartomizer avvitato alla batteria.
- Se si utilizza un serbatoio di sigaretta elettronica, assicurarsi che un volume adeguato di liquido sigaretta elettronica viene caricato nel serbatoio e avvitare il serbatoio sulla base filettata 510.
- Inserire la punta della sigaretta convenzionale o elettronico nella porta di inalazione (Figura 1, #1) e fissarlo con una fascetta stringitubo.
- Accendere la pompa del vuoto.
- Regolare il misuratore di portata per tirare 1,65 L/minuto per garantire un soffio di 55 mL per 2 secondi.
- Accendere il microcontrollore. Se si utilizza una sigaretta convenzionale, accendere la sigaretta sulla prima boccata.
- Esegui fino a quando proiettato desiderata concentrazione (in parti per milione o % peso/volume) è raggiunto.
-
Determinare la massa di ogni e-sigaretta cartomizer/tank dopo vaporizzazione utilizzando una bilancia analitica. Confrontare questa misura alla misura presa nel passaggio 3.1 per determinare il totale massa consumato. Calcolare la concentrazione del consumato massa/volume di solvente. Utilizzare la concentrazione molare di nicotina consumata per normalizzare tra prodotti.
- Se una massa insufficiente è stata consumata, restituire la sigaretta elettronica al dispositivo e consumano ulteriormente.
- Se una massa sufficiente o in eccesso è stata consumata, procedere.
4. filtrazione e stoccaggio
- Se l'estratto è da utilizzarsi per la coltura cellulare, filtrare attraverso un filtro per siringa PES da 0,22 µm.
- Utilizzare gli estratti immediatamente o conservare a-80 ° c. Come parte della preparazione per Anderson, et al. 8, aerosol sigaretta elettronica è stato dimostrato di essere stabile per almeno due settimane, e la stabilità della sigaretta fumo fino a due anni è stata stabilita da truffatori, et al. 13.
5. pulizia del dispositivo
- Dopo ogni estrazione, sciacquare i tubi e serbatoi del dispositivo con etanolo al 70% ed acqua deionizzata per impedire riporto tra i campioni.
- Dopo il risciacquo, brevemente eseguire il dispositivo vuoto per consentire il flusso d'aria aiutare l'asciugatura delle linee.
6. applicazione esempio 1: Assorbimento rosso neutro analisi di attuabilità delle cellule
- Eseguire l'estratto come sopra in 4,3 mL di medium di crescita delle cellule endoteliali.
- Un giorno prima, semi di cellule endoteliali di vena ombelicale umana in 96 pozzetti ad una densità di 1 x 104 cellule/wellin 100 µ l di terreno di coltura delle cellule endoteliali.
- Trattare le cellule sostituendo il vecchio terreno di coltura delle cellule endoteliali con entrambi 100 µ l di terreno di coltura fresco delle cellule endoteliali per servire come un controllo o 75 µ l di terreno di crescita delle cellule endoteliali mescolato con 25 µ l di un Estratto di concentrazione di nicotina 2mm consumato (1,4 mg consumato nicotina nel mezzo di crescita delle cellule endoteliali 4,3 mL) per una concentrazione finale di 500 µM per servire come trattamento.
- Come molti dei componenti di entrambi aerosol di sigaretta elettronica e fumo di sigaretta sono volatili, è possibile utilizzare un foglio di sigillatura per mantenere i pozzetti ermetico.
- Incubare la piastra 18 – 24 h a 37 ° C e 5% CO2.
-
Preparare la soluzione di colorazione di rosso neutro:
- Creare una soluzione stock rosso neutro 100 x sciogliendo 33 mg di colorante rosso neutro in 10 mL di soluzione salina tamponata.
- Poco prima dell'uso, diluire 100 x 1: 100 di soluzione madre in mezzo di coltura cellulare per creare 1 x rosso neutro, soluzione di colorazione.
- Incubare il rosso neutro macchiatura soluzione a 37 ° C per almeno 30 min prima dell'uso e utilizzare immediatamente.
Nota: È normale che alcuni cristalli di precipitare durante l'incubazione. Prestare la massima attenzione per evitare di applicare questi cristalli per i pozzi di cultura cellulare. Se necessario, un filtro,22 µm utilizzabile per filtrare il brodo di rosso neutro e soluzioni di colorazione.
- Rimuovere l'estratto e aggiungere 100 µ l di soluzione per bene, uso in eccesso per creare almeno tre pozzi in bianco per la corretta quantificazione di colorazione di rosso neutro.
- Incubare la piastra a 2 – 4 h a 37 ° C e 5% CO2.
- Rosso neutro, soluzione di macchiatura di rimuovere e lavare 3x da immersione in PBS.
- Applicare rosso neutro de-macchia soluzione (acqua deionizzato il 50%, 49% etanolo, acido acetico 1%).
- Incubare per almeno 10 minuti a temperatura ambiente con agitazione.
- Leggere l'assorbanza a 540 nm.
- Analizzare dati sottraendo il valore medio dei pozzetti bianchi e normalizzante per la media del valore vuoto controllo regolato bene.
7. esempio di applicazione 2: Gas cromatografia spettrometria di massa
- Eseguire l'estrazione come sopra in 5 mL di acetone.
- Eseguire il dispositivo per ottenere una concentrazione finale di ~ 100 parti per milione (peso del liquido consumato/volume di acetone) del vostro campione.
- Utilizzando una siringa di vetro di precisione, iniettare 1 µ l nell'iniettore di un dispositivo di GC-MS. Iniettare a 250 ° C con un 01:20 diviso il rapporto in un sistema di spettrometro gascromatografo accoppiato/quadrupolo equipaggiato con una colonna di ZB-5 con il seguente protocollo di forno: 1 min a 50 ° C; rampa di 10 ° C/min fino a 140 ° C; rampa di 20 ° C/min fino a 300 ° C e tenere premuto per 10 min.
- Una partita di spettri di massa risultanti alla libreria di destinazione per identificare i componenti di aerosol.
Risultati
Entro 24 ore dell'esposizione della vena ombelicale umana le cellule endoteliali a Estratto di fumo di sigaretta convenzionale (CSE) o aerosol sigaretta elettronica estrarre (EAE), vi è una significativa (controllo vs CSE P < 0,001; controllo vs EAE P < 0.01; n = 6) riduzione nell'attuabilità delle cellule (Figura 3A). Gli estratti sono stati generati con un profilo puffing di 2, 2 secondi, soffi di 55 mL al minuto e normalizzato basato su...
Discussione
Elementi più critici del presente protocollo sono garantendo che il dispositivo è pulito all'inizio e fine di ogni estrazione, e garantendo che tutte le guarnizioni sono mantenute così che il flusso di aria rimane coerenza. Se il dispositivo non è adeguatamente pulito, c'è un rischio di carry over tra i campioni. Inoltre, se il dispositivo viene lasciato sporco per un lungo periodo di aerosol condensato tempo ed asciugato solvente può bloccare il sistema. Nota che è normale per lì per essere una caduta di pressio...
Divulgazioni
Il programma di tabacco prodotto normativo Science Research Fellowship amministrato dalla Tulane University è finanziato da Altria Client Services Regulatory Affairs.
Riconoscimenti
Gli autori riconoscono l'assistenza del Dr. Robert Dotson della Tulane University Dipartimento di cellula e biologia molecolare per la sua assistenza nella redazione del manoscritto e Dr. James Bollinger Tulane University Dipartimento di chimica per la sua assistenza con il progetto di protocollo di spettrometria di massa. Gli autori inoltre riconoscono la Tulane University Dipartimento di cellula e biologia molecolare e il dipartimento di chimica dell'Università di Tulane per il supporto e l'uso dello spazio e attrezzature. Questo lavoro è stato supportato da un tabacco prodotto normativo Science Research Fellowship a C. Anderson dalla Tulane University School of Science e ingegneria.
Materiali
| Name | Company | Catalog Number | Comments |
| 12 V AC/DC Wall Mount Adaptor | Digi-Key | T1099-P5P-ND | |
| 2.2 Ohm Resistors | Digi-Key | A105635-ND | Used in tandem to generate the 4.4 Ohm resistance in Figure 2A |
| 330 Ohm Resistors | Digi-Key | 330QBK-ND | |
| 510 Threaded Base | NJoy | N/A | Recovered by dismantalling a second generation NJoy electronic cigarette |
| Acetic Acid, Glacial | Sigma-Aldritch | A6283 | |
| Acetone (Chromatography Grade) | Sigma-Aldritch | 34850 | |
| Basic Stamp Project Board | Digi-Key | 27112-ND | This board contains the BS1 Microcontroller, serial adaptor, power switch, and a barrel pin connector for the AC/DC Wall Mount Adaptor |
| Basic Stamp USB to Serial Adapter | Digi-Key | 28030-ND | An optional component to allow the BS1 serial adaptor to communicate through USB |
| Buchner Flask (Vacuum Flask) 250 mL | VWR | 10545-854 | |
| Clear Tape | 3M | S-9783 | |
| Clear Vinyl Tubing, 3/8" ID | Watts | 443064 | |
| EGM-2 Endothelial Cell Culture Medium | Lonza | CC-3162 | |
| Ethanol | Pharmco-Aaper | 111000200 | |
| Flow Regulator | Dwyer | VFA-23-BV | |
| Gas Chromatograph | Varian | 450-GC | |
| Glass Syringe, 10 mL | Sigma-Aldritch | Z314552 | |
| Glass Syringe, 10 µL | Hamilton | 80300 | |
| High Vacuum Silicon Grease | Dow Corning | 146355D | |
| Hose Clamp | Precision Brand | 35125 | |
| Human Umbilical Vein Endothelial Cells | ATCC | PCS-100-013 | |
| Mass Spectrometer | Varian | 300-MS | |
| Midget Impinger | Chemglass | CG-1820-01 | |
| Neutral Red | Sigma-Aldritch | N4638 | |
| Paraffin Film | 3M | PM-992 | |
| Plate Seal Roller | BioRad | MSR0001 | |
| Plate Seal; Foil | Thermo | 276014 | |
| Ring Stand 20" | American Educational Products | 7-G15-A | |
| Solenoid Valve (normally open) | US Solid | USS2-00081 | |
| Solid State Relay | Digi-Key | CLA279-ND | |
| Stand Clamp | Eisco | CH0688 | |
| Syringe Filter, PES, 0.22 um | Millipore | SLGP033RS | |
| Syringe, 10 mL | BD Syringe | 309604 | |
| Through Hole Stopper, Size 6 | VWR | 59581-287 | |
| Vacuum Pump | KNF Neuberger | N86KTP |
Riferimenti
- World Health Organization. . WHO Report on the Global Tobacco Epidemic, 2011. , (2011).
- Weaver, S. R., Majeed, B. A., Pechacek, T. F., Nyman, A. L., Gregory, K. R., Eriksen, M. P. Use of electronic nicotine delivery systems and other tobacco products among USA adults, 2014: results from a national survey. Int. J. Public Health. 61 (2), 177-188 (2016).
- Singh, T., et al. Tobacco Use Among Middle and High School Students - United States, 2011–2015. MMWR Morb. Mortal. Wkly. Rep. 65 (14), 361-367 (2016).
- Corey, C. G., Ambrose, B. K., Apelberg, B. J., King, B. A. Flavored Tobacco Product Use Among Middle and High School Students--United States, 2014. MMWR Morb. Mortal. Wkly. Rep. 64 (38), 1066-1070 (2015).
- Pisinger, C., Døssing, M. A systematic review of health effects of electronic cigarettes. Prev. Med. 69, 248-260 (2014).
- Callahan-Lyon, P. Electronic cigarettes: human health effects. Tob. Control. 23 (Suppl 2), ii36-ii40 (2014).
- Dinakar, C., O'Connor, G. T. The Health Effects of Electronic Cigarettes. N. Engl. J. Med. 375 (14), 1372-1381 (2016).
- Anderson, C., Majeste, A., Hanus, J., Wang, S. E-cigarette aerosol exposure induces reactive oxygen species, DNA damage, and cell death in vascular endothelial cells. Toxicol. Sci. Off. J. Soc. Toxicol. , (2016).
- U.S. Department of Health and Human Services. . The Health Consequences of Smoking: 50 Years of Progress. A Report of the Surgeon General. , (2014).
- Farsalinos, K., et al. Comparison of the Cytotoxic Potential of Cigarette Smoke and Electronic Cigarette Vapour Extract on Cultured Myocardial Cells. Int. J. Environ. Res. Public. Health. 10 (10), 5146-5162 (2013).
- Schweitzer, K. S., et al. Endothelial disruptive proinflammatory effects of nicotine and e-cigarette vapor exposures. Am. J. Physiol. - Lung Cell. Mol. Physiol. 309 (2), L175-L187 (2015).
- Putzhammer, R., et al. Vapours of US and EU Market Leader Electronic Cigarette Brands and Liquids Are Cytotoxic for Human Vascular Endothelial Cells. PLOS ONE. 11 (6), e0157337 (2016).
- Crooks, I., Dillon, D. M., Scott, J. K., Ballantyne, M., Meredith, C. The effect of long term storage on tobacco smoke particulate matter in in vitro genotoxicity and cytotoxicity assays. Regul. Toxicol. Pharmacol. 65 (2), 196-200 (2013).
- Roemer, E., et al. Mainstream Smoke Chemistry and in Vitro and In Vivo Toxicity of the Reference Cigarettes 3R4F and 2R4F. Beitr. Zur Tab. Contrib. Tob. Res. 25 (1), (2014).
- International Organization for Standards. . ISO 3088:2012 Routine analytical cigarette smoking machine – Definitions and standard conditions. , (2012).
- World Health Organization. . Standard Operating Procedure for Intense Smoking of Cigarettes. , (2012).
- Brown, C. J., Cheng, J. M. Electronic cigarettes: product characterisation and design considerations. Tob. Control. 23 (Suppl 2), ii4-ii10 (2014).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 81 - Routine Analytical Machine for E-Cigarette Aerosol Generation and Collection - Definitions and Standard Conditions. , (2015).
- Thorne, D., Adamson, J. A review of in vitro cigarette smoke exposure systems. Exp. Toxicol. Pathol. 65 (7-8), 1183-1193 (2013).
- Klus, H., Boenke-Nimphius, B., Müller, L. Cigarette Mainstream Smoke: The Evolution of Methods and Devices for Generation, Exposure and Collection. Beitr. Zur Tab. Contrib. Tob. Res. 27 (4), (2016).
- Baker, R. The Development and Significance of Standards for Smoking-Machine Methodology. Beitr. Zur Tab. Contrib. Tob. Res. 20 (1), (2014).
- Thorne, D., Crooks, I., Hollings, M., Seymour, A., Meredith, C., Gaca, M. The mutagenic assessment of an electronic-cigarette and reference cigarette smoke using the Ames assay in strains TA98 and TA100. Mutat. Res. Toxicol. Environ. Mutagen. 812, 29-38 (2016).
- Thorne, D., Larard, S., Baxter, A., Meredith, C., Gaҫa, M. The comparative in vitro assessment of e-cigarette and cigarette smoke aerosols using the γH2AX assay and applied dose measurements. Toxicol. Lett. 265, 170-178 (2017).
- Herrington, J. S., Myers, C. Electronic cigarette solutions and resultant aerosol profiles. J. Chromatogr. A. 1418, 192-199 (2015).
- Yu, V., et al. Electronic cigarettes induce DNA strand breaks and cell death independently of nicotine in cell lines. Oral Oncol. 52, 58-65 (2016).
- Ji, E. H., et al. Characterization of Electronic Cigarette Aerosol and Its Induction of Oxidative Stress Response in Oral Keratinocytes. PLOS ONE. 11 (5), e0154447 (2016).
- Morgan, D. L., et al. Chemical Reactivity and Respiratory Toxicity of the -Diketone Flavoring Agents: 2,3-Butanedione, 2,3-Pentanedione, and 2,3-Hexanedione. Toxicol. Pathol. 44 (5), 763-783 (2016).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 84 - Determination of Glycerin, Propylene Glycol, Water, and Nicotine in the Aerosol of E-Cigarettes by Gas Chromatographic Analysis. , (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon