Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un microcontrôleur exploité le dispositif pour la génération d’extraits liquides d’aérosol de Cigarette fumée et électronique de Cigarette classique
Dans cet article
Résumé
Nous décrivons ici un appareil de laboratoire programmable qui peut être utilisé pour créer des extraits de l’aérosol de cigarette électronique et de fumée de cigarette classique. Cette méthode fournit un outil utile pour faire des comparaisons directes entre les cigarettes classiques et les cigarettes électroniques et est un point d’entrée accessible à la recherche de la cigarette électronique.
Résumé
Les cigarettes électroniques sont le produit de tabac le plus populaire parmi les cadres intermédiaires et les lycéens et produit de tabac alternatif le plus populaire chez les adultes. Haute qualité, recherche reproductible sur les conséquences de l’utilisation de la cigarette électronique est essentielle pour la compréhension émergeant des préoccupations de santé publique et élaboration de preuves la base politique de réglementation. Alors qu’un nombre croissant de documents de discuter les cigarettes électroniques, il est peu de cohérence dans les méthodes des groupes et très peu de consensus sur les résultats. Nous décrivons ici un appareil de laboratoire programmable qui peut être utilisé pour créer des extraits de l’aérosol de cigarette électronique et de fumée de cigarette classique. Ce protocole détaille les instructions pour l’assemblage et le fonctionnement du dispositif de ladite et illustre l’utilisation de l’extrait généré dans deux exemples d’applications : un in vitro l’analyse de viabilité de cellules et la chromatographie en phase gazeuse spectrométrie de masse. Cette méthode fournit un outil pour faire des comparaisons directes entre les cigarettes classiques et les cigarettes électroniques et est un point d’entrée accessible à la recherche de la cigarette électronique.
Introduction
Malgré un effort concentré par les organisations de santé, utilisation de produits de tabac reste la principale cause de décès évitables dans le monde entier, avec la majorité de ces décès dus à la cigarette fumer1. Depuis son entrée dans le marché en 2003, les cigarettes électroniques ont augmenté en popularité auprès des utilisateurs des produits du tabac. Actuellement, les cigarettes électroniques sont l’alternative plus populaire aux cigarettes classiques chez les adultes américains (environ 5 %)2 et le système de livraison de la nicotine plus populaire parmi les moyen (~ 5,3 %) et les lycéens (~ 16 %)3. Si les tendances actuelles se poursuivent, les cigarettes électroniques est censés remplacer les cigarettes classiques pour les générations futures. Toutefois, les conséquences sanitaires de l’utilisation de la cigarette électronique demeurent incertains.
Recherche sur les cigarettes électroniques n’a pas commencé dans sérieux, jusqu'à ce que la popularité de la cigarette électronique a augmenté rapidement en 20133,4. Depuis ce temps, un certain nombre de modèles différents ont été employé pour examiner la question de leur toxicité. Toutefois, les résultats de nombreuses études sont contradictoires, et il semble que les cigarettes électroniques sont généralement moins toxiques que les cigarettes classiques, il n’y a aucun consensus actuel sur les conséquences sanitaires de la cigarette électronique n’utiliser5, 6 , 7. nos recherches antérieures indiquent que les cigarettes électroniques sont nettement moins toxiques pour l’endothélium vasculaire que les cigarettes classiques, malgré leur capacité à causer des dommages à l’ADN et l’induction de l’oxydante stress et la mort cellulaire8 . Cependant, davantage de recherche est nécessaire avant que nous pouvons tirer des conclusions fermes sur les conséquences sanitaires de l’utilisation de la cigarette électronique.
Comme les cigarettes classiques sont des principales causes de maladie vasculaire9, il y a un intérêt croissant pour le risque pour la santé vasculaire de cigarette électronique emploi10,11,12. Afin d’étudier les effets des cigarettes électroniques sur le système vasculaire, notre laboratoire a développé un microcontrôleur assuré fumeurs/vaping périphérique (Figure 1)8. Cet appareil est capable de générer des extraits liquides d’un aérosol de cigarette fumée ou électronique cigarette classique dans des solvants organiques ou aqueuses. Comme le flux d’air est contrôlée par la combinaison d’un régulateur de débit d’air réglable et un programme de calendrier de PBASIC, l’appareil peut servir à générer des extraits selon n’importe quel nombre de protocoles définis par l’utilisateur. Ici, nous détaillons l’assemblage et le fonctionnement de ce dispositif ainsi que deux applications potentielles : in vitro évaluation de la viabilité cellulaire et la chromatographie en phase gazeuse spectrométrie de masse.
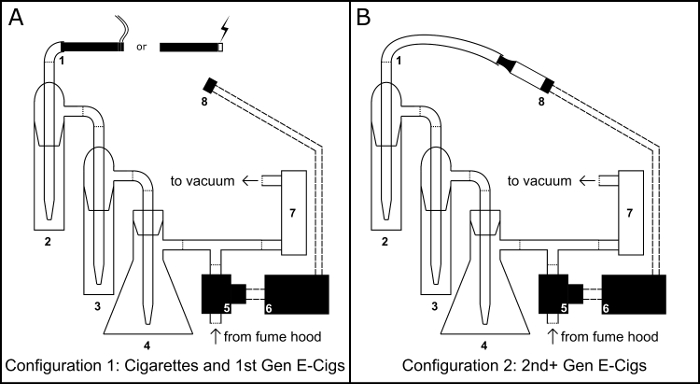
Figure 1 : appareil de fumer/Vaping. Schéma pour le montage physique de l’appareil de fumer/vaping en la/la cigarette comme configuration de cigarette électronique (e-cig) (A) et la configuration de cigarette électronique de réservoir (B). Composants principaux : 1) port d’Inhalation ; 2) impacteur de collection primaire ; 3) impacteur de débordement ; 4) piège à vide fiole Buchner ; 5) électrovanne normalement ouvert ; 6) microcontrôleur BS1 ; 7) régulateur de débit d’air ; 8) 510 fileté base du réservoir cigarette électronique. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocole
1. assemblage du dispositif
- Fixez un 100 mL fiole Buchner (Figure 1, #4) à un anneau en acier support et créer un piège sous vide en la remplissant avec 50 g de chlorure de calcium pour servir un déshydratant. Sceller la fiole avec un bouchon de caoutchouc à travers-trou, envelopper la jonction du bouchon avec le film de paraffine et d’exécuter une pipette dans le trou.
- Utilisez un tuyau en vinyle, connectez la pipette s’étendant de la butée à un raccord de tuyau d’intersection en t.
- Utilisez un tuyau en vinyle, branchez l’impacteur deux (Figure 1, #2 et #3) les uns aux autres et la sortie du deuxième impacteur sur le raccord de tuyau d’intersection en t.
- Utilisez un tuyau en vinyle, connectez le port d’entrée du premier impacteur pour servir comme un port d’inhalation (Figure 1, #1).
- Utilisez un tuyau de vinyle, connecter le bras latéral de la fiole Buchner au port d’entrée d’un régulateur de débit d’air (Figure 1, #7) et le port de sortie du régulateur d’air pour une pompe à vide.
- Assembler le circuit selon le schéma de la Figure 2 a.
- Télécharger le programme PBASIC SVL.bs1 (Figure 2 b, également disponible à https://github.com/ChastainAnderson/SVL) au microcontrôleur BS1 (Figure 1, #6) au moyen d’un adaptateur série et le logiciel du fabricant.
- Place le 510 fileté (Figure 1 #8) dans un anneau meuble pince.
- Utilisez un tuyau en vinyle, raccorder l’électrovanne (Figure 1, #5) à l’extrémité libre du raccord du tuyau de l’intersection en t.
Remarque : Le dispositif devrait être complet et prêt à fonctionner, vérifiez tous les raccords pour s’assurer qu’ils sont hermétiques et appliquent les colliers et graisse sous vide selon les besoins.
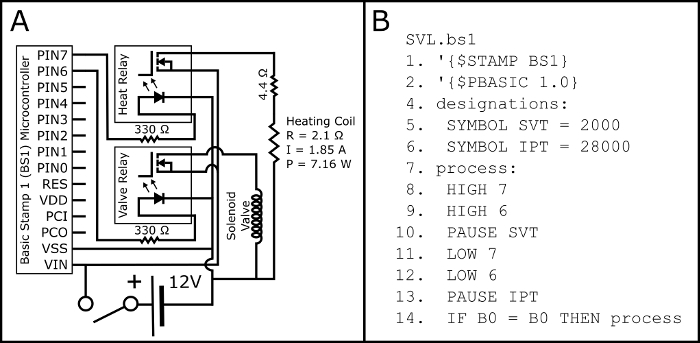
Figure 2 : schéma électrique et PBASIC Code. Figure 2 a affiche le schéma électrique pour le montage du circuit électrique nécessaire pour activer les deux normalement ouvert l’électrovanne et le serpentin de chauffage du bouton activé les cigarettes électroniques (par le biais de la 510 filetés électronique cigarette base du réservoir). Les paramètres électriques de la bobine de chauffage (P: puissance ; R : résistance ; et le courant i) sont projetées et doivent être vérifiées empiriquement un mât multimètre. Figure 2 b affiche le programme de calendrier de PBASIC nécessaire pour contrôler le circuit l' Figure 2 a (également disponible à https://github.com/ChastainAnderson/SVL). Les constantes de chronométrage SVT & IPT (#5 et #6) sont en ms et sont mis à offrir un temps d’activation de 2 secondes et un temps d’arrêt de 28 s. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
2. stockage et préparation de l’échantillon
- Garder tous les échantillons des cigarettes conventionnelles et électroniques non ouverts dans le noir dans des sacs en plastique hermétiques à température ambiante.
- Une fois ouverte, conserver les échantillons dans des sacs de plastique hermétiques à 4 ºC, avec du papier essuie-tout pour absorber l’excès d’humidité.
- Avant équilibrer tous les échantillons dans une cave à température ambiante à ~ 60 % d’humidité pendant au moins 30 minutes avant de les utiliser.
3. général fonctionnement du dispositif d’Extraction de Cigarette Cigarette électronique/fumée Aerosol
- Déterminer la masse de chaque e-cigarette cartomizer/réservoir pre-vaping à l’aide d’une balance analytique. La différence de poids de pré/post post vaping serviront à déterminer le dosage approprié.
Remarque : 3R4F cigarettes de référence sont censés pour contenir 0,7 mg de nicotine, et la teneur en nicotine des marques de cigarettes commerciales peut être déterminée par les méthodes classiques d’analyse13. - Exemple d’application 1, remplissez le réservoir de l’impacteur primaire avec 4,3 mL de milieu de culture de cellules endothéliales. Exemple d’application 2, remplissez le réservoir avec 5 mL d’acétone.
-
Préparation de la cigarette électronique ou la cigarette classique pour l’extraction :
- Si vous utilisez une cigarette classique, appliquez un morceau de ruban adhésif transparent autour du filtre et de mettre une marque visible où le papier à cigarettes rejoint le filtre.
- Si vous utilisez une cigarette e-cigarette, assurez-vous que la batterie est bien chargée et le cartomiseur solidement vissé à la batterie.
- Si vous utilisez un réservoir de cigarette électronique, assurez-vous qu’un volume suffisant de liquide cigarette électronique est chargé dans le réservoir et visser le réservoir sur le socle fileté 510.
- Insérez l’extrémité de la cigarette classique ou électronique dans le port d’inhalation (Figure 1, #1) et fixer avec un collier de serrage.
- Tourner sur la pompe à vide.
- Ajuster le débitmètre pour tirer 1,65 L/minute afin d’assurer une bouffée de 55 mL en 2 sec.
- Allumez le microcontrôleur. Si vous utilisez une cigarette classique, allumer la cigarette sur la première bouffée.
- Exécuter jusqu'à ce que visible désiré concentration (en parties par million ou % poids/volume) est atteint.
-
Déterminer la masse de chaque cartomiseur/réservoir de e-cigarette après vaporisation à l’aide d’une balance analytique. Comparer cette mesure à la mesure effectuée à l’étape 3.1 à déterminer la masse consommé au total. Calculer la concentration de la masse/volume consommé de solvant. Utiliser la concentration molaire de la nicotine consommée pour normaliser entre produits.
- Si une masse insuffisante a été consommée, la cigarette électronique de retour à l’appareil et consommer davantage.
- Si une masse suffisante ou excès a été consommée, aller de l’avant.
4. filtration et stockage
- Si l’extrait doit être utilisé pour la culture cellulaire, filtrer sur un filtre de seringue PES de 0,22 µm.
- Utilisez les extraits immédiatement ou conserver à-80 ° c. Dans le cadre de la préparation de Anderson, et al. 8, aérosol de la cigarette électronique a été démontrée comme stable pendant au moins deux semaines, et la stabilité de la fumée jusqu'à deux ans de cigarette a été établie par des escrocs, et al. 13.
5. nettoyage de l’appareil
- Après chaque extraction, rincer la tubulure et réservoirs de l’appareil avec l’éthanol à 70 % et de l’eau déionisée pour empêcher reportés entre les échantillons.
- Après rinçage, exécutez brièvement l’appareil vide pour permettre la circulation d’air faciliter le séchage des lignes.
6. exemple d’Application 1 : Absorption rouge neutre analyse de viabilité de cellules
- Effectuer l’extrait comme ci-dessus dans 4,3 mL de milieu de culture de cellules endothéliales.
- Un jour avant, les semences des cellules endothéliales de veine ombilicale humaine dans des 96 plaques puits à une densité de 1 x 104 cellules/wellin 100 µL de milieu de culture de cellules endothéliales.
- Traiter les cellules en remplaçant le vieux milieu de culture de cellules endothéliales avec soit 100 µL de milieu de culture de cellules endothéliales fraîche pour servir un contrôle ou de 75 µL de milieu de culture de cellules endothéliales mélangé avec 25 µL d’un extrait de concentration 2 mM consommé en nicotine (1,4 mg consommé de la nicotine dans le milieu de culture de cellules endothéliales 4,3 mL) pour une concentration finale de 500 µM à servir de traitement.
- Comme de nombreux éléments des deux aérosols de cigarette fumée et électronique de cigarette sont volatils, utiliser un opercule pour garder les puits étanche à l’air.
- Incuber la plaque de 18 à 24 h à 37 ° C et 5 % de CO2.
-
Préparer une coloration de solution de rouge neutre :
- Créer une solution-mère rouge neutre 100 x en dissolvant 33 mg du colorant rouge neutre dans 10 mL de solution saline tamponnée.
- Peu avant son utilisation, diluer 100 x 1/100 de solution mère dans le milieu de culture cellulaire pour créer 1 x coloration solution de rouge neutre.
- Incuber une coloration solution à 37 ° C pendant au moins 30 min avant utilisation et immédiatement rouge neutre.
Remarque : Il est normal que certains cristaux à précipiter durant l’incubation. Il faut de ne pas appliquer ces cristaux dans les puits de culture cellulaire. Si nécessaire, un filtre de.22 µm peut servir à filtrer les stock rouge neutre et les solutions de coloration.
- Extrait de supprimer et ajouter 100 µL de rouge neutre solution par bien, utilisation excédentaire pour créer au moins trois puits vides pour la quantification appropriée de coloration.
- Incuber les plaques à 2 – 4 h à 37 ° C et 5 % de CO2.
- Enlever une coloration de solution de rouge neutre et laver 3 fois par immersion dans du PBS.
- Appliquez le rouge neutre se détachant solution (50 % eau désionisée eau, éthanol à 49 %, 1 % d’acide acétique).
- Incuber au moins 10 min à température ambiante en agitant.
- Lire l’absorbance à 540 nm.
- Analyser les données en soustrayant la valeur moyenne des blancs et en normalisant à la moyenne de la valeur bien ajusté contrôle à blanc.
7. exemple d’Application 2 : chromatographie en phase gazeuse spectrométrie de masse
- Effectuer l’extraction comme ci-dessus dans 5 mL d’acétone.
- Exécutez l’appareil pour obtenir une concentration finale de ~ 100 parties par million (poids du e-liquide consommé/volume d’acétone) de votre échantillon.
- À l’aide d’une seringue de verre de précision, injecter 1 µL dans l’injecteur d’un dispositif de GC-MS. Injecter un 01:20 divisé ratio en un système de couplage chromatographe en phase gazeuse/quadrupolaire spectromètre équipé d’une colonne de ZB-5 avec le protocole suivant du four à 250 ° C : 1 min à 50 ° C ; rampe de 10 ° C/min jusqu'à 140 ° C ; rampe de 20 ° C/min jusqu'à 300 ° C et maintenez pendant 10 min.
- Correspondre à des spectres de masse qui en résulte pour la bibliothèque cible pour identifier les composants des aérosols.
Résultats
Dans les 24 heures de l’exposition de veine ombilicale humaine extrait de cellules endothéliales extrait de fumée de cigarette classique (CST) ou aérosols de cigarette électronique (EAE), il y a une importante (contrôle vs CST P < 0,001 ; commande vs EAE P < 0,01 ; n = 6) réduction de la viabilité cellulaire (Figure 3 a). Des extraits ont été générées avec un profil bouffée de 2, 2 secondes, souffles de 55 mL / minute et nor...
Discussion
Les éléments les plus critiques du présent protocole sont d’assurer que l’appareil est propre au début et la fin de chaque extraction, et veiller à ce que tous les joints sont maintenus si cette circulation d’air reste cohérente. Si l’appareil n’est pas correctement nettoyé, il existe un risque de Portage dans entre les échantillons. En outre, si l’appareil est laissé impur pendant une période prolongée d’aérosol condensé de temps et séché solvant peut bloquer le système. Notez qu’il est n...
Déclarations de divulgation
Le programme du tabac produit réglementaire Science Research Fellowship, administré par l’Université de Tulane est financé par Altria Client Services Regulatory Affairs.
Remerciements
Les auteurs tiennent à souligner l’aide du Dr Robert Dotson de la Tulane University Département de biologie cellulaire et moléculaire pour son aide dans l’édition du manuscrit et le Dr James Bollinger du département de chimie de l’Université de Tulane pour son aide avec la conception de protocole de spectrométrie de masse. Les auteurs autres reconnaissent la Tulane University Department de cellule et de biologie moléculaire et le département de chimie de l’Université de Tulane pour leur soutien et de l’utilisation de l’espace et l’équipement. Ce travail a été soutenu par une bourse de recherche de Science réglementaire du tabac produit C. Anderson de la Tulane University School of Science et ingénierie.
matériels
| Name | Company | Catalog Number | Comments |
| 12 V AC/DC Wall Mount Adaptor | Digi-Key | T1099-P5P-ND | |
| 2.2 Ohm Resistors | Digi-Key | A105635-ND | Used in tandem to generate the 4.4 Ohm resistance in Figure 2A |
| 330 Ohm Resistors | Digi-Key | 330QBK-ND | |
| 510 Threaded Base | NJoy | N/A | Recovered by dismantalling a second generation NJoy electronic cigarette |
| Acetic Acid, Glacial | Sigma-Aldritch | A6283 | |
| Acetone (Chromatography Grade) | Sigma-Aldritch | 34850 | |
| Basic Stamp Project Board | Digi-Key | 27112-ND | This board contains the BS1 Microcontroller, serial adaptor, power switch, and a barrel pin connector for the AC/DC Wall Mount Adaptor |
| Basic Stamp USB to Serial Adapter | Digi-Key | 28030-ND | An optional component to allow the BS1 serial adaptor to communicate through USB |
| Buchner Flask (Vacuum Flask) 250 mL | VWR | 10545-854 | |
| Clear Tape | 3M | S-9783 | |
| Clear Vinyl Tubing, 3/8" ID | Watts | 443064 | |
| EGM-2 Endothelial Cell Culture Medium | Lonza | CC-3162 | |
| Ethanol | Pharmco-Aaper | 111000200 | |
| Flow Regulator | Dwyer | VFA-23-BV | |
| Gas Chromatograph | Varian | 450-GC | |
| Glass Syringe, 10 mL | Sigma-Aldritch | Z314552 | |
| Glass Syringe, 10 µL | Hamilton | 80300 | |
| High Vacuum Silicon Grease | Dow Corning | 146355D | |
| Hose Clamp | Precision Brand | 35125 | |
| Human Umbilical Vein Endothelial Cells | ATCC | PCS-100-013 | |
| Mass Spectrometer | Varian | 300-MS | |
| Midget Impinger | Chemglass | CG-1820-01 | |
| Neutral Red | Sigma-Aldritch | N4638 | |
| Paraffin Film | 3M | PM-992 | |
| Plate Seal Roller | BioRad | MSR0001 | |
| Plate Seal; Foil | Thermo | 276014 | |
| Ring Stand 20" | American Educational Products | 7-G15-A | |
| Solenoid Valve (normally open) | US Solid | USS2-00081 | |
| Solid State Relay | Digi-Key | CLA279-ND | |
| Stand Clamp | Eisco | CH0688 | |
| Syringe Filter, PES, 0.22 um | Millipore | SLGP033RS | |
| Syringe, 10 mL | BD Syringe | 309604 | |
| Through Hole Stopper, Size 6 | VWR | 59581-287 | |
| Vacuum Pump | KNF Neuberger | N86KTP |
Références
- World Health Organization. . WHO Report on the Global Tobacco Epidemic, 2011. , (2011).
- Weaver, S. R., Majeed, B. A., Pechacek, T. F., Nyman, A. L., Gregory, K. R., Eriksen, M. P. Use of electronic nicotine delivery systems and other tobacco products among USA adults, 2014: results from a national survey. Int. J. Public Health. 61 (2), 177-188 (2016).
- Singh, T., et al. Tobacco Use Among Middle and High School Students - United States, 2011–2015. MMWR Morb. Mortal. Wkly. Rep. 65 (14), 361-367 (2016).
- Corey, C. G., Ambrose, B. K., Apelberg, B. J., King, B. A. Flavored Tobacco Product Use Among Middle and High School Students--United States, 2014. MMWR Morb. Mortal. Wkly. Rep. 64 (38), 1066-1070 (2015).
- Pisinger, C., Døssing, M. A systematic review of health effects of electronic cigarettes. Prev. Med. 69, 248-260 (2014).
- Callahan-Lyon, P. Electronic cigarettes: human health effects. Tob. Control. 23 (Suppl 2), ii36-ii40 (2014).
- Dinakar, C., O'Connor, G. T. The Health Effects of Electronic Cigarettes. N. Engl. J. Med. 375 (14), 1372-1381 (2016).
- Anderson, C., Majeste, A., Hanus, J., Wang, S. E-cigarette aerosol exposure induces reactive oxygen species, DNA damage, and cell death in vascular endothelial cells. Toxicol. Sci. Off. J. Soc. Toxicol. , (2016).
- U.S. Department of Health and Human Services. . The Health Consequences of Smoking: 50 Years of Progress. A Report of the Surgeon General. , (2014).
- Farsalinos, K., et al. Comparison of the Cytotoxic Potential of Cigarette Smoke and Electronic Cigarette Vapour Extract on Cultured Myocardial Cells. Int. J. Environ. Res. Public. Health. 10 (10), 5146-5162 (2013).
- Schweitzer, K. S., et al. Endothelial disruptive proinflammatory effects of nicotine and e-cigarette vapor exposures. Am. J. Physiol. - Lung Cell. Mol. Physiol. 309 (2), L175-L187 (2015).
- Putzhammer, R., et al. Vapours of US and EU Market Leader Electronic Cigarette Brands and Liquids Are Cytotoxic for Human Vascular Endothelial Cells. PLOS ONE. 11 (6), e0157337 (2016).
- Crooks, I., Dillon, D. M., Scott, J. K., Ballantyne, M., Meredith, C. The effect of long term storage on tobacco smoke particulate matter in in vitro genotoxicity and cytotoxicity assays. Regul. Toxicol. Pharmacol. 65 (2), 196-200 (2013).
- Roemer, E., et al. Mainstream Smoke Chemistry and in Vitro and In Vivo Toxicity of the Reference Cigarettes 3R4F and 2R4F. Beitr. Zur Tab. Contrib. Tob. Res. 25 (1), (2014).
- International Organization for Standards. . ISO 3088:2012 Routine analytical cigarette smoking machine – Definitions and standard conditions. , (2012).
- World Health Organization. . Standard Operating Procedure for Intense Smoking of Cigarettes. , (2012).
- Brown, C. J., Cheng, J. M. Electronic cigarettes: product characterisation and design considerations. Tob. Control. 23 (Suppl 2), ii4-ii10 (2014).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 81 - Routine Analytical Machine for E-Cigarette Aerosol Generation and Collection - Definitions and Standard Conditions. , (2015).
- Thorne, D., Adamson, J. A review of in vitro cigarette smoke exposure systems. Exp. Toxicol. Pathol. 65 (7-8), 1183-1193 (2013).
- Klus, H., Boenke-Nimphius, B., Müller, L. Cigarette Mainstream Smoke: The Evolution of Methods and Devices for Generation, Exposure and Collection. Beitr. Zur Tab. Contrib. Tob. Res. 27 (4), (2016).
- Baker, R. The Development and Significance of Standards for Smoking-Machine Methodology. Beitr. Zur Tab. Contrib. Tob. Res. 20 (1), (2014).
- Thorne, D., Crooks, I., Hollings, M., Seymour, A., Meredith, C., Gaca, M. The mutagenic assessment of an electronic-cigarette and reference cigarette smoke using the Ames assay in strains TA98 and TA100. Mutat. Res. Toxicol. Environ. Mutagen. 812, 29-38 (2016).
- Thorne, D., Larard, S., Baxter, A., Meredith, C., Gaҫa, M. The comparative in vitro assessment of e-cigarette and cigarette smoke aerosols using the γH2AX assay and applied dose measurements. Toxicol. Lett. 265, 170-178 (2017).
- Herrington, J. S., Myers, C. Electronic cigarette solutions and resultant aerosol profiles. J. Chromatogr. A. 1418, 192-199 (2015).
- Yu, V., et al. Electronic cigarettes induce DNA strand breaks and cell death independently of nicotine in cell lines. Oral Oncol. 52, 58-65 (2016).
- Ji, E. H., et al. Characterization of Electronic Cigarette Aerosol and Its Induction of Oxidative Stress Response in Oral Keratinocytes. PLOS ONE. 11 (5), e0154447 (2016).
- Morgan, D. L., et al. Chemical Reactivity and Respiratory Toxicity of the -Diketone Flavoring Agents: 2,3-Butanedione, 2,3-Pentanedione, and 2,3-Hexanedione. Toxicol. Pathol. 44 (5), 763-783 (2016).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 84 - Determination of Glycerin, Propylene Glycol, Water, and Nicotine in the Aerosol of E-Cigarettes by Gas Chromatographic Analysis. , (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon