Method Article
人工脂质纳米管网作为内质神经的底部模型的自发形成与重排
摘要
固体支持、无蛋白质、双磷脂双层膜 (dlbm) 可转化为复杂的动态脂质纳米管网络, 可作为内质网的2d 自下而上模型。
摘要
提出了一种建立内质网 (er) 自下而上的结构细胞器模型的简便方法。该模型由高密度脂质纳米管组成, 从形态和动力学上看, 这些纳米管让人想起 er。这些网络来源于粘附在透明铝2o3 基板上的磷脂双双层膜贴片 。粘附是由环境缓冲液中的 ca2 +介导的。随后通过 bapta\ edta 对 ca2 +的消耗导致膜的收缩, 导致自发性脂质纳米管网络的形成。该方法仅包括磷脂和微加工表面, 用于简单地形成 er 模型, 不需要添加蛋白质或化学能 (例如, gtp 或 atp)。与细胞内质网的三维形态不同, 该模型是二维的 (尽管保持了纳米管尺寸、几何形状、结构和动力学)。这种独特的体外er 模型仅由少数成分组成, 易于构建, 并且可以在光镜下观察到。由此产生的结构可以进一步装饰, 以获得额外的功能, 例如添加与 er 相关的蛋白质或粒子, 以研究管内的传输现象。这里描述的人工网络是适合细胞 er 的结构模型, 其独特的特征形态已被证明与其生物功能有关, 而有关管域和重新安排内仍未完全了解。我们注意到, 这种方法使用铝2o3 薄膜涂层显微镜覆盖片, 这是在商业上可用, 但需要特殊的订单.因此, 最好能进入微制造设施进行制备。
引言
er 在生物细胞中执行关键任务, 包括蛋白质折叠、脂质合成和钙调节1,2。er 形态是其执行的功能所固有的。它结合了平面堆栈和密度动态管域, 它们与细胞骨架不断相互作用, 并进行恒定的运动和重新排列。er 结构所经历的一些改造包括平面板和管之间的连续转变、从 er 腔形成或融合的囊泡形成、预先存在的管的伸长率、管的收缩、融合和断裂 3。管状网络的特殊结构在能量上是不利的。急诊室产生和维持这个组织的途径和机制, 以及这与它的职能之间的关系, 目前还没有完全了解4、5.
众所周知, er 在失去稳态时出现故障, 导致 er 应力, 这种情况是由蛋白质合成增加、错误折叠的蛋白质积累或 ca 2+的变化和氧化平衡引起的。er 应力反过来又会引起细胞器自然形态的变形, 特别是通过干扰网络组织6、7.作为响应, 单元格激活修复机制以返回到稳态状态。修复失败可导致 er 诱导的细胞凋亡, 这导致了几种代谢和退行性疾病, 如阿尔茨海默病、2型糖尿病、帕金森病、肌萎缩侧索硬化症等. 8。目前的研究重点是管状 er 网络的组织, 并有几项研究的重点是重组 er在体外2。一些现有的模型2,9,10需要蛋白质启动和维持膜曲率3,11, 并帮助细胞器达到其形状。显然, 非常需要反映 er 的一些关键结构和组织特征并提供高级实验研究的模型系统。
本文介绍了一种用于 er 的简便、无蛋白质/化学能量、动态体外模型的制备过程, 为研究 er 形态及相关功能提供了一个基本平台4。在这种方法中, er 模型是用一种自下而上的方法制造的, 它只使用少数元素, 在这种方法中, 感兴趣的分子可以集成, 以增加复杂性。网络代表 er 结构和动态。此外, 还可以观察到平面膜与管内的可逆转变、管内囊泡的形成、管的融合、滑动和收缩。除了作为不完全了解的细胞 er 的自下而上的模型外, 本协议中描述的通往纳米管网络的脂质路径还可适用于研究自组装、纳米流体、单分子和胶体的研究人员运输现象、马兰戈尼流和其他相关领域。我们方法中使用的唯一分子构建块是磷脂。该议定书几乎不需要实验室工作和基本设备, 可以纳入更多的要素。
研究方案
1. 磷脂叶泡悬浮液的制备
注: 对于本协议中称为 "清洁" 的所有材料, 请用异丙醇彻底清洗, 然后用去离子水清洗, 然后用氮气吹干。请注意, 使用强氧化酸性剂 (piranha 溶液) 对玻璃基板进行处理, 通常应用于固体基板上支持脂质膜的制备协议, 不应在 al 2o3 涂层上进行。载体。
- 放置在一个干净的10毫升圆底或倒梨形玻璃瓶: 大豆 l-α磷脂酰胆碱 (pc, 69% ww)、1、2-二烯醇-甘油-甘油-3-磷乙醇胺 (dope, 30% w/w) 和可选择的脂质共轭氟含量 [例如,德州 red 1, 2-氯仿中的二己二醇-sn-h光三醇胺三乙基铵盐 (tr-dhpe, 1% w w)];总用量为3000μg 的脂质, 为300μl 的氯仿, 最终浓度为 10 mg/ml。
注: 在处理含有氯仿的化合物时, 使用含有聚四氟乙烯柱塞的清洁、玻璃、气密注射器。
注意: 氯仿有毒且极易挥发, 应始终在通风罩下处理, 并配有相关的个人防护设备。 - 将烧瓶连接到旋转蒸发器, 其位置倾斜为 45°, 并在23°c 的水浴中以24转每分钟旋转 6小时, 降低气压, 以缓慢而完全地去除氯仿。在启动旋转后, 立即启动每 2分钟20千帕的旋转, 直到达到20千帕 (150 torr, 80% 真空)。
注: 在制备容器中形成均匀厚度的均匀脂膜是旋翼手术的最重要要求。脂质制剂对旋转速度、快速压力变化和最终压力值敏感;因此, 严格遵循缓慢的还原步骤以及端部压力和旋转速度。将酒瓶放置在45°的倾斜度下, 以保证脱水的脂质蛋糕作为薄膜均匀地形成在烧瓶的壁上。旋转的速度太快导致动荡和旋转引线的太慢 (由于重力) 到在烧瓶底部的一层厚的流体的积累。在随后的夜间肿胀过程中, 会产生一个非常不均匀的脂质质量, 对最终的超声步反应不好, 由此产生的分数是不同的成分。在该方法规定的范围内的压力和时间可确保缓慢的脱解。以氯仿为溶剂, 压力下降过快冷却混合物, 导致粘度增加, 成层和成膜不均匀。建议使用6小时的长时间, 以便最大限度地去除溶剂, 因为有机溶剂在补液时将其分解成脂质材料。 - 6小时后, 停止旋转, 并再次增加气压, 逐渐, 每2分钟的步骤20千帕, 直到达到100千帕。从旋转蒸发器上取下烧瓶, 加入3毫升的 pbs 和30μl 的甘油。轻轻旋涡, 溶解甘油。使用气密玻璃塞子密封装有脂质的烧瓶。
注: 甘油用于防止脂膜完全脱水, 并使双层分离12。它应该在使用前加热, 以降低其粘度, 这有利于处理这种化合物。加热的甘油仍然不能立即与 pbs 缓冲液混合。在甘油完全溶解之前, 需要温和的旋转。 - 将烧瓶存放在4°c 的冰箱里过夜, 以进行补液和脂质膜肿胀。
- 第二天, 用超声波水浴将脂质在室温 (rt, ~ 21°c) 和 35 khz 频率下, 直到达到均匀、稍微浑浊的脂质悬浮液。
注: 超声可需要10-30秒左右的时间. 延长超声速 (~ 1分钟) 产生热量, 不利于囊泡的形成。 - 步骤 1.1-1.5 产生含有两种类型的囊泡结构的悬浮液: 多层囊泡 (mlv) 和巨大的单锁囊泡 (guv) (图 1a-1f)。
- 为了储存, 使用总共30个微离心管将脂质悬浮液分成100μl 的 aliquots, 并将其存放在-20°c 的冰柜中。
注: 使用液氮的闪光冷冻是没有必要的, 在储存前也不使用。协议可以在这里暂停。在4°c 冰箱中长时间留下脂质悬浮液会导致脂质裂解, 从而影响膜的组成。
2. 基板的制备
注: 以下协议在 iso 64644-1 标准规范中归类为 iso 8 的洁净室执行。原子层沉积 (ald) 用于制备铝2o3 基板.指定的工艺参数与仪器相关, 可能因设备型号而异。它们可以作为开发过程的初始参数。
- 将 ald 反应器的温度设置为200°c。
- 将玻璃表面 (例如玻璃盖板) 与硅片一起装入样品室, 该晶片稍后将用作参考表面, 以确定椭圆偏振仪沉积的厚度。
注: 玻璃基板是开箱即用的, 在沉积前没有溶剂清洗。他们只是用氮气冲洗以去除颗粒。 - 将装载室疏散到 400 pa (3 torr), 将样品转移到主反应室, 并将其疏散到 200 pa。
注: 必须将反应器的温度保持在 200°c, 才能进行适当的沉积。因此, 在开始沉积之前, 必须平衡样品加载后的温度波动。室内压力设定为高于反应堆压力, 以避免任何前体在箱体外扩散。 - 开始保存原子胶片。一个周期包括150毫秒脉冲三甲基铝接触, 然后是1秒的清洗, 随后的 h2o 暴露时间为200 毫秒, 然后是1秒的清洗。
注: 所有设置, 包括腔内和反应器压力、周期长度和清洗, 都是自动化的, 以达到规定的沉积速率。这些参数可能因设备的不同型号而异。预配置的配方通常由负责在洁净室的供应商或工具准备, 并以每单位时间的沉积薄膜厚度传达给用户。 - 要在基板上达到铝2o3 的10纳米, 请重复该工艺100次循环.循环的数量取决于沉积速率, 沉积速率可能因不同配方或设备而异。
- 要从反应器中取出样品, 首先将腔中的样品排出, 直到其压力达到大气压力, 然后取出样品。
- 将样品存放在 rt 的气密容器中, 直至使用。
注: 使用前不建议进一步清洁。协议可以在这里暂停。
注: 理想情况下, 样品应在沉积后立即使用。最佳存储要求将聚丙烯晶片载体内的表面定位, 然后将载体封装在与洁净的房间兼容的塑料袋中, 塑料袋在真空密封前进行氮气冲洗。这样做的目的是为了避免表面暴露在空气中的污染物中。如有必要, 表面最多可以在 rt 密封容器中保存5天。不建议使用更长的存储时间。对于无法方便地进入附近洁净室、从国外购买或获取表面的用户来说, 通过氧气等离子体或臭氧处理对基板进行再氧化可能是另一种解决方案13。
3. 分子磷脂薄膜向管状网络的转化
- 解冻脂质悬浮液, 并将4μl 液滴悬浮液转移到干净的玻璃显微镜滑动/防滑。
- 将液滴干燥20分钟。液滴干燥后会塌陷成扁平的环状膜, 眼睛可以看到。
- 用 hepes 缓冲液1毫升 (见材料表) 补充脂膜3分钟。
注: 补液缓冲液的体积会影响囊泡悬浮液的密度 (单位体积的囊泡数), 然后转移到观察室。根据观察室的体积和所需的囊泡密度, 补液体积可调整为 0.5-1 毫升。清洁硼硅酸盐幻灯片往往支持几百微升的液滴达 1.5 ml, 没有问题。由于盖板不需要移动, 这不会导致技术问题。在更疏水的表面上, 如 su-8 覆聚合物的滑块, 即使 1.5 ml 也可以沉积12。
注: 脂类应该是新鲜准备的, 因为在 rt 处接触再水化脂膜超过20分钟会导致缓冲液蒸发和先前再水泡的部分脱水, 从而导致成分定义不清。 - 准备观察室: 为了允许通过自动移液器进行缓冲交换, 需要启动 er 变换, 使用了一个具有开口顶的观察室。该室由一个尺寸为 1.5 x 1.5 x 0.5 厘米的聚二甲基硅氧烷 (pdms) 框架组成, 粘附在沉积的 al2o3盖板上。图 1g表示了安装观测室的方案。采取了以下步骤来制造 pdms 框架并组装观察室:
- 在冰浴中的烧杯中, 将100克 koh 与100毫升异丙醇混合, 制备 koh 溶液。搅拌10小时或更长时间, 直到使用磁性搅拌器和磁搅拌板完全溶解 koh。
注意: koh 溶液具有腐蚀性, 会导致皮肤灼伤, 因此请务必使用适当的个人防护设备。
注: koh 在异丙醇中的溶解度不如在水中高。溶解是放热的。在溶解和连续搅拌之前将 koh 颗粒压碎是可取的。 - 将玻璃培养皿 (d = 6 厘米) 浸入 rt 的 koh 溶液中, 并将其保存一夜。
- 第二天, 将玻璃盘从溶液中取出, 用去离子水浸泡在容器中 5分钟, 用水冲洗几次, 并将其放入80°c 的烘干炉内 1小时, 用氮气将表面短暂吹气, 以确保该部分将被移除。
- 为了钝化表面并防止与 pdms 结合, 用塑料注射器将200μl 的二甲基二氯硅烷转移到一个干净的塑料容器中, 例如称重船。
- 将玻璃培养皿与硅烷一起存放 1小时, 放在疏散干燥器中 (低真空, ~ 20千帕)。
注意: 二甲基二氯硅烷有毒, 应始终在通风罩下处理, 并配备相关的个人防护设备。 - 在收集培养皿之前等待 15分钟, 以便剩余的二甲基二氯硅烷蒸气消散。培养皿现在是硅化的, 表面是疏水的。
注: 测试此步骤是否成功的快速方法是将水滴放置在硅化培养皿上。与未经处理的玻璃相比, 液滴与表面的接触角必须明显增加。 - 在250毫升塑料容器 (透明塑料杯新鲜包装) 中, 将10克有机硅弹性体底座与1克有机硅弹性体固化剂 (10应从 1) 混合。用塑料搅拌器搅拌5分钟。
注: 气泡在搅拌时形成, pdms 看起来会是苍白的。 - 将混合物在20千帕 < 中分解为脱气, 直到所有膨胀的气泡都破裂 (较高的真空加速了过程)。将脱气混合物倒进硅化培养皿中。
- 在65°c 的温度下, 在烤箱中固化2小时。
注: 通过将温度提高到 > 95°c, 可以将固化速度提高一倍。固化温度的升高会增加材料的刚度。 - 将充满固化 pdms 的培养皿冷却至 rt, 并用铲子取出 pdms 板。
- 使用手术刀, 将框架切割成适合显微镜阶段可用开口的尺寸和几何形状。1.5 (长) x 1.5 (宽) x 0.5 (高) 厘米的尺寸适用于大多数设置。
- 将 pdms 框架的光滑侧面 (与 petri 培养皿接触的底部) 与铝2o3 薄膜所在的表面的活动侧接触, 并轻轻施加压力, 相互推动框架和表面让他们坚持。
注: pdms 帧与铝 2o3基板之间的附着力较弱。接触界面上气泡的存在可能会导致去连接, 从而导致缓冲器和相关内容的泄漏。pdms 框架可以使用几次, 如果立即在每次使用后和之前, 它被冲洗与异丙醇, 然后用 di 水冲洗和吹干与氮。硅化培养皿也可以再利用。
- 在冰浴中的烧杯中, 将100克 koh 与100毫升异丙醇混合, 制备 koh 溶液。搅拌10小时或更长时间, 直到使用磁性搅拌器和磁搅拌板完全溶解 koh。
- 用 ca2 +-hepes 缓冲液填充观察室 (见材料表)。
注: 开封后, 应立即使用表面。与空气的接触会导致污染物的吸附, 从而逐渐降低表面的活性。组装后, 腔内应立即填充缓冲液。不要填充整个腔体积, 以便在随后的步骤中添加再水合脂质。 - 将腔置于共聚焦显微镜舞台上。将再水化的脂质材料 (现在是含有巨大小泡的悬浮液) 用塑料巴斯德移液器输送到室内 (图 1a-1g)。
- 等待 10-20, 让囊泡粘附在基板上并在表面上扩散 (图 1h-1j)。
注: 扩散开始后, 在表面的脂质沉积后立即开始。扩散速率可能略有变化, 具体取决于脂质组成、铝2o3 沉积技术 (adl、rf 溅射、化学气相沉积等)、基板的新鲜度和二价阳离子浓度.缓冲区。确保在传播补丁14破裂之前执行缓冲区交换. - 观察到多个脂质扩散后, 通过自动移液器慢慢去除环境缓冲液, 使底部只保留一层薄薄的缓冲膜。
注: 迅速去除缓冲液, 使表面的脂质结构受到干扰。 - 继续进行环境缓冲交换, 使用自动移液器缓慢地填充观察室 (见材料表) (图1k)。
注: 突然添加缓冲液会使表面的脂质结构受到干扰。 - 这最后一步产生了动态纳米管网络, 这是由 dlbm 由螯合物诱导的去汉化和撤回到 mlv4 (图 1l-1y) 形成的。
4. 显微镜观察
- 使用扫描频率为400赫兹的40x 油 (1.3 na) 浸入目标, 用倒置激光扫描共聚焦显微镜采集图像. 使用白光激光源, 在595纳米的情况下激发德州红色 dhpe。利用混合光子探测器收集605至700纳米的发射。
注: 或者, 也可以使用成像成像。根据可用的光源, 选择合适的脂质染料共轭。
结果
在协议第1步中获得并在整个实验中使用的脂质悬浮液包含两种主要类型的囊泡: mlv 和 guv。图 1a-1f显示了在三维构造的初始样本中的囊泡激光扫描共聚焦显微图像。图 1a-1c分别显示了 xyz、xz 和 yz 平面上的 mlv (脂质沉积)。图 1d-1f显示了类似的观点, 一个巨大的单侧囊泡 (guv)。guv 的内部部分缺乏多层次的特性, 是空心的;因此, 用于扩散的脂质物质受到明显限制。因此, 这种方法唯一有用的脂质库是 mlv。
当脂质悬浮液转移到含有 ca2 +-hepes 缓冲液 (图 1g) 的观察室时, mlv (图 1a-1c) 开始在 al 2o3 表面沉降.接触时, 囊泡粘附在表面, 圆形扁平双脂双层膜 (dlbm) 开始从每个 mlv 扩散到固体支撑 (图 1h-1j)。mlv 作为一个水库, 为不断扩大的 dlbm 提供脂质。远端 (上) 双层膜, 就固体支撑而言, 沿圆形边缘的周长连接到近端 (下) 双层膜, 执行滚动运动 (图 1i)。这两个双层被平定位在彼此之上, 只有一个薄薄的液体膜封装在他们之间。在扩张过程中, 近端膜持续粘附在支撑表面下方, 而远端膜通过膨胀的近端膜边缘侧向拉边缘。dlbm 的扩散是由 ca2 +介导的, 它在近端膜脂头基团和固体底物4之间起到了致热剂的作用。
如果传播持续很长时间, 膜张力就会增加, 导致破裂 (图 2 a 和2b)。之后, 膜收缩, 这是必要的, 以创建 er 管形态, 不能再诱导。因此, 识别破裂的膜是很重要的。由于我们实验中的脂质是荧光标记的, 因此可以直接观察到破裂。破裂的一个关键指标是破裂区域的荧光强度显著下降 (图 2 a 和2b)14。破裂是远端膜张力增加和随后毛孔形成的结果。因此, 在荧光显微镜下, 破裂区域将显示未破裂区域 (双双层) 14 (图 2 b) 的一半发射强度 (单近端双层).在孔隙形成过程中, 最初位于破裂区域的膜材料迁移到扩张斑块的边缘。这反过来又会导致整个补丁区域的增长。因此, 在破裂过程中, 也可以观察到圆形斑块轮廓的快速扩张。
为了避免导致斑块破裂的广泛生长, 在圆形贴片面积达到100-200μm 后, 用自动移液器轻轻取出 ca2 +-hepes 缓冲液, 直到表面仍有一层薄薄的液体。然后将 Chelator-HEPES 缓冲器轻轻添加到腔内, 以启动收缩 (图 1k)。样品完全脱水 (图 2c) 或快速交换缓冲液 (图 2 d 和2e) 会导致补丁的干扰、破裂或变形。螯合剂的加入逐渐从表面和膜之间的空间中去除 ca2 + 。chelator-hepes 缓冲器从脂质膜贴片的外围逐渐进入双层间基板空间。因此, 固定站点的删除从圆形修补程序的边缘开始并向内传播 (图 1k-1q)。由于去除罪, 脂质膜开始分离, 并从边缘向内回, 向中心的 mlv 前进。收缩过程导致了一个动态发展的脂质管网 4的新接口 (图 1l-1y)。固定的持久区域, 不允许膜完全分离, 留在表面和成核制表, 导致纳米管的长期分支网络。(图 1l-1y)。随着时间的推移, 随着时间的推移, 随着螯合过程的推移, 观察到脂质纳米管的连续去固定和进一步收缩。这种粗化和重新排列的网络分支在管状网络的动态行为中起着关键的作用, 类似于光滑的 er。
图 1l-1y显示了该协议中获得的纳米管网络的微观图。图 1l是图 1m中标记在白色框架中的区域的特写镜头。图 1 l 和1m中的连续亮红色区域是 dlbm 的收缩部分 (在图 1m 中用蓝色虚线标记)。图 1 n 和1 o中的管状网络的显微图被反转, 以增加对比度。图 1p和1q描述了膜区域管状密度在3小时和20分钟内的降低。管状密度的降低是由于在实验时间内逐渐弃除后, dlbm 从表面回缩而引起的。随着时间的推移, 从固定中释放的点数增加, 导致重新排列和管道覆盖的面积减少 (图 1p 和 1q)。管状重组的动机是在两个固定点之间悬浮的脂质纳米管的表面自由能最小化。众所周知, 最大限度地减少纳米管表面能量的最有效方法是减少其长度 15.因此, 当最初将纳米管固定在表面的致热区被取消固定时, 纳米管就会滑动并自发排列, 采用最小的长度。这些重新排列会导致纳米管对表面的覆盖逐渐减少 (图 1p 和 1q)。
我们无法想象 ca2 +介导的固定点, 但我们将它们的位置确定为管道有端子或急转弯的点。由于管对齐方向的突然移动 (图1r 和1x 中的绿色箭头), 夏普转弯被称为 v型连接点15或转折点。终点表示管的终点, 防止管收缩 (图 1x中的橙色箭头)。在重组过程中, 出现了被确定为 "y 结" 或 "三通连接点" 的管道的积极有利配置。y 结连接三个管, 每个管之间大约有120°角, 在那里可以固定最短的总管长度。y 连接点不具有终点, 而是位于多个纳米管之间, 不会固定。这是唯一可以执行滑动的 y 结类型 (蓝色箭头,图 1r)。如图1 r 和 1s 所示, y 结沿高度不稳定的交叉点滑动会导致形成两个单独的 y 结 (图 1s 中的蓝色箭头)。叠加在图 1s 上的虚线表示图1r中的管状网络碎片的轮廓。y 结的一小部分拥有结束端子 (图 1t 中的黄色箭头), 随着时间的推移, 最终会收回 (图 1u)。图1 v 和1w 中可以观察到 v 型结点通过对两条线段的交点进行去值化和通过将形成 v 形的其中一个管撤回而将 v 结转变为单个直管。分别图 1x和1y。
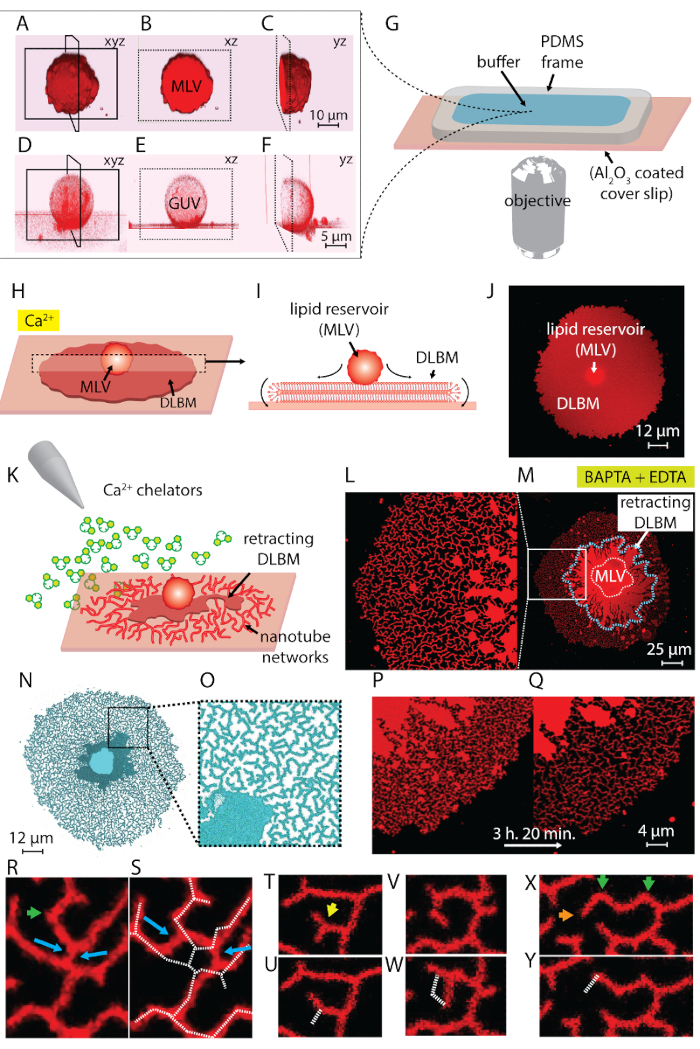
图 1: 脂质沉积转化为 er 样管状网络.(A-F)激光扫描共聚焦显微图的囊泡在初始样本中, 构建在3d。(A-C)多体脂质囊 (mlv, 脂质沉积) 分别在 xyz、xz 和 yz 平面。(D-F)类似的观点, 一个巨大的单形囊泡 (guv)。guv 的内部是空心的, 这使得扩散的脂质材料明显受限。因此, 这种方法有用的脂质库是 mlv. (g) 安装在倒置显微镜上的观察室的插图, 缓冲液和脂质沉积在显微镜上。该腔由固定在铝2o3 涂层盖板上的 pdms 框架组成, 提供一个开放的体积顶部.(H-J)mlv 传播现象的例证在 ca2 +的存在。(h) 在与铝 2o3接触时, mlv 以圆形双脂双层膜 (dlbm) 的形式自发传播.(i) xz 平面上 dlbm 的示意图侧视图, 外围在其中执行滚动运动。mlv (d = 5-15μm) 和 dlbm (厚度 = 10 nm) 没有被绘制到刻度。(j) 从顶视图传播的 dlbm 的共聚焦显微镜。(k) 描述本协议的主要步骤, 即将缓冲液交换到含有 ca 2 +螯合剂的步骤, 抑制扩散, 导致 dlbm 向 mlv 的收缩, 并导致脂质纳米管的形成。(L-Y)用所述方法得到的纳米管网络的显微图像。(l) 在框架中标记的 (m) 中区域的特写镜头。(l 和 m) 中的连续亮红色区域表示 dlbm (在 m 中也用蓝色虚线标记)。反演管网 (n 和 o) 的显微图, 以增加对比度。(p 和 q)描述膜区域管状密度在3小时和 20分钟 (r-y) 过程中的减少, 代表管状再安排。(r 和 s)通过收回一个终点将 y 结向 v 结点过渡, 并 (v 和 w) 将一个转折点的固定 (v 和 w) 断开, 从而消除 v 结点。(x 和 y)终点的收回。请点击这里查看此图的较大版本.
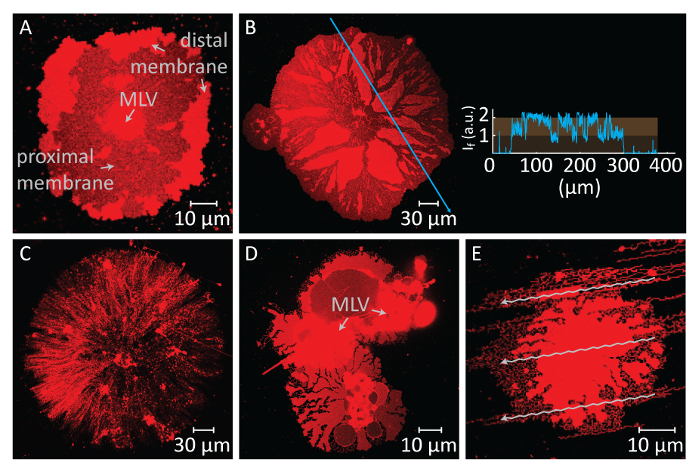
图 2: 潜在的负面结果.(a 和 b)由于在交换缓冲器之前等待的时间很长, 远端膜的破裂。破裂的区域, 其中近端膜变得可见, 出现作为黑暗的区域相比, 未破裂的远端膜区域。面板 b 的插入显示沿微图上的蓝色箭头的光强。膜破裂区域的强度 (近端单双层变得可见) 相当于未破裂膜 (远端/双双层) 强度的一半。(c) 由于从观察室中取出所有液体而形成的干脂质贴片的外观。(d 和 e)通过自动移液器快速交换缓冲液, 破坏膜。在 (d) 中, mlv 已分裂为 2 mlv, 导致非圆形、变形的脂质斑块。在 (e) 中, 由强注入螯合物 hepes 缓冲液产生的流动 (箭头) 模式反映在管状膜结构上。请点击这里查看此图的较大版本.
讨论
在下面的讨论中, 描述了协议的关键步骤、可能的修改和限制。第一个关键步骤是观察室的正确组装, 因为 pdms 框架与铝2o3 表面的粘附本质上是弱的。在框架不能正确粘附在基板上的情况下, 内容将从观察室泄漏, 实验将停止。阻碍表面和框架适当密封的主要因素是: 1) 缺乏对 (重复使用的) pdms 框架和 2) 气泡的彻底清洁, 而这些气泡偶尔会被夹住在框架和基板之间。应使用新准备或彻底清洁的 pdms 框架。每次使用异丙醇之前和之后, 应冲洗框架, 然后用 di 水冲洗, 用氮气吹干。铝 2o3表面不需要任何事先清洁, 因为它们是在洁净室环境中制造的, 并保存在密封的容器中, 直到使用.由于铝2o3 的两性性质, 它不应该暴露在强酸性或基本的溶液中。根据单个设置的可访问性, 可以使用观测室的其他设计。这个室的重要特点是从打开的顶部自由地访问液体样品, 以及框架材料相对于使用的溶液和样品的惰性。箱体尺寸也是一个重要因素, 因为它们应容纳0.5 至1毫升的体积。由于所使用的表面通常是标准尺寸的盖板 (24 x 60 mm), 因此箱体的体积主要由框架的厚度决定。据我们所知, 具有能够容纳此协议中通常处理的样本卷的大小和深度的间隔在商业上是不可用的。因此, 我们在协议中专门用一个部分来详细说明样品室框架的制造和组装。
此协议中的另一个关键步骤是缓冲区交换。此步骤中的一个挑战是执行此交换所需的时间。mlv 在与铝2o3 基板接触时的传播是即时的, dlbm 的持续扩展导致其破裂, 终止实验 (图 2a, b)。因此, 应不断监测传播情况, 必须及时进行缓冲区交换。在初始化传播后, 不应过于快速地进行交换, 以使膜贴片达到最佳尺寸 (直径为 100-200μm)。另一方面, 表面的连续粘附会导致膜的高张力, 从而导致破裂。因此, 所有的膜贴片最终破裂, 如果扩散不中断。每个补丁的破裂时间不同, 因为这取决于 mlv 的大小和内部结构以及其中脂质的可及性。因此, 交换的时刻应安排在一个时间点, 在这个时间点上, 具有最佳大小的未破裂补丁代表了整个种群的大多数。缓冲区交换步骤中的另一个挑战是缓冲区的删除和添加率。过快进行这种替代会对最终的膜结构产生不利影响 (图 2c-e)。过度提取 ca2 +-hepes 缓冲液, 而不在基板上留下薄膜, 导致干燥和不可逆转的变形膜斑块 (图 2c)。即使在表面保持适量的液体, 突然添加螯合物 hepes 缓冲器也会导致膜结构的扰动。图 2d,e显示了水动力破坏膜斑块的典型外观。整体形态破坏不一定影响最终结构的动态特性 (即剩余区域的管状重组仍将发生)。然而, 在变形结构上, 观察物质的转变将变得困难。例如, 在图 2d中, 很难确定 dlbm 缩回的 mlv 方向。
该协议的一个可能的修改是所使用的脂质组合物。主要关注的焦点是在哺乳动物和酵母16 (例如)中主导 er 成分的磷脂。g. 磷脂酰胆碱 (pc)、磷脂酰乙醇胺 (pe) 和磷脂酰肌醇 (pi)。采用 pc 和 pi 混合物4进行了原实验。结果表明, 采用了 pc 和 dope 的混合和 pe 的衍生物。然而, 并不是所有的任意脂质成分已被发现创造通过该协议获得的管状结构。其他一些实验研究的脂质混合物涉及总心脏提取物, 大豆提取物极性,大肠杆菌提取物极性, pc 与硬耳骨-2-羟基-甘油-3-磷肌醇 (lyso-pi) 的混合物在不同的比例, 和混合物按不同比例计算的 pc-pe-pi-papfatidyl 丝氨酸 (ps)。由于管状膜结构具有较高的曲率, 需要单独的脂质分子的特殊排列, 因此所观察到的现象预计是脂质成分特异性的。
该协议中应用的另一个修改是表面制造方法。在这里, ald 被用来制造铝2o3 涂层盖板 。这与最初报告的沉积方法--反应溅射 4--不同。虽然这表明, 替代表面制造方法仍然可以导致像 er 样的管, 一个重要的限制似乎是表面材料的特异性。粘附的传播方式和强度在很大程度上取决于表面材料的性能, 这影响了静电相互作用、润湿性、疏水性和表面粗糙度等因素。al2o3 表面提供最佳的粘附强度, 脂膜既能紧密地附着在一起, 以作为双脂质双层膜传播, 又能在去除 ca2 +离子时分离形成管状网络.我们以前用 sio2 试验了类似的实验, 其中多层囊泡作为双脂双层膜扩散, 但在添加螯合剂17时没有观察到管状网络的形成。仅在铝2o3 或等离子体蚀刻铝18上观察到去连接和管的形成。我们的调查显示, 导致这种现象的促成参数是表面的 zeta 电位, 其中铝和 al 2o3 接近零 ( mv), sio2明显为负值。硼硅酸盐的 zeta 电位与 sio219 相似;因此, 脂质膜对硼硅酸盐的粘附同样强烈且不可逆。事实上, 多层脂质储层与硼硅酸盐表面的接触通常会导致单脂质双层的立即破裂和形成.本协议所需的 al 2o3 表面不容易或在商业上可用.但是, 它们可以从特种玻璃和基材制造商处定制订购。我们强烈建议您使用带薄膜制造设备的洁净室设施。
其他现有的自下而上的方法来制造像 er 样管状网络2,10涉及蛋白质以及化学能的输入 (例如, gtp 和 atp)。rapoport 和他的同事 2报告了在玻璃覆盖物上通过将 er 中存在的膜弯曲蛋白与磷脂和 gtp 混合在体外形成的 er 网络。bachand等人的作品.10显示了如何利用分子马达和 atp 作为能量源来创建这种动态管状网络。该协议不要求膜蛋白或有机化合物水解的能源。唯一必不可少的成分是固体基板和磷脂。不需要纯化和提取蛋白质。该协议在本构分子的简单性方面提供了最基本的 er 模型。
建立了这种基于口红的基本 er 模型后, 通过添加与 er 相关的组件来提高复杂性是令人感兴趣的, 因为它可以调查对系统的个别影响。与实际的 er 网络类似, 模型中的管是动态的。标记的膜蛋白 (或整个管状网络中的荧光颗粒) 的共轭和迁移可能会提供有关膜运动方向的信息。在转换过程中封装和监测 dlbm 和管内的荧光液体, 并可能对管内内容传输进行映射, 这可能是另一个焦点。最后, 通过对水凝胶体系结构中的网络封装, 可以从该协议产生的 2d er 模型向三维平滑 er 模型过渡。
披露声明
作者没有什么可透露的。
致谢
我们感谢瑞典查尔莫斯技术大学的阿尔多·耶索卡教授对手稿的宝贵评论。这项工作是通过挪威研究理事会 (Forskningsrådet) 项目赠款274433提供的, uio: 生命科学融合环境, 瑞典研究理事会 (Vetenskapsrådet) 项目赠款 2015-04561,以及挪威分子医学中心 & 奥斯陆大学数学和自然科学系提供的启动资金。
材料
| Name | Company | Catalog Number | Comments |
| Pear-shape flask 10 mL | Lenz Laborglasinstrumente | 3.0314.13 | In which the lipid mixture is prepared |
| Hamilton 5 mL glass syringe (P/N) | Hamilton | P/N81520 | For transfer of the chloroform to beaker |
| Custom large hub needle Gauge 22 S | Hamilton | 7748-18 | Removable needle for syringe specified in row 3 |
| Hamilton 250 µL glass syringe | Hamilton | 7639-01 | Used for transfer of lipids in chloroform to the flask |
| Large hub Gauge 22 S | Hamilton | 7780-03 | Removable needle for syringe specified in row 5 |
| Hamilton 50 µL glass syringe | Hamilton | 7637-01 | Used for transfer of fluorophore-conjugated lipids to the flask |
| Small hub Gauge 22 S | Hamilton | 7770-01 | Removable needle for syringe specified in row 7 |
| Chloroform anhydrous (≥99%) | Sigma-Aldrich | 288306 | Used to complete the lipid mixture to a total of 300 µL |
| Soy L-α Phosphatidyl choline lipid (Soy PC) | Avanti Polar Lipids Inc | 441601 | phospholipid species contributing to 69% of the total composition/mixture |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE) | Avanti Polar Lipids Inc | 850725 | phospholipid species contributing to 30% of the lipid composition/mixture |
| L-α Phosphatidyl inositol lipid (Soy PI) | Avanti Polar Lipids Inc | 840044 | alterative phospholipid species contributing to 30% of the lipid composition/mixture (from the original article Bilal and Gözen, Biomaterials Science, 2017) |
| Texas Red 1,2-dihexadecanoyl-sn-glycero-3-phosphoethanolamine,triethylammonium salt (Texas Red DHPE) | Invitrogen (Thermo Fisher Scientific) | T1395MP | Fluorescent-lipid conjugate, 1% of the lipid composition/mixture |
| Digital Dry Baths/Block Heaters | Thermo Fischer | 88870006 | To warm glycerol in order to decrease its viscosity |
| Glycerol for molecular biology (≥99%) | Sigma Life Science | G5516 | For lipid preparation |
| PBS buffer (pH=7.8); ingredients below in rows 17-21 | Used to prepare the lipid suspension | ||
| TRIZMA base, primary standard and buffer (≥99%) | Sigma Life Science | T1503 | Used to prepare PBS buffer |
| Potassium phosphate tribasic, reagent grade (≥98%) (K3PO4) | Sigma-Aldrich | P5629 | PBS buffer ingredient |
| Magnesium sulfate heptahydrate, BioUltra (≥99,5%) KT (MgSO47H2O) | Sigma Life Science | 63138 | PBS buffer ingredient |
| Potassium phosphate monobasic, anhydrous, free flowing, Redi-Dri, ACS (KH2PO4) | Sigma-Aldrich | 795488 | PBS buffer ingredient |
| Ethylenediaminetetraacetic acid disodium salt dihydrate ACS reagent, 99.0-101.0% (Na2EDTA) | Sigma-Aldrich | E4884 | PBS and Chelator-HEPES buffer ingredient |
| Ultrasonic cleaner USC-TH | VWR | 142-0084 | Ultrasonication of rehydrated lipids |
| Rotary evaporator - Büchi rotary evaporator Model R-200 | Sigma | Z626797 | For evaporation of chloroform |
| Pressure meter - Vacuum regulator IRV-100 | SMC | IRV10/20 | For controlling the pressure value during lipid dehydration |
| HEPES-buffer (pH=7.8); ingredients below in rows 26-27 | Used for rehydration of lipids. Content: 10 mM HEPES with 100 m NaCl diluted in ultrapure deionized water | ||
| HEPES ≥99.5% (titration) | Sigma Life Science | H3375 | HEPES-buffer ingredient |
| Sodium chloride for molecular biology, DNase, RNase, and protease, none detected, ≥98% (titration) (NaCl) | Sigma Life Science | S3014 | HEPES-buffer ingredient |
| Calcium-HEPES buffer (pH=7.8); effective ingredient below in row 29 | Used for spreading of lipids. Content: 10 mM HEPES, 100 mM NaCl, 4 mM CaCl2 diluted in ultrapure deionized water | ||
| Calcium chloride anhydrous, BioReagent, suitable for insect cell culture, suitable for plant cell culture, ≥96.0% (CaCl2) | Sigma Life Science | C5670 | To prepare Calcium-HEPES buffer |
| Chelator-HEPES buffer (pH=7.8); effective ingredient below in row 31 | Used to promote the formation of tubular networks. Content: 10 mM HEPES, 100 mM NaCl, 10 mM EDTA and 7 mM BAPTA diluted in ultrapure deionized water | ||
| 1,2-Bis(2-aminophenoxy)ethane-N,N,N′,N′-tetraacetic acid tetrasodium salt ≥95% (HPLC) (BAPTA-Na4) | Sigma Life Science | 14513 | Chelator-HEPES buffer ingredient |
| Sodium Hydroxide | Sigma | 30620 | Basic solution used to adjust the pH of the buffers |
| pH meter accumet™ AE150 pH | Fisher Scientific | 1544693 | Used to measure the pH of all buffers |
| Glass petri dish | VWR | HECH41042012 | 6 cm, used for making the PDMS sheet |
| Potassium hydroxide ACS reagent, ≥85%, pellets (KOH) | Sigma-Aldrich | 221473 | To make the KOH solution for cleaning glass petri dish for the fabrication of the PDMS sheet |
| Isopropanol prima ren 99.5% | Antibac AS | 600079 | KOH solution ingredient |
| Heating and drying oven - venticell | MMM Medcenter Einrichtungen GmbH | MC000714 | For drying of the glass petri dish after silanization and to cure PDMS |
| Dichlorodimethylsilane ≥99.5% | Sigma-Aldrich | 440272 | Used for silanization of glass petri dish in which PDMS sheet is prepared |
| Vacuum pump | Cole-Parmer | EW-79202-05 | Connected to desiccator |
| Sylgard 184 silicone elastomer curing agent | Dow corning | 24236-10 | Kit to make PDMS solution |
| Sylgard 184 Silicone elastomer base | |||
| Disposable scalpel | Swann-Morton | 11798343 | Used to cut the PDMS |
| Cover slips | Menzel -Gläser | MEZ102460 | 24x60 mm. Used to deposit thin film of Al2O3 |
| Atomic layer deposition system | Beneq | TFS200 (model number) | Atomic Layer deposition system used to deposit thin film of Al2O3 in microscope cover glass |
| Ellipsometer | J.A. Woollan Co. | Alpha-SE (model name) | System used to charcaterize the thickness of the film deposited on glass surface |
| Laser scanning confocal microscope | Leica Microsystems | Leica TCS SP8 X | Microscope used for visualization of the experiment |
| Objective 40x, 1.3 NA | Leica Microsystems | 1550635 | Used for visualization of the experiment |
| White light laser source | Leica Microsystems | Leica TCS SP8 X | For excitation of the membrane fluorophore |
参考文献
- Chen, S., Novick, P., Ferro-Novick, S. ER structure and function. Current Opinion in Cell Biology. 25 (4), 428-433 (2013).
- Powers, R. E., Wang, S., Liu, T. Y., Rapoport, T. A. Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature. 543 (7644), 257-260 (2017).
- Pendin, D., McNew, J. A., Daga, A. Balancing ER dynamics: Shaping, bending, severing, and mending membranes. Current Opinion in Cell Biology. 23 (4), 435-442 (2011).
- Bilal, T., Gözen, I. Formation and dynamics of endoplasmic reticulum-like lipid nanotube networks. Biomaterials Science. 5 (7), 1256-1264 (2017).
- Shibata, Y., et al. Mechanisms determining the morphology of the peripheral ER. Cell. 143 (5), 774-788 (2010).
- Ozcan, L., Tabas, I. Role of endoplasmic reticulum stress in metabolic disease and other disorders. Annual Review of Medicine. 63, 317-328 (2012).
- Yamanaka, T., Nukina, N. ER dynamics and derangement in neurological diseases. Frontiers in Neuroscience. 12, (2018).
- Taalab, Y. M., et al. Mechanisms of disordered neurodegenerative function: Concepts and facts about the different roles of the protein kinase RNA-like endoplasmic reticulum kinase (PERK). Reviews in the Neurosciences. , (2018).
- Shemesh, T., et al. A model for the generation and interconversion of ER morphologies. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 5243-5251 (2014).
- Bouxsein, N. F., Carroll-Portillo, A., Bachand, M., Sasaki, D. Y., Bachand, G. D. A continuous network of lipid nanotubes fabricated from the gliding motility of kinesin powered microtubule filaments. Langmuir. 29 (9), 2992-2999 (2013).
- Sackmann, E. Endoplasmatic reticulum shaping by generic mechanisms and protein-induced spontaneous curvature. Advances in Colloid and Interface Science. 208, 153-160 (2014).
- Jesorka, A., et al. Generation of phospholipid vesicle-nanotube networks and transport of molecules therein. Nature Protocols. 6, 791 (2011).
- Hook, D. A., Olhausen, J. A., Krim, J., Dugger, M. T. Evaluation of Oxygen Plasma and UV Ozone Methods for Cleaning of Occluded Areas in MEMS Devices. Journal of Microelectromechanical Systems. 19 (6), 1292-1298 (2010).
- Gözen, I., et al. Fractal avalanche ruptures in biological membranes. Nature Materials. 9 (11), 908-912 (2010).
- Lobovkina, T., Dommersnes, P., Joanny, J. -. F., Hurtig, J., Orwar, O. Zipper Dynamics of Surfactant Nanotube Y Junctions. Phys Rev Lett. 97, (2006).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews Molecular Cell Biology. 9 (2), 112-124 (2008).
- Gözen, I., et al. Repair of large area pores in supported double bilayers. Soft Matter. 9 (10), 2787-2792 (2013).
- Gözen, I., et al. Thermal migration of molecular lipid films as a contactless fabrication strategy for lipid nanotube networks. Lab on a Chip. 13 (19), 3822-3826 (2013).
- Sides, P. J., Hoggard, J. D. Measurement of the Zeta Potential of Planar Solid Surfaces by Means of a Rotating Disk. Langmuir. 20 (26), 11493-11498 (2004).
- Nissen, J., Jacobs, K., Rädler, J. O. Interface Dynamics of Lipid Membrane Spreading on Solid Surfaces. Physical Review Letters. 86 (9), 1904-1907 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。