Method Article
Formación espontánea y cambio de redes de nanotubos lipídica Artificial como un modelo Bottom-Up de retículo endoplasmático
En este artículo
Resumen
Apoyo sólido, libre de proteína, dobles membranas de bicapa de fosfolípidos (DLBM) pueden transformarse en redes de nanotubos de lípidos complejos y dinámicos y pueden servir como modelos 2D de abajo hacia arriba del retículo endoplasmático.
Resumen
Presentamos un método conveniente para formar un modelo de organelas estructural ascendente para el retículo endoplásmico (ER). El modelo consiste en nanotubos lipídicos altamente densos que son, en términos de morfología y dinámica, de ER. Las redes son derivadas de parches de membrana de doble bicapa de fosfolípido adhiriéndose al sustrato transparente Al2O3 . La adhesión es mediada por Ca2 + en el búfer de ambiente. Agotamiento posterior de Ca2 + por medio de BAPTA/EDTA causa retracción de la membrana, dando por resultado la formación de redes de nanotubos lipídica espontánea. El método sólo está formado por fosfolípidos y recientemente las superficies para la formación simple de un modelo de ER y no requiere la adición de proteínas o energía química (por ejemplo, GTP o ATP). En contraste con la morfología 3D del retículo endoplásmico celular, el modelo es bidimensional (aunque se mantiene las dimensiones de los nanotubos, geometría, estructura y dinámica). Este modelo único en vitro ER consiste en sólo unos pocos componentes, es fácil de construir y se observan bajo un microscopio de luz. La estructura resultante puede ser aún más decoración, funcionalidad adicional, como la adición de proteínas asociadas a ER o partículas para estudiar fenómenos de transporte entre los tubos. Las redes artificiales descritas aquí son modelos estructurales adecuados para el celu ER, cuya morfología característica única se ha demostrado para ser relacionados con su función biológica, mientras que los detalles sobre la formación del dominio tubular y todavía se entienden los cambios dentro. Observamos que este método utiliza Al2O3 microscopía fino-recubiertos con película cubreobjetos, que están comercialmente disponibles pero requieren pedidos especiales. Por lo tanto, es recomendable tener acceso a una instalación de microfabricación para preparación.
Introducción
La sala de urgencias se lleva a cabo tareas vitales en la célula biológica incluyendo el plegamiento de la proteína, síntesis de lípidos y calcio regulación1,2. La morfología de la ER es inherente a las funciones que realiza. Combina pilas planas y dominios tubulares denso-dinámico, que continuamente interactúan con el citoesqueleto y someterse a cambio y movimiento constante. Algunas de la remodelación que se someten las estructuras ER incluyen la transformación continua entre las hojas planas y tubos, la formación de vesícula o fusión al lumen del re, elongación de los tubos existentes, retracción del tubo, fusión y rotura3. La peculiar estructura de las redes tubulares es enérgio desfavorable. Las vías y mecanismos por el cual la sala de emergencia genera y mantiene que esta organización y cómo esto se relaciona con su función no es todavía comprendido de4,5.
Es conocido que el ER funciona mal cuando pierde su estado homeostático, lo que resulta en estrés de ER, una condición causada por un aumento en la síntesis de proteínas, acumulación de proteínas mal plegadas, o cambios en el equilibrio oxidativo y Ca2 + . ER el estrés a su vez causa deformación de la morfología natural de las organelas, específicamente por perturbar la red organización6,7. Como respuesta, la célula activa un mecanismo de reparación para volver a un estado homeostático. Fracaso en la reparación puede conducir a la apoptosis celular inducida por ER, que contribuye a varias enfermedades metabólicas y degenerativas como la enfermedad de Alzheimer, diabetes tipo 2, enfermedad de Parkinson, esclerosis lateral amiotrófica y varios otros7, 8. La investigación actual apunta a la organización de las redes tubulares de ER, y varios estudios se están centrando en reconstituyendo las ER in vitro2. Existen unos modelos2,9,10 requieren proteínas para iniciar y mantener la curvatura de la membrana3,11 y El organelo Ayude a llegar a su forma. Claramente, el modelo de los sistemas que reflejan algunas de las principales características estructurales y de organización de la sala de emergencia y facilitar el acceso a estudios experimentales avanzados está en gran demanda.
Aquí presentamos los procedimientos para la preparación de un simplista, proteína químico energía libre, dinámico en vitro modelo ER, proporcionando una plataforma básica para estudiar la morfología de ER y las funciones asociadas4. En este método, un modelo de ER se fabrica con un enfoque de abajo hacia arriba usando sólo unos pocos elementos, en el cual las moléculas de interés pueden ser integradas para añadir complejidad. La red representa la dinámica y estructura de ER. Además, transformación reversible entre la membrana planar y los tubos, formación de vesículas desde los tubos, tubo de fusión, desplazamiento y contracción todos se observan. Además de servir como un modelo de abajo hacia arriba para el ER celular incompleto entendido, la ruta de lípidos a las redes de nanotubos descritos en el presente Protocolo puede ser aplicable a los investigadores estudiar autoensamblaje, nanofluídica, una sola molécula y coloide fenómenos de transporte, flujo de Marangoni y otros campos relacionados. Los bloques sólo moleculares utilizados en nuestro método son fosfolípidos. El protocolo requiere trabajo de laboratorio poco y equipamiento básico y es accesible para la incorporación de elementos adicionales.
Protocolo
1. preparación de la suspensión de vesículas de fosfolípidos
Nota: Para todos los materiales que se refiere como "limpio" en el presente Protocolo, bien lavarlos con isopropanol seguido de agua desionizada y secar con nitrógeno. Tenga en cuenta que no se debe realizar un tratamiento de substratos de vidrio con agentes ácidos (solución Piraña), fuertemente oxidantes que se aplica normalmente en los protocolos de preparación para las películas lipídicas en sustratos sólidos, Al2O3-revestido portadores.
- Lugar en un matraz de fondo redondo o invertida en forma de pera de vidrio de 10 mL limpio: fosfatidil colina (PC, 69% w/w), 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (droga, 30% w/w) y un fluoróforo lípidos conjugados de elección [por ejemplo, Texas Red 1,2 - soja L-α sal de dihexadecanoyl-sn-glycero-3-phosphoethanolamine Trietilamonio (TR-DHPE, 1% w/w)] en cloroformo; por un monto total de 3000 mg de lípidos en 300 μL de cloroformo, lo que resulta en una concentración final de 10 mg/mL.
Nota: Utilice, limpia vidrio, jeringas gas tight con pistones politetrafluoetileno al manejar compuestos que contienen cloroformo.
PRECAUCIÓN: El cloroformo es tóxico y altamente volátil y siempre debe ser manejado bajo una campana de humos con equipo de protección personal asociado. - Conectar el matraz de un rotavapor, posición con una inclinación de 45° y girar a 24 rpm dentro de un baño de agua a 23 ° C durante 6 h con presión de aire reducida lentamente y remover completamente el cloroformo. Empezar a reducir el derecho de presión después de iniciar la rotación por pasos de 20 kPa cada 2 min hasta llegar a 20 kPa (150 Torr, 80% de vacío).
Nota: La formación de una película lipídica homogénea de espesor uniforme en el recipiente de preparación es el requisito más importante para el procedimiento de rotavapor. Preparados de lípidos son sensibles a la velocidad de rotación, cambios rápidos de presión y presión final valor; por lo tanto, seguir estrictamente los pasos de reducción lenta así como la velocidad de rotación y presión final. Coloque el matraz con una inclinación de 45° para garantizar que el pastel de lípidos deshidratado se forma uniformemente como una película en la pared del frasco. Demasiado rápido de una rotación conduce a turbulencias y una rotación muy lenta conduce (debido a la gravedad) a la acumulación de una gruesa capa de líquido en la parte inferior del matraz. Durante la noche posterior hinchazón proceso, un lípido no muy homogéneo masa produce que no responden bien a la etapa final de sonicación, y las fracciones resultantes son de diferentes composiciones. Presión y tiempo dentro de la gama especificada en el método asegura desolvation lento. Con cloroformo como disolvente, muy rápidos de una caída de presión se haya enfriado la mezcla, dando por resultado aumento de la viscosidad y formación global y desigual de la película. El período de tiempo de 6 h se recomienda para eliminar el solvente en la mayor medida posible, las particiones de solvente orgánicas en el material lipídico en la rehidratación. - Después de 6 h, parar la rotación y aumentar la presión de aire otra vez, poco a poco, en pasos de 20 kPa cada 2 min hasta llegar a 100 kPa. Quitar el matraz del evaporador rotatorio y añadir 3 mL de PBS y 30 μl de glicerol. Agitar suavemente el frasco para disolver el glicerol. Use un tapón de cristal hermético para sellar el frasco que contiene los lípidos.
Nota: La glicerina se usa para prevenir la deshidratación completa de la película lipídica y permite bicapa separación12. Deben ser calentado antes de su uso para disminuir su viscosidad, que facilita el manejo de este compuesto. El glicerol caliente todavía no inmediatamente mezcle con el tampón de PBS. Agitación suave es necesario hasta que la glicerina se haya disuelto completamente. - Guarde el frasco en el refrigerador a 4 ° C durante la noche para la rehidratación y la hinchazón de las películas de lípidos.
- Al día siguiente, someter a ultrasonidos los lípidos con un baño de ultrasonidos a temperatura ambiente (RT, ~ 21 ° C) y en frecuencia de 35 kHz hasta lograr una suspensión uniforme, ligeramente turbio del lípido.
Nota: Sonicación puede tomar alrededor de 10-30 s. sonicación prolongada (~ 1 min) produce calor y es perjudicial para la formación de la vesícula. - Pasos 1.1-1.5 rendimiento una suspensión que contiene dos tipos de estructuras vesiculares: vesículas multilamellar (MLV) y vesículas gigantes unilaminar (GUV) (figura 1A 1F).
- Para el almacenamiento, la suspensión lipídica se dividen en alícuotas de 100 μl, con un total de 30 tubos de microcentrífuga y almacenar en un congelador a-20 ° C.
Nota: Flash congelación con nitrógeno líquido no es necesario y no se usa antes del almacenamiento. El protocolo puede hacer una pausa aquí. Dejando suspensiones de lípidos en el refrigerador de 4 ° C para prolongados tiempos causas lisis de lípidos, que afecta la composición de la membrana.
2. preparación de sustratos
Nota: El siguiente protocolo se realiza en una sala limpia clasificada como ISO 8 en la especificación estándar de ISO 14644-1. Deposición de capa atómica (ALD) se utiliza para fabricar sustratos de Al2O3 . Los parámetros de proceso especificado dependen del instrumento y pueden variar entre diferentes modelos de equipos. Pueden ser utilizados como parámetros iniciales para desarrollar el proceso.
- Ajustar la temperatura del reactor ALD a 200 ° C.
- Carga las superficies de vidrio (por ejemplo, el vidrio cubreobjetos) en la cámara de muestra junto con una oblea de silicio, que se utilizará más adelante como superficie de referencia para determinar el espesor de la deposición por Elipsometría.
Nota: Substratos de vidrio fueron usada hacia fuera-de-la-caja y no fueran solvente limpiado antes de la deposición. Sólo se lava con nitrógeno para eliminar las partículas. - Evacuar la cámara de carga hasta 400 Pa (3 torres) y transferir las muestras en la cámara de reacción principal y evacuar a 200 PA.
Nota: Debe mantenerse la temperatura del reactor a 200 ° C para la deposición adecuada. Fluctuaciones de temperatura después de carga de la muestra debe equilibrarse por lo tanto antes de iniciar la deposición. Presión de la cámara está llamada a ser más alta que la presión del reactor para evitar cualquier precursores a difundir fuera de la cámara. - Empezar a depositar la película atómica. Un ciclo consiste en una exposición de 150 ms pulso trimetil aluminio, seguida de una purga de s 1 y posteriormente, una exposición de2O de H de 200 ms de duración seguido de una purga de s 1.
Nota: Todas las configuraciones incluyendo la cámara y reactor de presión, longitud de los ciclos y las purgas son automatizados para lograr una tasa definida de deposición. Estos parámetros pueden variar entre los distintos modelos de equipos. Las recetas preconfiguradas a menudo preparadas por el proveedor o responsable en la habitación de la herramienta y comunicadas al usuario como espesor de la película depositada por unidad de tiempo. - Para llegar a 10 nm de Al2O3 en el substrato, repita el proceso para 100 ciclos. El número de ciclos depende de la tasa de deposición, que puede variar entre diferentes recetas o equipo.
- Para quitar las muestras del reactor, primera salida de la cámara hasta que la presión alcanza la presión atmosférica, luego retire las muestras.
- Almacenar las muestras en recipientes herméticos a temperatura ambiente hasta su uso.
Nota: Se recomienda no limpiar antes de usar. El protocolo puede hacer una pausa aquí.
Nota: Las muestras idealmente deben utilizarse inmediatamente después de la deposición. El almacenamiento óptimo requiere posicionamiento las superficies del interior portadores de oblea polipropileno, seguidos por envolviendo los portadores en sala limpia compatible con bolsas de plástico, que son nitrógeno-irrigar antes del sellado de vacío. El propósito es evitar exponer la superficie a contaminantes del aire. Si es necesario, las superficies pueden conservarse en recipientes herméticos a temperatura ambiente como máximo 5 días. No se recomienda un almacenaje más largo. Para los usuarios que no tienen fácil acceso a una habitación cercana y comprar u obtener las superficies del exterior, volver a oxidar los substratos mediante tratamiento con oxígeno ozono o plasma puede ser una solución alternativa13.
3. transformación de las películas de fosfolípidos moleculares a las redes tubulares
- La suspensión lipídica de descongelar y transferir una gota 4 de μl de la suspensión en un microscopio diapositiva/cubreobjetos de vidrio limpio.
- Secar la gota durante 20 minutos. La gota se derrumbará en una película plana circular de lípidos después de la desecación, que es visible para el ojo.
- Rehidratar la película lipídica con 1 mL de tampón HEPES (véase Tabla de materiales) por 3 minutos.
Nota: El volumen de rehidratación tampón afecta la densidad de la suspensión de la vesícula (el número de vesículas por unidad de volumen), que posteriormente es transferido a la cámara de observación. Según el volumen de la cámara de observación y la densidad deseada de la vesícula, el volumen de rehidratación puede ajustarse al 0.5-1 mL. Diapositivas de borosilicato limpio tienden a apoyar gotas de varios cien microlitros hasta 1,5 mL sin problemas. Puesto que el cubreobjetos no necesita moverse, esto no conduce a un problema técnico. En superficies más hidrofóbicas, tales como SU-8 portaobjetos recubiertos con polímeros, incluso 1,5 mL puede ser depositado12.
Nota: Los lípidos deben ser recién preparados, como exposición de la película lipídica rehidratado por más de 20 min a temperatura ambiente conduce a la evaporación del búfer y deshidratación parcial de las vesículas previamente rehidratadas, que conduce a una mal definida la composición. - Preparar la sala de observación: para permitir intercambio de buffer por medio de una pipeta automática, que es necesaria para iniciar la transformación de ER, se utilizó una cámara de observación con una parte superior abierta. Esta cámara consiste en un marco de polidimetilsiloxano (PDMS) de dimensiones 1,5 x 1,5 x 0,5 cm, adheridos en Al2O3 depositado cubreobjetos. Un esquema de la cámara de observación montado es representado en la figura 1G. Se realizaron los siguientes pasos para fabricar el marco PDMS y montar la cámara de observación:
- Preparar una solución KOH al mezclar 100 g de KOH con 100 mL de isopropanol en un vaso en un baño de hielo. Revolver durante 10 h o más hasta que el KOH se disuelve completamente con un agitador magnético y una placa de agitación magnética.
PRECAUCIÓN: Solución de KOH es corrosivo y puede provocar quemaduras en la piel, manejar siempre con equipo de protección personal adecuado.
Nota: La solubilidad de KOH en isopropanol no es tan alta como en agua. La disolución es exotérmica. Los pellets KOH antes de la disolución y agitación continua de trituración es recomendable. - Sumerja un plato de Petri de vidrio (d = 6 cm) en la solución KOH en RT y mantener durante la noche.
- Al día siguiente, retire el plato de vidrio de la solución, sumergirlo en un recipiente con agua desionizada durante 5 min, enjuagar varias veces con agua y colocarlo dentro de un horno de secado a 80 ° C por 1 h. golpe la superficie brevemente con una corriente de nitrógeno para asegurar esa parte icles se eliminan.
- Para apaciguar la superficie y evitar la vinculación a PDMS, transfiera 200 μL de dimetildiclorosilano con una jeringa de plástico en un recipiente plástico limpio como un barco de carga.
- Almacene el vidrio de Petri junto con silano para 1 h en un desecador de vacío (vacío bajo, ~ 20 kPa).
PRECAUCIÓN: Dimetildiclorosilano es tóxico y siempre debe ser manejado bajo una campana de humos con equipo de protección personal asociado. - Espere 15 minutos antes de recoger la placa de Petri en orden para el vapor de dimetildiclorosilano restante se disipe. La caja Petri está ahora silanizada y la superficie es hidrófoba.
Nota: Una forma rápida de comprobar el éxito de este paso es colocar una gotita de agua en el silanizada de Petri. El ángulo de contacto de la gota con la superficie debe aumentar visiblemente comparado con el vidrio sin tratar. - En un envase de plástico 250 mL (transparente vaso de plástico fresco del paquete), mezclar 10 g de base de elastómero de silicona con 1 g de agente de curado de elastómero de silicón (10:1). Revuelva con una espátula plástica/agitador durante 5 minutos.
Nota: Se forman burbujas de aire sobre la agitación y el PDMS se verá pálido-blanco. - Desecar la mezcla desgasificación en < 20 kPa hasta que se han derrumbado todas las burbujas de aire creciente (mayor vacío acelera el proceso). Vierta la mezcla desgasificada en silanizada de Petri.
- La curación a 65 ° C por 2 h en un horno.
Nota: Es posible duplicar la velocidad de curado mediante el aumento de la temperatura a > 95 ° C. La temperatura de curado aumento resulta en un aumento en la rigidez del material. - Enfriar la placa de Petri con el PDMS curado a RT y retire la placa PDMS con una espátula.
- Con un bisturí, cortar el marco de las dimensiones y geometría adecuada para la apertura disponible en la platina del microscopio. Dimensiones de 1,5 (largo) x 1,5 (ancho) x 0,5 cm (altura) es conveniente para la mayoría de configuraciones.
- Traer el lado liso (la parte que estaba en contacto con la placa de Petri) de los PDMS del marco en contacto con el lado activo de la superficie donde se encuentra la película de Al2O3 y suavemente aplique presión para empujar el marco y la superficie contra la otra para hacerlos cumplir.
Nota: La adherencia entre el marco PDMS y el Al2O3 substrato es débil. La presencia de burbujas de aire en la interfase de contacto puede provocar la fijación y, en consecuencia, la salida del búfer y contenido relacionado. El marco PDMS puede usarse varias veces si inmediatamente después y antes de cada uso enjuagar con isopropanol, seguido de enjuague con agua desionizada y secado con nitrógeno. Silanizada de Petri también puede ser reutilizado.
- Preparar una solución KOH al mezclar 100 g de KOH con 100 mL de isopropanol en un vaso en un baño de hielo. Revolver durante 10 h o más hasta que el KOH se disuelve completamente con un agitador magnético y una placa de agitación magnética.
- Llene la cámara de observación con el Ca2 +- HEPES almacenador intermediario (véase Tabla de materiales).
Nota: La superficie debe utilizarse inmediatamente después de unsealing el paquete. Contacto con el aire conduce a la adsorción de contaminantes, que disminuye progresivamente la actividad de la superficie. La cámara debe llenarse con tampón inmediatamente después del montaje. No llene el volumen entero para permitir la adición de los lípidos rehidratados en el paso posterior. - Coloque la cámara sobre la platina del microscopio confocal. Transferir el material lipídico rehidratado, ahora una suspensión que contiene vesículas gigantes, en la cámara con una pipeta de Pasteur (figura 1A-1 G) de plástico.
- Esperar 10-20 minutos para permitir que las vesículas se adhieren sobre el substrato y repartidos en la superficie (figura 1H-1J).
Nota: La difusión comienza inmediatamente después de la deposición de lípidos en la superficie. La tasa de propagación puede variar ligeramente dependiendo de la composición de lípidos, Al2O3 técnica de depósito (ADL, deposición de vapor químico, RF-sputtering, etcetera), frescura del sustrato y la concentración de cationes divalentes en la memoria intermedia. Asegúrese de que cambio de tampón se realiza antes de ruptura de separarse parches14. - Después de observar varias extensiones de lípidos, Extraiga lentamente el búfer de ambiente a través de una pipeta automática, tal que sólo una película fina tampón permanece en la parte inferior.
Nota: La rápida eliminación de búfer perturba las estructuras de lípidos en la superficie. - Proceder al intercambio de amortiguamiento ambiental por poco a poco llenando la sala de observación con tampón HEPES quelante (véase Tabla de materiales) con una pipeta automática (figura 1K).
Nota: Abrupto adición de tampón perturba las estructuras de lípidos en la superficie. - Este último paso da nanotubulares dinámico redes, formadas como resultado de la inducida por el quelante depinning y retracción de la DLBM a MLV4 (figura 1L-1Y).
4. microscopía observación
- Adquirir las imágenes con un láser invertido microscopio confocal con un 40 X objetivo de inmersión de aceite (NA 1.3) con una frecuencia de exploración de 400 Hz. Emplee una fuente blanca luz láser para excitar el DHPE rojo de Texas a 595 nm. Recoger la emisión de 605 a 700 nm utilizando un detector del fotón de híbrido.
Nota: Como alternativa, un microscopio de epi-fluorescencia puede utilizarse para la proyección de imagen. Dependiendo de las fuentes de luz disponibles, seleccione un conjugado apropiado lípido-colorante.
Resultados
La suspensión lipídica obtenida en el paso 1 del protocolo y utilizados en los experimentos contiene dos tipos de vesículas: MLV y 2.fino. Figura 1 A-1F muestra láser de barrido confocales micrografías de las vesículas en la muestra inicial construido en 3D. Figura 1 A-1_C muestra un MLV (depósito de lípidos) en xyz, xz y yz planos, respectivamente. Figura 1 D-1F muestra vistas similares a una vesícula unilaminar gigante (GUV). La parte interna de la 2.fino, que carecen de multilamellarity, es hueca; por lo tanto, el material lipídico para separarse es considerablemente limitado. Por lo tanto, los depósitos de lípidos sólo es útil para este método son proveedores de servicios multilingües.
Cuando la suspensión lipídica es transferida a la sala de observación con el Ca2 +- HEPES tampón (figura 1G), el MLV (figura 1A-1_C) comienza a asentarse en la superficie de Al2O3 . Al entrar en contacto, las vesículas se adhieren a la superficie, y una membrana de bicapa lipídica plana doble circular (DLBM) comienza a difundir de cada MLV sobre el soporte sólido (figura 1H-1J). El MLV actúa como un reservorio que proporciona los lípidos para la expansión DLBM. La membrana distal bicapa (superior), con respecto al soporte sólido, está conectada a la proximal membrana bicapa (inferior) a lo largo de la circunferencia del borde circular, realizando un movimiento de balanceo (figura 1). Las dos bicapas se colocan de plano uno encima del otro, teniendo sólo una fina película de líquido encapsulada entre ellos. Durante la propagación, la membrana proximal continuamente se adhiere a la superficie de apoyo, mientras que la membrana distal se tira lateralmente en los bordes del expansión borde proximal de la membrana. Separarse de la DLBM es mediado por el Ca2 +, que actúa como un agente fusogénicas entre grupos principales lípidos de la membrana proximal y sustrato sólido4.
Si la propagación continúa por períodos prolongados, la membrana de tensión aumenta, llevando a rupturas (figura 2A y 2B). Después de que el punto, retracción de la membrana, que es necesario crear la morfología tubular de ER, ya no puede ser inducida. Por lo tanto, es importante reconocer la rotura de membranas. Ya que la fluorescencia se etiquetan los lípidos en nuestros experimentos, la ruptura puede observarse directamente. Un indicador clave de ruptura es el descenso en la intensidad de fluorescencia en la región de ruptura (figura 2A y 2B)14. La ruptura es el resultado del aumento de la tensión y la formación posterior del poro en la membrana distal. Bajo un microscopio de fluorescencia, las regiones rotas por lo tanto, exhibirá la mitad la intensidad de emisión (bicapa individual proximal) de la regiones unruptured (doble bicapa)14 (figura 2B). Durante la formación del poro, el material de la membrana, que fue colocado inicialmente en las regiones rotas, migra a los bordes del parche que se separa. Esto a su vez provoca un crecimiento de la superficie total del parche. Por lo tanto, también puede observarse una rápida expansión del contorno del parche circular durante la ruptura.
Para evitar el crecimiento extenso que lleva a la ruptura de los parches, inmediatamente después de que el área del parche circular alcanza 100-200 μm, el búfer de Ca2 +- HEPES se retira suavemente con una pipeta automática hasta una fina película de líquido queda en la superficie. El buffer quelante-HEPES suavemente luego se añade a la cámara para iniciar la contracción (figura 1K). Una deshidratación total de la muestra (figura 2C) o intercambio rápido de buffers (figura 2D y 2E) causa disturbio, ruptura o deformación de los parches. La adición de quelantes gradualmente elimina el Ca2 + el espacio entre la superficie y la membrana. El buffer quelante-HEPES accesos gradualmente el espacio inter-bilayer-sustrato, a partir de la periferia del parche de membrana lipídica. Por lo tanto, la eliminación de los sitios de fijación se inicia desde los bordes del parche circular y se propaga hacia el interior (figura 1K-1Q). Como resultado de la depinning, la membrana lipídica comienza a separar y retraer de la hacia el interior los bordes, avanzando hacia el MLV en el centro. El proceso de contracción conduce a una nueva interfaz de forma dinámica desarrollar redes tubulares lipídica4 (figura 1L-1Y). Las regiones persistente de clavos, que no permita que la membrana separar completamente, quedan en la superficie y nuclea tabulación, llevando a larga ramificada red de nanotubos. (L-1Yde lafigura 1). Continua la fijación y mayor retracción de nanotubos de lípidos se observan con el tiempo como resultado del proceso de quelación gradual. Este engrosamiento y reordenamiento de las ramas de la red juega un papel clave en el comportamiento dinámico de las redes tubulares que se asemejan al ER liso.
Figura 1 L-1Y muestra micrografías de las redes de nanotubos obtenidas en el protocolo. Figura 1 L es que un primer plano de la región en la figura 1M marcada en el armazón blanco. Las regiones rojo brillante continuadas figura 1L y 1 M son la fracción de retracción de la DLBM (marcado con una línea discontinua azul en la figura 1M). Micrografía de una red tubular en figura 1N y 1O se invierte para aumentar el contraste. Figura 1 P y 1Q representa la reducción de la densidad tubular en una región de la membrana a lo largo de 3 h y 20 min. La disminución de la densidad tubular se produce debido a la depinning gradual seguido por retracción de la DLBM de la superficie en el período experimental. Con el tiempo, el número de puntos de fijación aumenta, conduciendo a los cambios y una reducción del área cubierta por los tubos (figura 1P y 1Q). Los cambios tubulares están motivados por la minimización de la energía libre superficial de un nanotubo de lípidos suspendido entre dos puntos fijos. Está bien establecido que la manera más eficaz de minimizar la energía superficial de un nanotubo es reducir su longitud15. Por lo tanto, cuando las regiones fusogénica, que inicialmente los nanotubos en la superficie, son de anclados, los nanotubos se deslice y se arreglan espontáneamente, adoptando una longitud mínima. Estos cambios provocan una cobertura gradualmente reducida de la superficie de los nanotubos (figura 1P y 1Q).
Nosotros no podemos visualizar el Ca2 +-mediada por puntos de fijación, pero establecemos sus lugares como los puntos donde los tubos tienen giros terminal o afilados. Curvas se denominan uniones V15 o puntos de inflexión debido al cambio repentino en la dirección de la alineación del tubo (flechas verdes en la figura 1R y 1 X). El punto final representa el terminal del tubo, lo que impide que el tubo retráctil (naranja flechas en la figura 1X). Durante la reorganización, enérgio favorable disposición de los tubos identificados como "Y-uniones" o "uniones de 3 vías", aparecer. El cruce Y conecta tres tubos con ángulos de aproximadamente 120 º entre cada tubo, de donde puede obtenerse la longitud más corta de tubo total. Las uniones Y, que no poseen un punto final y en su lugar se colocan entre múltiples nanotubos, no se cubrió. Este es el único tipo de Unión Y que puede realizar desplazamiento (flechas azules, figura 1R). Como se muestra en la figura 1R y 1S, deslizamiento de un cruce Y a lo largo de los resultados de un cruce muy inestable en la formación de dos individuales Y de las ensambladuras (flechas azules en la figura 1S). La línea blanca discontinua superpuesta en la figura 1S representa el contorno del fragmento en la figura 1RRed tubular. Una fracción de las ensambladuras Y posee terminales del extremo (flecha amarilla en la figura 1T) que, con el tiempo, eventualmente retracción (figura 1U). La transformación de una ensambladura de V a un solo tubo recto por depinning del punto de intersección de los segmentos de dos líneas y por retracción de uno de los tubos formando la forma de V se puede observar en la figura 1V y 1W y Figura 1X y 1Y, respectivamente.
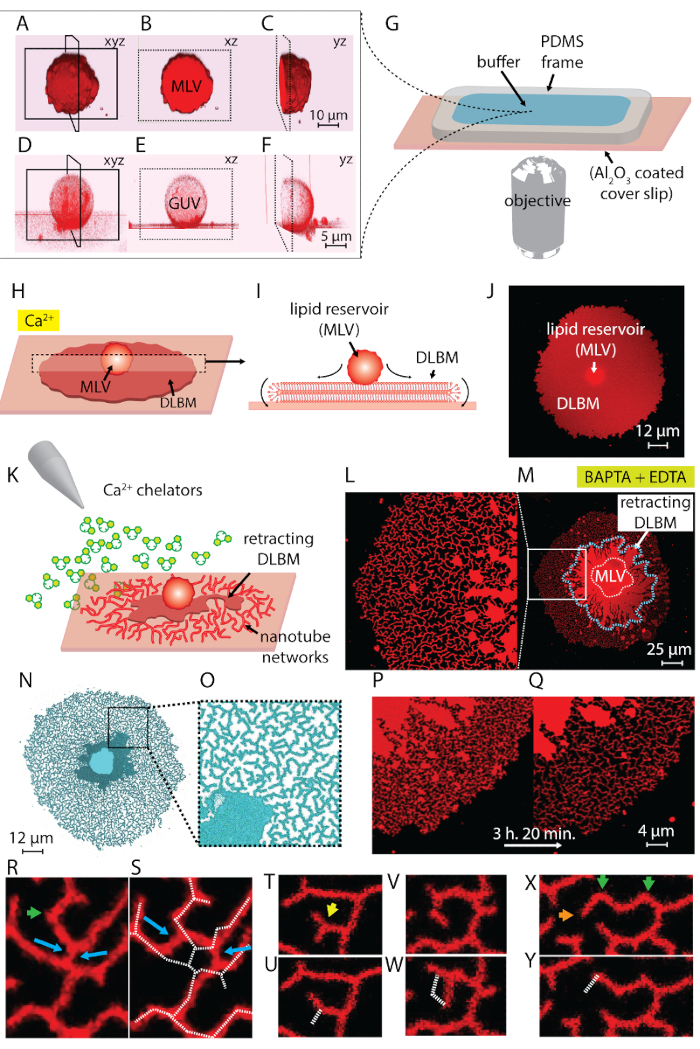
Figura 1 : Transformación de lípido depósitos a las redes tubulares como ER. (A-F) Láser de barrido confocales micrografías de las vesículas en la muestra inicial, construido en 3D. (A-C) Vesículas de lípidos multilamellar (MLV, depósito de lípidos) en xyz, xz y yz planos, respectivamente. (D-F) Vista similar a una vesícula unilaminar gigante (GUV). La parte interna de la 2.fino es hueca, que hace que el material lipídico para separarse significativamente limitada. Los depósitos de lípidos útiles para este método son por lo tanto MLV. (G) ilustración de la cámara de observación montada en un microscopio invertido sobre el que se depositan los buffer y los lípidos. La cámara se compone de un PDMS marco adherido sobre un cubreobjetos Al2O3 recubierto, proporcionando un alto volumen abierto. (H-J) Ilustración de los fenómenos que se separa de la MLV en presencia de Ca2 +. (H) al entrar en contacto con Al2O3, el MLV se separa espontáneamente en forma de una circular, doble membrana de bicapa de lipídica (DLBM). (I) vista esquemática de la DLBM en el plano xz, en las periferias realizan movimiento de balanceo. MLV (d = 5-15 μm) y DLBM (espesor = 10 nm) no se dibujan a escala. (J) una micrografía confocal de un DLBM separarse de vista superior. (K) describe el paso principal de este protocolo, donde se intercambia el búfer a una que contiene Ca2 + agentes quelantes, inhibición de la propagación, causando retracción de la DLBM a la MLV y llevan a la formación de los nanotubos de lípidos. (L-Y) Micrografías de las redes de nanotubos obtenidas con el método descrito. (L) cerca de la región en (M) marcado en un marco. Las regiones de color rojo brillante continuadas (L y M) representan el DLBM (también marcado con una línea discontinua azul en M). Micrografía de una red tubular (N y O) es invertida para aumentar el contraste. (P y Q) Representación de la reducción de la densidad tubular en una región de la membrana a lo largo de 3 h y 20 minutos (R-Y) representante tubular reorganización. (R y S) Desplazamiento (T y U) transición de un cruce Y cruce de V por la contracción de un punto final y (V y W) la fijación de un punto de inflexión, lo que resulta en la erradicación de una ensambladura. (X y Y) Retracción de un punto final. Haga clic aquí para ver una versión más grande de esta figura.
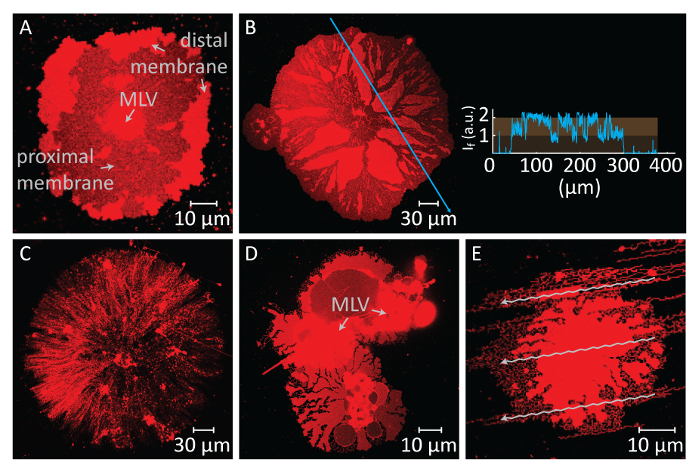
Figura 2 : Posibles resultados negativos. (A y B) Ruptura de la membrana distal debido a un largo tiempo de espera antes del cambio de los amortiguadores. Las áreas de ruptura, donde la membrana proximal se convierte en visible, aparecen como las regiones oscuras en comparación con las regiones de unruptured membrana distal. El recuadro a panel B muestra la intensidad de la luz a lo largo de la flecha azul en la micrografía. La intensidad de las regiones de ruptura de la membrana (bicapa individual proximal se hace visible) corresponde a la mitad la intensidad de la membrana unruptured (distal doble bicapa). (C) aspecto de un parche de lípido seco formado como resultado de la eliminación de todo líquido de la cámara de observación. (D y E) Interrupción de la membrana de intercambio rápido de buffers mediante pipeta automática. En (D), el MLV ha dividida en 2 MLV, llevando a un parche de lípidos no circular, deformada. En (E), el patrón de los flujos (flechas), creado por la fuerte inyección del buffer quelante-HEPES, se refleja en la estructura de la membrana tubulated. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En la siguiente discusión se describen los pasos críticos, posibles modificaciones y limitaciones del protocolo. El primer paso crítico es el montaje correcto de la cámara de observación, dado que la adhesión del marco del PDMS para Al2O3 superficie es intrínsecamente débil. En el caso donde el marco no se adhiere al sustrato correctamente, el contenido saldrá de la cámara de observación y el experimento se detuvo. Los principales factores que impiden la correcta de sellado de la superficie y marco son 1) falta de limpieza de la estructura PDMS (reutilizada) y 2) burbujas que de vez en cuando Haz atrapado entre el marco y el sustrato. Debe usarse un marco PDMS recién preparado o bien limpio. El marco debe ser aclarado antes y después de cada uso con isopropanol, seguido de enjuague con agua desionizada y secado con nitrógeno. Las superficies de Al2O3 no requieren ninguna limpieza previa, ya que son fabricados en un ambiente de sala limpia y mantenerse en recipientes cerrados hasta su utilización. Dado el carácter anfótero Al2O3, no debe estar expuesto a soluciones fuertemente ácidas o básicas. Otros diseños para la sala de observación se pueden emplear, dependiendo de la disponibilidad de la instalación individual. Características importantes de esta cámara son acceso gratuito a la muestra líquida de la parte superior abierta y la inercia de la material del marco con respecto a las soluciones usadas y las muestras. Las dimensiones de la cámara también son un factor importante, ya que deben dar cabida a un volumen de 0,5 a 1 mL. Puesto que las superficies son típicamente de tamaño estándar cubreobjetos (24 x 60 mm), el volumen de la cámara se determina sobre todo por el grosor del marco. A nuestro conocimiento, separadores con el tamaño y la profundidad que puede acomodar los volúmenes de muestra típicamente manejados en el presente Protocolo no están comercialmente disponibles. Por lo tanto, hemos dedicado una sección en el protocolo a los detalles de la fabricación y montaje de un bastidor de cámara de la muestra.
El otro paso crítico en este protocolo es el cambio de buffer. Un reto en este paso es el tiempo necesitado para realizar este intercambio. Separarse de la MLV al entrar en contacto con el sustrato de Al2O3 es instantáneo, y la continua expansión de la DLBM conduce a su ruptura, terminando el experimento (figura 2A, B). Por lo tanto, la difusión debe ser vigilada constantemente, y el cambio de tampón debe realizarse de manera oportuna. El cambio no debe realizarse muy rápidamente después de la inicialización de separarse, con el fin de permitir que los parches de membrana para llegar a un tamaño óptimo (100-200 μm de diámetro). Por otro lado, continua adherencia en la superficie provoca tensión elevada de la membrana, que conduce a la ruptura. Por lo tanto, todas las membranas parches eventualmente ruptura si no se interrumpe la difusión. El momento de la ruptura es diferente para cada parche, ya que depende del tamaño y estructura interna de la MLV y accesibilidad de los lípidos en esto. Por lo tanto, el momento del intercambio debe colocarse a un punto en el que los parches no rotos con tamaños óptimos representan una mayoría de toda la población. Otro desafío en el paso del cambio de tampón es la tasa de eliminación y adición de los buffers. Realizar esta sustitución demasiado rápido tiene una influencia perjudicial sobre las estructuras de membrana final (figura 2C-E). La extracción excesiva del Ca2 +- HEPES buffer sin dejar una película líquida delgada sobre el sustrato, se traduce en manchas secas y deforme irreversiblemente la membrana (figura 2C). Incluso si se mantiene una cantidad adecuada de líquido en la superficie, abrupta además del buffer HEPES quelante también provoca perturbación de las estructuras de membrana. Figura 2 D,E muestra la apariencia típica de los parches de membrana interrumpida hidrodinámico. La alteración morfológica en general no necesariamente influye en las propiedades dinámicas de las estructuras finales (es decir, los cambios tubulares en áreas restantes todavía se producirán). Sin embargo, será difícil observar la transformación material de las estructuras deformadas. Por ejemplo, en la figura 2D, sería difícil determinar la dirección hacia la cual se retrae MLV el DLBM.
Una posible modificación del protocolo es la composición de lípidos utilizada. El objetivo principal ha sido en los fosfolípidos que dominan la composición de ER en los mamíferos y16 de la levadura (e. g., fosfatidilcolina (PC), fosfatidiletanolamina (PE) y fosfatidilinositol (PI). Los experimentos originales se realizaron utilizando mezclas de PC y PI4. En los resultados presentados, se utilizan una mezcla de PC y la droga y un derivado de la PE. Sin embargo, no todas las composiciones arbitrarias de lípidos se han encontrado para crear las estructuras tubulares obtenidas a través de este protocolo. Algunas de las otras mezclas de lípidos investigado experimentalmente incluyen extracto de corazón total, polar del extracto de la haba de la soja, e. coli extracto polar, mezclas de PC con stearoyl-2-hydroxy-sn-glycero-3-phosphoinositol (Lyso-PI) en diferentes proporciones y mezclas de la PC-PE-PI-Posphatidyl serina (PS) en diferentes proporciones. Puesto que las estructuras tubulares de la membrana poseen curvaturas altas y requieren la disposición especial de las moléculas individuales de lípidos, se espera que el fenómeno observado es lípidos específicos de composición.
Otra modificación aplicada en este protocolo es el método para la fabricación de la superficie. Aquí, la ALD se utilizó para fabricar Al2O3 recubierto cubreobjetos. Esto difiere del método de deposición originalmente reportados,4la farfulla reactivo. Mientras que esto indica que un método de fabricación de superficie alternativos puede llevar todavía a ER-como tubulation, una limitación importante parece ser la especificidad del material superficial. El modo de propagación y la fuerza de adherencia es altamente dependientes en las propiedades del material superficial, que influyen factores como las interacciones electrostáticas, mojabilidad, hidrofobicidad y rugosidad de la superficie. Al2O3 superficies proporcionan una adherencia óptima fuerza, y películas de lípidos pueden tanto Fije fuertemente bastante para difundir como una membrana de bicapa lipídica doble y separe a las redes tubulares forma al retirar iones de Ca2 + . Previamente se probó el mismo experimento con SiO2, en el cual las vesículas multilamellar se difundió como una membrana de bicapa lipídica doble, pero ninguna formación de la Red tubular se observó sobre adición de quelantes17. La sujeción y la formación de tubo se observan solamente en Al2O3 o plasma grabado Al18. Nuestras investigaciones revelaron que el parámetro que contribuye a este fenómeno fue el zeta potencial de las superficies, para que Al y Al2O3 estaban cerca de cero (mV) y SiO2 significativamente negativo. El potencial zeta de borosilicato es similar a SiO219; por lo tanto, la adherencia de películas de lípidos en borosilicato es igualmente fuerte e irreversible. De hecho, lípidos multilamellar depósito contacto con superficies de borosilicato típicamente conduce a ruptura inmediata y formación de bicapas de lípidos solo20. Al2O3 superficies necesarias para este Protocolo no están disponibles fácilmente o comercialmente. Sin embargo, pueden, ser ordenado por encargo de fabricantes de vidrio y sustrato de especialidad. Acceso a las instalaciones de la sala con equipos de fabricación de película delgada es muy recomendable.
Los métodos de abajo hacia arriba otros existentes para fabricar redes tubulares como ER2,10 involucran proteínas así como aporte de energía química (por ej., GTP y ATP). Rapoport y colegas2 informó la formación de redes de ER el cubreobjetos de vidrio en vitro mezclando las flexión de la membrana las proteínas presentes en ER, con fosfolípidos y GTP. La obra de Bachand et al. 10 muestra cómo se pueden crear tales redes tubulares dinámicas utilizando motores moleculares y el ATP como fuente de energía. Este protocolo presentada no requiere proteínas de membrana o hidrólisis de compuestos orgánicos para la energía. Los componentes sólo esenciales son el sustrato sólido y los fosfolípidos. No se requiere purificación y extracción de proteínas. Este protocolo proporciona, en términos de simplicidad de las moléculas constitutivas, el modelo más básico de ER.
Con esta base, base de lípidos ER modelo establecido, fortalecimiento de complejidad mediante la adición de componentes asociados de ER es de interés, ya que permite la investigación de los impactos individuales en el sistema. Similares a las actuales redes de ER, tubos en el modelo son dinámicos. La conjugación a y migración de las proteínas de la membrana de etiqueta o partículas fluorescentes a lo largo de la Red tubular, pueden dar información sobre la dirección del movimiento de la membrana. Encapsulado y control de los líquidos fluorescentes dentro de los tubos y DLBM durante la transformación y una cartografía posible del transporte contenido intratubular pueden servir como otro foco. Por último, se puede adoptar una transición desde el modelo 2D de ER resultante de este protocolo a un modelo 3D de ER liso a través de la encapsulación de las redes de arquitecturas de hidrogel.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Prof. Aldo Jesorka de la Chalmers University of Technology en Suecia por sus invaluables comentarios sobre el manuscrito. Este trabajo fue posible a través de apoyo financiero de la concesión del proyecto del Consejo de investigación de Noruega (Forskningsrådet) 274433, UiO: Ciencias de la vida entorno de convergencia, el Consejo Sueco de investigación (Vetenskapsrådet) proyecto Grant 2015-04561, así como la puesta en marcha la financiación proporcionada por el centro de Noruega de Medicina Molecular, Facultad de matemáticas y Ciencias naturales en la Universidad de Oslo.
Materiales
| Name | Company | Catalog Number | Comments |
| Pear-shape flask 10 mL | Lenz Laborglasinstrumente | 3.0314.13 | In which the lipid mixture is prepared |
| Hamilton 5 mL glass syringe (P/N) | Hamilton | P/N81520 | For transfer of the chloroform to beaker |
| Custom large hub needle Gauge 22 S | Hamilton | 7748-18 | Removable needle for syringe specified in row 3 |
| Hamilton 250 µL glass syringe | Hamilton | 7639-01 | Used for transfer of lipids in chloroform to the flask |
| Large hub Gauge 22 S | Hamilton | 7780-03 | Removable needle for syringe specified in row 5 |
| Hamilton 50 µL glass syringe | Hamilton | 7637-01 | Used for transfer of fluorophore-conjugated lipids to the flask |
| Small hub Gauge 22 S | Hamilton | 7770-01 | Removable needle for syringe specified in row 7 |
| Chloroform anhydrous (≥99%) | Sigma-Aldrich | 288306 | Used to complete the lipid mixture to a total of 300 µL |
| Soy L-α Phosphatidyl choline lipid (Soy PC) | Avanti Polar Lipids Inc | 441601 | phospholipid species contributing to 69% of the total composition/mixture |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE) | Avanti Polar Lipids Inc | 850725 | phospholipid species contributing to 30% of the lipid composition/mixture |
| L-α Phosphatidyl inositol lipid (Soy PI) | Avanti Polar Lipids Inc | 840044 | alterative phospholipid species contributing to 30% of the lipid composition/mixture (from the original article Bilal and Gözen, Biomaterials Science, 2017) |
| Texas Red 1,2-dihexadecanoyl-sn-glycero-3-phosphoethanolamine,triethylammonium salt (Texas Red DHPE) | Invitrogen (Thermo Fisher Scientific) | T1395MP | Fluorescent-lipid conjugate, 1% of the lipid composition/mixture |
| Digital Dry Baths/Block Heaters | Thermo Fischer | 88870006 | To warm glycerol in order to decrease its viscosity |
| Glycerol for molecular biology (≥99%) | Sigma Life Science | G5516 | For lipid preparation |
| PBS buffer (pH=7.8); ingredients below in rows 17-21 | Used to prepare the lipid suspension | ||
| TRIZMA base, primary standard and buffer (≥99%) | Sigma Life Science | T1503 | Used to prepare PBS buffer |
| Potassium phosphate tribasic, reagent grade (≥98%) (K3PO4) | Sigma-Aldrich | P5629 | PBS buffer ingredient |
| Magnesium sulfate heptahydrate, BioUltra (≥99,5%) KT (MgSO47H2O) | Sigma Life Science | 63138 | PBS buffer ingredient |
| Potassium phosphate monobasic, anhydrous, free flowing, Redi-Dri, ACS (KH2PO4) | Sigma-Aldrich | 795488 | PBS buffer ingredient |
| Ethylenediaminetetraacetic acid disodium salt dihydrate ACS reagent, 99.0-101.0% (Na2EDTA) | Sigma-Aldrich | E4884 | PBS and Chelator-HEPES buffer ingredient |
| Ultrasonic cleaner USC-TH | VWR | 142-0084 | Ultrasonication of rehydrated lipids |
| Rotary evaporator - Büchi rotary evaporator Model R-200 | Sigma | Z626797 | For evaporation of chloroform |
| Pressure meter - Vacuum regulator IRV-100 | SMC | IRV10/20 | For controlling the pressure value during lipid dehydration |
| HEPES-buffer (pH=7.8); ingredients below in rows 26-27 | Used for rehydration of lipids. Content: 10 mM HEPES with 100 m NaCl diluted in ultrapure deionized water | ||
| HEPES ≥99.5% (titration) | Sigma Life Science | H3375 | HEPES-buffer ingredient |
| Sodium chloride for molecular biology, DNase, RNase, and protease, none detected, ≥98% (titration) (NaCl) | Sigma Life Science | S3014 | HEPES-buffer ingredient |
| Calcium-HEPES buffer (pH=7.8); effective ingredient below in row 29 | Used for spreading of lipids. Content: 10 mM HEPES, 100 mM NaCl, 4 mM CaCl2 diluted in ultrapure deionized water | ||
| Calcium chloride anhydrous, BioReagent, suitable for insect cell culture, suitable for plant cell culture, ≥96.0% (CaCl2) | Sigma Life Science | C5670 | To prepare Calcium-HEPES buffer |
| Chelator-HEPES buffer (pH=7.8); effective ingredient below in row 31 | Used to promote the formation of tubular networks. Content: 10 mM HEPES, 100 mM NaCl, 10 mM EDTA and 7 mM BAPTA diluted in ultrapure deionized water | ||
| 1,2-Bis(2-aminophenoxy)ethane-N,N,N′,N′-tetraacetic acid tetrasodium salt ≥95% (HPLC) (BAPTA-Na4) | Sigma Life Science | 14513 | Chelator-HEPES buffer ingredient |
| Sodium Hydroxide | Sigma | 30620 | Basic solution used to adjust the pH of the buffers |
| pH meter accumet™ AE150 pH | Fisher Scientific | 1544693 | Used to measure the pH of all buffers |
| Glass petri dish | VWR | HECH41042012 | 6 cm, used for making the PDMS sheet |
| Potassium hydroxide ACS reagent, ≥85%, pellets (KOH) | Sigma-Aldrich | 221473 | To make the KOH solution for cleaning glass petri dish for the fabrication of the PDMS sheet |
| Isopropanol prima ren 99.5% | Antibac AS | 600079 | KOH solution ingredient |
| Heating and drying oven - venticell | MMM Medcenter Einrichtungen GmbH | MC000714 | For drying of the glass petri dish after silanization and to cure PDMS |
| Dichlorodimethylsilane ≥99.5% | Sigma-Aldrich | 440272 | Used for silanization of glass petri dish in which PDMS sheet is prepared |
| Vacuum pump | Cole-Parmer | EW-79202-05 | Connected to desiccator |
| Sylgard 184 silicone elastomer curing agent | Dow corning | 24236-10 | Kit to make PDMS solution |
| Sylgard 184 Silicone elastomer base | |||
| Disposable scalpel | Swann-Morton | 11798343 | Used to cut the PDMS |
| Cover slips | Menzel -Gläser | MEZ102460 | 24x60 mm. Used to deposit thin film of Al2O3 |
| Atomic layer deposition system | Beneq | TFS200 (model number) | Atomic Layer deposition system used to deposit thin film of Al2O3 in microscope cover glass |
| Ellipsometer | J.A. Woollan Co. | Alpha-SE (model name) | System used to charcaterize the thickness of the film deposited on glass surface |
| Laser scanning confocal microscope | Leica Microsystems | Leica TCS SP8 X | Microscope used for visualization of the experiment |
| Objective 40x, 1.3 NA | Leica Microsystems | 1550635 | Used for visualization of the experiment |
| White light laser source | Leica Microsystems | Leica TCS SP8 X | For excitation of the membrane fluorophore |
Referencias
- Chen, S., Novick, P., Ferro-Novick, S. ER structure and function. Current Opinion in Cell Biology. 25 (4), 428-433 (2013).
- Powers, R. E., Wang, S., Liu, T. Y., Rapoport, T. A. Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature. 543 (7644), 257-260 (2017).
- Pendin, D., McNew, J. A., Daga, A. Balancing ER dynamics: Shaping, bending, severing, and mending membranes. Current Opinion in Cell Biology. 23 (4), 435-442 (2011).
- Bilal, T., Gözen, I. Formation and dynamics of endoplasmic reticulum-like lipid nanotube networks. Biomaterials Science. 5 (7), 1256-1264 (2017).
- Shibata, Y., et al. Mechanisms determining the morphology of the peripheral ER. Cell. 143 (5), 774-788 (2010).
- Ozcan, L., Tabas, I. Role of endoplasmic reticulum stress in metabolic disease and other disorders. Annual Review of Medicine. 63, 317-328 (2012).
- Yamanaka, T., Nukina, N. ER dynamics and derangement in neurological diseases. Frontiers in Neuroscience. 12, (2018).
- Taalab, Y. M., et al. Mechanisms of disordered neurodegenerative function: Concepts and facts about the different roles of the protein kinase RNA-like endoplasmic reticulum kinase (PERK). Reviews in the Neurosciences. , (2018).
- Shemesh, T., et al. A model for the generation and interconversion of ER morphologies. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 5243-5251 (2014).
- Bouxsein, N. F., Carroll-Portillo, A., Bachand, M., Sasaki, D. Y., Bachand, G. D. A continuous network of lipid nanotubes fabricated from the gliding motility of kinesin powered microtubule filaments. Langmuir. 29 (9), 2992-2999 (2013).
- Sackmann, E. Endoplasmatic reticulum shaping by generic mechanisms and protein-induced spontaneous curvature. Advances in Colloid and Interface Science. 208, 153-160 (2014).
- Jesorka, A., et al. Generation of phospholipid vesicle-nanotube networks and transport of molecules therein. Nature Protocols. 6, 791 (2011).
- Hook, D. A., Olhausen, J. A., Krim, J., Dugger, M. T. Evaluation of Oxygen Plasma and UV Ozone Methods for Cleaning of Occluded Areas in MEMS Devices. Journal of Microelectromechanical Systems. 19 (6), 1292-1298 (2010).
- Gözen, I., et al. Fractal avalanche ruptures in biological membranes. Nature Materials. 9 (11), 908-912 (2010).
- Lobovkina, T., Dommersnes, P., Joanny, J. -. F., Hurtig, J., Orwar, O. Zipper Dynamics of Surfactant Nanotube Y Junctions. Phys Rev Lett. 97, (2006).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews Molecular Cell Biology. 9 (2), 112-124 (2008).
- Gözen, I., et al. Repair of large area pores in supported double bilayers. Soft Matter. 9 (10), 2787-2792 (2013).
- Gözen, I., et al. Thermal migration of molecular lipid films as a contactless fabrication strategy for lipid nanotube networks. Lab on a Chip. 13 (19), 3822-3826 (2013).
- Sides, P. J., Hoggard, J. D. Measurement of the Zeta Potential of Planar Solid Surfaces by Means of a Rotating Disk. Langmuir. 20 (26), 11493-11498 (2004).
- Nissen, J., Jacobs, K., Rädler, J. O. Interface Dynamics of Lipid Membrane Spreading on Solid Surfaces. Physical Review Letters. 86 (9), 1904-1907 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados