Method Article
Formazione spontanea e riorganizzazione delle reti di Nanotube del lipido artificiale come un modello Bottom-Up per il reticolo endoplasmico
In questo articolo
Riepilogo
Solido-supportato, privo di proteine, doppia membrane di doppio strato del fosfolipide (DLBM) possono essere trasformate in reti di nanotube del lipido complessa e dinamica e possono servire come modelli 2D ascendente del reticolo endoplasmico.
Abstract
Presentiamo un metodo conveniente per formare un modello strutturale organello ascendente per il reticolo endoplasmico (ER). Il modello è costituito da nanotubi lipidici molto densi che sono, in termini di morfologia e dinamiche, che ricorda di ER. Le reti sono derivate da patch di membrana doppia bilayer del fosfolipide aderendo al substrato trasparente Al2O3 . L'adesione è mediato da Ca2 + nel buffer di ambiente. Lo svuotamento successivo di Ca2 + tramite BAPTA/EDTA provoca retrazione della membrana, con conseguente formazione di rete di nanotubi spontanea del lipido. Il metodo solo comprende fosfolipidi e superfici microfabbricati per semplice formazione di un modello ER e non richiede l'aggiunta di proteine o di energia chimica (ad es., GTP o ATP). In contrasto con la morfologia 3D del reticolo endoplasmico cellulare, il modello è bidimensionale (anche se le dimensioni di nanotubi, la geometria, la struttura e la dinamica è mantenuti). Questo modello unico in vitro ER è costituito da pochi componenti, è facile da costruire e può essere osservato sotto un microscopio chiaro. La struttura risultante può essere ulteriormente decorata per funzionalità aggiuntive, come l'aggiunta di proteine associate ER o particelle di studiare fenomeni di trasporto tra i tubi. Le reti artificiali descritte qui sono modelli strutturali adatti per il cellulare ER, la cui morfologia caratteristica unica è stato indicato per essere legate alla sua funzione biologica, mentre i dettagli per quanto riguarda la formazione del dominio tubolare e le riorganizzazioni all'interno ancora non completamente sono capite. Notiamo che questo metodo utilizza Al2O3 rivestita con film sottile microscopia vetrini coprioggetti, che sono disponibili in commercio, ma richiedono ordini speciali. Pertanto, si consiglia di avere accesso ad un impianto di microfabbricazione per la preparazione.
Introduzione
ER svolge compiti cruciali nella cella biologica tra cui piegatura della proteina, la sintesi di lipidi e calcio regolamento1,2. La morfologia di ER è intrinseca per le funzioni che svolge. Esso combina pile planare e domini tubolare denso-dinamico, che continuamente interagiscono con il citoscheletro e subiscono la riorganizzazione e il costante movimento. Sono alcuni del rimodellamento che strutture ER subiscono la trasformazione continua tra fogli planari e tubi, la formazione della vescicola da o fusion al lume ER, allungamento di tubi pre-esistenti, la ritrazione di tubo, fusione e rottura3. La particolare struttura delle reti tubolari è energico sfavorevole. Le vie e i meccanismi con cui ER genera e mantiene che questa organizzazione nonché come come questo si riferisce alla sua funzione non è ancora pienamente compreso4,5.
È noto che l'ER malfunzionamenti quando perde il suo stato omeostatico, conseguente ER stress, una condizione causata da un aumento della sintesi proteica, accumulo di proteine misfolded o variazioni di Ca2 + e bilancio ossidativo. ER lo stress a sua volta provoca deformazione della morfologia naturale dell'organello, specificamente da disturbare la rete organizzazione6,7. Come risposta, la cella attiva un meccanismo di riparazione per tornare a uno stato omeostatico. Guasto in riparazione può portare all'apoptosi cellulare indotta da ER, che contribuisce a parecchie malattie metaboliche e degenerative come il morbo di Alzheimer, il diabete di tipo 2, malattia di Parkinson, sclerosi laterale amiotrofica e molti altri7, 8. La ricerca attuale si rivolge l'organizzazione delle reti ER tubolare, e diversi studi si stanno concentrando sulla ricostituzione ER in vitro2. Esistenti a pochi modelli2,9,10 richiedono proteine per avviare e mantenere la membrana curvatura3,11 e aiutare l'organello a raggiungere la sua forma. Chiaramente, i sistemi di modello che rispecchiano alcune delle caratteristiche strutturali ed organizzative chiave dell'ER e forniscono l'accesso agli studi sperimentali avanzati sono in grande richiesta.
Vi presentiamo qui le procedure per la preparazione di un facile, modello privo di energia, dinamica in vitro di proteina/chimico per l'ER, fornendo una piattaforma di base per studiare la morfologia di ER e funzioni associate4. In questo metodo, un modello ER è fabbricato con un approccio bottom-up utilizzando solo alcuni elementi, in cui le molecole di interesse possono essere integrate per aggiungere complessità. La rete rappresenta la dinamica e la struttura di ER. Inoltre, trasformazione reversibile tra la membrana planare e i tubi, la formazione della vescicola dai tubi, tubo fusione, scorrevole e retrazione può tutti essere osservata. Oltre a servire come un modello bottom-up per il ER cellulare in modo incompleto capito, l'itinerario del lipido a reti di nanotubi descritti nel presente protocollo può essere applicabile per i ricercatori che studiano l'auto-assemblaggio, nanofluidica, singola molecola e colloide fenomeni di trasporto, flusso di Marangoni e altri campi correlati. I blocchi di costruzione solo molecolari utilizzati nel nostro metodo sono fosfolipidi. Il protocollo richiede un piccolo laboratorio lavoro e attrezzature di base ed è accessibile per l'incorporazione di elementi aggiuntivi.
Protocollo
1. preparazione della sospensione delle vescicole di fosfolipidi
Nota: Per tutti i materiali definito come "pulito" in questo protocollo, accuratamente lavarli con isopropanolo seguita da acqua deionizzata e li piega con azoto. Si noti che un trattamento di substrati di vetro con fortemente ossidanti agenti acidi (soluzione Piranha), che è generalmente applicato in protocolli di preparazione per il film lipidico supportati su substrati solidi, non deve essere eseguito Al2O3-rivestito elementi portanti.
- Posto in un fiasco di vetro a forma di pera sfondo sferico o invertito pulito 10 mL: soia L-α fosfatidil colina (PC, 69% w/w), 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 30% w/w) e un fluoroforo lipido-coniugati di scelta [ad es., Texas Red 1,2 - dihexadecanoyl-sn-glicero-3-fosfoetanolammina triethylammonium salt (TR-DHPE, 1% w/w)] in cloroformio; per un totale di 3000 µ g di lipidi in 300 µ l di cloroformio, conseguente a una concentrazione finale di 10 mg/mL.
Nota: Usare e pulito, vetro, siringhe a tenuta di gas con pistoni politetrafluoroetilene durante la manipolazione di composti contenenti cloroformio.
Attenzione: Cloroformio è tossico e altamente volatile e deve essere trattato sotto cappa aspirante con dispositivi di protezione individuale associato. - Raccordare il pallone all'evaporatore rotante, posizione con un'inclinazione di 45° e ruotare lentamente a 24 giri all'interno di un bagno di acqua a 23 ° C per 6 h con pressione ridotta dell'aria e rimuovere completamente il cloroformio. Iniziare a ridurre il diritto di pressione dopo l'inizio della rotazione a passi di 20 kPa ogni 2 min fino a 20 kPa (150 Torr, 80% di vuoto).
Nota: La formazione di una pellicola omogenea del lipido di spessore uniforme del serbatoio di preparazione è il requisito più importante per la procedura di rotavap. Preparazioni del lipido sono sensibili alla velocità di rotazione, cambiamenti di pressione rapida e valore della pressione finale; Pertanto, seguire rigorosamente la procedura di riduzione lenta così come la velocità di rotazione e pressione di fine. Posizionare il pallone con un'inclinazione di 45° per garantire che la torta del lipido disidratato è formata in modo uniforme come un film sulla parete del matraccio. Troppo veloce di una rotazione (a causa della gravità) conduce a turbolenze e troppo lento di una rotazione conduce all'accumulazione di uno spesso strato di liquido nella parte inferiore del pallone. Durante la notte successiva gonfiore processo, un lipide molto inhomogenous massa è prodotto che non risponde bene al passaggio finale sonicazione, e le frazioni risultanti sono di diverse composizioni. Pressione e tempo all'interno dell'intervallo specificato nel metodo assicura desolvatazione lento. Con cloroformio come solvente, troppo rapida di un calo di pressione si raffredda la miscela, con conseguente aumentata viscosità e filmazione aggregazione e irregolare. Il lungo periodo di tempo di 6 ore è consigliato al fine di rimuovere il solvente per quanto più possibile, come le partizioni di solvente organiche nel materiale lipidico sulla reidratazione. - Dopo 6 h, arrestare la rotazione e aumenta la pressione dell'aria ancora una volta, gradualmente, a passi di 20 kPa ogni 2 min fino a raggiungere 100 kPa. Togliere il matraccio dall'evaporatore e aggiungere 3 mL di PBS e 30 µ l di glicerolo. Agitare delicatamente il pallone per dissolvere il glicerolo. Utilizzare un tappo di vetro ermetici per tappare il matraccio contenente i lipidi.
Nota: Il glicerolo è usato per prevenire la disidratazione completa del film lipidico e consente a doppio strato separazione12. Esso deve essere riscaldata prima dell'uso per diminuire la sua viscosità, che facilita la gestione di questo composto. Il glicerolo riscaldato ancora non immediatamente mescolare con il tampone PBS. Agitando delicatamente è necessaria fino a quando il glicerolo è completamente sciolto. - Memorizzare la beuta in frigorifero a 4 ° C durante la notte per la reidratazione ed il gonfiamento dei film lipidico.
- Il giorno seguente, Sonicare i lipidi con un bagno di acqua ad ultrasuoni a temperatura ambiente (~ 21 ° C, RT) e a 35 kHz frequenza fino ad ottenere una sospensione uniforme, leggermente torbido del lipido.
Nota: Sonicazione può richiedere intorno 10-30 s. prolungata sonicazione (~ 1 min) produce calore ed è dannoso per la formazione della vescicola. - Punti 1.1-1.5 rendimento una sospensione contenente due tipi di strutture vescicolari: vescicole multilamellari (MLV) e vescicole unilamellari gigante (GUV) (Figura 1A-1F).
- Per deposito, dividere la sospensione del lipido in aliquote di 100 µ l, con un totale di 30 microcentrifuga e memorizzarli in un congelatore a-20 ° C.
Nota: Flash di congelamento con azoto liquido non è necessari e non utilizzati prima della conservazione. Il protocollo può essere messo in pausa qui. Lasciando sospensioni del lipido in frigorifero a 4 ° C per periodi volte cause del lipido Lisi, che influenza la composizione della membrana.
2. preparazione di substrati
Nota: Il seguente protocollo viene eseguito in una camera bianca classificata come ISO 8 nella specifica standard ISO 14644-1. Deposizione di strati atomici (ALD) è usato per fabbricare Al2O3 substrati. I parametri di processo specificato sono strumento-dipendenti e possono variare tra i diversi modelli di apparecchiature. Essi possono essere utilizzati come parametri iniziali a sviluppare il processo.
- Impostare la temperatura del reattore ALD a 200 ° C.
- Caricare le superfici di vetro (ad es., lamelle di vetro) nel pozzetto di misurazione insieme un wafer di silicio, che verrà utilizzato in seguito come una superficie di riferimento per determinare lo spessore della deposizione di ellissometria.
Nota: Substrati di vetro erano usate out-of-the-box e non erano puliti a solvente prima deposizione. Essi sono stati scaricati solo con gas azoto per rimuovere le particelle. - Evacuare la camera di carico a 400 Pa (3 torr) e trasferire i campioni nella camera di reazione principale ed evacuarla a 200 Pa.
Nota: La temperatura del reattore deve essere mantenuta a 200 ° C per la corretta deposizione. Fluttuazioni di temperatura dopo il caricamento del campione deve pertanto essere equilibrato prima di iniziare la deposizione. Pressione della camera è impostato per essere superiore a pressione del reattore per evitare eventuali precursori a diffondersi fuori dall'aula. - Iniziare a depositare il film atomico. Un ciclo è costituito da un'esposizione di alluminio 150 ms impulso trimetil, seguita da una purga di s 1 e, successivamente, un'esposizione di H2O 200 ms di durata seguita da una purga di s 1.
Nota: Tutte le impostazioni compresa la pressione in camera di scoppio e reattore, lunghezza dei cicli e purghe sono automatizzati per ottenere un tasso definito di deposizione. Questi parametri possono variare tra i diversi modelli di apparecchiature. Le ricette pre-configurate sono spesso preparate dal fornitore o strumento responsabile nella camera pulita e comunicate all'utente come spessore del film depositato per unità di tempo. - Per raggiungere 10 nm di Al2O3 sul substrato, ripetere il processo per 100 cicli. Il numero di cicli dipende la velocità di deposizione, che può variare tra diverse ricette o attrezzature.
- Per rimuovere i campioni dal reattore, primo sfogo della camera fino a quando la pressione raggiunge la pressione atmosferica, quindi rimuovere i campioni.
- Conservare i campioni in contenitori a tenuta d'aria a RT fino all'utilizzo.
Nota: Nessun ulteriore pulizia è raccomandato prima dell'uso. Il protocollo può essere messo in pausa qui.
Nota: I campioni idealmente devono essere utilizzati immediatamente dopo la deposizione. L'archiviazione ottima richiede posizionamento le superfici interne in polipropilene portawafer, seguita da avvolgente i vettori in sacchetti di plastica camera pulita-compatibile, che sono di azoto-essere lavato prima di tenuta in vuoto. Lo scopo è quello di evitare di esporre la superficie a contaminanti volatili. Se necessario, le superfici possono essere conservate in contenitori ermetici a RT al massimo per 5 giorni. Si consiglia di non conservarli più a lungo. Per gli utenti che non hanno facile accesso a una camera pulita nelle vicinanze e acquistare o ottenere le superfici dall'estero, ri-ossidanti i substrati mediante trattamento al plasma o ozono dell'ossigeno può essere una soluzione alternativa13.
3. trasformazione di film molecolari del fosfolipide di reti tubolari
- Scongelare la sospensione del lipido e trasferire una goccia 4 µ l di sospensione su un microscopio diapositiva/coprioggetto in vetro pulito.
- Essiccare la goccia per 20 min. La gocciolina crollerà in un film circolare piana dei lipidi dopo il loro disseccamento, che è visibile ad occhio.
- Reidratare il film lipidico con 1 mL di tampone HEPES (Vedi Tabella materiali) per 3 min.
Nota: Il volume di tampone di reidratazione colpisce la densità della sospensione della vescicola (il numero delle vescicole per unità di volume), che viene successivamente trasferita alla camera di osservazione. A seconda del volume della camera di osservazione e la densità desiderata della vescicola, il volume di reidratazione può essere sintonizzato a 0,5-1 mL. Borosilicato pulito diapositive tendono a sostenere le goccioline di diverse centinaia microlitri fino a 1,5 mL senza problemi. Poiché il vetrino coprioggetto non ha bisogno di essere spostati, questo non porta a un problema tecnico. Su superfici più idrofobiche, come SU-8 diapositive con rivestimento polimerico, anche 1,5 mL può essere depositato12.
Nota: I lipidi devono essere preparati, come l'esposizione della pellicola lipidica reidratato per più di 20 min a RT conduce all'evaporazione del buffer e disidratazione parziale delle vescicole precedentemente reidratate, che conduce ad un mal definito composizione. - Preparare la camera di osservazione: per consentire il cambio di buffer per mezzo di una pipetta automatica, che è necessario per avviare la trasformazione di ER, è stata utilizzata una camera di osservazione con una parte superiore aperta. Questa camera è costituito da una cornice di polidimetilsilossano (PDMS) con dimensioni 1,5 x 1,5 x 0,5 cm, aderito Al2O3 depositato coprivetrino. Uno schema di camera di osservazione montato è rappresentato in Figura 1G. Per fabbricare il telaio PDMS e montare la camera di osservazione sono state eseguite le seguenti operazioni:
- Preparare una soluzione KOH con 100 g di KOH in 100 mL di isopropanolo in un becher in un bagno di ghiaccio. Mescolare per 10 ore o più fino a quando il KOH è completamente disciolto utilizzando un agitatore magnetico e una piastra magnetica.
Attenzione: La soluzione di KOH è corrosivo e possa causare ustioni alla pelle, così sempre gestire con dispositivi di protezione personale.
Nota: La solubilità di KOH in isopropanolo non è elevata come in acqua. La dissoluzione è esotermica. Schiacciare i pellet KOH prima della dissoluzione e agitazione continua è consigliabile. - Immergere un bicchiere di Petri (d = 6 cm) nella soluzione di KOH a RT e mantenere durante la notte.
- Il giorno seguente, rimuovere il piatto di vetro dalla soluzione, immergerlo in un recipiente con acqua deionizzata per 5 min, sciacquare più volte con acqua e posizionarlo all'interno di un forno di essiccazione a 80 ° C per 1 h. Blow la superficie brevemente con un flusso di azoto per garantire che una parte Icles vengono rimossi.
- Per passivare la superficie ed evitare il legame di PDMS, trasferire 200 µ l di dimetildiclorosilano con una siringa di plastica in un contenitore di plastica pulito come una barca di ponderazione.
- Conservare il vetro di Petri insieme con il silano per 1h in un essiccatore sottovuoto (basso vuoto, ~ 20 kPa).
Attenzione: Dimetildiclorosilano è tossico e deve essere trattato sotto cappa aspirante con dispositivi di protezione individuale associato. - Attendere 15 minuti prima di raccogliere la capsula di Petri in ordine per il vapore residuo di dimetildiclorosilano a dissipare. La capsula di Petri è ora silanizzata, e la superficie è idrofobica.
Nota: Un modo rapido per verificare il successo di questo passaggio è porre una goccia d'acqua sul silanizzata capsula di Petri. L'angolo di contatto della goccia con la superficie visibilmente deve aumentare rispetto al vetro non trattato. - In un contenitore di plastica 250 mL (fresco dal pacchetto di tazza plastica trasparente), mescolare 10 g di elastomero di silicone base con 1 g di agente indurente in elastomero di silicone (10:1). Mescolare con una spatola di plastica agitatore per 5 min.
Nota: Le bolle d'aria si formano all'agitazione, e il PDMS avrà un aspetto pallido-bianco. - Essiccare la miscela a degas a < 20 kPa fino a quando le bolle di aria in espansione sono crollate (più alto vuoto accelera il processo). Versare la miscela degassata silanizzata capsula di Petri.
- Curare a 65 ° C per 2 h in un forno.
Nota: È possibile raddoppiare la velocità di vulcanizzazione aumentando la temperatura a > 95 ° C. La temperatura di polimerizzazione crescente si traduce in un aumento della rigidità del materiale. - Raffreddare la capsula di Petri riempito con il PDMS polimerizzato a RT e rimuovere la lastra PDMS con una spatola.
- Con un bisturi, tagliare il telaio nelle dimensioni e la geometria appropriata per l'apertura disponibile in fase di microscopio. Dimensioni di 1.5 (lunghezza) x 1,5 (larghezza) x 0,5 cm (altezza) sono adatti per la maggior parte delle configurazioni.
- Portare il lato liscio (lato di fondo era in contatto con la capsula di Petri) del PDMS telaio a contatto con il lato attivo della superficie dove risiede il film di Al2O3 e applicare una leggera pressione per spingere il telaio e la superficie contro l'altro per farle aderire.
Nota: L'adesione tra il PDMS telaio e Al substrato di2O3 è debole. La presenza di bolle d'aria nell'interfaccia di contatto può causare de-allegato e, di conseguenza, la perdita del buffer e contenuti correlati. Il telaio PDMS può essere utilizzato più volte se immediatamente dopo e prima di ogni utilizzo sciacquare con isopropanolo, seguita da risciacquo con acqua deionizzata e asciugare con azoto. Possa essere riutilizzato anche silanizzata capsula di Petri.
- Preparare una soluzione KOH con 100 g di KOH in 100 mL di isopropanolo in un becher in un bagno di ghiaccio. Mescolare per 10 ore o più fino a quando il KOH è completamente disciolto utilizzando un agitatore magnetico e una piastra magnetica.
- Riempire la camera di osservazione con il Ca2 +- HEPES tampone (Vedi Tabella materiali).
Nota: La superficie deve essere utilizzata immediatamente dopo l'apertura delle prese il pacchetto. Contatto con l'aria conduce ad adsorbimento di contaminanti, che diminuisce gradualmente l'attività della superficie. La camera dovrebbe essere riempita con buffer immediatamente dopo il montaggio. Non riempire il volume intero alloggiamento per consentire l'aggiunta dei lipidi reidratati nel passaggio successivo. - Posizionare la camera sul palco al microscopio confocale. Trasferire il materiale lipidico reidratato, ora una sospensione contenente vescicole giganti, nella camera con una pipetta Pasteur (Figura 1A-1 G) di plastica.
- Attendere 10-20 min per lasciare che le vescicole aderiscono sul substrato e si sono diffuse attraverso la superficie (Figura 1H-1J).
Nota: La diffusione inizia immediatamente dopo la deposizione di lipidi sulla superficie. Il tasso di diffusione potrebbe variare leggermente a seconda della composizione dei lipidi, Al2O3 tecnica di deposizione (ADL, RF-sputtering, chemical vapour deposition, ecc.), freschezza del substrato e concentrazione del catione bivalente nella buffer. Assicurarsi che il cambio di buffer viene eseguita prima rottura della diffusione patch14. - Dopo aver osservato più spread del lipido, rimuovere lentamente il buffer di ambiente tramite una pipetta automatica, tale che solo un film sottile tampone rimane sul fondo.
Nota: La rimozione rapida del buffer perturba le strutture dei lipidi sulla superficie. - Procedere allo scambio di tampone ambientale riempiendo lentamente la camera di osservazione con tampone HEPES chelante (Vedi Tabella materiali) utilizzando una pipetta automatica (Figura 1K).
Nota: Aggiunta brusco di buffer perturba le strutture dei lipidi sulla superficie. - Questo passaggio produce reti dinamiche nanotubulare, formate come conseguenza il chelante-indotto depinning e retrazione del DLBM a MLV4 (Figura 1L-1Y).
4. microscopia osservazione
- Acquisire le immagini con un laser invertito microscopio confocale utilizzando un 40 X obiettivo a immersione in olio (1,3 NA) con una frequenza di scansione di 400 Hz. impiegare una fonte di laser a luce bianca per eccitare il Texas Red DHPE a 595 nm. Raccogliere l'emissione da 605 a 700 nm utilizzando un rivelatore del fotone di ibrido.
Nota: In alternativa, un microscopio a epifluorescenza può essere utilizzato per l'imaging. A seconda delle sorgenti di luce disponibili, selezionare un coniugato appropriato del lipido-colorante.
Risultati
La sospensione del lipido ottenuto nel passaggio 1 del protocollo e utilizzato in tutto gli esperimenti contiene due tipi principali di vescicole: MLV e GUV. Figura 1 A-1F spettacoli laser a scansione confocale micrografie delle vescicole nel campione iniziale costruito in 3D. Figura 1 A-1_C Mostra un MLV (deposito di lipidi) nel xyz, xz e yz aerei, rispettivamente. Figura 1 D-1F Mostra simili vedute di una vescicola unilamellari gigante (GUV). La parte interna del Guv, che difettano di multilamellarity, è vuota; quindi, il materiale del lipido per la diffusione è significativamente limitato. Di conseguenza, i serbatoi del lipido utile solo per questo metodo sono MLV.
Quando la sospensione del lipido è trasferita alla camera di osservazione contenente il Ca2 +- tampone HEPES (Figura 1G), MLV (Figura 1A-1_C) iniziano a stabilirsi nell'area di Al2O3 . In caso di contatto, le vescicole aderiscono alla superficie, e una membrana di bilayer del lipido piatta doppia circolare (DLBM) inizia a diffondersi da ogni MLV sul supporto solido (Figura 1H-1J). Il MLV agisce come un serbatoio che fornisce i lipidi per la continua espansione DLBM. La membrana distale doppio strato (superiore), per quanto riguarda il supporto solido, è collegata alla membrana prossimale (inferiore) doppio strato lungo la circonferenza del bordo circolare, eseguendo un movimento rotatorio (Figura 1ho). I due strati lipidici sono posizionati categoricamente in cima a vicenda, avendo solo una sottile pellicola liquida incapsulata tra loro. Durante la diffusione, la membrana prossimale continuamente aderisce al piano di appoggio sottostante, mentre la membrana distale è tirata lateralmente ai bordi di espansione bordo prossimale della membrana. La diffusione della DLBM è mediata da Ca2 +, che agisce come un agente fusogena tra gruppi testa del lipido della membrana prossimale e substrato solido4.
Se la diffusione continua per periodi prolungati, la membrana tensione aumenta, portando a rottura (Figura 2A e 2B). Dopo questo punto, retrazione della membrana, che è necessario creare la morfologia tubolare ER, non può essere indotto. Pertanto, è importante riconoscere le membrane rotte. Poiché i lipidi nei nostri esperimenti fluorescente sono etichettati, la rottura può essere osservata direttamente. Un indicatore chiave di rottura è il significativo calo dell'intensità di fluorescenza nella regione rotto (Figura 2A e 2B)14. La rottura è un risultato dell'aumento della tensione e formazione successiva dei pori nella membrana distale. Sotto un microscopio a fluorescenza, le regioni rotte esporrà quindi metà l'intensità di emissione (singolo doppio strato prossimale) delle regioni unruptured (doppio strato doppio)14 (Figura 2B). Durante la formazione del poro, il materiale della membrana, che inizialmente era posizionato a regioni rotte, migra verso i bordi della patch diffusione. Questo a sua volta provoca una crescita della superficie totale di patch. Pertanto, una rapida espansione del contorno della patch circolari possa essere osservata anche durante la rottura.
Per evitare la crescita estensiva che conduce alla rottura delle patch, subito dopo l'area circolare patch raggiunge 100-200 µm, il buffer di Ca2 +- HEPES viene rimosso delicatamente con una pipetta automatica fino a una sottile pellicola di liquidi rimane sulla superficie. Il buffer di chelante-HEPES delicatamente viene quindi aggiunto alla camera per avviare la retrazione (Figura 1K). Una completa disidratazione del campione (Figura 2C) o scambio rapido di buffer (Figura 2D e 2E) provoca la dispersione, la rottura o la deformazione delle patch. L'aggiunta di chelanti rimuove gradualmente Ca2 + dallo spazio tra la superficie e la membrana. Il buffer di chelante-HEPES accede gradualmente lo spazio inter-bilayer-substrato, a partire dalla periferia della zona di membrana lipidica. Pertanto, la rimozione dei siti schienando inizia dai bordi della patch circolare e si propaga verso l'interno (Figura 1K-1 ° trimestre). A seguito di depinning, la membrana lipidica inizia a staccare e ritrarre dal verso l'interno bordi, progredendo verso il MLV al centro. Il processo di retrazione conduce a una nuova interfaccia di sviluppo dinamico lipidico reti tubolari4 (Figura 1L-1Y). Le regioni persistente del blocco, che non consentono la membrana a staccare completamente, rimangono la tabulazione mononucleata e di superficie, che conduce lungo ramificata rete di nanotubi. (Figura 1L-1Y). Continuo de-pinning e ulteriore retrazione del lipido nanotubi sono osservate nel tempo come risultato il processo graduale di chelazione. Questo involgarimento e riorganizzazione dei rami rete svolge un ruolo chiave nel comportamento dinamico delle reti tubolari, che ricordano il re liscio.
Figura 1 L-1Y Mostra le micrografie delle reti nanotubi ottenute nel protocollo. Figura 1 L è che un primo piano della regione in Figura 1M contrassegnato nel riquadro bianco. Le regioni di rosso continue in Figura 1L e 1 M sono la frazione retrattile di DLBM (segnato con una linea blu tratteggiata in Figura 1M). Il micrografo di una rete tubolare in Figura 1N e 1O è invertito per aumentare il contrasto. Figura 1 P e 1Q raffigura la riduzione della densità del tubolare su un'area di membrana nel corso di 3 ore e 20 min. La diminuzione di densità tubolare si verifica a causa del graduale depinning seguita da retrazione della DLBM dalla superficie nel periodo di tempo sperimentale. Nel corso del tempo, il numero di punti liberato da appuntare aumenta, portando a riorganizzazioni e una riduzione dell'area coperta da tubi (Figura 1P e 1Q). I riarrangiamenti tubolari sono motivati da minimizzazione di energia libera di superficie di un nanotubo lipidica sospeso tra due punti fissi. È affermato che il modo più efficace di ridurre al minimo l'energia di superficie di un nanotubo è quello di ridurre la sua lunghezza15. Pertanto, quando le regioni fusogena, che inizialmente tengono i nanotubi sulla superficie, sono de-appuntate, i nanotubi diapositiva e si organizzano spontaneamente, l'adozione di una lunghezza minima. Queste riorganizzazioni causano una gradualmente ridotta copertura della superficie di nanotubi (Figura 1P e 1Q).
Noi non possiamo visualizzare il Ca2 +-mediata blocco punti, ma stabiliamo loro posizioni come i punti dove i tubi hanno terminali o taglienti giri. Curve strette sono definite come V-giunzioni15 o punti di svolta per il cambiamento improvviso nella direzione di allineamento del tubo (frecce verdi nella Figura 1R e 1 X). L'end-point rappresenta il capolinea del tubo, che impedisce che il tubo di retrazione (frecce arancioni in Figura 1X). Durante la riorganizzazione, energico favorevole disposizione dei tubi identificato come "Y-giunzioni" o "3-way giunzioni", vengono visualizzati. Y-bivio si connette tre tubi con angoli di 120° circa tra ogni tubo, dove si possa fissare la lunghezza totale tubo più corta. Le giunzioni di Y, che non possiedono un end-point e invece sono posizionate tra nanotubi di più, non sono state bloccate. Questo è l'unico tipo di Y-giunzione che può eseguire scorrevole (frecce blu, Figura 1R). Come illustrato nella Figura 1R e 1S, scorrevole di una giunzione di Y lungo un risultati altamente instabile intersezione nella formazione dei due singole Y-giunzioni (frecce blu in Figura 1S). La linea bianca tratteggiata sovrapposta Figura 1S rappresenta il contorno del frammento rete tubolare in Figura 1R. Una frazione delle Y-giunzioni possiede terminali (freccia gialla in Figura 1T) che, nel tempo, alla fine di ritrarre (Figura 1U). La trasformazione di un V-bivio per un singolo, tubo dritto di depinning del punto di intersezione dei due segmenti e di ritrazione di uno dei tubi che formano la forma a V si può osservare in Figura 1V e 1W e Figura 1X e 1Y, rispettivamente.
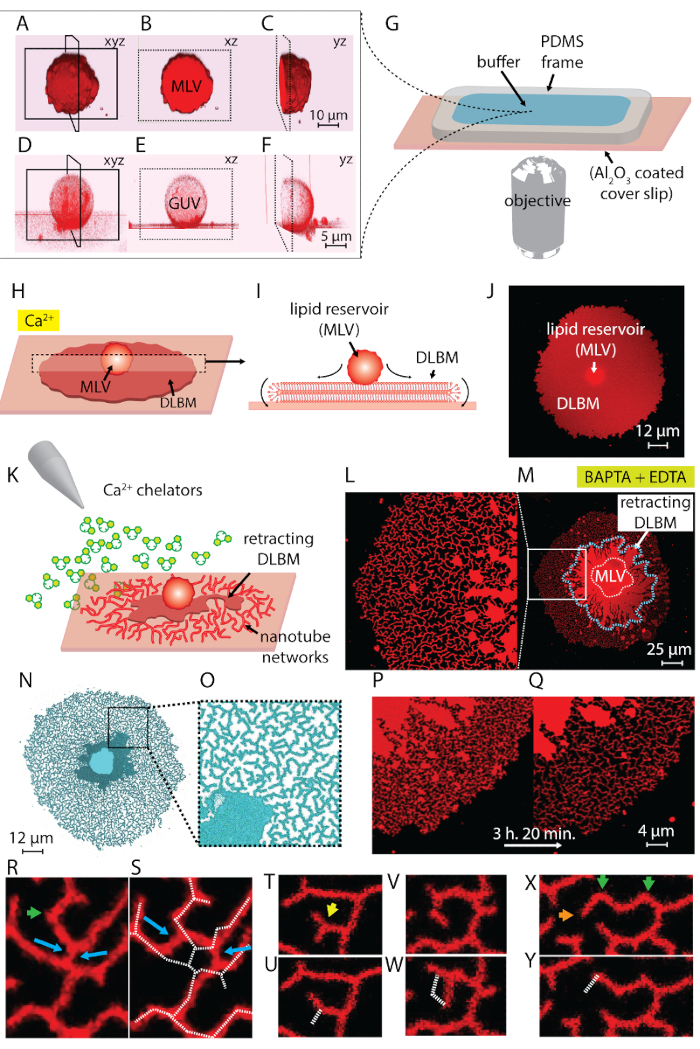
Figura 1 : Trasformazione del lipido depositi a ER-come reti tubolari. (A-F) Laser a scansione confocale micrografie delle vescicole nel campione iniziale, costruito in 3D. (A-C) Gli aerei delle vescicole multilamellari lipidica (MLV, deposito di lipidi) in xyz, xz e yz, rispettivamente. (D-F) Opinioni simili di una vescicola unilamellari gigante (GUV). La parte interna del Guv è cava, che rende il materiale lipidico per diffusione significativamente limitata. I serbatoi dei lipidi utili per questo metodo sono pertanto MLV. (G) illustrazione di camera di osservazione montata su un microscopio rovesciato sul quale sono depositati i buffer e lipidi. La camera è composta da un PDMS telaio aderito su un coprioggetto Al2O3 rivestito, fornendo un alto volume aperto. (H-J) Illustrazione dei fenomeni diffusione di MLV in presenza di Ca2 +. (H) al contatto con Al2O3, il MLV si diffonde spontaneamente in forma di una circolare, doppia membrana lipidica a doppio strato (DLBM). (I) vista laterale schematica di DLBM nel piano xz, dove le periferie eseguono il movimento di rotolamento. MLV (d = 5-15 µm) e DLBM (spessore = 10 nm) non vengono disegnate in scala. (J) un confocal microfotografia di una diffusione DLBM da vista dall'alto. (K) viene descritto il passaggio principale del presente protocollo, dove il buffer viene scambiato per uno contenente Ca2 + agenti chelanti, inibendo la diffusione, causando la ritrazione della DLBM fino al MLV e che portano alla formazione dei nanotubi del lipido. (L-Y) Micrografie delle reti nanotubi ottenute con il metodo descritto. (L) primo piano della regione a (M) segnata in un frame. Le regioni rosso continue (L e M) rappresentano il DLBM (anche segnato con una linea tratteggiata blu in M). Il micrografo di una rete tubolare in (N e O) è invertito per aumentare il contrasto. (P e Q) Raffigurazione della riduzione della densità del tubolare su un'area di membrana nel corso delle riorganizzazioni del tubolare rappresentante 3 h e 20 min (R-Y). (R e S) Scorrevole, (T e U) la transizione di una Y-giunzione a V-giunzione di ritrazione di un end-point e (V e W) de-pinning di un punto di svolta, con conseguente eradicazione di una giunzione di V. (X e Y) Ritrazione di un end-point. Clicca qui per visualizzare una versione più grande di questa figura.
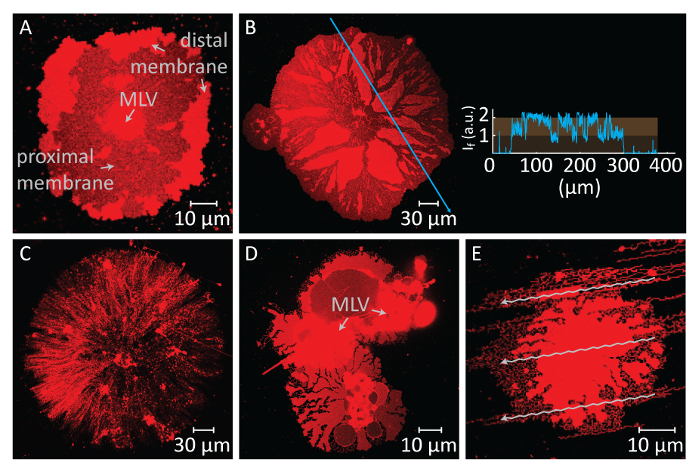
Figura 2 : Risultati negativi potenziali. (A e B) Rottura della membrana distale a causa di un lungo tempo di attesa prima dello scambio dei buffer. Le aree rotte, dove la membrana prossimale diventa visibile, appaiono come regioni scure rispetto alle regioni unruptured membrana distale. L'inserto al pannello B Mostra l'intensità della luce lungo la freccia blu sul micrografo. L'intensità delle regioni rotte della membrana (prossimale/singolo doppio strato diventa visibile) corrisponde alla metà l'intensità della membrana unruptured (distale matrimoniale/doppio strato). (C) aspetto di una patch di secca lipidica formata a seguito della rimozione di tutti i liquidi dalla camera di osservazione. (D ed E) Rottura della membrana di scambio rapido di buffer tramite pipetta automatica. (D), il MLV è suddiviso in 2 MLV, portando a una patch del lipido non circolari, deformi. (E), il modello del flusso (frecce), creato da forte iniezione del buffer chelante-HEPES, si riflette sulla struttura da membrana. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Nella discussione seguente, sono descritte le fasi critiche, eventuali modifiche e limitazioni del protocollo. Il primo passaggio fondamentale è il corretto assemblaggio della camera di osservazione, dato che l'adesione del telaio alla superficie Al2O3 PDMS è intrinsecamente debole. Nel caso in cui il telaio non aderisce al substrato correttamente, il contenuto verrà una perdita dalla camera di osservazione e l'esperimento verrà a una battuta d'arresto. I principali fattori che ostacolano la corretta tenuta della superficie e telaio sono 1) la mancanza di pulizia accurata del telaio PDMS (riutilizzato) e 2) aria bolle che occasionalmente ottenere intrappolate tra il telaio e il substrato. Deve essere utilizzato un telaio PDMS appena preparato o pulito accuratamente. Il telaio deve essere risciacquato prima e dopo ogni utilizzo con isopropanolo, seguita da risciacquo con acqua deionizzata e asciugare con azoto. Le superfici di Al2O3 non richiedono alcuna preventiva pulizia, poiché sono fabbricati in un ambiente di camera bianca e conservati in contenitori sigillati fino all'utilizzo. Dovuto la natura anfotera dell'Al2O3, non dovrebbe essere esposto alle soluzioni fortemente acidi o basici. Altri disegni per la camera di osservazione possono essere impiegate, a seconda di accessibilità dell'installazione individuale. Caratteristiche importanti di quest'Aula sono accesso gratuito per il campione di liquido dalla parte superiore aperta e l'inerzia del materiale telaio per quanto riguarda le soluzioni utilizzate e campioni. Le dimensioni della camera sono anche un fattore significativo, in quanto dovrebbe ospitare un volume da 0,5 a 1 mL. Poiché le superfici utilizzate sono in genere di dimensioni standard coprioggetti (24 x 60 mm), il volume della camera è determinato principalmente dallo spessore del telaio. A nostra conoscenza, distanziali con la dimensione e la profondità che può ospitare i volumi di campione in genere gestiti in questo protocollo non sono commercialmente disponibili. Pertanto abbiamo dedicato una sezione nel protocollo di dettagli di fabbricazione e assemblaggio di un telaio di alloggiamento del campione.
L'altro passo critico in questo protocollo è lo scambio di buffer. Una sfida in questo passaggio è la tempistica necessaria per eseguire questo scambio. La diffusione di MLV al contatto con il substrato di Al2O3 è immediata, e la continua espansione del DLBM conduce alla sua rottura, che chiude l'esperimento (Figura 2A, B). Di conseguenza, la diffusione deve essere costantemente monitorata e lo scambio di buffer deve essere eseguito in modo tempestivo. Lo scambio non deve essere eseguito troppo in fretta dopo l'inizializzazione della diffusione, al fine di consentire le patch di membrana raggiungere una dimensione ottimale (100-200 µm di diametro). D'altra parte, continua adesione sulla superficie provoca una membrana ad alta tensione, che conduce alla rottura. Così, membrana tutte le patch alla fine rottura se la diffusione non è interrotto. I tempi della rottura è diverso per ogni patch, dato che dipende la dimensione e la struttura interna al MLV e accessibilità dei lipidi in esso. Quindi, il momento dello scambio deve essere disposte a un timepoint in cui la patch non-rotto con dimensioni ottimali rappresentano una maggioranza dell'intera popolazione. Un'altra sfida per il passo del cambio di buffer è il tasso di rimozione e aggiunta dei buffer. Eseguire questa sostituzione troppo rapidamente ha un'influenza negativa sulle strutture di membrana finale (Figura 2C-E). L'eccessiva estrazione del Ca2 +- HEPES buffer senza lasciare una sottile pellicola liquida sul substrato, si traduce in patch di membrana secca e irreversibilmente deformati (Figura 2C). Anche se una quantità adeguata di liquido viene mantenuta sulla superficie, brusco aggiunta del buffer chelante-HEPES provoca anche perturbazione delle strutture della membrana. Figura 2 D,E Mostra il tipico aspetto di patch di membrana idrodinamicamente perturbato. La rottura nel complesso morfologica non influenza necessariamente le proprietà dinamiche delle strutture finale (cioè, le riorganizzazioni tubolare in zone restanti si verificano ancora). Tuttavia, diventerà difficile osservare la trasformazione materiale sulle strutture deformate. Ad esempio, in Figura 2D, sarebbe difficile determinare la direzione verso la quale si ritrae MLV il DLBM.
Una eventuale modifica del protocollo è la composizione lipidica usata. L'obiettivo principale è stato il fosfolipidi che dominano la composizione di ER nei mammiferi e16 di lievito (e. g., fosfatidilcolina (PC), phosphatidylethanolamine (PE) e fosfatidilinositolo (PI). Gli esperimenti originali sono stati eseguiti utilizzando PC e PI miscele4. Nei risultati presentati, veniva utilizzate una miscela di PC e DOPE e un derivato del PE. Tuttavia, non tutte le composizioni di arbitrario del lipido sono state trovate per creare le strutture tubolari ottenute tramite questo protocollo. Alcune delle altre miscele lipidica sperimentalmente indagati coinvolgono cuore totale estratto, Estratto di fagiolo della soia polar, Estratto di e. coli polar, miscele di PC con stearoyl-2-hydroxy-sn-glycero-3-phosphoinositol (Lyso-PI) in proporzioni variabili e miscele di PC-PE-PI-Posphatidyl serina (PS) in proporzioni variabili. Poiché strutture della membrana tubolare possiedono alte curvature e richiedono speciale disposizione delle molecole del lipido individuali, si prevede che il fenomeno osservato è lipido composizione specifica.
Un'altra modifica applicata in questo protocollo è il metodo per montaggio superficiale. Qui, l'ALD è stata usata per fabbricare Al2O3 verniciato a lamelle. Questo differisce dal metodo originariamente riferito deposizione, reattivo sputtering4. Mentre questo indica che un metodo di fabbricazione alternativi di superficie può ancora portare a ER-come tubulation, una limitazione importante sembra essere la specificità del materiale della superficie. La modalità di diffusione e la forza di adesione è fortemente dipendente dalle proprietà del materiale della superficie, che influenzano fattori come interazioni elettrostatiche, bagnabilità, idrofobicità e rugosità della superficie. Al2O3 superfici forniscono la forza di adesione ottimale, e film lipidico può entrambi collegare abbastanza fortemente per diffondere come una membrana di bilayer del lipido doppio e staccare per formare reti tubolari dopo la rimozione di ioni Ca2 + . Abbiamo testato in precedenza lo stesso esperimento con SiO2, in cui le vescicole multilamellari diffondersi come una membrana di bilayer del lipido doppio, ma nessuna formazione di rete tubolare è stata osservata con l'aggiunta di chelanti17. De-attaccamento e formazione del tubo sono osservate solo su Al2O3 o al plasma inciso Al18. Le nostre indagini hanno rivelato che il parametro che contribuisce portando a tale fenomeno era la zeta potenziale delle superfici, per cui Al e Al2O3 erano vicino a zero (mV) e SiO2 significativamente negativo. Il potenziale zeta in borosilicato è simile a SiO219; di conseguenza, adesione del film lipidico in borosilicato è altrettanto forte e irreversibile. Infatti, lipidi multilamellari serbatoio a contatto con superfici di borosilicato in genere conduce alla immediata rottura e formazione di singolo lipidi bilayer20. Al2O3 superfici necessarie per questo protocollo non sono prontamente o commercialmente disponibili. Possono, tuttavia, essere personalizzato-ordinato da produttori di vetro e substrato di specialità. Accesso ai servizi di camera bianca con apparecchiature di fabbricazione di film sottile è altamente raccomandato.
Gli altri metodi esistenti di ascendente per fabbricare reti tubolari ER-come2,10 coinvolgono proteine così come l'input di energia chimica (ad es., ATP e GTP). Rapoport e colleghi2 segnalata la formazione di reti di ER il vetro coprioggetti in vitro miscelando le proteine di membrana di piegamento presenti in ER, con fosfolipidi e GTP. Il lavoro di Bachand et al. 10 Mostra come tali reti tubolari dinamiche possono essere creati utilizzando motori molecolari e ATP come fonte di energia. Questo protocollo presentato non richiede proteine di membrana o idrolisi di composti organici per l'energia. I componenti essenziali sono il substrato solido e fosfolipidi. Purificazione ed estrazione delle proteine non sono necessari. Questo protocollo fornisce, in termini di semplicità delle molecole costitutive, il modello più semplice di ER.
Con questo modello base, basata sui lipidi ER stabilito, costruire complessità aggiungendo componenti ER-collegata è di interesse, poiché permette di indagine dei singoli impatti sul sistema. Simili alle attuali reti ER, tubi nel modello sono dinamici. La coniugazione e la migrazione delle proteine di membrana con etichetta o particelle fluorescenti in tutta la rete tubolare, può dare informazioni sulla direzione del movimento della membrana. Incapsulamento e monitoraggio dei liquidi all'interno del DLBM e tubi fluorescenti durante la trasformazione e un mapping possibile del trasporto contenuto intratubular può servire come un altro fuoco. Infine, una transizione dal modello ER 2D risultanti da questo protocollo verso un modello 3D di ER regolare può essere adottata tramite l'incapsulamento delle reti nelle architetture di idrogel.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo il professor Aldo Jesorka da Chalmers University of Technology in Svezia per il suo prezioso commento sul manoscritto. Questo lavoro è stato reso possibile attraverso il sostegno finanziario ottenuto dal Consiglio di ricerca della Norvegia (Forskningsrådet) progetto Grant 274433, UiO: ambiente di convergenza di Scienze della vita, il 04561-Swedish Research Council (Vetenskapsrådet) progetto Grant 2015, come pure il finanziamento di Start-up fornito dal centro per la medicina molecolare Norvegia & facoltà di matematica e scienze naturali presso l'Università di Oslo.
Materiali
| Name | Company | Catalog Number | Comments |
| Pear-shape flask 10 mL | Lenz Laborglasinstrumente | 3.0314.13 | In which the lipid mixture is prepared |
| Hamilton 5 mL glass syringe (P/N) | Hamilton | P/N81520 | For transfer of the chloroform to beaker |
| Custom large hub needle Gauge 22 S | Hamilton | 7748-18 | Removable needle for syringe specified in row 3 |
| Hamilton 250 µL glass syringe | Hamilton | 7639-01 | Used for transfer of lipids in chloroform to the flask |
| Large hub Gauge 22 S | Hamilton | 7780-03 | Removable needle for syringe specified in row 5 |
| Hamilton 50 µL glass syringe | Hamilton | 7637-01 | Used for transfer of fluorophore-conjugated lipids to the flask |
| Small hub Gauge 22 S | Hamilton | 7770-01 | Removable needle for syringe specified in row 7 |
| Chloroform anhydrous (≥99%) | Sigma-Aldrich | 288306 | Used to complete the lipid mixture to a total of 300 µL |
| Soy L-α Phosphatidyl choline lipid (Soy PC) | Avanti Polar Lipids Inc | 441601 | phospholipid species contributing to 69% of the total composition/mixture |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE) | Avanti Polar Lipids Inc | 850725 | phospholipid species contributing to 30% of the lipid composition/mixture |
| L-α Phosphatidyl inositol lipid (Soy PI) | Avanti Polar Lipids Inc | 840044 | alterative phospholipid species contributing to 30% of the lipid composition/mixture (from the original article Bilal and Gözen, Biomaterials Science, 2017) |
| Texas Red 1,2-dihexadecanoyl-sn-glycero-3-phosphoethanolamine,triethylammonium salt (Texas Red DHPE) | Invitrogen (Thermo Fisher Scientific) | T1395MP | Fluorescent-lipid conjugate, 1% of the lipid composition/mixture |
| Digital Dry Baths/Block Heaters | Thermo Fischer | 88870006 | To warm glycerol in order to decrease its viscosity |
| Glycerol for molecular biology (≥99%) | Sigma Life Science | G5516 | For lipid preparation |
| PBS buffer (pH=7.8); ingredients below in rows 17-21 | Used to prepare the lipid suspension | ||
| TRIZMA base, primary standard and buffer (≥99%) | Sigma Life Science | T1503 | Used to prepare PBS buffer |
| Potassium phosphate tribasic, reagent grade (≥98%) (K3PO4) | Sigma-Aldrich | P5629 | PBS buffer ingredient |
| Magnesium sulfate heptahydrate, BioUltra (≥99,5%) KT (MgSO47H2O) | Sigma Life Science | 63138 | PBS buffer ingredient |
| Potassium phosphate monobasic, anhydrous, free flowing, Redi-Dri, ACS (KH2PO4) | Sigma-Aldrich | 795488 | PBS buffer ingredient |
| Ethylenediaminetetraacetic acid disodium salt dihydrate ACS reagent, 99.0-101.0% (Na2EDTA) | Sigma-Aldrich | E4884 | PBS and Chelator-HEPES buffer ingredient |
| Ultrasonic cleaner USC-TH | VWR | 142-0084 | Ultrasonication of rehydrated lipids |
| Rotary evaporator - Büchi rotary evaporator Model R-200 | Sigma | Z626797 | For evaporation of chloroform |
| Pressure meter - Vacuum regulator IRV-100 | SMC | IRV10/20 | For controlling the pressure value during lipid dehydration |
| HEPES-buffer (pH=7.8); ingredients below in rows 26-27 | Used for rehydration of lipids. Content: 10 mM HEPES with 100 m NaCl diluted in ultrapure deionized water | ||
| HEPES ≥99.5% (titration) | Sigma Life Science | H3375 | HEPES-buffer ingredient |
| Sodium chloride for molecular biology, DNase, RNase, and protease, none detected, ≥98% (titration) (NaCl) | Sigma Life Science | S3014 | HEPES-buffer ingredient |
| Calcium-HEPES buffer (pH=7.8); effective ingredient below in row 29 | Used for spreading of lipids. Content: 10 mM HEPES, 100 mM NaCl, 4 mM CaCl2 diluted in ultrapure deionized water | ||
| Calcium chloride anhydrous, BioReagent, suitable for insect cell culture, suitable for plant cell culture, ≥96.0% (CaCl2) | Sigma Life Science | C5670 | To prepare Calcium-HEPES buffer |
| Chelator-HEPES buffer (pH=7.8); effective ingredient below in row 31 | Used to promote the formation of tubular networks. Content: 10 mM HEPES, 100 mM NaCl, 10 mM EDTA and 7 mM BAPTA diluted in ultrapure deionized water | ||
| 1,2-Bis(2-aminophenoxy)ethane-N,N,N′,N′-tetraacetic acid tetrasodium salt ≥95% (HPLC) (BAPTA-Na4) | Sigma Life Science | 14513 | Chelator-HEPES buffer ingredient |
| Sodium Hydroxide | Sigma | 30620 | Basic solution used to adjust the pH of the buffers |
| pH meter accumet™ AE150 pH | Fisher Scientific | 1544693 | Used to measure the pH of all buffers |
| Glass petri dish | VWR | HECH41042012 | 6 cm, used for making the PDMS sheet |
| Potassium hydroxide ACS reagent, ≥85%, pellets (KOH) | Sigma-Aldrich | 221473 | To make the KOH solution for cleaning glass petri dish for the fabrication of the PDMS sheet |
| Isopropanol prima ren 99.5% | Antibac AS | 600079 | KOH solution ingredient |
| Heating and drying oven - venticell | MMM Medcenter Einrichtungen GmbH | MC000714 | For drying of the glass petri dish after silanization and to cure PDMS |
| Dichlorodimethylsilane ≥99.5% | Sigma-Aldrich | 440272 | Used for silanization of glass petri dish in which PDMS sheet is prepared |
| Vacuum pump | Cole-Parmer | EW-79202-05 | Connected to desiccator |
| Sylgard 184 silicone elastomer curing agent | Dow corning | 24236-10 | Kit to make PDMS solution |
| Sylgard 184 Silicone elastomer base | |||
| Disposable scalpel | Swann-Morton | 11798343 | Used to cut the PDMS |
| Cover slips | Menzel -Gläser | MEZ102460 | 24x60 mm. Used to deposit thin film of Al2O3 |
| Atomic layer deposition system | Beneq | TFS200 (model number) | Atomic Layer deposition system used to deposit thin film of Al2O3 in microscope cover glass |
| Ellipsometer | J.A. Woollan Co. | Alpha-SE (model name) | System used to charcaterize the thickness of the film deposited on glass surface |
| Laser scanning confocal microscope | Leica Microsystems | Leica TCS SP8 X | Microscope used for visualization of the experiment |
| Objective 40x, 1.3 NA | Leica Microsystems | 1550635 | Used for visualization of the experiment |
| White light laser source | Leica Microsystems | Leica TCS SP8 X | For excitation of the membrane fluorophore |
Riferimenti
- Chen, S., Novick, P., Ferro-Novick, S. ER structure and function. Current Opinion in Cell Biology. 25 (4), 428-433 (2013).
- Powers, R. E., Wang, S., Liu, T. Y., Rapoport, T. A. Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature. 543 (7644), 257-260 (2017).
- Pendin, D., McNew, J. A., Daga, A. Balancing ER dynamics: Shaping, bending, severing, and mending membranes. Current Opinion in Cell Biology. 23 (4), 435-442 (2011).
- Bilal, T., Gözen, I. Formation and dynamics of endoplasmic reticulum-like lipid nanotube networks. Biomaterials Science. 5 (7), 1256-1264 (2017).
- Shibata, Y., et al. Mechanisms determining the morphology of the peripheral ER. Cell. 143 (5), 774-788 (2010).
- Ozcan, L., Tabas, I. Role of endoplasmic reticulum stress in metabolic disease and other disorders. Annual Review of Medicine. 63, 317-328 (2012).
- Yamanaka, T., Nukina, N. ER dynamics and derangement in neurological diseases. Frontiers in Neuroscience. 12, (2018).
- Taalab, Y. M., et al. Mechanisms of disordered neurodegenerative function: Concepts and facts about the different roles of the protein kinase RNA-like endoplasmic reticulum kinase (PERK). Reviews in the Neurosciences. , (2018).
- Shemesh, T., et al. A model for the generation and interconversion of ER morphologies. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 5243-5251 (2014).
- Bouxsein, N. F., Carroll-Portillo, A., Bachand, M., Sasaki, D. Y., Bachand, G. D. A continuous network of lipid nanotubes fabricated from the gliding motility of kinesin powered microtubule filaments. Langmuir. 29 (9), 2992-2999 (2013).
- Sackmann, E. Endoplasmatic reticulum shaping by generic mechanisms and protein-induced spontaneous curvature. Advances in Colloid and Interface Science. 208, 153-160 (2014).
- Jesorka, A., et al. Generation of phospholipid vesicle-nanotube networks and transport of molecules therein. Nature Protocols. 6, 791 (2011).
- Hook, D. A., Olhausen, J. A., Krim, J., Dugger, M. T. Evaluation of Oxygen Plasma and UV Ozone Methods for Cleaning of Occluded Areas in MEMS Devices. Journal of Microelectromechanical Systems. 19 (6), 1292-1298 (2010).
- Gözen, I., et al. Fractal avalanche ruptures in biological membranes. Nature Materials. 9 (11), 908-912 (2010).
- Lobovkina, T., Dommersnes, P., Joanny, J. -. F., Hurtig, J., Orwar, O. Zipper Dynamics of Surfactant Nanotube Y Junctions. Phys Rev Lett. 97, (2006).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews Molecular Cell Biology. 9 (2), 112-124 (2008).
- Gözen, I., et al. Repair of large area pores in supported double bilayers. Soft Matter. 9 (10), 2787-2792 (2013).
- Gözen, I., et al. Thermal migration of molecular lipid films as a contactless fabrication strategy for lipid nanotube networks. Lab on a Chip. 13 (19), 3822-3826 (2013).
- Sides, P. J., Hoggard, J. D. Measurement of the Zeta Potential of Planar Solid Surfaces by Means of a Rotating Disk. Langmuir. 20 (26), 11493-11498 (2004).
- Nissen, J., Jacobs, K., Rädler, J. O. Interface Dynamics of Lipid Membrane Spreading on Solid Surfaces. Physical Review Letters. 86 (9), 1904-1907 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon