Method Article
Spontane Bildung und Neuordnung der künstlichen Lipid Nanotube Netze als Bottom-Up-Modell für endoplasmatische Retikulum
In diesem Artikel
Zusammenfassung
Solide unterstützt, eiweißfreie, doppelte Phospholipid Bilayer Membranen (DLBM) können in komplexen und dynamischen Lipid Nanotube Netze umgewandelt werden und können als 2D Bottom-up-Modellen von dem endoplasmatischen Retikulum dienen.
Zusammenfassung
Wir präsentieren Ihnen eine bequeme Methode, um eine strukturelle Organelle Bottom-Up-Modell für das endoplasmatische Retikulum (ER) bilden. Das Modell besteht aus sehr dichtem Lipid-Nanoröhren, die, in Bezug auf die Morphologie und Dynamik, ER erinnert. Die Netze werden von Phospholipid Bilayer doppelte Membran Patches festhalten an einem transparenten Al2O3 Substrat abgeleitet. Die Haftung wird von Ca2 + im ambient Puffer vermittelt. Nachfolgende Erschöpfung der Ca2 + mittels BAPTA/EDTA bewirkt, dass Retraktion der Membran, was zu spontanen Lipid Nanotube Netzwerkbildung. Die Methode besteht aus Phospholipiden und Microfabricated Oberflächen für einfache Bildung von ein ER-Modell nur und erfordert nicht die Zugabe von Proteinen oder chemische Energie (z. B. GTP oder ATP). Im Gegensatz zu den 3D Morphologie der zellulären endoplasmatische Retikulum ist das Modell zweidimensional (wenn auch die Nanoröhre Maße, Geometrie, Struktur und Dynamik beibehalten werden). Dieses einzigartige in-vitro- ER-Modell besteht aus nur wenigen Komponenten, ist leicht zu bauen, und unter einem Lichtmikroskop beobachtet werden kann. Die resultierende Struktur kann für zusätzliche Funktionen, wie die Zugabe von ER-assoziierte Proteine oder Partikel, Transportphänomene unter den Rohren zu studieren weiter verziert werden. Die künstlichen Netzen, die hier beschrieben sind geeignete strukturelle Modelle für die zelluläre ER, dessen einzigartige charakteristische Morphologie gezeigt hat, dass seine biologische Funktion verwandt werden während details zur Entstehung der manschettenförmige Bereich und Umstellungen innerhalb sind noch nicht vollständig verstanden. Wir stellen fest, dass diese Methode verwendet Al2O3 thin-Film-coated Mikroskopie Deckgläsern, die im Handel erhältlich, sondern erfordern spezielle Aufträge. Daher ist es ratsam, zur Vorbereitung auf eine Microfabrication Anlage zugreifen.
Einleitung
ER führt wichtige Aufgaben in der biologischen Zelle einschließlich der Proteinfaltung, Lipid-Synthese und Kalzium Verordnung1,2. Die ER Morphologie ist untrennbar mit den Funktionen, die es ausführt. Es verbindet planaren Stacks und dichten-dynamische röhrenförmigen Domains, die kontinuierlich interagieren mit dem Zytoskelett und ständig in Bewegung und Neuordnung zu unterziehen. Die Umgestaltung, dass ER Strukturen unterziehen gehören die kontinuierliche Transformation zwischen planaren Bleche und Rohre, Vesikel-Formation von oder Fusion zum ER-Lumen, Dehnung der bereits bestehenden Röhren, Röhre einfahren, Fusion und Bruch3. Die besondere Struktur der röhrenförmigen Netze ist energetisch ungünstig. Die Wege und Mechanismen, die ER erzeugt und behauptet, diese Organisation so gut wie dies bezieht sich auf seine Funktion nicht, verstanden noch4,5.
Es ist bekannt, dass ER Störungen wenn es verliert seine homöostatischen Zustand, wodurch ER Stress, eine Erkrankung, die durch eine Erhöhung der Proteinsynthese, Ansammlung von fehlgefaltete Proteine oder Änderungen in Ca2 + und oxidative Balance. ER verursacht Stress wiederum Verformung der natürlichen Morphologie der Organelle, speziell von störenden Netzwerk Organisation6,7. Als Reaktion aktiviert die Zelle einen Repair-Mechanismus, um einem homöostatischen Zustand zurückzukehren. Fehler in der Reparatur kann ER-induzierte Zellapoptose trägt zur mehrere metabolische und degenerative Erkrankungen wie Alzheimer-Krankheit, Typ-2-Diabetes, Morbus Parkinson, Amyotrophe Lateralsklerose und mehrere andere7, 8. Aktueller Forschung zielt auf die Organisation der röhrenförmigen ER Netze, und mehrere Studien konzentrieren sich auf Neuaufbau ER in-vitro-2. Ein paar bestehende Modelle2,9,10 benötigen Proteine zu initiieren und pflegen Membran Krümmung3,11 und helfen die Organellen, die seine Form zu erreichen. Klar, Modellsysteme, die spiegeln einige der wichtigsten strukturellen und organisatorischen Funktionen von der Notaufnahme und bieten Zugang zu erweiterten experimentellen Studien sind sehr gefragt.
Wir stellen Ihnen hier Verfahren für die Erstellung eines facile, Protein/chemische Energie frei, dynamischen in-vitro- Modell für die ER eine grundlegende Plattform um ER Morphologie und zugehörigen Funktionen4zu studieren. Bei dieser Methode wird eine ER-Modell hergestellt, mit einem Bottom-up-Ansatz mit nur wenigen Elementen, in denen die Moleküle des Interesses integriert werden können, um Komplexität hinzufügen. Das Netzwerk stellt ER Struktur und Dynamik. Darüber hinaus kann reversible Umwandlung zwischen der planaren Membran und die Rohre, Vesikel-Formation von Röhren, Röhre Fusion, Rutschen und Retraktion alle beobachtet werden. Zusätzlich dienen als Bottom-Up-Modell für zelluläre ER unvollständig verstanden, kann der Lipid-Weg zur Nanotube Netze beschrieben in diesem Protokoll für Forscher Selbstmontage, Nanofluidics, Einzelmolekül- und Kolloid anwendbar Transportphänomene, Marangoni fließen und anderen verwandten Bereichen. In unserer Methode verwendet nur molekulare Bausteine sind Phospholipide. Das Protokoll erfordert wenig Laborarbeit und Grundausstattung und ist zugänglich für die Aufnahme von zusätzlichen Elementen.
Protokoll
1. Vorbereitung des Phospholipid Vesikel Suspension
Hinweis: Für alle Materialien im Sinne als "sauber" in diesem Protokoll, gründlich mit Isopropanol, gefolgt von entionisiertem Wasser waschen und Föhnen sie mit Stickstoff. Beachten Sie, dass eine Behandlung von Glassubstraten mit stark oxidierende Säuren (Piranha-Lösung), die in der Regel in Vorbereitung-Protokolle für die unterstützten Lipid Filme auf festen Substraten angewandt wird, nicht auf Al2O3durchgeführt werden sollten-beschichtet Träger.
- Platz in einem sauberen 10 mL Rundboden oder invertierte birnenförmigen Glaskolben: Soja L-α-Phosphatidyl-Cholin (PC, 69 % w/w), 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (Schmiere, 30 % w/w) und ein Lipid-konjugiert Fluorophor [z. B. Texas Red 1,2 - Wahl Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamine-Triethylammoniumhydrochlorid-Salz (TR-DHPE, 1 % w/w)] in Chloroform; für einen Gesamtbetrag von 3000 µg von Lipiden in 300 µL Chloroform, wodurch eine Endkonzentration von 10 mg/mL.
Hinweis: Verwenden Sie sauber, Glas, gasdichte Spritzen mit Polytetrafluorethylen Kolben beim Umgang mit Verbindungen mit Chloroform.
Achtung: Chloroform ist giftig und sehr volatil und sollte immer unter einer Abzugshaube mit damit verbundenen persönlichen Schutzausrüstungen behandelt werden. - Verbinden Sie den Kolben mit Drehverdampfer, Position mit einer Neigung von 45° und 24 u/min in einem Wasserbad bei 23 ° C für 6 h mit reduziertem Luftdruck zu langsam drehen und die Chloroform vollständig zu entfernen. Starten Sie reduzieren den Druck rechts nach der Einleitung der Rotation in Schritten von 20 kPa alle 2 min bis 20 kPa (150 Torr, 80 % Vakuum) erreicht.
Hinweis: Die Bildung eines homogenen Lipid-Films von gleichmäßiger Dicke in der Vorbereitung Gefäß ist die wichtigste Voraussetzung für das Rotavap-Verfahren. Lipid-Vorbereitungen sind empfindlich gegen Rotationsgeschwindigkeit, schnellen Druckänderungen und Enddruck Wert; deshalb streng folgen Sie die langsame Reduktion Schritte sowie die Ende Druck und Rotation-Geschwindigkeit. Positionieren Sie den Kolben mit einer Neigung von 45° zu gewährleisten, dass die dehydrierte Lipid-Kuchen gleichmäßig wie ein Film an der Wand des Kolbens entsteht. Zu schnell von einer Rotation führt zu Turbulenzen und zu langsam für eine Drehung führt (Erdbeschleunigung) auf die Anhäufung von einer dicken Schicht von Flüssigkeit an der Unterseite des Kolbens. Während der anschließenden Übernachtung Schwellung Prozess, eine sehr inhomogene Lipid Masse entsteht, die nicht gut auf die endgültige Beschallung Schritt reagiert, und die daraus resultierenden Brüche sind verschiedene Kompositionen. Druck und Zeit innerhalb des Bereichs in der Methode angegeben wird langsam zugeführten sichergestellt. Mit Chloroform als Lösungsmittel kühlt auch Rapid bei Druckabfall die Mischung, was zu erhöhten Viskosität und aggregieren und unebenen Filmbildung. Der langen Zeitraum von 6 h wird empfohlen, um die so weit wie möglich, da die organischen Lösungsmittel Partitionen in der Lipid-Material nach Rehydratation Lösungsmittel zu entfernen. - Stoppen Sie nach 6 h die Rotation und erhöhen Sie den Luftdruck wieder, allmählich, in Schritten von 20 kPa alle 2 min bis zum erreichen von 100 kPa. Entfernen Sie die Flasche aus der Drehverdampfer und fügen Sie 3 mL PBS und 30 µL Glycerin hinzu. Vorsichtig schwenken die Flasche Glycerin zu lösen. Verwenden Sie eine luftdichte Glas-Stopper, um den Kolben mit den Lipiden zu versiegeln.
Hinweis: Das Glycerin wird verwendet, um die vollständige Austrocknung der Lipid-Film zu verhindern und ermöglicht Bilayer Trennung12. Es sollte vor dem Gebrauch, seine Viskosität zu verringern, die erleichtert den Umgang mit dieser Verbindung erhitzt werden. Die erwärmte Glycerin mischt noch nicht sofort mit dem PBS-Puffer. Sanfte Verwirbelung ist erforderlich, bis das Glycerin komplett aufgelöst ist. - Speichern Sie die Flasche im Kühlschrank bei 4 ° C über Nacht zur Rehydratation und Schwellungen der Lipid-Filme.
- Am Folgetag beschallen Sie die Lipide mit einem Ultraschall Wasserbad bei Raumtemperatur (RT, ~ 21 ° C) und bei 35 kHz Frequenz bis zum Erreichen einer einheitlichen, leicht trübe Lipid-Suspension.
Hinweis: Beschallung kann dauern rund um 10-30 S. längerer Beschallung (~ 1 min) erzeugt Wärme und wirkt sich nachteilig auf Bläschen Bildung. - Schritte 1.1-1.5 Ertrag einer Suspension enthält zwei Arten von vesikuläre Strukturen: multilamellar Vesikel (MLV) und giant Unilamellar Vesikeln (GUV) (Abbildung 1A-1F).
- Zur Lagerung teilen Sie die Lipid-Suspension in 100 µL-Aliquots, mit insgesamt 30 Mikrozentrifugenröhrchen auf und speichern sie in einem Gefrierschrank bei-20 ° C.
Hinweis: Flash mit flüssigem Stickstoff Einfrieren ist nicht notwendig und nicht vor der Lagerung verwendet. Das Protokoll kann hier angehalten werden. Verlassend Lipid Suspensionen im Kühlschrank 4 ° C für längere Zeiten Ursachen Lipid Lyse betrifft, die die Membran-Zusammensetzung.
2. Vorbereitung der Untergründe
Hinweis: Das folgende Protokoll erfolgt auf einem Reinraum ISO 8 eingestuft, in der ISO 14644-1 standard-Spezifikation. Atomic Layer Deposition (ALD) wird verwendet, um Al2O3 Substrate zu fabrizieren. Die angegebenen Prozessparameter sind abhängig von der Instrument und variieren zwischen den verschiedenen Modellen der Ausrüstung. Sie können als ersten Parameter verwendet werden, um den Prozess zu entwickeln.
- Stellen Sie die Temperatur des Reaktors ALD bis 200 ° C.
- Laden Sie die Glasflächen (z.B. Glasdeckgläser) in die Probenkammer mit einem Silizium-Wafer, die später als Referenzfläche verwendet werden, um Dicke der Ablagerung zu bestimmen von Ellipsometrie.
Hinweis: Glassubstrate waren verwendeten Out of Box und nicht vor Ablagerung Lösungsmittel gereinigt. Sie wurden nur mit Stickstoffgas Partikel entfernen gespült. - Evakuieren der Füllraum bis 400 Pa (3 Torr) übertragen die Proben in die Hauptreaktion Kammer und evakuieren sie bis 200 Pa.
Hinweis: Die Temperatur des Reaktors bei 200 ° C für richtige Ablagerung einzuhalten. Temperaturschwankungen nach Probenbeladung daher vor Beginn der Ablagerung equilibriert werden muss. Kammerdruck wird voraussichtlich höher sein als Reaktordruck Vorläufer, außerhalb der Kammer zu verbreiten zu vermeiden. - Hinterlegung des atomaren Films zu starten. Ein Zyklus besteht aus einer 150 ms Puls Trimethyl Aluminium Exposition, gefolgt von einer 1 s Säuberung und anschließend eine H2O Exposition von 200 ms Dauer, gefolgt von einer 1 s Säuberung.
Hinweis: Alle Einstellungen einschließlich der Kammer und Reaktor Druck, Länge der Zyklen und Säuberungen sind automatisiert, um eine definierte Abscheidung zu erzielen. Diese Parameter können unter den verschiedenen Modellen der Ausrüstung variieren. Die vorkonfigurierten Rezepte sind oft vorbereitet durch den Verkäufer oder Werkzeug im Reinraum verantwortlich und für den Benutzer als abgeschiedenen Schichtdicke pro Zeiteinheit mitgeteilt. - Erreiche 10 nm Al2O3 auf das Substrat, wiederholen Sie den Vorgang für 100 Zyklen. Die Anzahl der Zyklen hängt die Abscheiderate, die unter verschiedenen Rezepten oder Ausrüstung variieren.
- Um die Proben aus dem Reaktor zu entfernen, erste Vent der Kammer bis der Druck atmosphärischer Druck, erreicht dann die Proben entfernen.
- Speichern Sie die Proben in luftdichten Behältern bei RT bis zur Verwendung.
Hinweis: Keine weiteren vor Gebrauch reinigen. Das Protokoll kann hier angehalten werden.
Hinweis: Die Proben sollten idealerweise unmittelbar nach der Ablagerung verwendet werden. Die optimale Lagerung erfordert Positionierung der Oberflächen im Inneren Polypropylen Wafer Carrier, gefolgt von umhüllt die Träger in Reinraum-kompatiblen Plastiktüten, die Stickstoff gespült werden-vor dem Vakuumieren. Der Zweck ist, aussetzen der Oberfläche aerogene Kontaminationen zu vermeiden. Falls erforderlich, können die Oberflächen in luftdichten Behältern bei RT maximal für 5 Tage gehalten werden. Längerer Lagerung wird nicht empfohlen. Für Benutzer, die nicht bequem in ein sauberes Zimmer in der Nähe, und erwerben oder erhalten die Oberflächen aus dem Ausland, möglicherweise erneut oxidieren die Substrate mittels Plasma oder Ozon-Sauerstoff-Behandlung eine alternative Lösung13.
3. Umwandlung der molekularen Phospholipid Filme, röhrenförmigen Netze
- Tauen Sie die Lipid-Aussetzung und übertragen Sie ein 4 µL Tröpfchen der Suspension auf ein sauberes Glas Mikroskop Dia/Deckglas zu.
- Das Droplet für 20 min auszutrocknen. Das Droplet zusammenbrechen zu einem flachen runden Film von Lipiden nach Austrocknung, die für das Auge sichtbar ist.
- Rehydrieren die Lipid-Film mit 1 mL HEPES-Puffer (siehe Tabelle der Materialien) für 3 min.
Hinweis: Das Volumen der Rehydratation Puffer wirkt sich die Dichte des Vesikels Aussetzung (die Anzahl der Bläschen pro Volumeneinheit), die anschließend an die Beobachtung Kammer übertragen wird. Je nach Volumen der Kammer Beobachtung und die gewünschte Vesikel Dichte Rehydratation Volumen kann abgestimmt werden, um 0,5-1 mL. Saubere Borosilikat Folien neigen dazu, Tröpfchen von mehreren hundert Mikroliter unterstützen bis zu 1,5 mL ohne Probleme. Da das Deckglas nicht verschoben werden muss, führt dies nicht zu einem technischen Problem. Auf mehr hydrophobe Oberflächen, wie z. B. SU-8 Polymer beschichteten Folien können sogar 1,5 mL hinterlegten12sein.
Hinweis: Lipide sollten frisch zubereitet werden, wie Belichtung eingeweichtes Lipid-Film für mehr als 20 min bei RT zur Verdampfung des Puffers und partielle Austrocknung der zuvor eingeweichtes Vesikel führt, was dazu führt, eine schlecht Zusammensetzung definierte. - Bereiten Sie die Beobachtung Kammer: eine Beobachtung Kammer mit offenem Verdeck wurde verwendet, um Buffer Tausch durch eine automatische Pipette, die erforderlich ist, die ER Transformation zu initiieren zu ermöglichen. Diese Kammer besteht aus einem Polydimethylsiloxan (PDMS) Rahmen mit den Maßen von 1,5 x 1,5 x 0,5 cm, auf die Al2O3 hinterlegt Deckglas geklebt. In Abbildung 1Gist ein Schema der montierten Beobachtung Kammer vertreten. Die folgenden Schritte wurden durchgeführt, um der PDMS-Rahmen zu fertigen und montieren die Beobachtung Kammer:
- Bereiten Sie eine KOH-Lösung durch Mischen 100 g KOH mit 100 mL Isopropanol in ein Becherglas im Eisbad. Rühren Sie für 10 Stunden oder länger, bis die KOH mit einem Magnetrührer und magnetische rühren Platte vollständig gelöst ist.
Achtung: KOH-Lösung ist ätzend und kann zu Verbrennungen der Haut, also immer mit der richtigen persönlichen Schutzausrüstung behandeln.
Hinweis: Die Löslichkeit von KOH in Isopropanol ist nicht so hoch wie im Wasser. Die Auflösung ist exotherm. Die KOH-Pellets vor der Auflösung und kontinuierliche rühren Zerkleinern ist ratsam. - Tauchen Sie ein Glas Petrischalen (d = 6 cm) in der KOH-Lösung bei RT und halten Sie es über Nacht.
- Am nächsten Tag entfernen Sie die Glasschale aus der Projektmappe, Tauchen Sie ihn in einem Behälter mit entionisiertem Wasser für 5 Minuten spülen sie mehrmals mit Wasser und legen Sie sie in einem Trockenschrank bei 80 ° C für 1 h Schlag der Oberfläche kurz mit einem Strom von Stickstoff um sicherzustellen, dass ein Teil Icles werden entfernt.
- Passiviert die Oberfläche und verhindert Verkleben, PDMS, transfer 200 µL siliciumhaltigen mit einer Plastik Spritze in eine saubere Kunststoff Behälter wie z. B. eine Gewichtung Boot.
- Speichern Sie das Glas Petrischale zusammen mit dem Silan für 1 h in einem evakuierten Exsikkator (Grobvakuum, ~ 20 kPa).
Achtung: Siliciumhaltigen ist giftig und sollte immer unter einer Abzugshaube mit damit verbundenen persönlichen Schutzausrüstungen behandelt werden. - Warten Sie 15 Minuten vor dem Sammeln der Petrischale in Reihenfolge für die verbleibenden siliciumhaltigen Dampf zu zerstreuen. Die Petrischale ist jetzt silanisiert, und die Oberfläche ist hydrophob.
Hinweis: Eine schnelle Möglichkeit, den Erfolg dieses Schrittes zu testen ist ein Wassertropfen auf die silanisiert Petrischale platzieren. Der Kontaktwinkel des Tröpfchens mit der Oberfläche muss sichtbar im Vergleich zu unbehandeltem Glas erhöhen. - Mischen Sie in einem 250 mL Kunststoff-Behälter (transparente Plastikbecher frisch aus der Verpackung) 10 g Silikon-Elastomer-Basis mit 1 g Silikon Elastomer Härtemittel (10:1). Mit einem Kunststoff Rührer/Kunststoff-Spachtel für 5 min rühren.
Hinweis: Luftblasen bilden sich beim Rühren und die PDMS sieht blass-weiß. - Die Mischung zu entgasen bei < 20 kPa bis alle expandierenden Luftblasen zusammengebrochen auszutrocknen (höheres Vakuum beschleunigt den Prozess). Die entgast Teig in silanisiert Petrischale.
- Heilung bei 65 ° C für 2 h im Ofen.
Hinweis: Es ist möglich, die Aushärtung Geschwindigkeit verdoppeln durch Erhöhung der Temperatur auf > 95 ° C. Der zunehmende Härtungstemperatur führt zu einer Erhöhung der Steifigkeit des Materials. - Die Petrischale gefüllt mit dem ausgehärteten PDMS auf RT abkühlen und PDMS-Platte mit einem Spachtel entfernen.
- Schneiden Sie mit einem Skalpell den Rahmen in den Abmessungen und Geometrie für die verfügbare Öffnung in den Mikroskoptisch. Abmessungen von 1.5 (Länge) x 1,5 (Breite) x 0,5 cm (Höhe) eignen sich für die meisten Setups.
- Bringen Sie die glatte Seite (die Unterseite, die in Kontakt mit der Petrischale war) von der PDMS Rahmen in Kontakt mit der aktiven Seite der Oberfläche wo befindet sich die Al2O3 Film, und sanft andrücken, schieben Sie den Rahmen und Oberflächen gegeneinander Sie zu halten.
Hinweis: Die Haftung zwischen dem PDMS und Al2O3 Substrat ist schwach. Das Vorhandensein von Luftblasen auf der Kontakt-Schnittstelle verursachen de-Anlage und infolgedessen die Leckage der Puffer und ähnliche Inhalte. Der PDMS-Rahmen kann mehrmals verwendet werden, wenn sofort nach und vor jedem Gebrauch, die es mit Isopropanol, gespült wird gefolgt durch Spülen mit VE-Wasser und Föhnen mit Stickstoff. Die silanisiert Petrischale kann auch wiederverwendet werden.
- Bereiten Sie eine KOH-Lösung durch Mischen 100 g KOH mit 100 mL Isopropanol in ein Becherglas im Eisbad. Rühren Sie für 10 Stunden oder länger, bis die KOH mit einem Magnetrührer und magnetische rühren Platte vollständig gelöst ist.
- Füllen Sie die Beobachtung Kammer mit Ca2 +- HEPES-Puffer (siehe Tabelle der Materialien).
Hinweis: Die Oberfläche sollte unmittelbar nach der Entsiegelung des Pakets verwendet werden. Kontakt mit der Luft führt zur Adsorption von Schadstoffen, die die Aktivität der Oberfläche allmählich abnimmt. Die Kammer sollte sofort nach der Montage mit Puffer gefüllt werden. Füllen Sie nicht das gesamte Kammervolumen, um Zugabe von konzentrierter Lipide im anschließenden Schritt zu ermöglichen. - Legen Sie die Kammer auf die Bühne confocal Mikroskop. Eingeweichtes Lipid Material, jetzt eine Suspension mit riesigen Vesikel in die Kammer mit einem Kunststoff Pasteurpipette (Abbildung 1A-1 G) zu übertragen.
- Warten Sie 10-20 min, lassen die Bläschen auf das Substrat zu halten und auf der Oberfläche (Abbildung 1H-1J) verteilt.
Hinweis: Die Verbreitung beginnt unmittelbar nach der Ablagerung von Lipiden auf der Oberfläche. Die Rate der Verbreitung möglicherweise geringfügig je nachdem die Lipidzusammensetzung Al2O3 Ablagerung Technik (ADL, RF-Sputtern, chemical Vapor Deposition, etc.), frische des Substrats und zweiwertigen kationen-Konzentration in der Puffer. Sicherstellen Sie, dass Buffer Tausch durchgeführt wird, bevor der Ausbreitung bersten14patches. - Nach der Beobachtung entfernen mehrere Lipid-Aufstriche, langsam den ambient Puffer über eine automatische Pipette so, dass nur ein dünne Puffer-Film auf dem Boden bleibt.
Hinweis: Rasche Entfernung des Puffers stört die Lipid-Strukturen auf der Oberfläche. - Fahren Sie mit der ambient Buffer Tausch von Chelator-HEPES-Puffer langsam die Beobachtung Kammer einfüllen (siehe Tabelle der Materialien) mit einer automatischen Pipette (Abbildung 1K).
Hinweis: Abrupte Zugabe von Puffer stört die Lipid-Strukturen auf der Oberfläche. - Dieser letzte Schritt liefert dynamische Nanotubular Netzwerke, als Folge der Chelator-induzierte depinning und Ausfahren des DLBM um MLV4 (Abbildung 1L-1Y) gebildet.
(4) Mikroskopie Beobachtung
- Erwerben die Bilder mit einer invertierten Laserscanning confocal Mikroskop mit einem 40 X Öl (1,3 NA) eintauchen Ziel mit einer Scan-Frequenz von 400 Hz. beschäftigen eine weiße Licht Laserquelle zur Anregung der Texas Red DHPE bei 595 nm. Sammle die Emission von 605 bis 700 nm mit einem Hybrid-Photon-Detektor.
Hinweis: Alternativ kann ein Epi-Fluoreszenz-Mikroskop für die Bildgebung verwendet werden. Abhängig von den Lichtquellen zur Verfügung wählen Sie eine geeignete Lipid-Farbstoff konjugiert.
Ergebnisse
Die Lipid-Suspension in Schritt 1 des Protokolls erhalten und verwendet während der Experimente enthält zwei Arten von Vesikeln: MLV und GUVs. Abbildung 1 A-1F zeigt Laser-scanning-konfokale Mikrographen der Vesikel in der ursprünglichen Probe in 3D konstruiert. Abbildung 1 A-1_C zeigt eine MLV (Lipid Kaution) in Xyz, Xz und Yz-Ebenen, beziehungsweise. Abbildung 1 D-1F zeigt ähnliche Ansichten von einem riesigen Unilamellar Vesicle (GUV). Der innere Teil des GUVs, das Multilamellarity fehlt, ist hohl; Daher ist die Lipid-Material für die Verbreitung deutlich eingeschränkt. Daher sind die einzig brauchbare Lipid-Reservoirs für diese Methode MLV.
Wenn die Lipid-Aussetzung der Beobachtung Kammer mit Ca2 +HEPES - Puffer (Abbildung 1G) übertragen wird, beginnen die MLV (Abbildung 1A-1_C) an die Al2O3 Oberfläche zu begleichen. Bei Berührung die Bläschen an der Oberfläche haften, und beginnt eine kreisförmige flache doppelte Bilayer Lipidmembran (DLBM) von jeder MLV auf fester Unterlage (Abbildung 1H-1J) zu verbreiten. Der MLV fungiert als ein Reservoir, das die Lipide für die ständig wachsenden DLBM bietet. Die distale (oberen) Bilayer Membran, in Bezug auf die solide Unterstützung ist mit der proximalen (unteren) Bilayer Membran entlang des Umfangs der runden Kante, Durchführung einer Rollbewegung (Abbildung 1ich) verbunden. Zwei Doppelmembranen sind flach übereinander positioniert nur mit einem dünnen Flüssigkeitsfilm zwischen ihnen gekapselt. Bei der Ausbringung, hält sich die proximale Membran kontinuierlich an der Auflagefläche unter, während die distale Membran seitlich an den Rändern durch den expandierenden proximale Membran Rand gezogen wird. Die Verbreitung der DLBM wird von Ca2 +, fungiert als ein Fusogenic-Agent zwischen Lipid Kopfgruppen aus der proximale Membran und festen Substrat4vermittelt.
Wenn die Verbreitung über einen längeren Zeitraum anhält, die Membrane Spannung erhöht, was zu Brüchen (Abbildung 2A und 2 b). Nach diesem Punkt kann die Membran einfahren, ist notwendig, die ER röhrenförmige Morphologie zu erstellen, nicht mehr induziert werden. Daher ist es wichtig, die gerissenen Membranen zu erkennen. Da die Lipide in unseren Experimenten Eindringmittel gekennzeichnet sind, kann die Brechung direkt beobachtet werden. Ein wichtiger Indikator für die Brechung ist der erhebliche Rückgang der Fluoreszenzintensität in den geplatzten Region (Abbildung 2A und 2 b)14. Die Brechung ist ein Ergebnis der erhöhten Spannung und anschließende Porenbildung in der distalen Membran. Unter einem fluoreszierenden Mikroskop zeigen die geplatzten Regionen daher Hälfte die Emissionsintensität (einzelne proximalen Bilayer) rupturierten Regionen (doppelte Bilayer)14 (Abbildung 2B). Während der Porenbildung wandert das Membranmaterial, die anfangs auf den geplatzten Regionen eingestellt wurde, zu den Rändern des sich ausbreitenden Patches. Dies wiederum bewirkt, dass eine Wachstum der Gesamtfläche Patch. Daher kann eine rasche Ausweitung der Kontur des kreisförmigen Patches auch beim bersten beobachtet werden.
Um zu vermeiden das umfangreiche Wachstum führt zum Bruch der Patches, unmittelbar nach der kreisförmigen Patchbereich 100-200 µm erreicht, wird die Ca2 +HEPES - Puffer sanft mit einer automatischen Pipette bis eine Dünnschicht des flüssigen bleibt auf der Oberfläche entfernt. Der Chelator-HEPES-Puffer wird dann sanft in die Kammer einfahren (Abbildung 1K) initiieren hinzugefügt. Eine vollständige Austrocknung der Probe (Abbildung 2C) oder schnellen Austausch der Puffer (Abbildung 2D und 2E) verursacht Störung, bersten oder Verformung der Patches. Die Zugabe von Chelatoren entfernt allmählich Ca2 + aus dem Raum zwischen der Oberfläche und Membran. Der Chelator-HEPES-Puffer greift allmählich den inter-bilayer-Substrat-Raum, ausgehend von der Peripherie des Lipid-Membran-Patches. Daher die Entfernung der pinning Seiten beginnt von den Rändern des kreisförmigen Patches und breitet sich nach innen (Abbildung 1K-1Q). Als Folge der depinning beginnt die Lipidmembran zurückziehen von Kanten nach innen, Fortschritte auf dem Weg der MLV in der Mitte zu trennen. Die Rücknahme-Prozess führt zu eine neue Schnittstelle Lipid-röhrenförmigen Netze4 (Abbildung 1L-1Y) dynamisch zu entwickeln. Die anhaltende Regionen anheften, die nicht die Membran vollständig lösen lassen, bleiben auf der Oberfläche und Blasensiedens Aufstellung, was zu langen verzweigten Netz von Nanoröhren. (Abbildung 1L-1Y). De-kontinuierliche anheften und weiter ausfahren des Lipid-Nanoröhren sind im Laufe der Zeit als Ergebnis der allmählichen Chelat-Prozess beobachtet. Diese Vergröberung und Neuordnung der Zweige Netzwerk spielt eine Schlüsselrolle in das dynamische Verhalten der röhrenförmigen Netze, die das glatte ER ähneln.
Abbildung 1 L-1J zeigt die Aufnahmen der Nanotube Netze in das Protokoll erhalten. Abbildung 1 L ist eine Nahaufnahme der Region in Abbildung 1M in den weißen Rahmen markiert. Die kontinuierliche hellrot Regionen in Abbildung 1L und 1 M sind die einziehbaren Bruchteil von den DLBM (gekennzeichnet mit einem blau gestrichelte Linie in Abbildung 1M). Das Schliffbild eines röhrenförmigen Netzwerks in Abbildung 1N und 1O wird invertiert, um den Kontrast zu erhöhen. Abbildung 1 P und 1Q zeigt die Reduzierung der röhrenförmigen Dichte auf eine Membran-Region im Laufe von 3 h 20 min. Die Abnahme der röhrenförmigen Dichte entsteht durch die allmähliche depinning gefolgt durch Retraktion der die DLBM von der Oberfläche über den experimentellen Zeitraum. Im Laufe der Zeit die Anzahl der Punkte erhöht, was zu Umgestaltungen und eine Reduzierung der Fläche durch Rohre (Abbildung 1P und 1Q) anheften befreit. Die röhrenförmigen Umstellungen sind motiviert durch freien Oberflächenenergie Minimierung der ein Lipid-Nanoröhrchen zwischen zwei festen Punkten aufgehängt. Es ist gut etabliert, dass der effizienteste Weg zur Minimierung der Oberflächenenergie ein Nanotube ist, seine Länge15zu reduzieren. Daher, wenn die Fusogenic Regionen, die zunächst die Nanotubes auf der Oberfläche halten, de-fixiert sind, die Nanotubes schieben und ordnen sich spontan, Annahme einer minimalen Länge. Diese Umstellungen führen eine schrittweise reduzierte Abdeckung der Oberfläche durch die Nanoröhren (Abbildung 1P und 1Q).
Wir können nicht visualisieren die Ca2 +-vermittelte anheften Punkte, sondern wir schaffen ihre Positionen als die Punkte, wo Rohre terminal oder scharfe Kurven haben. Scharfe Kurven sind als V-Kreuzungen15 oder Wendepunkte wegen der plötzlichen Verschiebung in Richtung der Ausrichtung der Röhre (grüne Pfeile in Abbildung 1R und 1 X) bezeichnet. Der Endpunkt ist die Endstation des Rohres, die verhindert, dass das Rohr einziehen (orange Pfeile in der Abbildung 1X). Während der Re-Organisation, energetisch günstige Anordnung der Rohre, die als "Y-Kreuzungen" oder "3-Wege-Kreuzungen", angezeigt. Die Y-Kreuzung verbindet drei Röhren mit ca. 120° Winkel zwischen jedes Rohr, wo die kürzeste gesamten Rohrlänge gesichert werden kann. Die Y-Kreuzungen, die nicht besitzen einen Endpunkt und stattdessen zwischen mehreren Nanoröhren positioniert sind, sind nicht fixiert. Dies ist die einzige Art der Y-Kreuzung, die Schiebetüren (blaue Pfeile, Abbildung 1R) durchführen können. Wie in Abbildung 1R und 1 s, gleiten von einer Y-Kreuzung entlang einer sehr instabil Kreuzung führt zur Bildung von zwei einzelnen Y-Kreuzungen (blaue Pfeile in der Abbildung 1S). Die gestrichelte weiße Linie überlagert Abbildung 1S stellt die Kontur des röhrenförmigen Netz-Fragment in Abbildung 1R. Ein Bruchteil der Y-Kreuzungen besitzt Endgeräte (gelber Pfeil in Abbildung 1T), die im Laufe der Zeit schließlich (Abbildung 1U) einfahren. Die Umwandlung von einem V-Übergang zu einem einzigen geraden Rohrs durch depinning von den Schnittpunkt der beiden Liniensegmente und durch Retraktion der eines der Rohre bilden die V-Form kann in Abbildung 1V und 1W und beobachtet werden Abbildung 1X und 1Y, beziehungsweise.
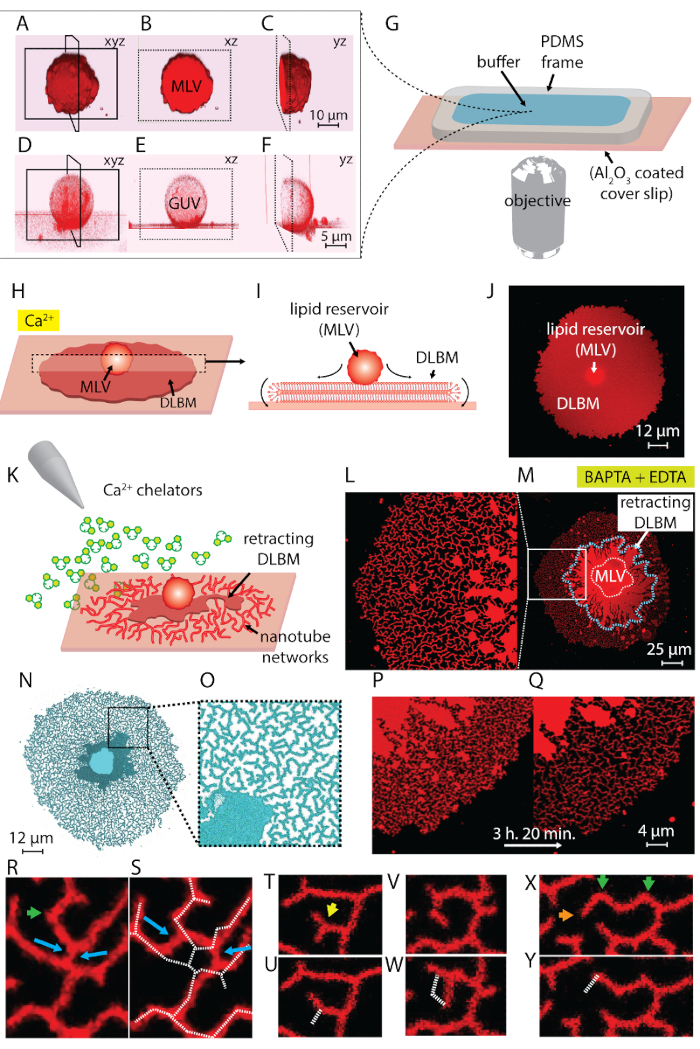
Abbildung 1 : Umwandlung von Lipid Ablagerungen zu ER-wie röhrenförmigen Netze. (A-F) Laserscanning konfokale Mikrographen der Vesikel in der ursprünglichen Probe in 3D konstruiert. (A-C) Multilamellar Lipid-Vesikel (MLV, Lipid-Depot) in Xyz, Xz und Yz Flugzeuge, beziehungsweise. (D-F) Ähnliche Ansichten von einem riesigen Unilamellar Vesicle (GUV). Der innere Teil der GUVs ist hohl, wodurch das Lipid-Material für die Verbreitung deutlich eingeschränkt. Die nützliche Lipid-Reservoirs für diese Methode sind daher MLV. (G) Illustration der Beobachtung Kammer montiert auf einem inversen Mikroskop auf den Puffer und Lipide abgelagert werden. Die Kammer setzt sich zusammen aus einem PDMS Frame auf eine Al2O3 beschichtet Deckglas, bietet eine offene Volumen oben eingehalten. (H-J) Darstellung der Verbreitung Phänomene der MLV in Anwesenheit von Ca2 +. (H) nach dem Kontakt mit Al2O3breitet sich die MLV spontan in Form von einem runden, doppelt Lipid Bilayer Membran (DLBM). (I) schematische Seitenansicht des DLBM in der Xz-Ebene, wo die Peripherie rollende Bewegung durchführen. MLV (d = 5-15 µm) und DLBM (Dicke = 10 nm) stammen nicht maßstabsgetreu. (J) ein konfokale Schliffbild einer sich ausbreitenden DLBM aus Draufsicht. (K) beschreibt die wichtigsten Schritt dieses Protokolls, wo der Puffer auf eine mit Ca2 + Komplexbildner, hemmt die Ausbreitung der MLV Retraktion des die DLBM zufügen und zur Bildung von Lipid-Nanoröhren ausgetauscht wird. (L-Y) Aufnahmen der Nanotube Netze mit dem beschriebenen Verfahren gewonnen. (L) Nahaufnahme der Region in (M) in einem Rahmen markiert. Die kontinuierliche hellrot Regionen (L und M) repräsentieren die DLBM (auch gekennzeichnet durch eine blaue gestrichelte Linie in M). Das Schliffbild eines röhrenförmigen Netzwerks (N und O) ist invertiert, um den Kontrast zu erhöhen. (P und Q) Darstellung der Reduzierung der röhrenförmigen Dichte auf eine Membran-Region im Laufe von 3 h und 20 min. (R-Y) repräsentative tubuläre Re Vereinbarungen. (R und S) Schiebetüren (T und U) Übergang von einer Y-Kreuzung bis V-Kreuzung durch Retraktion der einen Endpunkt, und (V und W) de-pinning der einen Wendepunkt dar, mit dem Ergebnis bei der Beseitigung der V-Kreuzung. (X und Y) Retraktion der einen Endpunkt. Bitte klicken Sie hier für eine größere Version dieser Figur.
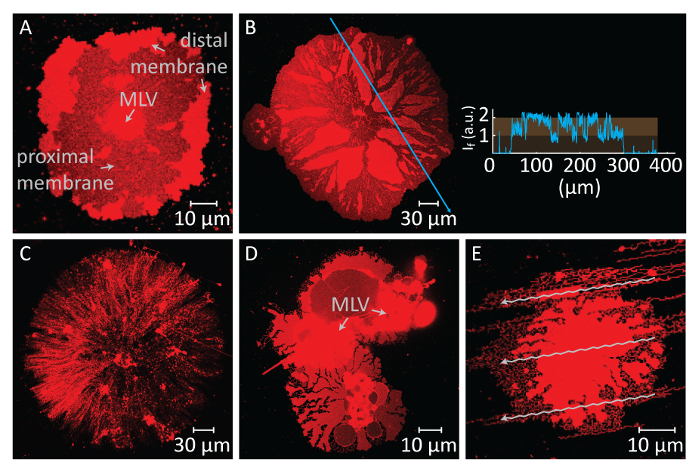
Abbildung 2 : Mögliche negative Ergebnisse. (A und B) Ruptur der distalen Membran durch eine lange Wartezeit vor dem Austausch der Puffer. Die geplatzten Bereiche, wo die proximale Membran sichtbar wird, erscheinen als dunkle Bereiche im Vergleich zu den rupturierten distalen Membran-Regionen. Das Panel B sehen Sie der Lichtintensität auf den blauen Pfeil auf das Schliffbild. Die Intensität der geplatzten Regionen der Membran (proximalen/Single Bilayer wird sichtbar) entspricht der Hälfte der Intensität der rupturierten Membran (distale/Doppel Bilayer). (C) Aussehen eines trockenen Lipid-Patches gegründet als Folge der Entfernung der ganzen Flüssigkeit aus der Beobachtung Kammer. (D und E) Störung der Membran durch schnellen Austausch der Puffer über automatische Pipette. (D) hat 2 MLV, führt zu einem unrunden, deformierte Lipid-Patch die MLV aufgeteilt. In (E) spiegelt sich das Muster der Strömung (Pfeile), erstellt von starke Zufuhr von der Chelator-HEPES-Puffer auf die tubulated Membran-Struktur. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
In der anschließenden Diskussion werden die kritischen Schritte, eventuelle Änderungen und Einschränkungen des Protokolls beschrieben. Der erste wichtige Schritt ist die richtige Montage der Beobachtung Kammer, angesichts der Tatsache, dass die Haftung des PDMS Rahmens an die Al2O3 Oberfläche intrinsisch schwach ist. In dem Fall, wo der Rahmen nicht an das Substrat richtig hält, wird der Inhalt aus der Beobachtung Kammer undicht und das Experiment wird zum Stillstand kommen. Die Hauptfaktoren, die richtige behindern Versiegelung der Oberfläche und Rahmen sind (1) fehlende gründliche Reinigung des Rahmens (wiederverwendet) PDMS und (2) Luftblasen, die gelegentlich zwischen Rahmen und Substrat gefangen bekommen. Ein neu vorbereitet oder gründlich gereinigten PDMS-Rahmen sollte verwendet werden. Der Rahmen sollte vor und nach jedem Gebrauch mit Isopropanol, gefolgt von Spülen mit VE-Wasser und Föhnen mit Stickstoff gespült werden. Die Al2O3 Oberflächen erfordern keine vorherige Reinigung nicht denn sie sind in einem Reinraum gefertigt und bis zum Gebrauch in verschlossenen Behältnissen aufbewahrt. Aufgrund der amphoter Natur von Al2O3sollte es nicht zu stark sauren oder basischen Lösungen ausgesetzt werden. Andere Entwürfe für die Beobachtung Kammer können eingesetzt werden, je nach Zugänglichkeit der einzelnen Einrichtung. Wichtige Merkmale dieses Hauses sind freien Zugang zu der flüssigen Probe aus der oben offen und die Trägheit der das Material in Bezug auf die verwendeten Lösungen und Beispiele. Die Kammer Abmessungen sind auch ein wichtiger Faktor, da sie ein Volumen von 0,5 bis 1 mL unterbringen sollte. Da die Flächen in der Regel Standardgröße Deckgläsern (24 x 60 mm) sind, wird das Volumen der Kammer vor allem durch die Dicke des Rahmens bestimmt. Nach unserer Kenntnis sind Abstandhalter mit der Größe und Tiefe, die die Probenvolumen in der Regel in diesem Protokoll behandelt unterbringen kann nicht im Handel erhältlich. Wir haben deshalb einen Abschnitt des Details der Herstellung und Montage von einer Probe-Kammer-Rahmen gewidmet.
Der andere entscheidende Schritt in diesem Protokoll ist der Puffer-Austausch. Eine Herausforderung in diesem Schritt ist das Timing erforderlich, um diesen Austausch durchzuführen. Die Verbreitung von MLV beim Kontakt mit dem Al2O3 Substrat erfolgt sofort, und der kontinuierliche Ausbau der DLBM führt zu seiner bersten, beendet das Experiment (Abbildung 2A, B). Daher die Ausbreitung sollten ständig überwacht und Buffer Tausch muss zeitnah durchgeführt werden. Der Austausch sollte nicht zu schnell nach der Initialisierung verbreiten, damit die Membran-Patches zu erreichen eine optimale Größe (100-200 µm im Durchmesser) kann durchgeführt werden. Auf der anderen Seite verursacht kontinuierliche Haftung auf der Oberfläche hohe Membran Spannung, führt zu bersten. So patches alle Membran schließlich Bruch, wenn die Verbreitung nicht unterbrochen wird. Der Zeitplan für die Brechung unterscheidet sich für jeden Patch, da es von der Größe und die interne Struktur der MLV und Zugänglichkeit der Lipide darin hängt. Daher sollte der Moment des Austauschs zu einem Timepoint angeordnet werden, an dem die UN-geplatzten Patches mit optimalen Größen einen Großteil der gesamten Bevölkerung darstellen. Eine weitere Herausforderung im Puffer Austausch Schritt ist die Entfernung und Ergänzung der Puffer. Durchführung dieser Substitution zu schnell, hat einen nachteiligen Einfluss auf die endgültige Membrankonstruktionen (Abbildung 2C-E). Die übermäßige Extraktion von Ca2 +HEPES - Puffer ohne ein dünner Flüssigkeitsfilm auf dem Substrat führt getrocknet und irreversibel deformiert Membran Patches (Abbildung 2C). Auch wenn eine angemessene Menge an Flüssigkeit auf der Oberfläche beibehalten wird, verursacht plötzliche Zugabe von der Chelator-HEPES-Puffer auch Störung der Membranstrukturen. Abbildung 2 D,E zeigt das typische Erscheinungsbild der hydrodynamisch gestörten Membran Patches. Die insgesamt morphologische Störung beeinflusst nicht notwendigerweise die dynamischen Eigenschaften der endgültigen Strukturen (d. h. die röhrenförmigen Umstellungen in den verbleibenden Bereichen noch auftreten werden). Jedoch wird es schwierig, die materielle Umwandlung auf die verformten Strukturen zu beobachten. Zum Beispiel in Abbildung 2Dwäre es schwierig, die Richtung zu bestimmen, die MLV die DLBM fährt.
Eine mögliche Änderung des Protokolls ist die Lipidzusammensetzung verwendet. Das Hauptaugenmerk wurde auf Phospholipide, die dominieren der ER Komposition bei Säugetieren und Hefe-16 (e. g., Phosphatidylcholin (PC), Phosphatidylethanolamine (PE) und Phosphatidylinositol (PI). Die ursprüngliche Experimente wurden durchgeführt mit Hilfe von PC und PI Mischungen4. Die vorgestellten Ergebnisse benutzte eine Mischung aus PC und Schmiere und ein Derivat von PE. Jedoch wurden nicht alle beliebigen Lipid Kompositionen gefunden die röhrenförmigen Strukturen erhalten durch dieses Protokoll zu erstellen. Ein paar der anderen experimentell untersuchten Lipid Mischungen beinhalten insgesamt Herz-Extrakt, Soja-Bohnen-Extrakt polar polar E. Coli -Extrakt, Mischungen von PC mit Stearoyl-2-hydroxy-sn-glycero-3-phosphoinositol (Lyso-PI) in unterschiedlichen Verhältnissen und Mischungen der PC-PE-PI-Posphatidyl Serin (PS) in unterschiedlichen Verhältnissen. Da röhrenförmige Membranstrukturen hohe Krümmungen besitzen und erfordern besonderen Anordnung der einzelnen Lipidmoleküle, ist zu erwarten, dass das beobachtete Phänomen Lipid Zusammensetzung-spezifisch ist.
Eine weitere Änderung, die in diesem Protokoll angewendet ist die Methode für die Oberfläche Fertigung. Hier wurde die ALD verwendet, um die Al2O3 beschichtet Deckgläsern fabrizieren. Dies unterscheidet sich von den ursprünglich gemeldeten Abscheidungsverfahren, reaktiven Sputtern4. Während dies bedeutet, dass eine alternative Oberfläche Herstellungsverfahren noch zu ER-wie Schlauchbildung führen kann, scheint eine wichtige Einschränkung der Spezifität des Oberflächenmaterials. Die Verbreitung und Stärke der Adhäsion ist stark abhängig von den Eigenschaften des Oberflächenmaterials, welche Faktoren wie elektrostatische Wechselwirkungen, Benetzbarkeit, Hydrophobie und Rauheit der Oberfläche beeinflussen. Al2O3 Flächen sorgen für optimale Haftfestigkeit Lipid-Filme können beide befestigen und stark genug zu verbreiten als doppelte Lipid Bilayer Membran und Netzwerke zu bilden, röhrenförmigen nach Entfernung der Ca2 + -Ionen zu trennen. Wir testeten zuvor das gleiche Experiment mit SiO2, in dem die multilamellar Vesikel zu verbreiten, als doppelte Lipid Bilayer Membran, aber keine röhrenförmigen Netzwerkbildung wurde nach Zugabe von Chelatoren17beobachtet. De-Anlage und Rohr Bildung sind nur auf Al2O3 beobachtet oder Plasma geätzt Al18. Unsere Nachforschungen ergaben, dass die Beitragende Parameter führt zu solch ein Phänomen der Zeta wurde von Oberflächen, welche Al und Al2O3 wurden in der Nähe von Null (mV) und SiO2 deutlich negativ. Das Zetapotential von Borosilikatglas ist ähnlich wie SiO219; Haftung der Lipid-Filme auf Borosilikatglas ist demzufolge ebenso stark und irreversibel. In der Tat führt multilamellar Lipid Reservoir Kontakt mit Borosilikatglas Oberflächen typischerweise zu sofortigen Bruch und Bildung von einzelnen Lipid Bilayer20. Die Al2O3 Oberflächen erforderlich für dieses Protokoll sind nicht ohne weiteres oder kommerziell verfügbar. Sie können jedoch individuell bestellten aus Spezial-Glas und Substrat-Hersteller sein. Zugang zu Reinraum Einrichtungen mit Dünnschicht-Fertigungseinrichtungen wird dringend empfohlen.
Die anderen vorhandenen Bottom-Up-Methoden zu ER-wie röhrenförmigen Netze2,10 fabrizieren beinhalten Proteine sowie Input von chemischer Energie (zB., GTP und ATP). Rapoport und Kollegen2 berichtete die Bildung von ER-Netzwerken über Glas Deckgläsern in Vitro durch Mischen der Membran-Biege-Proteinen in Notaufnahme, mit Phospholipiden und GTP. Die Arbeit von Crying Et al. 10 zeigt, wie solche dynamischen röhrenförmigen Netze erstellt werden können, durch molekulare Motoren und ATP als Energiequelle. Dieses Protokoll präsentiert erfordert keine Membranproteine oder Hydrolyse organischer Verbindungen für Energie. Nur wesentliche Bestandteile sind die festen Substrat und die Phospholipide. Reinigung und Extraktion von Proteinen sind nicht erforderlich. Dieses Protokoll bietet in Bezug auf die Einfachheit der konstituierenden Moleküle, die grundlegendste ER-Modell.
Mit dieser grundlegenden, Lipid-basierte ER-Modell etabliert ist Aufbau von Komplexität indem ER verbundenen Komponenten von Interesse, da es ermöglicht die Untersuchung der einzelnen Auswirkungen auf das System. Ähnlich wie bei der eigentlichen ER Netze, Röhren im Modell sind dynamisch. Konjugation, und die Migration der beschrifteten Membranproteine oder fluoreszierende Partikel im gesamten röhrenförmigen Netz können Informationen über die Richtung der Bewegung der Membran bringen. Kapselung und Überwachung der fluoreszierenden Flüssigkeiten innerhalb des DLBM und der Rohre während der Transformation und eine mögliche Zuordnung von intratubular Content-Transport können als ein weiterer Schwerpunkt dienen. Schließlich kann ein Übergang von 2D ER-Modell infolge dieses Protokolls in Richtung eines 3D-Modells glatt ER durch Kapselung der Hydrogel-Architekturen-Netzwerke angenommen werden.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir danken Prof. Aldo Jesorka an der Chalmers University of Technology in Schweden für seine wertvollen Bemerkungen über das Manuskript. Diese Arbeit wurde ermöglicht durch die finanzielle Unterstützung aus dem Research Council of Norway (Forskningsrådet) Project Grant 274433, UiO gewonnen: Life Sciences Konvergenz Umwelt, der schwedischen Forschungsrat (Vetenskapsrådet) Projekt Grant 2015-04561, sowie die Anschubfinanzierung zur Verfügung gestellt vom Zentrum für Molekularmedizin Norwegen & Fakultät für Mathematik und Naturwissenschaften an der Universität Oslo.
Materialien
| Name | Company | Catalog Number | Comments |
| Pear-shape flask 10 mL | Lenz Laborglasinstrumente | 3.0314.13 | In which the lipid mixture is prepared |
| Hamilton 5 mL glass syringe (P/N) | Hamilton | P/N81520 | For transfer of the chloroform to beaker |
| Custom large hub needle Gauge 22 S | Hamilton | 7748-18 | Removable needle for syringe specified in row 3 |
| Hamilton 250 µL glass syringe | Hamilton | 7639-01 | Used for transfer of lipids in chloroform to the flask |
| Large hub Gauge 22 S | Hamilton | 7780-03 | Removable needle for syringe specified in row 5 |
| Hamilton 50 µL glass syringe | Hamilton | 7637-01 | Used for transfer of fluorophore-conjugated lipids to the flask |
| Small hub Gauge 22 S | Hamilton | 7770-01 | Removable needle for syringe specified in row 7 |
| Chloroform anhydrous (≥99%) | Sigma-Aldrich | 288306 | Used to complete the lipid mixture to a total of 300 µL |
| Soy L-α Phosphatidyl choline lipid (Soy PC) | Avanti Polar Lipids Inc | 441601 | phospholipid species contributing to 69% of the total composition/mixture |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE) | Avanti Polar Lipids Inc | 850725 | phospholipid species contributing to 30% of the lipid composition/mixture |
| L-α Phosphatidyl inositol lipid (Soy PI) | Avanti Polar Lipids Inc | 840044 | alterative phospholipid species contributing to 30% of the lipid composition/mixture (from the original article Bilal and Gözen, Biomaterials Science, 2017) |
| Texas Red 1,2-dihexadecanoyl-sn-glycero-3-phosphoethanolamine,triethylammonium salt (Texas Red DHPE) | Invitrogen (Thermo Fisher Scientific) | T1395MP | Fluorescent-lipid conjugate, 1% of the lipid composition/mixture |
| Digital Dry Baths/Block Heaters | Thermo Fischer | 88870006 | To warm glycerol in order to decrease its viscosity |
| Glycerol for molecular biology (≥99%) | Sigma Life Science | G5516 | For lipid preparation |
| PBS buffer (pH=7.8); ingredients below in rows 17-21 | Used to prepare the lipid suspension | ||
| TRIZMA base, primary standard and buffer (≥99%) | Sigma Life Science | T1503 | Used to prepare PBS buffer |
| Potassium phosphate tribasic, reagent grade (≥98%) (K3PO4) | Sigma-Aldrich | P5629 | PBS buffer ingredient |
| Magnesium sulfate heptahydrate, BioUltra (≥99,5%) KT (MgSO47H2O) | Sigma Life Science | 63138 | PBS buffer ingredient |
| Potassium phosphate monobasic, anhydrous, free flowing, Redi-Dri, ACS (KH2PO4) | Sigma-Aldrich | 795488 | PBS buffer ingredient |
| Ethylenediaminetetraacetic acid disodium salt dihydrate ACS reagent, 99.0-101.0% (Na2EDTA) | Sigma-Aldrich | E4884 | PBS and Chelator-HEPES buffer ingredient |
| Ultrasonic cleaner USC-TH | VWR | 142-0084 | Ultrasonication of rehydrated lipids |
| Rotary evaporator - Büchi rotary evaporator Model R-200 | Sigma | Z626797 | For evaporation of chloroform |
| Pressure meter - Vacuum regulator IRV-100 | SMC | IRV10/20 | For controlling the pressure value during lipid dehydration |
| HEPES-buffer (pH=7.8); ingredients below in rows 26-27 | Used for rehydration of lipids. Content: 10 mM HEPES with 100 m NaCl diluted in ultrapure deionized water | ||
| HEPES ≥99.5% (titration) | Sigma Life Science | H3375 | HEPES-buffer ingredient |
| Sodium chloride for molecular biology, DNase, RNase, and protease, none detected, ≥98% (titration) (NaCl) | Sigma Life Science | S3014 | HEPES-buffer ingredient |
| Calcium-HEPES buffer (pH=7.8); effective ingredient below in row 29 | Used for spreading of lipids. Content: 10 mM HEPES, 100 mM NaCl, 4 mM CaCl2 diluted in ultrapure deionized water | ||
| Calcium chloride anhydrous, BioReagent, suitable for insect cell culture, suitable for plant cell culture, ≥96.0% (CaCl2) | Sigma Life Science | C5670 | To prepare Calcium-HEPES buffer |
| Chelator-HEPES buffer (pH=7.8); effective ingredient below in row 31 | Used to promote the formation of tubular networks. Content: 10 mM HEPES, 100 mM NaCl, 10 mM EDTA and 7 mM BAPTA diluted in ultrapure deionized water | ||
| 1,2-Bis(2-aminophenoxy)ethane-N,N,N′,N′-tetraacetic acid tetrasodium salt ≥95% (HPLC) (BAPTA-Na4) | Sigma Life Science | 14513 | Chelator-HEPES buffer ingredient |
| Sodium Hydroxide | Sigma | 30620 | Basic solution used to adjust the pH of the buffers |
| pH meter accumet™ AE150 pH | Fisher Scientific | 1544693 | Used to measure the pH of all buffers |
| Glass petri dish | VWR | HECH41042012 | 6 cm, used for making the PDMS sheet |
| Potassium hydroxide ACS reagent, ≥85%, pellets (KOH) | Sigma-Aldrich | 221473 | To make the KOH solution for cleaning glass petri dish for the fabrication of the PDMS sheet |
| Isopropanol prima ren 99.5% | Antibac AS | 600079 | KOH solution ingredient |
| Heating and drying oven - venticell | MMM Medcenter Einrichtungen GmbH | MC000714 | For drying of the glass petri dish after silanization and to cure PDMS |
| Dichlorodimethylsilane ≥99.5% | Sigma-Aldrich | 440272 | Used for silanization of glass petri dish in which PDMS sheet is prepared |
| Vacuum pump | Cole-Parmer | EW-79202-05 | Connected to desiccator |
| Sylgard 184 silicone elastomer curing agent | Dow corning | 24236-10 | Kit to make PDMS solution |
| Sylgard 184 Silicone elastomer base | |||
| Disposable scalpel | Swann-Morton | 11798343 | Used to cut the PDMS |
| Cover slips | Menzel -Gläser | MEZ102460 | 24x60 mm. Used to deposit thin film of Al2O3 |
| Atomic layer deposition system | Beneq | TFS200 (model number) | Atomic Layer deposition system used to deposit thin film of Al2O3 in microscope cover glass |
| Ellipsometer | J.A. Woollan Co. | Alpha-SE (model name) | System used to charcaterize the thickness of the film deposited on glass surface |
| Laser scanning confocal microscope | Leica Microsystems | Leica TCS SP8 X | Microscope used for visualization of the experiment |
| Objective 40x, 1.3 NA | Leica Microsystems | 1550635 | Used for visualization of the experiment |
| White light laser source | Leica Microsystems | Leica TCS SP8 X | For excitation of the membrane fluorophore |
Referenzen
- Chen, S., Novick, P., Ferro-Novick, S. ER structure and function. Current Opinion in Cell Biology. 25 (4), 428-433 (2013).
- Powers, R. E., Wang, S., Liu, T. Y., Rapoport, T. A. Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature. 543 (7644), 257-260 (2017).
- Pendin, D., McNew, J. A., Daga, A. Balancing ER dynamics: Shaping, bending, severing, and mending membranes. Current Opinion in Cell Biology. 23 (4), 435-442 (2011).
- Bilal, T., Gözen, I. Formation and dynamics of endoplasmic reticulum-like lipid nanotube networks. Biomaterials Science. 5 (7), 1256-1264 (2017).
- Shibata, Y., et al. Mechanisms determining the morphology of the peripheral ER. Cell. 143 (5), 774-788 (2010).
- Ozcan, L., Tabas, I. Role of endoplasmic reticulum stress in metabolic disease and other disorders. Annual Review of Medicine. 63, 317-328 (2012).
- Yamanaka, T., Nukina, N. ER dynamics and derangement in neurological diseases. Frontiers in Neuroscience. 12, (2018).
- Taalab, Y. M., et al. Mechanisms of disordered neurodegenerative function: Concepts and facts about the different roles of the protein kinase RNA-like endoplasmic reticulum kinase (PERK). Reviews in the Neurosciences. , (2018).
- Shemesh, T., et al. A model for the generation and interconversion of ER morphologies. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 5243-5251 (2014).
- Bouxsein, N. F., Carroll-Portillo, A., Bachand, M., Sasaki, D. Y., Bachand, G. D. A continuous network of lipid nanotubes fabricated from the gliding motility of kinesin powered microtubule filaments. Langmuir. 29 (9), 2992-2999 (2013).
- Sackmann, E. Endoplasmatic reticulum shaping by generic mechanisms and protein-induced spontaneous curvature. Advances in Colloid and Interface Science. 208, 153-160 (2014).
- Jesorka, A., et al. Generation of phospholipid vesicle-nanotube networks and transport of molecules therein. Nature Protocols. 6, 791 (2011).
- Hook, D. A., Olhausen, J. A., Krim, J., Dugger, M. T. Evaluation of Oxygen Plasma and UV Ozone Methods for Cleaning of Occluded Areas in MEMS Devices. Journal of Microelectromechanical Systems. 19 (6), 1292-1298 (2010).
- Gözen, I., et al. Fractal avalanche ruptures in biological membranes. Nature Materials. 9 (11), 908-912 (2010).
- Lobovkina, T., Dommersnes, P., Joanny, J. -. F., Hurtig, J., Orwar, O. Zipper Dynamics of Surfactant Nanotube Y Junctions. Phys Rev Lett. 97, (2006).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews Molecular Cell Biology. 9 (2), 112-124 (2008).
- Gözen, I., et al. Repair of large area pores in supported double bilayers. Soft Matter. 9 (10), 2787-2792 (2013).
- Gözen, I., et al. Thermal migration of molecular lipid films as a contactless fabrication strategy for lipid nanotube networks. Lab on a Chip. 13 (19), 3822-3826 (2013).
- Sides, P. J., Hoggard, J. D. Measurement of the Zeta Potential of Planar Solid Surfaces by Means of a Rotating Disk. Langmuir. 20 (26), 11493-11498 (2004).
- Nissen, J., Jacobs, K., Rädler, J. O. Interface Dynamics of Lipid Membrane Spreading on Solid Surfaces. Physical Review Letters. 86 (9), 1904-1907 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten