Method Article
Formation spontanée et le réarrangement des réseaux de Nanotube lipidique artificielle comme un modèle de bas en haut pour le réticulum endoplasmique
Dans cet article
Résumé
Solide-soutenus, sans protéines, double membranes bicouches phospholipidiques (DALG) peuvent être transformés en réseaux de nanotube de lipides complexes et dynamiques et peuvent servir de modèles 2D de bas en haut du réticulum endoplasmique.
Résumé
Nous présentons une méthode commode pour former un modèle ascendant organelle structurels pour le réticulum endoplasmique (re). Le modèle est constitué de nanotubes de lipidiques très denses qui sont, en termes de morphologie et dynamique, qui rappelle d’ER. Les réseaux sont issus de parcelles de membrane double bicouche phospholipidique adhérant sur un transparent Al2O3 support. L’adhérence est médiée par Ca2 + dans le tampon ambiant. Appauvrissement ultérieur de Ca2 + par le biais de BAPTA/EDTA provoque la rétraction de la membrane, entraînant la formation de réseau pour le nanotube lipides spontanée. Seulement, la méthode compose de phospholipides et surfaces microfabriques pour formation simple d’un modèle ER et ne nécessite pas l’ajout de protéines ou d’énergie chimique (p. ex., GTP ou ATP). Contrairement à la morphologie 3D du réticulum endoplasmique cellulaire, le modèle est à deux dimensions (bien que le nanotube dimensions, géométrie, structure et dynamique est maintenue). Ce modèle unique en vitro ER se compose de seulement quelques éléments, est facile à construire et peut être observé sous un microscope optique. La structure résultante peut être décorée de plus pour des fonctionnalités supplémentaires, telles que l’ajout de protéines associées à l’ER ou de particules pour étudier les phénomènes de transport entre les tubes. Les réseaux artificiels décrites ici sont des modèles structurels appropriés pour le cellulaire ER, dont la morphologie caractéristique unique s’est avérée être liée à sa fonction biologique, alors que les détails concernant la formation du domaine tubulaire et réarrangements dans ne sont pas encore entièrement compris. Nous notons que cette méthode utilise Al2O3 thin-film-coated microscopie lamelles, qui sont disponibles dans le commerce mais qui nécessitent des commandes spéciales. Par conséquent, il est conseillé d’avoir accès à une installation de microfabrication pour la préparation.
Introduction
Le ER effectue des tâches cruciales dans la cellule biologique dont le repliement des protéines, la synthèse des lipides et calcium règlement1,2. La morphologie de l’ER est intrinsèque aux fonctions qu'il effectue. Il combine des piles planaires et domaines tubulaires dense-dynamique, qui continuellement interagir avec le cytosquelette et subissent des restructurations et constamment en mouvement. Le remodelage que subissent des structures ER parmi la transformation continue entre feuilles planes et de tubes, de la formation de vésicules ou de fusion au lumen ER, allongement des tubes préexistants, rétraction du tube, fusion et casse3. La structure particulière des réseaux tubulaires est énergétiquement défavorable. Les voies et les mécanismes par lesquels l’ER génère et maintient cette organisation, ainsi que la façon dont il s’agit de sa fonction n'est pas encore totalement comprises4,5.
On sait que l’ER fonctionne mal quand il perd son état homéostatique, ayant pour résultat une condition causée par une augmentation de la synthèse des protéines, l’accumulation de protéines mal repliées, ou changements de Ca2 + et équilibre oxydatif, stress du re. ER stress à son tour provoque la déformation de la morphologie naturelle de l’organite, spécifiquement en perturbant le réseau organisation6,7. En réponse, la cellule active un mécanisme de réparation pour retourner à un état homéostatique. Panne en réparation peut conduire à l’apoptose cellulaire induite par l’ER, qui contribue à plusieurs maladies métaboliques et dégénératives comme la maladie d’Alzheimer, le diabète de type 2, maladie de Parkinson, sclérose latérale amyotrophique et plusieurs autres7, 8. La recherche actuelle vise l’organisation des réseaux ER tubulaires, et plusieurs études mettent l’accent sur la reconstitution de l’ER in vitro2. Existent quelques modèles2,9,10 ont besoin de protéines pour initier et maintenir la membrane courbure3,11 et aider l’organite atteindre sa forme. De toute évidence, les systèmes de modèles qui reflètent quelques-unes des principales caractéristiques structurelles et organisationnelles de l’ER et donnent accès à des études expérimentales avancées sont en grande demande.
Nous présentons ici les procédures pour la préparation d’un modèle dynamique, apport énergétique le in vitro facile, protéine/produit chimique pour la ER, fournissant une plateforme de base pour étudier la morphologie de l’ER et fonctions associées4. Dans cette méthode, un modèle ER est fabriqué avec une approche bottom-up en utilisant seulement quelques éléments, dans lequel les molécules d’intérêt peuvent être intégrées pour ajouter à la complexité. Le réseau représente la dynamique et la structure de l’ER. En outre, transformation réversible entre la membrane plane et les tubes, formation de vésicules des tubes, tube fusion, glissant et rétraction peut tout observer. En plus de servir comme un modèle de bas en haut pour la ER cellulaire incomplètement comprise, l’itinéraire de lipides à nanotube réseaux décrits dans le présent protocole peut être applicable pour les chercheurs qui étudient l’auto-assemblage, nanofluidics, molécule unique et colloïde phénomènes de transport, le flux de Marangoni et autres domaines concernant. Les blocs de construction seulement moléculaires utilisées dans notre méthode sont les phospholipides. Le protocole exige peu de laboratoire et l’équipement de base et est accessible pour l’incorporation des éléments supplémentaires.
Protocole
1. préparation des phospholipides vésicule Suspension
Remarque : Pour toutes les matières visées comme « propre » dans le présent protocole, lavez-les avec de l’isopropanol suivi d’eau déminéralisée et les sécher avec de l’azote. Notez qu’un traitement des substrats de verre avec fortement oxydants acides (solution de Piranha), qui est généralement appliqué dans les protocoles de préparation pour les films de lipides pris en charge sur des substrats solides, ne doit pas être exécuté sur Al2O3-enduit transporteurs.
- Place dans une fiole de verre en forme de poire de fond rond ou ombiliqués propre de 10 mL : soja L-α phosphatidyl-choline (PC, 69 % w/w), 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 30 % w/w) et un fluorophore lipides conjugué de choix [par exemple, Texas Red 1,2 - sel de dihexadecanoyl-sn-glycéro-3-phosphoéthanolamine triéthylammonium (TR-DHMPE, 1 % p/p)] dans le chloroforme ; pour un montant total de 3000 µg de lipides dans 300 µL du chloroforme, aboutissant à une concentration finale de 10 mg/mL.
Remarque : Utilisation propre, verre, seringues étanches au gaz avec pistons de polytétrafluoroéthylène lors de la manipulation des composés contenant du chloroforme.
Attention : Chloroforme est toxique et hautement volatile et doit toujours être manipulé sous une hotte de laboratoire avec des équipements de protection individuelle associés. - Raccorder le ballon à un évaporateur rotatif, position avec une inclinaison de 45° et rotation lente à 24 t/mn dans un bain d’eau à 23 ° C pendant 6 h avec une pression d’air réduite pour supprimer complètement le chloroforme. Commencer à réduire le droit de pression après avoir entrepris la rotation par pas de 20 kPa toutes les 2 min, jusqu'à ce qu’il atteigne 20 kPa (150 Torr, 80 % de vide).
Remarque : La formation d’un film lipidique homogène d’épaisseur uniforme dans le récipient de préparation est l’exigence la plus importante pour la procédure de rotavap. Préparations de lipides sont sensibles à la vitesse de rotation, les changements de pression rapide et valeur de la pression finale ; par conséquent, suivre strictement les étapes de réduction lente ainsi que la vitesse de rotation et la pression finale. Positionner le ballon avec une inclinaison de 45° afin de garantir que le gâteau déshydraté lipidique est formé uniformément comme un film sur la paroi du ballon. Trop vite d’une rotation conduit aux turbulences et trop lent d’une rotation conduit (due à la pesanteur) à l’accumulation d’une épaisse couche de liquide au fond de la fiole. Au cours de la nuit subséquente gonflement des processus, un lipide très hétérogène qui ne répondent pas bien à l’étape finale de sonication est produit en masse, et les fractions qui en résultent sont de compositions différentes. Pression et temps à la plage spécifiée dans la méthode assure la désolvatation lente. Avec du chloroforme comme solvant, trop rapide d’une chute de pression refroidit le mélange, viscosité accrue et de la formation de film d’agrégation et inégale. La longue période de temps de 6 heures est recommandée afin d’éliminer le solvant à la mesure du possible, aux cloisons de solvants organiques dans la matière lipidique après réhydratation. - Après 6 h, arrêter la rotation et augmenter la pression de l’air nouveau, progressivement, par étapes de 20 kPa toutes les 2 min jusqu'à arriver à 100 kPa. Enlever le ballon de l’évaporateur rotatif et ajouter 3 mL de PBS et 30 µL de glycérol. Doucement agiter le ballon pour dissoudre le glycérol. Utiliser un bouchon de verre hermétiques pour sceller la fiole contenant des lipides.
Remarque : Le glycérol est utilisé pour prévenir la déshydratation complète du film lipidique et permet la séparation de bicouche12. Il doit être chauffé avant utilisation pour diminuer sa viscosité, ce qui facilite la manipulation de ce composé. Le glycérol réchauffée ne toujours pas immédiatement se mélange avec le tampon PBS. Il est nécessaire d’agitant doucement jusqu'à dissolution complète du glycérol. - Ranger le flacon au réfrigérateur à 4 ° C durant la nuit pour la réhydratation et l’enflure des films lipidiques.
- Le lendemain, laisser agir les lipides avec un bain à ultrasons à température ambiante (RT, ~ 21 ° C) et à 35 kHz fréquence jusqu'à obtenir une suspension homogène, légèrement trouble lipidique.
Remarque : La Sonication peut prendre environ 10-30 s. sonication prolongée (~ 1 min) produit de la chaleur et est préjudiciable à la formation de vésicules. - Mesures de rendement de 1,1 à 1,5 une suspension contenant deux types de structures vésiculaires : vésicules multilamellaires (MLV) et vésicules unilamellaires géant (GUV) (Figure 1A-1F).
- Pour le stockage, diviser la suspension de lipides dans 100 µL d’extraits, en utilisant un total de 30 microtubes à centrifuger et rangez-les dans un congélateur à-20 ° C.
Remarque : Flash de congélation à l’azote liquide n’est pas nécessaire et ne sont pas utilisés avant l’entreposage. Le protocole peut être suspendu ici. Partant des suspensions de lipides dans le réfrigérateur à 4 ° C pour prolongé fois causes lipides lyse, qui influe sur la composition de la membrane.
2. préparation des substrats
Remarque : Le protocole suivant est effectué dans une salle blanche classée ISO 8 dans la spécification de norme ISO 14644-1. Dépôt de couches atomiques (ALD) est utilisé pour fabriquer des Al2O3 substrats. Les paramètres de processus spécifié sont instrument-dépendante et peuvent varier entre les différents modèles d’équipements. Il peuvent servir de paramètres initiaux pour élaborer le processus.
- Régler la température du réacteur ALD à 200 ° C.
- Charger les surfaces en verre (par exemple, des lamelles de verre) dans le compartiment de mesure ainsi qu’une plaquette de silicium, qui sera utilisé plus tard comme une surface de référence pour déterminer l’épaisseur des dépôts par ellipsométrie.
Remarque : Des substrats de verre ont été utilisé out-of-the-box et n’étaient pas nettoyé à solvant avant le dépôt. Ils ont été vidés à l’azote pour enlever les particules. - Évacuer la chambre de chargement à 400 Pa (3 torr) et transférer les échantillons dans la chambre de réaction principale et évacue à 200 pa.
Remarque : La température du réacteur doit être maintenue à 200 ° C pour les dépôts appropriés. Fluctuations de la température après que chargement d’échantillon doit par conséquent être équilibré avant d’initier le dépôt. Pression dans la chambre devrait être supérieure à la pression de réacteur pour éviter toute précurseurs à se répandre à l’extérieur de la chambre. - Commencer à déposer le film atomique. Un cycle se compose d’une ms 150 impulsions triméthyl exposition à l’aluminium, suivie d’une purge de s 1 et par la suite, une exposition de2O H de durée de 200 ms suivie d’une purge de s 1.
Remarque : Tous les paramètres y compris chambre et réacteur à pression, longueur des cycles et des purges sont automatisées pour atteindre un taux défini de dépôt. Ces paramètres peuvent varier parmi les différents modèles d’équipements. Les recettes pré-paramétrés sont souvent préparés par le vendeur ou l’outil chargé dans la salle blanche et communiquées à l’utilisateur comme l’épaisseur du film déposé par unité de temps. - Pour atteindre de 10 nm de Al2O3 sur le substrat, répétez le processus pour 100 cycles. Le nombre de cycles dépend de la vitesse de dépôt, qui peut varier entre les différentes recettes ou de l’équipement.
- Pour supprimer les échantillons provenant du réacteur, premier évent de la chambre jusqu'à ce que sa pression atteigne la pression atmosphérique, puis retirez les échantillons.
- Stocker les échantillons dans des récipients hermétiques à ta jusqu'à utilisation.
NOTE : Aucun autre nettoyage est recommandé avant l’utilisation. Le protocole peut être suspendu ici.
NOTE : Les échantillons devraient idéalement être utilisés immédiatement après le dépôt. Le stockage optimal nécessite le positionnement des surfaces à l’intérieur des supports de plaquette en polypropylène, suivies enveloppant les transporteurs en salle blanche-compatible avec des sacs en plastique, qui doivent être vidées d’azote avant fermeture sous vide. Le but est pour éviter d’exposer la surface aux contaminants atmosphérique. Si nécessaire, les surfaces peuvent être conservés dans des contenants hermétiques à RT au maximum pendant 5 jours. Une conservation plus longue n’est pas recommandée. Pour ceux qui ne pas avoir facilement accès à une salle blanche est proche et acheter ou obtenir les surfaces de l’étranger, ré-oxyder les substrats au moyen de plasma ou l’ozone de l’oxygénothérapie peut être une solution de rechange13.
3. transformation de Films moléculaires phospholipides aux réseaux tubulaires
- Décongeler la suspension de lipides et transférer une goutte de 4 µL de suspension sur une diapositive/lamelle de microscope verre propre.
- Dessécher la goutte pendant 20 min. La goutte va s’effondrer au cinéma circulaire plat des lipides après dessiccation, qui est visible à le œil.
- Réhydrater le film lipidique avec 1 mL de tampon HEPES (voir Table des matières) pendant 3 min.
Remarque : Le volume de tampon de réhydratation affecte la densité de suspension de vésicule (le nombre de vésicules par unité de volume), que l'on reporte ensuite à la chambre d’observation. Selon le volume de la chambre de l’observation et la densité désirée vésicule, le volume de réhydratation peut être ajustée à 0,5 à 1 mL. Borosilicate propres diapositives tendent à soutenir des gouttelettes de plusieurs centaines microlitres jusqu'à 1,5 mL sans problème. Étant donné que la lamelle ne doit pas être déplacé, cela ne conduit pas à un problème technique. Sur des surfaces plus hydrophobes, comme SU-8 lames de revêtement polymère, même 1,5 mL peut être déposé12.
NOTE : Les lipides doivent être fraîchement préparées, comme l’exposition du film lipidique réhydratées pendant plus de 20 min à ta conduit à l’évaporation de la mémoire tampon et de la déshydratation partielle des vésicules préalablement réhydratés, qui conduit à un mal défini la composition. - Préparer la chambre d’observation : pour permettre l’échange de la mémoire tampon au moyen d’une pipette automatique, qui est nécessaire pour initier la transformation ER, une chambre d’observation avec un sommet ouvert a été utilisée. Cette chambre comprend un châssis de polydiméthylsiloxane (PDMS) avec des dimensions 1,5 x 1,5 x 0,5 cm, collé sur l’Al2O3 déposé de lamelle. Un schéma de la chambre d’observation monté est représenté dans la Figure 1G. Les étapes suivantes ont été effectuées pour fabriquer le cadre PDMS et assembler la chambre d’observation :
- Préparer une solution KOH en mélangeant 100 g de KOH avec 100 mL d’isopropanol dans un bécher dans un bain de glace. Remuer pendant 10 h ou plus jusqu'à ce que le KOH se dissout complètement à l’aide d’un agitateur magnétique et plaque d’agitation magnétique.
Attention : La solution de KOH est corrosive et peut conduire à des brûlures de la peau, il faut donc toujours manipuler avec un équipement de protection personnels.
Remarque : La solubilité de KOH dans l’isopropanol n’est pas aussi élevée que dans l’eau. La dissolution est exothermique. Il est conseillé d’écraser les granulés KOH avant la dissolution et l’agitation continue. - Plonger un verre de pétri (d = 6 cm) dans la solution KOH à RT et garder pour elle la nuit.
- Le lendemain, retirer le plat de verre de la solution, plongez-le dans un récipient avec de l’eau désionisée pendant 5 min, rincer plusieurs fois à l’eau et placez-le dans une étuve à 80 ° C pendant 1 h. coup la surface brièvement dans un courant d’azote afin d’assurer la partie icles sont supprimés.
- Pour passiver la surface et empêcher le collage sur PDMS, transférer 200 µL de diméthyldichlorosilane avec une seringue en plastique dans un récipient en plastique comme un bateau de pondération.
- Stocker le verre plat de pétri avec le silane pendant 1 h dans un dessiccateur sous vide (vide faible, environ 20 kPa).
Attention : Diméthyldichlorosilane est toxique et doit toujours être manipulé sous une hotte de laboratoire avec des équipements de protection individuelle associés. - Attendre 15 min avant de prélever la boîte de pétri afin que la vapeur de diméthyldichlorosilane restants se dissipe. La boîte de pétri est maintenant silanisée, et la surface est hydrophobe.
Remarque : Un moyen rapide pour tester le succès de cette étape est de placer une goutte d’eau sur la silanisée pétri. L’angle de contact de la gouttelette avec la surface doit augmenter visiblement par rapport au verre non traitée. - Dans un récipient en plastique de 250 mL (tasse en plastique transparent fraîche en provenance de l’emballage), mélanger 10 g d’élastomère de silicone base avec 1 g de silicone élastomère de salaison (10:1). Remuer à l’aide d’une spatule agitateur plastique/plastic pendant 5 min.
NOTE : Bulles d’Air sont forment à l’agitation et le PDMS ressemblera blanc pâle. - Dessécher le mélange pour dégazer à < 20 kPa jusqu'à ce que toutes les bulles d’air en expansion sont sont effondrés (vide plus élevée accélère le processus). Versez le mélange dégazé dans la silanisée pétri.
- Guérir à 65 ° C pendant 2 h dans un four.
Remarque : Il est possible de doubler la vitesse de durcissement en augmentant la température à > 95 ° C. L’augmentation de la température séchage entraîne une augmentation de la rigidité du matériau. - Refroidir la boîte de pétri remplie avec le PDMS durci a RT et retirer la dalle PDMS avec une spatule.
- Avec un scalpel, couper la trame dans les dimensions et la géométrie appropriée pour l’ouverture disponible à la platine du microscope. Dimensions de 1,5 (longueur) x 1,5 (largeur) x 0,5 cm (hauteur) conviennent à la plupart des configurations.
- Mettre le côté lisse (la face inférieure qui a été en contact avec la boîte de pétri) du PDMS encadrer en contact avec le côté actif de la surface où l’Al2O3 film réside et exercez une légère pression pour pousser le cadre et les uns contre les autres de surface les faire adhérer.
Remarque : L’adhérence entre la trame de PDMS et le Al2O3 substrat est faible. La présence de bulles d’air à l’interface de contact peut causer la pièce jointe et, partant, la fuite de la mémoire tampon et les contenus. L’armature PDMS peut être utilisé plusieurs fois si immédiatement après et avant chaque utilisation il est rincé avec de l’isopropanol, suivie d’un rinçage avec l’eau distillée et brushing avec de l’azote. La silanisée pétri peut également être réutilisée.
- Préparer une solution KOH en mélangeant 100 g de KOH avec 100 mL d’isopropanol dans un bécher dans un bain de glace. Remuer pendant 10 h ou plus jusqu'à ce que le KOH se dissout complètement à l’aide d’un agitateur magnétique et plaque d’agitation magnétique.
- Remplir la chambre d’observation avec Ca2 +- un tampon HEPES (voir Table des matières).
Remarque : La surface doit être utilisée immédiatement après descellement le paquet. Contact avec l’air conduit à l’adsorption des contaminants, ce qui diminue l’activité de la surface progressivement. La chambre doit être remplie avec tampon immédiatement après l’Assemblée. Ne pas remplir le volume entier permettant l’ajout des lipides réhydratées dans l’étape suivante. - Placez la chambre sur la platine du microscope confocal. Transférer le matériel lipidique réhydraté, maintenant une suspension contenant des vésicules géants, dans la chambre avec un plastique, pipette Pasteur (Figure 1A-1 G).
- Attendez 10 à 20 min de laisser les vésicules adhèrent sur le substrat et répartis sur la surface (Figure 1H-1J).
Remarque : La diffusion commence immédiatement après le dépôt de lipides sur la surface. Le taux de propagation légèrement peut-être varier en fonction de la composition lipidique, Al2O3 technique de dépôt (ADL, dépôt en phase vapeur RF sputtering, chimiques, etc.), fraîcheur du substrat et la concentration des cations divalents dans le mémoire tampon. Ce que change de tampon soit menée avant la rupture de la propagation de correctifs14. - Après avoir observé plusieurs lipides tartinades, retirez lentement le tampon ambiant via une pipette automatique, telle que seulement un film mince tampon reste sur le fond.
Remarque : Une extraction rapide du tampon perturbe les structures lipidiques sur la surface. - Procéder à l’échange tampon ambiant en remplissant lentement la chambre d’observation avec un tampon HEPES-chélateur (voir Table des matières) à l’aide d’une pipette automatique (Figure 1K).
NOTE : Brusque addition de tampon perturbe les structures lipidiques sur la surface. - Cette dernière étape donne des réseaux de nanotubular dynamique, formés à la suite de l’induite par le chélateur depinning et rétraction de la DALG au MLV4 (Figure 1L-1Y).
4. microscopie Observation
- Acquérir les images avec un inversé laser scanning microscope confocal utilisant un 40 X objectif à immersion d’huile (1,3 NA) avec une fréquence de balayage de 400 Hz. employer une source laser de lumière blanche pour exciter le Texas Red DHMPE à 595 nm. Recueillir l’émission de 605 à 700 nm en utilisant un détecteur de photons hybride.
Remarque : Vous pouvez également un microscope épifluorescente peut être utilisé pour l’imagerie. Selon les sources lumineuses disponibles, sélectionnez un conjugué de lipide-colorant approprié.
Résultats
La suspension de lipides obtenue à l’étape 1 du protocole et utilisé au cours des expériences contient deux principaux types de vésicules : VVA et GUVs. Figure 1 A-1F montre laser scanning confocal micrographies des vésicules dans l’échantillon initial construit en 3D. Figure 1 A-1_C montre un MLV (dépôt de lipides) dans le xyz, xz et yz planes, respectivement. Figure 1 D-1F montre des vues similaires d’une vésicule unilamellaires géant (GUV). La partie intérieure des GUVs, qui n’ont pas multilamellarity, est creuse ; le matériel de lipides pour la diffusion est donc considérablement limité. Par conséquent, les réservoirs de lipides n’est utile que pour cette méthode sont VCP.
Lorsque la suspension de lipides est transférée à la chambre d’observation contenant le Ca2 +- un tampon HEPES (Figure 1G), la VCP (Figure 1,A-1_C) commence à s’installer sur la surface de3 Al2O. Cas de contact, les vésicules adhèrent à la surface, et une circulaire plat double membrane lipidique bi-couche (DALG) commence à se répandre de chaque canalisation principale sur le support solide (Figure 1H-1J). Le VCP agit comme un réservoir qui fournit les lipides pour le DALG en constante croissant. La membrane distale bicouche (supérieur), en ce qui concerne le support solide, est reliée à la membrane proximale de bicouche (en bas) le long de la circonférence du bord circulaire, effectuant un mouvement de roulis (Figure 1j’ai). Les deux bicouches sont positionnés carrément sur le dessus de l’autre, ayant seulement un mince film de liquid encapsulé entre eux. Au cours de la propagation, la membrane proximale continuellement adhère à la surface de soutien dessous, tandis que la membrane distale est tirée latéralement sur les bords par le bord proximal de membrane en expansion. La diffusion de la DALG est médiée par Ca2 +, qui agit comme un agent fusogène entre groupes de tête de lipides de la membrane proximale et substrat solide4.
Si la diffusion continue pendant des périodes prolongées, la membrane de tension augmente, entraînant ruptures (Figure 2A et 2 b). Après ce point, rétraction de membrane, qui est nécessaire pour créer la morphologie tubulaire ER, peut ne plus être induite. Par conséquent, il est important de reconnaître les rupture des membranes. Puisque les lipides dans nos expériences sont étiquetés fluorescent, la rupture peut être directement observée. Un indicateur clé de la rupture est la baisse significative de l’intensité de la fluorescence dans le région de rupture (Figure 2A et 2 b)14. La rupture est la conséquence de la tension accrue et la formation subséquente de pore dans la membrane distale. Sous un microscope à fluorescence, les régions de ruptures exposera donc moitié l’intensité de d’émission (bicouche proximale unique) des régions non rompue (double bicouche)14 (Figure 2B). Au cours de la formation de pores, le matériau de la membrane, qui était initialement placé dans les régions de ruptures, migre vers les bords du timbre étalé. Cela provoque à son tour une augmentation de la superficie totale de patch. Par conséquent, une expansion rapide du périmètre de rayonnement du patch circulaire peut également être observée lors de la rupture.
Pour éviter la croissance extensive conduisant à la rupture des patchs, immédiatement après que la zone circulaire patch atteint 100 à 200 µm, le Ca2 +- un tampon HEPES est délicatement retiré avec une pipette automatique jusqu'à un mince film de liquide reste sur la surface. Le tampon HEPES-chélateur est ensuite doucement ajouté à la chambre pour initier la rétraction (Figure 1K). Une déshydratation complète de l’échantillon (Figure 2C) ou un échange rapide de tampons (Figure 2D et 2E) provoque des perturbations, une rupture ou déformation des patchs. L’addition de chélateurs supprime progressivement Ca2 + de l’espace entre la surface et la membrane. Le tampon HEPES-chélateur accède peu à peu l’espace inter-bilayer-substrat, à partir de la périphérie du patch membrane lipidique. Par conséquent, la suppression des sites épinglage commence sur les bords de la tache circulaire et se propage vers l’intérieur (Figure 1K-1 q). À la suite de depinning, la membrane lipidique commence à se détacher et de se rétracter de la vers l’intérieur de bords, progressant vers la canalisation principale au centre. Le processus de rétraction conduit à une nouvelle interface de développement dynamique des réseaux tubulaire lipidiques4 (Figure 1L-1Y). Les régions persistantes de l’épinglage, qui ne permettent pas la membrane détacher complètement, restent sur la surface et nuclée tabulation, menant à réseau ramifié longtemps des nanotubes. (Figure 1L-1Y). Continu hors épinglage et outre la rentrée de nanotubes de lipides sont observées au fil du temps comme résultat du processus de chélation progressive. Ce durcissement et le réarrangement des branches réseau joue un rôle clé dans le comportement dynamique des réseaux tubulaires, qui ressemblent à la re lisse.
Figure 1 L-1Y montre les micrographies des réseaux de nanotube obtenus dans le protocole. Figure 1 L est qu'un gros plan de la région dans la Figure 1M marqué dans le cadre blanc. Les régions de rouge vif continues dans la Figure 1L et 1 M sont la fraction rétractable de la DALG (indiqué par une ligne pointillée bleue dans la Figure 1M). La micrographie d’un réseau tubulaire en Figure 1N et 1O est inversée pour augmenter le contraste. Figure 1 P et 1 q représente la réduction de la densité tubulaire sur une région de la membrane au cours de 3 h et 20 min. La diminution de la densité tubulaire se produit en raison de la depinning progressive, suivie par la rétraction de la logistique de la surface pendant la période expérimentale. Au fil du temps, le nombre de points libérés de l’épinglage des augmentations, conduisant à des réarrangements et une réduction de la superficie couverte par les tubes (Figure 1P et 1 q). Les réarrangements tubulaires sont motivées par minimisation d’énergie libre de surface d’un nanotube de lipides suspendue entre deux points fixes. Il est bien établi que la façon la plus efficace de réduire au minimum l’énergie de surface d’un nanotube est de réduire sa longueur15. Par conséquent, lorsque les régions coniques, qui initialement tenir les nanotubes sur la surface, sont épinglées hors, les nanotubes glisser et s’arrangent spontanément, adoptant une longueur minimale. Ces réarrangements provoquent une couverture réduite progressivement de la surface par les nanotubes (Figure 1P et 1 q).
Nous ne pouvons pas visualiser le Ca2 +-médiée épinglage points, mais nous établissons leurs emplacements comme les points où les tubes ont spires terminales ou pointus. Des virages serrés sont appelés jonctions V15 ou tournants en raison de la brusque changement de direction d’alignement du tube (flèches vertes en Figure 1R et 1 X). Le point final représente l’extrémité du tube, qui empêche le tube de se rétracter (flèches orange à la Figure 1X). Au cours de la ré-organisation, disposition énergétiquement favorable des tubes identifiés comme « Y-jonctions » ou « 3-way carrefours », apparaissent. La jonction en Y relie trois tubes avec des angles de 120° environ entre chaque tube, où vous pouvez fixer la longueur totale de tube plus court. Les jonctions-Y, qui ne possèdent pas un point final et au contraire sont positionnées entre les nanotubes multiples, ne sont pas épinglées. C’est le seul type de jonction en Y pouvant effectuer glissant (flèches bleues, Figure 1R). Comme illustré à la Figure 1R et 1 s, glissant d’une jonction en Y le long d’un conduit intersection hautement instable à la formation des deux individuels Y-jonctions (flèches bleues en Figure 1S). Les pointillés blancs superposés Figure 1S représentant le contour du fragment réseau tubulaire en Figure 1R. Une fraction des jonctions-Y possède des bornes extrêmes (flèche jaune dans la Figure 1T) qui, au fil du temps, finissent par se rétractent (Figure 1U). La transformation d’une V-jonction à un seul, tube droit de depinning du point d’intersection des segments de deux lignes et par la rétraction de l’un des tubes formant la forme V peut être observé dans la Figure 1V et 1W et Figure 1X et 1Y, respectivement.
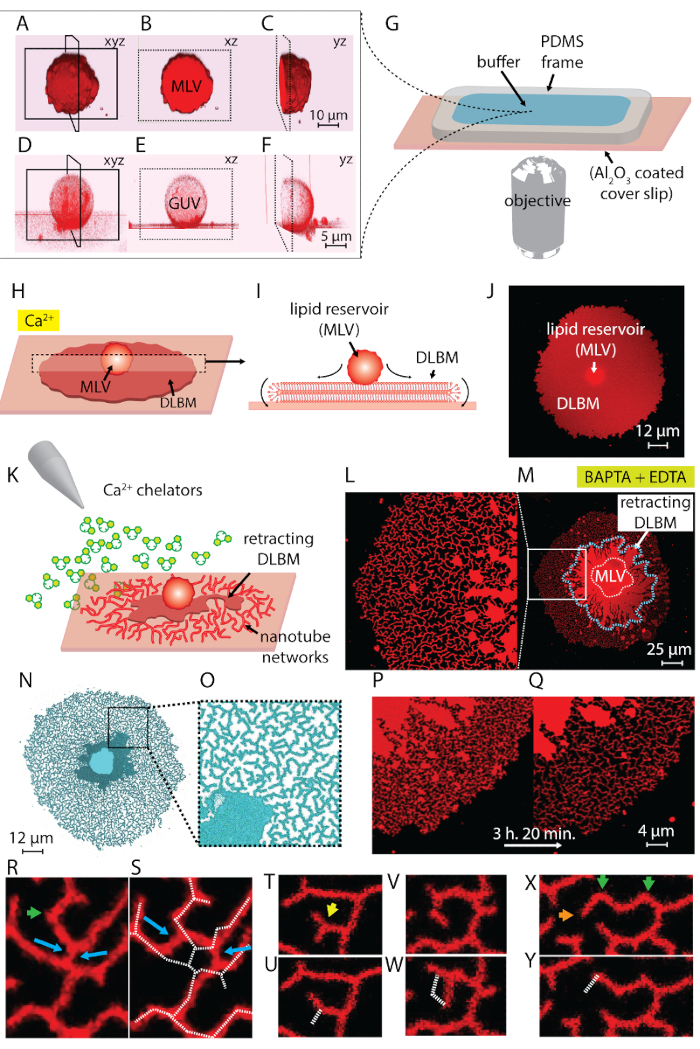
Figure 1 : Transformation des lipides dépôts aux réseaux tubulaires de type ER. (A-F) Balayage de microscopie confocale des vésicules dans l’échantillon initial, construit en 3D au laser. (A-C) Plans de vésicules lipidiques multilamellaires (MLV, dépôt lipidique) dans xyz, xz et yz, respectivement. (D-F) Vues similaires d’une vésicule unilamellaires géant (GUV). La partie intérieure des GUVs est creuse, ce qui rend la matière lipidique pour répandre considérablement limitée. Les réservoirs de lipides utiles pour cette méthode sont donc Illustration VCP. (G) de la chambre d’observation montée sur un microscope inversé sur lequel sont déposés les tampons et les lipides. La chambre est composée d’un PDMS cadre collé sur un Al2O3 enduit lamelle, offrant un haut volume ouvert. (H.-J.) Illustrer les phénomènes de propagation de la VCP en présence de Ca2 +. (H) au contact de Al2O3, le VCP se propage spontanément sous forme d’une circulaire, double membrane bicouche lipidique (logistique). (I) vue schématique de la logistique dans le plan xz, où les périphéries effectuent de mouvement de roulis. VCP (d = 5 à 15 µm) et DALG (épaisseur = 10 nm) ne sont pas dessinés à l’échelle. (J) un confocal micrographie d’un épandage DALG de vue de dessus. (K) décrit l’étape principale de ce protocole, où la mémoire tampon est échangé à un Ca contenant2 + agents de chélation, inhibant la diffusion, provoquant la rétraction de la DALG à la VCP et conduisant à la formation des nanotubes lipidique. (L-Y) Micrographies des réseaux de nanotube obtenus avec la méthode décrite. (L) gros plan de la région (M) marqué dans un cadre. Les régions continues de rouge vif (L et M) représentent le DALG (également marqué par une ligne en pointillés bleue en M). La micrographie d’un réseau tubulaire (N et O) est inversée pour augmenter le contraste. (P et Q) Représentation de la réduction de la densité tubulaire sur une région de la membrane au cours de 3 h et 20 min. (R-Y) représentant réorganisations tubulaire. (R et S) Coulissante, (T et U) la transition d’une jonction en Y à V-jonction par la rétraction d’un point d’arrêt et (V et W) hors l’épinglage d’un tournant, ce qui a entraîné l’élimination d’une V-jonction. (X et Y) Rétraction d’un point final. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
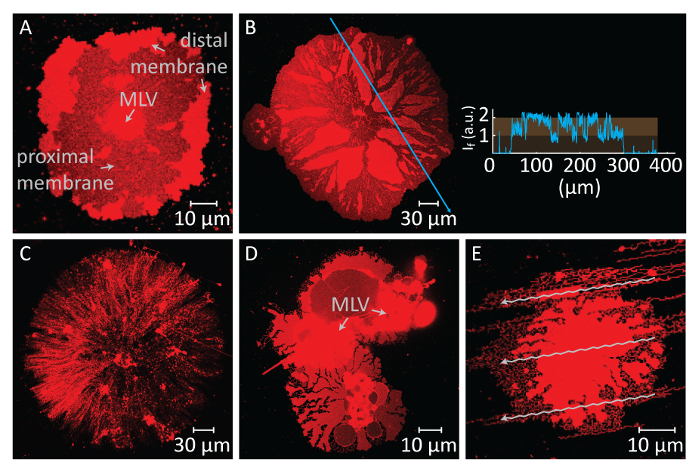
Figure 2 : Résultats négatifs potentiels. (A et B) Une rupture de la membrane distale due à un long temps d’attente avant l’échange des tampons. Les zones de ruptures, où la membrane proximale devient visible, apparaissent comme des régions sombres en comparaison avec les régions de membrane distale non rompue. L’encart au panneau B montre l’intensité de la lumière le long de la flèche bleue sur la micrographie. L’intensité des régions ruptures de la membrane (bicouche proximale/single devient visible) correspond à la moitié de l’intensité de la membrane non rompue (distal/double bicouche). (C) l’apparence d’un timbre sec lipidique formé par suite du retrait de tous les liquides de la chambre d’observation. (D et E) Rupture de la membrane par un échange rapide de tampons via automatique pipette. (D), le VCP est divisée en 2 VCP, conduisant à un patch de lipides non circulaire, déformés. (E), le modèle de l’écoulement (flèches), créé par injection forte du tampon HEPES-chélateur, se reflète sur la structure de la membrane tubulated. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Dans la discussion qui suit, les étapes critiques et modifications éventuelles limitations du protocole sont décrits. La première étape critique est le montage de la chambre d’observation, étant donné que l’adhérence de l’image PDMS à l’Al2O3 surface est intrinsèquement faible. Dans le cas où le cadre n’adhère pas au substrat correctement, le contenu provoquera une fuite de la chambre de l’observation et l’expérience va s’arrêter. Les principaux facteurs qui entravent la bonne étanchéité de la surface et le cadre sont 1) l’absence de nettoyage en profondeur de l’armature PDMS (réutilisé) et 2) bulles qui parfois obtenir emprisonnés entre châssis et substrat d’air. Un cadre PDMS nouvellement préparé ou completement nettoye doit être utilisé. Le cadre doit être rincé avant et après chaque utilisation avec de l’isopropanol, suivie d’un rinçage avec l’eau distillée et brushing avec de l’azote. L’Al2O3 surfaces n’exigent pas n’importe quel nettoyage préalable, car ils sont fabriqués dans un environnement de salle blanche et conservés dans des contenants hermétiques jusqu'à utilisation. En raison du caractère amphotère Al2O3, il ne devrait pas être exposé à des solutions fortement acides ou basiques. Autres modèles pour la chambre d’observation peuvent être employées, selon l’accessibilité de l’installation individuelle. Caractéristiques importantes de cette chambre sont un accès gratuit à l’échantillon liquide de l’ouverture supérieure et l’inertie du matériau cadre en ce qui concerne les solutions utilisées et les échantillons. Les dimensions de la chambre sont également un facteur important, car elles devraient accueillir un volume de 0,5 à 1 mL. Puisque les surfaces utilisées sont généralement de taille standard des lamelles (24 x 60 mm), le volume de la chambre est principalement déterminé par l’épaisseur du cadre. À notre connaissance, les entretoises à l’ampleur et la profondeur qui peut accueillir le volume des échantillons généralement géré par le présent protocole ne sont pas disponibles dans le commerce. Nous avons donc consacré un article dans le protocole pour les détails de la fabrication et l’assemblage d’un cadre de chambre d’échantillon.
L’autre étape critique dans le présent protocole est l’échange de la mémoire tampon. Un défi dans cette étape est le moment choisi pour effectuer cet échange. La diffusion de la canalisation principale lors du contact avec le substrat de3 Al2O est instantanée, et l’expansion continue de le DALG conduit à sa rupture, clôturant l’expérience (Figure 2A, B). Par conséquent, la diffusion doit être constamment surveillée, et l’échange de la mémoire tampon doit être effectuée dans un délai raisonnable. L’échange ne doit pas être exécuté trop rapidement après l’initialisation de la diffusion, afin de permettre les patchs de membrane atteindre une taille optimale (100 à 200 µm de diamètre). En revanche, adhérence continue sur la surface provoque la tension membranaire élevé, ce qui conduit à une rupture. Ainsi, membrane tous les correctifs éventuellement rupture si l’épandage n’est pas interrompu. Le moment de la rupture est différente pour chaque patch, puisque cela dépend de la taille et la structure interne de la canalisation principale et l’accessibilité des lipides qui y sont. Par conséquent, au moment de l’échange doit être disposé à un validant au cours de laquelle les patchs non rompus avec les tailles optimales représentent la majorité de l’ensemble de la population. Un autre défi dans l’étape d’échange tampon est le taux de suppression et ajout des tampons. Effectuer cette substitution trop rapidement a un effet néfaste sur les structures de membrane final (Figure 2C-E). L’extraction excessive de la Ca2 +- un tampon HEPES sans laisser un mince film de liquide sur le substrat, se traduit par patchs membrane séchés et irréversiblement déformées (Figure 2C). Même s’il subsiste une quantité adéquate de liquide sur la surface, addition brusque du tampon HEPES-chélateur provoque également des perturbations des structures membranaires. Figure 2 D,E , montre l’aspect typique des patchs de membrane hydrodynamique perturbé. Les perturbations dans l’ensemble morphologique n’influencent pas nécessairement les propriétés dynamiques des structures finales (c'est-à-dire, les réarrangements tubulaires dans les zones restantes se produira encore). Cependant, il deviendra difficile d’observer la transformation matérielle sur les structures déformées. Par exemple, dans la Figure 2D, il serait difficile de déterminer la direction vers laquelle se rétracte MLV le DALG.
Une éventuelle modification du protocole est la composition lipidique utilisée. L’accent a été mis sur les phospholipides qui dominent la composition ER chez les mammifères et16 de levure (e. g., la phosphatidylcholine (PC), la phosphatidyléthanolamine (PE) et le phosphatidylinositol (PI). Les expériences initiales ont été effectuées à l’aide de mélanges de PC et PI4. Dans les résultats présentés, un mélange de PC et de DOPE et un dérivé du PE a été utilisés. Cependant, pas toutes les compositions lipidiques arbitraires ont été trouvées pour créer les structures tubulaires obtenues par le biais de ce protocole. Quelques-uns des autres mélanges lipides étudiées expérimentalement impliquent cœur total extrait, extrait de haricot de soja polaire, e. coli polaire, mélanges de PC avec stearoyl-2-hydroxy-sn-glycero-3-phosphoinositol (Lyso-PI) dans des proportions variables et mélanges de PC-PE-PI-Posphatidyl sérine (PS) en proportions variables. Car structures à membrane tubulaire possèdent des courbures hautes nécessitent la disposition particulière des molécules lipidiques individuels, il est prévu que le phénomène observé est lipidique composition spécifique.
Une autre modification appliquée dans le présent protocole est la méthode pour la fabrication de la surface. Ici, l’ALD a été utilisé pour fabriquer l’Al2O3 enduit lamelles couvre-objet. Cela diffère de la méthode de dépôt rapportées,4de pulvérisation réactive. Tandis que ceci indique qu’une méthode alternative de fabrication surface peut entraîner encore tubulation ER-comme, une limitation importante semble être la spécificité du matériau de la surface. Le mode de propagation et de la force d’adhérence dépend beaucoup de propriétés du matériau de la surface, qui influence sur des facteurs tels que les interactions électrostatiques, mouillabilité, hydrophobie et la rugosité de la surface. Al2O3 surfaces offrent une adhérence optimale et films lipidiques peuvent tous deux attacher assez fortement à se propager comme une membrane de bicouche lipidique double et se détacher de constituer des réseaux tubulaire lors du retrait des ions Ca2 + . Nous avons testé précédemment la même expérience avec la SiO2, dans lequel les vésicules multilamellaires s’est répandu comme une membrane de bicouche lipidique double, mais aucune formation réseau tubulaire a été observée lors de l’addition de chélateurs17. La fixation et la formation des tubes sont observés uniquement sur Al2O3 ou plasma gravé Al18. Nos enquêtes ont révélé que le paramètre contributif menant à un tel phénomène est la fonction Zêta de potentiel des surfaces et pour lesquels Al Al2O3 étaient proches de zéro (mV) et SiO2 nettement défavorable. Le potentiel zêta de borosilicate est similaire à SiO219; par conséquent, adhérence du film lipidique sur le borosilicaté est tout aussi forte et irréversible. En fait, lipides multilamellaires réservoir contact avec des surfaces de borosilicate mène habituellement à la rupture immédiate et de la formation des lipides simples bicouches20. L’Al2O3 surfaces requis pour que ce protocole ne sont pas facilement ou commercialement disponibles. Ils peuvent, toutefois, être commande de fabricants de verre et substrat de spécialités. Accès à la salle blanche avec des équipements de fabrication de couches minces est fortement recommandée.
Les autres méthodes existantes de bas en haut pour fabriquer des réseaux tubulaire type ER2,10 impliquent des protéines ainsi que d’entrée de l’énergie chimique (p. ex.., ATP et GTP). Rapoport et collègues2 a signalé la formation de réseaux-ER sur verre couvre-objet en vitro en mélangeant les protéines membranaires-flexion présentes dans urgences, avec des phospholipides et GTP. Le travail de m. Bachand et al. 10 montre comment ces réseaux tubulaire dynamiques peut être créés en utilisant des moteurs moléculaires et l’ATP comme source d’énergie. Ce protocole présenté ne nécessite pas de protéines membranaires ou hydrolyse de composés organiques pour l’énergie. Les seuls éléments essentiels sont le substrat solid et les phospholipides. Purification et extraction des protéines ne sont pas exigés. Ce protocole prévoit, en termes de simplicité des molécules constitutives, le plus simple modèle ER.
Avec ce modèle de ER base, base de lipides mis en place, mise en place de complexité en ajoutant les composants associés à ER est intéressant, puisqu’il permet aux enquêtes des impacts individuels sur le système. Similaire aux réseaux ER réelles, les tubes dans le modèle sont dynamiques. La conjugaison d’et la migration des protéines membranaires étiquetées ou particules fluorescentes dans tout le réseau tubulaire, peuvent donner des informations sur la direction du mouvement de la membrane. Encapsulation et la surveillance des liquides à l’intérieur du DALG et tubes fluorescents au cours de la transformation et une cartographie possible du transport contenu intratubulaires pourraient servir une autre mise au point. Enfin, une transition entre le modèle ER 2D résultant de ce protocole vers un modèle 3D de ER lisse peut-être être adoptée par encapsulation des réseaux dans les architectures d’hydrogel.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions le professeur Aldo Jesorka de la Chalmers University of Technology en Suède pour ses précieux commentaires sur le manuscrit. Ce travail a été rendu possible grâce au soutien financier provenant de la subvention de projet de recherche du Conseil de la Norvège (Forskningsrådet) 274433, UiO : Sciences de la vie environnement de Convergence, le Conseil de recherche suédois (Vetenskapsrådet) projet subvention 2015-04561, ainsi que le financement de démarrage fourni par le Centre for Molecular Medicine Norvège & faculté de mathématiques et de Sciences naturelles à l’Université d’Oslo.
matériels
| Name | Company | Catalog Number | Comments |
| Pear-shape flask 10 mL | Lenz Laborglasinstrumente | 3.0314.13 | In which the lipid mixture is prepared |
| Hamilton 5 mL glass syringe (P/N) | Hamilton | P/N81520 | For transfer of the chloroform to beaker |
| Custom large hub needle Gauge 22 S | Hamilton | 7748-18 | Removable needle for syringe specified in row 3 |
| Hamilton 250 µL glass syringe | Hamilton | 7639-01 | Used for transfer of lipids in chloroform to the flask |
| Large hub Gauge 22 S | Hamilton | 7780-03 | Removable needle for syringe specified in row 5 |
| Hamilton 50 µL glass syringe | Hamilton | 7637-01 | Used for transfer of fluorophore-conjugated lipids to the flask |
| Small hub Gauge 22 S | Hamilton | 7770-01 | Removable needle for syringe specified in row 7 |
| Chloroform anhydrous (≥99%) | Sigma-Aldrich | 288306 | Used to complete the lipid mixture to a total of 300 µL |
| Soy L-α Phosphatidyl choline lipid (Soy PC) | Avanti Polar Lipids Inc | 441601 | phospholipid species contributing to 69% of the total composition/mixture |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE) | Avanti Polar Lipids Inc | 850725 | phospholipid species contributing to 30% of the lipid composition/mixture |
| L-α Phosphatidyl inositol lipid (Soy PI) | Avanti Polar Lipids Inc | 840044 | alterative phospholipid species contributing to 30% of the lipid composition/mixture (from the original article Bilal and Gözen, Biomaterials Science, 2017) |
| Texas Red 1,2-dihexadecanoyl-sn-glycero-3-phosphoethanolamine,triethylammonium salt (Texas Red DHPE) | Invitrogen (Thermo Fisher Scientific) | T1395MP | Fluorescent-lipid conjugate, 1% of the lipid composition/mixture |
| Digital Dry Baths/Block Heaters | Thermo Fischer | 88870006 | To warm glycerol in order to decrease its viscosity |
| Glycerol for molecular biology (≥99%) | Sigma Life Science | G5516 | For lipid preparation |
| PBS buffer (pH=7.8); ingredients below in rows 17-21 | Used to prepare the lipid suspension | ||
| TRIZMA base, primary standard and buffer (≥99%) | Sigma Life Science | T1503 | Used to prepare PBS buffer |
| Potassium phosphate tribasic, reagent grade (≥98%) (K3PO4) | Sigma-Aldrich | P5629 | PBS buffer ingredient |
| Magnesium sulfate heptahydrate, BioUltra (≥99,5%) KT (MgSO47H2O) | Sigma Life Science | 63138 | PBS buffer ingredient |
| Potassium phosphate monobasic, anhydrous, free flowing, Redi-Dri, ACS (KH2PO4) | Sigma-Aldrich | 795488 | PBS buffer ingredient |
| Ethylenediaminetetraacetic acid disodium salt dihydrate ACS reagent, 99.0-101.0% (Na2EDTA) | Sigma-Aldrich | E4884 | PBS and Chelator-HEPES buffer ingredient |
| Ultrasonic cleaner USC-TH | VWR | 142-0084 | Ultrasonication of rehydrated lipids |
| Rotary evaporator - Büchi rotary evaporator Model R-200 | Sigma | Z626797 | For evaporation of chloroform |
| Pressure meter - Vacuum regulator IRV-100 | SMC | IRV10/20 | For controlling the pressure value during lipid dehydration |
| HEPES-buffer (pH=7.8); ingredients below in rows 26-27 | Used for rehydration of lipids. Content: 10 mM HEPES with 100 m NaCl diluted in ultrapure deionized water | ||
| HEPES ≥99.5% (titration) | Sigma Life Science | H3375 | HEPES-buffer ingredient |
| Sodium chloride for molecular biology, DNase, RNase, and protease, none detected, ≥98% (titration) (NaCl) | Sigma Life Science | S3014 | HEPES-buffer ingredient |
| Calcium-HEPES buffer (pH=7.8); effective ingredient below in row 29 | Used for spreading of lipids. Content: 10 mM HEPES, 100 mM NaCl, 4 mM CaCl2 diluted in ultrapure deionized water | ||
| Calcium chloride anhydrous, BioReagent, suitable for insect cell culture, suitable for plant cell culture, ≥96.0% (CaCl2) | Sigma Life Science | C5670 | To prepare Calcium-HEPES buffer |
| Chelator-HEPES buffer (pH=7.8); effective ingredient below in row 31 | Used to promote the formation of tubular networks. Content: 10 mM HEPES, 100 mM NaCl, 10 mM EDTA and 7 mM BAPTA diluted in ultrapure deionized water | ||
| 1,2-Bis(2-aminophenoxy)ethane-N,N,N′,N′-tetraacetic acid tetrasodium salt ≥95% (HPLC) (BAPTA-Na4) | Sigma Life Science | 14513 | Chelator-HEPES buffer ingredient |
| Sodium Hydroxide | Sigma | 30620 | Basic solution used to adjust the pH of the buffers |
| pH meter accumet™ AE150 pH | Fisher Scientific | 1544693 | Used to measure the pH of all buffers |
| Glass petri dish | VWR | HECH41042012 | 6 cm, used for making the PDMS sheet |
| Potassium hydroxide ACS reagent, ≥85%, pellets (KOH) | Sigma-Aldrich | 221473 | To make the KOH solution for cleaning glass petri dish for the fabrication of the PDMS sheet |
| Isopropanol prima ren 99.5% | Antibac AS | 600079 | KOH solution ingredient |
| Heating and drying oven - venticell | MMM Medcenter Einrichtungen GmbH | MC000714 | For drying of the glass petri dish after silanization and to cure PDMS |
| Dichlorodimethylsilane ≥99.5% | Sigma-Aldrich | 440272 | Used for silanization of glass petri dish in which PDMS sheet is prepared |
| Vacuum pump | Cole-Parmer | EW-79202-05 | Connected to desiccator |
| Sylgard 184 silicone elastomer curing agent | Dow corning | 24236-10 | Kit to make PDMS solution |
| Sylgard 184 Silicone elastomer base | |||
| Disposable scalpel | Swann-Morton | 11798343 | Used to cut the PDMS |
| Cover slips | Menzel -Gläser | MEZ102460 | 24x60 mm. Used to deposit thin film of Al2O3 |
| Atomic layer deposition system | Beneq | TFS200 (model number) | Atomic Layer deposition system used to deposit thin film of Al2O3 in microscope cover glass |
| Ellipsometer | J.A. Woollan Co. | Alpha-SE (model name) | System used to charcaterize the thickness of the film deposited on glass surface |
| Laser scanning confocal microscope | Leica Microsystems | Leica TCS SP8 X | Microscope used for visualization of the experiment |
| Objective 40x, 1.3 NA | Leica Microsystems | 1550635 | Used for visualization of the experiment |
| White light laser source | Leica Microsystems | Leica TCS SP8 X | For excitation of the membrane fluorophore |
Références
- Chen, S., Novick, P., Ferro-Novick, S. ER structure and function. Current Opinion in Cell Biology. 25 (4), 428-433 (2013).
- Powers, R. E., Wang, S., Liu, T. Y., Rapoport, T. A. Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature. 543 (7644), 257-260 (2017).
- Pendin, D., McNew, J. A., Daga, A. Balancing ER dynamics: Shaping, bending, severing, and mending membranes. Current Opinion in Cell Biology. 23 (4), 435-442 (2011).
- Bilal, T., Gözen, I. Formation and dynamics of endoplasmic reticulum-like lipid nanotube networks. Biomaterials Science. 5 (7), 1256-1264 (2017).
- Shibata, Y., et al. Mechanisms determining the morphology of the peripheral ER. Cell. 143 (5), 774-788 (2010).
- Ozcan, L., Tabas, I. Role of endoplasmic reticulum stress in metabolic disease and other disorders. Annual Review of Medicine. 63, 317-328 (2012).
- Yamanaka, T., Nukina, N. ER dynamics and derangement in neurological diseases. Frontiers in Neuroscience. 12, (2018).
- Taalab, Y. M., et al. Mechanisms of disordered neurodegenerative function: Concepts and facts about the different roles of the protein kinase RNA-like endoplasmic reticulum kinase (PERK). Reviews in the Neurosciences. , (2018).
- Shemesh, T., et al. A model for the generation and interconversion of ER morphologies. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 5243-5251 (2014).
- Bouxsein, N. F., Carroll-Portillo, A., Bachand, M., Sasaki, D. Y., Bachand, G. D. A continuous network of lipid nanotubes fabricated from the gliding motility of kinesin powered microtubule filaments. Langmuir. 29 (9), 2992-2999 (2013).
- Sackmann, E. Endoplasmatic reticulum shaping by generic mechanisms and protein-induced spontaneous curvature. Advances in Colloid and Interface Science. 208, 153-160 (2014).
- Jesorka, A., et al. Generation of phospholipid vesicle-nanotube networks and transport of molecules therein. Nature Protocols. 6, 791 (2011).
- Hook, D. A., Olhausen, J. A., Krim, J., Dugger, M. T. Evaluation of Oxygen Plasma and UV Ozone Methods for Cleaning of Occluded Areas in MEMS Devices. Journal of Microelectromechanical Systems. 19 (6), 1292-1298 (2010).
- Gözen, I., et al. Fractal avalanche ruptures in biological membranes. Nature Materials. 9 (11), 908-912 (2010).
- Lobovkina, T., Dommersnes, P., Joanny, J. -. F., Hurtig, J., Orwar, O. Zipper Dynamics of Surfactant Nanotube Y Junctions. Phys Rev Lett. 97, (2006).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews Molecular Cell Biology. 9 (2), 112-124 (2008).
- Gözen, I., et al. Repair of large area pores in supported double bilayers. Soft Matter. 9 (10), 2787-2792 (2013).
- Gözen, I., et al. Thermal migration of molecular lipid films as a contactless fabrication strategy for lipid nanotube networks. Lab on a Chip. 13 (19), 3822-3826 (2013).
- Sides, P. J., Hoggard, J. D. Measurement of the Zeta Potential of Planar Solid Surfaces by Means of a Rotating Disk. Langmuir. 20 (26), 11493-11498 (2004).
- Nissen, J., Jacobs, K., Rädler, J. O. Interface Dynamics of Lipid Membrane Spreading on Solid Surfaces. Physical Review Letters. 86 (9), 1904-1907 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon