Method Article
자발적인 형성 및 바인딩과 그물에 대 한 상향식 모델로 인공 지질 나노튜브 네트워크의 재배치
요약
솔리드-지원, 단백질-무료, 이중 인지질 bilayer 막 (DLBM) 복잡 하 고 동적 지질 나노튜브 네트워크로 변형 될 수 있다 고 바인딩과 그물의 2D 상향식 모델로 사용할 수 있습니다.
초록
우리는 편리한 메서드 바인딩과 그물 (ER)에 대 한 상향식 구조 세포 기관이 모델을 제시. 모델은 고집적 lipidic 나노튜브의 구성, 형태와 역동성, 응급실의 연상. 네트워크는 인지질 이중 bilayer 막 패치 준수 하는 투명 한 알2O3 기판에서에서 파생 됩니다. 접착은 캘리포니아2 + 주변 버퍼에 의해 중재 됩니다. BAPTA/EDTA에 의하여 캘리포니아2 + 의 후속 고갈 자연 지질 나노튜브 네트워크 형성에 따른 막의 철회를 하면 됩니다. 메서드는만 인지질 및 ER 모델의 간단한 형성 ﹙ 표면 구성 하 고 단백질 또는예를 들어, GTP (ATP) 화학 에너지의 추가 요구 하지 않습니다. 세포질 바인딩과 그물의 3D 형태, 달리 모델은 2 차원 (이기는 하지만 나노튜브 치수, 형상, 구조, 및 역학 유지 됩니다). 이 독특한 생체 외에서 ER 모델만 몇 가지 구성 요소로 구성 되어, 쉽게 생성, 그리고 가벼운 현미경 관찰 될 수 있다. 결과 구조 응급실 관련 단백질 또는 튜브 중 교통 현상을 공부 하는 입자의 추가 등의 추가 기능에 대 한 추가 장식 하실 수 있습니다. 여기에 설명 된 인공 네트워크는 응급실, 그 독특한 특성 형태학 보였다 그것의 생물학 기능에 관련 된 반면 관 도메인의 형성에 관한 내용을 휴대에 적합 한 구조 모델 및 내에서 재배열 아직 완전히 이해 된다. 우리는이 방법은 Al2O3 얇은 필름 코팅 현미경 coverslips, 상업적으로 사용할 수 있지만 특별 한 주문 필요 사용 주의. 따라서, 그것이 준비를 위한 제작 시설에 대 한 액세스 권한이 좋습니다.
서문
ER는 단백질 폴딩, 지질 합성, 그리고 칼슘 규정1,2를 포함 하 여 생물 세포에 중요 한 작업을 수행 합니다. ER 형태학은 그것을 수행 하는 기능을 내장. 그것은 결합 평면 스택 및 조밀한 동적 관 도메인을 지속적으로 골격과 상호 작용 하 고 지속적인 운동 및 재배치를 받 다. 일부 응급실 구조 받을 리 모델링의 평면 시트 튜브, 소포 형성에서 또는 응급실 루멘, 기존의 튜브, 튜브 철회, 퓨전, 그리고 파손3의 신장에 퓨전 사이 연속 변환을 포함 합니다. 관 네트워크의 독특한 구조는 정력적으로 호의 베푸는. 경로 및 메커니즘은 응급실 생성 하 고이 조직 뿐만이 그것의 기능에 관한 방법 이다 유지 하지 아직 완전히4,5이해.
응급실 오작동 항상성 상태로 잃을 때 ER 스트레스, 단백질 합성, misfolded 단백질의 축적의 증가 또는 캘리포니아2 + 그리고 산화 균형의 변화에 의해 발생 하는 조건에서에서 결과로 알려져 있다. 어 스트레스 차례로 하면 변형, 세포 기관이의 자연 형태의 구체적으로 방해 하는 네트워크 조직6,7. 응답으로, 셀 항상성 상태로 돌아가려면 복구 메커니즘을 활성화 합니다. 복구에 실패 응급실 유도 세포 apoptosis,7알 츠 하이 머 병, 2 형 당뇨병, 파 킨 슨 병, 루 경화 증, 그리고 여러 다른 등 여러 대사 및 퇴행 성 질환에 기여, 이어질 수 있습니다. 8. 현재 연구 대상 관 ER 네트워크의 조직 그리고 여러 연구2 체 외에서응급실을 재구성에 초점을 맞추고 있습니다. 몇 가지 기존 모델2,,910 단백질을 시작 하 고 고 막 곡률3,11 을 유지 하 고 세포 기관이 그것의 모양에 도달 도움이 필요. 명확 하 게, 응급실의 주요 구조 및 조직 기능 중 일부를 거울 및 고급 실험 연구에 대 한 액세스를 제공 하는 모델 시스템은 큰 수요에 있다.
우리는 현재 여기는 ER 모델 에너지 무료, 동적 생체 외에서 손쉬운, 단백질/화학의 준비에 대 한 절차 응급실 형태학 및 관련된 기능4를 공부 하는 기본 플랫폼을 제공 하. 이 방법에서는 ER 모델은 상향식 접근을 사용 하는 추가 복잡성을 관심의 분자 통합 수 있습니다만 몇 가지 요소를 사용 하 여 조작. 네트워크는 ER 구조와 역동성을 나타냅니다. 또한, 평면 막과 튜브 사이 가역 변환, 튜브, 튜브 퓨전, 슬라이딩 및 철회에서 소포 형성 모두 관찰할 수 있습니다. 불완전 하 게 이해 셀룰러 응급실에 대 한 상향식 모델로 봉사, 이외에 지질으로이 프로토콜에서 설명 하는 나노튜브 네트워크 연구원 nanofluidics, 단일 분자와 콜 로이드 자기 조립, 공부에 대 한 적용 가능할 수 있다 전송 현상, 연수 흐름, 및 기타 관련 분야. 단 분자 빌딩 블록 우리의 방법에 사용 되는 인지질입니다. 프로토콜 작은 실험실 작업 및 기본 장비 이며의 추가 요소에 액세스할 수 있습니다.
프로토콜
1입니다. 인지질 기 현 탁 액의 준비
참고: 모든 자료에 대 한 언급으로 "깨끗 한"이이 프로토콜에서 철저 하 게 소 프로 파 놀 뒤에 이온된 수로 그들을 씻어과 질소로 그들을 타격 건조. 일반적으로 고체 기판에 지원된 지질 영화에 대 한 준비 프로토콜에 적용 되는 강력한 산화 제 산 성 (피 솔루션)와 함께 유리 기판의 치료 Al2O3에 수행 하지 않도록 주의-코팅 항공사입니다.
- 깨끗 한 10 mL 라운드 하단 또는 거꾸로 배 모양의 유리 플라스 크에 장소: 간장 L-α phosphatidyl 콜린 (PC, 69 %w / w), 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (마약, 30 %w / w), 그리고 지질 활용 fluorophore의 선택 [예를 들어, 텍사스 레드 1, 2- dihexadecanoyl-sn-glycero-3-phosphoethanolamine triethylammonium 소금 (TR-DHPE, 1 %w / w)]에서 클로 프롬. 대 한 지질 10 mg/mL의 최종 농도에 따른 클로 프롬의 300 µ L에서의 µ g 3000의 총 양.
참고: 청소, 유리, 소계 plungers 때 클로 프롬을 포함 하는 화합물을 처리와 함께 가스 꽉 주사기 사용 합니다.
주의: 클로 프롬 독성과 높은 휘발성 이며 항상 관련된 개인 보호 장비와 증기 두건에서 처리 해야 합니다. - 로터리 증발, 45 °의 기울기와 위치에 플라스 크를 연결 하 고 천천히 감소 된 공기 압력을 가진 6 h 23 ° C에서 물 욕조 안에 24 rpm 회전 완전히 제거 하는 클로 프롬. 그것은 20 kPa (150 하루, 80% 진공)에 도달할 때까지 20 kPa 마다 2 분의 단계에 의해 회전을 시작한 후 압력 오른쪽 감소 시작.
참고: 준비 선박에서 균일 한 두께의 균질 성 지질 필름 형성은 rotavap 절차에 대 한 가장 중요 한 요구 사항. 지질 준비는 회전 속도, 급속 한 압력 변화와 최종 압력 값; 따라서, 엄격 하 게 최종 압력 및 회전 속도 뿐만 아니라 느린 감소 단계 따릅니다. 탈수 지질 케이크 플라스 크의 벽에는 영화로 균등 하 게 형성 되도록 45 °의 기울기로 플라스 크를 배치 합니다. 너무 빨리 회전의 소란 하 고 너무 느린 회전의 리드 (때문에 중력) 플라스 크의 바닥에 액체의 두꺼운 층의 축적에 지도 한다. 프로세스는 매우 동 질 지질 붓기 후속 하룻밤 동안 질량 최종 쥡니다 단계에 잘 반응 하지 않는 생산 되며 결과 분수 다른 작곡의. 압력 및 메서드에 지정 된 범위 내의 시간 느린 desolvation을 보장 합니다. 용 매로 서 클로 프롬와 너무 압력에 있는 하락의 급속 한 증가 점도 및 집계 및 고르지 못한 영화 형성의 결과로 혼합물을 아래로 냉각 한다. 6 h의 오랜 기간 재 시 지질 소재에 유기 용 매 파티션으로 가능한 최고의 범위에 용 매를 제거 하려면 것이 좋습니다. - 6 h 후 회전을 중지 하 고 20 kPa 100 kPa에 도달할 때까지 2 분 마다의 단계에 의해 다시, 점차적으로, 공기 압력을 증가. 로터리 증발 기에서 플라스 크를 제거 하 고 PBS의 3 mL 및 글리세롤의 30 µ L 추가. 부드럽게 글 리세 린을 해산 하기 위해 플라스 크를 소용돌이 친다. 지질을 포함 하는 플라스 크를 밀봉 밀폐 유리 스 토퍼를 사용 합니다.
참고:는 글리세롤 지질 영화의 완전 한 탈수를 방지 하는 데 사용 하 고 bilayer 분리12를 수 있습니다. 그것은 화합물의 처리를 용이 하 게 그것의 점성을 감소를 사용 하기 전에가 열 한다. 따뜻하게 글리세롤은 여전히 즉시 PBS 버퍼와 혼합 됩니다. 부드러운 소용돌이 글리세롤 완전히 해산 될 때까지 필요 합니다. - 재에 대 한 숙박 및 지질 영화의 붓기 4 ° C에서 냉장고에 플라스 크를 저장 합니다.
- 다음 날, 유니폼, 약간 탁 한 지질 정지 달성까지 실내 온도 (RT, ~ 21 ° C)와 35 kHz 주파수 초음파 물 목욕으로 지질을 sonicate.
참고: 쥡니다 주위 걸릴 수 있습니다 10-30 s. 장기간된 쥡니다 (~ 1 분) 열을 생산 하 고 소포 형성에 해롭습니다. - 단계 1.1-1.5 수익률 두 유형의 나노미터 구조를 포함 하는 서 스 펜 션: multilamellar 소포 (MLV)와 거 대 한 unilamellar 소포 (우두머리) (그림 1A-1 층).
- 저장용, 지질 정지 30 microcentrifuge 튜브의 총을 사용 하 여 100 µ L aliquots에 분열과-20 ° c.에 냉동 실에 보관
참고: 액체 질소로 냉동 플래시는 없습니다 필요 하 고 저장 하기 전에 사용 되지 않습니다. 프로토콜 여기 일시 중지 될 수 있습니다. 원인은 지질 세포의 용 해 시간 연장에 대 한 지질 정지 4 ℃ 냉장고에서 떠나, 어떤 막 구성을 영향을 줍니다.
2입니다. 기판의 준비
참고: 다음 프로토콜 ISO 14644-1 표준 규격에서 ISO 8로 분류 하는 클린 룸에서 수행 됩니다. 원자 층 증 착 (ALD) 알루미늄2O3 기판 조작 하는 데 사용 됩니다. 지정 된 프로세스 매개 변수는 악기 및 장비의 서로 다른 모델 사이 다를 수 있습니다. 그들은 개발 과정 초기 매개 변수로 사용할 수 있습니다.
- ALD 반응 기의 온도 200 ° c.를 설정
- 나중을 기준 면으로 증 착의 두께 결정 하에 의해 사용 됩니다 ellipsometry 실리콘 웨이퍼와 함께 샘플 챔버에 유리 표면 (예를 들어, 유리 coverslips)를 로드 합니다.
참고: 유리 기판 사용된 아웃-의-더-박스 했다 및 증 착 하기 전에 용 매 청소 했다. 그들은 입자를 제거 하는 질소 가스와 함께 플러시됩니다만 했다. - 400 로드 챔버를 철수 Pa (3 torr) 주요 반응 챔버로 샘플을 전송 하 고 200 철수 아빠
참고: 반응 기의 온도 200 ° C 적절 한 증 착에서 유지 되어야 합니다. 온도 동요 후 샘플 로드는 증 착을 시작 하기 전에 equilibrated 따라서 해야 합니다 약 실 압력을 어떤 선구자 챔버 외부 확산을 피하기 위해 원자로 압력 보다 높은 것으로 설정 됩니다. - 원자 필름을 입금을 시작 합니다. 150 ms 펄스 유통 알루미늄 노출, 1 s 퍼지 그리고 그 후, 1 s 제거 다음 200 ms의 H2O 노출 뒤 1 사이클에 의하여 이루어져 있다.
참고: 실과 반응 기 압력을 포함 한 모든 설정, 주기, 및 제거의 길이 자동 증 착의 정의 된 속도 달성 하기 위해. 이 매개 변수는 장비의 다양 한 모델 중에서 달라질 수 있습니다. 미리 구성 된 조리법 자주 공급 업체 또는 도구 클린 룸에 책임에 의해 준비 하 고 시간 단위 당 예금 된 필름 간격으로 사용자에 게 전달. - 10에 도달 100 사이클 과정을 반복 하는 기판에 Al2O3 의 nm. 사이클의 수는 다른 조리법 또는 장비 마다 다를 수 있는 증 착 속도에 따라 달라 집니다.
- 원자로에서 샘플을 제거 하려면 첫 번째 환기 챔버의 압력이 대기 압력에 도달할 때까지 예제를 제거 합니다.
- RT에 공기가 꽉 컨테이너 사용까지 샘플을 저장 합니다.
참고: 더 이상 청소 사용 하기 전에 것이 좋습니다. 프로토콜 여기 일시 중지 될 수 있습니다.
참고: 샘플 이상적으로 증 착 후 즉시 사용 해야 합니다. 최적의 스토리지 폴 리 프로필 렌 웨이퍼 캐리어, 질소-플러시되어야 진공 씰링 전에 클린 룸 호환 비닐 봉지에 운반대를 뒤 덮 었 다음 내부 표면에 위치 해야 합니다. 목적은 부담 공기 오염 물질에 표면 노출 방지 하는 것입니다. 필요한 경우 5 일에 대 한 표면 최대 RT에 공기가 꽉 용기에 보관 수 있습니다. 더 이상 저장 하지는 것이 좋습니다. 사용자를 하거나 하지 않는, 클린 룸에 쉽게 액세스할 및 구매 해외에서 서피스를 얻기 위해, 다시는 기판 산소 플라즈마 또는 오존 처리에 의해 산화 하는 것은 대안 솔루션13있을 수 있습니다.
3. 분자 인지질 영화 관 네트워크의 변화
- 지질 정지를 해 동 하 고 깨끗 한 유리 현미경 슬라이드/coverslip에 서 스 펜 션의 4 µ L 작은 물방울 전송.
- 20 분에 대 한 방울만 드롭릿에 지질 평면 원형 필름으로 건조, 후 눈에 보이지는 붕괴 됩니다.
- HEPES 버퍼의 1 mL와 함께 지질 영화 rehydrate ( 재료의 표참조) 3 분.
참고: rehydration 버퍼의 볼륨 이후에 관찰 실로 전송 소포 정지 (소포 단위 부피 당 수)의 밀도를 영향을 줍니다. 관측 실과 원하는 기 밀도의 볼륨에 따라 재 볼륨은 0.5-1에 조정 될 수 있다 mL. 깨끗 한 붕 슬라이드 최대 몇 백 microliters의 방울을 지원 해 경향이 문제 없이 1.5 mL. 이후는 coverslip 이동할 필요는 없습니다,이 기술적인 문제에 연결 되지 않습니다. 수-8 폴리머-코팅 슬라이드, 같은 더 소수 성 표면에도 1.5 mL 입금된12될 수 있습니다.
참고: 지질 수 갓 준비 한다, RT에서 20 분 이상 rehydrated 지질 영화 노출 버퍼의 증발 및 이전 rehydrated 소포, 제대로 하는 리드 정의 구성의 부분 탈수를 리드. - 관측 실 준비: 버퍼 교환 하는 데 필요한 응급실 변환 시작, 자동 피 펫을 사용 하 여 허용 하는 오픈 탑으로 관찰 챔버를 사용 되었다. 입니다 (PDMS) 프레임 크기 1.5 x 1.5 x 0.5 c m, 알루미늄2O3 입금 coverslip에 준수와 함께이 약 실에 의하여 이루어져 있다. 탑재 된 관측 챔버의 구조는 그림 1G에 표시 됩니다. 다음 단계는 PDMS 프레임을 조작 하 여 관찰 챔버 조립 수행 했다:
- 100 mL의 얼음 목욕에서 비 커에 소 프로 파 놀과 코의 100 g을 혼합 하 여 코 솔루션을 준비 합니다. 10 h 이상는 코 자력과 자기 저 어 접시를 사용 하 여 완전히 해산 될 때까지 저 어.
주의: 코 솔루션 부식성 이며 피부 화상, 그래서 항상 적절 한 개인 보호 장비와 처리 발생할 수 있습니다.
참고: 소 프로 파 놀 코의 용 해도 물으로 높은. 해산 발열 이다입니다. 연속 교 반 용 해 전에 코 펠 릿을 분쇄 하는 것이 좋습니다. - 잠수함 유리 페 트리 접시 (d = 6 m) RT와 계속 코 솔루션에 하룻밤.
- 다음 날, 솔루션에서 유리 접시를 제거, 5 분에 대 한 이온된 수와 컨테이너에 담가, 물으로 여러 번 씻어 그리고 안으로 배치 건조 오븐 1 h. 타격 80 ° C에서 그 부분을 보장 하기 위해 질소의 흐름과 함께 짧게 표면 icles 제거 됩니다.
- 표면 passivate 및 PDMS 결합 방지, 가중치 보트 같은 깨끗 한 플라스틱 용기에 사용 플라스틱 주사기와 dimethyldichlorosilane의 200 µ L을 전송.
- 1 시간에 대 한 실 란과 페 트리 접시 유리는 대피 desiccator (낮은 진공, ~ 20 kPa)에 저장 합니다.
주의: Dimethyldichlorosilane 독성 이며 항상 관련된 개인 보호 장비와 증기 두건에서 처리 해야 합니다. - 사라지고 나머지 dimethyldichlorosilane 증기에서 페 트리 접시를 수집 하기 전에 15 분 기다립니다. 페 트리 접시는 지금 silanized, 그리고 표면 소수 이다.
참고:이 단계의 성공 테스트 하는 빠른 방법은 silanized 페 트리 접시에 물방울을 배치 하는. 표면과 물방울의 접촉 각은 눈에 띄게 치료 유리에 비해 증가 해야 한다. - 250 mL 플라스틱 용기 (투명 플라스틱 컵 패키지에서 신선한), 실리콘 탄성 중합체 경화제 (10:1)의 1 g 10 g 기본 실리콘 탄성 중합체의 혼합. 플라스틱 교 반기/플라스틱 주걱을 사용 하 여 5 분 동안 저 어.
참고: 기포 교 반, 따라 형성 되 고 있는 PDMS 창백한 흰색을 볼 것 이다. - 모든 확장 공기 거품 붕괴 때까지 < 20 kPa에 드 혼합물만 (높은 진공 가속 과정). Silanized 페 트리 접시에 degassed 혼합물을 부 어.
- 65 ° c 오븐에서 2 시간에 대 한 치료.
참고: 그것은 > 95 ° c 온도 증가 시켜 경화 속도 두 배로 증가 경화 온도 재료의 강성 증가 발생합니다. - Rt 치료 PDMS 가득 페 트리 접시 아래로 냉각 하 고 주걱으로 PDMS 슬 래 브를 제거.
- 메스, 잘라 프레임 크기 및 형상으로 현미경 단계에서 사용 가능한 개방에 대 한 적절 한. 1.5 (길이) x 1.5 x 0.5 (높이) cm (폭)의 크기는 대부분의 설정에 적합 합니다.
- 부드러운 측면 (페 트리 접시 접촉 했다 밑바닥 측)를가지고 PDMS의 표면의 적극적인 측면에 접촉으로 Al2O3 영화 있는 프레임과 부드럽게 프레임을 밀어 하 고 서로 대 한 표면에 압력을 적용 하 게 준수.
참고: PDMS 구조 및 Al2O3 기판 사이의 접착은 약 합니다. 연락처 인터페이스에서 공기 방울의 존재는 드 첨부 파일 및, 따라서, 버퍼 및 관련된 내용을 누설 될 수 있습니다. PDMS 프레임 사용 그것은 소 프로 파 놀, 씻어 서 다음에 디 물으로 헹 구 고 질소로 타격은-건조 직후 고 각 하기 전에 여러 번 사용할 수 있습니다. Silanized 페 트리 접시 또한 다시 사용할 수 있습니다.
- 100 mL의 얼음 목욕에서 비 커에 소 프로 파 놀과 코의 100 g을 혼합 하 여 코 솔루션을 준비 합니다. 10 h 이상는 코 자력과 자기 저 어 접시를 사용 하 여 완전히 해산 될 때까지 저 어.
- 캘리포니아2 +-HEPES 버퍼에 채워 관찰 챔버 ( 재료의 표참조).
참고: 표면 즉시 패키지를 개봉한 후 사용 해야 합니다. 공기 접촉 표면 활동을 점차적으로 감소 하는 오염 물질의 흡착 이끌어 낸다. 챔버 조립 후 즉시 버퍼 가득 해야 합니다. 후속 단계에서 rehydrated 지질의 추가 수 있도록 전체 챔버 볼륨을 채우지 않습니다. - Confocal 현미경 스테이지에 챔버를 놓습니다. 전송 rehydrated 지질 소재, 플라스틱 피 펫 파스퇴르 (그림 1A-1 G) 상공에 거 대 한 소포를 포함 하는 정지 지금.
- 기판에 준수 하 고 (그림 1H 1J) 표면에 걸쳐 확산 소포를 10-20 분을 기다립니다.
참고: 퍼지기의 표면에 지질 증 착 후 즉시 시작 됩니다. 확산의 속도 수 있습니다 약간 따라 지질 구성, Al2O3 증 착 기술 (ADL, RF 스퍼터 링, 화학 기상 증 착, 등.), 고 기판, divalent 양이온 농도의 신선도 버퍼입니다. 14패치는 확산의 파열 하기 전에 버퍼 exchange 수행 됩니다 확인 합니다. - 관찰 후 여러 지질 스프레드, 천천히 제거 자동 피 펫을 통해 주변 버퍼 같은 얇은 버퍼 영화 바닥에 남아 있다.
참고: 버퍼의 급속 한 제거 perturbs 표면에 지질 구조. - 천천히 chelator HEPES 버퍼 관찰 챔버를 작성 하 여 주변 버퍼 교환 진행 ( 재료의 표참조)는 자동 피 펫 (그림 1K)를 사용 하 여.
참고: 버퍼의 갑작스러운 추가 perturbs 표면에 지질 구조. - 이 마지막 단계는 chelator 유도 depinning 고 철회 MLV4 (그림 1L-1 년)에 DLBM의 결과로 형성 된 동적 nanotubular 네트워크를 생성 합니다.
4. 현미경 관찰
- 595에서 텍사스 레드 DHPE 자극 화이트 라이트 레이저 소스는 거꾸로 레이저 confocal 현미경 400 Hz. 고용의 스캐닝 주파수와 오일 (1.3 없음) 침수 목표 X 40을 사용 하 여 스캔 이미지를 취득 nm. 700 605에서 방출 수집 nm 하이브리드 광자 검출기를 사용 하 여.
참고: 또는, 피 형광 현미경 사용할 수 있습니다 이미징. 사용할 수 있는 가벼운 소스에 따라 적절 한 지질 염색 공액을 선택 합니다.
결과
프로토콜의 1 단계에서 얻은 고 실험에서 사용 되는 지질 정지 포함 소포의 두 가지 주요 유형: MLVs 및 GUVs. 그림 1 A-1 층 레이저의 3 차원에서 건설 초기 샘플에 소포 confocal 현미경 검사를 보여 줍니다. 그림 1 A-1_C xyz, xz, yz 평면에 각각 MLV (지질 예금) 보여줍니다. 그림 1 D-1 층 거 대 한 unilamellar 소포 (우두머리)의 비슷한 플레이 보여줍니다. Multilamellarity 부족, GUVs의 내부 부분은 빈; 따라서, 확산을 위한 지질 자료 크게 제한 됩니다. 따라서,이 방법만 유용한 지질 저수지는 MLVs.
지질 정지 캘리포니아2 +-HEPES 버퍼 (그림 1G)을 포함 하는 관찰 실로 전송 될 때 MLVs (그림 1A-1_C) Al2O3 표면에 정착을 시작 합니다. 접촉, 시는 소포 표면에 고착 하 고 원형 평면 이중 지질 bilayer 막 (DLBM) 고체 지원 (그림 1H 1J)에 각 MLV에서 확산 하기 시작 합니다. MLV 지속적으로 확장 하는 DLBM에 대 한 지질을 제공 하는 저수지 역할을 합니다. 단단한 지원에 관하여 원심 (상단) bilayer 막, (그림 1나) 롤링 모션을 수행 원형 모서리의 둘레를 따라 근 위 (아래) bilayer 막에 연결 되어 있습니다. 두 bilayers 위치 단호하게 서로,만 데 액체 박막 그들 사이 캡슐화 합니다. 확산, 동안 근 막 지속적으로 준수, 아래 지원 표면에 동안 원심 막 확장 근 막 가장자리 가장자리에 옆으로 당 겼 다. DLBM의 확산 캘리포니아2 +, 근 막에서 지질 머리 그룹 및 고체 기질4사이 fusogenic 에이전트의 역할에 의해 중재 됩니다.
장기간 동안 계속 확산, 막 긴장 증가, (그림 2A 와 2B) 파열으로 이어지는. 그 시점, 후 막 철회, 응급실 관 형태를 만드는 데 필요한는 유도 이상 수 있다. 따라서, 그것은 파열된 막 인식 하는 것이 중요입니다. 우리의 실험에 지질 붙일 셔 서, 이후는 파열 관찰할 수 있습니다 직접. 파열의 주요 지표는 (그림 2A 와 2B) 파열된 지역14에서 형광 강도에 상당한 드롭. 파열은 증가 긴장 및 말 초 막에서 후속 기 공 형성의 결과 이다. 형광 현미경 파열된 지역 따라서 절반 방출 (단일 인접 bilayer)의 강도 unruptured 지역 (더블 bilayer)14 (그림 2B)을 전시할 것 이다. 기 공 형성 동안 처음 파열된 지역에 위치한, 막 소재, 확산 패치의 가장자리를 마이그레이션합니다. 차례로 전체 패치 영역의 성장을 발생합니다. 따라서, 원형 패치의 윤곽선의 급속 한 확장 파열 하는 동안 또한 관찰할 수 있습니다.
원형 패치 지역에 100-200 µ m를 도달 하는 후에 즉시 패치, 파열으로 이어지는 광범위 한 성장을 피하기 위해, 캘리포니아2 +-HEPES 버퍼 박막 표면에 액체 유지까지 자동 피 펫으로 부드럽게 제거 됩니다. Chelator HEPES 버퍼는 부드럽게 시작 철회 (그림 1K)를 챔버에 추가 됩니다. (그림 2C) 샘플의 완전 한 탈수 또는 버퍼 (그림 2D 와 2E)의 신속한 교환 소요, 파열, 또는 패치 변형 발생 합니다. Chelators의 추가 점차적으로 제거 합니다 Ca2 + 표면 막 사이 공간에서. Chelator HEPES 버퍼 점차적으로 지질 막 패치의 주변에서 시작 하는 남북 bilayer 기판 공간에 액세스 합니다. 따라서, 고정 사이트 제거 원형 패치의 가장자리에서 시작 하 고 안쪽으로 전파 (그림 1K-1 분기). Depinning, 결과로 지질 막 분리 하 고 중심에 MLV 향해 진행 가장자리 안쪽에서 철회 하기 시작 합니다. 철회 과정 lipidic 관 네트워크4 (그림 1L-1 년)을 동적으로 개발의 새로운 인터페이스를 이끌어 낸다. 막 완전 하 게 분리를 허용 하지 않는, 고정, 영구 지역 선도 표면 및 핵 집계에 남아 나노튜브의 긴 분기 네트워크. (그림 1L-1 년). 연속 드 고정 및 추가 지질 나노튜브의 철회 점진적 chelation 과정 결과로 시간이 지남에 따라 관찰 된다. 이 coarsening 및 네트워크의 재배치 매끄러운 ER을 닮는 관 네트워크의 동적 행동에 주요 역할을 하고있다.
그림 1 L-1 년 보여줍니다 프로토콜에서 얻은 나노튜브 네트워크의 현미경 사진. 그림 1 L 은 그림 1M 에 지역의 근접 흰색 프레임에 표시 합니다. 그림 1L 와 1m 에서 연속 밝은 빨간색 영역 ( 그림 1M에 파란색 파선으로 표시 되는) DLBM의 retracting 분수입니다. 그림 1N 에 1O 관 네트워크의 현미경 사진 대비 증가 반전 이다. 그림 1 P 와 1 분기 3 h 20 분에 걸쳐 막 지역에 관 밀도의 감소를 보여 줍니다. 관 밀도의 감소 때문에 점진적 depinning는 실험 기간 동안 표면에서 철회 된 DLBM의 다음 발생 합니다. 이상 시간 증가, 재배열 및 튜브 (그림 1P 와 1 분기)에 의해 보호 지역의 감소를 고정에서 해방 하는 점의 수입니다. 관 재배열 두 고정된 지점 사이의 일시 중지는 지질 나노튜브의 표면 자유 에너지 최소화에 의해 좌우 됩니다. 그것은 확고 한 나노튜브의 표면 에너지를 최소화 하는 가장 효율적인 방법을15그것의 길이 줄이기 위해 하는 것입니다. 따라서, 표면에는 나노튜브를 처음 잡아 fusogenic 지역, 인 드 고정는 나노튜브 슬라이드 하 고 배열 한다을 자발적으로, 최소 길이 채택. 이 재배열 발생 (그림 1P 와 1 분기) 나노튜브에 의해 표면의 점차적으로 감소 된 범위.
우리는 시각화 수 없습니다 캘리포니아2 +-고정 포인트, 중재 하지만 우리 튜브 터미널 또는 날카로운 회전에 있는 지점으로 그들의 위치를 설정. 날카로운 회전 이라고 하 V-접속점15 또는 터 닝 포인트 튜브의 정렬 (녹색 화살표 그림 1R 에 1 X)의 방향으로 갑자기 변화 때문에. 끝점 튜브, 튜브 (주황색 화살표 그림 1X)을 제거 하지 못하도록의 종점을 나타냅니다. 개편, "Y-교차점" 또는 "3 방향 접합"로 식별 하는 튜브의 정력적으로 호의 베푸는 처리 하는 동안 나타납니다. Y 접점 각 관, 가장 짧은 총 관 길이 보안 할 수 있습니다 사이 약 120 ° 각도와 3 개의 튜브를 연결 합니다. 끝점을 소유 하지 않는, 대신 여러 나노튜브 사이 위치는 Y-접합, 고정 하지는. (파란색 화살표, 그림 1R) 슬라이딩 수행할 수 있는 유일한 Y 접점 유형입니다. 그림 1R 1에 같이 두 명의 개별 Y 접속점 (파란색 화살표 그림 1S)의 형성에 매우 불안정 교차로 결과 따라 Y 접합의 슬라이딩. 그림 1S 에 겹쳐 흰색 점선 그림 1R관 네트워크 조각의 윤곽을 나타냅니다. Y-접합의 일부는 시간이 지남에, 결국 철회 (그림 1U) 끝 단자를 (노란색 화살표 그림 1T) 소유한 다. 하나의 V 접점의 변화, 직선 튜브 두 선 세그먼트의 교차점의 depinning 및 V 모양을 형성 하는 튜브의 철회는 그림 1V 및 1W 및 에서 관찰 될 수 있다 그림 1X 와 1 년, 각각.
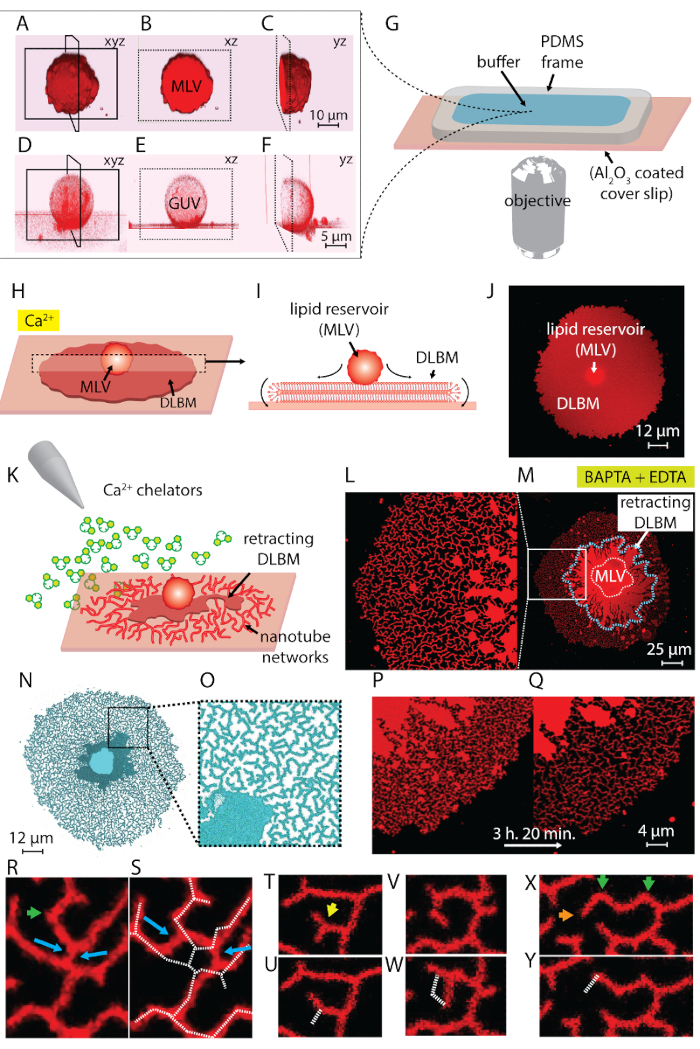
그림 1 : ER 같은 관 네트워크에 변화의 지질 예금. (A-F) 레이저 3d에서 건설 초기 샘플에 소포의 confocal 현미경 검사. (A-C) Xyz, xz, yz multilamellar 지질 소포 (MLV, 지질 예금) 비행기, 각각. (D-F) 거 대 한 unilamellar 소포 (우두머리)의 유사한 전망. GUVs의 내부 부분은 크게 제한 확산을 위한 지질 자료 게 빈, 이다. 이 방법에 대 한 유용한 지질 저수지는 그러므로 MLVs. (G)는 버퍼와 지질 예금는 거꾸로 한 현미경에 장착 된 관찰 챔버의 그림. 챔버는 PDMS의 구성 프레임 오픈 볼륨 탑을 제공 하는 알2O3 코팅 coverslip에 준수. (H-J) 캘리포니아2 +존재 MLV의 확산 현상의 그림. (H) 알루미늄2O3와 접촉, 시는 MLV 저절로 원형, 이중 지질 bilayer 막 (DLBM)의 형태로 확산. (I)는 peripheries 롤링 모션을 수행할 xz 평면에 DLBM의 도식 측면 보기. MLV (d = 5 ~ 15 μ m) 및 DLBM (두께 = 10 nm) 하지 그려집니다 규모. (탑 뷰에서 확산 DLBM의 현미경 J)는 confocal 사진 (K)는 버퍼 1 포함 캘리포니아2 + 킬레이트 화 대리인, 확산 억제, MLV에 있는 DLBM의 철회를 일으키는 및 지질 나노튜브의 형성으로 이어지는 교환 되이 프로토콜의 주요 단계를 설명 합니다. (L-Y) 설명 된 방법으로 얻은 나노튜브 네트워크의 현미경 사진. (L) (M)에 지역의 근접 한 프레임에 표시 됩니다. (L과 M)에서 연속 밝은 빨간색 영역 DLBM을 (또한 M에 파란색 파선으로 표시)을 나타냅니다. (N과 O) 관 네트워크의 현미경 사진 대비 증가 반전 이다. (P와 Q) 3 h와 20 분 (R-Y) 대표 관 재 준비의 과정을 통해 막 지역에 관 밀도의 감소 묘사 (R, S) 슬라이딩, (T 그리고 U) 전환점의 한 끝점, 그리고 (V와 W) 드 고정의 철회에 의해 V 접점을 Y 접합의 전환, V 접점의 박멸에 결과. (X 및 Y) 한 끝점의 철회입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
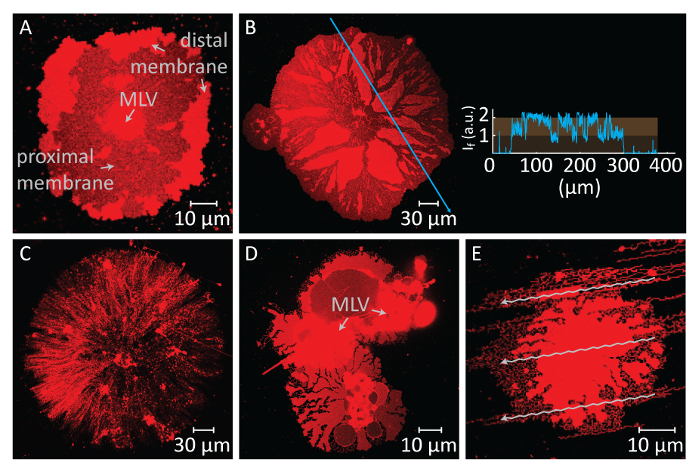
그림 2 : 잠재적인 부정적인 결과. (A와 B) 때문에 긴 말 초 막의 파열 버퍼 교환 하기 전에 대기 시간. 어디 근 막 표시 됩니다, 파열된 지역 unruptured 말 초 막 지역에 비해 어두운 영역으로 나타납니다. 패널 B 인세트는 현미경 사진에 파란색 화살표를 따라 빛의 강도 보여줍니다. 막의 파열 영역의 강도 (인접/단일 bilayer 표시 됩니다) unruptured 막 (원심/더블 bilayer)의 절반 강도에 해당. (C) 건조 지질 패치의 모양을 관찰 실에서 모든 액체의 제거 결과로 형성 했다. (D 및 E) 버퍼를 통해 자동 피 펫의 급속 한 교환에 의해 막의 교란 한다. (D)는 MLV는 비 원형, 변형 지질 패치로 이어지는 2 MLVs로 분할 됩니다. (E), (화살표), 흐름의 패턴 chelator HEPES 버퍼의 강한 주입에 의해 만들어진 tubulated 막 구조에 반영 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
다음 토론에서 중요 한 단계, 가능한 수정 및 프로토콜의 제한 사항을 설명 합니다. 첫 번째 중요 한 단계는 Al2O3 표면에 PDMS 프레임의 접착은 본질적으로 약한 관찰 챔버의 적절 한 어셈블리입니다. 어디 프레임 준수 하지 않는 기판에 제대로 하는 경우, 콘텐츠는 관찰 실에서 누출 됩니다 하 고 실험 중단 올 것 이다. 적절 한 방해 하는 주요 요인 1) (재사용된) PDMS 프레임의 철저 한 청소의 부족 이며 2) 가끔 프레임와 기판 사이의 갇힌 얻을 거품 공기 표면와 프레임의 씰링. 새로 준비 나 철저 하 게 청소 PDMS 프레임을 사용 해야 합니다. 프레임 전과 소 프로 파 놀, 디 물으로 rinsing 및 질소로 타격은-건조와 각 사용 후 씻어 서 해야 합니다. Al2O3 표면 필요 하지 않습니다 어떤 사전 청소 이후 클린 룸 환경에서 조립 되며 사용까지 밀폐 용기에 보관. Al2O3의 amphoteric 특성, 그것은 강하게 산 성 또는 기본적인 솔루션에 노출 한다. 관측 실에 대 한 다른 디자인 개별 설정의 접근에 따라 사용할 수 있습니다. 이 챔버의 중요 한 기능 오픈 탑 사용된 솔루션 및 샘플 구조 물자의 inertness에서 액체 샘플 무료 있습니다. 챔버 크기는 또한 중요 한 요인으로 그들은 1 mL에 0.5에서 볼륨을 수용 한다. 사용 하는 표면 일반적으로 표준 크기 coverslips (24 x 60 m m) 이기 때문에, 챔버의 볼륨 프레임의 두께 의해 주로 결정 됩니다. 우리의 지식, 일반적으로이 프로토콜에서 처리 하는 샘플 볼륨을 수용할 수 있는 깊이와 크기 스페이서 상업적으로 사용할 수 있습니다. 우리는 제조의 세부 사항 및 샘플 챔버 프레임의 어셈블리에 따라서 프로토콜에서 섹션을 전담 했다.
이 프로토콜에서 다른 중요 한 단계는 버퍼 교환 이다. 이 단계에서 과제 수행이 교환 하는 데 필요한 타이밍 이다. Al2O3 기판와 접촉 시 MLV의 확산은 즉시, 그리고는 DLBM의 연속 확장 (그림 2A, B) 실험을 종료의 파열, 리드. 따라서, 확산 한다 지속적으로 모니터링, 그리고 버퍼 교환 적시에 수행 해야 합니다. 교환 하지 확산, 막 패치는 최적의 크기 (직경에 있는 100-200 µ m)에 도달 할 수 있도록의 초기화 후 너무 빨리 수행 되어야 한다. 다른 한편으로, 지속적인 접착 표면에 높은 막 긴장 파열에 이르게 발생 합니다. 따라서, 모든 막 패치 결국 파열 경우 확산을 중단 되지 않습니다. 파열의 타이밍 각 패치 이후 거기에 크기와는 MLV의 내부 구조와 지질의 접근에 따라 다릅니다. 따라서, 교류의 순간은 최적의 크기와 유엔 파열 패치 전체 인구의 대다수를 대표 한 timepoint에 배열 되어야 한다. 버퍼 교환 단계에서 또 다른 도전을 제거의 속도 버퍼의 추가 이다. 너무 급속 하 게이 대체를 수행 하는 것은 최종 막 구조 (그림 2C-E)에 해로운 영향. 캘리포니아2 +-HEPES 버퍼의 기판에 박막 액체를 떠나지 않고 과도 한 추출 말리 고 irreversibly 변형 막 패치 (그림 2C)에서 발생 합니다. 적절 한 양의 액체 표면에 유지 하는 경우에 Chelator HEPES 버퍼의 갑작스러운 추가 막 구조의 섭 동을 발생 합니다. 그림 2 D,E hydrodynamically 방해 막 패치의 전형적인 모습을 보여줍니다. 전반적인 형태학 중단 최종 구조 (즉, 나머지 지역에 관 재배열 여전히 발생)의 동적 속성의 영향을 반드시 줄 하지 않습니다. 그러나, 그것은 변형된 구조에 소재 변화를 관찰 하기 어려운 될 것입니다. 예를 들어 그림 2D, 그것은 어려울 것 이다 MLV는 DLBM 버릴 수 있는 쪽으로 방향을 결정 하.
프로토콜의 한 가능한 수정 사용 지질 구성입니다. 주요 초점은 포유류에서 응급실 구성 지배 하 고 효 모16 인지질에 왔다 (e. g., phosphatidylcholine (PC), phosphatidylethanolamine (PE) 및 phosphatidylinositol (PI). 원래 실험 PC와 PI 혼합물4를 사용 하 여 수행 했다. 제시 결과에서 PC와 진한 액체의 혼합물 및 PE의 파생 사용 되었다. 그러나, 모든 임의의 지질 작곡이이 프로토콜을 통해 얻은 관 구조를 만들 발견 되었습니다. 몇 가지 다른 실험적 조사 지질 혼합물 포함 총 심장 추출, 극 지 간장 콩 추출 물, 대장균 추출 북극, 다양 한 비율에서 stearoyl-2-hydroxy-sn-glycero-3-phosphoinositol (Lyso-PI)와 PC의 혼합물 및 혼합물 다양 한 비율에서 PE, PC, Posphatidyl, PI 떠들고 (PS)의 관 막 구조 높은 곡률을가지고 있기 때문에 필요한 개별 지질 분자의 특별 한 배열, 관찰 된 현상 지질 구성 관련은 예상 된다.
다른 수정이이 프로토콜에 적용 되는 표면 제작 방법입니다. 여기, Al2O3 코팅 coverslips를 조작 하는 ALD 사용 되었다. 이 원래 보고 된 증 착 방법, 반응성 스퍼터 링4에서 다릅니다. 이 나타냅니다 다른 표면 제작 방법 ER 같은 tubulation 여전히 발생할 수 있습니다, 한 가지 중요 한 제한 표면 소재의 특이성 나타납니다. 확산의 모드와의 접착 강도 높은 정전기 상호 작용, 습윤, hydrophobicity, 및 표면 거칠기 등의 요인에 영향을 미치는 표면 재료의 특성에 의존 합니다. Al2O3 표면 제공 최적의 접착 강도, 그리고 지질 영화 둘 다에 연결할 수 있는 충분히 강하게 이중 지질 bilayer 막으로 확산 및 캘리포니아2 + 이온의 제거에 따라 양식 관 네트워크를 분리. 우리는 이전 SiO2, multilamellar 소포 이중 지질 bilayer 막으로 확산 하지만 전혀 관 네트워크 형성 chelators17의 추가 따라 관찰 되었다와 같은 실험 테스트. Al2O3 에 드 첨부 파일 및 관 형성 관찰 된다 또는 플라즈마 에칭 알18. 우리의 조사 기여 매개 변수 같은 현상이 이어지는 제타는 공개는 알 한 알2O3 0 (mV) 가까이 했다 표면의 잠재력 및 SiO2 크게 부정적인. 붕 규 산의 zeta 잠재력 SiO219;와 비슷합니다. 따라서, 붕 규 산에 지질 필름의 접착은 동등 하 게 강력 하 고 돌이킬 수 없는. 사실, 붕 규 산 표면 multilamellar 지질 저수지 접촉 즉시 파열 및 단일 지질 bilayers20의 형성에 일반적으로 지도 한다. 이 프로토콜에 필요한 알루미늄2O3 표면 쉽게 또는 상업적으로 사용할 수 있습니다. 그러나 그들은,, 수 특수 유리 기판 제조 업체에서 사용자 지정 정렬. 박막 제조 장비와 클린 룸 시설 매우는 것이 좋습니다.
ER 같은 관 네트워크2,10 조작 하 다른 기존의 상향식 방법 포함 단백질 뿐만 아니라 화학 에너지의 입력 (예., GTP와 ATP). Rapoport와 동료2 인지질와 GTP 응급실에 구 부리는 막 단백질을 혼합 하 여 유리 coverslips에서 시험관에 에 ER 네트워크의 형성을 보도 했다. 작품 Bachand 외. 10 같은 동적 관 네트워크 분자 모터와 ATP 에너지 원으로 사용 하 여 만들 수 있습니다 방법을 보여 줍니다. 이 프로토콜 제시 에너지에 대 한 막 단백질 이나 유기 화합물의 가수분해 필요 하지 않습니다. 꼭 필요한 구성 요소는 고체 기질과는 인지질. 정화 및 단백질의 추출 필요 하지 않습니다. 이 프로토콜을 제공 합니다, 단순 구성 분자의 관점에서 가장 기본적인 ER 모델을.
이 기본, 지질 기반 ER 모델 설립, 응급실 관련 구성 요소를 추가 하 여 복잡도를 건물은 관심, 이후 시스템에서 개별 영향의 조사 수 있습니다. 실제 응급실 네트워크와 마찬가지로, 튜브 모델에서은 동적입니다. 레이블이 지정 된 막 단백질, 또는 관 네트워크를 통해 형광 입자의 마이그레이션 및 활용을 막 운동의 방향에 대 한 정보를 제공할 수 있습니다. 캡슐화 및 변환 및 intratubular 콘텐츠 전송의 가능한 매핑 동안 DLBM 및 튜브 형광 액체의 모니터링 다른 초점으로 봉사 할지도 모른다. 마지막으로, 3 차원 매끄러운 ER 모형으로이 프로토콜에서 발생 하는 2D ER 모델에서 히드로 아키텍처 네트워크의 캡슐화를 통해 채택 될 수 있습니다.
공개
저자는 공개 없다.
감사의 말
원고에 대 한 그의 귀중 한 의견에 감사 스웨덴에서 Chalmers 기술 대학에서에서 교수 알도 Jesorka 하 고. 이 작품에서 노르웨이의 연구 협의회 (Forskningsrådet) 프로젝트 그랜트 274433, UiO 얻은 금융 지원을 통해 가능 하 게 되었다: 생명과학 융합 환경, 스웨덴 연구 위원회 (Vetenskapsrådet) 프로젝트 그랜트 2015-04561, 뿐만 아니라 시작 자금 센터 분자 의학 노르웨이 & 교수의 수학 및 자연과학 오슬로의 대학에 의해 제공.
자료
| Name | Company | Catalog Number | Comments |
| Pear-shape flask 10 mL | Lenz Laborglasinstrumente | 3.0314.13 | In which the lipid mixture is prepared |
| Hamilton 5 mL glass syringe (P/N) | Hamilton | P/N81520 | For transfer of the chloroform to beaker |
| Custom large hub needle Gauge 22 S | Hamilton | 7748-18 | Removable needle for syringe specified in row 3 |
| Hamilton 250 µL glass syringe | Hamilton | 7639-01 | Used for transfer of lipids in chloroform to the flask |
| Large hub Gauge 22 S | Hamilton | 7780-03 | Removable needle for syringe specified in row 5 |
| Hamilton 50 µL glass syringe | Hamilton | 7637-01 | Used for transfer of fluorophore-conjugated lipids to the flask |
| Small hub Gauge 22 S | Hamilton | 7770-01 | Removable needle for syringe specified in row 7 |
| Chloroform anhydrous (≥99%) | Sigma-Aldrich | 288306 | Used to complete the lipid mixture to a total of 300 µL |
| Soy L-α Phosphatidyl choline lipid (Soy PC) | Avanti Polar Lipids Inc | 441601 | phospholipid species contributing to 69% of the total composition/mixture |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE) | Avanti Polar Lipids Inc | 850725 | phospholipid species contributing to 30% of the lipid composition/mixture |
| L-α Phosphatidyl inositol lipid (Soy PI) | Avanti Polar Lipids Inc | 840044 | alterative phospholipid species contributing to 30% of the lipid composition/mixture (from the original article Bilal and Gözen, Biomaterials Science, 2017) |
| Texas Red 1,2-dihexadecanoyl-sn-glycero-3-phosphoethanolamine,triethylammonium salt (Texas Red DHPE) | Invitrogen (Thermo Fisher Scientific) | T1395MP | Fluorescent-lipid conjugate, 1% of the lipid composition/mixture |
| Digital Dry Baths/Block Heaters | Thermo Fischer | 88870006 | To warm glycerol in order to decrease its viscosity |
| Glycerol for molecular biology (≥99%) | Sigma Life Science | G5516 | For lipid preparation |
| PBS buffer (pH=7.8); ingredients below in rows 17-21 | Used to prepare the lipid suspension | ||
| TRIZMA base, primary standard and buffer (≥99%) | Sigma Life Science | T1503 | Used to prepare PBS buffer |
| Potassium phosphate tribasic, reagent grade (≥98%) (K3PO4) | Sigma-Aldrich | P5629 | PBS buffer ingredient |
| Magnesium sulfate heptahydrate, BioUltra (≥99,5%) KT (MgSO47H2O) | Sigma Life Science | 63138 | PBS buffer ingredient |
| Potassium phosphate monobasic, anhydrous, free flowing, Redi-Dri, ACS (KH2PO4) | Sigma-Aldrich | 795488 | PBS buffer ingredient |
| Ethylenediaminetetraacetic acid disodium salt dihydrate ACS reagent, 99.0-101.0% (Na2EDTA) | Sigma-Aldrich | E4884 | PBS and Chelator-HEPES buffer ingredient |
| Ultrasonic cleaner USC-TH | VWR | 142-0084 | Ultrasonication of rehydrated lipids |
| Rotary evaporator - Büchi rotary evaporator Model R-200 | Sigma | Z626797 | For evaporation of chloroform |
| Pressure meter - Vacuum regulator IRV-100 | SMC | IRV10/20 | For controlling the pressure value during lipid dehydration |
| HEPES-buffer (pH=7.8); ingredients below in rows 26-27 | Used for rehydration of lipids. Content: 10 mM HEPES with 100 m NaCl diluted in ultrapure deionized water | ||
| HEPES ≥99.5% (titration) | Sigma Life Science | H3375 | HEPES-buffer ingredient |
| Sodium chloride for molecular biology, DNase, RNase, and protease, none detected, ≥98% (titration) (NaCl) | Sigma Life Science | S3014 | HEPES-buffer ingredient |
| Calcium-HEPES buffer (pH=7.8); effective ingredient below in row 29 | Used for spreading of lipids. Content: 10 mM HEPES, 100 mM NaCl, 4 mM CaCl2 diluted in ultrapure deionized water | ||
| Calcium chloride anhydrous, BioReagent, suitable for insect cell culture, suitable for plant cell culture, ≥96.0% (CaCl2) | Sigma Life Science | C5670 | To prepare Calcium-HEPES buffer |
| Chelator-HEPES buffer (pH=7.8); effective ingredient below in row 31 | Used to promote the formation of tubular networks. Content: 10 mM HEPES, 100 mM NaCl, 10 mM EDTA and 7 mM BAPTA diluted in ultrapure deionized water | ||
| 1,2-Bis(2-aminophenoxy)ethane-N,N,N′,N′-tetraacetic acid tetrasodium salt ≥95% (HPLC) (BAPTA-Na4) | Sigma Life Science | 14513 | Chelator-HEPES buffer ingredient |
| Sodium Hydroxide | Sigma | 30620 | Basic solution used to adjust the pH of the buffers |
| pH meter accumet™ AE150 pH | Fisher Scientific | 1544693 | Used to measure the pH of all buffers |
| Glass petri dish | VWR | HECH41042012 | 6 cm, used for making the PDMS sheet |
| Potassium hydroxide ACS reagent, ≥85%, pellets (KOH) | Sigma-Aldrich | 221473 | To make the KOH solution for cleaning glass petri dish for the fabrication of the PDMS sheet |
| Isopropanol prima ren 99.5% | Antibac AS | 600079 | KOH solution ingredient |
| Heating and drying oven - venticell | MMM Medcenter Einrichtungen GmbH | MC000714 | For drying of the glass petri dish after silanization and to cure PDMS |
| Dichlorodimethylsilane ≥99.5% | Sigma-Aldrich | 440272 | Used for silanization of glass petri dish in which PDMS sheet is prepared |
| Vacuum pump | Cole-Parmer | EW-79202-05 | Connected to desiccator |
| Sylgard 184 silicone elastomer curing agent | Dow corning | 24236-10 | Kit to make PDMS solution |
| Sylgard 184 Silicone elastomer base | |||
| Disposable scalpel | Swann-Morton | 11798343 | Used to cut the PDMS |
| Cover slips | Menzel -Gläser | MEZ102460 | 24x60 mm. Used to deposit thin film of Al2O3 |
| Atomic layer deposition system | Beneq | TFS200 (model number) | Atomic Layer deposition system used to deposit thin film of Al2O3 in microscope cover glass |
| Ellipsometer | J.A. Woollan Co. | Alpha-SE (model name) | System used to charcaterize the thickness of the film deposited on glass surface |
| Laser scanning confocal microscope | Leica Microsystems | Leica TCS SP8 X | Microscope used for visualization of the experiment |
| Objective 40x, 1.3 NA | Leica Microsystems | 1550635 | Used for visualization of the experiment |
| White light laser source | Leica Microsystems | Leica TCS SP8 X | For excitation of the membrane fluorophore |
참고문헌
- Chen, S., Novick, P., Ferro-Novick, S. ER structure and function. Current Opinion in Cell Biology. 25 (4), 428-433 (2013).
- Powers, R. E., Wang, S., Liu, T. Y., Rapoport, T. A. Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature. 543 (7644), 257-260 (2017).
- Pendin, D., McNew, J. A., Daga, A. Balancing ER dynamics: Shaping, bending, severing, and mending membranes. Current Opinion in Cell Biology. 23 (4), 435-442 (2011).
- Bilal, T., Gözen, I. Formation and dynamics of endoplasmic reticulum-like lipid nanotube networks. Biomaterials Science. 5 (7), 1256-1264 (2017).
- Shibata, Y., et al. Mechanisms determining the morphology of the peripheral ER. Cell. 143 (5), 774-788 (2010).
- Ozcan, L., Tabas, I. Role of endoplasmic reticulum stress in metabolic disease and other disorders. Annual Review of Medicine. 63, 317-328 (2012).
- Yamanaka, T., Nukina, N. ER dynamics and derangement in neurological diseases. Frontiers in Neuroscience. 12, (2018).
- Taalab, Y. M., et al. Mechanisms of disordered neurodegenerative function: Concepts and facts about the different roles of the protein kinase RNA-like endoplasmic reticulum kinase (PERK). Reviews in the Neurosciences. , (2018).
- Shemesh, T., et al. A model for the generation and interconversion of ER morphologies. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 5243-5251 (2014).
- Bouxsein, N. F., Carroll-Portillo, A., Bachand, M., Sasaki, D. Y., Bachand, G. D. A continuous network of lipid nanotubes fabricated from the gliding motility of kinesin powered microtubule filaments. Langmuir. 29 (9), 2992-2999 (2013).
- Sackmann, E. Endoplasmatic reticulum shaping by generic mechanisms and protein-induced spontaneous curvature. Advances in Colloid and Interface Science. 208, 153-160 (2014).
- Jesorka, A., et al. Generation of phospholipid vesicle-nanotube networks and transport of molecules therein. Nature Protocols. 6, 791 (2011).
- Hook, D. A., Olhausen, J. A., Krim, J., Dugger, M. T. Evaluation of Oxygen Plasma and UV Ozone Methods for Cleaning of Occluded Areas in MEMS Devices. Journal of Microelectromechanical Systems. 19 (6), 1292-1298 (2010).
- Gözen, I., et al. Fractal avalanche ruptures in biological membranes. Nature Materials. 9 (11), 908-912 (2010).
- Lobovkina, T., Dommersnes, P., Joanny, J. -. F., Hurtig, J., Orwar, O. Zipper Dynamics of Surfactant Nanotube Y Junctions. Phys Rev Lett. 97, (2006).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews Molecular Cell Biology. 9 (2), 112-124 (2008).
- Gözen, I., et al. Repair of large area pores in supported double bilayers. Soft Matter. 9 (10), 2787-2792 (2013).
- Gözen, I., et al. Thermal migration of molecular lipid films as a contactless fabrication strategy for lipid nanotube networks. Lab on a Chip. 13 (19), 3822-3826 (2013).
- Sides, P. J., Hoggard, J. D. Measurement of the Zeta Potential of Planar Solid Surfaces by Means of a Rotating Disk. Langmuir. 20 (26), 11493-11498 (2004).
- Nissen, J., Jacobs, K., Rädler, J. O. Interface Dynamics of Lipid Membrane Spreading on Solid Surfaces. Physical Review Letters. 86 (9), 1904-1907 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유