需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
低温微波辅助热液碳化降低柳树燃料排放
摘要
提出了低温微波辅助水热液碳化处理低质量生物量排放前体排放前体流失的方案。该协议包括微波参数和生物产品及工艺水的分析。
摘要
生物质是一种可持续的燃料, 因为其二氧化碳排放在生物质生长中得到了再整合。然而, 生物质中的无机前体对环境和矿渣的形成造成了负面影响。选定的短旋转椰子 (SRC) 柳木灰分含量高 (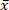 = 1.96)因此, 排放和矿渣前体的含量很高。因此, 研究了低温微波辅助热液碳化 (MAHC) 在150°c、170°c 和185°c 条件下对 SRC 柳树木材矿物的还原。与传统反应器相比, MAHC 的优势是反应介质中的温度电导率均匀, 因为微波穿透了整个反应器的体积。这样可以更好地控制温度和更快的冷却时间。因此, 可以有效地分析一系列的解聚、转化和再聚合反应。通过对经处理和未经处理的 SCR 柳木的质量损失、灰分含量和组成、加热值以及摩尔奥克和 H/c 比的分析, 表明 MAHC 煤的矿物含量降低, 加热值提高。工艺水的 pH 值降低, 含有呋喃和 5-甲基呋喃。170°c 的工艺温度显示出能量输入和灰分还原的最佳组合。MAHC 可以更好地了解热液碳化过程, 而大规模的工业应用是不可能的, 因为投资成本很高。
= 1.96)因此, 排放和矿渣前体的含量很高。因此, 研究了低温微波辅助热液碳化 (MAHC) 在150°c、170°c 和185°c 条件下对 SRC 柳树木材矿物的还原。与传统反应器相比, MAHC 的优势是反应介质中的温度电导率均匀, 因为微波穿透了整个反应器的体积。这样可以更好地控制温度和更快的冷却时间。因此, 可以有效地分析一系列的解聚、转化和再聚合反应。通过对经处理和未经处理的 SCR 柳木的质量损失、灰分含量和组成、加热值以及摩尔奥克和 H/c 比的分析, 表明 MAHC 煤的矿物含量降低, 加热值提高。工艺水的 pH 值降低, 含有呋喃和 5-甲基呋喃。170°c 的工艺温度显示出能量输入和灰分还原的最佳组合。MAHC 可以更好地了解热液碳化过程, 而大规模的工业应用是不可能的, 因为投资成本很高。
引言
将微波应用于热液碳化 (mahc), 用于果糖、葡萄糖1、2或纤维素3等生物质模型化合物的热化学转化, 以及有机底物的热化学转化。最好是废料4,5,6,7,8, 9,10。微波的利用是有利的, 因为它允许处理过的生物量 2,10的均匀加热主要是通过介质溶剂 11,12的热损失, 尽管微波确实如此没有转移足够的能量来直接破坏化学键和诱发反应。微波穿透 HTC 反应堆容器的整个反应体积, 并将能量直接转移到材料上, 这在常规反应器中是不可能的, 因为钢制地幔和钢制地幔的加热能力很高, 加热速度较慢。样品本身14。样品的水分子通过微波进行均匀的激发, 可以改进过程控制, 因为微波反应器中的温度均匀分布 11,14,15, 之后冷却反应要快得多。此外, 传统的反应堆加热速度要慢得多, 加热过程中发生的化学反应可能会影响通常分配给最终温度的结果。经过改进的 MAHC 反应器过程控制使您能够精确地描述选定的 HTC 反应 (例如脱水或脱羧化) 的温度依赖性。在 htc 反应器体积中温度分布均匀的另一个优点是固定化和完全碳化颗粒在内反应器壁2上的附着力较低.然而, 水只是一种平均的微波吸收溶剂, 即使在较高的温度下也能降低微波吸收率, 从而限制了可实现的最高温度。当在 HTC 工艺过程中产生酸或在处理前添加催化剂 (离子或极性物种) 时, 这种负面影响是可以补偿的。微波诱导反应表明, 与砂床催化反应 12相比, 普通11、15和特别是果糖 5-羟基甲基呋喃 (5-hmf) 的产物产率较高.与传统的加热方法 15、16 相比, 它们的能量平衡也要好得多。
水热碳化的基本化学概念是生物质的降解和连续聚合。在这些复杂的相互作用反应过程中, 组织缺氧, 这增加了加热值。首先, 将半纤维素和纤维素聚合物水解为糖单体 17, 但低温主要影响半纤维素18,19,20,21。在 HTC 反应的这一早期阶段, 有机酸是通过糖醛的转化和半纤维素的去乙酰化形成的。这些酸可以是醋酸、乳酸、左旋、丙烯酸或甲酸20、21、22, 它们降低反应器中反应水的 ph 值。由于离解, 它们形成游离负离子, 增加了工艺水中的离子产物。增加的离子产物可以解决阳离子, 而阳离子是生物量中灰分的主要成分。通过这种机制, 组织从排放前体和渣形成者 (如钾、钠、钙、氯和重金属)中耗尽23、24.
形成的有机酸可以支持糖单体脱水到呋喃。一种常见的糖脱水产品是呋喃和 5-羟基甲基呋喃, 这是化工行业可行的产品, 因为它们是平台产品 (例如, 用于生物聚合物的合成)。5-甲基呋喃可通过纤维蛋白25、26或 5-羟基甲基呋喃27的催化反应形成。虽然生物聚合物合成是在受控条件下的人工再聚合, 但呋喃还可以在 MAHC 反应器复杂的化学环境中凝聚、聚合并形成高分子量芳香族结构。溶解性有机和无机化合物与改性木细胞基质的相互作用增加了反应系统的复杂性 20。呋喃聚合反应途径采用了醛缩合或分子间脱水 18,20, 并产生疏水壳和更亲水的核心28的水焦炭颗粒.目前还没有发现生物质颗粒是完全分解后再重新聚合, 还是生物质颗粒作为碳化的模板。然而, 降解和再聚合反应包括脱水和脱羧反应, 以及29,30, 这导致了范克勒伦图下降, 向奥克和 h 比率的黑碳。
而其他研究证明了传统反应堆水热处理31的矿物还原效果, 水洗涤与联合机械浸出32或水乙酰/盐酸洗涤33, 我们的首次研究了微波低温碳化过程中的矿物浸出情况。本研究以排放前驱体浸出用于燃料升级为研究对象, 研究了钾、钠、镁、钙、氯、硫、氮和重金属的命运。在气态温度升高的情况下, 细尘前体形成挥发性盐 (如 kcl 或 k2so-4).当这些盐积累在烟气中时, 锌等重金属可以将其作为成核颗粒清除, 从而导致颗粒生长链反应。在较低的烟气温度下, 盐凝结会进一步触发颗粒生长, 并导致来自烟囱的癌变细粉尘排放。这些排放目前是影响生物质燃料可持续性的主要因素。可持续能源供应依赖于昂贵的过滤器或燃料的减少 (例如, MAHC)。由于本研究采用了一种实用的方法, 选择短旋转椰子 (SRC) 柳木作为潜在的生物能源原料, 具有较高的生长率。它可以由农民在他们的田地上种植, 通过气化实现自我可持续的电力供应, 但也可以通过直接燃烧产生热量。柳树 SRC 的一个缺点是其树皮含量高, 因为它的茎: 树皮比例在成熟阶段较低。与木材34、35、36、37相比, 树皮含有大量矿物质, 产生更多的气体或颗粒排放.低温 HTC 可以改善 SRC 柳树的燃烧性能, 从而促进可持续的热和供电。本研究研究的 HTC 生物气的另一个重要参数是其能量密度、较高的初始燃烧温度和较高的最终燃烧温度39。
研究方案
1. 样品材料的制备
- 收获5岁柳树, 克隆型 "Todes" ([Salix schwerinii x s. Vimalis] x s. vim. x v. x), 高度为12-14 米, 乳房直径约为15厘米。
- 将木材切碎, 在105°c 的窑炉烘干机中擦干芯片, 24小时。
- 用切割机切割木屑, 用离心磨机研磨, 粒径为 0.12 mm。
2. 微波辅助热液碳化
- 使用 850 W 的微波炉和 2, 455 MHz 的磁控管频率。
- 将步骤1.3 中的500毫克原料放入带有铲子的50毫升聚四氟乙烯 (PTFE) 反应容器中。加入10毫升的脱盐水。拧紧反应容器盖, 使瓶盖中的压力阀与封盖边缘处于同一水平。
- 对于每个处理温度, 将12个反应容器与原料放在微波炉中, 然后关闭烤箱。
- 设置三个温度程序, 与微波为三个温度: 150°c (坡道 + 12.5°c 分钟-1, 保持 60分钟, 峰值功率 50%), 170°c (坡道 + 9.6°c 分钟-1, 保持 60分钟, 峰值功率 80%) 和 185°c (坡道 + 5.3°c 分钟-1, 保持 30分钟, 坡道-1.1°c 最小-1至 150°c, 峰值功率 100%)。启动微波炉, 为每个单一的程序。
- 程序完成后, 取出反应容器, 让它们冷却并重新激活。然后在释放里面的压力后, 在通风柜下打开它们。
- 在每个反应容器中加入35毫升的两次蒸馏水。将每个容器中的溶液以 714 x g 的速度倒在离心机筒和离心机上, 时间为10分钟。
- 工艺用水被排放到另一个管中, 并在-5°c 处冷冻, 用于 pH 值和气相色谱-质谱分析。
- 将离心机缸与剩余的生物球团冻结在-5°c。然后取出生物球团, 在105°c 下干燥 24小时, 称量生物球团, 计算 MAHC 处理引起的体重减轻。
- 重复步骤 2.2-2.8 每个温度四次 (每个温度48个反应容器), 以产生足够的生物细胞 (约22克), 用于后续分析。
3. 灰分含量测定
- 分别称重20个空陶瓷盘。在每个1克样品中加入 (5 x 1 克原料, 每次温度处理 5 x 1 克生物酒)。
注: 由于盘子无法贴上标签, 因此必须为烤箱中的容器的布置制定计划。 - 将打开的陶瓷盘放入马弗炉, 然后关闭炉。
- 为马弗炉编程温度程序 (+ 6°c 最小-1从25°c 到 250°c, 保持 60分钟, + 10°c 最小- 1 到 550°c, 保持 120分钟), 并启动该程序。
- 程序完成后, 让马弗炉冷却至105°c。然后打开熔炉, 取出陶瓷盘。
- 将陶瓷盘放入盛满硅胶干燥剂的萃取器 (材料表) 中。在真空泵的帮助下, 关闭干燥器并进行真空干燥。
- 冷却24小时后取出陶瓷盘。通过减去空陶瓷盘的重量, 称量含灰的陶瓷盘, 计算灰分重量。
- 通过将灰分重量除以原料或生物食品的干量来确定灰分含量。
4. 确定较高和较低的加热值
- 启动热量计的水泵, 打开氧气阀, 向热量计供应99.5% 的氧气。
- 称量1克葡萄糖, 放入一个确定的热值为 46 479 jg 的塑料样品袋中, 将样品袋放入热量计炸弹的燃烧熔炉中。
- 在炸弹底部加入5毫升的二次去离子水, 然后拧紧炸弹。把炸弹放进热量计, 然后关闭热量计。
- 输入样品的重量, 并将设置更改为样品袋方法。启动热量计。
- 测量完成后, 取出炸弹, 将其倒置, 慢慢晃动1分钟。
- 拧下炸弹, 取出5ml 的二次脱盐水, 并将其存放在螺帽容器中, 以便随后进行离子色谱分析。
- 重复步骤 4.2-4.6 三次, 以获得校准标准。
- 重复步骤 4.2-4.6 5次, 每个 MAHC 生物组织 (150°c、170°c、185°C) 和原材料。
- 使用以下公式40 计算较低的加热值:
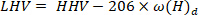
在 LHV 是较低的加热值的地方, HHV 是从步骤4.4 中的热量计中获得的较高的加热值, 是 [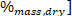 从元素分析中获得的氢含量。
从元素分析中获得的氢含量。
5. 用于氯定量的离子色谱法
注: 分析前, 请检查离子色谱仪的校准。
- 从步骤4.8 中取出5毫升溶液, 在50毫升体积掩模中加入45毫升的二次脱盐水。
- 将样品吸管插入样品容器中, 并将样品中的大约3毫升与注射器放入前柱中。开始分析运行。
- 根据制造商的说明进行测量。
- 对第4节中制备的每个样品重复步骤5.2 和5.3。
6. 测定 o 和 h 比的元素分析
- 从仪器手册中选择合适的方法来测量样品。
- 制作校准设备所需的所有20毫克磺胺标准和空白。
- 要制备材料样品, 请将20毫克的样品放入锡箔的微天平上。在锡箔上称重样品, 关闭样品周围的铝箔, 然后按下包装, 以尽可能少的空气。之后, 每个样本重复此5倍。
注: 为了能够分析生物炭样品, 必须以1:1 的比例添加与样品量相同的三氧化钨。这是必要的, 以补偿缺失的氧气在生物炭, 以确保完全燃烧在元素分析仪。 - 将准备好的样品插入元素分析仪的自动取样器中。
- 打开元素分析仪燃烧室的氧气和氦阀。
- 当设备达到设备指定的温度时, 开始分析。在这种情况下, 请等到温度达到900°c。
- 用磺胺标准重量 (步骤 6.2) 和相应元素的1摩尔的重量计算磺胺标准中每个元素的摩尔。
- 计算从步骤6.7 中获得的磺胺中 C、H、S 和 N 的摩尔与各自的峰面积之间的关系。
- 从步骤3.7 中提取的样品灰分含量, 从样本总重量中减去。
- 比较磺胺标准和样品中各元素的峰值面积, 并将磺胺中每个元素的摩尔相乘, 得到样品中元素的摩尔。
- 通过将从步骤6.10 中获得的元素摩尔与周期表中元素的相应摩尔质量相乘, 计算样品中 c、H、S 和 N 的重量。
- 利用从步骤6.11 中获得的无灰样品质量计算样品中的氧气重量, 并减去从步骤6.11 中获得的 C、H、N 和 S 的重量。
- 计算原料和 MAHC 生物样品中的摩尔 h 和 occ 比。
7. 诱导耦合等离子体光学发射光谱
- 称量400毫克的干原料或 MAHC 生物果油, 并将其放入一个50毫升的 PTFE 反应容器与铲子。加入3毫升的69% 硝酸和9% 的盐酸。
- 拧紧反应容器盖, 使瓶盖中的压力阀与封盖边缘处于同一水平。
- 将样品的反应容器放入微波炉中分析, 然后关闭烤箱。
- 程序的温度程序, 使有机材料完全降解: 坡道 + 15.5°c-1至 200°c, 保持 30分钟, 冷却至 180°c, 保持 5分钟, 启动微波炉。
- 程序完成后, 取出反应容器, 让它们冷却并重新激活。然后在释放里面的压力后, 打开通风柜下的容器。
- 将样品倒进一个50毫升的灯泡缸。然后用两次去离子水彻底冲洗反应容器, 并将其转移到灯泡缸。用两次去离子水将钢瓶加满50毫升标记, 以确保所有样品均匀稀释。
- 用150微米的网格滤纸对步骤7.6 中的样品进行过滤。将滤液填充到50毫升锥形离心管中。
- 将标准样品放入 ICP-OES 的自动喷射器中。标准样品的浓度为 (0.0001 ppm, 0.001 ppm、0.1 ppm、1 ppm 10 ppm、20 ppm、50 ppm) 的元素 (Ca、As、b、be、Fe、se、Zn、ag、al, Ba、bi、Cd、co、Cr、Cu、Ga、Ga、k、Li, Mg, Mn, Mo, Na, Ni, Pb, Rb, Sr, te, Tl, v)。
- 将样品放入 ICP-OES 的自动喷射器中, 并使用相同的参数运行 ICP-OES 分析。
- 在 ICP-OES 分析后, 根据步骤7.8 中标准样品获得的校准曲线, 从软件中获得元素浓度, 以 mg/kg 为单位自动计算。
- 计算所产生的生物气中元素浓度的降低:
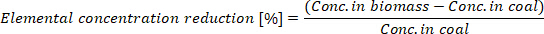
其中生物量中的元素浓度是生物量和生物量中的元素浓度。煤是生物海洋中的元素浓度。
8. 测量 HTC 工艺水的 pH 值
- 在四个不同的烧杯中填充原料的 mahc 处理 (步骤 2.7) 和三个生物油的每个液体组分。
- 用标准溶液校准 pH 探头。
- 测量原料和三个 MAHC 生物材料的液体部分的 pH 值。
9. 气相色谱-质谱联用
- 用150μm 网格滤纸过滤 mahc 处理 (步骤 2.7) 产生的液体组分。在过滤后的液体组分中加入20毫升甲醇。
- 将200μl 转移到 GC-MS 自动采样器小瓶中, 并将小瓶放入 GC-MS 自动采样器中。
- 将呋喃和 5-甲基呋喃 (分析级) 的纯标准稀释为10-2、10-3、10-4 和10-5.
- 将标准放入 GC-MS 自动采样器中, 并对其进行参数分析: 230°c 喷射器温度下的1:40 注入体积和1:40 的分离;5MS 非极性柱 (材料表), 长度为15米, 膜厚度为 0.25 mm;温度方案 30°c, 保持 2分钟, 坡道 + 40°c 至 250°c, 保持 2分钟;在扫描模式下具有 70 mV 和 MS 检测器的电离, m/z 范围为 35-400, 每次扫描时间为0.3秒。
- 根据总离子计数 (TIC) 峰值面积和化合物浓度建立校准曲线。
- 运行具有相同分析参数的 HTC 生物相液相样品, 并通过标准的保留时间和光谱匹配在光谱库中识别呋喃和 5-甲基呋喃。
- 利用计算的校准曲线 (步骤 9.6) 测定呋喃和 5-甲基呋喃的浓度, 并插入呋喃和 5-甲基呋喃的样本峰值区域。
10. 统计
- 用夏皮罗·威尔克斯的正态分布测试来分析数据。
- 使用 Manns-whitney u 型测试处理非正常分布式数据集, 对正常分布式数据集使用 t 型测试, 以发现数据集之间的显著差异。
注: 如果一个数据集通常分布, 而另一个数据集不分布, 请使用 Mann-whttney u 测试。
结果
元素分析的结果显示了柳树木材的 OSE-HCH 比与 MAHC 生物质的比例之间的差异 (图 1)。原料比含量较高, 值变化较大。MAHC 处理减少了微波反应器中均匀化引起的值变化。微波反应器的精度使降解的三个阶段得以分化。在150°c 时降低了 h 比, 降低了 h 和 occ 比的变化。在170°c 下, 奥克比降低, 在185°c 时, 奥克比进一步降低。
讨论
MAHC 允许通过应用不同强度的热处理来区分化学降解的步骤。因此, 可以评估过程水中质量损失、OCE-HCH-HCP 比、加热值、灰分组分还原、ph 值增加和工艺水中呋喃积累之间的相互作用。与传统的 HTC 反应器方法相比, MAHC 方法的优点是通过微波进行热传导, 通过微波穿透整个反应器体积, 在微观上进行热量, 而不是通过宏观层加热反应器体积。不同的温度10。这使得确定了三个不同的?...
披露声明
作者没有什么可透露的。
致谢
作者感谢 Christoph Warth、Michael R威廉姆斯、Carala Lepski、Julian Tejada 和 Rainer Kirchhof 博士的技术支持。这项研究由 BMBF (Bicolim-bio-co-coumbolibles Limpios 项目) 根据赠款编号01DN16036 资助。
材料
| Name | Company | Catalog Number | Comments |
| 5MS non-polar cloumn | Thermo Fisher Scientific,Waltham, USA | TraceGOLD SQC | GCMS |
| 9µm polyvinylalcohol particle column | Methrom AG, Filderstadt, Germany | Metrosep A Supp 4 -250/4.0 | Ion chromatography |
| argon | Westfalen AG, Münster, Germany | UN 1006 | ICP-OES |
| calorimeter | IKA-Werke GmbH & Co.KG, Stauffen, Germany | C6000 | higher and lower heating value |
| centrifuge | Andreas Hettich GmbH & Co.KG, Germany | Rotofix 32 A | |
| centrifuge mill | Retsch Technology GmbH, Haan, Germany | ZM 200 | |
| ceramic dishes | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | XX83.1 | Ash content |
| cutting mill | Fritsch GmbH, Markt Einersheim, Germany | pulverisette 19 | |
| D(+) Glucose | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | X997.1 | higher and lower heating value |
| elemental analyzer | elementar Analysesysteme GmbH, Langenselbold, Germany | varioMACRO cube | elemental analysis |
| exicator | DWK Life Sciences GmbH, Wertheim, Germany | DURAN DN300 | Ash content |
| GC-MS system | Thermo Fisher Scientific,Waltham, USA | Trace 1300 | GCMS |
| hydrochloric acid | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | HN53.3 | ICP-OES |
| ICP OES | Spectro Analytical Instruments GmbH, Kleve, Germany | Spectro Blue-EOP- TI | ICP-OES |
| Ion chromatograph | Methrom GmbH&Co.KG, Filderstadt, Germany | 833 Basic IC plus | Ion chromatography |
| kiln dryer | Schellinger KG, Weingarten, Germany | ||
| kiln dryer | Schellinger KG, Weingarten, Germany | Ash content | |
| mesh filter paper | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | L874.1 | ICP-OES |
| microwave oven | Anton Paar GmbH, Graz, Austria | Multiwave Go | |
| muffel furnance | Carbolite Gero GmbH &Co.KG, Neuhausen, Germany | AAF 1100 | Ash content |
| nitric acid | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | 4989.1 | ICP-OES |
| oxygen | Westfalen AG, Münster, Germany | UN 1072 | higher and lower heating value |
| pH-meter | ylem Analytics Germany Sales GmbH & Co. KG, Weilheim,Germany | pH 3310 | pH |
| sample bag | IKA-Werke GmbH & Co.KG, Stauffen, Germany | C12a | higher and lower heating value |
| Standard Laboratory Vessels and Instruments | |||
| standard samples | Bernd Kraft GmbH, Duisburg, Germany | ICP-OES | |
| sulfonamite | elementar Analysesysteme GmbH, Langenselbold, Germany | SLBS4782 | elemental analysis |
| teflon reaction vessels | Anton Paar, Austria | HVT50 | |
| teflon reaction vessels | Anton Paar, Austria | HVT50 | ICP-OES |
| tin foil | elementar Analysesysteme GmbH, Langenselbold, Germany | S12.01-0032 | elemental analysis |
| tungstenVIoxide | elementar Analysesysteme GmbH, Langenselbold, Germany | 11.02-0024 | elemental analysis |
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | ||
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | higher and lower heating value | |
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | ICP-OES |
参考文献
- Li, C., Zhao, Z. K., Cai, H., Wang, A., Zhang, T. Microwave-promoted conversion of concentrated fructose into 5-hydroxymethylfurfural in ionic liquids in the absence of catalysts. Biomass and Bioenergy. 35 (5), 2013-2017 (2011).
- Möller, M., Harnisch, F., Schröder, U. Microwave-assisted hydrothermal degradation of fructose and glucose in subcritical water. Biomass and Bioenergy. 39, 389-398 (2012).
- Guiotoku, M., Rambo, C. R., Hansel, F. A., Magalhães, W. L. E., Hotza, D. Microwave-assisted hydrothermal carbonization of lignocellulosic materials. Materials Letters. 63 (30), 2707-2709 (2009).
- Guiotoku, M., Rambo, C. R., hansel, F. A., Magalhães, W. L. E., Hotza, D. Microwave-assisted hydrothermal carbonization of lignocellulosic materials. Materials Letters. (63), 2707-2709 (2009).
- Kannan, S., Gariepy, Y., Raghavan, G. S. V. Optimization and characterization of hydrochar produced from microwave hydrothermal cabonization of fish waste. Waste Management. , 159-168 (2017).
- Elaigwu, S. E., Greenway, G. M. Microwave-assisted and conventional hydrothermal carbonization of lignocellulosic waste material: Comparison of the chemical and structural properties of the hydrochars. Journal of Analytical and Applied Pyrolysis. 118, 1-8 (2016).
- Elaigwu, S. E., Greenway, G. M. Microwave-assisted hydrothermal carbonization of rapeseed husk: A strategy for improving its solid fuel properties. Fuel Processing Technology. 149, 305-312 (2016).
- Chen, W. -. H., Ye, S. -. C., Sheen, H. -. K. Hydrothermal carbonization of sugarcane bagasse via wet torrefaction in association with microwave heating. Bioresource technology. 118, 195-203 (2012).
- Nizamuddin, S., et al. Upgradation of chemical, fuel, thermal, and structural properties of rice husk through microwave-assisted hydrothermal carbonization. Environmental science and pollution research international. 25 (18), 17529-17539 (2018).
- Nizamuddin, S., et al. An overview of microwave hydrothermal carbonization and microwave pyrolysis of biomass. Reviews in Environmental Science and Bio/Technology. 17 (4), 813-837 (2018).
- Dallinger, D., Kappe, C. O. Microwave-assisted synthesis in water as solvent. Chemical reviews. 107 (6), 2563-2591 (2007).
- Qi, X., Watanabe, M., Aida, T. M., Smith, J. R. L. Catalytic dehydration of fructose into 5-hydroxymethylfurfural by ion-exchange resin in mixed-aqueous system by microwave heating. Green Chemistry. 10 (7), 799 (2008).
- Nüchter, M., Ondruschka, B., Bonrath, W., Gum, A. Microwave assisted synthesis - a critical technology overview. Green Chem. 6 (3), 128-141 (2004).
- Schanche, J. -. S. Microwave synthesis solutions from personal chemistry. Molecular Diversity. 7 (2-4), 291-298 (2003).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angewandte Chemie (International ed. in English). 43 (46), 6250-6284 (2004).
- Gronnow, M. J., White, R. J., Clark, J. H., Macquarrie, D. J. Energy Efficiency in Chemical Reactions: A Comparative Study of Different Reaction Techniques. Organic Process Research & Development. 9 (4), 516-518 (2005).
- Kruse, A., Dahmen, N. Hydrothermal biomass conversion: Quo vadis?. The Journal of Supercritical Fluids. 134, 114-123 (2018).
- Reza, M. T., et al. Hydrothermal Carbonization of Biomass for Energy and Crop Production. Applied Bioenergy. 1 (1), (2014).
- Libra, J. A., et al. Hydrothermal carbonization of biomass residuals: a comparative review of the chemistry, processes and applications of wet and dry pyrolysis. Biofuels. 2 (1), 71-106 (2011).
- Reza, M. T., Uddin, M. H., Lynam, J. G., Hoekman, S. K., Coronella, C. J. Hydrothermal carbonization of loblolly pine: reaction chemistry and water balance. Biomass Conversion and Biorefinery. 4 (4), 311-321 (2014).
- Funke, A., Ziegler, F. Hydrothermal carbonization of biomass: A summary and discussion of chemical mechanisms for process engineering. Biofuels, Bioproducts and Biorefining. 4 (2), 160-177 (2010).
- Kruse, A., Funke, A., Titirici, M. -. M. Hydrothermal conversion of biomass to fuels and energetic materials. Current opinion in chemical biology. 17 (3), 515-521 (2013).
- Reza, M. T., Lynam, J. G., Uddin, M. H., Coronella, C. J. Hydrothermal carbonization: Fate of inorganics. Biomass and Bioenergy. 49, 86-94 (2013).
- Zhang, D., et al. Comparison study on fuel properties of hydrochars produced from corn stalk and corn stalk digestate. Energy. 165, 527-536 (2018).
- Huang, Y. -. B., Yang, Z., Dai, J. -. J., Guo, Q. -. X., Fu, Y. Production of high quality fuels from lignocellulose-derived chemicals: a convenient C-C bond formation of furfural, 5-methylfurfural and aromatic aldehyde. RSC Advances. 2 (30), 11211 (2012).
- Van de Vyver, S., Geboers, J., Jacobs, P. A., Sels, B. F. Recent Advances in the Catalytic Conversion of Cellulose. ChemCatChem. 3 (1), 82-94 (2011).
- Delidovich, I., Leonhard, K., Palkovits, R. Cellulose and hemicellulose valorisation: an integrated challenge of catalysis and reaction engineering. Energy & Environmental Science. 7 (9), 2803 (2014).
- Sevilla, M., Fuertes, A. B. The production of carbon materials by hydrothermal carbonization of cellulose. Carbon. 47 (9), 2281-2289 (2009).
- Yao, Z., Ma, X. Characteristics of co-hydrothermal carbonization on polyvinyl chloride wastes with bamboo. Bioresource technology. 247, 302-309 (2018).
- Funke, A., Ziegler, F. Hydrothermal carbonization of biomass: A summary and discussion of chemical mechanisms for process engineering. Biofuels, Bioproducts and Biorefining. (4), 160-177 (2010).
- Liu, Z., Balasubramanian, R. Upgrading of waste biomass by hydrothermal carbonization (HTC) and low temperature pyrolysis (LTP): A comparative evaluation. Applied Energy. 114, 857-864 (2014).
- Khalsa, J., Döhling, F., Berger, F. Foliage and Grass as Fuel Pellets-Small Scale Combustion of Washed and Mechanically Leached Biomass. Energies. 9 (5), 361 (2016).
- Saddawi, A., Jones, J. M., Williams, A., Le Coeur, C. Commodity Fuels from Biomass through Pretreatment and Torrefaction: Effects of Mineral Content on Torrefied Fuel Characteristics and Quality. Energy & Fuels. 26 (11), 6466-6474 (2012).
- Kaltschmitt, M., Hartmann, H., Hofbauer, H. . Energie aus Biomasse: Grundlagen, Techniken und Verfahren. , (2016).
- Fengel, D., Wegener, G. . Wood: Chemistry, Ultrastructure, Reactions. , (1989).
- Obernberger, I., Thek, G. Physical characterisation and chemical composition of densified biomass fuels with regard to their combustion behaviour. Biomass and Bioenergy. 27 (6), 653-669 (2004).
- Kenney, W. A., Sennerby-Forsse, L., Layton, P. A review of biomass quality research relevant to the use of poplar and willow for energy conversion. Biomass. 21 (3), 163-188 (1990).
- Tharakan, P. J., Volk, T. A., Abrahamson, L. P., White, E. H. Energy feedstock characteristics of willow and hybrid poplar clones at harvest age. Biomass and Bioenergy. 25 (6), 571-580 (2003).
- Liu, Z., Quek, A., Balasubramanian, R. Preparation and characterization of fuel pellets from woody biomass, agro-residues and their corresponding hydrochars. Applied Energy. , 1315-1322 (2014).
- Technischen Komitee ISO/TC 238. . "Solid biofuels" und Technisches Komitee CEN/TC 335 "Biogene Festbrennstoffe" Solid biofuels - Determination of calorific value (ISO 18125:2017); German version EN ISO 18125:2017. , (2017).
- Kambo, H. S., Dutta, A. A comparative review of biochar and hydrochar in terms of production, physico-chemical properties and applications. Renewable and Sustainable Energy Reviews. 45, 359-378 (2015).
- Knappe, V., et al. Low temperature microwave assisted hydrothermal carbonization (MAHC) reduces combustion emission precursors in short rotation coppice willow wood. Journal of Analytical and Applied Pyrolysis. 134, 162-166 (2018).
- Liu, Z., Quek, A., Kent Hoekman, S., Balasubramanian, R. Production of solid biochar fuel from waste biomass by hydrothermal carbonization. Fuel. 103, 943-949 (2013).
- Hoekman, S. K., Broch, A., Robbins, C., Zielinska, B., Felix, L. Hydrothermal carbonization (HTC) of selected woody and herbaceous biomass feedstocks. Biomass Conversion and Biorefinery. 3 (2), 113-126 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。