Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Reduzierung der Abgas-Holzbrennstoff-Emission durch eine kohlrigelgestützte mikrowellenassistierte hydrothermale Karbonisierung
In diesem Artikel
Zusammenfassung
Es wird ein Protokoll zur Emission der Abschöpfung von minderwertiger Biomasse durch mikrowellengestützte Hydrothermalkohlenbehandlung vorgestellt. Dieses Protokoll umfasst die Mikrowellenparameter und die Analyse des Biokohleprodukts und des Prozesswassers.
Zusammenfassung
Biomasse ist ein nachhaltiger Brennstoff, da seine CO2-Emissionen wieder in das Biomassewachstum integriert werden. Die anorganischen Vorläufer in der Biomasse verursachen jedoch negative Umweltauswirkungen und Schlackenbildung. Das ausgewählte kurze Rotationskoppel (SRC) Weidenholz hat einen hohen Aschegehalt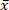 (= 1,96%) Und damit ein hoher Gehalt an Emissions-und Schlackenvorläufern. Daher wird die Reduktion von Mineralien aus SRC-Weidenholz durch mikrowellengestützte hydrothermale Karbonisierung (MAHC) bei 150 ° C, 170 ° C und 185 ° C untersucht. Ein Vorteil von MAHC gegenüber herkömmlichen Reaktoren ist eine gleichmäßige Temperaturleitfähigkeit im Reaktionsmedium, da Mikrowellen in das gesamte Reaktorvolumen eindringen. Das ermöglicht eine bessere Temperaturregelung und eine schnellere Abklingzeit. So kann eine Abfolge von Depolymerisierungs-, Transformations-und Repolymonationsreaktionen effektiv analysiert werden. In dieser Studie wurde die Analyse des Massenverlustes, des Aschegehalts und der Zusammensetzung, der Heizwerte und der molaren O/C und H/C-Verhältnisse des behandelten und unbehandelten SCR-Weidenholzes gezeigt, dass der Mineralgehalt der MAHC-Kohle reduziert und der Heizwert erhöht wurde. Das Prozesswasser zeigte einen abnehmenden pH-Wert und enthielt Fural-und 5-Methylfural. Eine Prozesstemperatur von 170 ° C zeigte die beste Kombination aus Energieeingabe und Aschekomponentenreduktion. Der MAHC ermöglicht ein besseres Verständnis des hydrothermalen Karbonisierungsprozesses, während eine großflächige industrielle Anwendung wegen der hohen Investitionskosten unwahrscheinlich ist.
(= 1,96%) Und damit ein hoher Gehalt an Emissions-und Schlackenvorläufern. Daher wird die Reduktion von Mineralien aus SRC-Weidenholz durch mikrowellengestützte hydrothermale Karbonisierung (MAHC) bei 150 ° C, 170 ° C und 185 ° C untersucht. Ein Vorteil von MAHC gegenüber herkömmlichen Reaktoren ist eine gleichmäßige Temperaturleitfähigkeit im Reaktionsmedium, da Mikrowellen in das gesamte Reaktorvolumen eindringen. Das ermöglicht eine bessere Temperaturregelung und eine schnellere Abklingzeit. So kann eine Abfolge von Depolymerisierungs-, Transformations-und Repolymonationsreaktionen effektiv analysiert werden. In dieser Studie wurde die Analyse des Massenverlustes, des Aschegehalts und der Zusammensetzung, der Heizwerte und der molaren O/C und H/C-Verhältnisse des behandelten und unbehandelten SCR-Weidenholzes gezeigt, dass der Mineralgehalt der MAHC-Kohle reduziert und der Heizwert erhöht wurde. Das Prozesswasser zeigte einen abnehmenden pH-Wert und enthielt Fural-und 5-Methylfural. Eine Prozesstemperatur von 170 ° C zeigte die beste Kombination aus Energieeingabe und Aschekomponentenreduktion. Der MAHC ermöglicht ein besseres Verständnis des hydrothermalen Karbonisierungsprozesses, während eine großflächige industrielle Anwendung wegen der hohen Investitionskosten unwahrscheinlich ist.
Einleitung
Die Anwendung von Mikrowellen für die hydrothermale Karbonisierung (MAHC) wurde für die thermochemische Transformation von Biomassemodellverbindungen wie Fruktose,Glukose 1,2oder Zellulose 3 und für organische Substrate eingesetzt, Am besten Abfallmaterial4,5, 6,7,8,9, 10. Die Nutzung von Mikrowellen ist vorteilhaft, da sie eine gleichmäßige Erwärmung der behandelten Biomasse2,10vor allem durch thermische Verluste eines dielektrischen Lösemittels 11,12ermöglicht, obwohl die Mikrowellenestun Nicht genug Energie übertragen, um chemische Bindungen direkt zu brechen undReaktionen 13 zu induzieren. Die Mikrowellen dringen in das gesamte Reaktionsvolumen des HTC-Reaktorbehälters ein und übertragen die Energie direkt auf das Material, was bei einem konventionellen Reaktor, der aufgrund der hohen Heizleistung des Stahlmantels und der Probe selbst14. Die gleichmäßige Anregung der Wassermoleküle der Probe durch Mikrowellen ermöglicht eine verbesserte Prozesssteuerung, da die Temperatur im Mikrowellenreaktor gleichmäßig auf 11, 14,15 und die Abklingzeit nach Die Reaktion ist viel schneller. Darüber hinaus erwärmen sich herkömmliche Reaktoren deutlich langsamer und die chemischen Reaktionen, die während der Heizung auftreten, können die Ergebnisse, die normalerweise der Endtemperatur zugeordnet werden, beeinflussen. Die verbesserte Prozesssteuerung in einem MAHC-Reaktor ermöglicht eine präzise Abgrenzung der Temperaturabhängigkeit ausgewählter HTC-Reaktionen (z.B. Dehydrierung oder Dekarboxylierung). Ein weiterer Vorteil der gleichmäßigen Temperaturverteilung im HTC-Reaktorvolumen ist die geringere Haftung immobilisierter und vollständig kohlensäurehaltiger Partikel an der Innenreaktorwand2. Wasser ist jedoch nur ein durchschnittliches Mikrowellenabsorbierungleichmittel, das bei höheren Temperaturen sogar eine abnehmende Mikrowellenabsorbance zeigt, was die erreichbare Höchsttemperatur begrenzt. Dieser negative Effekt wird kompensiert, wenn Säuren während des HTC-Prozesses produziert werden oder Katalysatoren (ionische oder polare Arten) vor der Behandlung zugesetzt werden. Mikrowelleninduzierte Reaktionen zeigen im Vergleich zuSandbett-katalysiertenReaktionen 12 im Allgemeinen 11, 15und speziell von 5-Hydroxymethylfurfural (5-HMF) aus Fruktose höhere Produkterträge. Sie haben auch eine viel bessere Energiebilanz als herkömmliche Heizungsmethoden15,16.
Das grundlegende chemische Konzept der hydrothermalen Karbonisierung ist der Abbau und die sukzessive Polymerisation der Biomasse. Bei diesen komplexen Wechselreaktionen wird das Gewebe mit Sauerstoff erschöpft, was den Heizwert erhöht. Zunächst werden die Polymere hemicellulose und Zellulose zu Zuckermonomern17hydrolysiert,obwohlniedrige Temperaturen vor allem die Hämatellulose 18,19, 20,21betreffen. In diesem frühen Stadium der HTC-Reaktionen bilden sich organische Säuren aus der Transformation der Zuckeraldehyde und der Deacetylierung von Hemicellulose. Diese Säuren können Essik, Milche, Lvulinsäure, Acryl oder Ameisensäure 20,21, 22sein und sie verringern den pH-Wert des Reaktionswassers im Reaktor. Durch die Dissoziation bilden sie freie Negativ-Ionen, die das Ionenprodukt im Prozesswasser erhöhen. Das zunehmende Ionenprodukt ermöglicht die Lösung von Kationen, die die Hauptbestandteile der Asche in der Biomasse sind. Durch diesen Mechanismus wird das Gewebe von Emissionsvorläufern und Schlackenformern (z.B. Kalium, Natrium, Kalzium, Chlor und Schwermetalle) 23,24abgezogen.
Die gebildeten organischen Säuren können die Austrocknung von Zuckermonomeren zu Furanen unterstützen. Ein häufiges Zuckeraudradrationsprodukt ist Pelz und 5-Hydroxymethylfurfural, die für die chemische Industrie machbare Produkte sind, da sie als Plattformprodukte (z.B. für die Synthese von Biopolymeren) dienen. 5-Methylfurfural kann durch katalysierte Reaktionen aus Zellulose 25,26 oder 5-Hydroxymethylfurfural27gebildet werden. Während es sich bei der Biopolymer-Synthese um eine künstliche Repolyparierung unter kontrollierten Bedingungen handelt, können die Furane auch hochmolekulare aromatische Strukturen in der komplexen chemischen Umgebung des MAHC-Reaktors verdichten, polymerisieren und bilden. Das Zusammenspiel der lösungrigen organischen und anorganischen Verbindungen mit der modifizierten Holzzellmatrix trägt zur Komplexität des Reaktionssystems20bei. Die Furan-Polymerisierungsreaktionswege verwenden Aldol-Kondenswasser bzw. intermolekulareDehydrierung 18,20 und ergeben hydrochare Partikel mit einer hydrophobischen Hülleund einem hydrophilen Kern 28. Es wird noch nicht enthüllt, ob Biomassepartikel vollständig abgebaut und dann repolypolyhymiert werden oder ob die Biomassepartikel als Vorlage für die Karbonisierung dienen. Die Abbau-und Repolyhymationsreaktionen umfassen jedoch Dehydratations-und Dekarboxylierungsreaktionensowie 29,30, was den Rückgang des van Krevelen-Diagramms in Richtung der O/C und H/C-Verhältnisse von schwarzem Kohlenstoff bewirkt.
Während andere Studien die mineralisch reduzierende Wirkung der konventionellen Reaktortherapie31, einer Wasserwäsche mit kombinierter mechanischer Auslaugung32 oder Wasser-/Ammonium acetate/SalzsäureWaschen 33, nachgewiesen haben, ist unsere Studien untersuchen erstmals die mineralische Auslaugung bei der niedrigen Temperatur-Karbonisierung mit Mikrowellen. Da sich diese Studie auf die Emission Vorläufer-Lleichung für die Aufwertung von Kraftstoffen konzentriert, untersucht sie das Schicksal von Kalium, Natrium, Magnesium, Kalzium, Chlor, Schwefel, Stickstoff und Schwermetallen. Feinstaubvorläufer bilden bei erhöhten Temperaturen in der Gasphase flüchtige Salze (z.B.KCl oder K 2 SO4). Wenn sich diese Salze im Rauchgas ansammeln, können Schwermetalle wie Zink sie als Nukleationspartikel zerstreuen, was zu einer Partikelwachstumskette führt. Bei niedrigeren Rauchgastemperaturen löst die Salzkondensation das Partikelwachstum weiter aus und führt zu einer krebserregenden Feinstaubemission aus dem Schornstein. Diese Emissionen sind derzeit der Hauptfaktor, der die Nachhaltigkeit von Biomassekraftstoffen gefährdet. Eine nachhaltige Energieversorgung ist auf deren Reduktion durch teure Filter oder deren Reduzierung der Brennstoffe (z.B. durch MAHC) angewiesen. Da diese Studie einem praktischen Ansatz folgt, wurde kurzrotendes Coppice (SRC) Weidenholz als potenzieller Bioenergie-Ausgangsstoff mit hohen Wachstumsraten ausgewählt. Sie kann von den Landwirten auf ihren Feldern für eine selbstnachhaltige Stromversorgung durch Vergasung, aber auch für die Wärmeerzeugung durch direkte Verbrennung angebaut werden. Ein Nachteil von Weide SRC ist der hohe Rindengehalt durch einen niedrigen Stamm: Rindenverhältnis in reifem Stadium. Die Rinde enthält im Vergleich zu Holz 34,35, 36,37vieleMineralien underzeugt höhere Mengen an gasförmigen oder partikelbedingtenEmissionen 38. HTC mit niedriger Temperatur kann die Verbrennungseigenschaften von SRC-Weidenholz verbessern und damit zu einer nachhaltigen Wärme-und Stromversorgung beitragen. Ein weiterer wichtiger Parameter der in dieser Studie untersuchten HTC Biokohle ist die Energiedichte, die höhere Anfangstemperatur und die höhere Endbrenntemperatur39.
Protokoll
1. Zubereitung von Probenmaterial
- Ernte fünf Jahre alte Weide, Klon-Typ "Tordes" ([Salix schwerinii x S. viminalis] x S. vim.), mit einer Höhe von 12 − 14 m und einem Brustdurchmesser von ca. 15 cm.
- Das Holz zupumpen und die Späne in einem Ofen trocknen.
- Die Hackschnitzel mit einer Schneidemühle schneiden und mit einer Zentrifugalmühle auf eine Partikelgröße von 0,12 mm mahlen.
2. Mikrowellengestützte Hydrothermalcarbonisierung
- Verwenden Sie einen Mikrowellenherd mit 850 W und einer Magnetron-Frequenz von 2.455 MHz.
- 500 mg Rohstoff aus Schritt 1,3 in ein 50 mL-Reaktionsgefäß Polytetrafluoroethylen (PTFE) mit Spachtel legen. Fügen Sie 10 ml demineralisiertem Wasser hinzu. Schrauben Sie die Reaktionsgefäßkappe ab, so dass das Druckventil in der Kappe auf dem gleichen Niveau wie die Kappe Rand ist.
- Für jede Aufbereitungstemperatur zwölf Reaktionsgefäße mit Rohstoffen in den Mikrowellenherd legen und den Backofen schließen.
- Drei Temperaturprogramme aufstellen, Mit der Mikrowelle für die drei Temperaturen: 150 ° C (Rampe + 12,5 ° C min-1, Halten 60 min, Spitzenleistung 50%), 170 ° C (Rampe + 9,6 ° C min-1, Halten 60 min, Spitzenleistung 80%) und 185 ° C (Rampe + 5,3 ° C min-1 Halten Sie 30 min, Rampe-1,1 ° C min-1 bis 150 ° C, Spitzenleistung 100%). Starten Sie die Mikrowelle für jedes einzelne Programm.
- Nach Abschluss des Programms die Reaktionsgefäße entfernen, abkühlen lassen und reaktivieren. Dann öffnen Sie sie unter einem Rauchschrank, nachdem sie den Druck im Inneren freigegeben haben.
- Fügen Sie 35 ml zweimal destilliertes Wasser zu jedem Reaktionsgefäß hinzu. Die Lösung in jedem Behälter auf einen Zentrifugenzylinder und die Zentrifuge auf 1.714 x g für 10 min geben.
- Das Prozesswasser wird in ein anderes Rohr geleitet und bei-5 ° C für die pH-und gaschromatographische Massenspektrometrie (GC-MS) eingefroren.
- Den Zentrifugenzylinder mit dem restlichen Biokohlepellet bei-5 ° C einfrieren. Dann nehmen Sie das Biokohle-Pellet heraus und trocknen es bei 105 ° C für 24 Stunden. Wiegen Sie das Biokohle-Pellet und berechnen Sie den Gewichtsverlust, der durch die MAHC-Behandlung verursacht wird.
- Wiederholen Sie die Schritte 2,2 − 2,8 viermal pro Temperatur (48 Reaktionsgefäße pro Temperatur), um genügend Biokohle (ca. 22 g) für die anschließende Analyse zu produzieren.
3. Asche-Content-Bestimmung
- 20 leere Keramikschalen einzeln wiegen. Fügen Sie in jede 1 g Probe (5 x 1 g Rohstoff und 5 x 1 g Biokohle aus jeder Temperaturbehandlung).
Achtung: Weil die Gerichte nicht beschriftet werden können, muss ein Plan für die Anordnung der Gefäße im Ofen gezogen werden. - Die geöffneten Keramikschalen in einen Muffelofen geben und den Ofen schließen.
- Programmieren Sie ein Temperaturprogramm für den Muffelofen (+ 6 ° C min-1 von 25 ° C bis 250 ° C, halten Sie 60 min, + 10 ° C min-1 bis 550 ° C, halten Sie 120 min) und starten Sie das Programm.
- Nachdem das Programm abgeschlossen ist, den Muffelofen auf 105 ° C abkühlen lassen. Dann den Ofen öffnen und die Keramikschalen herausnehmen.
- Legen Sie die Keramikschalen in einen Absauger (Materialtisch), der mit einem Trocknungsmittel aus Siliziumgel gefüllt ist. Schließen Sie den Trockner und das Vakuum trocknen Sie mit Hilfe einer Vakuumpumpe.
- Die Keramikschalen nach 24 Stunden Abkühlung herausnehmen. Die Keramikschale, die die Asche enthält, gewichten und das Aschegewicht berechnen, indem man das Gewicht der leeren Keramikschale abzieht.
- Bestimmen Sie den Aschegehalt in Prozent, indem Sie das Aschgewicht durch die trockene Masse des Rohstoffs oder der Biokohle teilen.
4. Ermittlung der höheren und niedrigeren Heizwerte
- Aktivieren Sie die Wasserpumpe des Kalorimeters und öffnen Sie das Sauerstoffventil, um 99,5% Sauerstoff an den Kalorimeter zu liefern.
- Wiegen Sie 1 g Glukose und legen Sie sie in einen Plastik-Musterbeutel mit einem definierten Heizwert von 46.479 J/g. Legen Sie den Musterbeutel in den Verbrennungstiegel einer Kalorimeter-Bombe.
- Fügen Sie 5 ml doppelt vergöttertes Wasser in den Boden der Bombe und schrauben Sie die Bombe. Die Bombe in den Kalorimeter geben und den Kalorimeter schließen.
- Geben Sie das Gewicht der Probe ein und ändern Sie die Einstellungen der Probenbeutel-Methode. Den Kalorimeter starten.
- Nach Abschluss der Messung die Bombe herausnehmen, auf den Kopf stellen und langsam für 1 Minute schütteln.
- Die Bombe abschrauben, 5 ml zweimal entmineralisiertes Wasser entfernen und in einem Schraubkappenbehälter für die anschließende Ionenchromatographie-Analyse aufbewahren.
- Wiederholen Sie die Schritte 4.2 − 4,6 dreimal, um den Kalibrierungsstandard zu erhalten.
- Wiederholen Sie die Schritte 4.2 − 4,6 fünfmal mit jeder MAHC-Biokohle (150 ° C, 170 ° C, 185 ° C) und dem Rohstoff.
- Berechnen Sie den niedrigeren Heizwert mit folgender Gleichung40:
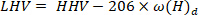
Wenn LHV der niedrigere Heizwert ist, ist HHV der höhere Heizwert, der aus dem Kalorimeter in Schritt 4.4 gewonnen wird, und der Wasserstoffgehalt (gewonnen aus der Elementaranalyse)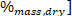 .
.
5. Ionen-Chromatographie zur Quantifizierung von Chlor
Hinweis: Prüfen Sie die Kalibrierung des Ionenchromatographen vor der Analyse.
- Nehmen Sie die 5 ml Lösung aus Schritt 4.8 heraus und fügen Sie 45 ml zweimal entmineralisiertes Wasser in eine 50 ml volumetrische Maske.
- Das Probensaugrohr in einen Probenbehälter geben und mit einer Spritze ca. 3 mL der Probe in die Vorsäule ziehen. Starten Sie den Analyselauf.
- Führen Sie die Messungen nach Herstellerangaben durch.
- Wiederholen Sie die Schritte 5.2 und 5.3 für jede Probe, die in Abschnitt 4 zubereitet wird.
6. Elementaranalyse zur Bestimmung der O/C und H/C-Verhältnisse
- Wählen Sie aus der Instrumentenmanufaktur eine geeignete Methode für die zu messenden Proben aus.
- Machen Sie alle 20 mg Sulfonamid-Standards und Rohlinge, die für die Kalibrierung des Gerätes erforderlich sind.
- Um eine Materialprobe zuzubereiten, 20 mg Probe in Blechfolie auf die Mikro-Bilanz legen. Die Probe auf der Blechfolie abwägen, die Folie um die Probe schließen und die Verpackung so wenig Luft wie möglich drücken. Danach wiederholen Sie diese 5x für jede Probe.
Hinweis: Um die Biochar-Proben analysieren zu können, muss die gleiche Menge an Wolfram-Trioxid wie die Menge der Probe in einem Verhältnis von 1:1 hinzugefügt werden. Dies ist notwendig, um den fehlenden Sauerstoff in der Biochar zu kompensieren, um eine vollständige Verbrennung im Elementaranalysator zu gewährleisten. - Die vorbereiteten Proben in den Autosampler des Elementaranalysators einlegen.
- Öffnen Sie das Sauerstoff-und Heliumventil für die Brennkammer des Elementaranalysators.
- Starten Sie die Analyse, wenn das Gerät die vom Gerät angegebene Temperatur erreicht hat. In diesem Fall warten Sie, bis die Temperatur 900 ° C erreicht.
- Berechnen Sie die Maulwürfe jedes Elements im Sulfonamid-Standard durch das Standardgewicht des Sulfonamid (Schritt 6.2) und das Gewicht von 1 Maulwurf des jeweiligen Elements.
- Berechnen Sie das Verhältnis zwischen den Maulwürfen von C, H, S und N in Sulfonamid, die aus Schritt 6,7 gewonnen wurden, und den jeweiligen Spitzenbereichen.
- Subtrahieren Sie den Aschegehalt der Probe, der aus Schritt 3.7 gewonnen wird, aus dem Gesamtgewicht der Probe.
- Vergleichen Sie den jeweiligen Element-Peak-Bereich im Sulfonamid-Standard und der Probe und multiplizieren Sie mit dem Maulwurf jedes Elements in Sulfonamid, um den Maulwurf des Elements in der Probe zu erhalten.
- Berechnen Sie das Gewicht von C, H, S und N in der Probe, indem Sie den Maulwurf des Elements, der aus Schritt 6.10 gewonnen wird, mit der jeweiligen molaren Masse des Elements aus der Periodentabelle multiplizieren.
- Berechnen Sie das Gewicht des Sauerstoffs in der Probe, indem Sie die Aschefreimasse verwenden, die aus Schritt 6,9 gewonnen wird, und das Gewicht von C, H, N und S, die aus Schritt 6.11 gewonnen werden.
- Berechnen Sie die molaren H/C-und O/C-Verhältnisse im Rohstoff und die MAHC-Biokohleproben.
7. induzierte gekoppelte Plasma-optische Emissionsspektroskopie
- 400 mg getrocknetem Rohstoff oder MAHC-Biokohle wiegen und in ein 50 mL PTFE-Reaktionsgefäß mit Spachtel geben. 3 ml von 69% Salpetersäure und 9 ml von 35% Salzsäure hinzufügen.
- Schrauben Sie die Reaktionsgefäßkappe ab, so dass das Druckventil in der Kappe auf dem gleichen Niveau wie die Kappe Rand ist.
- Legen Sie die Reaktionsgefäße der Proben, die im Mikrowellenherd analysiert werden, und schließen Sie den Ofen.
- Programmieren Sie das Temperaturprogramm für den kompletten Abbau des organischen Materials: Rampe + 15,5 ° C min-1 bis 200 ° C, 30 min halten, auf 180 ° C abkühlen, 5 min halten.
- Nach Abschluss des Programms die Reaktionsgefäße entfernen, abkühlen lassen und reaktivieren. Dann öffnen Sie die Behälter unter einem Rauchschrank, nachdem Sie den Druck im Inneren freigegeben haben.
- Die Proben in einen 50 ml Glühbirnenzylinder gießen. Anschließend das Reaktionsgefäß gründlich mit zweimal vergöttertem Wasser abspülen und auf den Glühbirnenzylinder übertragen. Der Zylinder mit doppelt vergöttertem Wasser auf die 50-mL-Marke auffüllen, um eine gleichmäßige Verdünnung aller Proben zu gewährleisten.
- Filtern Sie die Probe von Schritt 7,6 mit 150 μm Mesh-Filterpapier. Das Filtrat in 50 mL konische Zentrifugenrohre füllen.
- Legen Sie die Standardproben in den Autosinjektor des ICP-OES. Die Standardproben sind von den bekannten Konzentrationen (0.0001 ppm, 0.001 ppm, 0.1 ppm, 1 ppm 10 ppm, 20 ppm, 50 ppm) der zu quantifizierenden Elemente (Ca, As, B, Be, Fe, Se, Zn, Ag, Al, Ba, Bi, Cd, Co, Cr, Cu, Ga, K, Li) , Mg, Mn, Mo, Na, Ni, Pb, Rb, Sr, Te, Tl, V).
- Legen Sie die Proben in den Autolinjektor der ICP-OES und führen Sie die ICP-OES-Analyse mit den gleichen Parametern aus.
- Nach der ICP-OES-Analyse erhalten Sie die Elementarkonzentration aus der Software, die automatisch in mg/kg berechnet wird, basierend auf den Kalibrierkurven, die aus Standardproben in Schritt 7.8 gewonnen werden.
- Berechnen Sie die Elementarkonzentrationsreduktion der erzeugten Biokohle:
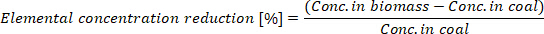
Wo Conc. in Biomasse die Elementarkonzentration in der Biomasse und Conc ist. In der Kohle ist die Elementarkonzentration in der Biokohle.
8. Messung des pH-Wertes des HTC-Prozesswassers
- Füllen Sie jeden Flüssigkeitsanteil aus der MAHC-Behandlung (Schritt 2.7) des Rohstoffes und der drei Biocoals in vier entsprechenden Bechern.
- Die pH-Sonde mit Standardlösungen kalibrieren.
- Messen Sie den pH-Wert des flüssigen Bruchs des Rohstoffs und der drei MAHC-Biokokale.
9. Gaschromatografie-Massenspektrometrie
- Filtern Sie die flüssigen Bruchteile aus der MAHC-Behandlung (Schritt 2,7) mit 150 μm Mesh-Filterpapier. 20 ml Methanol zu 1 ml der gefilterten flüssigen Fraktionen hinzufügen.
- 200 μL auf einen GC-MS-Autosampler vial übertragen und die Vial in den GC-MS-Autosampler legen.
- Die reinen Standards der Furfural-und 5-Methylfurfural (analytische Sorte) bis zu 10-2,10-3,10-4 und 10-5mit Methanol verdünnen.
- Setzen Sie die Standards in den GC-MS-Autosampler und analysieren Sie sie mit den Parametern: 1 μL Einspritzvolumen bei 230 ° C Injektortemperatur und 1:40 Split; 5MS nichtpolare Säule (Materialtabelle) mit 15 m Länge und 0,25 mm Filmstärke; Temperaturprogramm 30 ° C, Halten 2 min, Rampe von + 40 ° C/min bis 250 ° C, Halten 2 min; Ionisation mit 70 mV und MS-Detektor im Scan-Modus mit einem m/Bereich von 35 − 400, jeweils in 0,3 s.
- Etablieren Sie Kalibrierkurven durch die Gesamtzahl der Ionen (TIC) und die Compound-Konzentration.
- Führen Sie die vorbereiteten HTC-Biokohleflüssigkeitsplageproben mit den gleichen analytischen Parametern aus und identifizieren Sie furfurale und 5-Methylfural mittels Retentionszeit des Standards und des Spektrums in einer Spektralbibliothek.
- Bestimmen Sie die Konzentrationen von Furfural und 5-Methylfurfural anhand der berechneten Kalibrierkurve (Schritt 9.6) und dem Einsetzen der Probenhöhle Furfural und 5-Methylfurfural.
10. Statistik
- Analysieren Sie die Daten mit dem Shapiro Wilks-Test für die normale Verteilung.
- Verwenden Sie den Mann-Whitney U-Test für nicht normal verteilte Datensätze und den t-test für normal verteilte Datensätze, um signifikante Unterschiede zwischen den Datensätzen zu finden.
Hinweis: Wenn ein Datensatz normal verteilt ist und der andere nicht, verwenden Sie den Mann-Whitney U-Test.
Ergebnisse
Die Ergebnisse der Elementaranalyse zeigten Unterschiede zwischen dem O/C-H/C-Verhältnis des Weidenholzes und den MAHC-Biokokalen (Abbildung1). Der Rohstoff weist höhere O/C-H/C-Verhältnisse und eine höhere Variation der Werte auf. Die MAHC-Behandlung reduzierte die Wertevariante durch Homogenisierung im Mikrowellenreaktor. Die Präzision des Mikrowellenreaktors ermöglichte die Differenzierung von drei Stufen des Abbaus. Das H/C-Verhältnis wurde bei 150...
Diskussion
Der MAHC ermöglicht die Differenzierung der Schritte der chemischen Degradierung durch die Anwendung unterschiedlicher Intensitäten der thermischen Behandlung. So ist es möglich, die Wechselwirkungen zwischen dem Massenverlust, dem O/C-H/C-Verhältnis, dem Heizwert, der Aschekomponentenreduzierung, der pH-Erhöhung des Prozesswassers und der Ansammlung von Furanen im Prozesswasser zu beurteilen. Der Vorteil der MAHC-Methode gegenüber der herkömmlichen HTC-Reaktormethode liegt in der Wärmeleitung über Mikrowellen, ...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren bedanken sich bei Christoph Warth, Michael Russ, Carola Lepski, Julian Tejada und Dr. Rainer Kirchhof für die technische Unterstützung. Die Studie wurde vom BMBF (Projekt BiCoLim-Bio-Combustibles Limpios) unter der Fördernummer 01DN16036 gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| 5MS non-polar cloumn | Thermo Fisher Scientific,Waltham, USA | TraceGOLD SQC | GCMS |
| 9µm polyvinylalcohol particle column | Methrom AG, Filderstadt, Germany | Metrosep A Supp 4 -250/4.0 | Ion chromatography |
| argon | Westfalen AG, Münster, Germany | UN 1006 | ICP-OES |
| calorimeter | IKA-Werke GmbH & Co.KG, Stauffen, Germany | C6000 | higher and lower heating value |
| centrifuge | Andreas Hettich GmbH & Co.KG, Germany | Rotofix 32 A | |
| centrifuge mill | Retsch Technology GmbH, Haan, Germany | ZM 200 | |
| ceramic dishes | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | XX83.1 | Ash content |
| cutting mill | Fritsch GmbH, Markt Einersheim, Germany | pulverisette 19 | |
| D(+) Glucose | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | X997.1 | higher and lower heating value |
| elemental analyzer | elementar Analysesysteme GmbH, Langenselbold, Germany | varioMACRO cube | elemental analysis |
| exicator | DWK Life Sciences GmbH, Wertheim, Germany | DURAN DN300 | Ash content |
| GC-MS system | Thermo Fisher Scientific,Waltham, USA | Trace 1300 | GCMS |
| hydrochloric acid | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | HN53.3 | ICP-OES |
| ICP OES | Spectro Analytical Instruments GmbH, Kleve, Germany | Spectro Blue-EOP- TI | ICP-OES |
| Ion chromatograph | Methrom GmbH&Co.KG, Filderstadt, Germany | 833 Basic IC plus | Ion chromatography |
| kiln dryer | Schellinger KG, Weingarten, Germany | ||
| kiln dryer | Schellinger KG, Weingarten, Germany | Ash content | |
| mesh filter paper | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | L874.1 | ICP-OES |
| microwave oven | Anton Paar GmbH, Graz, Austria | Multiwave Go | |
| muffel furnance | Carbolite Gero GmbH &Co.KG, Neuhausen, Germany | AAF 1100 | Ash content |
| nitric acid | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | 4989.1 | ICP-OES |
| oxygen | Westfalen AG, Münster, Germany | UN 1072 | higher and lower heating value |
| pH-meter | ylem Analytics Germany Sales GmbH & Co. KG, Weilheim,Germany | pH 3310 | pH |
| sample bag | IKA-Werke GmbH & Co.KG, Stauffen, Germany | C12a | higher and lower heating value |
| Standard Laboratory Vessels and Instruments | |||
| standard samples | Bernd Kraft GmbH, Duisburg, Germany | ICP-OES | |
| sulfonamite | elementar Analysesysteme GmbH, Langenselbold, Germany | SLBS4782 | elemental analysis |
| teflon reaction vessels | Anton Paar, Austria | HVT50 | |
| teflon reaction vessels | Anton Paar, Austria | HVT50 | ICP-OES |
| tin foil | elementar Analysesysteme GmbH, Langenselbold, Germany | S12.01-0032 | elemental analysis |
| tungstenVIoxide | elementar Analysesysteme GmbH, Langenselbold, Germany | 11.02-0024 | elemental analysis |
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | ||
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | higher and lower heating value | |
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | ICP-OES |
Referenzen
- Li, C., Zhao, Z. K., Cai, H., Wang, A., Zhang, T. Microwave-promoted conversion of concentrated fructose into 5-hydroxymethylfurfural in ionic liquids in the absence of catalysts. Biomass and Bioenergy. 35 (5), 2013-2017 (2011).
- Möller, M., Harnisch, F., Schröder, U. Microwave-assisted hydrothermal degradation of fructose and glucose in subcritical water. Biomass and Bioenergy. 39, 389-398 (2012).
- Guiotoku, M., Rambo, C. R., Hansel, F. A., Magalhães, W. L. E., Hotza, D. Microwave-assisted hydrothermal carbonization of lignocellulosic materials. Materials Letters. 63 (30), 2707-2709 (2009).
- Guiotoku, M., Rambo, C. R., hansel, F. A., Magalhães, W. L. E., Hotza, D. Microwave-assisted hydrothermal carbonization of lignocellulosic materials. Materials Letters. (63), 2707-2709 (2009).
- Kannan, S., Gariepy, Y., Raghavan, G. S. V. Optimization and characterization of hydrochar produced from microwave hydrothermal cabonization of fish waste. Waste Management. , 159-168 (2017).
- Elaigwu, S. E., Greenway, G. M. Microwave-assisted and conventional hydrothermal carbonization of lignocellulosic waste material: Comparison of the chemical and structural properties of the hydrochars. Journal of Analytical and Applied Pyrolysis. 118, 1-8 (2016).
- Elaigwu, S. E., Greenway, G. M. Microwave-assisted hydrothermal carbonization of rapeseed husk: A strategy for improving its solid fuel properties. Fuel Processing Technology. 149, 305-312 (2016).
- Chen, W. -. H., Ye, S. -. C., Sheen, H. -. K. Hydrothermal carbonization of sugarcane bagasse via wet torrefaction in association with microwave heating. Bioresource technology. 118, 195-203 (2012).
- Nizamuddin, S., et al. Upgradation of chemical, fuel, thermal, and structural properties of rice husk through microwave-assisted hydrothermal carbonization. Environmental science and pollution research international. 25 (18), 17529-17539 (2018).
- Nizamuddin, S., et al. An overview of microwave hydrothermal carbonization and microwave pyrolysis of biomass. Reviews in Environmental Science and Bio/Technology. 17 (4), 813-837 (2018).
- Dallinger, D., Kappe, C. O. Microwave-assisted synthesis in water as solvent. Chemical reviews. 107 (6), 2563-2591 (2007).
- Qi, X., Watanabe, M., Aida, T. M., Smith, J. R. L. Catalytic dehydration of fructose into 5-hydroxymethylfurfural by ion-exchange resin in mixed-aqueous system by microwave heating. Green Chemistry. 10 (7), 799 (2008).
- Nüchter, M., Ondruschka, B., Bonrath, W., Gum, A. Microwave assisted synthesis - a critical technology overview. Green Chem. 6 (3), 128-141 (2004).
- Schanche, J. -. S. Microwave synthesis solutions from personal chemistry. Molecular Diversity. 7 (2-4), 291-298 (2003).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angewandte Chemie (International ed. in English). 43 (46), 6250-6284 (2004).
- Gronnow, M. J., White, R. J., Clark, J. H., Macquarrie, D. J. Energy Efficiency in Chemical Reactions: A Comparative Study of Different Reaction Techniques. Organic Process Research & Development. 9 (4), 516-518 (2005).
- Kruse, A., Dahmen, N. Hydrothermal biomass conversion: Quo vadis?. The Journal of Supercritical Fluids. 134, 114-123 (2018).
- Reza, M. T., et al. Hydrothermal Carbonization of Biomass for Energy and Crop Production. Applied Bioenergy. 1 (1), (2014).
- Libra, J. A., et al. Hydrothermal carbonization of biomass residuals: a comparative review of the chemistry, processes and applications of wet and dry pyrolysis. Biofuels. 2 (1), 71-106 (2011).
- Reza, M. T., Uddin, M. H., Lynam, J. G., Hoekman, S. K., Coronella, C. J. Hydrothermal carbonization of loblolly pine: reaction chemistry and water balance. Biomass Conversion and Biorefinery. 4 (4), 311-321 (2014).
- Funke, A., Ziegler, F. Hydrothermal carbonization of biomass: A summary and discussion of chemical mechanisms for process engineering. Biofuels, Bioproducts and Biorefining. 4 (2), 160-177 (2010).
- Kruse, A., Funke, A., Titirici, M. -. M. Hydrothermal conversion of biomass to fuels and energetic materials. Current opinion in chemical biology. 17 (3), 515-521 (2013).
- Reza, M. T., Lynam, J. G., Uddin, M. H., Coronella, C. J. Hydrothermal carbonization: Fate of inorganics. Biomass and Bioenergy. 49, 86-94 (2013).
- Zhang, D., et al. Comparison study on fuel properties of hydrochars produced from corn stalk and corn stalk digestate. Energy. 165, 527-536 (2018).
- Huang, Y. -. B., Yang, Z., Dai, J. -. J., Guo, Q. -. X., Fu, Y. Production of high quality fuels from lignocellulose-derived chemicals: a convenient C-C bond formation of furfural, 5-methylfurfural and aromatic aldehyde. RSC Advances. 2 (30), 11211 (2012).
- Van de Vyver, S., Geboers, J., Jacobs, P. A., Sels, B. F. Recent Advances in the Catalytic Conversion of Cellulose. ChemCatChem. 3 (1), 82-94 (2011).
- Delidovich, I., Leonhard, K., Palkovits, R. Cellulose and hemicellulose valorisation: an integrated challenge of catalysis and reaction engineering. Energy & Environmental Science. 7 (9), 2803 (2014).
- Sevilla, M., Fuertes, A. B. The production of carbon materials by hydrothermal carbonization of cellulose. Carbon. 47 (9), 2281-2289 (2009).
- Yao, Z., Ma, X. Characteristics of co-hydrothermal carbonization on polyvinyl chloride wastes with bamboo. Bioresource technology. 247, 302-309 (2018).
- Funke, A., Ziegler, F. Hydrothermal carbonization of biomass: A summary and discussion of chemical mechanisms for process engineering. Biofuels, Bioproducts and Biorefining. (4), 160-177 (2010).
- Liu, Z., Balasubramanian, R. Upgrading of waste biomass by hydrothermal carbonization (HTC) and low temperature pyrolysis (LTP): A comparative evaluation. Applied Energy. 114, 857-864 (2014).
- Khalsa, J., Döhling, F., Berger, F. Foliage and Grass as Fuel Pellets-Small Scale Combustion of Washed and Mechanically Leached Biomass. Energies. 9 (5), 361 (2016).
- Saddawi, A., Jones, J. M., Williams, A., Le Coeur, C. Commodity Fuels from Biomass through Pretreatment and Torrefaction: Effects of Mineral Content on Torrefied Fuel Characteristics and Quality. Energy & Fuels. 26 (11), 6466-6474 (2012).
- Kaltschmitt, M., Hartmann, H., Hofbauer, H. . Energie aus Biomasse: Grundlagen, Techniken und Verfahren. , (2016).
- Fengel, D., Wegener, G. . Wood: Chemistry, Ultrastructure, Reactions. , (1989).
- Obernberger, I., Thek, G. Physical characterisation and chemical composition of densified biomass fuels with regard to their combustion behaviour. Biomass and Bioenergy. 27 (6), 653-669 (2004).
- Kenney, W. A., Sennerby-Forsse, L., Layton, P. A review of biomass quality research relevant to the use of poplar and willow for energy conversion. Biomass. 21 (3), 163-188 (1990).
- Tharakan, P. J., Volk, T. A., Abrahamson, L. P., White, E. H. Energy feedstock characteristics of willow and hybrid poplar clones at harvest age. Biomass and Bioenergy. 25 (6), 571-580 (2003).
- Liu, Z., Quek, A., Balasubramanian, R. Preparation and characterization of fuel pellets from woody biomass, agro-residues and their corresponding hydrochars. Applied Energy. , 1315-1322 (2014).
- Technischen Komitee ISO/TC 238. . "Solid biofuels" und Technisches Komitee CEN/TC 335 "Biogene Festbrennstoffe" Solid biofuels - Determination of calorific value (ISO 18125:2017); German version EN ISO 18125:2017. , (2017).
- Kambo, H. S., Dutta, A. A comparative review of biochar and hydrochar in terms of production, physico-chemical properties and applications. Renewable and Sustainable Energy Reviews. 45, 359-378 (2015).
- Knappe, V., et al. Low temperature microwave assisted hydrothermal carbonization (MAHC) reduces combustion emission precursors in short rotation coppice willow wood. Journal of Analytical and Applied Pyrolysis. 134, 162-166 (2018).
- Liu, Z., Quek, A., Kent Hoekman, S., Balasubramanian, R. Production of solid biochar fuel from waste biomass by hydrothermal carbonization. Fuel. 103, 943-949 (2013).
- Hoekman, S. K., Broch, A., Robbins, C., Zielinska, B., Felix, L. Hydrothermal carbonization (HTC) of selected woody and herbaceous biomass feedstocks. Biomass Conversion and Biorefinery. 3 (2), 113-126 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten