Method Article
用于狂犬病诊断的泛源病毒实时RT-PCR
摘要
这种使用dsDNA间染的实时RT-PCR适用于诊断裂解病毒感染。该方法从从狂犬病疑似前身或死后样本中提取的RNA开始,详细说明主混合物制备、RNA添加、实时机器的设置以及结果的正确解释。
摘要
分子测定是快速、敏感和特异性的,已成为诊断狂犬病的核心。几十年来,基于PCR的检测一直被用来确认狂犬病诊断,但直到最近才被世界动物卫生组织(OIE)接受,作为检测狂犬病感染的主要方法。实时 RT-PCR 检测提供实时数据,是闭管系统,可最大限度降低设置过程中的污染风险。脱氧核糖核酸(DNA)交相氟铬实时RT-PCR检测不需要昂贵的探针,将每个样品的成本降至最低,当引物设计在保存区域时,该检测是跨病毒属的特异性检测,而不是仅针对一种病毒。物种是可能的。在这里,我们描述了泛莱沙病毒SYBR实时RT-PCR检测,检测莱莎病毒属的莱沙病毒,包括最发散的病毒IKOV,WCBV和LLEBV。结合解结曲线分析,该测定是敏感和具体的,具有检测所有莱沙病毒物种的优点。该检测已在许多具有质量保证环境的诊断实验室中采用,能够对动物和人类狂犬病病例进行可靠、快速、灵敏的诊断。
引言
2018年,世界动物和动物事务厅接受了使用分子方法诊断狂犬病,认识到这些技术在确认狂犬病病例方面的优势,特别是在样本不理想的情况下,或用于验尸诊断,因为不需要活病毒或新鲜样本。由于基因组为RNA,在PCR开始之前,对莱沙病毒的PCR检测需要逆转录(RT)。RT-PCR检测基因组的3'近区域被认为是最敏感的,因为转录梯度发生在莱西病毒复制期间。常用的RT-PCR测定可以大致分为两类:端点(或凝胶基)和实时。两种方法都是敏感和具体的;然而,实时测定还有一些额外的好处,如在"实时"中获得结果,并在全封闭管系统中执行,从而减少操作员污染的可能性。有两种主要方法检测使用实时测定获得的莱沙病毒特异性放大组。第一种利用含荧光和环流的水解探针(如TaqMan探头)。当探针在放大过程中与目标区域结合时,聚合酶的外糖酶活性会导致荧光和淬火的解结,从而能够测量产生的荧光。第二种利用DNA间质染料(氟色素如SYBR绿色),在扩增过程中与双绞合DNA结合。结合的荧铬会发出在每个周期中检测到的荧光,从而能够实时检测和定量产品。由于与任何dsDNA结合的非特定性质,进行解结曲线分析以确认反应的特异性。实时RT-PCR由于放大剂尺寸小,长度通常小于200 bp,因此速度很快;然而,在保存区域中确定设计引物和探头的适当区域可能具有挑战性,因此取消探头要求是一个明显的优势。
一些实时RT-PCR被设计专门检测RABV2的单个菌株或谱系,并检测第3、4、5、6属的赖沙病毒。 7,8,9.所有检测都有检测限制,这取决于引物(如有必要,探针)序列在整个属中保存程度。事实上,新兴或新型病毒株可能使高度特异性的基于探针的检测无效。实时检测(染料与探头)的选择将取决于预期应用。对于对本地来源的大脑材料进行监测并期望大量阴性样本的实验室来说,使用更便宜的间质染料是一个明智的选择。SYBR Green 方法在进行扫描监测时也是最佳方法,因为基于更有限的基于探头的检测不会检测到新型或发散性莱沙病毒的存在。
Lyssa病毒属的所有成员都引起狂犬病,一旦出现症状,狂犬病就致命。绝大多数人畜狂犬病病例都是狂犬病病毒(RABV)引起的,狂犬病的主要宿主是家犬10。蝙蝠是溶于溶类病毒的重要宿主宿主,除了两种利沙病毒外,所有病毒种类都直接在蝙蝠中被识别——伊科马利萨病毒(IKOV)和莫科拉病毒(MOKV)——在这两种中,IKOV被推测有一个蝙蝠宿主宿主水库11.除了16种公认的莱沙病毒12外,最近还有两种莱沙病毒被描述:台湾蝙蝠莱沙病毒(TWBLV)13和科塔拉赫蒂蝙蝠利沙病毒(KBLV)14。裂氧病毒在基因上可以分为三个植物群,大多数裂源病毒,包括RABV,属于植物群I。然而,最发散的赖萨病毒属于植物群III,并且不太可能被设计为RABV或Phylogroup I病毒序列的RT-PCR检测到。
此处描述的测定利用了实时引物对 JW12-N165,在 2005年首次描述 3 。引引被设计成泛莱沙病毒,尽管最初的应用是作为TaqMan检测与探针来区分莱沙病毒物种。随后确认引物对是泛莱沙病毒的特异性是通过2步SYBR实时测定所有可用的莱沙病毒物种,包括WCBV15。引物对在这里描述在一步RT-PCR实时测定使用中钙化氟铬,验证使用代表从所有16个公认的裂解病毒物种。这种一步式实时测定是一种快速、灵敏、感染病毒特异性测定,并表明引物集的鲁棒性能够识别甚至高度不同的流毒病毒物种。
研究方案
自然感染后在APHA收到的诊断材料样本,或通过根据英国内政部法规根据许可70/7394对APHA伦理和统计委员会评估的协议对小鼠进行接种而获得的样本。
1. 使用微体积分光光度计对RNA进行定量
- 确保分光光度计的设置设置为RNA。
- 使用 1-2 μL 的分子级水初始化机器并设置基线。
- 使用每个测试RNA样品的1-2μL来评估RNA数量。
- 保存读数和文档。
- 如果需要,将RNA调节到1μg/μL。
注:RNA 必须始终保存在冰上(或冷却块)。如果使用柱或基于珠的方法获得RNA,RNA通常小于1μg/μL。在这种情况下,使用RNA整洁。
2. 制备RNA稀释系列以确定终点灵敏度
-
对RNA进行10倍的连续稀释。
- 带有稀释系列(例如,10-1、10-2等)和RNA细节的标签管。
- 在每个管中加入45μL的分子级水。
- 加入5μL的RNA(以前稀释到1μg/μL),并混合良好。
- 将移液器尖端处理在适当的消毒剂中,然后更换为新的吸头。
- 从 10-1中取 5 μL,加入 10-2管并混合均匀。
- 对剩余的稀释重复 2.1.3-2.1.5。
注:RNA 必须始终保存在冰上(或冷却块)。
3. 实时RT-PCR反应的准备
- 使用电子表格,根据检测样本的数量和控制样本(包括莱沙病毒和β-actin测定)规划板布局。
注:如果用正阴性对照重复测试4个样本,这相当于两种检测的10个反应。 - 在"洁净室"或与RNA模板分离的区域中,在使用前用适当的消毒剂擦拭表面,或准备PCR工作站(如果使用)。要准备工作站,请用适当的消毒擦拭机柜表面,并将所需物品放入工作站并关闭车门。打开紫外线灯 10 分钟
- 从冰箱中取出起重剂和引种并解冻(表1中列出的试剂和表2中的引注)。
注:酶混合物储存在甘油中,因此不需要解冻,必须始终保持在冰(或冷却块)上。所有其他试剂可在室温下解冻。 - 解冻后,将试剂和离心机短暂混合以收集液体。
注:不要涡旋酶混合物,只需短暂地离心。 - 为莱沙病毒和β-actin准备单独的主混合物。对于每种反应,加入7.55μL的分子级水,10μL的2x通用SYBR绿色反应混合物,0.6μL的正向底漆,0.6μL的反向底漆,0.25μL的iTaq RT酶混合。
- 使用电子表格计算正确的交易量,以避免手动计算中的错误。确保准备好足够的主混合,以补偿移液错误。因此,如果需要 10 种反应(参见 3.1 中的注释),准备 12 种反应
- 在冰上(或冷却方块)上准备主混合物,并留在冰上,直到放入实时机器。
- 将准备好的主混合器、离心机短暂混合,将 19 μL 分配到带管的相关孔中或与正在使用的实时机器兼容的 96 孔板。
注:在移液的同时,尽量减少井中气泡的产生。 - 在单独的房间内,或在 3.2 中所述准备的 UV 机柜中,小心地将先前调整到 1 μg/μL 的 RNA 添加到相应主混合良好的表面下方(参见步骤 1.5),然后轻轻混合。使用后(表面下)将移液器尖端直接放入消毒剂中。
- 在测试样本后添加对照,接下来添加阳性对照,最后添加无模板控制(NTC + 分子级水)。使用的RNA量可以根据样品类型和使用的RNA提取而改变。必须验证使用量以确保反应得到优化。
- 使用带盖或封口机的密封板,确保所有盖都牢固关闭并贴上足够的标签,以定位样品。标记板/带管的边缘。
- 使用离心机将样品分解,以收集井底的所有液体。
- 将板转移到实时 PCR 机器,打开车门并放置在支架中,确保根据板布局正确定位样品。
注:如果使用管条,请确保支架就位。 - 打开实时PCR机程序,选择SYBR解散曲线实时实验选项。使用表3中指定的热循环条件(包括数据收集点)对实时PCR机器进行编程。
- 选择SYBR作为荧光染料,选择未知作为样本类型,并将名称插入正确的样本名称框中。
注:区分复制和莱沙病毒和β-actin井之间。 - 选择一个文件位置来保存实验数据,确保灯在运行结束时关闭,然后开始运行。
注:由于第一步是 RT 阶段,因此在此期间不会收集数据,因此,如果灯需要预热期,则在 RT 阶段可能发生。实时机器和软件将实时显示放大曲线,而熔炼曲线将在周期结束时生成。
4. 数据分析
-
运行完成后,执行如下数据分析。
- 首先分析测试样本与对照样本的扩增图结果。正样本显示指数斜率,后面通常为高原和 Ct值。负样本显示没有 Ct值的平面放大图 (图 1A)。Ct值由软件自动计算,但应根据需要进行检查和手动更改。
- 其次,分析与对照样本一起的测试样本解散曲线结果。正极样品的熔化温度(Tm)为77~80°C,与正对照图1B重叠。
- 通过确保控制有效来获取总体诊断结果。使用表 4解释与内部 _-actin 控件相关的结果。如果正控制样本为负和/或负样本为正,则应忽略运行。
- 在"控制卡"中记录为对照RNA获得的Ct和Tm值,以便进行趋势分析并帮助识别测定灵敏度中的漂移。
结果
按照上述协议,在控制标准病毒(CVS)的稀释系列上演示了泛性病毒RT-PCR的灵敏度。图 1) 和一系列其他莱沙病毒 (图 2和图 3).SYBR Green I 染料用作通用单步RT-PCR,在单个管中进行cDNA合成和PCR扩增。当特定目标的放大时,更多的染料被束缚,导致荧光水平实时增加。所有染料间实时测定必须分两个阶段解释:扩增和解离。扩增相与任何实时扩增(图 1A).在早期周期中,由于与背景的信号不足,无法计算DNA扩增的线性"早期阶段"。其长度与示例中的目标量直接相关。随后,有一个指数相,其中DNA分子的倍增被检测和记录。最后,达到高原阶段(除了高度稀释的样品,在程序结束之前可能无法达到这个阶段)。在此阶段,由于试剂耗尽,荧光强度水平升高。使用 CVS 的 10 倍串行稀释观察到的放大图符合预期图(图 1AC) 其中莱沙病毒测定表现出比 β-actin 测定更高的灵敏度。分离曲线在扩增后计算,其中dsDNA通过温度的增量增加分离成sDNA,荧光监测为温度的函数(图 1B, D-F).特定放大子分离成sDNA的阈值温度,引起荧光释放,由热循环器软件测量(Tm).此解向阶段提供了有关放大子大小的数据,使用户能够将结果与正对照进行比较,从而产生假阳性结果的可能性微乎其微。Tm使用泛莱沙病毒测定() 观察到 CVS图 1B) 和 β-actin 测定 (图 1D) 是不同的,并且通过注意到 Tm获得(图 1E).此外,Ct和 Tm对运行和运算符之间的值进行了评估,并证明该值是可重现的(表 5).用于计算 C 的阈值t值由软件自动计算,并取决于许多因素,包括反应组合或所使用的仪器。在 12 个独立运行平均 Ct莱沙病毒测定为20.66(SD 0.63),β-actin测定为27.5(SD 1.13)。相反,在T中观察到的变化m由于缺乏外部影响,值明显降低。例如,均值 TmCVS 莱沙病毒测定为 78.92 (SD 0.16) (表 5,当与所有莱沙病毒的平均值相比,78.81 °C (SD 0.531) (表 6和图 1F).T 中缺乏变异m跨越 Lyssavirus属是有利的,因为相同的控制RNA可以使用,无论在样品中的莱沙病毒,但区分的莱沙病毒物种使用Tm是不可能的,特别是因为不同的RABV子谱系跨越T的范围m观测值(表 6).这种测定很少观察到非特异性扩增图;但是,需要定义正结果与非特定负结果的特定参数。在所有莱沙病毒(0.531)上观察到的SD应用到最低(77.34 - LBVa)和最高(79.67 - IKOV)观察Tm值,用于为正特定波段设置范围 76.8 °C - 80.2 °C。因此,Tm超出此范围的值被视为非特定值,因此是负结果。有时,一个样本会观察到多个峰值。如果主导峰位于正确的 Tm(对于每个复制),然后样本被视为正。观察到非特异性峰值的最常见原因是由于引漆-二聚醚,测定已经过优化,以尽量减少底漆二聚器。底漆二聚器通常产生小于目标序列的放大素,因此具有 Tm低于特定产品。
使用TRIzol提取的三种流解病毒阳性脑样本RNA的10倍连续稀释被并行运行并绘制(图2)。三种利沙病毒的检测限值各不相同,但没有一种超过Ct 36。图 2中绘制的病毒的 R2系数值范围为 0.9637 和 0.996。对于所有分析的病毒 (表 6) 范围没有超过此范围,此外,29 种利沙病毒中的 7 种具有 R2 >0.99(未显示数据)。考虑到稀释系列的制备来自总RNA萃取,观察到的线性度提供了测定鲁棒的证据。最后,利用一组跨越莱莎病毒属所有三个植物群的RNA小组,调查了所有莱沙病毒物种(特别是最多样化的植物群III病毒)的检测。使用上述协议,使用从原始或实验性感染小鼠(脑材料)中提取的RNA。结果证实引基扩增了所有莱沙病毒物种,包括发散的植物群III感染病毒IKOV、WBCV和LLEBV(表6和图3)。一组不同的非赖萨病毒的横纹病毒,最初收集和分析抗原16,最近基因17被筛选,并检测到无交叉反应,表明引物是特定的仅莱萨病毒属的成员(未显示数据)。自 2013 年以来,泛裂化病毒实时测定已包含在 EURL(欧盟参考实验室)实验室间熟练程度计划中,表明泛裂性病毒 TaqMan 测定和其他分子测定100% 一致。传统的RT-PCR测定,除了FAT(荧光抗体测试)。
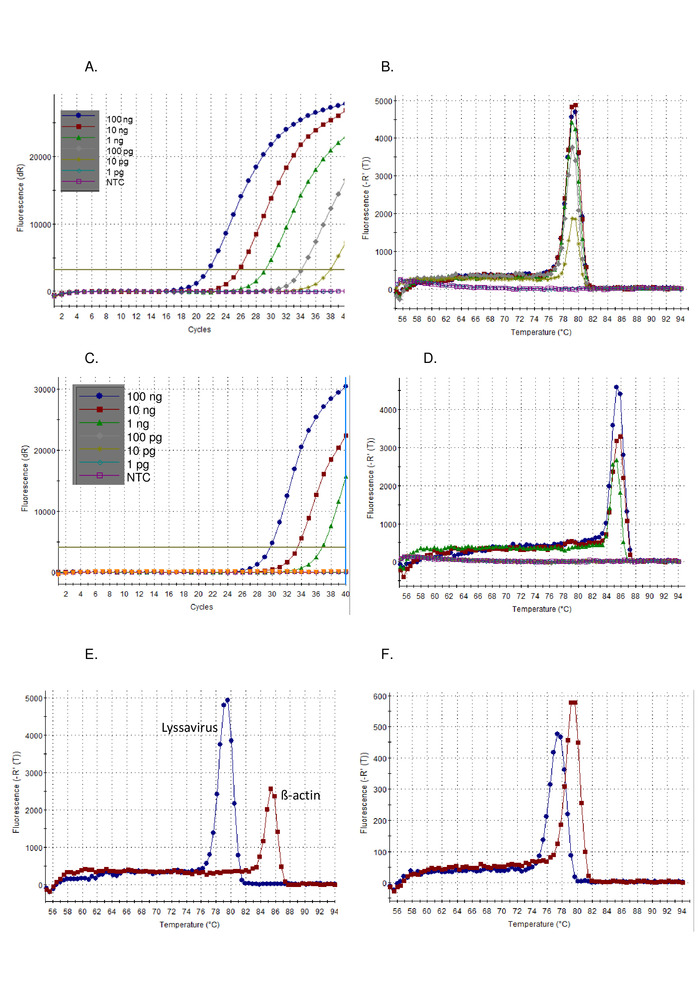
图1:CVS正对照RNA的10倍连续稀释,在泛流沙病毒RT-PCR测定上运行,可视化为扩增图(A)和解散曲线(B),并在被可视化为扩增图(C)的β-actin RT-PCR测定上运行,并且解散曲线 (D)。NTC = 无模板控件。在泛流解病毒RT-PCR测定(蓝色)和β-actin RT-PCR测定(红色)上运行的CVS对照RNA的比较,显示解散曲线(E)的差异——有关平均值,见表5; 最后,LBVa(蓝色)和IKOV(红色)的解散曲线显示在整个Lysa病毒属(F )上观察到的Tm值范围。请点击此处查看此图的较大版本。
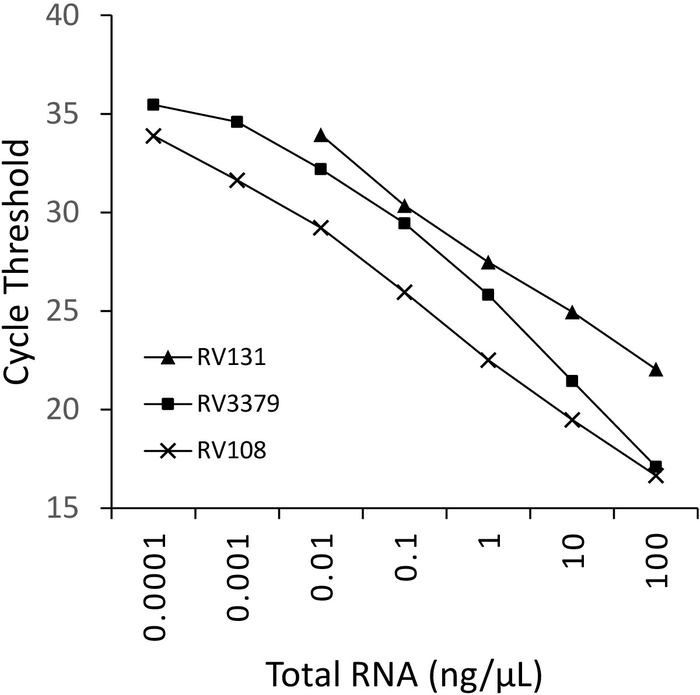
图2:三种溶沙病毒的10倍连续稀释:RABV (RV108)、DUVV (RV131) 和 ARAV (RV3379)。R2 = 0.996、0.9962 和 0.9637。数据点在 10-7 (0.0001 纳克/μL) 达到检测极限 (其中获得值)。请点击此处查看此图的较大版本。
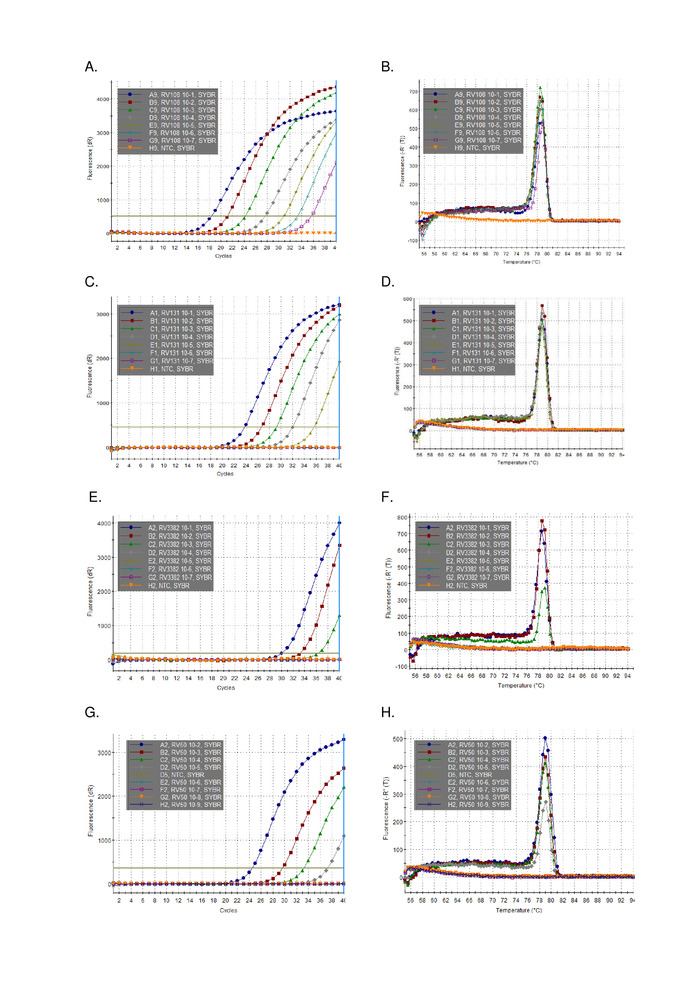
图3:代表10倍的序列稀释数据,来自整个莱莎病毒属(参见关于莱沙病毒标识的个别图例和表6,了解与其他莱沙病毒相比的表格结果)。面板A、C、E、G扩增图和B、D、F、H分离曲线分别用于 A、C、E 和 G。请点击此处查看此图的较大版本。
| 试剂 | μL/反应 |
| 分子级水 | 7.55 |
| 2x 通用RT PCR反应混合物 | 10 |
| 引推前 [20 ]M] | 0.6 |
| 底漆反向 [20 ]M] | 0.6 |
| RT酶混合 | 0.25 |
| 每次反应总计 | 19 |
表1:泛赖沙病毒实时RT-PCR主组合试剂。
| 测定 | 引种名称 | 引力角色 | 序列 5'-3' | 位置1 |
| 莱萨病毒 | JW12 | RT-PCR | ATG TAA CAC CYC TAC AAT G | 53-73 |
| N165 | Pcr | GCA GGG TTR TAC TA | 165-146 | |
| * -actin | * -actin 电子学 | Pcr | CGA TGA AGA ACA AGA TCA TCA TTG | 1051-1072 |
| * - 行为反向 | RT-PCR | AAG CAT TG CGG TGG 交流 | 1204-1188 | |
| 根据巴斯德病毒序列 (M13215) 和小鼠 + actin 基因序列 (NM_007393) 给出引体位置 | ||||
表2:泛利沙病毒实时RT-PCR引物详细信息。
| 阶段 | 周期 | 温度 | 时间 | 数据采集 |
| 反向转录 | 1 | 50 °C | 10分钟 | |
| RT 失活/初始变性 | 1 | 95 °C | 5分钟 | |
| 放大 | 40 | 95 °C | 10 s | |
| 60 °C | 30 s | 端点 | ||
| 解结曲线分析 | 1 | 9°C | 1 分钟 | |
| 55 °C | 1 分钟 | |||
| 55 - 95 °C | 10 s | 所有点 |
表3:泛利沙病毒实时RT-PCR循环条件。
| 测试结果 | 内部 β-actin 控制 | 总体结果 |
| 负 | 负1 | 无效。重复提取和测定2 |
| 负 | 积极 | 报告负结果 |
| 积极 | 积极 | 报告阳性结果 |
| 积极 | 负1 | 重复提取和测定3 |
| 1在重复提取期间,使用异构外部控制是有益的。 | ||
| 2如果内部控制获得第二个阴性结果,则此检测将报告样本不可测试。 | ||
| 3如果内部控制获得第二个阴性结果,同时获得阳性检测结果,则为继发狂犬病 | ||
| 应进行诊断测试以确认此结果。 | ||
表4:泛莱沙病毒实时RT-PCR的结果和总体结果摘要。负值被指定为无 Ct值(放大)和无熔体温度(解散)的样品,或超出正溶于利沙病毒(76.8 °C - 80.2 °C)的熔融温度。正值被指定为具有 Ct值(放大)和熔融温度(解散)的样品,该温度位于正溶沙病毒的 Tm范围内。
| 莱萨病毒测定 | * - actin 测定 | |||
| Ct | Tm | Ct | Tm | |
| 意味 着 | 20.66 | 78.92 | 27.5 | 85.26 |
| Sd | 0.63 | 0.16 | 1.13 | 0.35 |
| LCL (95%) | 19.39 | 78.59 | 25.23 | 84.56 |
| UCL (95%) | 21.93 | 79.25 | 29.76 | 85.96 |
表 5:在 12 个独立运行(包括多个运算符)中对 CVS 正控制进行运行间分析。
| 植物群 | 物种 | 病毒 ID | 血统 | 检测限制 | Tm |
| Ⅰ | RABV | RV50 | 美国蝙蝠 | 10-5 | 79.5 |
| Ⅰ | RABV | RV51 | 美国福克斯 | 10-7 | 77.6 |
| Ⅰ | RABV | RV108 | 智利蝙蝠 | 10-7 | 78.63 |
| Ⅰ | RABV | RV313 | 欧洲福克斯 | 10-9 | 78.53 |
| Ⅰ | RABV | RV437 | 欧洲拉狗 | 10-7 | 78.09 |
| Ⅰ | RABV | RV1237 | 欧洲鹿 | 10-8 | 78.76 |
| Ⅰ | RABV | RV334 | 中国疫苗 | 10-8 | 79.03 |
| Ⅰ | RABV | RV102 | 非洲 2 | 10-7 | 78.58 |
| Ⅰ | RABV | RV995 | 非洲 3a | 10-8 | 79.66 |
| Ⅰ | RABV | RV410 | 非洲 3b | 10-7 | 79.03 |
| Ⅰ | RABV | RV2324 | 非洲 4 | 10-7 | 79.17 |
| Ⅰ | RABV | RV2417 | 斯里兰卡 狗 | 10-9 | 78.71 |
| Ⅰ | RABV | CVS-11 | 10-7 | 79.17 | |
| Ⅰ | EBLV-1 | RV20 | 德国 | 10-6 | 79.05 |
| Ⅰ | EBLV-2 | RV1787 | 英国 | 10-7 | 78.76 |
| Ⅰ | BBLV | RV2507 | 德国 | 10-9 | 78.71 |
| Ⅰ | ABLV | RV634 | 10-8 | 78.25 | |
| Ⅰ | DUVV | RV131 | 10-5 | 79.03 | |
| Ⅰ | GBLV | RV3269 | 10-7 | 79.15 | |
| Ⅰ | ARAV | RV3379 | 10-7 | 79.46 | |
| Ⅰ | 胡夫 | RV3380 | 10-7 | 78.97 | |
| Ⅰ | SHIBV | RV3381 | 10-7 | 78.59 | |
| Ⅰ | 伊尔克 | RV3382 | 10-3 | 78.59 | |
| Ⅱ | LBVa | RV767 | 10-5 | 77.34 | |
| Ⅱ | LBVd | RV3383 | 10-7 | 78.59 | |
| Ⅱ | 莫克 | RV4 | 10-3 | 78.81 | |
| Ⅲ | 伊科夫 | RV2508 | 10-5 | 79.67 | |
| Ⅲ | LLEBV | RV3208 | 10-4 | 79.15 | |
| Ⅲ | WCBV | RV3384 | 10-3 | 79 |
表6:三种植物群中具有代表性的莱沙病毒的实时RT-PCR特异性、敏感性和Tm的摘要。莱沙病毒的平均Tm为78.81(SD 0.531)。
讨论
描述的泛莱沙病毒实时RT-PCR测定是一种闭管、一步检测,可检测所有三个植物群的莱沙病毒。该检测已验证为动物和人类狂犬病诊断,包括死后脑组织(最佳脑干),以及前验尸样本,如皮肤活检、连续收集的唾液或脑脊髓液 (CSF)。该测定中使用的引引剂首先用于基于探针的测定,以区分RABV、EBLV-1和EBLV-2 3,这些引源已在许多OIE狂犬病实验室中使用,并在EURL熟练度方案中持续进行。随后,使用两步实时测定15,证实了这些引物的"泛利沙病毒"性质。此处描述的测定利用引材在一步式 SYBR 测定中进一步优化 RT-PCR,从而实现闭管快速系统。此外,在狂犬病流行国家使用这种检测的培训已证实适合在任何实验室实施,具有基本的PPE和质量系统,以减少交叉污染和微量样本,设施储存试剂和实时带 SYBR 检测的机器。测定非常可靠,与FAT有100%的相关性,对分解样品3的灵敏度提高。与基于探针的测定相比,基于DNA的间印染料测定的主要优点之一是相对成本。另一个好处是,测定只使用两个引基,因此由于序列发散,检测失败的风险较小,这在以前发布的基于探针的检测中一直是一个弱点。事实上,所有裂解病毒物种(除了TWBLV和KBLV)的代表都使用这种测定检测,并且对TWBLV和KBLV在引种位进行序列分析后发现,没有显著差异,强烈表明它们也将被检测使用此方法。在所分析的病毒中观察到的检测极限范围,可视为由两个主要因素造成的。首先,RNA是从临床脑材料中分离出来的,因此每个未稀释样品中的基因组拷贝量不能直接比较。RNA通过将总RNA调整到1μg/μL而"正常化";然而,病毒基因组RNA在样本中的比例会有所不同。第二是莱沙病毒序列的多样性,尽管引物位位于保存区域,但仍然存在变化位置。因此,大多数对测定灵敏度较低的莱沙病毒是植物群II和III病毒也就不足为奇了。解结曲线分析代表一个基本参数,将由于引精华二聚器的形成或宿主基因组中非特定区域的扩增而可能产生的假阳性结果降至最低。在现实中,这是罕见的发生,解结曲线分析相当于运行一个胶合,以可视化正确大小的常规RT-PCR放大剂。根据在我们的实验室收集的数据,提供了可接受的 Tm值范围(77-80 °C)。强烈建议各实验室整理内部数据,以确保范围可转让并作相应修改。解释放大和解离图的结果,以及正负对照和β-actin结果,可实现稳健且可重复的诊断结果。
在该协议的范围之外是用于获得高质量RNA的RNA提取方法。本协议中分析的所有RNA均使用TRIzol制备;然而,有许多合适的基于钠的提取RNA提取方案,包括柱基和基于珠的提取试剂盒。处理莱沙病毒阳性(或疑似阳性)样品必须在国家批准的许可生物控制设施内处理。然而,提取的总RNA是非传染性的,因此在低密封实验室中处理。根据所使用的提取方法,需要评估定量和稀释RNA的要求。对于基于苯酚的萃取物,包括TRIzol,此步骤是必需的,并防止抑制检测物污染gDNA;然而,基于柱和珠的萃取(尤其是那些DNA耗尽阶段)在测试前不需要稀释。
在整个协议中,必须小心谨慎,防止交叉污染,并将样品准确添加到正确的油井中。带有试剂计算和板布局的电子表格可作为补充文件下载。良好的实验室实践,包括清洁工作表面、定期更换手套、使用屏障提示和不同的房间/紫外线柜来分离每个阶段,将污染的可能性降至最低。为了确保测试使用预期参数执行,必须包括正负控制,并且所有测试样本以重复(或三元)形式运行。
包含控制是任何 PCR 的基本功能,尤其是对于诊断。阳性控制RNA是从CVS(挑战病毒标准)感染的小鼠大脑分批制备的,并经过验证和校准,以确保批次之间的一致性。对照RNA被量化并稀释至1μg/μL.RNA,在串行稀释中获得阳性结果,至少达到10-4(等于100 pg/μL)被认为是适合目的的。正对照RNA在-80°C以10-1等分储存。必要时,将等分稀释1:100,以1纳克/μL提供工作库存,并在-80°C下储存在5μL一次性等量中。稀释的阳性控制RNA用于表示低水平阳性样品,并确保检测出检测出任何灵敏度降低。为每个控件保留一张"控制卡",以监控 Ct值并识别趋势(表 5)。表 5显示了 CVS 正对照样本 Ct和 Tm值在多日内和运算符的良好运行间可比性,从而保证测定是可靠且可重现的。应调查偏离这些测量的结果,并在必要时重复测试样品。分子级水作为NTC包含在每次运行中,以确认试剂没有赖沙病毒RNA的污染,并确认阴性样本。此外,为了确保RNA提取的有效性,在单独的管中与测试样品一起测试β-actin。莱沙病毒阳性控制RNA也用于β-actin阳性控制。其他内源性基因或异源性内部控制系统也可用于利用。使用这些控件可确保在与测试样本相同的条件下分析所有步骤。有时,如果样品严重降解或没有足够的宿主RNA(如唾液或CSF),内源基因PCR可能会失败。在这种情况下,当莱沙病毒实时RT-PCR结果为阳性时,确认独立RNA提取 - 在原始测试或二次测试(分子,如常规RT-PCR)上排除RNA提取过程中的污染,或 FAT。在分析诊断样本时使用表 4可确保正确的解释。
无论用于确认狂犬病感染的分子测定,后续调查使用Sanger测序来确定莱沙病毒物种和经典技术在病毒学,如FAT或病毒分离也应进行允许进一步病毒特征化,并支持将阳性病例通知世界世界和免疫卫生组织。
披露声明
作者没有什么可透露的。
致谢
作者们感谢艾玛·怀斯小姐和梅根·戈尔丁小姐协助完成实验。该协议的制定得到了英国环境、食品和农村事务部(Defra)、苏格兰政府和威尔士政府的资助,赠款[SV3500和SE0431]以及欧洲病毒档案馆全球(EVAg)项目根据第653316号赠款协议,从欧洲联盟的Horizon 2020研究和创新方案获得资金。
材料
| Name | Company | Catalog Number | Comments |
| Art Barrier pipette tips (various sizes) | Thermofisher | various | |
| Centrifuge | Beckman | Allegra 21R | Rotor capable of holding 96 well plates required. Step 3.8. |
| Centrifuge (mico) | Sigma | ||
| Finnpipettes (to dispense 0.5-1,000 µL) | Thermofisher | various | |
| iTaq Universal SYBR Green One-Step RT-PCR kit | Bio-Rad | 172-5150 | Equivalent kits can be used if validated |
| MX3000P or MX3005P real-tme PCR system | Stratagene | N/A | Eqivalent machines can be used if validated |
| MicroAmp reaction plate base | Any suitable | Used to hold tube strip and plates securely. | |
| Optically clear flat clear strips (8) | ABgene | AB-0866 | |
| Perfect fit frame (if using tube strips) | Stratagene | N/A | Specific to machine |
| Primers: for primer details see Table 2. | Ordered at 0.05 µmole scale HPLC purified. | ||
| Thermo-Fast 96 well plares, non skirted | ABgene | AB-600 | |
| Thermo-Fast strips (8) Thermo-tubes | ABgene | AB-0452 | |
| Vortex machine / Whirlimixer | Fisons Scientific equipment | SGP-202-010J | |
| Unless stated, alternative equipment can be used |
参考文献
- . OIE. OIE Terrestrial Manual 2018. , 8-14 (2018).
- Panning, M., et al. Comparative analysis of rabies virus reverse transcription-PCR and virus isolation using samples from a patient infected with rabies virus. Journal of Clinical Microbiology. 48 (8), 2960-2962 (2010).
- Wakeley, P. R., et al. Development of a real-time, TaqMan reverse transcription-PCR assay for detection and differentiation of lyssavirus genotypes 1, 5, and 6. Journal of Clinical Microbiology. 43 (6), 2786-2792 (2005).
- Wang, L., et al. A SYBR-green I quantitative real-time reverse transcription-PCR assay for rabies viruses with different virulence. Virologica Sinica. 29 (2), 131-132 (2014).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR Assay for the Detection of Highly Variable Rabies virus and Other Lyssaviruses. PLOS Neglected Tropical Diseases. 11 (1), e0005258 (2017).
- Nadin-Davis, S. A., Sheen, M., Wandeler, A. I. Development of real-time reverse transcriptase polymerase chain reaction methods for human rabies diagnosis. Journal of Medical Virology. 81 (8), 1484-1497 (2009).
- Hoffmann, B., et al. Improved safety for molecular diagnosis of classical rabies viruses by use of a TaqMan real-time reverse transcription-PCR "double check" strategy. Journal of Clinical Microbiology. 48 (11), 3970-3978 (2010).
- Faye, M., et al. Development and validation of sensitive real-time RT-PCR assay for broad detection of rabies virus. Journal of Virological Methods. 243, 120-130 (2017).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLOS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Fooks, A. R., et al. Rabies. Nature Reviews Disease Primers. 3, 17091 (2017).
- Marston, D. A., et al. Ikoma lyssavirus, highly divergent novel lyssavirus in an african civet. Emerging Infectious Diseases. 18 (4), 664-667 (2012).
- . Virus Taxonomy: 2018 Release: Email ratification October 2018 (MSL #33) Available from: https://talk.ictvonline.org/taxonomy/ (2018)
- Hu, S. C., et al. Lyssavirus in Japanese Pipistrelle, Taiwan. Emerging Infectious Disease. 24 (4), 782-785 (2018).
- Nokireki, T., Tammiranta, N., Kokkonen, U. M., Kantala, T., Gadd, T. Tentative novel lyssavirus in a bat in Finland. Transboundary and Emerging Diseases. 65 (3), 593-596 (2018).
- Hayman, D. T., et al. A universal real-time assay for the detection of Lyssaviruses. Journal of Virological Methods. 177 (1), 87-93 (2011).
- Calisher, C. H., et al. Antigenic relationships among rhabdoviruses from vertebrates and hematophagous arthropods. Intervirology. 30 (5), 241-257 (1989).
- Aznar-Lopez, C., et al. Detection of rhabdovirus viral RNA in oropharyngeal swabs and ectoparasites of Spanish bats. Journal of General Virology. 94 (1), 69-75 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。