Method Article
Pan-lyssavirus en temps réel RT-PCR pour le diagnostic de la rage
Dans cet article
Résumé
Ce RT-PCR en temps réel utilisant le colorant intercalateur de dsDNA est approprié pour diagnostiquer des infections de lyssavirus. La méthode commence par l'ARN extrait d'échantillons pré-mortem ou post-mortem soupçonnés de rage, détaillant la préparation du mélange maître, l'ajout d'ARN, la configuration de la machine en temps réel et l'interprétation correcte des résultats.
Résumé
Les essais moléculaires sont rapides, sensibles et spécifiques, et sont devenus essentiels au diagnostic de la rage. Des tests basés sur la PCR ont été utilisés pendant des décennies pour confirmer le diagnostic de la rage, mais n'ont été acceptés que récemment par l'OIE (Organisation mondiale de la santé animale) comme méthode primaire pour détecter l'infection à la rage. Les essais RT-PCR en temps réel fournissent des données en temps réel et sont des systèmes à tube fermé, ce qui minimise le risque de contamination pendant la configuration. L'intercalation de l'ADN fluorochrome en temps réel RT-PCR essais ne nécessitent pas de sondes coûteuses, en minimisant le coût par échantillon, et lorsque les amorces sont conçus dans les régions conservées, les essais qui sont spécifiques à travers les genres de virus plutôt que spécifique à un seul virus espèces sont possibles. Ici, nous décrivons un pan-lyssavirus SYBR en temps réel RT-PCR analyse qui détecte les lyssavirus à travers le genre Lyssavirus, y compris les virus les plus divergents IKOV, WCBV et LLEBV. En conjonction avec l'analyse de la courbe de dissociation, cet analyse est sensible et spécifique, avec l'avantage de détecter toutes les espèces de lyssavirus. L'analyse a été adoptée dans de nombreux laboratoires de diagnostic avec des environnements de qualité assurés, permettant un diagnostic robuste, rapide et sensible des cas de rage animale et humaine.
Introduction
Le diagnostic de la rage à l'aide de méthodologies moléculaires a été accepté par l'OIE en 20181, reconnaissant les avantages de ces techniques dans la confirmation des cas de rage, en particulier dans les situations où les échantillons sont sous-optimaux, ou pour le diagnostic ante-mortem, qu'il n'y a pas d'exigence pour le virus vivant ou des échantillons frais. Les tests de PCR pour les lyssavirus nécessitent une transcription inversée (RT) avant que PCR puisse commencer car le génome est ARN. Les tests RT-PCR qui détectent la région proximale de 3' du génome sont considérés comme les plus sensibles, car les gradients transcriptionnels se produisent pendant la réplication du lyssavirus. Les essais RT-PCR couramment utilisés peuvent être divisés en deux catégories, le point final (ou à base de gel) et en temps réel. Les deux approches sont sensibles et spécifiques; cependant, l'essai en temps réel présente certains avantages supplémentaires, comme l'obtention de résultats en « temps réel » et l'exécution dans un système de tube entièrement fermé, réduisant ainsi le risque de contamination de l'opérateur. Il existe deux approches principales pour détecter les amplicons spécifiques au lyssavirus obtenus à l'aide d'analyses en temps réel. La première utilise des sondes d'hydrolyse (comme les sondes TaqMan) qui contiennent un fluorophore et un quencher. Lorsque la sonde se lie à la région cible pendant l'amplification, l'activité d'exonuclage de la polymérase entraîne la dissociation du fluorophore et du quencher, ce qui permet de mesurer la fluorescence résultante. Le second utilise un colorant intercalateur d'ADN (fluorochrome tel que SYBR Green) qui se lie à l'ADN double brin pendant l'amplification. Les fluorochromes liés émettent de la fluorescence détectée à chaque cycle, ce qui permet la détection et la quantification en temps réel du produit. En raison de la nature non spécifique de la liaison à toute dsDNA, une analyse de la courbe de dissociation est entreprise pour confirmer la spécificité de la réaction. Les RT-PCR en temps réel sont rapides en raison des petites tailles d'amplicon, généralement moins de 200 bp de longueur ; cependant, l'identification de régions appropriées pour concevoir des amorces et des sondes dans les régions conservées, peut s'avérer difficile, donc la suppression de l'exigence d'une sonde est un avantage distinct.
Un certain nombre de RT-PCR en temps réel ont été conçus pour détecter spécifiquement les souches individuelles ou les lignées de RABV2 et aussi pour détecter les lyssavirus à travers le genre3,4,5,6, 7,8,9. Tous les essais auront une limite de détection en fonction de la façon dont conservé l'amorce (et si nécessaire, la sonde) séquences sont à travers le genre. En effet, les souches virales émergentes ou nouvelles peuvent rendre les essais très spécifiques basés sur la sonde inefficaces. Le choix de la détection en temps réel (teinture vs sonde) dépendra de l'application prévue. Pour un laboratoire effectuant une surveillance sur du matériel cérébral d'origine locale et s'attendant à un nombre élevé d'échantillons négatifs, l'utilisation du colorant intercalateur moins cher est un choix judicieux. L'approche SYBR Green serait également optimale lorsqu'il s'agirait d'effectuer une surveillance de balayage lorsque la présence de lyssavirus nouveaux ou divergents ne serait pas détectée par des essais plus restreints basés sur des sondes.
Tous les membres du genre Lyssavirus causent la rage de la maladie, qui est mortelle une fois que les symptômes apparaissent. La grande majorité des cas de rage humaine et animale sont dus au virus de la rage (RABV), dont le réservoir dominant est le chien domestique10. Les chauves-souris sont d'importants réservoirs hôtes pour les lyssavirus et toutes les espèces de lyssavirus, sauf deux, caractérisées ont été identifiées directement chez les chauves-souris — le lyssavirus d'Ikoma (IKOV) et le virus Mokola (MOKV) — et de ces deux espèces, IKOV a été spéculée pour avoir un réservoir d'hôte de chauve-souris 11. En plus des 16 espèces reconnues de lyssavirus12,il y a deux lyssavirus qui ont été récemment décrits : le lyssavirus de chauve-souris de Taiwan (TWBLV)13 et le lyssavirus de chauve-souris de Kotalahti (KBLV)14. Les lyssavirus peuvent être génétiquement divisés en trois phylogroupes, la majorité des lyssavirus, y compris le RABV, appartenant au phylogroupe I. Cependant, les lyssavirus les plus divergents appartiennent au phylogroupe III et sont peu susceptibles d'être détectés par rt-PCR conçus pour cibler les séquences de virus RABV ou phylogroupe I.
Le scarest décrit ici utilise la paire de primer en temps réel JW12-N165, décrite pour la première fois en 20053. Les amorces ont été conçues pour être pan-lyssavirus bien que l'application originale était comme un analyse TaqMan avec des sondes pour différencier les espèces de lyssavirus. La confirmation ultérieure que la paire d'amorce était pan-lyssavirus dans la spécificité a été réalisée en utilisant un sYBR en 2 étapes d'analyse en temps réel sur toutes les espèces de lyssavirus disponibles, y compris WCBV15. La paire d'amorce est décrite ici dans un exemple en temps réel RT-PCR en une seule étape utilisant un fluorochrome intercalant, validé à l'aide de représentants des 16 espèces reconnues de lyssavirus. Cet analyse en temps réel en une seule étape est un test rapide, sensible, spécifique au lyssavirus et démontre que la robustesse de l'amorce vise à identifier même les espèces de lyssavirus très divergentes.
Protocole
Échantillons de matériel diagnostique reçu à l'APHA après une infection naturelle, ou obtenus par des souris inoculantes à l'aide de protocoles évalués par le comité d'éthique et de statistique de l'APHA en vertu des règlements du ministère de l'Intérieur du Royaume-Uni sous licence 70/7394.
1. Quantification de l'ARN à l'aide d'un spectrophotomètre à micro-volume
- Assurez-vous que les réglages du spectrophotomètre sont réglés sur l'ARN.
- Utilisez 1-2 L d'eau de qualité moléculaire pour initialiser la machine et définir une ligne de base.
- Utilisez 1 à 2 L de chaque échantillon d'ARN d'essai pour évaluer la quantité d'ARN.
- Enregistrez les lectures et le document.
- Ajustez l'ARN à 1 g/L, si nécessaire.
REMARQUE: L'ARN doit être conservé sur la glace (ou dans un bloc frais) en tout temps. Si l'ARN est obtenu à l'aide d'une colonne ou d'une méthode à base de perles, l'ARN est habituellement inférieur à 1 g/L. Dans cette situation utiliser l'ARN soigné.
2. Préparation de la série de dilution d'ARN pour déterminer la sensibilité de point final
-
Faire une dilution série11 de 10 de l'ARN.
- Tubes d'étiquette avec la série de dilution (par exemple, 10-1, 10-2,etc.) et les détails d'ARN.
- Ajouter 45 l'eau de qualité moléculaire à chaque tube.
- Ajouter 5 ll de l'ARN (préalablement dilué à 1 g/L) et bien mélanger.
- Endisposer la pointe de pipette dans le désinfectant approprié et remplacer par une pointe fraîche.
- Prendre 5 l 'L à partir de la 10-1 et ajouter à 10-2 tube et bien mélanger.
- Répéter 2.1.3-2.1.5 avec les dilutions restantes.
REMARQUE: L'ARN doit être conservé sur la glace (ou dans un bloc frais) en tout temps.
3. Préparation des réactions RT-PCR en temps réel
- À l'aide d'une feuille de calcul, planifiez la disposition de la plaque en fonction du nombre d'échantillons d'essai et d'échantillons témoins, tant pour les analyses de lyssavirus que pour les analyses de lyssavirus et d'actine.
REMARQUE: Si 4 échantillons doivent être testés en double avec un contrôle positif et négatif, cela équivaut à 10 réactions pour les deux essais. - Dans une « pièce propre » ou une zone séparée du modèle d'ARN, essuyez les surfaces à l'aide d'un désinfectant approprié avant d'utiliser ou préparez un poste de travail PCR (si vous l'utilisez). Pour préparer le poste de travail, essuyez la surface de l'armoire avec une désinfection appropriée et placez les articles nécessaires dans le poste de travail et fermez les portes. Allumez la lumière UV pendant 10 minutes
- Retirer les régents et les amorces du congélateur et décongeler (réactifs énumérés dans le tableau 1 et amorces dans le tableau 2).
REMARQUE: Le mélange d'enzymes est stocké dans le glycérol, donc ne nécessite pas de décongélation et doit être conservé sur la glace (ou dans un bloc frais) en tout temps. Tous les autres réactifs peuvent être décongelés à température ambiante. - Une fois décongelés, mélanger brièvement les réactifs et la centrifugeuse pour recueillir le liquide.
REMARQUE: Ne pas vortex le mélange d'enzymes, juste centrifugeuse brièvement. - Préparer des mélanges principaux séparés pour le lyssavirus et l'actine. Pour chaque réaction, ajouter 7,55 l d'eau de qualité moléculaire, 10 l de 2x Mix de réaction verte SYBR universel, 0,6 L d'apprêt avant, 0,6 l d'amorce inversée, 0,25 oL de mélange d'enzymes iTaq RT.
- Utilisez une feuille de calcul pour calculer les volumes corrects afin d'éviter les erreurs dans le calcul manuel. Assurez-vous qu'un mélange de maître suffisant est prêt pour compenser l'erreur de tuyauterie. Par conséquent, si 10 réactions sont nécessaires (voir NOTE en 3.1), préparez 12 réactions
- Préparer le mélange de maître sur glace (ou dans un bloc frais) et rester sur la glace jusqu'à ce qu'il soit placé dans la machine en temps réel.
- Mélanger brièvement les mélanges de maître préparés, la centrifugeuse et distribuer 19 L dans les puits pertinents de tubes à bande ou une plaque de puits 96 compatible avec la machine en temps réel en service.
REMARQUE: Minimiser la production de bulles dans les puits tout en pipetting. - Dans une pièce séparée, ou dans une armoire UV préparée comme décrit dans 3.2, ajouter délicatement 1 l de l'ARN préalablement ajusté à 1 g/L (voir l'étape 1.5) sous la surface du puits de maître-mélange approprié et mélanger doucement. Jeter la pointe de pipette dans le désinfectant directement après utilisation (sous la surface).
- Ajoutez les commandes après les échantillons d'essai, avec le contrôle positif ajouté suivant et le contrôle sans modèle (NTC - eau de qualité moléculaire) ajouté en dernier. La quantité d'ARN utilisée peut être modifiée en fonction du type d'échantillon et de l'extraction de l'ARN utilisée. La quantité utilisée doit être validée pour s'assurer que la réaction est optimisée.
- Plaque d'étanchéité à l'aide de couvercles à bande ou de scelleur en prenant soin de s'assurer que tous les couvercles sont fermement fermés et étiquetés suffisamment pour orienter les échantillons. Étiqueter le bord de la plaque/tubes à bande.
- Faire tourner les échantillons à l'aide d'une centrifugeuse pour recueillir tout le liquide au fond des puits.
- Transférer la plaque à la machine PCR en temps réel, ouvrir la porte et placer dans le support en assurant l'emplacement correct / orientation des échantillons en fonction de la disposition de la plaque.
REMARQUE: Si des bandes de tube sont utilisées, assurez-vous que le support est en place. - Ouvrez le programme de machine PCR en temps réel et choisissez l'option pour l'expérience en temps réel SYBR avec la courbe de dissociation. Programmez la machine PCR en temps réel en utilisant les conditions de cycle thermique spécifiées dans le tableau 3, y compris les points de collecte de données.
- Sélectionnez SYBR comme colorant fluorescent et sélectionnez inconnu comme type d'échantillon et insérez un nom dans la boîte de nom de l'échantillon correcte.
REMARQUE: Différencier entre les répliques et aussi entre les puits de lyssavirus et d'actine. - Choisissez un emplacement de fichier pour enregistrer les données expérimentales, assurez-vous que la lampe sera éteinte à la fin de l'exécution, puis démarrez l'exécution.
REMARQUE: Comme la première étape est une étape RT, aucune donnée n'est recueillie pendant ce temps, par conséquent, si la lampe nécessite une période d'échauffement cela peut se produire pendant l'étape RT. La machine et le logiciel en temps réel afficheront les courbes d'amplification en temps réel, tandis que la courbe de fusion sera générée à la fin du cycle.
4. Analyse des données
-
Une fois l'exécution terminée, effectuez l'analyse des données comme suit.
- D'abord analyser les résultats de la parcelle d'amplification des échantillons d'essai à côté des échantillons témoins. Les échantillons positifs affichent des rampes exponentielles, généralement suivies d'un plateau et d'une valeur C t. Les échantillons négatifs affichent des parcelles d'amplification plates sans valeurs Ct (Figure 1A). La valeur Ct est automatiquement calculée par le logiciel, bien que celle-ci doit être vérifiée et modifiée manuellement si nécessaire.
- Deuxièmement, analyser les résultats de la courbe de dissociation des échantillons d'essai à côté des échantillons témoins. Un échantillon positif aura une température de fusion (Tm) 77 à 80 oC, et se chevauchera avec la figure de contrôle positive 1B).
- Obtenir le résultat diagnostique global en s'assurant que les contrôles sont valides. Utilisez le tableau 4 pour interpréter les résultats par rapport au contrôle interne de l'actine. Si les échantillons témoins positifs sont négatifs et/ou les échantillons négatifs sont positifs, la course doit être ignorée.
- Enregistrez les valeurs Ct et Tm obtenues pour l'ARN témoin dans une « carte de contrôle » pour permettre l'analyse des tendances et aider à identifier les dérives dans la sensibilité à l'analyse.
Résultats
Après le protocole décrit ci-dessus, la sensibilité du pan-lyssavirus RT-PCR a été démontrée sur une série de dilution du virus standard de contrôle (CVS) (Figure 1) et une gamme d'autres lyssavirus (Figure 2etFigure 3). SYBR Green I colorant a été utilisé comme un universel en une étape RT-PCR, où la synthèse de l'ADNc et l'amplification PCR sont effectuées dans un seul tube. Au fur et à mesure que l'amplification de la cible spécifique se produit, plus de colorant est lié, ce qui entraîne une augmentation en temps réel des niveaux de fluorescence. Tous les tests de colorant intercalant en temps réel doivent être interprétés en deux phases : amplification et dissociation. La phase d'amplification est identique à toute amplification en temps réel (Figure 1A). Il y a une « phase précoce » linéaire pendant les premiers cycles où l'amplification de l'ADN ne peut pas être calculée en raison d'un signal insuffisant par rapport à l'arrière-plan. La longueur de ce montant est directement liée à la quantité de cible dans l'échantillon. Par la suite, il y a une phase exponentielle où le doublement des molécules d'ADN est détecté et enregistré. Enfin, la phase de plateau est atteinte (à l'exception des échantillons fortement dilués qui peuvent ne pas atteindre cette phase avant la fin du programme). Dans cette phase, l'intensité de la fluorescence se niveaux, en raison de l'épuisement des réactifs. Les parcelles d'amplification observées à l'aide d'une dilution sérielle de 10 fois de CVS, conformes aux parcelles attendues (Figure 1AC) où l'analyse du lyssavirus a démontré une sensibilité plus élevée que l'analyse de l'actine. La courbe de dissociation a été calculée après amplification, où l'ADN-Ds a été dissocié en ssDNA par une augmentation incrémentielle de la température et la fluorescence surveillée en fonction de la température (Figure 1B, D-F). La température de seuil à laquelle l'amplicon spécifique se dissocie en ssDNA, a provoqué une libération de fluorescence, qui a été mesurée par le logiciel thermocycler (Tm). Cette phase de dissociation a fourni des données sur la taille de l'amplicon, permettant à l'utilisateur d'interpréter le résultat par rapport à un contrôle positif, ce qui a entraîné une probabilité négligeable de résultats faussement positifs. Le Tmobservé pour CVS à l'aide de l'analyse panlyssavirus (Figure 1B) et l'étosay de l'actine (Figure 1D) sont distincts et a aidé l'utilisateur à confirmer l'analyse d'essai correcte en notant lemobtenus (Figure 1E). En outre, le CTet Tmles valeurs entre les courses et les opérateurs ont été évaluées et se sont avérées reproductibles (Tableau 5). Le seuil utilisé pour calculer le CTla valeur a été calculée automatiquement par le logiciel et dépend de nombreux facteurs, y compris le mélange de réaction ou l'instrument utilisé. Sur les 12 exécutions indépendantes, la moyenne CTétait de 20,66 (SD 0,63) pour l'analyse du lyssavirus et de 27,5 (SD 1,13) pour l'analyse de l'actine. En revanche, la variation observée dans lema été nettement inférieure, en raison de l'absence d'influences externes sur cette mesure. Par exemple, la moyenne Tmpour l'analyse du lyssavirus CVS était de 78,92 (SD 0,16) (Tableau 5), par rapport à la moyenne de tous les lyssavirus 78,81 oC (SD 0,531) (Tableau 6etFigure 1F). Ce manque de variation dans lemà travers le Lyssavirusgenre est avantageux car le même ARN de contrôle peut être utilisé indépendamment du lyssavirus dans l'échantillon, quelle que soit la différencié entre les espèces de lyssavirus utilisant le Tmn'est pas possible, en particulier parce que différentes sous-lignées RABV s'étendaient sur la gamme de Tmvaleurs observées (Tableau 6). Des parcelles d'amplification non spécifiques sont rarement observées avec cet exemple; toutefois, des paramètres spécifiques pour définir un résultat positif par rapport à un résultat négatif non spécifique sont nécessaires. Le SD observé sur tous les lyssavirus (0,531) a été appliqué au plus bas (77,34 - LBVa) et le plus élevé (79,67 - IKOV) observé Tmd'établir une fourchette de 76,8 à 80,2 oC pour des bandes spécifiques positives. Par conséquent, Tmvaleurs en dehors de cette fourchette ont été considérées comme non spécifiques et donc un résultat négatif. De temps en temps, plusieurs pics sont observés pour un échantillon. Si le pic dominant est au bon Tm(pour chaque réplique), l'échantillon est considéré comme positif. La raison la plus courante d'un pic non spécifique est observée est due à des amorces-dimers, l'assay a été optimisé pour minimiser les tamis. Les douilleurs d'apprêt donnent généralement un amplicon plus petit que celui de la séquence cible,mplus faible que le produit spécifique.
Une dilution en série de 10 fois de trois ARN positifs de lyssavirus extraits à l'aide de TRIzol, ont été exécutés en parallèle et tracés (figure 2). La limite de détection des trois lyssavirus variait, mais aucun n'excédait le Ct 36. Les valeurs de coefficient R2 pour les virus tracés à la figure 2 variaient de 0,9637 et 0,996. Pour tous les virus analysés (tableau 6) la plage n'a pas dépassé cela, en outre, 7 des 29 lyssavirus avait R2 -0,99 (données non affichées). Compte tenu du fait que la préparation de la série de dilution provient d'extractions totales d'ARN, la linéarité observée fournit la preuve que l'essai est robuste. Enfin, la détection de toutes les espèces de lyssavirus (en particulier les virus phylogroupes III les plus divers) a été étudiée à l'aide d'un panel d'ARN couvrant les trois phylogroupes du genre Lyssavirus. L'ARN extrait de souris originales ou infectées expérimentalement, matériel cérébral, a été utilisé en utilisant les protocoles décrits ci-dessus. Les résultats confirment que les amorces amplifient toutes les espèces de lyssavirus, y compris les lyssavirus phylogroupes III divergents IKOV, WBCV et LLEBV (tableau6 et figure 3). Un panel diversifié de rhabdovirus non-lyssavirus, initialement recueillis et analysés antigéniquement16, et plus récemment génétiquement17 ont été examinés et la réactivité sans croisement a été détectée, ce qui indique que les amorces sont spécifiques pour membres du genre Lyssavirus seulement (données non affichées). L'analyse en temps réel du panlyssavirus a été incluse dans les schémas de compétence interlaboratoire s'est fait au système de compétence interlaboratoire de l'EURL (EU Reference Laboratory) depuis 2013, démontrant une concordance à 100 % avec d'autres essais moléculaires tels que l'analyse panlysavirus TaqMan et le test RT-PCR conventionnel en plus du FAT (Fluorescent Antibody test).
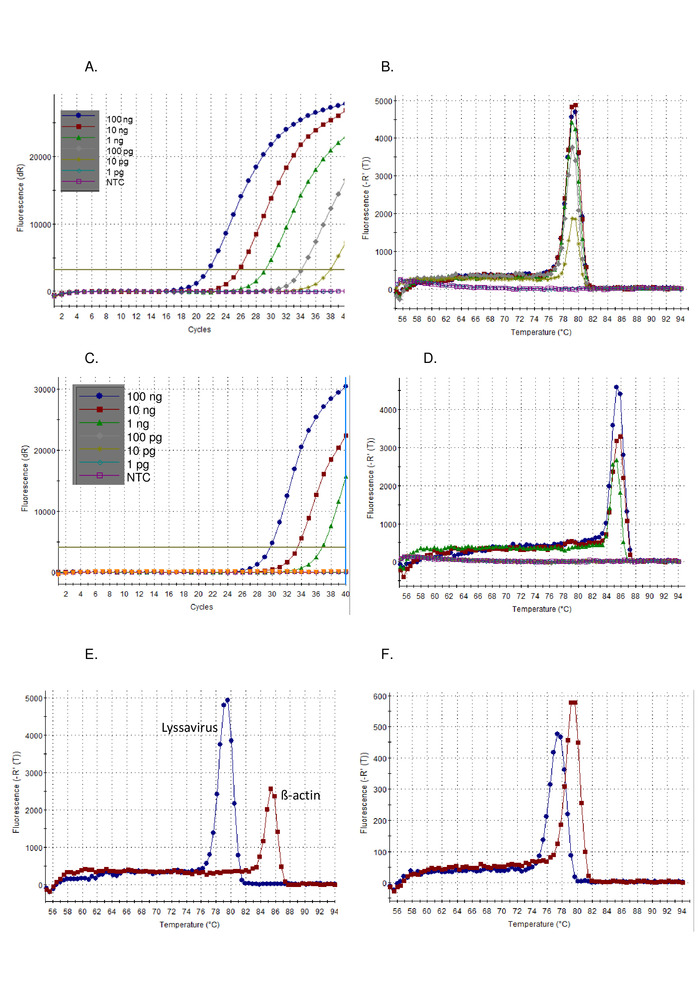
Figure 1 : dilution en série 10 fois de l'ARN de contrôle positif CVS, exécuté sur l'essai de la ruse de panlysavirus RT-PCR, visualisé comme la parcelle d'amplification (A), et courbe de dissociation (B), et exécuté sur l'essai RT-PCR de l'actine visualisée comme la parcelle d'amplification (C), et courbe de dissociation (D). NTC - pas de contrôle de modèle. Comparaison de l'ARN de contrôle CVS exécuté à la fois sur l'analyse de panlysavirus RT-PCR (bleu) et l'essai RT-PCR (rouge) de l'actine (rouge) démontrant la différence dans les courbes de dissociation (E) — voir tableau 5 pour les valeurs moyennes; et enfin des courbes de dissociation pour LBVa (bleu) et IKOV (rouge) démontrant la gamme de valeurs Tm observées à travers le genre Lyssavirus (F). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
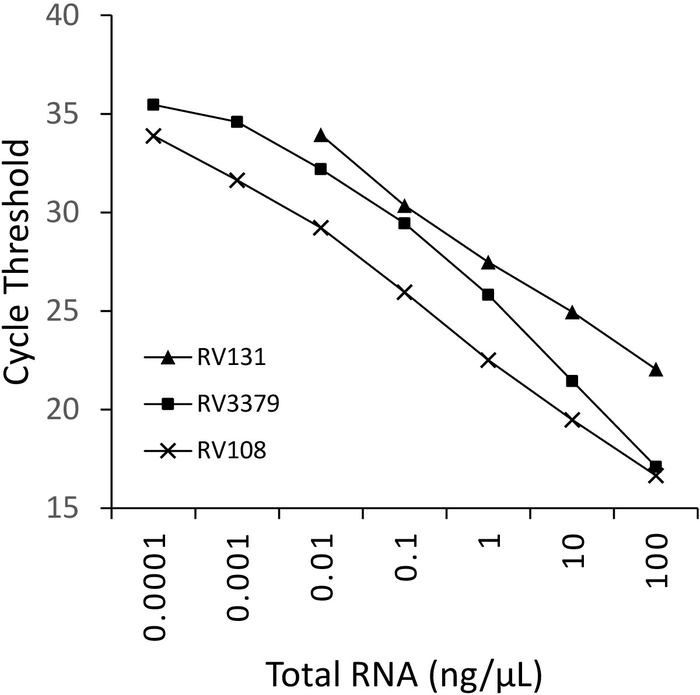
Figure 2 : dilutions en série 10 fois pour trois espèces de lyssavirus : RABV (RV108), DUVV (RV131) et ARAV (RV3379). R2 - 0,996, 0,9962 et 0,9637 respectivement. Les points de données à 10-7 (0,0001 ng/L) ont atteint la limite de détection (où une valeur a été obtenue). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
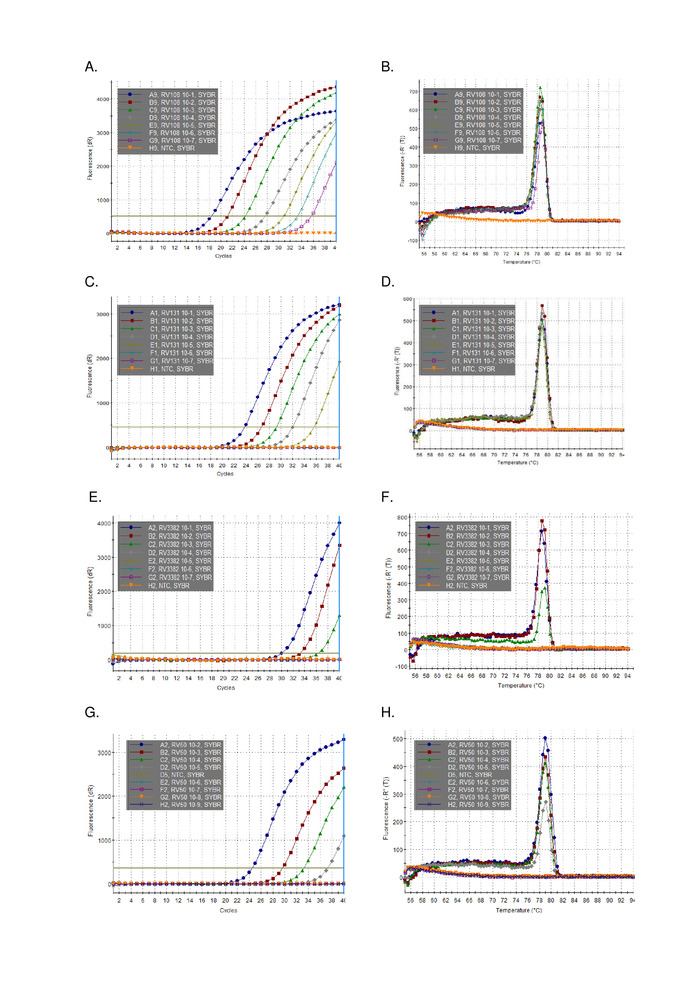
Figure 3 : Données représentatives de dilution en série 10 fois provenant de l'ensemble du genre Lyssavirus (voir légendes individuelles pour l'identité du lyssavirus et tableau 6 pour les résultats compilés par rapport à d'autres lyssavirus). Panneaux A, C, E, G et courbes d'amplification B, D, F, H pour A, C, E et G respectivement. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| réactif | L/Réaction |
| Eau de qualité moléculaire | 7,55 |
| 2x Universal RT PCR reaction mix | 10 Ans et plus |
| Primer Forward [20 M] | 0,6 |
| Primer Reverse [20 M] | 0,6 |
| Mélange d'enzymes RT | 0,25 |
| Total par réaction | 19 ans, états-unis qui |
Tableau 1 : Réagents de mixage maître RT-PCR en temps réel de Pan-lyssavirus.
| Dosage | Nom d'amorce | Rôle d'amorce | Séquence 5'-3' | Position1 |
| Lyssavirus | JW12 (en) | RT-PCR (en anglais seulement) | ATG TAA CAC CYC TAC AAT G | 53 à 73 ans |
| N165 (en) | Pcr | GCA GGG TAY TTR TAC TCA TA | 165-146 Annonces | |
| -actin | intronic-actin | Pcr | CGA TGA AGA TCA AGA TCA TTG | 1051-1072 Annonces |
| -actin inverse | RT-PCR (en anglais seulement) | AAG CAT TTG CGG TGG AC | 1204-1188 | |
| Les positions d'amorce sont données en relation avec la séquence du virus Pasteur (M13215) et la séquence de gène de souris -actine (NM-007393) | ||||
Tableau 2 : Détails de l'amorce RT-PCR en temps réel de Pan-lyssavirus.
| stade | Cycles | température | temps | Collecte de données |
| Transcription inversée | 1 Fois | 50 oC | 10 min | |
| Inactivation RT/dénaturation initiale | 1 Fois | 95 oC | 5 min | |
| amplification | 40 ans, états-unis ( | 95 oC | 10 s | |
| 60 oC | 30 s | point final | ||
| Analyse de la courbe de dissociation | 1 Fois | 9 oC | 1 min | |
| 55 oC | 1 min | |||
| 55 - 95 oC | 10 s | tous les points |
Tableau 3 : Conditions de cycle RT-PCR en temps réel de Pan-lyssavirus.
| Résultat du test | Contrôle interne de l'actine | Résultat global |
| négative | Négatif1 | Non valide. Répéter l'extraction et l'astodonte2 |
| négative | positif | Résultat négatif rapporté |
| positif | positif | Résultat positif rapporté |
| positif | Négatif1 | Répéter l'extraction et l'astodonte3 |
| 1 Fois L'utilisation de contrôle externe hétérologue serait bénéfique lors de l'extraction répétée. | ||
| 2 (en) Si un deuxième résultat négatif est obtenu pour le contrôle interne, l'échantillon sera déclaré indétestable par cet essai. | ||
| 3 (en) Si un deuxième résultat négatif est obtenu pour le contrôle interne, à côté d'un résultat positif d'un test une rage secondaire | ||
| l'essai diagnostique devrait être entrepris pour confirmer ce résultat. | ||
Tableau 4 : Sommaire des résultats et des résultats globaux pour le RT-PCR en temps réel du panlyssavirus. Négatif est désigné à un échantillon sans valeur Ct (amplification) et pas de température de fonte (dissociation), ou une température de fonte qui est en dehors de la plage de Tm pour les lyssavirus positifs (76,8 oC - 80,2 oC). Le positif est désigné à un échantillon avec une valeur Ct (amplification) et une température de fonte (dissociation) qui est à l'intérieur de la gamme Tm pour les lyssavirus positifs.
| Analyse de Lyssavirus | - -actin esay | |||
| Ct | Tm | Ct | Tm | |
| signifier | 20,66 Annonces | 78,92 | 27,5 | 85,26 |
| Sd | 0,63 | 0,16 | 1.13 (en) | 0,35 |
| LCL (95%) | à 19h39 | 78,59 | 25.23 Annonces | 84,56 |
| UCL (95%) | 21,93 | 79,25 | 29,76 Annonces | 85,96 |
Tableau 5 : Analyse inter-run du contrôle positif de CVS sur 12 pistes indépendantes, y compris plusieurs opérateurs.
| Phylogroupe (Phylogroupe) | espèce | ID de virus | Lignée | Limite de détection | Tm |
| Ⅰ | RABV (en) | RV50 (en) | Chauve-souris américaine | 10-5 Annonces | 79,5 |
| Ⅰ | RABV (en) | RV51 (en) | Renard des États-Unis | 10 à 7 ans | 77,6 |
| Ⅰ | RABV (en) | RV108 (en) | Chauve-souris du Chili | 10 à 7 ans | 78,63 |
| Ⅰ | RABV (en) | RV313 (en) | Renard européen | 10 à 9 ans | 78,53 |
| Ⅰ | RABV (en) | RV437 (en) | RacDog européen | 10 à 7 ans | 78,09 |
| Ⅰ | RABV (en) | RV1237 (en) | Cerfs d'Europe | 10 à 8 ans | 78,76 |
| Ⅰ | RABV (en) | RV334 (en) | Vaccin chinois | 10 à 8 ans | 79.03 Annonces |
| Ⅰ | RABV (en) | RV102 (en) | Afrique 2 | 10 à 7 ans | 78,58 |
| Ⅰ | RABV (en) | RV995 (en) | Afrique 3a | 10 à 8 ans | 79,66 |
| Ⅰ | RABV (en) | RV410 (RV410) | Afrique 3b | 10 à 7 ans | 79.03 Annonces |
| Ⅰ | RABV (en) | RV2324 (EN) | Afrique 4 | 10 à 7 ans | 79.17 Annonces |
| Ⅰ | RABV (en) | RV2417 (en) | Crabot du Sri Lanka | 10 à 9 ans | 78,71 |
| Ⅰ | RABV (en) | CVS-11 | 10 à 7 ans | 79.17 Annonces | |
| Ⅰ | EBLV-1 | RV20 (en) | Allemagne | 10-6 Annonces | 79,05 |
| Ⅰ | EBLV-2 | RV1787 (en) | Royaume-uni | 10 à 7 ans | 78,76 |
| Ⅰ | BBLV BBLV | RV2507 (en) | Allemagne | 10 à 9 ans | 78,71 |
| Ⅰ | ABLV (en) | RV634 (en) | 10 à 8 ans | 78,25 | |
| Ⅰ | DUVV (EN) | RV131 (en) | 10-5 Annonces | 79.03 Annonces | |
| Ⅰ | GBLV (en) | RV3269 (en) | 10 à 7 ans | 79.15 Annonces | |
| Ⅰ | Arav | RV3379 (en) | 10 à 7 ans | 79,46 | |
| Ⅰ | KHUV (en) | RV3380 (RV3380) | 10 à 7 ans | 78,97 | |
| Ⅰ | SHIBV (EN anglais seulement) | RV3381 (en) | 10 à 7 ans | 78,59 | |
| Ⅰ | IRKV (IRKV) | RV3382 (en) | 10 à 3 ans | 78,59 | |
| Ⅱ | LBVa (LBVa) | RV767 (en) | 10-5 Annonces | 77,34 | |
| Ⅱ | LBVd (LBVd) | RV3383 (en) | 10 à 7 ans | 78,59 | |
| Ⅱ | MOKV MOKV | RV4 (en) | 10 à 3 ans | 78,81 | |
| Ⅲ | IKOV (en) | RV2508 (en) | 10-5 Annonces | 79,67 | |
| Ⅲ | LLEBV (en anglais seulement) | RV3208 (RV3208) | 10 à 4 ans | 79.15 Annonces | |
| Ⅲ | WCBV WCBV | RV3384 (en) | 10 à 3 ans | 79 Annonces |
Tableau 6 : Résumé de la spécificité, de la sensibilité et du T en temps réel du panlyssavirus RT-PCR pour les lyssavirus représentatifs dans les trois phylogroupes. Le M Moyen de T à travers les lyssavirus était 78.81 (SD 0.531).
Discussion
Le test de test RT-PCR en temps réel du panlyssavirus décrit est un essai à tube fermé en une seule étape qui détecte les lyssavirus dans les trois phylogroupes. L'analyse a été validée pour le diagnostic de la rage animale et humaine, y compris le tissu cérébral post-mortem (optimaldu le tronc cérébral), et les échantillons ante-mortem tels que la biopsie de peau, la salive en série, ou le fluide céphalo-rachidien (CSF). Les amorces utilisées dans cet analyse ont d'abord été conçues et utilisées pour un analyse à base de sondes pour différencier RABV, EBLV-1 et EBLV-23, qui a été utilisé dans de nombreux laboratoires de la rage de l'OIE et effectue régulièrement dans les systèmes de compétence EURL. Par la suite, la nature «pan-lyssavirus» de ces amorces a été confirmée à l'aide d'un 2-step en temps réel d'analyse15. Le test décrit ici a utilisé les amorces pour optimiser davantage la RT-PCR dans un essai SYBR en une seule étape permettant un tube fermé, système rapide. En outre, la formation dans les pays d'endémie de la rage utilisant cet analyse a confirmé l'aptitude à mettre en œuvre dans n'importe quel laboratoire avec l'EPI de base et des systèmes de qualité pour réduire la contamination croisée et des échantillons de traces, des installations pour stocker les réactifs et un temps réel machine avec détection SYBR. L'analyse est extrêmement robuste et a 100% de corrélation avec le FAT, avec une sensibilité améliorée pour les échantillons décomposés3. L'un des principaux avantages d'un colorant intercalateur d'ADN basé sur l'analyse par rapport à un test basé sur la sonde est le coût relatif. Un avantage supplémentaire est que l'analyse n'utilise que deux amorces, donc il ya moins de risque de détection échouée en raison de la divergence de séquence, qui a été une faiblesse dans les essais précédemment publiés à base de sondes. En effet, les représentants de toutes les espèces de lyssavirus (à l'exception de TWBLV et KBLV) sont détectés à l'aide de cet analyse, et l'analyse de la séquence de TWBLV et KBLV à travers les sites d'amorce ne révèle aucune divergence significative suggérant fortement qu'ils seront également détectés en utilisant cette méthode. La plage de limite de détection observée dans les virus analysés peut être considérée comme due à deux facteurs principaux. La première est que l'ARN a été isolé du matériel clinique du cerveau, donc la quantité de copies du génome dans chaque échantillon non dilué n'est pas directement comparable. L'ARN a été « normalisé » en ajustant l'ARN total à 1 g/L; cependant, la proportion d'ARN du génome viral dans cet échantillon variera. La deuxième est la diversité des séquences de lyssavirus, malgré les sites d'amorce situés dans des régions conservées, il reste des positions de variation. Par conséquent, il n'est pas surprenant que la majorité des lyssavirus avec une sensibilité plus faible pour l'analyse sont des virus phylogroupe II et III. L'analyse de la courbe de dissociation représente un paramètre essentiel, minimisant un résultat faussement positif qui pourrait autrement se produire en raison de la formation de diététistes d'apprêt, ou de l'amplification d'une région non spécifique dans le génome hôte. En réalité, il s'agit d'un événement rare et l'analyse de la courbe de dissociation équivaut à l'exécution d'un gel d'agarose pour visualiser les amplicônes RT-PCR conventionnels de taille correcte. La gamme de valeurs tm acceptables a été fournie (77-80 oC), sur la base des données recueillies dans notre laboratoire. Il est fortement recommandé que les laboratoires individuels rassemblent des données internes pour s'assurer que la plage est transférable et modifier en conséquence. L'interprétation des résultats des parcelles d'amplification et de dissociation, ainsi que les contrôles positifs et négatifs et les résultats de l'actine, permet des résultats diagnostiques robustes et reproductibles.
En dehors de la portée de ce protocole est la méthode d'extraction de l'ARN utilisé pour obtenir de l'ARN de haute qualité. Tout l'ARN analysé dans ce protocole a été préparé utilisant TRIzol ; cependant, il existe de nombreux protocoles d'extraction d'ARN à base de guanidium appropriés disponibles, y compris des kits d'extraction à base de colonnes et de perles. La manipulation d'échantillons de lyssavirus positifs (ou présumés positifs) doit se faire dans des installations de biocontenu autorisées approuvées à l'intérieur du pays. Cependant, l'ARN total extrait est non infectieux, donc manipulé dans les laboratoires de faible confinement. Selon la méthode d'extraction utilisée, l'exigence de quantifier et de diluer l'ARN devrait être évaluée. Pour les extractions à base de phénol, y compris le TRIzol, cette étape est nécessaire et empêche l'inhibition de l'analyse de contaminer l'ADNc; cependant, les extractions à base de colonnes et de perles (en particulier celles qui ont un stade d'épuisement de l'ADN) ne nécessitent pas de dilution avant les essais.
Tout au long du protocole, il est essentiel que les soins et la diligence soient utilisés pour prévenir la contamination croisée et l'ajout précis d'échantillons aux puits corrects. Une feuille de calcul avec les calculs de réactif et la disposition de la plaque est disponible pour téléchargement en tant que fichier supplémentaire. Une bonne pratique de laboratoire, y compris des surfaces de travail propres, des changements réguliers de gants, l'utilisation de pointes de barrière et différentes pièces/armoires UV pour séparer chaque étape, réduira au minimum les risques de contamination. Pour s'assurer que le test fonctionne avec les paramètres attendus, des contrôles positifs et négatifs doivent être inclus et tous les échantillons de test exécutés en double (ou triple).
L'inclusion des contrôles est une caractéristique essentielle de tout PCR, en particulier pour les diagnostics. L'ARN de contrôle positif a été préparé à partir de cerveaux de souris infectés par CVS (défi virus standard) par lots et validé et calibré pour assurer la cohérence entre les lots. L'ARN témoin a été quantifié et dilué à 1 'g/L. L. L'ARN pour lequel un résultat positif a été obtenu dans une dilution sérielle jusqu'à au moins 10-4 (égal à 100 pg/L) a été jugé apte à l'usage. L'ARN de contrôle positif a été stocké à -80 oC dans 10-1 aliquots. Au besoin, un aliquot a été dilué 1:100 pour fournir un stock de travail à 1 ng/L et stocké à -80 oC dans 5 aliquots à usage unique. L'ARN de contrôle positif dilué a été utilisé pour représenter des échantillons positifs de faible niveau et pour s'assurer que toute réduction de la sensibilité de l'analyse a été détectée. Une « carte de contrôle » a été conservée pour chaque contrôle afin de surveiller les valeurs Ct et d'identifier les tendances (tableau 5). Le tableau 5 a démontré une bonne comparabilité intermanche pour les valeurs de l'échantillon de contrôle positif CVS Ct et Tm sur plusieurs jours et les opérateurs, ce qui a donné l'assurance que l'essai est robuste et reproductible. Les résultats qui s'écartent de ces mesures doivent être étudiés et tester des échantillons répétés si nécessaire. L'eau de qualité moléculaire a été incluse dans chaque course comme NTC pour confirmer que les réactifs étaient exempts de contamination par l'ARN de lyssavirus et confirmer un échantillon négatif. De plus, pour assurer l'efficacité de l'extraction de l'ARN, l'actine a été testée à côté des échantillons d'essai dans un tube séparé. L'ARN de contrôle positif de lyssavirus a été également employé pour le contrôle positif de l'actine. D'autres gènes endogènes ou systèmes de contrôle interne hétérologues peuvent être utilisés. L'utilisation de ces contrôles a permis de s'assurer que toutes les étapes étaient analysées dans les mêmes conditions que les échantillons d'essai. De temps en temps, si l'échantillon était fortement dégradé ou ne contenait pas suffisamment d'ARN hôte (comme la salive ou le CSF), le gène endogène PCR peut échouer. Dans ce cas, où le résultat RT-PCR en temps réel du lyssavirus était positif, confirmation sur une extraction indépendante d'ARN - pour exclure la contamination pendant l'extraction d'ARN sur le test original ou par un essai secondaire (moléculaire, tel que RT-PCR conventionnel) , ou FAT. L'utilisation du tableau 4 lors de l'analyse d'un échantillon diagnostique a assuré la bonne interprétation.
Indépendamment de l'analyse moléculaire utilisée pour confirmer l'infection à la rage, des enquêtes de suivi utilisant le séquençage de Sanger pour déterminer l'espèce de lyssavirus et les techniques classiques en virologie telles que la FAT ou l'isolement de virus devraient également être entreprises pour permettre d'autres caractérisations virales et soutiennent la notification de cas positifs à l'OIE et à l'OMS.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tiennent à remercier Mlle Emma Wise et Miss Megan Golding pour leur aide dans la réalisation des expériences. L'élaboration de ce protocole a été soutenue financièrement par le ministère britannique de l'Environnement, de l'Alimentation et des Affaires rurales (Defra), le gouvernement écossais et le gouvernement gallois par des subventions [SV3500, et SE0431] et par le projet global European Virus Archive (EVAg) qui a a reçu un financement du programme de recherche et d'innovation Horizon 2020 de l'Union européenne dans le cadre de l'accord de subvention no 653316.
matériels
| Name | Company | Catalog Number | Comments |
| Art Barrier pipette tips (various sizes) | Thermofisher | various | |
| Centrifuge | Beckman | Allegra 21R | Rotor capable of holding 96 well plates required. Step 3.8. |
| Centrifuge (mico) | Sigma | ||
| Finnpipettes (to dispense 0.5-1,000 µL) | Thermofisher | various | |
| iTaq Universal SYBR Green One-Step RT-PCR kit | Bio-Rad | 172-5150 | Equivalent kits can be used if validated |
| MX3000P or MX3005P real-tme PCR system | Stratagene | N/A | Eqivalent machines can be used if validated |
| MicroAmp reaction plate base | Any suitable | Used to hold tube strip and plates securely. | |
| Optically clear flat clear strips (8) | ABgene | AB-0866 | |
| Perfect fit frame (if using tube strips) | Stratagene | N/A | Specific to machine |
| Primers: for primer details see Table 2. | Ordered at 0.05 µmole scale HPLC purified. | ||
| Thermo-Fast 96 well plares, non skirted | ABgene | AB-600 | |
| Thermo-Fast strips (8) Thermo-tubes | ABgene | AB-0452 | |
| Vortex machine / Whirlimixer | Fisons Scientific equipment | SGP-202-010J | |
| Unless stated, alternative equipment can be used |
Références
- . OIE. OIE Terrestrial Manual 2018. , 8-14 (2018).
- Panning, M., et al. Comparative analysis of rabies virus reverse transcription-PCR and virus isolation using samples from a patient infected with rabies virus. Journal of Clinical Microbiology. 48 (8), 2960-2962 (2010).
- Wakeley, P. R., et al. Development of a real-time, TaqMan reverse transcription-PCR assay for detection and differentiation of lyssavirus genotypes 1, 5, and 6. Journal of Clinical Microbiology. 43 (6), 2786-2792 (2005).
- Wang, L., et al. A SYBR-green I quantitative real-time reverse transcription-PCR assay for rabies viruses with different virulence. Virologica Sinica. 29 (2), 131-132 (2014).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR Assay for the Detection of Highly Variable Rabies virus and Other Lyssaviruses. PLOS Neglected Tropical Diseases. 11 (1), e0005258 (2017).
- Nadin-Davis, S. A., Sheen, M., Wandeler, A. I. Development of real-time reverse transcriptase polymerase chain reaction methods for human rabies diagnosis. Journal of Medical Virology. 81 (8), 1484-1497 (2009).
- Hoffmann, B., et al. Improved safety for molecular diagnosis of classical rabies viruses by use of a TaqMan real-time reverse transcription-PCR "double check" strategy. Journal of Clinical Microbiology. 48 (11), 3970-3978 (2010).
- Faye, M., et al. Development and validation of sensitive real-time RT-PCR assay for broad detection of rabies virus. Journal of Virological Methods. 243, 120-130 (2017).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLOS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Fooks, A. R., et al. Rabies. Nature Reviews Disease Primers. 3, 17091 (2017).
- Marston, D. A., et al. Ikoma lyssavirus, highly divergent novel lyssavirus in an african civet. Emerging Infectious Diseases. 18 (4), 664-667 (2012).
- . Virus Taxonomy: 2018 Release: Email ratification October 2018 (MSL #33) Available from: https://talk.ictvonline.org/taxonomy/ (2018)
- Hu, S. C., et al. Lyssavirus in Japanese Pipistrelle, Taiwan. Emerging Infectious Disease. 24 (4), 782-785 (2018).
- Nokireki, T., Tammiranta, N., Kokkonen, U. M., Kantala, T., Gadd, T. Tentative novel lyssavirus in a bat in Finland. Transboundary and Emerging Diseases. 65 (3), 593-596 (2018).
- Hayman, D. T., et al. A universal real-time assay for the detection of Lyssaviruses. Journal of Virological Methods. 177 (1), 87-93 (2011).
- Calisher, C. H., et al. Antigenic relationships among rhabdoviruses from vertebrates and hematophagous arthropods. Intervirology. 30 (5), 241-257 (1989).
- Aznar-Lopez, C., et al. Detection of rhabdovirus viral RNA in oropharyngeal swabs and ectoparasites of Spanish bats. Journal of General Virology. 94 (1), 69-75 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon