Method Article
Pan-lyssavirus in tempo reale RT-PCR per la diagnosi di rabbia
In questo articolo
Riepilogo
Questo RT-PCR in tempo reale utilizzando dsDNA tintura intercalating è adatto per diagnosticare le infezioni da lyssavirus. Il metodo inizia con l'RNA estratto dalla rabbia sospetti campioni ante mortem o post-mortem, dettagliando la preparazione del mix master, l'aggiunta di RNA, l'impostazione della macchina in tempo reale e la corretta interpretazione dei risultati.
Abstract
I test molecolari sono rapidi, sensibili e specifici e sono diventati centrali nella diagnosi della rabbia. I test basati sulla PCR sono stati utilizzati per decenni per confermare la diagnosi della rabbia, ma solo di recente sono stati accettati dall'OIE (Organizzazione mondiale per la salute animale) come metodo primario per rilevare l'infezione da rabbia. I test RT-PCR in tempo reale forniscono dati in tempo reale e sono sistemi a tubi chiusi, riducendo al minimo il rischio di contaminazione durante l'installazione. I saggi RT-PCR in fluorocrocromo fluorocromo del DNA non richiedono sonde costose, riducendo al minimo il costo per campione, e quando i primer sono progettati in regioni conservate, analisi specifiche tra i generi di virus piuttosto che specifiche per un solo virus specie sono possibili. Qui descriviamo un saggio RT-PCR in tempo reale di pan-lyssavirus che rileva i lyssavirus attraverso il genere Lyssavirus, compresi i virus più divergenti IKOV, WCBV e LLEBV. In combinazione con l'analisi della curva di dissociazione, questo saggio è sensibile e specifico, con il vantaggio di rilevare tutte le specie di lyssavirus. Il test è stato adottato in molti laboratori diagnostici con ambienti di qualità garantiti, consentendo una diagnosi robusta, rapida e sensibile di casi di rabbia animale e umana.
Introduzione
La diagnosi di rabbia con metodologie molecolari è stata accettatadall'OIE nel 2018 1, riconoscendo i vantaggi di queste tecniche nel confermare i casi di rabbia, in particolare in situazioni in cui i campioni sono sub-ottimali, o per la diagnosi ante-mortem, in quanto non vi è alcun requisito per virus dal vivo o campioni freschi. I saggi PCR per i lissavirus richiedono una trascrizione inversa (RT) prima che la PCR possa iniziare quando il genoma è l'RNA. I saggi RT-PCR che rilevano la regione prossimale 3' del genoma sono considerati i più sensibili, poiché i gradienti trascrizionali si verificano durante la replicazione del lyssavirus. I saggi RT-PCR comunemente usati possono essere suddivisi in due categorie: fine punto (o basato su gel) e in tempo reale. Entrambi gli approcci sono sensibili e specifici; tuttavia, il test in tempo reale presenta alcuni vantaggi aggiuntivi, come ottenere risultati in "tempo reale" ed essere eseguito in un sistema di tubi completamente chiuso, riducendo così il potenziale di contaminazione dell'operatore. Ci sono due approcci principali per rilevare gli amplificatori specifici del lyssavirus ottenuti utilizzando saggi in tempo reale. Il primo utilizza sonde di idrolisi (come le sonde TaqMan) che contengono un fluoroforo e un quencher. Quando la sonda si lega alla regione di destinazione durante l'amplificazione, l'attività di esonucalea della polimerasi determina la dissociazione del fluoroforo e del quencher, consentendo di misurare la fluorescenza risultante. Il secondo utilizza un colorante intercalante del DNA (fluorocromo come SYBR Green) che si lega al DNA a doppio filamento durante l'amplificazione. I fluorocromi legati emettono fluorescenza che viene rilevata ad ogni ciclo, consentendo il rilevamento e la quantificazione in tempo reale del prodotto. A causa della natura non specifica del legame con qualsiasi dsDNA, viene effettuata un'analisi della curva di dissociazione per confermare la specificità della reazione. Gli RT-PCR in tempo reale sono rapidi a causa delle piccole dimensioni dell'amplificatore, in genere meno di 200 bp di lunghezza; tuttavia, identificare le regioni idonee per progettare primer e sonde in regioni conservate può rivelarsi impegnativo, quindi rimuovere il requisito di una sonda è un netto vantaggio.
Un certo numero di RT-PCR in tempo reale sono stati progettati per rilevare specificamente singoli ceppi o lignaggi di RABV2 e anche per rilevare lyssavirus in tutto il genere3,4,5,6, 7,8,9. Tutti i saggi avranno un limite di rilevamento a seconda di quanto conservato il primer (e se necessario, la sonda) sequenze sono attraverso il genere. In effetti, ceppi di virus emergenti o nuovi possono rendere inefficaci i saggi basati su sonde altamente specifici. La scelta del rilevamento in tempo reale (colorante vs sonda) dipenderà dall'applicazione desiderata. Per un laboratorio che conduce la sorveglianza su materiale cerebrale di provenienza locale e si aspetta un numero elevato di campioni negativi, l'uso del tintura intercalato più economico è una scelta sensata. L'approccio SYBR Green sarebbe anche ottimale quando si conduce la sorveglianza a scansione in cui la presenza di nuovi o divergenti lissavirus sarebbe rimasta inosservata da analisi basate su sonde più ristrette.
Tutti i membri del genere Lyssavirus causano la malattia rabbia, che è fatale una volta che compaiono i sintomi. La stragrande maggioranza dei casi di rabbia umana e animale è dovuta al virus della rabbia (RABV), il serbatoio dominante per il quale è il cane domestico10. I pipistrelli sono importanti serbatoi di accoglienza per i lissavirus e tutte le specie di lyssavirus tranne due caratterizzate sono state identificate direttamente nei pipistrelli - Ikoma lyssavirus (IKOV) e Mokola virus (MOKV) - e di questi due, IKOV è stato ipotizzato di avere un serbatoio di ospite pipistrico 11.Oltre alle 16 specie di lissavirus riconosciute12, ci sono due lyssavirus che sono stati recentemente descritti: Taiwan bat lyssavirus (TWBLV)13 e Kotalahti bat lyssavirus (KBLV)14. I lissavirus possono essere geneticamente divisi in tre filogruppi, con la maggior parte dei lissavirus, tra cui RABV, appartenenti al filogruppo I. Tuttavia, i lissavirus più divergenti appartengono al filogruppo III ed è improbabile che vengano rilevati da RT-PCR progettati per colpire le sequenze di virus RABV o phylogroup I.
L'esempio qui descritto utilizza la coppia di primer in tempo reale JW12-N165, descritta per la prima volta nel 20053. I primer sono stati progettati per essere pan-lyssavirus anche se l'applicazione originale era come un saggio TaqMan con sonde per differenziare le specie di lyssavirus. La successiva conferma che la coppia primer era pan-lyssavirus in specificità è stata raggiunta utilizzando un 2-step SYBR analisi in tempo reale su tutte le specie di lyssavirus disponibili tra cui WCBV15. La coppia di primer è descritta qui in un saggio RT-PCR in tempo reale che utilizza un fluorocro intercalante, convalidato utilizzando rappresentanti di tutte le 16 specie lissavirus riconosciute. Questo saggio in tempo reale in un solo passaggio è un'analisi rapida, sensibile, specifica del lissavirus e dimostra che la robustezza del primer impostato per identificare anche le specie di lissavirus altamente divergenti.
Protocollo
Campioni di materiale diagnostico ricevuti all'APHA dopo l'infezione naturale o ottenuti inoculando i topi utilizzando protocolli valutati dal comitato etico e statistico dell'APHA ai sensi delle normative del Consiglio degli Interni del Regno Unito sotto licenza 70/7394.
1. Quantificazione dell'RNA utilizzando uno spettrometro microvolume
- Assicurarsi che le impostazioni dello spettrofotometro siano impostate sull'RNA.
- Utilizzare 1-2 l di acqua di grado molecolare per inizializzare la macchina e impostare una linea di base.
- Utilizzare 1-2 l di ogni campione di RNA di prova per valutare la quantità di RNA.
- Salvare le letture e il documento.
- Se necessario, regolare l'RNA a 1 g/L.
NOT: L'RNA deve essere tenuto sempre sul ghiaccio (o in un blocco freddo). Se l'RNA viene ottenuto utilizzando una colonna, o un metodo basato sul tallone, l'RNA è di solito inferiore a 1 g/ l. In questa situazione utilizzare l'RNA pulito.
2. Preparazione della serie di diluizione dell'RNA per determinare la sensibilità del punto finale
-
Effettuare una diluizione seriale di 10 volte dell'RNA.
- Tubi di etichettatura con la serie di diluizione (ad esempio, 10-1, 10-2,ecc.) e i dettagli dell'RNA.
- Aggiungere 45 -L di acqua di grado molecolare ad ogni tubo.
- Aggiungere 5 - L dell'RNA (precedentemente diluito a 1 g/l) e mescolare bene.
- Smaltire la punta della pipetta nel disinfettante appropriato e sostituirla con una punta fresca.
- Prendere 5 l dal 10-1 e aggiungere a 10-2 tubo e mescolare bene.
- Ripetere 2.1.3-2.1.5 con le diluizioni rimanenti.
NOT: L'RNA deve essere tenuto sempre sul ghiaccio (o in un blocco freddo).
3. Preparazione delle reazioni RT-PCR in tempo reale
- Utilizzando un foglio di calcolo, pianificare il layout della piastra in base al numero di campioni di prova e campioni di controllo, sia per i saggi lyssavirus che per i saggi di influenza.
NOT: Se 4 campioni devono essere testati in duplicato con un controllo positivo e negativo, ciò equivale a 10 reazioni per entrambi i saggi. - In una "stanza pulita" o in un'area separata dal modello di RNA, pulire le superfici con un disinfettante appropriato prima di utilizzare o preparare una workstation PCR (se usato). Per preparare la postazione di lavoro, pulire la superficie dell'armadio con un disinfettare appropriato e posizionare gli elementi necessari nella postazione di lavoro e chiudere le porte. Accendere la luce UV per 10 minuti
- Rimuovere reggenti e primer dal congelatore e disgelo (reagenti elencati nella tabella 1 e primer nella tabella 2).
NOT: La miscela enzimatica è immagazzinata in glicerolo in modo da non richiedere lo scongelamento e deve essere mantenuta sul ghiaccio (o in un blocco fresco) in ogni momento. Tutti gli altri reagenti possono essere sconfuti a temperatura ambiente. - Una volta scongelato, mescolare brevemente i reagenti e la centrifuga per raccogliere il liquido.
NOT: Non vorare la miscela enzimatica, basta centrifugare brevemente. - Preparare miscele master separate per lyssavirus e z-actin. Per ogni reazione, aggiungere 7,55 ll di acqua di grado molecolare, 10 -L di 2x Miscela di reazione verde SYBR universale, 0,6 l di primer in avanti, 0,6 l di primer inverso, 0,25 l di mix enzimatico iTaq RT.
- Utilizzare un foglio di calcolo per calcolare i volumi corretti per evitare errori nel calcolo manuale. Assicurarsi che un numero sufficiente di master-mix sia pronto per compensare l'errore di pipettaggio. Pertanto, se sono necessarie 10 reazioni (vedere NOTA in 3.1), preparare 12 reazioni
- Preparare il master-mix sul ghiaccio (o in un blocco fresco) e rimanere sul ghiaccio fino a quando non viene inserito nella macchina in tempo reale.
- Mescolare brevemente le miscele master preparate, centrifugare e erogare 19 gradi in relativi pozzi di tubi a strisce o in un pozzo da 96 appiattina compatibile con la macchina in tempo reale in uso.
NOT: Ridurre al minimo la produzione di bolle nei pozzi durante la pipettatura. - In una stanza separata, o in un armadio UV preparato come descritto nella 3.2, aggiungere con attenzione 1 l'RNA precedentemente regolato a 1 g/L (vedi passo 1,5) sotto la superficie del pozzo master-mix appropriato e mescolare delicatamente. Scartare la punta della pipetta in disinfettante direttamente dopo l'uso (sotto la superficie).
- Aggiungere i controlli dopo i campioni di test, con il controllo positivo aggiunto successivamente e il controllo nessun modello (NTC – acqua di grado molecolare) aggiunto per ultimo. La quantità di RNA utilizzata può essere modificata a seconda del tipo di campione e l'estrazione dell'RNA utilizzato. La quantità utilizzata deve essere convalidata per garantire che la reazione sia ottimizzata.
- Piastra di sigillazione utilizzando coperchi a strisce o sigillanti preparate per garantire che tutti i coperchi siano saldamente chiusi ed etichettati sufficientemente per orientare i campioni. Etichettare il bordo dei tubi piastra/striscia.
- Girare i campioni utilizzando una centrifuga per raccogliere tutto il liquido sul fondo dei pozzi.
- Trasferire la piastra alla macchina PCR in tempo reale, aprire la porta e posizionare nel supporto assicurando la corretta posizione / orientamento dei campioni secondo il layout della piastra.
NOT: Se vengono utilizzate strisce di tubi, assicurarsi che il supporto sia in posizione. - Apri il programma di macchine PCR in tempo reale e scegli l'opzione per l'esperimento in tempo reale SYBR con la curva di dissociazione. Programmare la macchina PCR in tempo reale utilizzando le condizioni di ciclo termico specificate nella tabella3, inclusi i punti di raccolta dati.
- Selezionare SYBR come tipo di tintio fluorescente e sconosciuto come tipo di campione e inserire un nome nella casella del nome del campione corretto.
NOT: Differenziare tra le repliche e anche tra il lissavirus e i pozzi di z-actin. - Scegliere un percorso di file per salvare i dati sperimentali, assicurarsi che la lampada verrà spenta alla fine della corsa, quindi avviare la corsa.
NOT: Poiché il primo passo è una fase RT, non vengono raccolti dati durante questo periodo, quindi, se la lampada richiede un periodo di riscaldamento questo può verificarsi durante la fase RT. La macchina e il software in tempo reale visualizzeranno le curve di amplificazione in tempo reale, mentre la curva di fusione verrà generata alla fine del ciclo.
4. Analisi dei dati
-
Una volta completata l'esecuzione, eseguire l'analisi dei dati come indicato di seguito.
- Analizzare innanzitutto i risultati del grafico di amplificazione dei campioni di prova insieme ai campioni di controllo. I campioni positivi visualizzano rampe esponenziali, di solito seguite da plateau e da un valore C t. I campioni negativi visualizzano i grafici di amplificazione piatta senza valori Ct (Figura1A). Il valore Ct viene calcolato automaticamente dal software, anche se questo dovrebbe essere controllato e modificato manualmente se necessario.
- In secondo luogo, analizzare i risultati della curva di dissociazione dei campioni di prova insieme ai campioni di controllo. Un campione positivo avrà una temperatura di fusione (Tm) 77 – 80 gradi centigradi, e si sovrappone alla figura di controllo positivo 1B).
- Ottenere il risultato diagnostico complessivo assicurandosi che i controlli siano validi. Utilizzare la tabella 4 per interpretare i risultati in relazione al controllo interno dell'actina . Se i campioni di controllo positivi sono negativi e/o i campioni negativi sono positivi, la corsa deve essere ignorata.
- Registrare i valori Ct e Tm ottenuti per l'RNA di controllo in una "scheda di controllo" per consentire l'analisi delle tendenze e aiutare a identificare le derive nella sensibilità del saggio.
Risultati
Seguendo il protocollo descritto sopra, la sensibilità del pan-lyssavirus RT-PCR è stata dimostrata su una serie di diluizione del virus standard di controllo (CVS) (Figura 1) e una serie di altri lissavirus (Figura 2eFigura 3). Il colorante SYBR Green I è stato utilizzato come un RT-PCR universale in un solo passaggio, dove la sintesi cDNA e l'amplificazione PCR vengono effettuate in un unico tubo. Quando si verifica l'amplificazione del bersaglio specifico, più coloranti è legato, con conseguente aumento in tempo reale dei livelli di fluorescenza. Tutti i saggi in tempo reale che intercalano il colorante devono essere interpretati in due fasi: amplificazione e dissociazione. La fase di amplificazione è identica a qualsiasi amplificazione in tempo reale (Figura 1A). C'è una "fase precoce" lineare durante i primi cicli in cui l'amplificazione del DNA non può essere calcolata a causa di un segnale insufficiente in relazione allo sfondo. La lunghezza di questo è direttamente correlata alla quantità di obiettivo nel campione. Successivamente, c'è una fase esponenziale in cui il raddoppio delle molecole di DNA viene rilevato e registrato. Infine, viene raggiunta la fase dell'altopiano (a parte i campioni altamente diluiti che potrebbero non raggiungere questa fase prima della fine del programma). In questa fase, l'intensità della fluorescenza si livella, a causa dell'esaurimento dei reagenti. I grafici di amplificazione osservati utilizzando una diluizione seriale di 10 volte di CVS, conforme ai grafici attesi (Figura 1Asec) in cui il saggio di lyssavirus ha dimostrato una sensibilità maggiore rispetto all'analisi di z-actin. La curva di dissociazione è stata calcolata dopo l'amplificazione, dove il dsDNA è stato dissociato in ssDNA da un aumento incrementale della temperatura e dalla fluorescenza monitorata in funzione della temperatura (Figura 1B, D-F). La temperatura soglia alla quale l'amplificatore specifico si dissocia in ssDNA, ha causato un rilascio di fluorescenza, misurato dal software termociclore (Tm). Questa fase di dissociazione ha fornito dati sulle dimensioni dell'amplificatore, consentendo all'utente di interpretare il risultato rispetto a un controllo positivo, con conseguente probabilità trascurabile di risultati falsi positivi. La Tmosservato per la CVS utilizzando il saggio pan-lyssavirus (Figura 1B) e il saggio di z-actin (Figura 1D) sono distinti e hanno aiutato l'utente a confermare la corretta analisi del saggiomottenuto (Figura 1E). Inoltre, la CTe Tmi valori tra le corse e gli operatori sono stati valutati e si sono dimostrati riproducibili (Tabella n. 5). La soglia utilizzata per calcolare ilTil valore è stato calcolato automaticamente dal software e dipende da molti fattori, tra cui il mix di reazione o lo strumento utilizzato. Nel corso dei 12 punti indipendenti la media CTera 20,66 (SD 0,63) per il saggio lyssavirus e 27,5 (SD 1.13) per il saggio di e-actin. Al contrario, la variazione osservata nelmsono stati nettamente inferiori, a causa della mancanza di influenze esterne su questa misurazione. Ad esempio, la media Tmper il saggio CVS lyssavirus era 78.92 (SD 0.16) (Tabella n. 5), rispetto alla media di tutti i lissavirus 78,81 c (SD 0,531) (Tabella n. 6eFigura 1F). Questa mancanza di variazionemin tutto il Lyssavirusgenere è vantaggioso in quanto lo stesso RNA di controllo può essere utilizzato indipendentemente dal lyssavirus nel campione, tuttavia differenziando tra le specie di lissavirus utilizzando il Tmnon è possibile, in particolare perché diversi sotto-lineagi RABV abbracciavano la gamma di Tmvalori osservati (Tabella n. 6). Le trame di amplificazione non specifiche sono raramente osservate con questo saggio; tuttavia, sono necessari parametri specifici per definire un risultato positivo rispetto a un risultato negativo non specifico. La SD osservata in tutti i licisavirus (0,531) è stata applicata al più basso (77.34 - LBVa) e più alto (79.67 - IKOV) osservato Tmper impostare un intervallo di 76,8 gradi centigradi - 80,2 gradi centigradi per le bande specifiche positive. Pertanto, Tmvalori al di fuori di questo intervallo sono stati considerati non specifici e quindi un risultato negativo. Occasionalmente vengono osservati più picchi per un campione. Se il picco dominante si trova alm(per ogni replica) quindi il campione è considerato positivo. Il motivo più comune per cui si osserva un picco non specifico è dovuto ai primer-dimer, il saggio è stato ottimizzato per ridurre al minimo i dimeri primer. I dimeri Primer in genere si traducono in un'ampia con un'ampiezza più piccola di quella della sequenza di destinazione,minferiore al prodotto specifico.
Una diluizione seriale di 10 volte di tre RNA positivi di campionamento cerebrale lyssavirus estratti utilizzando TRIzol, sono stati eseguiti in parallelo e tracciati (Figura 2). Il limite di rilevamento per i tre lyssavirus variava, ma nessuno superava Ct 36. I valori del coefficiente R2 per i virus tracciati nella Figura 2 variavano da 0,9637 e 0,996. Per tutti i virus analizzati (Tabella 6) l'intervallo non ha superato questo valore, inoltre, 7 dei 29 licienziai avevano R2 >0.99 (dati non mostrati). Tenendo conto che la preparazione della serie di diluizione proviene da estrazioni totali di RNA, la linearità osservata fornisce la prova che il saggio è robusto. Infine, è stato studiato il rilevamento di tutte le specie di lyssavirus (in particolare i più diversi virus del filogruppo III) utilizzando un pannello di RNA che copre tutti e tre i filogruppi del genere Lyssavirus. L'RNA estratto da topi originali o infetti sperimentalmente, materiale cerebrale, è stato utilizzato utilizzando i protocolli descritti in precedenza. I risultati confermano che i primer amplificano tutte le specie di lyssavirus, compresi i divergenti filogruppo III lyssavirusi IKOV, WBCV e LLEBV (tabella6 e Figura 3). Un gruppo eterogeneo di rhabdovirus non-lyssavirus, originariamente raccolti e analizzati antigeneticamente16, e più recentemente geneticamente17 sono stati sottoposti a screening e non è stata rilevata una reattività senza attraversamento, indicando che i primer sono specifici per membri del genere Lyssavirus (dati non mostrati). Il saggio pan-lyssavirus in tempo reale è stato incluso nei sistemi di competenza interlaboratorio EURL (EU Reference Laboratory) dal 2013, dimostrando la concordanza al 100% con altri saggi molecolari come l'assaggio pan-lyssavirus TaqMan e il test RT-PCR convenzionale in aggiunta al FAT (Fluorescent efluorescente Antibody test).
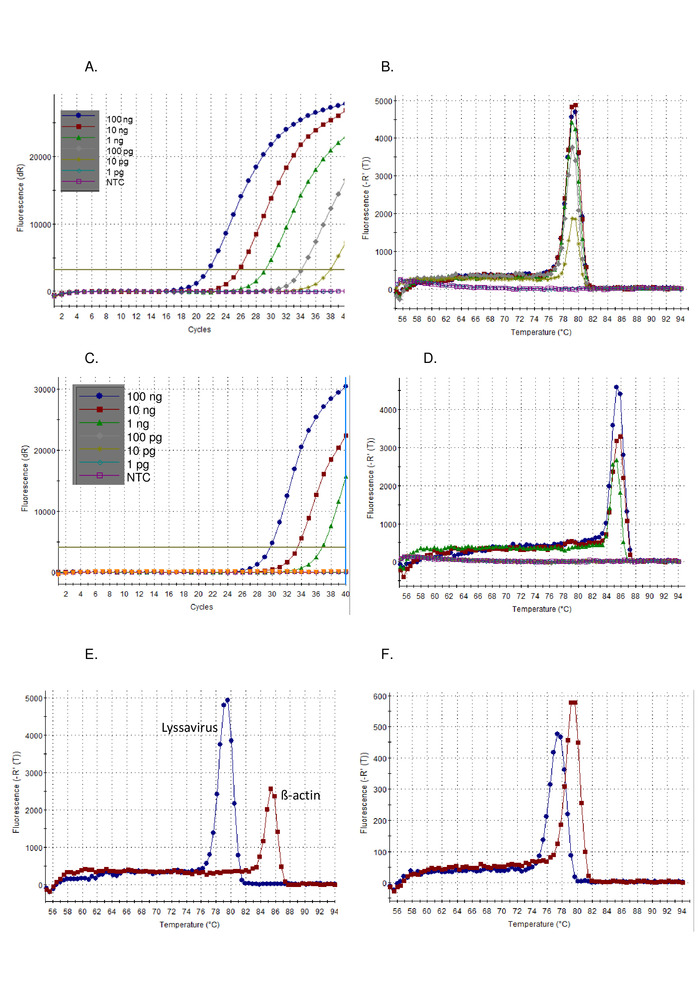
Figura 1: diluizione seriale di 10 volte dell'RNA di controllo positivo CVS, eseguita sull'analizzatore RT-PCR pan-lyssavirus, visualizzata come grafico di amplificazione (A) e curva di dissociazione (B), ed eseguita sul saggio RT-PCR di z Actin visualizzato come il grafico di amplificazione (C) e la curva di dissociazione (B), ed eseguita sul saggio RT-PCR di zActin s,visualizzato come grafico di amplificazione (C) e curva di dissociazione (D). NTC: nessun controllo del modello. Confronto tra l'RNA di controllo CVS eseguito sia sull'asdetto rt-PCR del pan-lyssavirus (blu) che sull'indice RT-PCR (rosso) che dimostra la differenza nelle curve di dissociazione (E), vedere la tabella 5 per i valori medi; e infine le curve di dissociazione per LBVa (blu) e IKOV (rosso) che dimostrano la gamma di valori Tm osservati in tutto il genere Lyssavirus (F). Fare clic qui per visualizzare una versione più grande di questa figura.
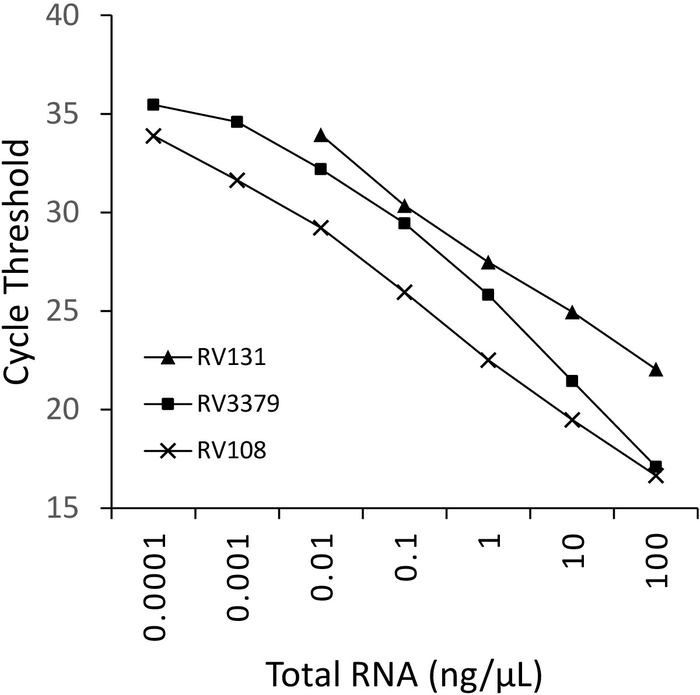
Figura 2: diluizioni seriali di 10 volte per tre specie di lyssavirus: RABV (RV108), DUVV (RV131) e ARAV (RV3379). R2 - 0,996, 0,9962 e 0,9637 rispettivamente. I punti dati a 10-7 (0,0001 ng/L) hanno raggiunto il limite di rilevamento (dove è stato ottenuto un valore). Fare clic qui per visualizzare una versione più grande di questa figura.
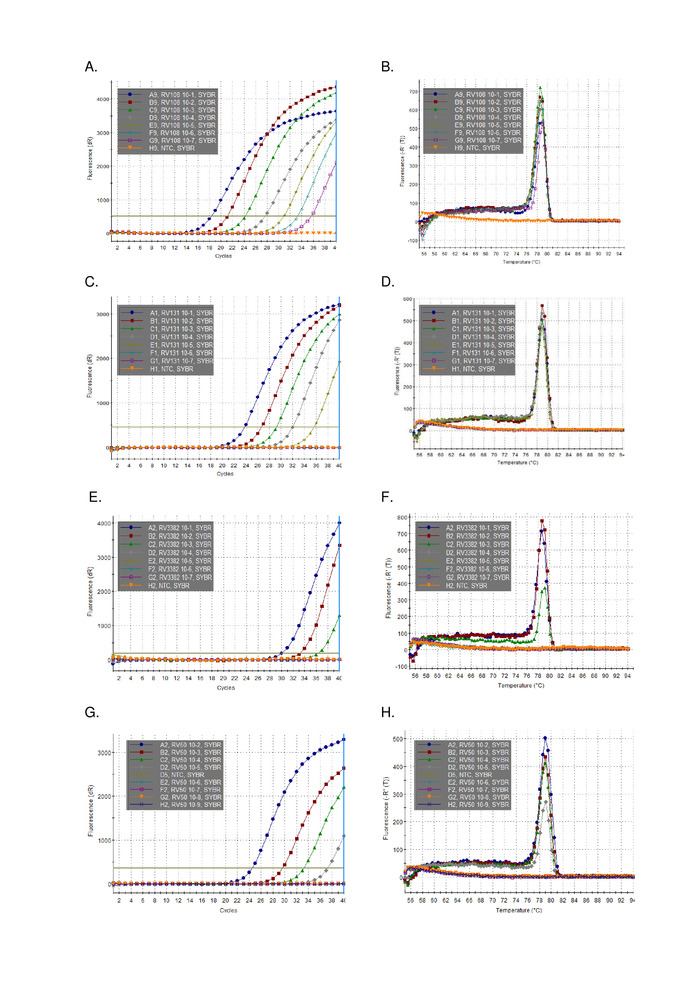
Figura 3: Rappresentativo di dati di diluizione seriale di 10 volte da tutto il genere Lyssavirus (vedi le singole leggende per l'identità lyssavirus e tabella 6 per i risultati tabulati in confronto ad altri lyssavirus). Pannelli A, C, E, G di stampa di amplificazione e B, D, F, H delle curve di dissociazione rispettivamente per A, C, E e G. Fare clic qui per visualizzare una versione più grande di questa figura.
| Reagente | L/Reazione |
| Acqua di grado molecolare | 7.55 (in questo stato del documento) |
| 2x Miscela di reazione PCR RT universale | 10 del sistema |
| Primer Avanti [20 M] | 0,6 (in inglese) |
| Primer Reverse [20 M] | 0,6 (in inglese) |
| Miscela di enzimi RT | 0,25 |
| Totale per reazione | 19 del 12 |
Tabella 1: Reagenti di mix master RT-PCR in tempo reale.
| Analisi | Nome primer | Ruolo Primer | Sequenza 5'-3' | Posizione1 |
| Lyssavirus | JW12 (in questo gè) | RT-PCR | ATG TAA CAC CYC TAC AAT G | 53-73 |
| N165 (in inglese) | Pcr | GCA GGG TAY TTR TAC TCA TA | 165-146 | |
| Actina a z | intronica di z-actin | Pcr | TGA TGA AGA AGA TGA TTG | 1051-1072 |
| z-actin inverso | RT-PCR | AAG CAT TTG CGG TGG AC | 1204-1188 | |
| Le posizioni dei Primer sono date in relazione alla sequenza del virus Pasteur (M13215) e alla sequenza genica del mouse -actin (NM_007393) | ||||
Tabella 2: Dettagli primer RT-PCR Pan-lyssavirus in tempo reale.
| Palco | Cicli | temperatura | ora | Raccolta dati |
| Trascrizione inversa | 1 : il nome del | 50 gradi centigradi | 10 min | |
| inattivazione RT/denaturazione iniziale | 1 : il nome del | 95 gradi centigradi | 5 min | |
| Amplificazione | 40 anni ( | 95 gradi centigradi | 10 s | |
| 60 gradi centigradi | 30 s | punto finale | ||
| Analisi della curva di dissociazione | 1 : il nome del | 9 cC | 1 min | |
| 55 gradi centigradi | 1 min | |||
| 55 - 95 gradi centigradi | 10 s | tutti i punti |
Tabella 3: Condizioni di ciclismo RT-PCR in tempo reale.
| Risultato del test | Controllo interno dell'actina | Risultato complessivo |
| negativo | Negativo1 | Non valido. Ripetere l'estrazione e il saggio2 |
| negativo | costruttivo | Risultato negativo riportato |
| costruttivo | costruttivo | Positivo risultato riportato |
| costruttivo | Negativo1 | Ripetere l'estrazione e il saggio3 |
| 1 : il nome del L'uso del controllo esterno etetologo sarebbe utile durante l'estrazione ripetuta. | ||
| 2 Il nome del sistema Se si ottiene un secondo risultato negativo per il controllo interno, il campione sarà segnalato come non testabile da questo test. | ||
| 3 (COM del nome Se si ottiene un secondo risultato negativo per il controllo interno, insieme a un risultato positivo del test, | ||
| test diagnostico dovrebbe essere intrapreso per confermare questo risultato. | ||
Tabella 4: Riepilogo dei risultati e dei risultati complessivi per RT-PCR pan-lyssavirus in tempo reale. Negativo è designato per un campione senza valore Ct (amplificazione) e senza temperatura di fusione (dissociazione), o una temperatura di fusione che è al di fuori della gamma Tm per lissavirus positivi (76,8 c - 80,2 gradi centigradi). Positivo è designato per un campione con un valore diT t (amplificazione) e una temperatura di fusione (dissociazione) che si trova all'interno della gamma Tm per lissavirus positivi.
| Saggio di Lyssavirus | Saggio di azione a z | |||
| Ct | Tm | Ct | Tm | |
| Significare | Or e il numero 20.66 | 78.92 (in ti1o | 27,5 Anni | 85.26 |
| Sd | 0,63 (in inglese) | 0.16 | 1.13 (in modo non il più necessario) | 0,35 (in questo da fwlinka che) |
| LCL (95%) | 19.39 | 78,59 | Ore 25.23 | 84,56 |
| UCL (95%) | Ore 21.93 | 79.25 | Ore 29.76 | 85.96 |
Tabella 5: Analisi interesecuzione del controllo positivo CVS in 12 esecuzioni indipendenti, tra cui più operatori.
| Filogruppo | specie | ID virus | stirpe f | Limite di rilevamento | Tm |
| Ho | RABV | RV50 | Pipistrello degli Stati Uniti | 10-5 | 79,5 |
| Ho | RABV | RV51 (in via ravsi) | Volpe statunitense | 10-7 | 77,6 |
| Ho | RABV | RV108 | Pipistrello cileno | 10-7 | 78.63 |
| Ho | RABV | RV313 | Volpe europea | 10-9 anni (in modo inesulto) | 78,53 |
| Ho | RABV | RV437 | RacDog europeo | 10-7 | Ore 78.09 |
| Ho | RABV | RV1237 | Cervo europeo | 10-8 | 78.76 |
| Ho | RABV | RV334 | Vaccino cinese | 10-8 | ORe 79.03 |
| Ho | RABV | RV102 | Africa 2 | 10-7 | 78,58 |
| Ho | RABV | RV995 | Africa 3a | 10-8 | 79.66 |
| Ho | RABV | RV410 (in modo rv. | Africa 3b | 10-7 | ORe 79.03 |
| Ho | RABV | RV2324 | Africa 4 | 10-7 | 79.17 |
| Ho | RABV | RV2417 | Cane dello Sri Lanka | 10-9 anni (in modo inesulto) | 78.71 |
| Ho | RABV | CVS-11 | 10-7 | 79.17 | |
| Ho | EBLV-1 | RV20 | Germania | 10-6 | ORe 79.05 |
| Ho | EBLV-2 | RV1787 | Regno unito | 10-7 | 78.76 |
| Ho | BBLV | RV2507 | Germania | 10-9 anni (in modo inesulto) | 78.71 |
| Ho | ABLV | RV634 (in inglese) | 10-8 | 78.25 | |
| Ho | DUVV | RV131 (in via ravsi). | 10-5 | ORe 79.03 | |
| Ho | GBLV (gbLV) | RV3269 | 10-7 | 79.15 | |
| Ho | Arav | RV3379 | 10-7 | 79.46 | |
| Ho | KHUV | RV3380 | 10-7 | 78.97 | |
| Ho | SHIBV | RV3381 | 10-7 | 78,59 | |
| Ho | IRKV | RV3382 | 10-3 | 78,59 | |
| Ⅱ | LBVa | RV767 | 10-5 | 77.34 | |
| Ⅱ | LBVd | RV3383 | 10-7 | 78,59 | |
| Ⅱ | MOKV | Versione RV4 | 10-3 | 78.81 | |
| Iii | IKOV. | RV2508 | 10-5 | 79.67 | |
| Iii | LLEBV | RV3208 | 10-4 | 79.15 | |
| Iii | WCBV (il programma WCBV) | RV3384 | 10-3 | 79 del 132 24 |
Tabella 6: Riepilogo della specificità RT-PCR in tempo reale in tempo reale, sensibilità e Tm per i lissavirus rappresentativi in tutti e tre i filogruppi. Il Tm medio attraverso lyssavirus era 78.81 (SD 0.531).
Discussione
Il pan-lyssavirus in tempo reale RT-PCR assay descritto è un tubo chiuso, un test in un passaggio che rileva lyssavirus su tutti e tre i filogruppi. Il saggio è stato convalidato per la diagnosi di rabbia animale e umana, tra cui tessuto cerebrale post-mortem (albo cerebrale ottimale), e campioni ante-mortem come biopsia cutanea, saliva raccolta in serie o liquido spinale cerebrale (CSF). I primer utilizzati in questo saggio sono stati inizialmente progettati e utilizzati per un saggio basato su sonda per distinguere tra RABV, EBLV-1 e EBLV-23, che è stato utilizzato in molti laboratori di rabbia OIE ed esegue in modo coerente negli schemi di competenza EURL. Successivamente la natura "pan-lyssavirus" di questi primer è stata confermata utilizzando un assaggio in tempo reale in due passaggi15. Il test qui descritto ha utilizzato le primer per ottimizzare ulteriormente la RT-PCR in un saggio SYBR in un solo passaggio che consente un sistema rapido a tubi chiusi. Inoltre, la formazione nei paesi endemici della rabbia che utilizzano questo saggio ha confermato l'idoneità all'implementazione in qualsiasi laboratorio con PPE di base e sistemi di qualità per ridurre la contaminazione incrociata e i campioni di traccia, le strutture per immagazzinare i reagenti e un tempo reale macchina con rilevamento SYBR. Il test è estremamente robusto e ha una correlazione del 100% con il FAT, con una migliore sensibilità per i campioni decomposti3. Uno dei principali vantaggi di un saggio basato su tintura di intercalazione del DNA rispetto a un saggio basato su sonda è il costo relativo. Un ulteriore vantaggio è che il saggio utilizza solo due primer, quindi c'è meno rischio di rilevamento non riuscito a causa della divergenza di sequenza, che è stata una debolezza nei saggi basati su sonde pubblicati in precedenza. Infatti, i rappresentanti di tutte le specie di lyssavirus (a parte TWBLV e KBLV) vengono rilevati utilizzando questo saggio, e l'analisi di sequenza di TWBLV e KBLV attraverso i siti primer non rivela alcuna divergenza significativa fortemente suggerendo che saranno rilevati anche utilizzando questo metodo. La gamma di limiti di rilevamento osservati tra i virus analizzati, può essere considerata dovuta a due fattori principali. Il primo è che l'RNA è stato isolato dal materiale cerebrale clinico, quindi la quantità di copie del genoma in ogni campione non diluito non è direttamente comparabile. L'RNA è stato "normalizzato" regolando l'RNA totale a 1 g/L; tuttavia, la proporzione di RNA genomico virale all'interno di tale campione varierà. Il secondo è la diversità delle sequenze di lyssavirus, nonostante i siti primer si trovano in regioni conservate, rimangono posizioni di variazione. Pertanto, non è sorprendente che la maggior parte dei lissavirus con minore sensibilità per il saggio sono virus filogruppo II e III. L'analisi della curva di dissociazione rappresenta un parametro essenziale, riducendo al minimo un risultato falso positivo che potrebbe altrimenti verificarsi a causa della formazione di dimeri primer o amplificazione di una regione non specifica nel genoma ospite. In realtà, si tratta di un evento raro e l'analisi della curva di dissociazione è equivalente all'esecuzione di un gel agarose per visualizzare gli amplificatori RT-PCR convenzionali di dimensioni corrette. L'intervallo di valori accettabili di Tm è stato fornito (77-80 gradi centigradi), sulla base dei dati raccolti nel nostro laboratorio. Si raccomanda vivamente che i singoli laboratori fascicolino i dati interni per garantire che l'intervallo sia trasferibile e modificare di conseguenza. L'interpretazione dei risultati dei grafici di amplificazione e di dissociazione, insieme ai controlli positivi e negativi e ai risultati dell'atto zin, consente risultati diagnostici robusti e riproducibili.
Al di fuori dell'ambito di questo protocollo è il metodo di estrazione dell'RNA utilizzato per ottenere RNA di alta qualità. Tutto l'RNA analizzato in questo protocollo è stato preparato utilizzando TRIzol; tuttavia, ci sono molti protocolli adatti per l'estrazione dell'RNA di estrazione di estrazioni di guanidio, tra cui kit di estrazione a colonna e perline. La movimentazione di campioni positivi (o sospetti positivi) del lyssavirus deve essere all'interno di strutture di biocontenimento autorizzate approvate all'interno del paese. Tuttavia, l'RNA totale estratto non è infettivo, quindi gestito all'interno di laboratori a basso contenimento. A seconda del metodo di estrazione utilizzato, sarebbe necessario valutare il requisito di quantificare e diluire l'RNA. Per le estrazioni a base di fenolo, compreso il TRIzol, questo passaggio è necessario e impedisce che l'inibizione del saggio contamini gDNA; tuttavia, le estrazioni a base di colonne e perline (in particolare quelle con una fase di deplezione del DNA) non richiedono diluizione prima del test.
In tutto il protocollo, è essenziale che la cura e la diligenza siano utilizzate per prevenire la contaminazione incrociata e l'aggiunta accurata del campione ai pozzi corretti. Un foglio di calcolo con i calcoli del reagente e il layout della piastra è disponibile per il download come file supplementare. Buone pratiche di laboratorio, tra cui superfici di lavoro pulite, cambiamenti regolari di guanti, l'uso di punte di barriera e diverse stanze / armadi UV per separare ogni fase ridurrà al minimo la possibilità di contaminazione. Per garantire che il test funzioni con i parametri previsti, è necessario includere controlli positivi e negativi e tutti i campioni di test eseguiti in duplicati (o triplice).
L'inclusione dei controlli è una caratteristica essenziale di qualsiasi PCR, in particolare per la diagnostica. L'RNA di controllo positivo è stato preparato dal cervello infetto DA CVS (sfida virus standard) in lotti e convalidato e calibrato per garantire la coerenza tra i lotti. L'RNA di controllo è stato quantificato e diluito a 1 g/L. RNA per il quale è stato ottenuto un risultato positivo in una diluizione seriale fino ad almeno 10-4 (pari a 100 pg/L) è stato considerato adatto allo scopo. L'RNA di controllo positivo è stato immagazzinato a -80 gradi centigradi in 10-1 aliquote. Quando necessario, un'aliquota è stata diluita 1:100 per fornire una riserva di lavoro a 1 ng/L e conservata a -80 gradi centigradi in 5 aliquote monouso. L'RNA di controllo positivo diluito è stato utilizzato per rappresentare campioni positivi di basso livello e per garantire che sia stata rilevata qualsiasi riduzione della sensibilità del saggio. Per ogni controllo è stata mantenuta una "scheda di controllo" per monitorare i valoriC t e identificare le tendenze (tabella5). La tabella 5 ha dimostrato una buona comparabilità interrun per i valori Ct e Tm positivi di CONTROLLO CVS in più giorni e operatori, garantendo che la analisi sia robusta e riproducibile. I risultati che si discostano da queste misurazioni devono essere studiati e i campioni di prova ripetuti se necessario. L'acqua di grado molecolare è stata inclusa in ogni corsa come NTC per confermare che i reagenti erano privi di contaminazione con RNA lyssavirus e confermano un campione negativo. Inoltre, per garantire l'efficacia dell'estrazione dell'RNA, l'actino è stato testato insieme ai campioni di prova in un tubo separato. L'RNA di controllo positivo lyssavirus è stato utilizzato anche per il controllo positivo di z-actin. Possono essere utilizzati altri geni endogeni o sistemi di controllo interno eterologi. L'uso di questi controlli ha garantito che tutti i passaggi siano stati analizzati nelle stesse condizioni dei campioni di test. Occasionalmente, se il campione è stato altamente degradato o non contiene sufficiente RNA ospite (come saliva o CSF), la PCR genica endogena può fallire. In questo caso, dove il risultato RT-PCR in tempo reale del lyssavirus è stato positivo, la conferma di un'estrazione indipendente dell'RNA - per escludere la contaminazione dell'RNA durante l'estrazione dell'RNA sul test originale o mediante un test secondario (sia molecolare, come il convenzionale RT-PCR) o FAT. L'uso della tabella 4 durante l'analisi di un campione diagnostico ha garantito la corretta interpretazione.
Indipendentemente dal saggio molecolare utilizzato per confermare l'infezione da rabbia, è necessario intraprendere anche indagini di follow-up che utilizzano il sequenziamento di Sanger per determinare le specie di lissavirus e le tecniche classiche in virologia come il FAT o l'isolamento del virus caratterizzazione antivirus e sostenere la notifica di casi positivi all'OIE e all'OMS.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare Miss Emma Wise e Miss Megan Golding per l'assistenza nel completamento degli esperimenti. Lo sviluppo di questo protocollo è stato sostenuto finanziariamente dal Dipartimento britannico per l'ambiente, l'alimentazione e gli affari rurali (Defra), dal governo scozzese e dal governo gallese con sovvenzioni [SV3500, e SE0431] e da un progetto globale European Virus Archive (EVAg) che ha ha ricevuto finanziamenti dal programma di ricerca e innovazione Orizzonte 2020 dell'Unione europea nell'ambito dell'accordo di sovvenzione n. 653316.
Materiali
| Name | Company | Catalog Number | Comments |
| Art Barrier pipette tips (various sizes) | Thermofisher | various | |
| Centrifuge | Beckman | Allegra 21R | Rotor capable of holding 96 well plates required. Step 3.8. |
| Centrifuge (mico) | Sigma | ||
| Finnpipettes (to dispense 0.5-1,000 µL) | Thermofisher | various | |
| iTaq Universal SYBR Green One-Step RT-PCR kit | Bio-Rad | 172-5150 | Equivalent kits can be used if validated |
| MX3000P or MX3005P real-tme PCR system | Stratagene | N/A | Eqivalent machines can be used if validated |
| MicroAmp reaction plate base | Any suitable | Used to hold tube strip and plates securely. | |
| Optically clear flat clear strips (8) | ABgene | AB-0866 | |
| Perfect fit frame (if using tube strips) | Stratagene | N/A | Specific to machine |
| Primers: for primer details see Table 2. | Ordered at 0.05 µmole scale HPLC purified. | ||
| Thermo-Fast 96 well plares, non skirted | ABgene | AB-600 | |
| Thermo-Fast strips (8) Thermo-tubes | ABgene | AB-0452 | |
| Vortex machine / Whirlimixer | Fisons Scientific equipment | SGP-202-010J | |
| Unless stated, alternative equipment can be used |
Riferimenti
- . OIE. OIE Terrestrial Manual 2018. , 8-14 (2018).
- Panning, M., et al. Comparative analysis of rabies virus reverse transcription-PCR and virus isolation using samples from a patient infected with rabies virus. Journal of Clinical Microbiology. 48 (8), 2960-2962 (2010).
- Wakeley, P. R., et al. Development of a real-time, TaqMan reverse transcription-PCR assay for detection and differentiation of lyssavirus genotypes 1, 5, and 6. Journal of Clinical Microbiology. 43 (6), 2786-2792 (2005).
- Wang, L., et al. A SYBR-green I quantitative real-time reverse transcription-PCR assay for rabies viruses with different virulence. Virologica Sinica. 29 (2), 131-132 (2014).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR Assay for the Detection of Highly Variable Rabies virus and Other Lyssaviruses. PLOS Neglected Tropical Diseases. 11 (1), e0005258 (2017).
- Nadin-Davis, S. A., Sheen, M., Wandeler, A. I. Development of real-time reverse transcriptase polymerase chain reaction methods for human rabies diagnosis. Journal of Medical Virology. 81 (8), 1484-1497 (2009).
- Hoffmann, B., et al. Improved safety for molecular diagnosis of classical rabies viruses by use of a TaqMan real-time reverse transcription-PCR "double check" strategy. Journal of Clinical Microbiology. 48 (11), 3970-3978 (2010).
- Faye, M., et al. Development and validation of sensitive real-time RT-PCR assay for broad detection of rabies virus. Journal of Virological Methods. 243, 120-130 (2017).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLOS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Fooks, A. R., et al. Rabies. Nature Reviews Disease Primers. 3, 17091 (2017).
- Marston, D. A., et al. Ikoma lyssavirus, highly divergent novel lyssavirus in an african civet. Emerging Infectious Diseases. 18 (4), 664-667 (2012).
- . Virus Taxonomy: 2018 Release: Email ratification October 2018 (MSL #33) Available from: https://talk.ictvonline.org/taxonomy/ (2018)
- Hu, S. C., et al. Lyssavirus in Japanese Pipistrelle, Taiwan. Emerging Infectious Disease. 24 (4), 782-785 (2018).
- Nokireki, T., Tammiranta, N., Kokkonen, U. M., Kantala, T., Gadd, T. Tentative novel lyssavirus in a bat in Finland. Transboundary and Emerging Diseases. 65 (3), 593-596 (2018).
- Hayman, D. T., et al. A universal real-time assay for the detection of Lyssaviruses. Journal of Virological Methods. 177 (1), 87-93 (2011).
- Calisher, C. H., et al. Antigenic relationships among rhabdoviruses from vertebrates and hematophagous arthropods. Intervirology. 30 (5), 241-257 (1989).
- Aznar-Lopez, C., et al. Detection of rhabdovirus viral RNA in oropharyngeal swabs and ectoparasites of Spanish bats. Journal of General Virology. 94 (1), 69-75 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon