Method Article
狂犬病診断のためのパンリサウイルスリアルタイムRT-PCR
要約
dsDNAインターカリング色素を用いてこのリアルタイムRT-PCRは、リサウイルス感染の診断に適しています。この方法は、狂犬病から抽出されたRNAから始まり、マンテモーテムまたは死後サンプル、マスターミックス調製、RNA添加、リアルタイムマシンのセットアップ、結果の正しい解釈を詳細に説明します。
要約
分子アッセイは、迅速で感受性が高く、特異的であり、狂犬病の診断の中心となっています。PCRベースのアッセイは、狂犬病の診断を確認するために何十年も利用されてきましたが、狂犬病感染を検出する主要な方法としてOIE(世界動物衛生機構)によって受け入れられました。リアルタイムRT-PCRアッセイは、リアルタイムデータを提供し、クローズドチューブシステムであり、セットアップ中の汚染のリスクを最小限に抑えます。DNAインターカレーションフルオロクロムリアルタイムRT-PCRアッセイは、高価なプローブを必要とせず、サンプルあたりのコストを最小限に抑え、プライマーが保存領域で設計されている場合、1つのウイルスに特異的ではなく、ウイルスの系統全体に特異的なアッセイ種が可能です。ここでは、最も発散性ウイルスIKOV、WCBVおよびLLEBVを含むリッサウイルス属全体のリッサウイルスを検出するパンリッサウイルスSYBRリアルタイムRT-PCRアッセイについて説明する。解離曲線解析と組み合わせて、このアッセイは、すべてのリサウイルス種を検出する利点を持つ、敏感で特異的です。このアッセイは、品質保証された環境を備えた多くの診断ラボで採用されており、動物およびヒト狂犬病の症例の堅牢で迅速かつ敏感な診断を可能にします。
概要
2018年1月に分子方法論を用いて狂犬病の診断がOIEに受け入れられ、特にサンプルが最適でない場合や、アンテモーテ診断の場合に、狂犬病症例の確認におけるこれらの技術の利点を認識し、ライブウイルスや新鮮なサンプルのための要件がないため。リッサウイルスのPCRアッセイは、ゲノムがRNAであるにつれてPCRが開始される前に、逆転転写(RT)を必要とする。ゲノムの3'近位領域を検出するRT-PCRアッセイは、リサウイルス複製中に転写勾配が生じるため、最も敏感であると考えられている。一般的に使用されるRT-PCRアッセイは、エンドポイント(またはゲルベース)とリアルタイムの2つのカテゴリに大きく分けることができます。どちらの方法も機密性が高く、具体的です。しかし、リアルタイムアッセイには「リアルタイム」で結果を得ることや、完全に閉じたチューブシステムで実行されるなど、いくつかの付加的な利点があり、オペレータの汚染の可能性を低減します。リアルタイムアッセイを用いて得られたリッサウイルス特異的アンプリコンを検出するには、主に2つのアプローチがあります。1つ目は、蛍塩素とクエンチャーを含む加水分解プローブ(TaqManプローブなど)を利用します。プローブが増幅中に標的領域に結合すると、ポリメラーゼのエキソヌクレアーゼ活性が蛍光素とクエンチャーの解離をもたらし、得られた蛍光を測定することができる。2つ目は、増幅時に二重鎖DNAに結合するDNAインターカレーション色素(SYBRグリーンなどのフルオロクロム)を利用しています。結合したフルオロクロムは、各サイクルで検出される蛍光を放出し、製品のリアルタイム検出と定量を可能にします。任意のdsDNAへの結合の非特異的性質のために、解離曲線分析が行われ、反応の特異性を確認する。リアルタイムRT-PcRは、通常、長さが200 bp未満の小さなアンプリコンサイズのために迅速です。しかし、保存された領域でプライマーとプローブを設計するのに適した領域を特定することは困難であることが証明されるため、プローブの要件を取り除くことは明らかな利点です。
多くのリアルタイムRT-PcRは、RABV2の個々の株または系統を特異的に検出し、また属3、4、5、6の間でリッサウイルスを検出するように設計されています。 7,8,9.すべてのアッセイは、プライマー(および必要に応じてプローブ)配列が属を横切って保存される方法に依存する検出の限界を持ちます。実際、新しいウイルス株や新しいウイルス株は、非常に特異的なプローブベースのアッセイを無効にする可能性があります。リアルタイム検出(色素対プローブ)の選択は、意図したアプリケーションによって異なります。局所的に供給された脳材料に対してサーベイランスを行い、多数の陰性サンプルを期待する実験室では、安価なインターカリング色素の使用は賢明な選択です。SYBR Greenアプローチは、新規または発散性リサウイルスの存在がより制限されたプローブベースのアッセイによって検出されないスキャン監視を行う場合にも最適です。
リサウイルス属のすべてのメンバーは、症状が現れると致命的である狂犬病を引き起こす。ヒトおよび動物狂犬病の症例の大半は狂犬病ウイルス(RABV)によるもので、国内犬10である支配的な貯水池である。コウモリはリッサウイルスにとって重要な宿主貯水池であり、特徴付けされた2種のリッサウイルス種を除く全てがコウモリで直接同定されている- 生駒リッサウイルス(IKOV)とモコラウイルス(MOKV)-そして、これら2つのうち、IKOVはコウモリ宿主貯水池を持っていると推測されている。11.16の認識されたリッサウイルス種12に加えて、最近記載されている2つのリッサウイルスがあります:台湾コウモリリサウイルス(TWBLV)13とコタラチコウモリリサウイルス(KBLV)14。リッサウイルスは遺伝的に3つのフィログループに分けられ、RABVを含むリッサウイルスの大部分は、フィログループIに属する。しかし、最も発散性のリサウイルスはフィログループIIIに属し、RABVまたはフィログループIウイルス配列を標的とするように設計されたRT-PcRによって検出される可能性は低い。
ここで説明するアッセイは、2005年3月に最初に説明したリアルタイムプライマーペアJW12-N165を利用しています。プライマーは、元のアプリケーションがリサウイルス種を区別するためのプローブを用いたTaqManアッセイであったが、パンリサウイルスであるように設計された。その後、プライマー対が特異性におけるパン・リサウイルスであったことが確認され、WCBV15を含む利用可能な全てのライサウイルス種に対する2段階のSYBRリアルタイムアッセイを利用して達成された。プライマーペアは、インターカリングフルオロクロムを利用した1ステップRT-PCRリアルタイムアッセイで、認識された全16種のリサウイルス種の代表者を用いて検証した。この1ステップのリアルタイムアッセイは、迅速で敏感な、リッサウイルス特異的アッセイであり、プライマーの堅牢性が非常に発散性の高いリサウイルス種を同定するために設定されたことを示しています。
プロトコル
自然感染後にAPHAで受け取った診断材料からのサンプル、またはライセンス70/7394の下で英国内務省の規則の下でAPHA倫理および統計委員会によって評価されたプロトコルを使用してマウスを接種することによって得られる。
マイクロ容積分光光度計を用いたRNAの定量
- 分光光度計の設定がRNAに設定されていることを確認します。
- 1-2 μLの分子グレードの水を使用して機械を初期化し、ベースラインを設定します。
- 各試験RNAサンプルの1-2 μLを使用して、RNA量を評価します。
- 読み取りとドキュメントを保存します。
- 必要に応じて、RNA を 1 μg/μL に調整します。
注:RNAは常に氷の上(または涼しいブロック)に保管する必要があります。RNAがカラムを使用して得られる場合、またはビーズベースの方法では、RNAは通常1 μg/μL未満である。この状況では、RNA をきちんと使用します。
2. エンドポイント感度を決定するRNA希釈シリーズの調製
-
RNAの10倍のシリアル希釈を行います。
- 希釈系列(例えば、10-1、10-2など)およびRNAの詳細を含むチューブを標識する。
- 各チューブに45μLの分子グレードの水を加えます。
- RNAの5 μL(以前は1μg/μLに希釈)を加え、よく混ぜます。
- 適切な消毒剤でピペットチップを処分し、新鮮な先端に交換してください。
- 10-1から5μLを取り、10-2チューブに追加し、よく混ぜます。
- 残りの希釈で 2.1.3-2.1.5 を繰り返します。
注:RNAは常に氷の上(または涼しいブロック)に保管する必要があります。
3. リアルタイムRT-PCR反応の調製
- スプレッドシートを使用して、リサウイルスとβ-アクチンアッセイの両方について、試験サンプルと制御サンプルの数に応じてプレートレイアウトを計画します。
注:4つのサンプルが正と負の対照で複製して試験される場合、これは両方のアッセイに対する10の反応に相当します。 - RNAテンプレートとは別の「クリーンルーム」またはエリアで、PCRワークステーションを使用する前に適切な消毒剤で表面を拭き取るか、PCRワークステーションを準備します(使用する場合)。ワークステーションを準備するには、適切な消毒でキャビネット表面を拭き取り、必要なアイテムをワークステーションに置き、ドアを閉めます。紫外線を10分間オンにする
- 冷凍庫からリージェントとプライマーを取り出し、解凍します(表1に記載されている試薬および表2のプライマー)。
注:酵素ミックスはグリセロールに保存されているので、解凍を必要とせず、常に氷(または冷たいブロック)に保管する必要があります。他のすべての試薬は室温で解凍することができる。 - 解凍したら、試薬と遠心分離機を短時間混ぜて液体を回収します。
注:酵素ミックスを渦に入れないでください, ちょうど簡単に遠心分離. - リッサウイルスとβ-アクチンのための別々のマスターミックスを準備します。各反応について、分子グレード水の7.55μL、2xユニバーサルSYBRグリーン反応ミックスの10μL、フォワードプライマーの0.6μL、リバースプライマーの0.6μL、iTaq RT酵素ミックスの0.25 μLを追加します。
- 手動計算のエラーを回避するために、スプレッドシートを使用して正しいボリュームを計算します。ピペッティング エラーを補正するのに十分なマスター ミックスが用意されていることを確認します。したがって、10の反応が必要な場合(3.1の注を参照)、12の反応を調作成します。
- 氷(またはクールブロック)にマスターミックスを準備し、リアルタイムマシンに置かれるまで氷の上に残ります。
- 準備されたマスターミックス、遠心分離機を短時間混合し、ストリップチューブの関連ウェルまたは使用中のリアルタイムマシンと互換性のある96ウェルプレートに19 μLを分配します。
注:ピペッティングしながら、井戸の気泡の生産を最小限に抑えます。 - 別の部屋で、または3.2で説明するように調製されたUVキャビネットで、以前に調整されたRNAの1 μLを慎重に1 μg/μL(ステップ1.5参照)に加え、適切なマスターミックスの表面の下によく混ぜて穏やかに混ぜます。ピペットチップは、使用後(表面の下)に直接消毒剤に捨てます。
- テストサンプルの後にコントロールを追加し、次にポジティブコントロールを追加し、テンプレートコントロールなし(NTC – 分子グレードの水)を最後に追加しました。使用するRNAの量は、サンプルの種類、および使用されるRNA抽出に応じて変更することができる。反応が最適化されていることを確認するには、使用される量を検証する必要があります。
- すべての蓋がしっかりと閉じられ、サンプルを向くために十分にラベル付けされていることを確認するために注意してストリップ蓋またはシーラーを使用してシールプレート。プレート/ストリップチューブのエッジにラベルを付けます。
- 遠心分離機を使用してサンプルをスピンダウンし、井戸の底にあるすべての液体を収集します。
- リアルタイムPCRマシンにプレートを転送し、ドアを開け、ホルダー内に配置し、プレートレイアウトに従ってサンプルの正しい位置/方向を確保します。
注:チューブストリップを使用する場合は、ホルダーが所定の位置にあることを確認します。 - リアルタイムPCRマシンプログラムを開き、解離曲線を使用したSYBRリアルタイム実験のオプションを選択します。データ収集ポイントを含む、表3で指定した熱循環条件を使用してリアルタイムPCRマシンをプログラムします。
- 蛍光色素としてSYBRを選択し、サンプルタイプとして不明を選択し、正しいサンプル名ボックスに名前を挿入します。
注:複製物とリサウイルスとβ-アクチンウェルを区別する。 - 実験データを保存するファイルの場所を選択し、実行の最後にランプがオフになっていることを確認してから、実行を開始します。
注:最初のステップは RT ステージであるため、この間はデータが収集されないため、ランプがウォームアップ期間を必要とする場合、RT ステージ中に発生する可能性があります。リアルタイムマシンとソフトウェアは、増幅曲線をリアルタイムで表示し、融解曲線はサイクルの終了時に生成されます。
4. データ分析
-
実行が完了すると、次のようにデータ分析を実行します。
- まず、試験サンプルの増幅プロット結果をコントロールサンプルと一緒に分析します。正のサンプルは指数ランプを表示し、通常は高原と Ct値が続きます。負のサンプルは、Ct値のないフラット増幅プロットを表示します (図 1A)。Ct値はソフトウェアによって自動的に計算されますが、必要に応じてチェックして手動で変更する必要があります。
- 次に、検定サンプルの解離曲線結果をコントロールサンプルと共に分析します。陽性サンプルは溶融温度(T m)77~80°Cを持ち、正の対照図1Bと重なる。
- コントロールが有効であることを確認して、全体的な診断結果を取得します。表 4を使用して、内部 θ-アクチンコントロールに関連する結果を解釈します。正のコントロール サンプルが負の場合、または負のサンプルが正の場合は、実行を無視する必要があります。
- コントロールRNAで得られたCtおよびTm値を「コントロールカード」に記録し、トレンド分析を可能にし、アッセイ感度のドリフトを特定します。
結果
上記のプロトコルに従って、pan-lysavirus RT-PCRの感度は、コントロール標準ウイルス(CVS)の希釈シリーズで実証された(図 1)および他のリッサウイルスの範囲 (図 2そして図 3).SYBRグリーンI染料は、cDNA合成およびPCR増幅を単一のチューブで行うユニバーサルワンステップRT-PCRとして利用された。特定の標的の増幅が起こるにつれて、より多くの色素が結合し、その結果、蛍光のレベルがリアルタイムに増加する。すべての染料インターカレーションリアルタイムアッセイは、増幅と解離の2つの段階で解釈する必要があります。増幅フェーズは、リアルタイム増幅と同じです(図 1A).背景に対する信号が不十分なためにDNA増幅を計算できない初期のサイクルには、線形の「初期段階」があります。この長さは、サンプル内のターゲットの量に直接関係します。その後、DNA分子の倍増が検出され、記録される指数相があります。最後に、高原相に達する(プログラムの終了前にこの段階に達しない可能性がある高度に希釈されたサンプルを除く)。この段階では、試薬の枯渇に起因する蛍光レベルが出る。CVSの10倍の連続希釈を用いて観察された増幅プロットは、期待されるプロット((図 1AC)、リサウイルスアッセイは、β-アクチンアッセイよりも高い感度を示した。解離曲線は増幅後に計算され、dsDNAは温度の増分増加と蛍光温度の関数として監視されたssDNAに解離された(図 1B、D-F).特定のアンプリコンがssDNAに解離する閾値温度は、サーモサイクラーソフトウェアによって測定された蛍光の放出を引き起こした(TM).この解離フェーズは、アンプリコンサイズに関するデータを提供し、ユーザーが正の対照と比較して結果を解釈することを可能にし、偽陽性の結果の可能性はごくわずかです。TMパンリサウイルスアッセイを用いてCVSに対して観察される(図 1B)およびβ-アクチンアッセイ (図 1D)は異なり、Tに注意して正しいアッセイ分析を確認するのに役立ったM取得 (図 1E).さらに、Tと TM実行と演算子の間の値が評価され、再現可能であることが示されました(表 5).C の計算に使用されるしきい値T値はソフトウェアによって自動的に計算され、使用される反応ミックスや器具を含む多くの要因に依存します。12の独立した上に平均Cを実行しますTリサウイルスアッセイは20.66(SD 0.63)、β-アクチンアッセイでは27.5(SD 1.13)であった。対照的に、Tで観察される変動Mこの測定値に対する外部の影響がないため、値は著しく低くなっています。たとえば、平均 TMCVSリサウイルスアッセイは78.92(SD 0.16)(表 5), すべてのリッサウイルスの平均と比較した場合 78.81 °C (SD 0.531) (表 6そして図 1F).Tのバリエーションのこの欠如Mを横切って Lyssavirus属は、試料中のライサウイルスに関係なく同じコントロールRNAを使用することができるので有利であるが、Tを用いてライサウイルス種を区別するM特に異なるRABVサブリラインがTの範囲にまたがっているので、不可能ですM観察された値 (表 6).非特異的増幅プロットは、このアッセイではめったに観察されません。ただし、肯定的な結果と非特異的な負の結果を定義する特定のパラメーターが必要です。すべてのリサウイルス(0.531)で観察されたSDは、最も低い(77.34 - LBVa)と最も高い(79.67 - IKOV)観察されたTに適用されたM正の特定のバンドのための範囲76.8 °C - 80.2 °Cを設定する値。したがって、TMこの範囲外の値は非特異的と見なされるため、負の結果になります。サンプルに対して複数のピークが観察される場合があります。支配的なピークが正しい T の場合M(反復ごとに)サンプルは陽性と見なされます。非特異的ピークが観察される最も一般的な理由は、プライマーダイマーによるものであり、アッセイはプライマーダイマーを最小化するように最適化されている。プライマーダイマーは、通常、ターゲットシーケンスのアンプリコンよりも小さい結果になるので、Tを持つことになりますM特定の製品よりも低い。
TRIzolを用いて抽出した3つのライサウイルス陽性脳試料RNAの10倍の連続希釈を、並列に実行してプロットした(図2)。3つのライサウイルスの検出限界はさまざまであったが、いずれもC t36を超えたものはなかった。図2にプロットされたウイルスの R 2 係数値は、0.9637 と 0.996 の範囲でした。分析されたすべてのウイルス(表6)の範囲はこれを超えなかった、さらに、29リッサウイルスの7はR2 >0.99を有していた(データは示されていない)。希釈系列の調製は全RNA抽出物からであることを考慮すると、観察された線形性はアッセイが堅牢であることを証明する。最後に、すべてのリッサウイルス種(特に最も多様なフィログループIIIウイルス)の検出は、ライサウイルス属の3つのフィログループすべてにまたがるRNAのパネルを用いて調査された。本来のマウスまたは実験的に感染したマウスから抽出したRNAは、脳材料、上述のプロトコルを用いて利用した。結果は、プライマーが発散性フィログループIIIリサウイルスIKOV、WBCVおよびLLEBVを含むすべてのリッサウイルス種を増幅することを確認した(表6および図3)。 非リッサウイルスラブドウイルスの多様なパネルは、もともと抗原16を収集し、分析し、さらに最近では遺伝的に17をスクリーニングし、無十字反応性が検出され、プライマーが特異的であることを示すライサウイルス属のメンバーのみ(データは示されていません)。パンリサウイルスリアルタイムアッセイは、2013年以来EURL(EUリファレンスラボ)の実験室間熟練スキームに含まれており、パンリサウイルスTaqManアッセイおよび同様の他の分子アッセイと100%一致しています。従来のRT-PCRアッセイは、FAT(蛍光抗体試験)に加えて。
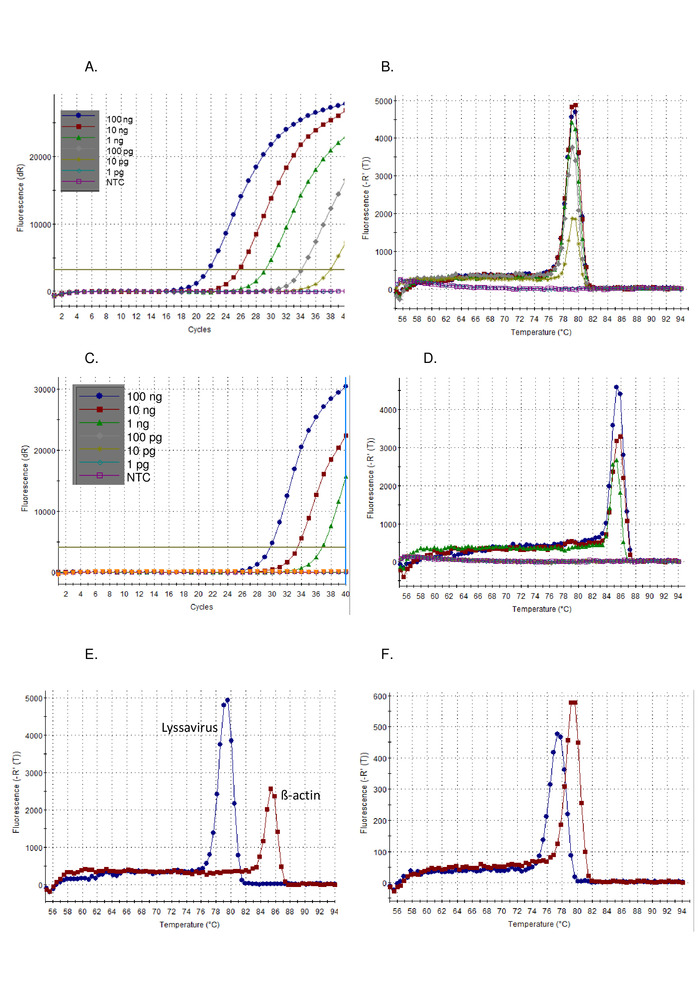
図1:CVS陽性対照RNAの10倍のシリアル希釈、パンリッサウイルスRT-PCRアッセイ上で実行し、増幅プロット(A)として可視化し、解離曲線(B)、及び増幅プロット(C)として可視化したβ-アクチンRT-PCRアッセイ上で実行し、及び、解離曲線(D)。NTC = テンプレート制御なし。解離曲線(E)の違いを示すパン・リッサウイルスRT-PCRアッセイ(青)とβ-アクチンRT-PCRアッセイ(赤色)の両方で実行されるCVSコントロールRNAの比較 -平均値の表5を参照してください。そして最後に、LBVa(青)およびIKOV(赤色)の解離曲線は、ライサウイルス属(F)全体で観察されたTm値の範囲を示す。この図のより大きなバージョンを表示するには、ここをクリックしてください。
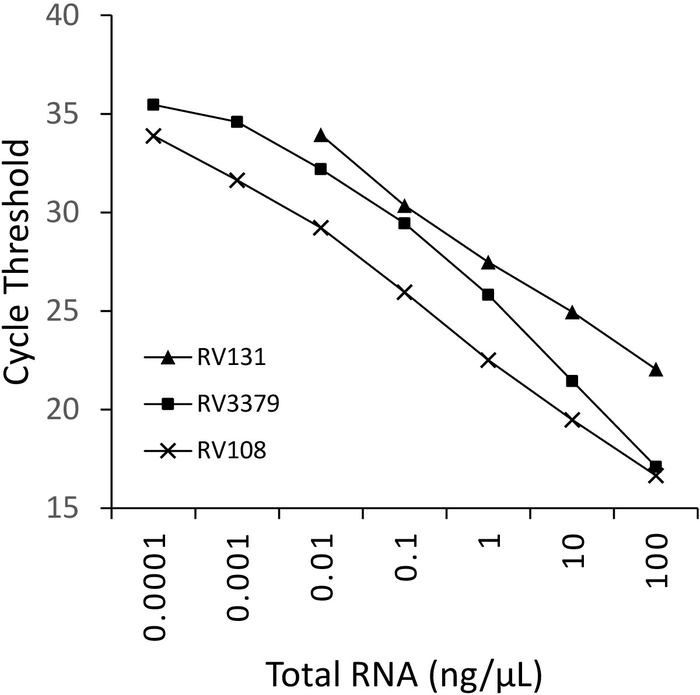
図2:3つのリサウイルス種の10倍の連続希釈:RABV(RV108)、DUVV(RV131)およびアラブ(RV3379)。R2 = 0.996、0.9962 および 0.9637 それぞれ。10-7 (0.0001 ng/μL) のデータ ポイントは検出の限界に達しました (値が得られた場所)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
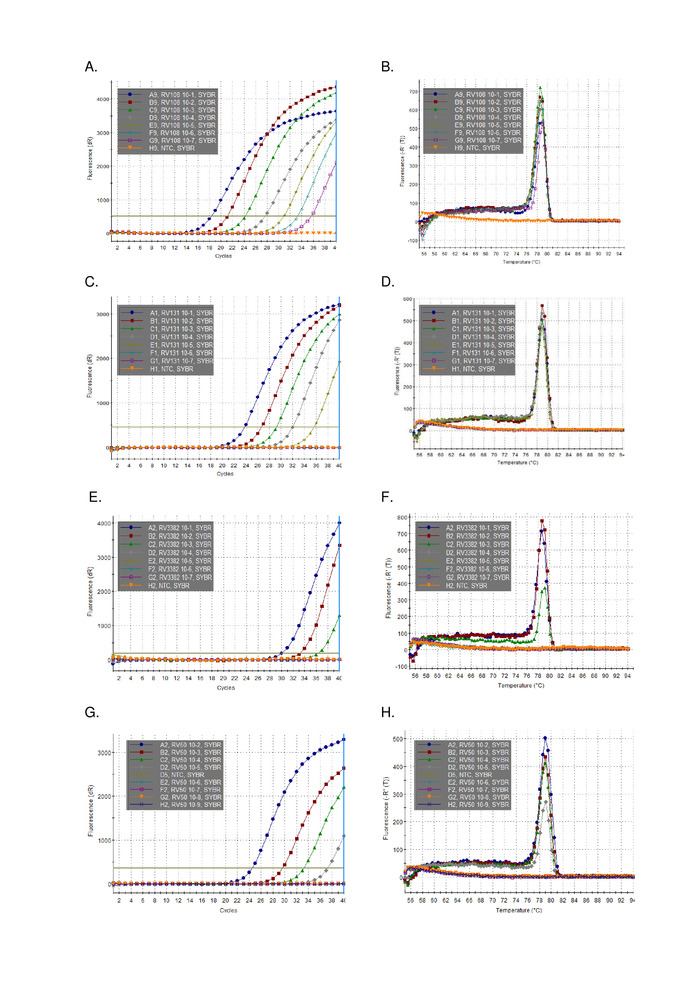
図3:リッサウイルス属全体の代表的な10倍のシリアル希釈データ(他のリサウイルスと比較して集計結果については、リッサウイルス同一性の個々の伝説と表6を参照)。パネルA、C、E、G増幅プロットおよびB、D、F、H解離曲線は、それぞれA、C、E、およびGである。この図のより大きなバージョンを表示するには、ここをクリックしてください。
| 試薬 | μL/反応 |
| 分子グレードの水 | 7.55年 |
| 2xユニバーサルRT PCR反応ミックス | 10歳 |
| プライマーフォワード [20 μM] | 0.6年 |
| プライマーリバース [20 μM] | 0.6年 |
| RT酵素ミックス | 0.25分 |
| 反応ごとの合計 | 19歳 |
表1:パンリサウイルスリアルタイムRT-PCRマスターミックス試薬。
| アッセイ | プライマー名 | プライマーロール | シーケンス 5'-3' | 位置1 |
| リッサウイルス | JW12 | RT-PCR | ATG TAA CAC CYC TAC AAT G | 53から73 |
| N165 | Pcr | GCA GGG テイ TTR タック TCA TA TA | 165-146年 | |
| β-アクチン | β-アクチンイントロニック | Pcr | CGA TGA アガ TCA アガ TCA TTG | 1051から1072年 |
| β-アクチン逆 | RT-PCR | AAG キャット TTG CGG TGG AC | 1204-1188年 | |
| プライマー位置は、パスツールウイルス配列(M13215)およびマウスβ-アクチン遺伝子配列(NM_007393)に関連して与えられる。 | ||||
表 2: パンリサウイルスリアルタイム RT-PCR プライマーの詳細.
| 段階 | サイクル | 温度 | 時間 | データ収集 |
| 逆転写 | 1 | 50 °C | 10分 | |
| RT 不活性化/初期の非核化 | 1 | 95 °C | 5 分 | |
| 増幅 | 40歳 | 95 °C | 10 s | |
| 60 °C | 30 s | 終了点 | ||
| 解離曲線解析 | 1 | 9 °C | 1 分 | |
| 55 °C | 1 分 | |||
| 55 ~ 95 °C | 10 s | すべてのポイント |
表3:パンリサウイルスリアルタイムRT-PCRサイクリング条件。
| テスト結果 | 内部β-アクチン制御 | 全体的な結果 |
| 負 | 負の 1 | 無効です。抽出とアッセイを繰り返す2 |
| 負 | 正 | 報告された否定的な結果 |
| 正 | 正 | 肯定的な結果が報告されました |
| 正 | 負の 1 | 抽出とアッセイを繰り返す 3 |
| 1回来性外部制御の使用は、繰り返し抽出中に有益であろう。 | ||
| 2内部制御に対して2番目の負の結果が得られた場合、サンプルはこのアッセイによってテスト不能として報告されます。 | ||
| 3内部制御に対して2番目の否定的な結果が得られた場合、陽性の検査結果と共に二次狂犬病 | ||
| この結果を確認するために診断テストを実施する必要があります。 | ||
表 4: パンリサウイルスリアルタイム RT-PCR の結果と全体的な結果の概要.負は、Ct値(増幅)なし、溶融温度(解離)のないサンプル、または正のリッサウイルス(76.8 °C - 80.2 °C)のTm範囲外の溶融温度に指定されます。陽性は、陽性リッサウイルスのTm範囲内にあるCt値(増幅)と溶融温度(解離)を有するサンプルに指定される。
| リッサウイルスアッセイ | β-アクチンアッセイ | |||
| Ct | Tm | Ct | Tm | |
| 意味 | 20.66年 | 78.92の | 27.5年 | 85.26円 |
| Sd | 0.63年 | 0.16分 | 1.13 | 0.35 |
| LCL (95%) | 19.39年 | 78.59円 | 25.23年 | 84.56円 |
| UCL (95%) | 21.93の | 79.25の | 29.76年 | 85.96円 |
表 5: 複数の演算子を含む 12 の独立した実行における CVS 陽性制御のインターラン分析。
| フィログループ | 種 | ウイルス ID | 系統 | 検出の制限 | Tm |
| 私 | ラブフ | RV50 | 米国のバット | 10-5日 | 79.5年 |
| 私 | ラブフ | RV51 | 米国フォックス | 10-7日 | 77.6歳 |
| 私 | ラブフ | RV108 | チリバット | 10-7日 | 78.63の |
| 私 | ラブフ | RV313 | ヨーロッパキツネ | 10-9日 | 78.53の |
| 私 | ラブフ | RV437 | ヨーロッパのラックドッグ | 10-7日 | 78.09円 |
| 私 | ラブフ | RV1237 | ヨーロッパの鹿 | 10-8日 | 78.76円 |
| 私 | ラブフ | RV334 | 中国ワクチン | 10-8日 | 79.03の |
| 私 | ラブフ | RV102 | アフリカ 2 | 10-7日 | 78.58円 |
| 私 | ラブフ | RV995 | アフリカ 3a | 10-8日 | 79.66の |
| 私 | ラブフ | RV410 | アフリカ 3b | 10-7日 | 79.03の |
| 私 | ラブフ | RV2324 | アフリカ 4 | 10-7日 | 79.17年 |
| 私 | ラブフ | RV2417 | スリランカ犬 | 10-9日 | 78.71の |
| 私 | ラブフ | CVS-11 | 10-7日 | 79.17年 | |
| 私 | EBLV-1 | RV20 | ドイツ | 10-6日 | 79.05の |
| 私 | EBLV-2 | RV1787 | 英国 | 10-7日 | 78.76円 |
| 私 | BBLV | RV2507 | ドイツ | 10-9日 | 78.71の |
| 私 | アブルブ | RV634 | 10-8日 | 78.25円 | |
| 私 | デュヴ | RV131 | 10-5日 | 79.03の | |
| 私 | GBLV | RV3269 | 10-7日 | 79.15年 | |
| 私 | アラブ | RV3379 | 10-7日 | 79.46の | |
| 私 | クーヴ | RV3380 | 10-7日 | 78.97の | |
| 私 | シブ | RV3381 | 10-7日 | 78.59円 | |
| 私 | IRKV | RV3382 | 10-3年 | 78.59円 | |
| Ii | LBVa | RV767 | 10-5日 | 77.34の | |
| Ii | LBVd | RV3383 | 10-7日 | 78.59円 | |
| Ii | モクフ | RV4 | 10-3年 | 78.81の | |
| Iii | イコフ | RV2508 | 10-5日 | 79.67の | |
| Iii | リブレブ | RV3208 | 10-4年 | 79.15年 | |
| Iii | WCBV | RV3384 | 10-3年 | 79歳 |
表6:3つの系統全てにわたる代表的なリッサウイルスに対するリアルタイムRT-PCR特異性、感度およびTmの概要。リサウイルス全体の平均Tmは78.81(SD 0.531)であった。
ディスカッション
記載されているパンリサウイルスリアルタイムRT-PCRアッセイは、3つのフィログループ全体でリッサウイルスを検出する閉じたチューブ、ワンステップアッセイである。このアッセイは、死後の脳組織(最適な脳幹)、皮膚生検、連続採取唾液、または脳脊髄液(CSF)などのアンテモーテ・サンプルを含む、動物とヒト狂犬病の診断の両方で検証されています。このアッセイで利用されるプライマーは、最初に多くのOIE狂犬病研究所で使用され、EURLの熟練スキームで一貫して実行されているRABV、EBLV-1およびEBLV-23を区別するためにプローブベースのアッセイのために設計され、利用されました。続いて、これらのプライマーの「パンリサウイルス」の性質は、2段階のリアルタイムアッセイ15を用いて確認された。ここで説明するアッセイは、プライマーを利用して、閉管、高速システムを可能にするワンステップSYBRアッセイでRT-PCRをさらに最適化した。さらに、このアッセイを用いた狂犬病流行国での訓練は、クロスコンタミネーションと微量サンプル、試薬を貯蔵する施設、リアルタイムの施設を削減するための基本的なPPEおよび品質システムを備えたあらゆる実験室で実施する適合性を確認した。SYBR検出を備えたマシン。アッセイは非常に強く、分解されたサンプル3に対する感度が向上し、FATと100%の相関関係があります。プローブベースのアッセイと比較して、DNAインターカリング色素ベースのアッセイの主な利点の1つは、相対コストです。もう一つの利点は、アッセイが2つのプライマーのみを使用するため、以前に公開されたプローブベースのアッセイの弱点であったシーケンス発散による検出に失敗するリスクが少ないです。実際、すべてのリッサウイルス種(TWBLVおよびKBLVを除く)の代表者は、このアッセイを使用して検出され、プライマー部位全体でのTWBLVおよびKBLVの配列分析は、それらも使用して検出されることを強く示唆する有意な発散を明らかにしないこのメソッド。分析されたウイルス全体で観察される検出の範囲は、2つの主な要因によるものと考えることができる。第1は、RNAが臨床脳材料から単離されたため、希釈されていない各サンプル中のゲノムコピーの量は直接比較できないということです。RNAは、総RNAを1 μg/μLに調整することによって「正規化」された。しかし、そのサンプル内のウイルスゲノムRNAの割合は異なります。第2は、リッサウイルス配列の多様性であり、プライマー部位が保存領域に位置しているにもかかわらず、変動の位置が残っている。したがって、アッセイに対する感受性が低いリッサウイルスの大部分がフィログループIIおよびIIIウイルスであることは驚くべきことではない。解離曲線解析は必須パラメータを表し、プライマーダイマーの形成、または宿主ゲノム内の非特異的領域の増幅によって起こり得る偽陽性の結果を最小限に抑えます。実際には、これはまれな発生であり、解離曲線解析は、正しいサイズの従来のRT-PCRアンプリコンを視覚化するためにアガロースゲルを実行することに相当します。当研究室で収集したデータに基づき、許容されるTm値の範囲(77~80°C)が提供されています。個々のラボが社内データを照合し、範囲が転送可能であることを確認し、それに応じて修正することを強くお勧めします。増幅および解離プロットの両方からの結果の解釈は、正と負のコントロールおよびθ-actinの結果と共に、堅牢で再現可能な診断結果を可能にする。
このプロトコルの範囲外には、高品質のRNAを得るために使用されるRNA抽出方法があります。このプロトコルで分析されたすべてのRNAは、TRIゾルを用いて調製した。しかし、カラムおよびビーズベースの抽出キットを含む、多くの適切なグアニジウムベースの抽出RNA抽出プロトコルが利用可能です。リッサウイルス陽性(または陽性の疑いのある)サンプルの取り扱いは、国内で承認された認可されたバイオコンテインメント施設内でなければなりません。しかし、抽出された全RNAは非感染性であるため、低封じ込め実験室内で処理されます。使用される抽出方法に応じて、RNAを定量化および希釈する要件を評価する必要があります。TRIzolを含むフェノールベースの抽出のために、このステップが必要であり、gDNAを汚染するアッセイの阻害を防ぎます。しかし、カラムおよびビーズベースの抽出(特にDNA枯渇段階を有するもの)は、試験前に希釈を必要としない。
プロトコル全体を通じて、適切な井戸へのクロスコンタミネーションとサンプルの正確な添加を防ぐために、ケアと勤勉が使用される必要があります。試薬の計算とプレートレイアウトを含むスプレッドシートは、補足ファイルとしてダウンロードできます。きれいな仕事の表面、手袋の定期的な変更、各段階を分離するために障壁の先端および異なった部屋/UVキャビネットの使用を含むよい実験室の練習は汚染のチャンスを最小にする。テストが期待されるパラメータで実行されていることを確認するには、正と負のコントロールを含め、すべてのテスト サンプルを重複 (または三文) で実行する必要があります。
コントロールを含めることは、特に診断のために、任意のPCRの不可欠な機能です。陽性対照RNAは、CVS(チャレンジウイルス標準)感染マウス脳からバッチで調製し、バッチ間の一貫性を確保するために検証および校正した。対照RNAを定量し、1μg/μL.RNAに希釈し、シリアル希釈で少なくとも10-4(100pg/μLに相当)まで陽性の結果が得られたので、目的に適していると考えられた。陽性対照RNAを10-1アリコートで-80°Cで保存した。必要に応じて、アリコートを1:100に希釈し、1ng/μLで作動ストックを提供し、5μL単一使用アリコートで-80°Cで保存した。希釈された陽性対照RNAは、低レベル陽性サンプルを表し、アッセイの感度の低下が検出されたことを確実にするために使用された。Ct値を監視し、傾向を識別するために、各コントロールに対して「コントロール カード」が保持されました (表5)。表 5は、CVS 陽性コントロール サンプルC tおよび Tm値が複数の日および演算子に対して良好な実行間比較性を示し、アッセイが堅牢で再現性があることを保証しました。これらの測定値から逸脱した結果を調査し、必要に応じてサンプルを繰り返す必要があります。分子グレードの水は、試薬がリサウイルスRNAによる汚染から自由であることを確認し、陰性サンプルを確認するために、NTCとしてすべての実行に含まれていました。さらに、RNA抽出の有効性を確保するために、β-アクチンを別のチューブ内の試験試料と共に試験した。ライサウイルス陽性対照RNAは、β-アクチン陽性対照にも用いられた。他の内因性遺伝子または異種内部制御システムが利用されうる。これらのコントロールを使用すると、すべてのステップがテスト サンプルと同じ条件で分析されました。時折、サンプルが高度に分解された場合、または十分な宿主RNA(唾液またはCSFなど)が含まれなかった場合、内因性遺伝子PCRが失敗する可能性があります。この場合、ライサウイルスリアルタイムRT-PCR結果が陽性であった場合、独立したRNA抽出に関する確認- 元の試験または二次試験(従来のRT-PCRなどの分子のいずれか)によるRNA抽出中の汚染を除外する。、または FAT を使用します。診断サンプルの分析中に表4を使用すると、正しい解釈が保証されました。
狂犬病感染を確認するために使用される分子アッセイにかかわらず、サンガーシーケンシングを使用してリッサウイルス種を決定し、FATやウイルスの単離などのウイルス学における古典的な技術を決定するために調査をフォローアップし、可能にする必要があります。さらなるウイルスの特徴付けとOIEとWHOへの陽性症例の通知をサポートします。
開示事項
著者は何も開示していない。
謝辞
著者たちは、実験を完了する際の支援のためにエマ・ワイズさんとミス・ミーガン・ゴールディングさんに感謝したいと思っています。このプロトコルの開発は、英国環境・食糧・農村省(Defra)、スコットランド政府、ウェールズ政府の助成金[SV3500、およびSE0431]および欧州ウイルスアーカイブ・グローバル(EVAg)プロジェクトによって財政的に支援されました。欧州連合のHorizon 2020研究・イノベーション・プログラムから助成金を受け取ったNo 653316。
資料
| Name | Company | Catalog Number | Comments |
| Art Barrier pipette tips (various sizes) | Thermofisher | various | |
| Centrifuge | Beckman | Allegra 21R | Rotor capable of holding 96 well plates required. Step 3.8. |
| Centrifuge (mico) | Sigma | ||
| Finnpipettes (to dispense 0.5-1,000 µL) | Thermofisher | various | |
| iTaq Universal SYBR Green One-Step RT-PCR kit | Bio-Rad | 172-5150 | Equivalent kits can be used if validated |
| MX3000P or MX3005P real-tme PCR system | Stratagene | N/A | Eqivalent machines can be used if validated |
| MicroAmp reaction plate base | Any suitable | Used to hold tube strip and plates securely. | |
| Optically clear flat clear strips (8) | ABgene | AB-0866 | |
| Perfect fit frame (if using tube strips) | Stratagene | N/A | Specific to machine |
| Primers: for primer details see Table 2. | Ordered at 0.05 µmole scale HPLC purified. | ||
| Thermo-Fast 96 well plares, non skirted | ABgene | AB-600 | |
| Thermo-Fast strips (8) Thermo-tubes | ABgene | AB-0452 | |
| Vortex machine / Whirlimixer | Fisons Scientific equipment | SGP-202-010J | |
| Unless stated, alternative equipment can be used |
参考文献
- . OIE. OIE Terrestrial Manual 2018. , 8-14 (2018).
- Panning, M., et al. Comparative analysis of rabies virus reverse transcription-PCR and virus isolation using samples from a patient infected with rabies virus. Journal of Clinical Microbiology. 48 (8), 2960-2962 (2010).
- Wakeley, P. R., et al. Development of a real-time, TaqMan reverse transcription-PCR assay for detection and differentiation of lyssavirus genotypes 1, 5, and 6. Journal of Clinical Microbiology. 43 (6), 2786-2792 (2005).
- Wang, L., et al. A SYBR-green I quantitative real-time reverse transcription-PCR assay for rabies viruses with different virulence. Virologica Sinica. 29 (2), 131-132 (2014).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR Assay for the Detection of Highly Variable Rabies virus and Other Lyssaviruses. PLOS Neglected Tropical Diseases. 11 (1), e0005258 (2017).
- Nadin-Davis, S. A., Sheen, M., Wandeler, A. I. Development of real-time reverse transcriptase polymerase chain reaction methods for human rabies diagnosis. Journal of Medical Virology. 81 (8), 1484-1497 (2009).
- Hoffmann, B., et al. Improved safety for molecular diagnosis of classical rabies viruses by use of a TaqMan real-time reverse transcription-PCR "double check" strategy. Journal of Clinical Microbiology. 48 (11), 3970-3978 (2010).
- Faye, M., et al. Development and validation of sensitive real-time RT-PCR assay for broad detection of rabies virus. Journal of Virological Methods. 243, 120-130 (2017).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLOS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Fooks, A. R., et al. Rabies. Nature Reviews Disease Primers. 3, 17091 (2017).
- Marston, D. A., et al. Ikoma lyssavirus, highly divergent novel lyssavirus in an african civet. Emerging Infectious Diseases. 18 (4), 664-667 (2012).
- . Virus Taxonomy: 2018 Release: Email ratification October 2018 (MSL #33) Available from: https://talk.ictvonline.org/taxonomy/ (2018)
- Hu, S. C., et al. Lyssavirus in Japanese Pipistrelle, Taiwan. Emerging Infectious Disease. 24 (4), 782-785 (2018).
- Nokireki, T., Tammiranta, N., Kokkonen, U. M., Kantala, T., Gadd, T. Tentative novel lyssavirus in a bat in Finland. Transboundary and Emerging Diseases. 65 (3), 593-596 (2018).
- Hayman, D. T., et al. A universal real-time assay for the detection of Lyssaviruses. Journal of Virological Methods. 177 (1), 87-93 (2011).
- Calisher, C. H., et al. Antigenic relationships among rhabdoviruses from vertebrates and hematophagous arthropods. Intervirology. 30 (5), 241-257 (1989).
- Aznar-Lopez, C., et al. Detection of rhabdovirus viral RNA in oropharyngeal swabs and ectoparasites of Spanish bats. Journal of General Virology. 94 (1), 69-75 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved