Method Article
Пан-лиссавирус в режиме реального времени RT-PCR для диагностики бешенства
В этой статье
Резюме
Этот RT-PCR в реальном времени с использованием dsDNA интеркалирующего красителя подходит для диагностики лиссавирусных инфекций. Метод начинается с РНК, извлеченных из бешенства подозреваемых анте-смертных или посмертных образцов, подробно мастер подготовки смеси, РНК дополнение, установка машины в режиме реального времени и правильное толкование результатов.
Аннотация
Молекулярные анализы являются быстрыми, чувствительными и специфическими, и стали центральными для диагностики бешенства. ПЦР на основе анализы были использованы в течение десятилетий для подтверждения диагноза бешенства, но только недавно были приняты МЭБ (Всемирная организация по охране здоровья животных) в качестве основного метода для выявления бешенства инфекции. Анализы RT-PCR в режиме реального времени предоставляют данные в режиме реального времени и являются системами с закрытыми трубками, минимизируя риск загрязнения во время установки. ДНК интеркалирующим флюорохром в реальном времени RT-PCR анализы не требуют дорогих зондов, минимизируя стоимость образца, и когда праймеры разработаны в сохраненных регионах, анализы, которые являются специфическими для вирусов, а не специфичны только для одного вируса видов возможны. Здесь мы описываем пан-лиссавирус SYBR в режиме реального времени RT-PCR, который обнаруживает лиссавирусы по всему роду lyssavirus, в том числе наиболее различных вирусов IKOV, WCBV и LLEBV. В сочетании с анализом кривой диссоциации, этот анализ является чувствительным и конкретным, с преимуществом обнаружения всех видов лиссавируса. Этот ассеия была принята во многих диагностических лабораториях с гарантированной качеством среды, что позволяет надежной, быстрой, чувствительной диагностики случаев бешенства животных и людей.
Введение
Диагностика бешенства с использованием молекулярных методологий была принята МЭЭ в 2018году1, признавая преимущества этих методов в подтверждении случаев бешенства, особенно в ситуациях, когда образцы являются неоптимальными, или для ante-mortem диагностики, как нет необходимости в живом вирусе или свежих образцах. ПЦР-анализы на лиссавирусы требуют обратной транскрипции (РТ) до того, как ПЦР может начаться, как геном РНК. RT-PCR анализы, которые обнаруживают 3' проксимальной области генома считаются наиболее чувствительными, как транскрипционные градиенты происходят во время репликации лиссавируса. Обычно используемые анализы RT-PCR можно разделить на две категории: конечная точка (или на основе геля) и в режиме реального времени. Оба подхода являются деликатными и специфическими; однако анализ в режиме реального времени имеет некоторые дополнительные преимущества, такие как получение результатов в "реальном времени" и проводится в полностью закрытой трубной системе, тем самым уменьшая вероятность заражения оператора. Существует два основных подхода к обнаружению ампронов, специфических лиссавирусов, полученных с помощью анализов в реальном времени. Первый использует гидролизные зонды (такие как зонды TaqMan), которые содержат фторофор и утоляющий. Когда зонд связывается с целевой областью во время усиления, экзонуклеизация деятельности полимераза приводит к диссоциации фторофора и утоления, что позволяет в результате флуоресценции, чтобы быть измерены. Второй использует ДНК интеркалирующего красителя (фторхром, таких как SYBR Green), который связывается с двойной мель ДНК во время усиления. Связанные флюорохромы испускают флуоресценцию, которая обнаруживается на каждом цикле, что позволяет в режиме реального времени обнаружения и количественной оценки продукта. В связи с неспецифическим характером связывания к какой-либо dsDNA проводится анализ кривой диссоциации для подтверждения специфики реакции. RT-PCR в реальном времени быстро из-за небольших размеров ампликона, как правило, менее 200 bp в длину; однако определение подходящих регионов для разработки грунтовок и зондов в законсервированных регионах может оказаться непростым, поэтому устранение требования к зонду является явным преимуществом.
Ряд RT-PCRs в реальном времени были разработаны специально для обнаружения отдельных штаммов или линий RABV 2, а также для обнаружения лиссавирусов по всему роду3,4,5,6, 7,8,9. Все анализы будут иметь предел обнаружения зависит от того, как сохраняется грунтовка (и, при необходимости, зонд) последовательности по всему роду. Действительно, возникающие или новые штаммы вируса могут сделать высокоспецифические анализы на основе зонда неэффективными. Выбор обнаружения в реальном времени (краситель против зонда) будет зависеть от предполагаемого приложения. Для лаборатории, осуществляющей наблюдение за местным исданным мозговым материалом и ожидающей большого количества отрицательных образцов, использование более дешевого интеркалирующего красителя является разумным выбором. Подход SYBR Green также был бы оптимальным при проведении сканирующего наблюдения, когда наличие новых или расходящихся лиссавирусов оставалось бы незамеченным более ограниченными анализами на основе зонда.
Все представители рода лиссавирус вызывают бешенство, которое приводит к летальному исходу после появления симптомов. Подавляющее большинство случаев бешенства человека и животных вызваны вирусом бешенства (RABV), доминирующим резервуаром для которого является домашняя собака10. Летучие мыши являются важными резервуарами для лиссавирусов, и все, кроме двух видов лиссавирусов, характеризуются, были выявлены непосредственно у летучих мышей - лиссавирус Икома (IKOV) и вирус Mokola (MOKV) - и из этих двух, IKOV был предположил, что у летучих мышей 11. В дополнение к 16 признанных лиссавирус видов12, Есть два лиссавирусов, которые были недавно описаны: Тайвань летучая мышь lyssavirus (TWBLV)13 и Kotalahti летучая мышь lyssavirus (KBLV)14. Лиссавирусы могут быть генетически разделены на три филогруппы, при этом большинство лиссавирусов, включая RABV, принадлежащих к филогруппе I. Однако наиболее расходящиеся лиссавирусы относятся к филогруппе III и вряд ли будут обнаружены RT-PCRs, предназначенными для таргетинга на последовательности вирусов RABV или phylogroup I.
В описанном здесь ассе используйте в режиме реального времени грунтовую пару JW12-N165, впервые описанную в 2005 году3. Праймеры были разработаны, чтобы быть пан-лиссавирус, хотя оригинальное приложение было как TaqMan асссс с зондами, чтобы дифференцировать лиссавирусвидов. Последующее подтверждение того, что первик пара была пан-лизавирус в специфике было достигнуто с использованием 2-ступенчатой SYBR в режиме реального времени асспо на всех видах лизазавирус, включая WCBV15. Первик пара описана здесь в одношаговой RT-PCR в режиме реального времени ассси с использованием интеркалирующего флюорохрома, проверенного с использованием представителей всех 16 признанных видов лизазавируса. Этот одношаговой ассея в режиме реального времени является быстрым, чувствительным, lyssavirus-специфический ассии и показывает, что надежность грунтовки установить для выявления даже весьма расходящихся лиссавирусных видов.
протокол
Образцы из диагностического материала, полученного в APHA после естественной инфекции, или полученные путем прививки мышей с помощью протоколов, оцененных этикой и статистическим комитетом APHA в соответствии с правилами Министерства внутренних дел Великобритании в соответствии с правилами лицензии 70/7394.
1. Количественная оценка РНК с использованием микротомного спектрофотометра
- Убедитесь, что настройки спектрофотометра настроены на РНК.
- Используйте 1-2 л воды молекулярного класса, чтобы инициализировать машину и установить базовый упор.
- Используйте 1-2 л каждого испытательного образца РНК для оценки количества РНК.
- Сохранить показания и документ.
- При необходимости отрегулируйте РНК до 1 мкг/л.
ПРИМЕЧАНИЕ: РНК должна храниться на льду (или в прохладном блоке) в любое время. Если РНК получена с помощью столбца, или бис основе метода РНК, как правило, меньше, чем 1 мкг / Зл. В этой ситуации использовать РНК аккуратно.
2. Подготовка серии разбавления РНК для определения чувствительности конечной точки
-
Сделать 10-кратное серийное разбавление РНК.
- Этикетка трубки с разбавления серии (например, 10-1, 10-2, и т.д.) и детали РНК.
- Добавьте 45 qL воды молекулярного класса к каждой трубе.
- Добавьте 5 зЛ РНК (ранее разбавленного до 1 мкг/Л) и хорошо перемешайте.
- Утилизируйте наконечник пипетки в соответствующем дезинфицирующем средстве и замените свежим наконечником.
- Возьмите 5 зл от 10-1 и добавить в 10-2 трубки и хорошо перемешать.
- Повторите 2.1.3-2.1.5 с остальными разбавлениями.
ПРИМЕЧАНИЕ: РНК должна храниться на льду (или в прохладном блоке) в любое время.
3. Подготовка реакций РТ-ПКР в режиме реального времени
- Используя электронную таблицу, спланируйте макет пластинв в соответствии с количеством тестовых образцов и контрольных образцов, как для анализов лиссавируса, так и для анализа.
ПРИМЕЧАНИЕ: Если 4 образца должны быть проверены в дубликате с положительным и отрицательным контролем, это приравнивается к 10 реакций для обоих анализов. - В «чистой комнате» или отдельной от шаблона РНК протрите поверхности соответствующим дезинфицирующим средством перед использованием или подготовьте рабочую станцию ПЦР (при использовании). Для подготовки рабочей станции протрите поверхность шкафа соответствующим дезинфицирующим средством и поместите необходимые предметы на рабочую станцию и закройте двери. Включите ультрафиолетовый свет на 10 минут
- Удалите регенты и грунтовки из морозильной камеры и оттепели (реагенты, перечисленные в таблице 1, и грунтовки в таблице2).
ПРИМЕЧАНИЕ: Ферментная смесь хранится в глицероле, поэтому не требует оттаивания и должна постоянно находиться на льду (или в прохладном блоке). Все остальные реагенты могут разморажиться при комнатной температуре. - После размораживания смешайте реагенты и центрифугу кратко для сбора жидкости.
ПРИМЕЧАНИЕ: Не вихрь фермента смесь, просто центрифуга кратко. - Приготовьте отдельные мастер-миксы для лиссавируса и з-актина. Для каждой реакции добавьте 7,55 л воды молекулярного сорта, 10 qL 2x Universal SYBR зеленая смесь реакции, 0,6 л форварда, 0,6 л обратной грунтовки, 0,25 л ферментной смеси iTaq RT.
- Используйте электронную таблицу для расчета правильных объемов, чтобы избежать ошибок при ручном вычислении. Убедитесь, что достаточно мастер-микс готов компенсировать ошибку трубачирования. Поэтому, если требуется 10 реакций (см. ПРИМЕЧАНИЕ в 3.1), подготовьте 12 реакций
- Подготовка мастер-микс на льду (или в прохладном блоке) и оставаться на льду до тех пор, пока помещается в машину в режиме реального времени.
- Смешайте подготовленные мастер-миксы, центрифуги кратко и обойтись 19 Зл в соответствующие скважины полосы труб или 96 хорошо пластины совместимы с в режиме реального времени машина в использовании.
ПРИМЕЧАНИЕ: Свести к минимуму производство пузырьков в скважинах во время pipetting. - В отдельной комнате, или в УФ-кабинете, подготовленном, как описано в 3.2, тщательно добавьте 1 зл РНК, ранее скорректированный до 1 мкг/Зл (см. шаг 1.5) под поверхностью соответствующего мастера-микс хорошо и аккуратно перемешайте. Отбросьте кончик пипетки в дезинфицирующее средство непосредственно после использования (под поверхностью).
- Добавить элементы управления после тестовых образцов, с положительным контролем добавил следующий и не шаблон управления (NTC - молекулярный класс воды) добавил последний. Количество используемой РНК может быть изменено в зависимости от типа образца, и экстракции РНК используется. Используемая сумма должна быть проверена для оптимизации реакции.
- Печать пластины с использованием крышки полосы или герметик заботиться, чтобы убедиться, что все крышки прочно закрыты и помечены достаточно, чтобы сориентировать образцы. Этикетка края пластины / полосы труб.
- Спин вниз образцы с помощью центрифуги, чтобы собрать всю жидкость на дне скважин.
- Передача пластины в режиме реального времени ПЦР машины, открыть дверь и место в держателе обеспечения правильного расположения / ориентации образцов в соответствии с расположением пластины.
ПРИМЕЧАНИЕ: Если используются прокладки трубки, убедитесь, что держатель на месте. - Откройте программу PCR в реальном времени и выберите опцию для эксперимента SYBR в режиме реального времени с кривой диссоциации. Программа в режиме реального времени PCR машины с использованием тепловых условий цикла, указанных в таблице 3, в том числе пунктов сбора данных.
- Выберите SYBR в качестве флуоресцентного красителя и выберите неизвестный тип образца и вставьте имя в правильное поле имени образца.
ПРИМЕЧАНИЕ: Дифференцируйте между репликациями, а также между лиссавирусом и скважинами з-актин. - Выберите местоположение файла, чтобы сохранить экспериментальные данные, убедитесь, что лампа будет выключена в конце запуска, а затем запустите запуск.
ПРИМЕЧАНИЕ: Поскольку первым шагом является этап RT, данные не собираются за это время, поэтому, если лампа требует периода разминки, это может произойти на этапе RT. Машина и программное обеспечение в режиме реального времени будут отображать кривые усиления в режиме реального времени, в то время как кривая плавления будет создана в конце цикла.
4. Анализ данных
-
После завершения выполнения выполните анализ данных следующим образом.
- Сначала проанализируйте результаты по плану усиления тестовых образцов наряду с контрольные образцы. Положительные образцы отображают экспоненциальные пандусы, обычно сопровождаемые плато и значением C t. Отрицательные образцы отображают плоские участки усиления без значений Ct (рисунок1A). Значение Ct автоматически рассчитывается программным обеспечением, хотя при необходимости его следует проверять и вручную изменять.
- Во-вторых, проанализируйте результаты кривой диссоциации тестовых образцов наряду с контрольными образцами. Положительный образец будет иметь температуру плавления (Tм) 77 - 80 градусов по Цельсию, и перекрываться с положительным контролем Рисунок 1B).
- Получите общий диагностический результат, гарантируя, что элементы управления действительны. Используйте таблицу 4 для интерпретации результатов по отношению к внутреннему контролю с актином. Если положительные контрольные пробы отрицательные и/или отрицательные пробы положительные, пробег следует игнорировать.
- Запись значений Ct и Tm, полученных для контрольной РНК в «контрольной карте», чтобы обеспечить анализ тренда и помочь определить заносы в чувствительности анализа.
Результаты
В соответствии с протоколом, описываемым выше, чувствительность пан-лиссавируса РТ-ПЦР была продемонстрирована на разбавлении серии стандартного вируса контроля (CVS) (Рисунок 1) и ряд других лиссавирусов (Рисунок 2ИРисунок 3). SYBR Green I краситель был использован в качестве универсального одноступенчатого RT-PCR, где синтез кДНА и усиление ПЦР осуществляются в одной трубке. По мере усиления конкретной цели происходит, больше красителя связан, в результате чего в режиме реального времени повышенные уровни флуоресценции. Все анализы красителя, пересекающиеся в режиме реального времени, должны интерпретироваться в два этапа: усиление и диссоциация. Фаза усиления идентична любому усилению в реальном времени (Рисунок 1A). Существует линейная «ранняя фаза» в ранних циклах, где усиление ДНК не может быть рассчитано из-за недостаточного сигнала по отношению к фону. Длина этого напрямую связана с количеством цели в образце. Впоследствии происходит экспоненциальная фаза, при которой обнаруживается и регистрируется удвоение молекул ДНК. Наконец, этап плато достигается (кроме сильно разбавленных образцов, которые могут не достичь этой фазы до конца программы). На этом этапе интенсивность флуоресценции выравнивается из-за истощения реагентов. Участок усиления, наблюдаемый с использованием 10-кратного серийного разбавления CVS, соответствовал ожидаемым участкам (Рисунок 1AC) где анализ лиссавируса продемонстрировал более высокую чувствительность, чем анализ «Актин». Кривая диссоциации была рассчитана после усиления, где dsDNA был диссоциирован в ssDNA путем постепенного повышения температуры и флуоресценции контролируется как функция температуры (Рисунок 1B, D-F). Пороговая температура, при которой специфический ампрессон диссоциируется в ssDNA, вызвала высвобождение флуоресценции, которая измерялась программным обеспечением термоциклора (TМ). Эта фаза диссоциации предоставила данные о размере ампронона, что позволило пользователю интерпретировать результат по сравнению с положительным контролем, что привело к незначительной вероятности ложноположительных результатов. TМнаблюдается для CVS с помощью пан-лиссавируса ассея (Рисунок 1B) и асссис-актин (Рисунок 1D) отличаются, и помогли пользователю, чтобы подтвердить правильный анализ анализа, отметив, TМполучено (Рисунок 1E). Кроме того, CTи TМзначения между пробегами и операторами были оценены и показаны как воспроизводимые (Таблица 5). Порог, используемый для расчета CTзначение было рассчитано автоматически программным обеспечением и зависело от многих факторов, включая набор реакций или используемый инструмент. За 12 независимых запусков среднее CTбыло 20,66 (SD 0.63) для азсавирусного асссея и 27,5 (SD 1.13) для ассса к-актина. В отличие от вариации, наблюдаемой в TМзначения были заметно ниже, из-за отсутствия внешних воздействий на это измерение. Например, среднее TМдля CVS lyssavirus ассса был 78,92 (SD 0.16) (Таблица 5), по сравнению со средним и всей лиссавирусами 78,81 КК (SD 0.531) (Таблица 6ИРисунок 1F). Это отсутствие вариаций в TМчерез Lyssavirusрод является выгодным, как тот же контроль РНК может быть использован независимо от лиссавируса в образце, однако дифференциация между лиссавирусами видов с использованием TМне представляется возможным, особенно потому, что различные подлинии RABV охватывали диапазон TМнаблюдаемые значения (Таблица 6). Неспецифические участки усиления редко наблюдаются с этим ассомом; однако для определения положительного результата по сравнению с неспецифическим отрицательным результатом требуются конкретные параметры. SD наблюдается во всех лиссавирусов (0,531) был применен к самым низким (77,34 - LBVa) и самый высокий (79,67 - IKOV) наблюдается TМзначения для установки диапазона 76,8 градусов по Цельсию - 80,2 градусов по Цельсию для положительных определенных полос. Таким образом, TМзначения за пределами этого диапазона были признаны неспецифическими и, следовательно, отрицательным результатом. Иногда в образце наблюдается несколько пиков. Если доминирующий пик находится на правильном TМ(для каждого репликации), то образец считается положительным. Наиболее распространенной причиной неспецифический пик наблюдается из-за грунтовки-dimers, ассес был оптимизирован, чтобы свести к минимуму грунтовки dimers. Праймер димеры обычно приводят к ампроцион меньше, чем в целевой последовательности, поэтому будет иметь TМниже, чем конкретный продукт.
10-кратное серийное разбавление трех лизавирусных положительных образцов мозга РНК, извлеченных с помощью TRIzol, были запущены параллельно и построены(рисунок 2). Предел обнаружения трех лиссавирусов варьировался, но ни один из них не превышал Ct 36. Значения коэффициента R2 для вирусов, нарисованных на рисунке 2, варьировались от 0,9637 и 0,996. Для всех анализируемых вирусов(таблица 6) диапазон не превышал этого, кроме того, 7 из 29 лиссавируса были R2 йgt;0.99 (данные не показаны). Принимая во внимание, что подготовка серии разбавления происходит от общего объема извлечения РНК, наблюдаемая линейность свидетельствует о том, что результаты такого расследования являются надежными. Наконец, обнаружение всех видов лиссавирусов (особенно самых разнообразных вирусов филогруппы III) было исследовано с помощью панели РНК, охватывающей все три филогруппы в лиссавирусном роду. РНК, извлеченная из оригинальных или экспериментально инфицированных мышей, мозгового материала, была использована с помощью протоколов, описанных выше. Результаты подтверждают, что праймеры усиливают все виды лиссавирусов, включая дивергентную филогруппу III лиссавирусов IKOV, WBCV и LLEBV(таблица 6 и рисунок 3). Разнообразная панель не-лиссавирусных рабдовирусов, первоначально собранных и проанализированных антигенически16, а в последнее время генетически17 были проверены и не-кросс реактивности был обнаружен, что указывает на то, что грунтовки являются специфическими для только представители рода лиссавирусов (данные не показаны). Пан-лиссавирус в режиме реального времени анализ был включен в EURL (ЕС Справочная лаборатория) межлабораторных схем владения с 2013 года, демонстрируя 100% соответствие с другими молекулярными assays, таких как пан-лиссавирус TaqMan анализ и обычный RT-PCR анализ в дополнение к FAT (флуоресцентные антитела тест).
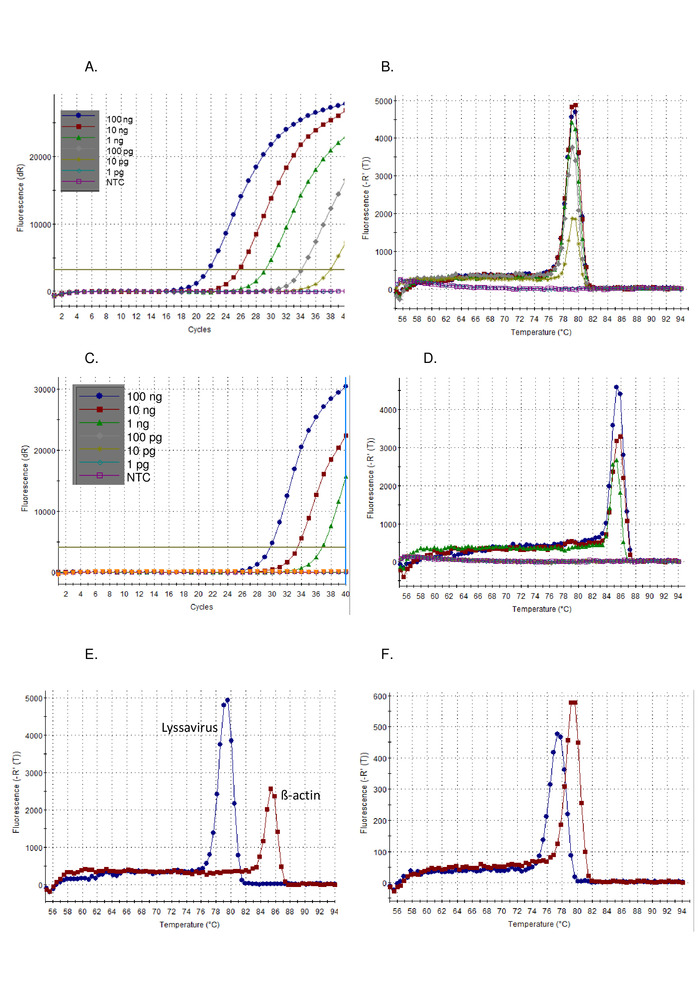
Рисунок 1: 10-раз серийное разбавление CVS положительного контроля РНК, работать на пан-лизавирус RT-PCR асссе, визуализированы как участок усиления (A), и дезинфицировать кривой (B), и работать на з-актин RT-PCR ассса визуализированы как участок усиления (C), и кривая диссоциации (D). NTC - нет шаблона управления. Сравнение РНК управления CVS, проводимого как на пан-лиссавирусе RT-PCR, так и на ассе «Актин РТ-ПЦР» (красный), демонстрирующий разницу в кривых диссоциации (E) - см. таблицу 5 для средних значений; и, наконец, кривые диссоциации для LBVa (синий) и IKOV (красный), демонстрирующий диапазон значений Т м, наблюдаемых в роду Lyssavirus (F ). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
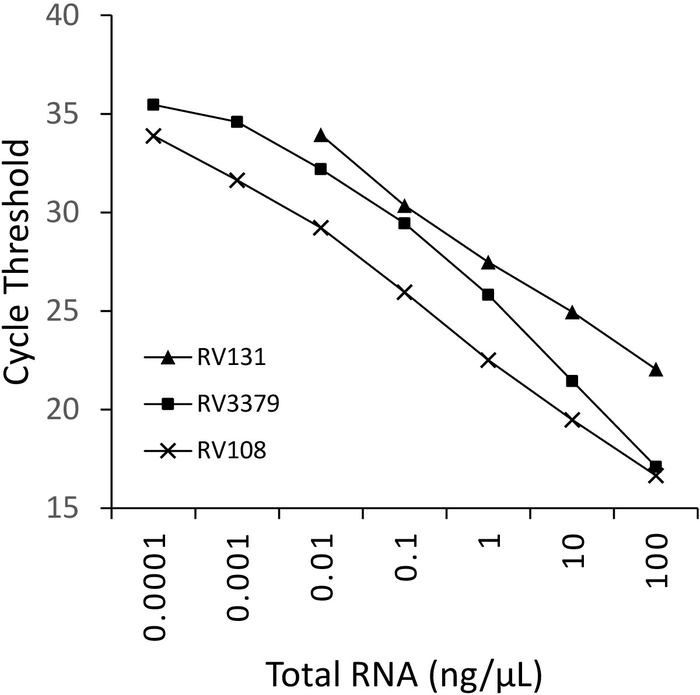
Рисунок 2: 10-кратное серийное разбавление трех видов лиссавирусов: RABV (RV108), DUVV (RV131) и ARAV (RV3379). R2 0,996, 0,9962 и 0,9637 соответственно. Точки данных на уровне 10-7 (0,0001 нг/Л) достигли предела обнаружения (где было получено значение). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
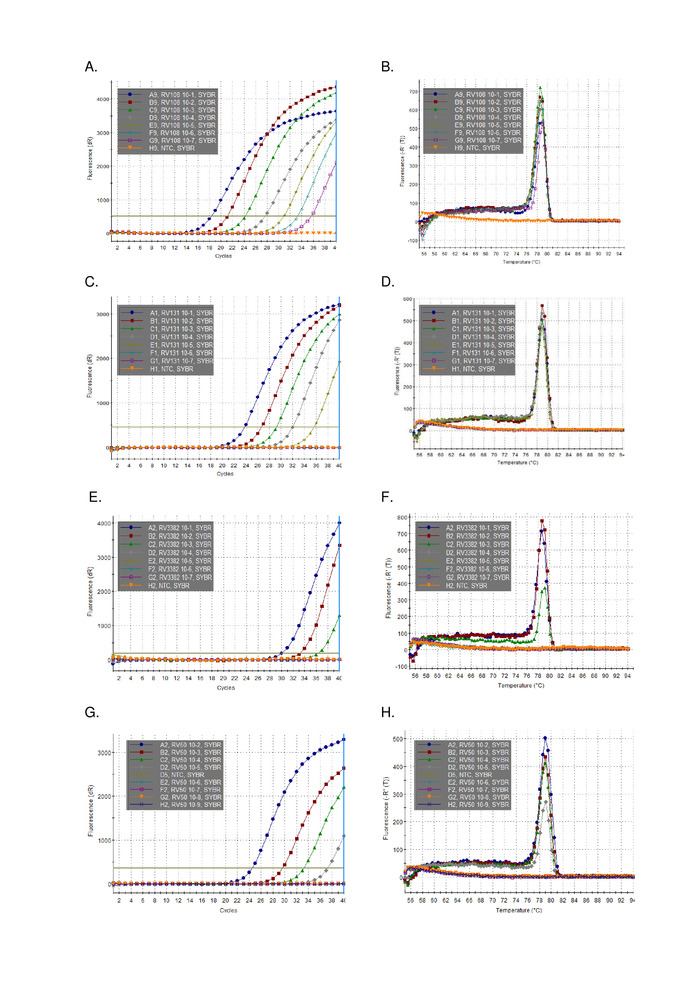
Рисунок 3: Репрезентативные 10-кратные данные о последовательном разбавлении со всего рода лиссавирусов (см. отдельные легенды о лиссавирусной идентичности и таблицу 6 для табличных результатов по сравнению с другими лиссавирусами). Панели A, C, E, G усиления участков и B, D, F, H декорации кривых для A, C, E и G соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Реагента | Л/Реакция |
| Молекулярная вода класса | 7.55 75 |
| 2x Универсальный RT PCR реакция смесь микс | 10 Лет |
| Праймер Форвард (20 мкм) | 0,6 |
| Праймер Обратный (20 мкм) | 0,6 |
| Смесь ферментов RT | 0,25 |
| Итого за реакцию | 19 лет |
Таблица 1: Пан-лиссавирус в режиме реального времени RT-PCR мастер смеси реагентов.
| Анализа | Имя праймер | Роль праймера | Последовательность 5'-3' | Позиция1 |
| Лиссавирус | JW12 | РТ-ПКР | ATG TAA CAC CYC TAC AAT G | 53-73 |
| N165 | Пцр | GCA GGG TAY TTR TAC TCA TCA TA | 165-146 | |
| - актин | Интроник в актине | Пцр | CGA TGA AGA TCA AGA TCA TTG | 1051-1072 |
| Обратный актин-актин | РТ-ПКР | AAG CAT TTG CGG TGG AC | 1204-1188 | |
| Позиции праймера приведены в связи с последовательностью вируса Пастера (M13215) и последовательности генов мыши и актина (NM-007393) | ||||
Таблица 2: Пан-лиссавирус в режиме реального времени RT-PCR праймер детали.
| Этапе | Циклов | Температура | Время | Сбор данных |
| Обратная транскрипция | 1 | 50 кв. c | 10 мин. | |
| Инактивация/начальная денатурация RT | 1 | 95 кв. c | 5 мин. | |
| Усиления | 40 г. | 95 кв. c | 10 с | |
| 60 кк | 30 с | конечная точка | ||
| Анализ кривой диссоциации | 1 | 9 кв. м | 1 мин. | |
| 55 кк с | 1 мин. | |||
| 55 - 95 градусов по Цельсию | 10 с | все точки |
Таблица 3: Пан-лиссавирус в режиме реального времени RT-PCR велосипедных условиях.
| Результат теста | Внутренний контроль за актином | Общий результат |
| Отрицательные | Отрицательный1 | Недопустимый. Повторите добычу и асссеи2 |
| Отрицательные | Положительные | Отрицательный результат, сообщенный |
| Положительные | Положительные | Положительный результат, о которых сообщается |
| Положительные | Отрицательный1 | Повторите добычу и просажение3 |
| 1 Использование гетерологового внешнего контроля было бы полезно при повторной добыче. | ||
| 2 Если второй отрицательный результат получен для внутреннего контроля, образец будет сообщен как непроверяемый этим анализом. | ||
| 3 Если второй отрицательный результат получен для внутреннего контроля, наряду с положительным результатом теста вторичного бешенства | ||
| диагностический тест должен быть проведен, чтобы подтвердить этот результат. | ||
Таблица 4: Резюме результатов и общих результатов для пан-лиссавируса в режиме реального времени RT-PCR. Отрицательный назначается образцу без значения Ct (усиление) и без температуры расплава (диссоциация), или температуры расплава, которая находится за пределами диапазона Тм для положительных лиссавирусов (76,8 градусов по Цельсию - 80,2 градуса по Цельсию). Положительный назначается образцу со значением Ct (усиление) и температурой расплава (диссоциация), которая находится внутри диапазона Тм для положительных лиссавирусов.
| Лыссавирусная ассса | Асссеи-актин-ассси | |||
| Ct | Тм | Ct | Тм | |
| Означает | 20.66 Для | 78,92 | 27.5 | 85,26 |
| Sd | 0,63 | 0,16 | 1.13 | 0,35 |
| LCL (95%) | 19.39 Для того, чтобы | 78,59 | 25.23 02.03.20.201 | 84.56 Г. |
| UCL (95%) | 21.93 | 79,25 | 29.76 | 85,96 |
Таблица 5: Межрегиональный анализ положительного контроля CVS в 12 независимых трассах, включая нескольких операторов.
| Филогруппа | Видов | Идентификатор вируса | Линии | Предел обнаружения | Тм |
| Я | РАБВ | RV50 | Сша летучая мышь | 10-5 | 79,5 |
| Я | РАБВ | RV51 | США Фокс | 10-7 | 77,6 |
| Я | РАБВ | RV108 | Чили летучая мышь | 10-7 | 78,63 |
| Я | РАБВ | RV313 | Европейская лиса | 10-9 | 78,53 |
| Я | РАБВ | RV437 | Европейский RacDog | 10-7 | 78.09 |
| Я | РАБВ | RV1237 | Европейский олень | 10-8 | 78,76 |
| Я | РАБВ | RV334 | Китайская вакцина | 10-8 | 79.03 |
| Я | РАБВ | RV102 | Африка 2 | 10-7 | 78,58 |
| Я | РАБВ | RV995 | Африка 3а | 10-8 | 79,66 |
| Я | РАБВ | RV410 | Африка 3b | 10-7 | 79.03 |
| Я | РАБВ | RV2324 | Африка 4 | 10-7 | 79.17 |
| Я | РАБВ | RV2417 | Шри-Ланка Собака | 10-9 | 78,71 |
| Я | РАБВ | CVS-11 | 10-7 | 79.17 | |
| Я | EBLV-1 | RV20 | Германия | 10-6 | 79.05 |
| Я | EBLV-2 | RV1787 | Великобритании | 10-7 | 78,76 |
| Я | BBLV | RV2507 | Германия | 10-9 | 78,71 |
| Я | Ablv | RV634 | 10-8 | 78,25 | |
| Я | DUVV | RV131 | 10-5 | 79.03 | |
| Я | GBLV | RV3269 | 10-7 | 79.15 | |
| Я | ARAV | RV3379 | 10-7 | 79.46 Часть | |
| Я | ХУВ | RV3380 | 10-7 | 78,97 | |
| Я | SHIBV | RV3381 | 10-7 | 78,59 | |
| Я | ИРКВ | RV3382 | 10-3 | 78,59 | |
| Ii | LBVa | RV767 | 10-5 | 77.34 | |
| Ii | LBVd | RV3383 | 10-7 | 78,59 | |
| Ii | МОКВ | RV4 | 10-3 | 78,81 | |
| Iii | ИКОВ | RV2508 | 10-5 | 79,67 | |
| Iii | LLEBV | RV3208 | 10-4 | 79.15 | |
| Iii | WCBV | RV3384 | 10-3 | 79 |
Таблица 6: Резюме пан-лиссавируса в режиме реального времени RT-PCR специфичность, чувствительность и Tм для репрезентативных лиссавирусов во всех трех филогрупп. Средний Tm через лиссавирусы был 78,81 (SD 0.531).
Обсуждение
Пан-лиссавирус в режиме реального времени RT-PCR ассси описано закрытой трубки, один шаг ассс, который обнаруживает лиссавирусы во всех трех филогрупп. Анализ был подтвержден как для животных, так и для человека, диагностики бешенства, в том числе посмертной ткани мозга (оптимально ствол мозга), и анте-мортем образцов, таких как биопсия кожи, последовательно собранной слюны, или спинномозговой жидкости (CSF). Праймеры, используемые в этом ассее, были впервые разработаны и использованы для зонда на основе асссе, чтобы различать RABV, EBLV-1 и EBLV-23, который был использован во многих лабораториях МЭБ бешенства и последовательно выполняет в EURL махинаций мастерства. Впоследствии "пан-лиссавирус" характер этих грунтовки была подтверждена с помощью 2-шаг в режиме реального времени асссы15. В описанном здесь ассе использовался праймер для дальнейшей оптимизации RT-PCR в одноэтапном sYBR-оценке, позволяющей замкнутую трубку, быструю систему. Кроме того, обучение в эндемичных странах бешенства с использованием этого анализа подтвердило пригодность для внедрения в любой лаборатории с базовыми системами СИЗ и качества для уменьшения перекрестного загрязнения и следов образцов, средств для хранения реагентов и в режиме реального времени машина с обнаружением SYBR. Анализ является чрезвычайно надежным и имеет 100% корреляцию с FAT, с улучшенной чувствительностью для разложившихся образцов3. Одним из основных преимуществ для ДНК интеркалирования красителя на основе анализа по сравнению с зондом на основе анализа является относительная стоимость. Дополнительным преимуществом является то, что анализ использует только два грунтовки, поэтому существует меньший риск неудачного обнаружения из-за расхождения последовательности, которая была слабостью в ранее опубликованных зондных анализов. Действительно, представители всех видов лиссавирусов (кроме TWBLV и KBLV) обнаруживаются с помощью этого анализа, и анализ последовательности TWBLV и KBLV на сайтах праймера не показывает значительных расхождений, что убедительно свидетельствует о том, что они также будут обнаружены с помощью этот метод. Диапазон пределов обнаружения, наблюдаемый среди анализируемых вирусов, можно считать обусловленным двумя основными факторами. Во-первых, РНК была выделена из клинического материала мозга, поэтому количество копий генома в каждом неразбавленном образце напрямую несопоставимо. РНК была «нормализована» путем корректировки общей РНК до 1 мкг/ЗЛ; однако доля РНК вирусного генома в этой выборке будет варьироваться. Во-вторых, разнообразие последовательностей лиссавируса, несмотря на то, что грунтовые участки расположены в законсервированных регионах, остаются вариационные позиции. Поэтому неудивительно, что большинство лиссавирусов с более низкой чувствительностью к анализу являются вирусами филогруппы II и III. Анализ кривой диссоциации представляет собой важный параметр, минимизирующий ложноположительный результат, который в противном случае мог произойти из-за образования грунтовых димеров или усиления неспецифического региона в геноме хоста. В действительности, это редкое явление, и анализ кривой диссоциации эквивалентен запуску геля агарозы, чтобы визуализировать правильно по размеру обычные ампулы RT-PCR. Диапазон приемлемых значений Тм был предоставлен (77-80 градусов по Цельсию), на основе данных, собранных в нашей лаборатории. Настоятельно рекомендуется, чтобы отдельные лаборатории сопоставляют внутренние данные для обеспечения передачи диапазона и соответствующим образом вносить изменения. Интерпретация результатов как от участка усиления, так и от диссоциации, наряду с положительным и отрицательным контролем и результатами « актина», обеспечивает надежные и воспроизводимые диагностические результаты.
Вне сферы действия этого протокола находится метод извлечения РНК, используемый для получения высококачественной РНК. Вся РНК, проанализированные в этом протоколе, была подготовлена с использованием TRIzol; однако, Есть много подходящих гуанидий на основе извлечения РНК протоколы извлечения доступны, в том числе колонки и бис основе комплектов извлечения. Обработка лиссавирусных положительных (или предполагаемых положительных) проб должна осуществляться в пределах лицензированных биосодержащих средств, утвержденных в пределах страны. Тем не менее, общая добытая РНК не является инфекционной, поэтому обрабатывается в лабораториях с низким содержанием. В зависимости от используемого метода извлечения необходимо будет оценить необходимость количественной оценки и разбавления РНК. Для экстрактов на основе фенола, включая TRIzol, этот шаг необходим и предотвращает ингибирование анализа от загрязнения гДНК; однако, выдержки на основе столбцов и биса (особенно с стадиями истощения ДНК) не требуют разбавления перед тестированием.
На протяжении всего протокола, важно, чтобы уход и осмотрительность используются для предотвращения перекрестного загрязнения и точного добавления образца к правильным скважинам. Электронная таблица с расчетами реагента и макетом пластин доступен для скачивания в качестве дополнительного файла. Надувная лабораторная практика, включая чистую рабочую поверхность, регулярные изменения перчаток, использование барьерных наконечников и различных комнат/УФ-кабинетов для разделения каждого этапа, сведет к минимуму вероятность загрязнения. Для обеспечения выполнения теста с ожидаемыми параметрами необходимо включить положительные и отрицательные элементы управления и провести все тестовые образцы в дубликате (или тройном).
Включение элементов управления является важной особенностью любого ПЦР, особенно для диагностики. Позитивная контрольная РНК была подготовлена из CVS (стандарт вируса вызова) инфицированных мозгов мыши партиями и проверена и откалибрована для обеспечения согласованности между партиями. Контрольная РНК была количественно оценена и разбавлена до 1 мкг/Л. РНК, для которой положительный результат был получен в серийном разбавлении до по крайней мере 10-4 (равно 100 пг/ Л) был признан пригодным для цели. Положительный контроль РНК хранился при -80 градусов по Цельсию в 10-1 aliquots. При необходимости аликот был разбавлен 1:100, чтобы обеспечить рабочий запас при 1 нг/Л и храниться при -80 градусов по Цельсию в 5 qL одноразового использования aliquots. Разбавленная РНК положительного контроля использовалась для представления низкоуровневых положительных проб и для обеспечения того, чтобы было обнаружено любое снижение чувствительности анализа. Для каждого элемента управления была сохранена «контрольная карта» для мониторинга значений Ct и определения тенденций (таблица5). Таблица 5 продемонстрировала хорошую межранжистую сопоставимость для положительной контрольной выборки Ct и Tm значений CVS в течение нескольких дней и операторов, обеспечивая уверенность в том, что анализ является надежным и воспроизводимым. Результаты, которые отклоняются от этих измерений, должны быть исследованы и при необходимости повторять образцы. Молекулярная вода была включена в каждый запуск в качестве NTC, чтобы подтвердить, что реагенты были свободны от загрязнения лиссавирусной РНК и подтвердить отрицательный образец. Кроме того, для обеспечения эффективности извлечения РНК, «Актин» был протестирован вместе с испытательными образцами в отдельной трубке. Лиссавирусположительный контроль РНК был также использован для положительного контроля з-актина. Другие эндогенные гены или гетерологические системы внутреннего контроля могут быть использованы. Использование этих элементов управления гарантирует, что все шаги были проанализированы в тех же условиях, что и тестовые образцы. Иногда, если образец был сильно деградирован или не содержал достаточное количество РНК-хозяина (например, слюны или CSF), эндогенный ген ПЦР может выдать себя за то. В данном случае, когда результат lyssavirus в реальном времени RT-PCR был положительным, подтверждение на независимой экстракции РНК - чтобы исключить загрязнение во время извлечения РНК на исходном тесте или вторичном тесте (либо молекулярном, например, обычном RT-PCR) , или FAT. Использование таблицы 4 при анализе диагностической выборки обеспечило правильное толкование.
Независимо от молекулярного анализа, используемого для подтверждения инфекции бешенства, следить за исследованиями с помощью секвенирования Sanger для определения лиссавирусного вида и классических методов в вирусологии, таких как FAT или изоляция вируса также должны быть предприняты, чтобы позволить дальнейшей характеристики вируса и поддержка уведомления о положительных случаях МЭИ и ВОЗ.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить мисс Эмму Уайз и мисс Меган Голдинг за помощь в завершении экспериментов. Разработка этого протокола была финансово поддержана Департаментом Великобритании по окружающей среде, продовольствию и сельским делам (Defra), шотландским правительством и правительством Уэльса грантами «SV3500 и SE0431» и проектом Европейского вирусного архива (EVAg), который имеет получил финансирование от научно-исследовательской и инновационной программы Европейского союза «Горизонт 2020» в рамках грантового соглашения No 653316.
Материалы
| Name | Company | Catalog Number | Comments |
| Art Barrier pipette tips (various sizes) | Thermofisher | various | |
| Centrifuge | Beckman | Allegra 21R | Rotor capable of holding 96 well plates required. Step 3.8. |
| Centrifuge (mico) | Sigma | ||
| Finnpipettes (to dispense 0.5-1,000 µL) | Thermofisher | various | |
| iTaq Universal SYBR Green One-Step RT-PCR kit | Bio-Rad | 172-5150 | Equivalent kits can be used if validated |
| MX3000P or MX3005P real-tme PCR system | Stratagene | N/A | Eqivalent machines can be used if validated |
| MicroAmp reaction plate base | Any suitable | Used to hold tube strip and plates securely. | |
| Optically clear flat clear strips (8) | ABgene | AB-0866 | |
| Perfect fit frame (if using tube strips) | Stratagene | N/A | Specific to machine |
| Primers: for primer details see Table 2. | Ordered at 0.05 µmole scale HPLC purified. | ||
| Thermo-Fast 96 well plares, non skirted | ABgene | AB-600 | |
| Thermo-Fast strips (8) Thermo-tubes | ABgene | AB-0452 | |
| Vortex machine / Whirlimixer | Fisons Scientific equipment | SGP-202-010J | |
| Unless stated, alternative equipment can be used |
Ссылки
- . OIE. OIE Terrestrial Manual 2018. , 8-14 (2018).
- Panning, M., et al. Comparative analysis of rabies virus reverse transcription-PCR and virus isolation using samples from a patient infected with rabies virus. Journal of Clinical Microbiology. 48 (8), 2960-2962 (2010).
- Wakeley, P. R., et al. Development of a real-time, TaqMan reverse transcription-PCR assay for detection and differentiation of lyssavirus genotypes 1, 5, and 6. Journal of Clinical Microbiology. 43 (6), 2786-2792 (2005).
- Wang, L., et al. A SYBR-green I quantitative real-time reverse transcription-PCR assay for rabies viruses with different virulence. Virologica Sinica. 29 (2), 131-132 (2014).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR Assay for the Detection of Highly Variable Rabies virus and Other Lyssaviruses. PLOS Neglected Tropical Diseases. 11 (1), e0005258 (2017).
- Nadin-Davis, S. A., Sheen, M., Wandeler, A. I. Development of real-time reverse transcriptase polymerase chain reaction methods for human rabies diagnosis. Journal of Medical Virology. 81 (8), 1484-1497 (2009).
- Hoffmann, B., et al. Improved safety for molecular diagnosis of classical rabies viruses by use of a TaqMan real-time reverse transcription-PCR "double check" strategy. Journal of Clinical Microbiology. 48 (11), 3970-3978 (2010).
- Faye, M., et al. Development and validation of sensitive real-time RT-PCR assay for broad detection of rabies virus. Journal of Virological Methods. 243, 120-130 (2017).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLOS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Fooks, A. R., et al. Rabies. Nature Reviews Disease Primers. 3, 17091 (2017).
- Marston, D. A., et al. Ikoma lyssavirus, highly divergent novel lyssavirus in an african civet. Emerging Infectious Diseases. 18 (4), 664-667 (2012).
- . Virus Taxonomy: 2018 Release: Email ratification October 2018 (MSL #33) Available from: https://talk.ictvonline.org/taxonomy/ (2018)
- Hu, S. C., et al. Lyssavirus in Japanese Pipistrelle, Taiwan. Emerging Infectious Disease. 24 (4), 782-785 (2018).
- Nokireki, T., Tammiranta, N., Kokkonen, U. M., Kantala, T., Gadd, T. Tentative novel lyssavirus in a bat in Finland. Transboundary and Emerging Diseases. 65 (3), 593-596 (2018).
- Hayman, D. T., et al. A universal real-time assay for the detection of Lyssaviruses. Journal of Virological Methods. 177 (1), 87-93 (2011).
- Calisher, C. H., et al. Antigenic relationships among rhabdoviruses from vertebrates and hematophagous arthropods. Intervirology. 30 (5), 241-257 (1989).
- Aznar-Lopez, C., et al. Detection of rhabdovirus viral RNA in oropharyngeal swabs and ectoparasites of Spanish bats. Journal of General Virology. 94 (1), 69-75 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены