Method Article
Pan-Lyssavirus gerçek zamanlı RT-PCR Rabies tanı için
Bu Makalede
Özet
DsDNA enterkalasyon boya kullanarak bu gerçek zamanlı RT-PCR Lissavirüse enfeksiyonları teşhis etmek için uygundur. Yöntem, kuduz şüpheli ante-mortem veya post-mortem örneklerinden çıkarılan RNA ile başlar, ana karışım hazırlama, RNA ilavesi, gerçek zamanlı makinenin kurulumu ve sonuçların doğru yorumlanması hakkında ayrıntı.
Özet
Moleküler tanı, hızlı, hassas ve spesifik ve kuduz teşhis için merkezi haline gelmiştir. PCR tabanlı tanılar, kuduz teşhisi onaylamak için yıllardır kullanılmıştır, ancak son zamanlarda kuduz enfeksiyonu tespit etmek için birincil bir yöntem olarak OIS (Dünya Hayvan Sağlığı Örgütü) tarafından kabul edilmiştir. Gerçek zamanlı RT-PCR sistemleri, gerçek zamanlı veri sağlar ve kapalı boru sistemleridir ve kurulum sırasında kontaminasyon riskini en aza indirir. DNA enterkalasyon fluorokrom gerçek zamanlı RT-PCR deneyleri pahalı problar gerektirmez, örnek başına maliyeti en aza indirmek, ve astar, koruma altındaki bölgelerde tasarlanmış olduğunda, sadece bir virüs özel yerine virüs cins arasında spesifik olan türleri mümkündür. Burada en farklı virüsler ikov, wcbv ve llebv de dahil olmak üzere Lyssavirus cins arasında lyssaviruses algılar bir Pan-Lyssavirus sybr gerçek zamanlı RT-PCR tahlil açıklanmaktadır. Ayrışma eğrisi analizi ile birlikte, bu tahlil hassas ve spesifik, tüm Lissavirüse türlerinin tespiti avantajı ile. Tahlil, hayvan ve insan kuduz vakalarının sağlam, hızlı, hassas tanısı sağlayarak, kaliteli güvence ortamları ile birçok tanı laboratuvarlarında benimsenmiştir.
Giriş
Moleküler metodolojileri kullanarak kuduz tanısı, 20181' de oI tarafından kabul edildi, bu tekniklerin kuduz vakalarının onaylanması, özellikle örneklerin alt-optimum olduğu durumlarda veya ante-mortem tanısı için avantajları tanınması, Canlı virüs veya taze örnekler için hiçbir gereksinimi olduğu gibi. PCR, lyssaviruses için bir ters Transkripsiyon (RT) gerektirdiğinden önce PCR, genom RNA olarak başlayabilir. RT-PCR, genomun 3 ' proksimal bölgesini algılamayı, Lissavirüse çoğaltması sırasında transkripsiyonel degradelerin oluştuğu gibi en hassas olarak kabul edildiğini gösteriyor. Yaygın olarak kullanılan RT-PCR deneyleri iki kategoride, son nokta (veya jel tabanlı) ve gerçek zamanlı olarak bölünmüş olabilir. Her iki yaklaşım duyarlı ve özeldir; Ancak, gerçek zamanlı tahlil gibi bazı ek faydaları vardır ' gerçek zamanlı ' sonuçları elde etmek ve tamamen kapalı bir tüp sisteminde gerçekleştirilen, böylece operatör kontaminasyonu potansiyelini azaltmak. Gerçek zamanlı uygulamalar kullanılarak elde edilen Lyssavirus özel amplikonlar algılamak için iki ana yaklaşımlar vardır. İlk hidroliz probları kullanır (örneğin TaqMan problar) bir fluorophore ve bir Quencher içerir. Prob, amplifikasyon sırasında hedef bölgeye bağlandığında, polimeraz 'nin eksonükleaz aktivitesi fluorophore ve Quencher 'ın dağılmasına neden olur ve bu da ortaya çıkan floresans ölçülmesini sağlar. İkinci bir DNA enterkalasyon boya kullanır (fluorokrom sybr yeşil gibi) amplifikasyon sırasında çift sıkışmış DNA bağlar. Bağlı florokromlarla, her döngüde algılanan floresans yayarak ürünün gerçek zamanlı algılanmasını ve ölçülmesini sağlar. Herhangi bir dsDNA bağlama spesifik olmayan doğası nedeniyle, bir ayrışma eğrisi Analizi reaksiyon özgüllüğü onaylamak için üstlenilir. Gerçek zamanlı RT-PCRs küçük amplikon boyutları nedeniyle hızlı, genellikle az 200 BP uzunluğunda; Bununla birlikte, uygun bölgeleri tespit eden alanlarda astar ve problar tasarlamak için, zorlu olabilir, bu nedenle bir prob gereksinimini kaldırmak farklı bir avantajdır.
Bir dizi gerçek zamanlı RT-PCRs özellikle bireysel suşları veya rabv2 sırlarını tespit etmek ve aynı zamanda cins3,4,5,6arasında lyssaviruses algılamak için tasarlanmıştır 7,8,9. Tüm asdaların, astar (ve gerekirse, prob) dizileri cins üzerinde olduğu nasıl bağlı algılama bağımlı bir sınırı olacaktır. Nitekim, ortaya çıkan veya yeni virüs suşları son derece spesifik prob tabanlı etkili etkisiz hale getirebilir. Gerçek zamanlı algılama (boya ve prob) seçimi amaçlanan uygulamaya bağlı olacaktır. Yerel kaynaklı beyin malzemesi üzerinde gözetim yapan ve negatif numunelerin yüksek sayıda beklediği bir laboratuar için, ucuz enterkalasyon boya kullanımı mantıklı bir seçimdir. Sybr yeşil yaklaşımı, aynı zamanda, roman veya farklı lyssaviruses varlığının daha kısıtlı prob bazlı bilgi tarafından algılanmazsa kalacağı tarama gözetimi yaparken de optimum olacaktır.
Cins Lyssavirus tüm üyeleri hastalık kuduz neden, belirtiler görünür kez ölümcül olan. İnsan ve hayvan kuduz vakalarının büyük çoğunluğu kuduz virüsü (RABV), yerli köpek10olan baskın rezervuar kaynaklanmaktadır. Yarasalar lyssaviruses için önemli ev sahibi rezervuarlar ve tüm ama iki Lissavirüse türleri karakterize tüm yarasalar doğrudan tespit edilmiştir-Ikoma Lissavirüse (ıkov) ve mokola virüs (mokv)-ve bu iki, ıkov bir yarasa ev sahibi rezervuar için spekülasyonlar olmuştur 11. 16 tanınan Lissavirüse türünün yanı sıra12, son zamanlarda açıklanan iki lyssaviruses vardır: Tayvan bat Lissavirüse (twblv)13 ve Kotalahti bat Lissavirüse (KBLV)14. Lyssaviruses genetik üç phylogroups bölünebilir, lyssaviruses çoğunluğu ile, RABV dahil, phylogroup ı ait. Ancak, en farklı lyssaviruses phylogroup III aittir ve RT-PCRs rabv veya phylogroup I virüs dizileri hedef için tasarlanmış tarafından algılanması olası değildir.
Tahlil burada açıklanan gerçek zamanlı primer çifti JW12-N165, ilk 2005 içinde açıklanan kullanır3. Astarlar Pan-Lissavirüse olmak için tasarlanmış olsa da orijinal uygulama problar ile bir TaqMan assay olarak Lissavirüse türlerini ayırt etmek oldu. Primer çifti özgüllük Pan-Lissavirüse olduğunu sonraki onay wcbv15dahil olmak üzere tüm Lissavirüse türleri üzerinde 2 adımlı sybr gerçek zamanlı tahlil kullanılarak elde edildi. Primer çifti burada açıklanan bir adım RT-PCR gerçek zamanlı tahlil bir enterkalasyon fluorokrom kullanarak, tüm temsilcileri kullanılarak doğrulanmış 16 tanınan Lissavirüse türleri. Bu bir adım gerçek zamanlı tahlil hızlı, hassas, Lissavirüse özgü tahlil ve astar sağlamlık bile son derece farklı Lissavirüse türleri belirlemek için ayarlanmış olduğunu göstermektedir.
Protokol
Tanı malzemesinden örnekler, doğal enfeksiyondan sonra APHA ' de alınan veya ınoculating fareler tarafından elde edilen protokolleri kullanarak, APHA etiği ve İstatistik Komitesi altında INGILTERE ev ofisi Yönetmeliği altında lisans 70/7394.
1. mikro hacim spektrofotometresi kullanılarak RNA 'nın ölçülmesini
- Spektrofotometrenin ayarlarının RNA 'ya ayarlandığından emin olun.
- Makine başlatmak ve bir taban çizgisi ayarlamak için 1-2 μL moleküler dereceli su kullanın.
- RNA miktarını değerlendirmek için her test RNA örneğinden 1-2 μL kullanın.
- Okumaları ve dokümanı kaydedin.
- Gerekirse RNA 'ya 1 μg/μL olarak ayarlayın.
Not: RNA her zaman buzda (veya serin bir blokta) tutulmalıdır. RNA bir sütun veya boncuk bazlı yöntem kullanılarak elde ediliyorsanız RNA genellikle 1 μg/μL 'den daha azdır. Bu durumda RNA düzgün kullanın.
2. son nokta hassasiyetini belirlemek için RNA seyreltme serisinin hazırlanması
-
RNA 'nın 10 kat seri seyreltme yapın.
- Seyreltme serisi (örn., 10-1, 10-2, vb.) ve RNA detayları ile etiket tüpleri.
- Her tüpe 45 μL moleküler dereceli su ekleyin.
- RNA 'nın 5 μL 'sını ekleyin (daha önce 1 μg/μL 'ye seyreltilmiş) ve iyi karıştırın.
- Pipet ucunu uygun dezenfektan içine atın ve yeni bir uç ile değiştirin.
- 10-1 ' e 5 μL alın ve 10-2 tüpüne ekleyin ve iyi karıştırın.
- Geri kalan seyreltme ile 2.1.3-2.1.5 tekrarlayın.
Not: RNA her zaman buzda (veya serin bir blokta) tutulmalıdır.
3. gerçek zamanlı RT-PCR reaksiyonları hazırlanması
- Bir elektronik tablo kullanarak, hem Lissavirüse hem de β-actin testleri için plaka düzenini test numunelerinin sayısına ve kontrol örneklerine göre planlayın.
Not: Eğer 4 numune, pozitif ve negatif kontrol ile çoğalmakta test ediliyorsa, bu her iki konuda da 10 reaksiyona eşittir. - RNA şablonundan ayrı bir ' temiz oda ' veya alanda, kullanmadan önce uygun bir dezenfektan ile yüzeyleri silin veya bir PCR iş istasyonu hazırlayın (kullanıyorsanız). İş istasyonunu hazırlamak için, dolap yüzeyini uygun bir dezenfekte ile silin ve gerekli maddeleri iş istasyonuna yerleştirin ve kapıları kapatın. UV ışığını 10 dakika boyunca açın
- Buzluğu ve çözülme (tablo 1 ' de listelenen reaktifler ve Tablo 2' de astar) ile reagents ve astarlar çıkarın.
Not: Enzim karışımı gliserol içinde saklanır, böylece çözme gerektirmez ve buz üzerinde tutulması gerekir (veya serin bir blok) her zaman. Diğer tüm reaktifler oda sıcaklığında çözülür. - Bir kez çözülmüş, reaktifler karıştırın ve sıvı toplamak için kısa bir süre Santrifüjlü.
Not: Enzim karışımı Vortex etmeyin, sadece kısaca Santrifüjü. - Lissavirüse ve β-actin için ayrı ana karışımları hazırlayın. Her reaksiyon için, 7,55 μL moleküler sınıf su, 10 μL 2x Universal SYBR yeşil reaksiyon karışımı, 0,6 μL ileri astar, 0,6 μL ters astar, 0,25 μL ıtaq RT enzim karışımı ekleyin.
- El ile hesaplamada hataları önlemek için doğru birimleri hesaplamak üzere bir elektronik tablo kullanın. Pipetleme hatasını telafi etmek için yeterli Master-Mix hazır olduğundan emin olun. Bu nedenle 10 reaksiyon gerekiyorsa (bkz. 3,1 Not), 12 reaksiyon hazırlayın
- Ana karışımı buzda (veya serin bir blokta) hazırlayın ve gerçek zamanlı makineye yerleştirilinceye kadar buzda kalın.
- Hazırlanan Master-karışımları karıştırın, kısa sürede santrifüjün ve 19 μL 'i şerit tüplerinin ilgili kuyularını veya 96 iyi plakayı kullanarak gerçek zamanlı makine ile uyumludur.
Not: Pipetleme sırasında kuyularda kabarcıkların üretimini en aza indirin. - Ayrı bir odada veya 3,2 'de açıklandığı gibi hazırlanan bir UV kabininde, daha önce 1 μg/μL 'ye ayarlanmış 1 μL RNA 'ya dikkatle ekleyin (bkz. Adım 1,5) uygun ana karışımı yüzeyinin altında iyi ve hafifçe karıştırın. Pipet ucunu, kullandıktan sonra (yüzeyin altında) doğrudan dezenfektan içine atın.
- Test örneklerinden sonra, pozitif denetim sonraki eklenen ve hiçbir şablon denetimi (NTC – moleküler sınıf su) son eklenen denetimleri ekleyin. Kullanılan RNA miktarı, numune tipine ve kullanılan RNA ekstraksiyonunuza bağlı olarak değişebilir. Reaksiyonunun optimize edildiğinden emin olmak için kullanılan miktar doğrulanmalıdır.
- Tüm kapakların sıkıca kapatıldığından ve numuneleri yönlendirmek için yeterince etiketlendiğinden emin olmak için şerit kapakları veya Sealer kullanarak mühür plakası. Plaka/şerit tüplerinin kenarını etiketleyin.
- Kuyuların altındaki tüm sıvı toplamak için bir Santrifüjü kullanarak örnekleri aşağı spin.
- Plakayı gerçek zamanlı PCR makinesine aktarın, plakaya göre numunelerin doğru konumu/yönünü sağlayarak tutucuya kapı ve yer açın.
Not: Tüp şeritler kullanılırsa, tutucunun yerinde olduğundan emin olun. - Gerçek zamanlı PCR makine programı açın ve ayrışma eğrisi ile sybr gerçek zamanlı deney için seçeneği seçin. Veri toplama noktaları dahil olmak üzere Tablo 3' te belirtilen Termal Bisiklet koşullarını kullanarak gerçek zamanlı PCR makinesini programlamak.
- Floresan boya olarak Sybr seçin ve örnek türü olarak Bilinmeyen seçin ve doğru örnek adı kutusuna bir ad ekleyin.
Not: Çoğaltır ve aynı zamanda Lissavirüse ve β-aktik kuyuları arasında ayırt. - Deneysel verileri kaydetmek için bir dosya konumu seçin, lamba çalışma sonunda kapalı olacak emin olun, sonra koşmak başlar.
Not: İlk adım bir RT aşaması olduğu için, bu süre zarfında hiçbir veri toplanmaz, bu nedenle, lamba sıcak bir süre gerektiriyorsa, bu RT aşamasında ortaya çıkabilir. Gerçek zamanlı makine ve yazılım, amplifikasyon eğrilerini gerçek zamanlı olarak gösterecektir, ancak erime eğrisi döngüsünün sonunda oluşturulur.
4. veri analizi
-
Çalışma tamamlandıktan sonra veri analizi aşağıdaki gibi gerçekleştirin.
- İlk olarak kontrol örneklerinin yanında test örneklerinin amplifikasyon Arsa sonuçlarını analiz edin. Pozitif numuneler genellikle Plato ve Ct değeri takip eden üstel rampaları görüntüler. Negatif örnekler, Ct değerleri olmayan düz amplifikasyon grafiklerini görüntüler (Şekil 1a). Ct değeri otomatik olarak yazılım tarafından hesaplanır, ancak bu kontrol edilmelidir ve gerekirse el ile değiştirilir.
- İkincisi, denetim örnekleri yanında test örneklerinin ayrışma eğrisi sonuçlarını analiz edin. Pozitif bir numune, erime sıcaklığına (Tm) 77 – 80 °c olur ve pozitif kontrol figürü 1Bile örtüşür).
- Denetimlerin geçerli olmasını sağlayarak genel tanılama sonucunu elde eder. İç β-akin kontrolüne ilişkin sonuçları yorumlamak için Tablo 4 ' ü kullanın. Pozitif denetim örnekleri negatif ve/veya negatif örnekleri pozitif ise, çalışma gözardı.
- Bir ' kontrol kartında ' kontrol RNA 'sı için elde edilen Ct ve tm değerlerini, Trend analizini etkinleştirmek ve tahlil hassasiyetinde sürükler belirlemeye yardımcı olmak için kaydedin.
Sonuçlar
Yukarıda belirtilen protokolün ardından, Pan-Lyssavirus RT-PCR ' i m hassasiyeti kontrol standardı virüsünün (CVS) bir seyreltme serisi üzerine gösterildi (Şekil 1) ve bir dizi diğer lyssaviruses (Şekil 2VeŞekil 3). SYBR yeşil ı boya, cDNA sentezi ve PCR amplifikasyonu tek bir tüpte gerçekleştirildiği evrensel bir adım RT-PCR olarak kullanılmıştır. Belirli bir hedefin amplifikasyonu ortaya çıktığında, daha fazla boya bağlıdır, gerçek zamanlı olarak floresan seviyeleri artmıştır. Tüm boya enterkalasyon gerçek zamanlı olarak iki aşamada yorumlanması gerekir: amplifikasyon ve dissociation. Amplifikasyon aşaması, gerçek zamanlı amplifikasyon ile aynıdır (Şekil 1A). Arka planda yetersiz sinyal nedeniyle DNA amplifikasyonu hesaplanamaz erken döngüleri sırasında doğrusal bir ' erken faz ' vardır. Bu uzunluğu doğrudan örnek hedef miktarına ilişkilidir. Daha sonra, DNA moleküllerinin ikiye katlanması ve kaydedildiği üstel bir faz vardır. Son olarak, Plato fazına (programın sonundan önce bu aşamaya ulaşamayabilir yüksek seyreltilmiş numuneler dışında) ulaşılır. Bu aşamada, reaktiflerin tükenmesi nedeniyle floresans seviyeleri dışarı. CVS 'nin 10 katlık seri seyreltme kullanılarak gözlenen amplifikasyon grafikleri, beklenen araziler için uygundur (Şekil 1AC) burada Lissavirüse tahlil β-aktik tahlil daha yüksek bir hassasiyet göstermiştir. Ayrışma eğrisi amplifikasyon sonra hesaplanır, burada dsDNA ısı artımlı bir artış ile ssDNA Disosiye ve floresan sıcaklık bir fonksiyon olarak izlenen (Şekil 1B, D-F). Belirli bir amplikon ssDNA 'ya ayrılması eşik sıcaklığı, termocycler yazılımı tarafından ölçülen floresan bir salınımı neden oldu (TM). Bu ayrışma aşaması, kullanıcının pozitif bir denetime kıyasla sonucu yorumlamasını sağlayan ve yanlış pozitif sonuçların ihmal edilebilir bir olasılığına neden olan amplikon boyutunda veri sağladı. TM, Pan-Lyssavirus assay kullanarak CVS için gözlenen (Şekil 1B) ve β-actin tahlil (Şekil 1D) farklıdır ve Kullanıcı T belirterek doğru tahlil Analizi onaylamak için destekliMeldeŞekil 1E). Ayrıca, CTve TMçalışır ve işleçler arasındaki değerler değerlendirildi ve yeniden üretilebilen (Tablo 5). C hesaplamak için kullanılan eşikTdeğer, yazılım tarafından otomatik olarak hesaplanır ve kullanılan reaksiyon karışımı veya enstrüman dahil olmak üzere birçok faktöre bağlıdır. 12 bağımsız çalışır üzerinde ortalama CTβ-actin tahlil için Lissavirüse assay ve 27,5 (SD 1,13) için 20,66 (SD 0,63) oldu. Aksine T gözlenen varyasyonMdeğerleri belirgin olarak düşükse, bu ölçümün dış etkilerinin olmaması nedeniyle. Örneğin, ortalama TMCVS Lissavirüse assay için 78,92 oldu (SD 0,16) (Tablo 5), tüm lyssaviruses ortalaması ile karşılaştırıldığında 78,81 °C (SD 0,531) (Tablo 6VeŞekil 1F). T varyasyon bu eksikliğiMarasında Lyssavirusaynı kontrol RNA 'nın örnekteki Lissavirüse 'tan bağımsız olarak kullanılabilirler, ancak T kullanarak Lissavirüse türleri arasında ayrım yapan cins avantajlıdırMözellikle farklı RABV Sub-lineages T aralığı yayılmış, mümkün değildirMgörülen değerler (Tablo 6). Spesifik olmayan amplifikasyon arazileri bu tahlil ile nadiren görülür; Ancak, spesifik parametreler pozitif bir sonuç vs. spesifik olmayan negatif sonuç tanımlamak için gereklidir. Tüm lyssaviruses (0,531) arasında gözlenen SD, en düşük (77,34-LBVa) ve en yüksek (79,67-ıKOV) olarak gözlenen TMpozitif belirli bantlar için 76,8 °C-80,2 °C aralığı ayarlamak için değerler. Bu nedenle, TMBu aralığın dışındaki değerler spesifik olmayan ve bu nedenle negatif bir sonuç olarak kabul edildi. Bazen bir örnek için birden fazla zirveler gözlenir. Baskın zirve doğru T iseM(her çoğaltma için) sonra örnek pozitif olarak kabul edilir. Özel olmayan bir zirve gözlenen en yaygın nedeni primer-dimers kaynaklanmaktadır, tahlil astar dimers en aza indirmek için optimize edilmiştir. Primer dimerleri genellikle hedef dizi daha küçük bir amplikon neden, bu nedenle bir T olurduMbelirli bir ürüne göre daha düşüktür.
Trizol kullanılarak çıkarılan üç Lissavirüse pozitif beyin numunesi Rnas 'ın 10 kat seri seyreltme paralel ve çizilen olarak çalıştırılıyorlardı (Şekil 2). Üç lyssaviruses için algılama sınırı çeşitli, ancak hiçbiri Ct 36 aştı. Şekil 2 ' de çizilen virüsler için R2 katsayısı değerleri 0,9637 ve 0,996 arasında değişmektedir. Tüm virüsler için (Tablo 6) Aralık bu aşmadı, Ayrıca, 7 29 Lissavirüse R2 > 0,99 (veri gösterilmez) vardı. Seyreltme serisinin hazırlanması toplam RNA çıkartmaları olduğunu dikkate alınarak, gözlenen doğrusallık tahlil sağlam olduğunu kanıtlar sağlar. Son olarak, tüm Lissavirüse türlerinin tespiti (özellikle en farklı phylogroup III virüsleri) Lissavirüse cins üç phylogroups yayılan bir Rnas paneli kullanılarak incelenmiştir. Ya orijinal veya deneysel enfekte fareler, beyin malzemesi çıkarılan RNA yukarıda açıklanan protokoller kullanılarak kullanılmıştır. Sonuçlar, astarlar, farklı phylogroup III lyssaviruses ıkov, wbcv ve llebv (Tablo 6 ve Şekil 3) de dahil olmak üzere tüm Lissavirüse türlerini güçlendirdiğini doğrular. Non-Lyssavirus rhabdovirüsleri çeşitli bir panel, başlangıçta toplanan ve antigenically16analiz ve daha son genetik17 ekran ve hiçbir çapraz reaktivite tespit edildi, astar için özel olduğunu belirten Sadece Lyssavirus cins üyeleri (veri gösterilmez). Pan-Lyssavirus gerçek zamanlı assay dahil edilmiştir EURL (AB referans laboratuvarı) inter-Laboratuar Yeterlilik düzenleri 2013 beri, gösteren 100% uyumlu diğer moleküler testlerle gibi Pan-Lyssavirus TaqMan tahlil ve FAT (floresan antikor testi) ek olarak konvansiyonel RT-PCR tahlil.
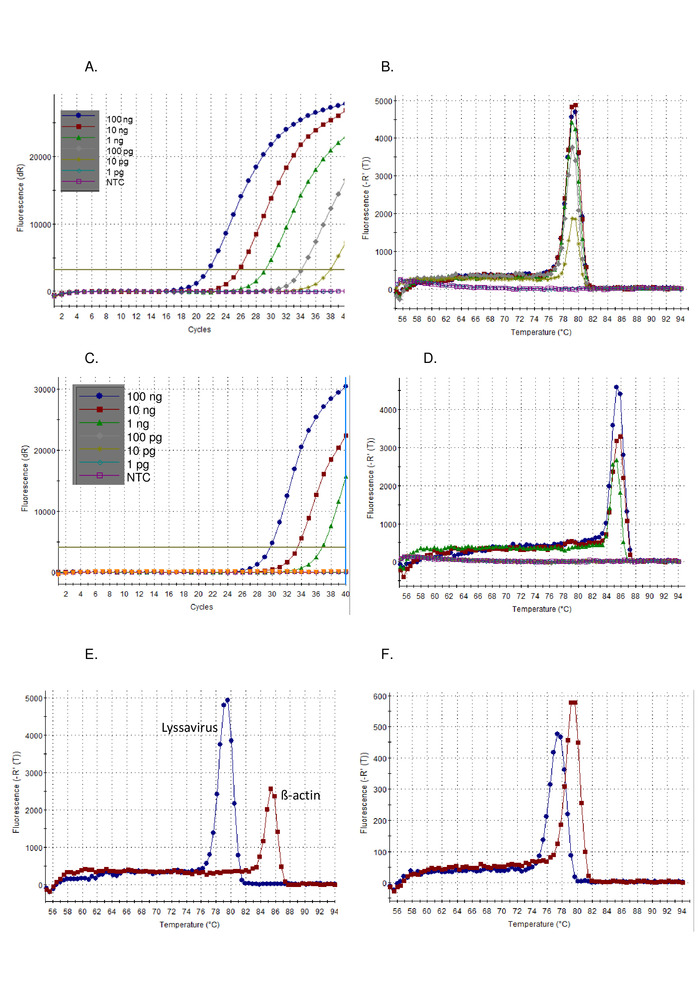
Şekil 1:10-kat seri seyreltme CVS pozitif kontrol RNA, Pan-Lyssavirus RT-PCR tahlil üzerinde koşmak, amplifikasyon Arsa (A) ve ayrışma eğrisi (B) olarak görselleştirilen ve β-actin RT-PCR tahlil üzerinde çalıştırmak amplifikasyon Arsa (C) olarak görselleştirilen ve eğme eğrisi (D). NTC = şablon denetimi yok. CVS kontrol RNA 'nın karşılaştırılması hem Pan-Lyssavirus RT-PCR Assay (mavi) hem de β-actin RT-PCR tahlili (kırmızı) dissosyasyon eğrilerinde (E) farkı gösteren – ortalama değerler için Tablo 5 ' i görün; ve son olarak Lyssavirus cins (F) boyunca gözlenen Tm değerlerinin aralığını gösteren LBVA (mavi) ve ıkov (kırmızı) için dağılma eğrileri. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
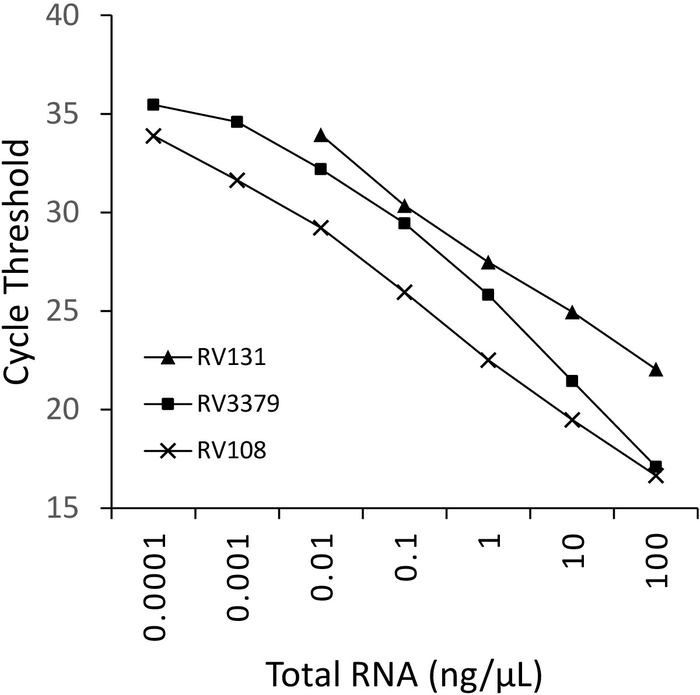
Üç Lissavirüse türü için Şekil 2:10-Fold seri seyreltme: RABV (RV108), DUVV (RV131) ve ARAV (RV3379). R2 = 0,996, 0,9962 ve 0,9637 sırasıyla. Veri noktaları 10-7 (0,0001 ng/μL) algılama sınırına ulaştı (burada bir değer elde edildi). Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
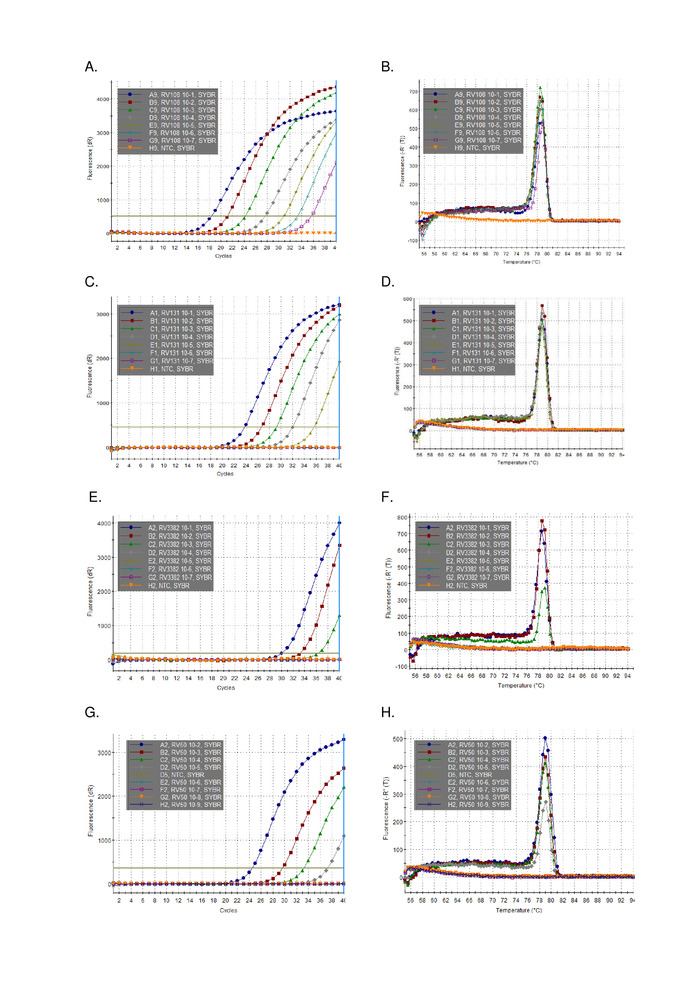
Şekil 3: Lissavirüse cins arasında temsilcisi 10 kat seri seyreltme verileri (diğer lyssaviruses karşılaştırıldığında tablo sonuçlar için Lissavirüse kimlik ve tablo 6 için bireysel efsanelere bakın). A, c, e, g amplifikasyon grafikleri ve B, D, F, H ayrışma eğrileri için a, c, e ve g panelleri sırasıyla. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
| Reaktif | μL/reaksiyon |
| Moleküler sınıf su | 7,55 |
| 2x Universal RT PCR reaksiyon karışımı | 10 |
| Ileri astar [20 μM] | 0,6 |
| Primer ters [20 μM] | 0,6 |
| RT enzim karışımı | 0,25 |
| Reaksiyon başına toplam | 19 |
Tablo 1: Pan-Lyssavirus gerçek zamanlı RT-PCR Master Mix reaktifler.
| Tahlil | Primer adı | Primer rol | Sıra 5 '-3 ' | Pozisyon1 |
| Lissavirüse | JW12 | RT-PCR | ATG TAA CAC CYC TAC AAT G | 53-73 |
| N165 | Pcr | GCA GGG TAY TTR TAC TCA TA | 165-146 | |
| β-akin | β-actin intronik | Pcr | CGA TGA AGA TCA AGA TCA TTG | 1051-1072 |
| β-actin ters | RT-PCR | AAG CAT TTG CGG TGG AC | 1204-1188 | |
| Pasteur virüs dizisi (M13215) ve fare β-aktik gen dizisi (NM_007393) ile ilgili olarak primer pozisyonlar verilmiştir. | ||||
Tablo 2: Pan-Lyssavirus gerçek zamanlı RT-PCR primer detayları.
| Sahne | Döngü | Sıcaklık | Zaman | Veri toplama |
| Ters transkripsiyon | 1 | 50 °C derece | 10 dak. | |
| RT inaktivasyon/ilk denatürasyon | 1 | 95 °C derece | 5 dk. | |
| Amplifikasyon | 40 | 95 °C derece | 10 sn | |
| 60 °C ' ye kadar | 30 sn | bitiş noktası | ||
| Dissociation eğrisi Analizi | 1 | 9 °C ' ye kadar | 1 dk. | |
| 55 °C ' ye kadar | 1 dk. | |||
| 55-95 °C | 10 sn | Tüm puanlar |
Tablo 3: Pan-Lyssavirus gerçek zamanlı RT-PCR Bisiklet koşulları.
| Test sonucu | Dahili β-aktik kontrolü | Genel sonuç |
| Negatif | Negatif1 | Geçersiz. Tekrar ekstraksiyon ve tahlil2 |
| Negatif | Pozitif | Negatif sonuç bildirdi |
| Pozitif | Pozitif | Pozitif sonuç bildirdi |
| Pozitif | Negatif1 | Tekrar ekstraksiyon ve tahlil3 |
| 1 Heterolog dış kontrol kullanımı tekrar ekstraksiyon sırasında yararlı olacaktır. | ||
| 2 İç denetim için ikinci bir negatif sonuç elde edilir, örnek bu tahlil tarafından varsayım olarak bildirilecektir. | ||
| 3 ' ü İç denetim için ikinci bir negatif sonuç elde edilir, pozitif test sonucu yanında ikincil bir kuduz | ||
| Bu sonucu onaylamak için teşhis testi yapılmalıdır. | ||
Tablo 4: sonuçlar ve Pan-Lyssavirus gerçek ZAMANLı RT-PCR için genel sonuçlar Özeti. Negatif, Ct değeri olmayan bir örneğe (amplifikasyon) ve erime sıcaklığı (dissociation) veya pozitif lyssaviruses (76,8 °c-80,2 °c) için tm aralığının dışında olan bir Melt sıcaklığına göre belirlenir. Pozitif lyssaviruses için Tm aralığının içinde olan bir Ct değeri (amplifikasyon) ve bir Melt sıcaklığı (dissociation) ile bir örnek belirlenir.
| Lyssavirus tahlil | β-actin tahlil | |||
| Ct | Tm | Ct | Tm | |
| Demek | 20,66 | 78,92 | 27,5 | 85,26 |
| Sd | 0,63 | 0,16 | 1,13 | 0,35 |
| LCL (% 95) | 19,39 | 78,59 | 25,23 | 84,56 |
| UCL (% 95) | 21,93 | 79,25 | 29,76 | 85,96 |
Tablo 5: birden fazla operatör dahil olmak üzere 12 bağımsız çalışır arasında CVS olumlu kontrol Inter-Run analizi.
| Phylogroup | Tür | Virüs KIMLIĞI | Lineage | Algılama sınırı | Tm |
| ı | RABV | RV50 | ABD yarasa | 10-5 | 79,5 |
| ı | RABV | RV51 | ABD tilki | 10-7 | 77,6 |
| ı | RABV | RV108 | Şili yarasa | 10-7 | 78,63 |
| ı | RABV | RV313 | Avrupa tilki | 10-9 | 78,53 |
| ı | RABV | RV437 | Avrupa RacDog | 10-7 | 78,09 |
| ı | RABV | RV1237 | Avrupa geyik | 10-8 | 78,76 |
| ı | RABV | RV334 | Çin aşısı | 10-8 | 79,03 |
| ı | RABV | RV102 | Afrika 2 | 10-7 | 78,58 |
| ı | RABV | RV995 | Afrika 3A | 10-8 | 79,66 |
| ı | RABV | RV410 | Afrika 3B | 10-7 | 79,03 |
| ı | RABV | RV2324 | Afrika 4 | 10-7 | 79,17 |
| ı | RABV | RV2417 | Sri Lanka köpek | 10-9 | 78,71 |
| ı | RABV | CVS-11 | 10-7 | 79,17 | |
| ı | EBLV-1 | RV20 | Almanya | 10-6 | 79,05 |
| ı | EBLV-2 | RV1787 | Ingiltere | 10-7 | 78,76 |
| ı | (BBLV) | RV2507 | Almanya | 10-9 | 78,71 |
| ı | ABLV | RV634 | 10-8 | 78,25 | |
| ı | DUVV | RV131 | 10-5 | 79,03 | |
| ı | (GBLV) | RV3269 | 10-7 | 79,15 | |
| ı | ARAV | RV3379 | 10-7 | 79,46 | |
| ı | ERMRE | RV3380 | 10-7 | 78,97 | |
| ı | ŞıBV | RV3381 | 10-7 | 78,59 | |
| ı | (IRKV) | RV3382 | 10-3 | 78,59 | |
| ıı | Bu konuda | RV767 | 10-5 | 77,34 | |
| ıı | (LBVd adresinde) | RV3383 | 10-7 | 78,59 | |
| ıı | MOKV makineleri | RV4 | 10-3 | 78,81 | |
| ııı | (IKOV) | RV2508 | 10-5 | 79,67 | |
| ııı | BIR | RV3208 | 10-4 | 79,15 | |
| ııı | WCBV | RV3384 | 10-3 | 79 |
Tablo 6: tüm üç phylogroups genelinde temsilci lyssaviruses için Pan-Lyssavirus gerçek zamanlı RT-PCR özgüllüğü, duyarlılık ve Tm Özeti. Lyssaviruses genelinde ortalama Tm 78,81 idi (SD 0,531).
Tartışmalar
Pan-Lyssavirus gerçek zamanlı RT-PCR tahlil açıklanan bir kapalı-tüp, tüm üç phylogroups arasında lyssaviruses algılar tek adımlı tahlil olduğunu. Tahlil hem hayvan hem de insan kuduz tanısı için doğrulandı, post-mortem beyin dokusu dahil (optimal beyin derisi), ve cilt biyopsisi gibi ante-mortem örnekleri, seri olarak toplanan tükürük, ya da serebral omurilik sıvısı (CSF). Bu tahlil kullanılan astar ilk tasarlanmış ve RABV arasında ayırt etmek için bir prob tabanlı tahlil için kullanılan, EBLV-1 ve EBLV-23, birçok OIE kuduz laboratuvarlarında kullanılan ve eurl yeterlilik şemaları tutarlı bir şekilde gerçekleştirir. Daha sonra bu astar ' Pan-Lyssavirus ' doğası 2-adım gerçek zamanlı tahlil15kullanılarak teyit edilmiştir. Tahlil burada açıklanan daha da RT-PCR tek adımlı bir SYBR tahlil bir kapalı tüp, hızlı sistem sağlayan optimize etmek için astar kullandı. Ayrıca, bu tahlil kullanarak kuduz endemik ülkelerde eğitim, çapraz kontaminasyon ve iz örneklerini azaltmak için temel KKD ve kalite sistemleri ile herhangi bir laboratuvarda uygulanması uygunluğu doğruladı, reaktifler ve gerçek zamanlı saklamak için tesisler SYBR algılama ile makine. Tahlil son derece sağlam ve yağ ile% 100 korelasyon vardır, deforme örnekleri için gelişmiş hassasiyet ile3. Bir DNA enterkalasyon boya bazlı tahlil bir prob tabanlı tahlil karşılaştırıldığında için ana avantajlardan biri göreli maliyetidir. Ek bir yararı tahlil sadece iki astar kullanır, bu nedenle daha önce yayınlanan prob tabanlı assays bir zayıflık olmuştur sıra divergence nedeniyle başarısız algılama daha az risk vardır. Nitekim, tüm Lissavirüse türlerinin temsilcileri (twblv ve KBLV dışında) bu tahlil kullanılarak tespit edilir, ve primer siteler arasında twblv ve KBLV dizi analizi önemli bir sapma şiddetle onlar da kullanılarak tespit edilecektir düşündüren ortaya çıkarır Bu yöntem. Virüsler arasında gözlenen algılama sınırı aralığı analiz edildi, iki ana faktör nedeniyle olarak kabul edilebilir. Birincisi RNA 'nın klinik beyin malzemesine göre izole edilmesidir, bu nedenle her seyreltilmiş örnekteki genom kopyaları doğrudan karşılaştırılabilir değildir. RNA, toplam RNA 'ya 1 μg/μL 'ye ayarlanarak ' normalleştirilmiş '; Ancak, bu numune içinde viral genom RNA oranı farklılık gösterecektir. İkincisi, Lissavirüse dizilerinin çeşitliliğindedir, primer sitelere rağmen kullanılan bölgelerde bulunan, varyasyon pozisyonları kalır. Bu nedenle, bu tahlil için daha düşük hassasiyet ile lyssaviruses çoğunluğu phylogroup II ve III virüslerdir şaşırtıcı değildir. Ayrışma eğrisi analizi, primer dimers oluşumu veya konak genomunda spesifik olmayan bir bölgenin amplifikasyonu nedeniyle ortaya çıkabilecek yanlış bir pozitif sonucu minimize eden temel bir parametreyi temsil eder. Gerçekte, bu nadir bir durumdur ve ayrışma eğrisi Analizi doğru boyutta konvansiyonel RT-PCR amplicons görselleştirmek için bir agaroz jel çalıştırmak için eşdeğerdir. Kabul edilebilir Tm değerleri yelpazesi, laboratuvarımızda toplanan verilere dayanarak (77-80 °c) sağlandı. Bireysel laboratuvarların kapsama alanı aktarılabilir ve buna göre değişiklik olmasını sağlamak için ev içi verileri harmanlarına şiddetle tavsiye edilir. Hem amplifikasyon hem de dağılma arazileri arasındaki sonuçların yorumlanması, pozitif ve negatif kontroller ve β-aksin sonuçlarının yanı sıra, sağlam ve yeniden üretilebilen teşhis sonuçları sağlar.
Bu protokol kapsamı dışında yüksek kaliteli RNA elde etmek için kullanılan RNA ekstraksiyon yöntemidir. Bu protokolde analiz edilen tüm RNA TRIzol kullanılarak hazırlanmıştır; Ancak, sütun ve boncuk bazlı ekstraksiyon kitleri de dahil olmak üzere birçok uygun guanidium tabanlı çıkarma RNA ekstraksiyon protokolleri mevcuttur. Lissavirüse pozitif (ya da olumlu şüpheli) numunelerin kullanımı ülke içinde onaylanmış lisanslı biyokapsama tesisleri içinde olmalıdır. Ancak, çıkarılan toplam RNA enfeksiyöz değildir, bu nedenle düşük koruma laboratuvarları içinde işlenir. Kullanılan ekstraksiyon yöntemine bağlı olarak RNA 'nın ölçülmesine ve seyrelmeye ihtiyacı değerlendirilmelidir. TRIzol dahil fenol bazlı çıkarma için, bu adım gereklidir ve gDNA kontamine gelen tahlil inhibisyonu önler; Ancak, sütun ve boncuk bazlı çıkartmalar (özellikle DNA tükenmesi aşamasına sahip olanlar) test öncesinde seyreltme gerektirmez.
Protokol boyunca, bakım ve özen doğru kuyuları için çapraz kontaminasyon ve numune doğru ilavesi önlemek için kullanılan esastır. Reaktif hesaplamaları ve plaka düzenini içeren bir elektronik tablo, ek bir dosya olarak indirilmek üzere kullanılabilir. Temiz çalışma yüzeyleri, düzenli eldiven değişimi, bariyer ipuçları kullanımı ve her aşamayı ayırmak için farklı odalar/UV dolapları gibi iyi bir laboratuar uygulaması, kontaminasyon olasılığını en aza indirir. Test beklenen parametrelerle performans sağlamak için pozitif ve negatif denetimler dahil edilmelidir ve tüm test örnekleri yinelenen (veya triplicate) çalıştırın.
Denetimlerin eklenmesi, özellikle Tanılama için herhangi bir PCR 'nin önemli bir özelliğidir. Pozitif kontrol RNA CVS (Challenge virüs standardı) enfekte fare beyni toplu olarak hazırlanmış ve doğrulanmış ve gruplar arasında tutarlılık sağlamak için kalibre edilmiştir. Kontrol RNA 'sı, en az 10-4 ' e kadar (100 pg/μL 'ye eşit) bir seri seyreltme sırasında pozitif bir sonuç elde edilen 1 μg/ΜL. RNA 'ya göre nicelik ve seyreltilmiş bir amaca uygun olarak kabul edildi. Pozitif kontrol RNA 10-1 aliquots-80 °c ' de saklanır. Gerektiğinde, 1 ng/μL 'de çalışma stokları sağlamak ve 5 μL tek kullanımlık aliquots 'da-80 °c ' de saklanan bir kısım 1:100 seyreltilmiş. Seyreltilmiş pozitif kontrol RNA 'sı düşük seviyeli pozitif numuneleri temsil etmek ve tahlil hassasiyetindeki herhangi bir azalma tespit edildiğinden emin olmak için kullanılmıştır. Ct değerlerini izlemek ve trendleri belirlemek için her kontrol için bir ' kontrol kartı ' tutuldu (Tablo 5). Tablo 5 , birden çok gün ve operatörler arasında CVS pozitif kontrol örneği Ct ve tm değerleri için iyi bir inter-Run karşılaştırılması gösterdi, tahlil sağlam ve tekrarlanabilir olduğunu güvence sağlar. Bu ölçümlerden sapacak sonuçlar araştırılmalıdır ve gerekirse test numuneleri tekrarlanmalıdır. Reaktiflerin Lissavirüse RNA ile kontaminasyondan serbest olduğunu ve negatif bir numuneyi onaylaması için bir NTC olarak her koşunun moleküler sınıf suyu dahil edildi. Ayrıca, RNA ekstraksiyon etkinliğini sağlamak için, β-aksini test örneklerinin yanında ayrı bir tüpte test edildi. Β-aksin pozitif kontrolü için Lissavirüse pozitif kontrol RNA 'sı da kullanılmıştır. Diğer endojen genler veya heterolog iç kontrol sistemleri kullanılabilir. Bu denetimlerin kullanımı, tüm adımların test örnekleriyle aynı koşullarda çözümlenmesi sağlanır. Bazen, örnek son derece düşükmüş veya yeterli ana RNA (örneğin, tükürük veya CSF) içermiyorsa, endojen gen PCR başarısız olabilir. Bu örnekte, Lissavirüse gerçek zamanlı RT-PCR sonucu pozitif olduğu, bağımsız RNA ekstraksiyonu üzerinde onay-orijinal testte RNA ekstraksiyon veya ikincil bir test (konvansiyonel RT-PCR gibi moleküler,) sırasında kontaminasyon dışarı kural veya FAT. Tablo 4 ' ün tanılama numunesi analizi sırasında kullanımı doğru yorumu sağladı.
Ne olursa olsun moleküler tahlil kuduz enfeksiyonu onaylamak için kullanılan, soruşturma takip Sanger sıralamayı kullanarak Lissavirüse türleri ve virolojide FAT veya virüs yalıtımı gibi klasik teknikleri belirlemek için de izin almak için üstlenilmesi gereken daha fazla virüs karakterizasyonu ve pozitif olguların OIS ve WHO 'ya bildirilmesini destekler.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Yazarlar, deneyler tamamlanmasında yardım için Miss Emma wise ve Miss Megan Golding teşekkür etmek istiyorum. Bu protokolün geliştirilmesi finansal olarak INGILTERE bölümü çevre, gıda ve kırsal Işler (DEFRA), Iskoç hükümeti ve Welsh hükümeti tarafından hibe [SV3500 ve SE0431] tarafından ve Avrupa virüs Arşivi Global (EVAg) projesi tarafından desteklenmektedir Avrupa Birliği 'nin Horizon 2020 araştırma ve İnovasyon programından fon alındı, Grant anlaşması kapsamında No 653316.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Art Barrier pipette tips (various sizes) | Thermofisher | various | |
| Centrifuge | Beckman | Allegra 21R | Rotor capable of holding 96 well plates required. Step 3.8. |
| Centrifuge (mico) | Sigma | ||
| Finnpipettes (to dispense 0.5-1,000 µL) | Thermofisher | various | |
| iTaq Universal SYBR Green One-Step RT-PCR kit | Bio-Rad | 172-5150 | Equivalent kits can be used if validated |
| MX3000P or MX3005P real-tme PCR system | Stratagene | N/A | Eqivalent machines can be used if validated |
| MicroAmp reaction plate base | Any suitable | Used to hold tube strip and plates securely. | |
| Optically clear flat clear strips (8) | ABgene | AB-0866 | |
| Perfect fit frame (if using tube strips) | Stratagene | N/A | Specific to machine |
| Primers: for primer details see Table 2. | Ordered at 0.05 µmole scale HPLC purified. | ||
| Thermo-Fast 96 well plares, non skirted | ABgene | AB-600 | |
| Thermo-Fast strips (8) Thermo-tubes | ABgene | AB-0452 | |
| Vortex machine / Whirlimixer | Fisons Scientific equipment | SGP-202-010J | |
| Unless stated, alternative equipment can be used |
Referanslar
- . OIE. OIE Terrestrial Manual 2018. , 8-14 (2018).
- Panning, M., et al. Comparative analysis of rabies virus reverse transcription-PCR and virus isolation using samples from a patient infected with rabies virus. Journal of Clinical Microbiology. 48 (8), 2960-2962 (2010).
- Wakeley, P. R., et al. Development of a real-time, TaqMan reverse transcription-PCR assay for detection and differentiation of lyssavirus genotypes 1, 5, and 6. Journal of Clinical Microbiology. 43 (6), 2786-2792 (2005).
- Wang, L., et al. A SYBR-green I quantitative real-time reverse transcription-PCR assay for rabies viruses with different virulence. Virologica Sinica. 29 (2), 131-132 (2014).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR Assay for the Detection of Highly Variable Rabies virus and Other Lyssaviruses. PLOS Neglected Tropical Diseases. 11 (1), e0005258 (2017).
- Nadin-Davis, S. A., Sheen, M., Wandeler, A. I. Development of real-time reverse transcriptase polymerase chain reaction methods for human rabies diagnosis. Journal of Medical Virology. 81 (8), 1484-1497 (2009).
- Hoffmann, B., et al. Improved safety for molecular diagnosis of classical rabies viruses by use of a TaqMan real-time reverse transcription-PCR "double check" strategy. Journal of Clinical Microbiology. 48 (11), 3970-3978 (2010).
- Faye, M., et al. Development and validation of sensitive real-time RT-PCR assay for broad detection of rabies virus. Journal of Virological Methods. 243, 120-130 (2017).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLOS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Fooks, A. R., et al. Rabies. Nature Reviews Disease Primers. 3, 17091 (2017).
- Marston, D. A., et al. Ikoma lyssavirus, highly divergent novel lyssavirus in an african civet. Emerging Infectious Diseases. 18 (4), 664-667 (2012).
- . Virus Taxonomy: 2018 Release: Email ratification October 2018 (MSL #33) Available from: https://talk.ictvonline.org/taxonomy/ (2018)
- Hu, S. C., et al. Lyssavirus in Japanese Pipistrelle, Taiwan. Emerging Infectious Disease. 24 (4), 782-785 (2018).
- Nokireki, T., Tammiranta, N., Kokkonen, U. M., Kantala, T., Gadd, T. Tentative novel lyssavirus in a bat in Finland. Transboundary and Emerging Diseases. 65 (3), 593-596 (2018).
- Hayman, D. T., et al. A universal real-time assay for the detection of Lyssaviruses. Journal of Virological Methods. 177 (1), 87-93 (2011).
- Calisher, C. H., et al. Antigenic relationships among rhabdoviruses from vertebrates and hematophagous arthropods. Intervirology. 30 (5), 241-257 (1989).
- Aznar-Lopez, C., et al. Detection of rhabdovirus viral RNA in oropharyngeal swabs and ectoparasites of Spanish bats. Journal of General Virology. 94 (1), 69-75 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır