Method Article
用DMSO对人多能干细胞的暂时性治疗促进分化
摘要
从人类多能干细胞(hPSCs)中产生分化的细胞类型具有巨大的治疗前景,但仍具有挑战性。PSC 通常表现出固有的无法区分,即使受到一组适当的信号刺激。此处介绍的一个简单的工具,用于增强各种 PSC 线路的多系差别。
摘要
尽管多能干细胞(PSCs)的使用越来越多,但在有效区分不同谱系的胚胎干细胞和诱导多能干细胞(ESCs和iPSCs)方面仍然存在挑战。已经开发了许多分化协议,但细胞系的变异性和低分化率给成功实施这些协议带来了挑战。此处描述的是提高 PSC 差异化能力的一种简单且廉价的方法。此前已经表明,对二甲基亚硫酸二氮(DMSO)低浓度的干细胞的治疗会显著增加各种PSC在定向分化后分化为不同细胞类型的倾向。这项技术现已证明在不同的物种(如小鼠、灵长类动物和人类)中是有效的,包括神经元和皮质球体到平滑肌细胞和肝细胞。DMSO 预处理通过调节细胞周期和启动干细胞以对分化信号做出更灵敏的反应,改善PSC分化。此处提供了使用这一简单工具作为可重现且广泛应用的方法的详细方法,以便更有效地将 PSC 区分为任何选择系系。
引言
多能干细胞的使用在生物医学研究上取得了许多进展,包括再生医学和基于干细胞的疗法、疾病建模和药物筛选等领域。这也导致了更多可翻译的研究和个性化医学的整体前景。20多年前诱导多能干细胞(iPSC)技术的出现,使研究人员能够从体细胞组织中开发多能干细胞,并将其分化为功能细胞类型,以研究各种病理,包括心血管、神经和免疫疾病。尽管干细胞分化技术取得了长足的进步,但在有效区分人类胚胎干细胞(hESCs)和iPSCs方面仍然存在挑战,限制了干细胞技术在不同领域的广泛使用。研究项目。不同细胞系和克隆的固有变异性继续对将干细胞系与所需的干细胞系区分为1构成障碍。此外,从 hPSC 中衍生出成熟、最终分化的功能单元,在许多谱系中仍是一个繁琐且低效的过程。事实上,从hPSC中分化的细胞往往不能最终分化成功能细胞2。在进一步推动干细胞疗法在患者中使用时,需要改进和确保由 hPSC 产生的细胞的疗效。
我们的实验室已经建立了一个快速、廉价的工具,可显著提高将 iPSC 和 ESC 区分为成熟细胞类型的效率。我们发现,在定向分化前24小时至48小时,用常用试剂二甲基亚硫酸盐(DMSO)对hiPSC和hESC进行预处理,可显著改善干细胞分化能力。使用DMSO治疗可增加细胞周期早期G1阶段中hiPSC和hESCs的比例,并激活视网膜母细胞瘤蛋白(Rb)3,这是细胞增殖、生存和分化的关键调节剂4。在最近的工作中,发现Rb及其家庭成员需要DMSO的亲分化效应,因此Rb的暂时失活抑制了DMSO的影响,而以瞬态方式对Rb的构成激活增强了DMSO 的效果5。与胚胎发育过程中的细胞周期类似,ESC和iPSC的细胞周期的特点是简略的G1相,促进自我更新6,7,8。这个缩写的G1阶段允许更不受限制的扩散,但限制了分化4,9的潜力。通过促进G1的生长抑制,并在hESCs和iPSC的细胞周期中激活检查点控制,DMSO治疗使细胞在定向分化后发生细胞命运变化。
迄今为止,DMSO预处理已被证明能提高30多个对照和疾病特异性人类ESC和iPSC细胞系3、5以及干细胞和其他各种生殖层的分化能力细胞系到各种其他成熟细胞类型在后续研究10,11,12,13,14,15,16, 17,18,19,20,21,22,23,24,25,26,27,28 (表 1. .此外,DMSO治疗已被证明能有效地促进非人类原发细胞21、23(如小鼠、灵长类动物、兔子)的分化,这表明物种之间的共享机制。最后,DMSO预处理也扩展到基因编辑技术,一项特别研究表明,24小时DMCSO预处理hESCs/iPSCs显著提高了聚类定期间隔短音重复(CRISPR)的能力/CRISPR相关蛋白-9(Cas9)介导的非编码DNA编辑效率,而不纳入意外突变29。这里提供了一个详细的方法,在干细胞生物学和定向分化中的应用,为hESCs和iPSCs的DMSO预处理。
研究方案
1. 干细胞维持
注:下面描述的细胞维持协议适用于在粘附单层中维持的全能干细胞(PSCs)。在DMSO治疗之前使用的介质、其他试剂和细胞培养板可以根据需要进行调整。对于本手稿中的所有以下协议,细胞应在生物安全柜下处理。
- 涂无菌,6孔,组织培养处理板与多能干细胞合格基质或基质根据制造商的指示制备,并在CO2孵化器(5%CO2,潮湿环境)孵育至少1小时。涂层板可包裹在 4°C 下,存放长达一周。
- 在 37°C 水浴中解冻冷冻的 PSC。在引入生物安全柜之前用乙醇对小瓶进行消毒,然后通过移液立即将细胞转移到含有5-10卷预温干细胞培养基的无菌锥形管中。
- 在室温 (RT) 下,在 300 x g下将细胞离心 5 分钟。
- 吸出培养基,在1mL的干细胞培养基中轻轻重新悬浮细胞颗粒,辅以10μM ROCK抑制剂,如Y-27632。
- 从板中吸出培养基质,以所需的密度将细胞播种,通常每孔0.5-1 x 106个细胞,每孔至少2mL的干细胞培养基。
注:电镀密度可能因细胞系和克隆而异,应相应地进行优化。 - 每天用预温干细胞培养基来维持细胞。分裂细胞在大约70%-80%的汇合或当细胞群落开始接触。
- 对于分裂细胞,吸出介质,用无菌PBS清洗细胞一次。在37°C下,用每口井的1mL解毒酶溶液孵育细胞5-10分钟。
- 用预加热的干细胞培养基清洗和重新悬浮细胞,并转移到具有5-10卷干细胞培养基的无菌锥形管中。按照步骤 1.3-1.7 为细胞板。
2. DMSO 预处理
注:在分化前为DMSO预处理的电镀细胞时,应结合干细胞系的典型生长速率以及所使用的分化方案,优化起始电镀细胞密度。必要时使用常规标记验证多能性。细胞在分化前初次解冻后至少应经过1x-2x。
-
2D 文化差异化
- 当细胞达到适当的汇合时,制备涂布板,分离细胞,并准备如上所述的单细胞悬浮液。
- 使用血细胞计或自动细胞计数器(包括锥形蓝色或其他活力标记)对活细胞进行计数。
- 将细胞板在涂布的6孔板上,在干细胞培养基中每孔0.5-1 x 106个细胞,使用10μM ROCK抑制剂。
注:对于我们实验室测试的细胞系,这些密度通常在24小时DMSO预处理内产生80%-90%的汇入细胞。 - 允许细胞在CO2孵化器(5%CO2,潮湿大气)中,在37°C下孵育24小时。
- 在预加热的干细胞培养基培养基中制备1%-2%的DMSO(例如,在10mL的介质中制备100μL DMSO = 1%DMSO溶液,或在10 mL介质中制备200μL DMSO = 2%DMSO溶液)。
- 24小时孵育后,从细胞中吸出介质,用DMSO溶液替换。
- 在分化之前,允许细胞在37°C下在CO2孵化器(5%CO2,潮湿气氛)中孵育24小时至48小时。
注:通常,在大多数人类ESC和iPSC线路上,24小时DMSO处理就足够了。生长速度非常慢(长倍倍)的细胞系可以通过使用DMSO的48小时孵育中受益。对于使用 DMSO 进行 48 小时孵育,可在治疗后使用 1%-2% DMSO 的新鲜干细胞培养基替换培养基。
-
3D 文化差异化:
- 当细胞达到适当的汇合时,分离并收集细胞悬浮液中的细胞,如上所述。
- 使用血细胞计或自动细胞计数器(包括活力标记)对活细胞进行计数。
- 在干细胞培养基中,用10μM ROCK抑制剂将细胞镀在无涂层、低附着6孔板中,每孔0.5-1 x 106个细胞。
注:对于我们实验室测试的细胞系,这些密度通常导致在设置细胞的24小时内形成3D hPSC球体。 - 允许细胞在CO2孵化器(5%CO2,潮湿大气)中,在37°C下孵育24小时。
- 在预加热的干细胞培养基培养基中制备1%-2%的DMSO(例如,在10mL的介质中制备100μL DMSO = 1%DMSO溶液,或在10 mL介质中制备200μL DMSO = 2%DMSO溶液)。
- 按照标准程序更换介质(例如,以30°-45°角倾斜板,使细胞球体沉降在井底;将细胞转移到无菌锥形管,让细胞球沉降在管的底部;或轻轻地收集细胞in 在RT时,使用5或10 mL移液器将5或10mL移液器悬浮到300 x g的无菌锥形管和离心机细胞中,5分钟)。
- 从电池中吸出介质,用 DMSO 溶液替换,轻轻移液。
- 在分化之前,允许细胞在37°C下在CO2孵化器(5%CO2,潮湿大气)中孵育24小时至48小时。
注:通常,在大多数人类ESC和iPSC线路上,24小时DMSO处理就足够了。生长速度非常慢(长倍倍)的细胞系可以通过使用DMSO的48小时孵育中受益。对于使用 DMSO 进行 48 小时孵育,可在治疗后使用 1%-2% DMSO 的新鲜干细胞培养基替换培养基。
3. 分化为初级细菌层
注:下面描述了以前在我们的实验室中证明有效的方法,用于在 6 个孔板上的单层中生长的 PSC。任何选择的分化协议都应在DMSO处理后使用,以促进分化到所需的谱系。在 24-48 小时处理后去除 DMSO 解决方案,然后按照标准协议进行分化。
-
内德德姆分化(改编自Kroon等人30)
- 对于 2D 培养物,使用 DMSO 预处理细胞。
- 准备 Wnt3a 和 Activin A 股票解决方案。
- 通过将 Wnt3a 添加到 20 纳克/mL 的最终浓度,将 Activin A 添加到 100 纳克/mL 的最终浓度,以适当的预热 RPMI 介质量,准备第 1 天内皮分化介质。
- DMSO 预处理后,从细胞中吸出介质,并将其替换为第 1 天介质(例如,6 孔板每孔 2 mL)。
- 允许细胞在CO2孵化器(5%CO2,潮湿大气)中,在37°C下孵育24小时。
- 通过将 Activin A 添加到 100 纳克/mL 的最终浓度到适当体积的预预热 RPMI 介质中,准备第 2 天和第 3 个内皮分化介质。
- 从电池中吸出介质,并将其替换为第 2 天介质(例如,6 孔板每孔 2 mL)。
- 让细胞在37°C的CO2培养箱(5%CO2,潮湿大气)中孵育24小时。
- 从电池中吸出介质,用第 3 天介质(例如,6 孔板每孔 2 mL)进行更换。
-
中微微分因(改编自张等人31)
- 如上文所述,为 2D 培养物预处理使用 DMSO 的细胞。
- 准备 Wnt3a 和 Activin A 股票解决方案。
- 通过将 Wnt3a 添加到 20 纳克/mL 的最终浓度,并将 Activin A 添加到 100 纳克/mL 的最终浓度,以适当的预热高级 RPMI 介质体积,制备中皮分化介质。
- DMSO 预处理后,从细胞中吸出介质,用分化介质(例如,6 孔板每孔 2 mL)。
- 允许细胞在CO2孵化器(5%CO2,潮湿大气)中,在37°C下孵育24小时。
-
埃托德姆分化(改编自钱伯斯等人第32条)
- 如上文所述,为 2D 培养物预处理使用 DMSO 的细胞。
- 准备诺金和SB431542库存解决方案。
- 通过溶解敲除血清替代物(KOSR)至在敲除DMEM中最终浓度为10%来制备外皮分化基基培养基培养物。
注:为 3-4 天的介质更换准备足够的基本介质。 - 通过将 Noggin 添加到 500 纳克/mL 的最终浓度和 SB431542 到 10 μM 的最终浓度到适当体积的预热 KOSR/敲除 DMEM,制备外皮分化介质。
- DMSO 预处理后,从细胞中吸出介质,用分化介质(例如,6 孔板每孔 2 mL)。
- 允许细胞在CO2培养箱(5%CO2,潮湿环境)中37°C孵育3-4天,每天用新鲜添加的分化因子取代培养基。
4. 对祖细胞类型的分化
下面介绍了以前在我们的实验室中对在 2D 或 3D 培养物中生长的 PSC 有效的方法。任何选择的分化协议都应在DMSO处理后使用,以促进分化到所需的谱系。在 24-48 小时处理后去除 DMSO 解决方案,然后按照标准协议进行分化。
- 神经祖细胞分化(改编自齐厄等人33)
- 根据制造商的说明,在CO2培养箱(5%CO2,潮湿环境)中,用多能干细胞鉴定的减生因子基质或基质涂装6孔板,至少1小时。涂层板可包裹在 4°C 下,存放长达 1 周。
- 上面所述的板PSC在含有ROCK抑制剂的干细胞培养基中,密度为每孔0.5-1 x 106个细胞。
- 对于 2D 培养物,使用 DMSO 预处理细胞。
- 制备小型缓化剂 LDN193189、SB431542 和 XAV939 库存溶液。
- 准备天 1-3 神经异种介质,用 500 nM LDN193189、10 μM SB431542 和 2 μM XAV939 补充基本 6 介质。
- DMSO 预处理后,吸出介质,用天1-3神经切除介质(例如,6孔板每孔2 mL)。每天更换媒体。
- 准备天 4-12 神经切除分化介质,用 500 nM LDN193189 和 10 μM SB431542 补充基本 6 介质。
- 在分化的第4天,吸出介质,代之以第4-12天神经分德介质。每天更改媒体。
- 经过12天的分化,分化细胞应表达神经祖细胞(NPCC)的适当标记。NPC可在含有DMEM/F-12、2%B-27、1%N-2的神经介质中进一步保持,并辅以10μg/mL基本成纤维细胞生长因子(bFGF)。使用细胞分离溶液进行融合时通过NPC,将NPC电镀为每孔0.5-1 x 106个单元。
- 奥利戈内德罗酮原细胞分化(改编自杜瓦拉斯和福萨蒂34)
- 在含有ROCK抑制剂的干细胞培养基中涂覆的6孔板上,以每孔1 x 105的密度将PSC板板。
- 对于 2D 培养物,使用 DMSO 预处理细胞。
- 准备 SB431542、LDN193189、全透反视黄酸 (RA) 和平滑激动剂 (SAG) 库存解决方案。
- 通过补充 DMEM/F-12 和 10 μM SB431542、250 nM LDN193189 和 100 nM RA 来准备 0⁄8 微分介质。
- DMSO预处理后,用分化培养剂孵育细胞8天,每天用新鲜添加的分化因子(例如,6孔板每孔2 mL)改变介质。
- 在第8天,用含有1xMEM非必需氨基酸(NEAA)溶液、1XL谷氨酰胺、2-甲酰胺、青霉素/链霉素和1xN-2补充100 nM RA和1 μM SAG的DMEM/F-12替换介质。每天更改媒体。
- 经过12天的分化,分化细胞应表达寡核苷酸祖细胞(OPCs)的适当标记物。
- 内分泌祖细胞分化(改编自帕格利卡等人35)
- 在干细胞培养基中6 x 105细胞/mL的种子PSC,以及500mL微调器中10μM ROCK抑制剂的PSC,在37°C培养箱、5%CO2和100%湿度下以70rpm的旋转速率放置在9位置搅拌板上。
- 允许簇在烧瓶底部沉降,吸出介质,然后用1%-2%DMSO预处理。
- 制备 Activin A、Chir99021、KGF、Sant1、全透反视黄酸 (RA)、LDN193189、PdBU、2XI、Alk51、T3 和 Betacelluin 库存解决方案。
- 根据表 3中的配方制备分化基介质。
- DMSO 预处理后,吸气介质并更换 S1 介质,辅以 100 纳克/mL Activin A 和 3 mM Chir99021(例如,每瓶 500 mL)。允许孵育24小时。
- 在第2天,用S1介质替换介质,辅以100纳克/mL Activin A.允许孵育2天。
- 第 4 天,用 S2 介质替换介质,并辅以 50 纳克/mL KGF。允许孵育3天,在前2天(第6天)后更换介质。
- 在第 7 天,用 S3 介质替换介质,辅以 50 纳克/mL KGF、0.25 mM Sant1、2 mM RA 和 200 nM LDN193189。允许孵育24小时。
- 第 8 天,使用 S3 介质替换介质,辅以 50 纳克/mL KGF、0.25 mM Sant1、2 mM RA、200 nM LDN193189 和 500 nM PdBU。允许孵育24小时。
- 在第 9 天,用 S3 介质替换介质,辅以 50 纳克/mL KGF、0.25 mM Sant1 和 100 nM RA。允许孵育5天,每2天(第11天和第13天)更换一次介质。
- 在第 14 天和第 16 天,用 S5 介质替换介质,辅以 0.25 mM Sant1、100 nM RA、1 mM 2XI、10 mM Alk5i II、1 mM T3 和 20 纳克/mL βcellulin(4 天总孵育)。
- 在第 18 天和第 20 天,用 S5 介质替换介质,辅以 25 nM RA、1 mM 2XI、10 mM Alk5i II、1 mM T3 和 20 纳克/mL βcellulin。
5. 微化免疫细胞化学验证
注:以下方法描述了一种可以根据需要进行调整的一般免疫细胞化学方案。主要抗体是以前在我们的实验室中验证的抗体。也可以使用其他微分验证技术(例如,流式细胞测定、qPCR、RNA测序、西方印迹、功能测定等)。
-
免疫标记细胞
- 对于悬浮的3D培养物,板全细胞簇或簇分散成单细胞悬浮在涂层板上18-24小时,在固定前。
- 从粘附细胞中吸出介质,在摇摇器上用 RT 的 PBS 短暂清洗。
- 对于细胞固定,吸气PBS和孵育细胞与4%甲醛(PFA)在PBS20分钟在RT在摇床。
警告:PFA 库存应准备在烟气罩下,由于其毒性。请勿吸入并佩戴适当的个人防护设备。 - 取出 PFA 并丢弃在适当的化学废物容器中。
- 用PBS清洗细胞3倍,每次在摇床上的RT洗涤至少5分钟。
- 对于细胞渗透和阻断,用5%驴血清在0.3%triton-x 100/PBS中制备5%驴血清孵育细胞,在摇床上的RT上孵育1小时。
- 在用于渗透/阻断的相同溶液中制备原抗体溶液。
- 在摇摇器上4°C处在原原抗体溶液中孵育过夜。
- 在一夜孵育后,用PBS洗涤细胞3倍,每次在摇床上的RT洗涤至少5分钟。
- 在渗透/阻断溶液中制备二级抗体溶液。
- 允许在振动器上的RT下在二次抗体溶液中孵育1小时。
- 吸气二级抗体溶液和洗涤细胞3x与PBS每次洗涤至少5分钟在RT在摇床。
- 用DAPI或其他首选标记孵育细胞,以进行适当的孵育,并在PBS中冲洗。
-
图像量化
- 在荧光显微镜和/或高含量筛查平台上,每个条件下至少获取三张图像。
- 使用无偏显成像软件(例如 ImageJ)或自动筛选平台,计算抗体染色细胞的总数和细胞总数(基于 DAPI/Hoechst 核染色),量化每个标记的阳性细胞百分比分析。
结果
DSO 处理 iPSC 的形态学
从对照对象派生的人类 iPSC 要么在附着式 2D 单层中培养,要么在悬浮的 3D 细胞球体中培养。初始电镀后约24小时,在维护培养基中用1%或2%DMSO处理24小时。DMSO处理后的代表性亮场图像如图1所示。与以前在单层3中保持的iPSCs报告一致,与非DMSO治疗细胞相比,DMSO预处理导致生长速率的瞬态剂量依赖性下降(图1A)。这种增殖减少与细胞与细胞接触的增加有关,这在2%DMSO处理细胞中尤为明显,这些细胞表现出高度聚集细胞菌落的形成增加。在其他细胞类型中,DMSO诱导的G1逮捕已被证明与细胞-细胞相互作用中参与的蛋白质表达增加有关,这些蛋白质支持接触抑制诱导生长逮捕36。在iPSC中,作为3D细胞球体维持,DMSO处理同样增加了细胞球体的数量(图1B)。此外,DMSO处理也导致变数较少的3D球体大小,这先前已被证明是指示提高细胞的分化能力37。重要的是,1% 或 2% DMSO 均不会导致细胞毒性,根据活力计数(n = 3;2D 培养素 % 活 + 控制:80 ± 1.3;1% DMSO: 82 = 3.7, 2%: 81 = 2.7;3D 培养素 % 活 + 控制: 81 = 4.3; 1% DMSO: 82 = 6.7, 2%: 82 = 2.7)。总体而言,这些结果与DMSO治疗改变培养干细胞中的细胞周期和生长模式的观点一致。当DMSO从介质中去除时,这些对生长抑制的影响是可逆的,如前面所示3。
DMSO处理改善ESC与原菌层的分化
HUES6 hESC 在涂布板上播种24小时,随后在维护介质中用2%DMSO进行24小时的处理。然后,细胞按照图2A30、31、32所示的治疗模式分化成三种主要生殖层。然后,对各生殖层(SOX17用于内皮,对中生代,SOX1为异体)的原生标记物进行固定和免疫染色。如图2B所示,24小时预处理与2%DMSO增加细胞表达每个不同的生殖层标记的比例。这与我们实验室以前的报告显示,使用DMSO3,5治疗的干细胞中,免疫反应、基因表达以及分化细胞的绝对数量增加,所有生殖层的分化细胞数量都有所增加。HUES6 是一种 hESC 线,在所有系系1上具有极低的分化倾向,但 DMSO 处理大大提高了在所有生殖层上区分其能力。
DMSO治疗改善对祖细胞类型的分化
为了研究DMSO对中枢神经系统祖细胞类型分化的影响,将人类iPSCs分化为神经祖细胞(NPC)或寡核苷酸祖细胞(OPCs)。为了产生NPC,在维护介质中用2%DMSO预处理细胞24小时,然后进行12天的定向分化33(图3A)。如图3B所示,2%的DMSO预处理比对照相比,增加了NPC标记PAX6的表达。使用另一个先前经过验证的协议34(图3C),iPSC被区分了12天进入OpCs。与NPC类似,从iPSC预处理的OPCs在24小时预处理2%的DSO显示表达OPC标记OLIG2的细胞比例增加(图3D)。
最初的DMSO治疗持续,以增强成熟细胞类型的分化
为了研究DMSO对分化协议后期的影响,HUES8 hESCs在分化前预处理24小时,在分化至β细胞之前,在图4a中所述的20天定向分化协议后,对Β35.HUES8被使用,因为他们先前已被证明有更高的倾向对内皮血统1,38。在明确的内分位阶段,分化细胞表达SOX17和FOXA2,明确的内分度(DE)特定标记。随着胰腺祖体(PP1)阶段的进一步分化,分化细胞表达PDX1和FOXA2,胰腺祖细胞的标记特征。在胰腺细胞分化的这些阶段,诱导到DE和随后进入PP1的效率很高,对于对照和DMSO处理的hESC分化到这些每个阶段(图4B,阶段1和3). 尽管 HUES8 细胞系已注意到分化成内皮系的倾向增加,但随着在末期阶段进一步诱导分化到更专门的细胞类型,DMSO 处理的 hESC 更多可能产生成熟的胰腺内分泌细胞。在DMSO处理的hESC中,产生PDX1/NKX6.1+胰腺祖细胞、神经根3+内分泌细胞和NKX6.1/C-肽® SC-++细胞的效率要高得多(图4B,阶段4和5)。这些结果符合NPC和OPC的分化,表明DMSO增强了祖细胞类型的分化潜力,也表明DMSO在产生更专业的细胞类型方面具有持久性。这与先前的工作一致,我们已经证明,最初的24小时DMSO治疗增加了在生殖层(包括神经元细胞)和击败心肌细胞31,39的终端细胞类型的分化在具有高或差的分化倾向的细胞系中3。
初始 DMSO 治疗改善在体内移植后 hESC 衍生的细胞功能
此前,我们已经证明了DMSO治疗在增强hESCs分化到功能性胰腺祖细胞的有效性,后来表明体内胰岛素分泌有显著改善。使用先前公布的协议3,30,40,HUES8 hESCs用1%DMSO治疗24小时,分化到胰腺祖细胞,并移植到免疫缺陷SCID-Beige小鼠评估功能(例如,胰岛素分泌,以响应葡萄糖挑战或KCl刺激) (图5A)。而分化为 FOXA2+ 的效率(+90%)和 PDX1+ (+75%)胰腺祖细胞在HUES8 hESC线的对照和DMSO处理的hESCs(图5B)之间具有可比性,在24小时1%DMSO治疗后与hESCs分化的细胞对葡萄糖和KCl的响应能力得到改善刺激在体内移植。移植后2周内功能明显改善(图5C),移植后至少16周(图5D)。综合起来,这些结果表明,DMSO预处理不仅提高了生殖层、祖细胞和更成熟的细胞类型的分化效率,而且持续增强体内分化细胞的功能。
| 差异化细胞类型 | 起始单元格类型 | %DMSO | DMSO 治疗长度 | DMSO 治疗长度 |
| 肝细胞 | Esc 肝细胞系 Esc Esc 中位干细胞 iPSC Esc Esc 肝细胞系 Esc | 1.0 1.0 1.0 0.5 0.1-2.0 1.0 1.0 0.5 1.0 0.6 | 8 天 几天 7 天 10-14天 7-21天 7 天 4 天 5 天 2-21天 整个 | 巴斯马等人,2008年 卡内布拉特和安德斯森,2008 Hay等人,2009年 段等人,2010年 Alizadeh等人,2014年 Kondo等人,2014年 斯科尔尼卡等人,2014年 Czysz等人,2015年 尼古拉·阿尔等人,2016 万霍夫等人,2016 |
| 主要生殖层 | ESC 和 iPSC hESC hESC | 0.1-2.0 0.5 0.1-2.0 | 24 小时 24 小时 24 小时 | 切蒂等人,2013年 切蒂等人,2015年 李等人,2018 |
| 心脏细胞 | ESC 和 iPSC P19 单元格 ESC 和 iPSC 胎儿中位干细胞 | 0.1-2.0 1.0 1.0-2.0 0.8-1.0 | 24 小时 4 天 24-30 小时 24 小时 | 切蒂等人,2013年 Choi等人,2014年 范登伯格等人,2016年 邓等人, 2017 |
| 胰腺细胞 | ESC 和 iPSC hESC | 0.1-2.0 0.5 | 24 小时 24 小时 | 切蒂等人,2013年 切蒂等人,2015年 |
| 平滑肌细胞 | P19 单元格 | 1.0 | 4 天 | Choi等人,2014年 |
| 内皮细胞 | P19 单元格 | 1.0 | 4 天 | Choi等人,2014年 |
| 肠细胞 | iPSC | 0-1.6 | 4 天 | Ogaki等人,2015年 |
| 古特上皮 | iPSC | 0-1.6 | 4 天 | Ogaki等人,2015年 |
| 神经细胞 | 马尔莫塞特 iPSC | 0.05-2.0 | 24 小时 | 邱等人,2015 |
| 中性 粒 细胞 | 白血病细胞系 | 1.25 | 6-8天 | 蒂莫里安和莫汉卢,2016 |
| 骨骼心肌管 | iPSC | 1.5 | 24 小时 | 斯瓦茨等人,2016 |
| 皮质器官 | hiPSC | 1.0 | 24 小时 | Yoon等人,2018 |
表1:以前发表的工作摘要,说明DMSO治疗对分化的有益影响。
| S1 | S2 | S3 | S5 | |
| MCDB131 (L) | 1 | 1 | 1 | 1 |
| 葡萄糖(克) | 0.44 | 0.44 | 0.44 | 3.6 |
| NaHCO3(克) | 2.46 | 1.23 | 1.23 | 1.754 |
| FAF-BSA (g) | 20 | 20 | 20 | 20 |
| ITS-X (mL) | 0.02 | 0.02 | 5 | 5 |
| 谷氨酸 (mL) | 10 | 10 | 10 | 10 |
| 维生素C(毫克) | 44 | 44 | 44 | 44 |
| 肝素(毫克) | 0 | 0 | 0 | 10 |
| 市盈率(升) | 10 | 10 | 10 | 10 |
表 2:的组件内分泌祖细胞分化基基介质。
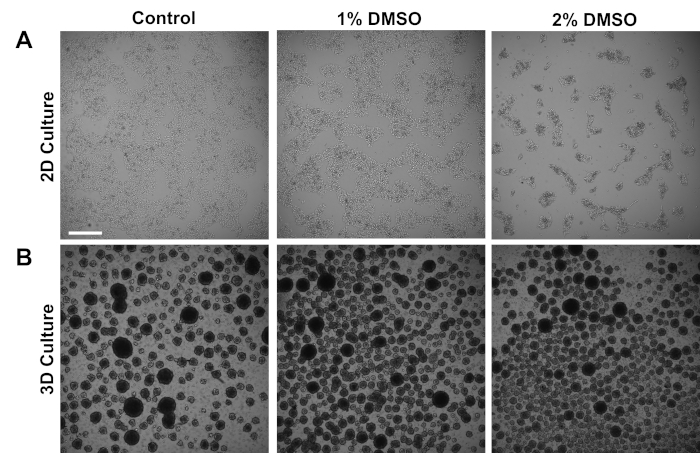
图 1:DMSO治疗改变hPSC的生长。(A)在接受无治疗(控制)或治疗后,在单层中镀有代表性的HiPSCs的亮场图像,在24小时,使用1%或2%的DMSO,DMSO促进iPSC的瞬态剂量依赖性生长抑制。(B)在低附着板上镀的 hiPSC 的代表性亮场图像,以便在 24 小时未接受 1% 或 2% DMSO 处理后允许 3D 球体形成,DMSO 处理可产生较少的可变 3D 球形形成与控制相比。比例尺 = 500 μm。请点击此处查看此图的较大版本。
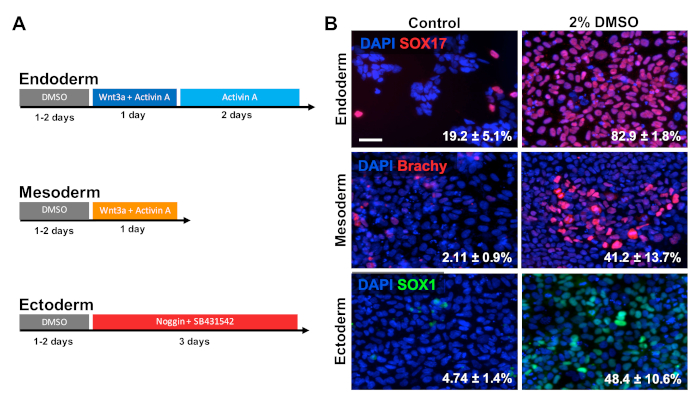
图 2:DMSO处理可改善hPSC与原发菌层的分化。(A) 用于生成三种主要生殖层的分化协议原理图.(B) 为 SOX17 (内分体)、紫鼓 (中位) 和 SOX1(异体化)进行免疫标记的差异化 HUES6 hESC 免疫标记的代表性图像。2% DMSO 的预处理24小时,提高了所有三个胚芽层的分化效率。分化成 SOX17+ 内皮、Brachyury(Brachy)® 中皮层或 SOX1+ 外皮细胞的百分比,在定向分化到每个生殖层的控制和 DMSO 处理的 hESC 后,通过三个生物复制的 SEM 进行记录.未配对 t 检验:内皮 p = 0.0003;中生位 p = 0.047;埃托德姆 p = 0.015。比例尺 = 50 μm。请点击此处查看此图的较大版本。
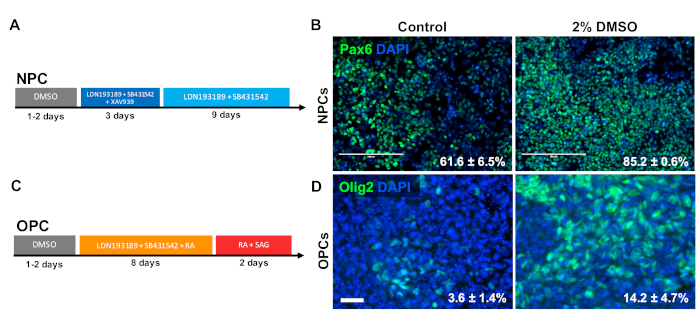
图 3:DMSO治疗改善对神经祖细胞类型的分化。(A) 用于生成神经祖细胞 (NPC) 的分化协议原理图。(B) 人类 iPSC 的代表性图像分化为 NPC 免疫标记的 Pax6。24小时预处理与2%DMSO增加数量PAX6阳性细胞。在控制直接分化和DSO处理的人类iPSC之后,区分成Pax6+NPC的细胞的百分比通过三个生物复制的SEM得到记录。未配对的 t 检验: p = 0.0225。刻度条 = 200 μm (C) 用于生成寡核苷酸祖细胞 (OPCs) 的分化方案原理图。(D) 人类 iPSC 的代表性图像分化为 OpCs 免疫标记,用于 OPC 标记 Olig2。与对照相比,2%DMSO 的预处理增加了两个 OPC 标记的表达。在控制定向分化和DMSO处理的人类iPSC后,分化成Olig2+OPC的细胞的百分比通过四个生物复制的SEM得到记录。未配对的 t 检验: p = 0.0466。比例尺 = 50 μm。请点击此处查看此图的较大版本。
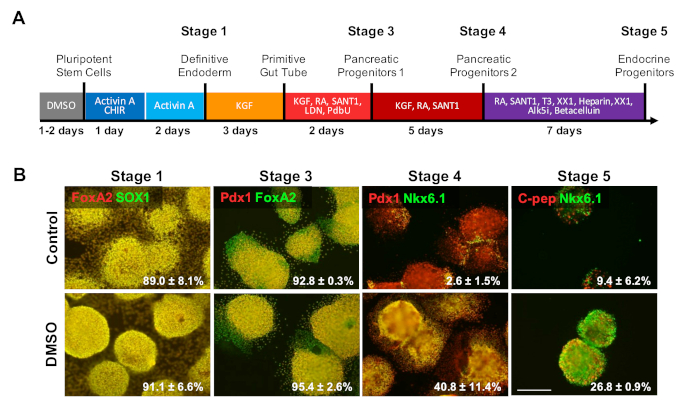
图 4:DMSO处理增强hPSC的终端分化潜力。(A) HUES8 hESCs 以 ±20 天定向分化为最终分化的胰腺内分泌细胞的架构。(B) 在未处理对照细胞和预处理2%DMSO的细胞进行定向分化后,在分化的每个阶段对指示标记物进行免疫染色,每次24小时。初始DMSO治疗在定向分化的后期阶段持续增加对终端内分泌细胞类型的分化。在对照定向分化和DMSO处理的hESC后,在分化的每个阶段,分化成指示标记的细胞的百分比以2至4个生物复制的SEM表示。比例尺 = 200 μm。请点击此处查看此图的较大版本。
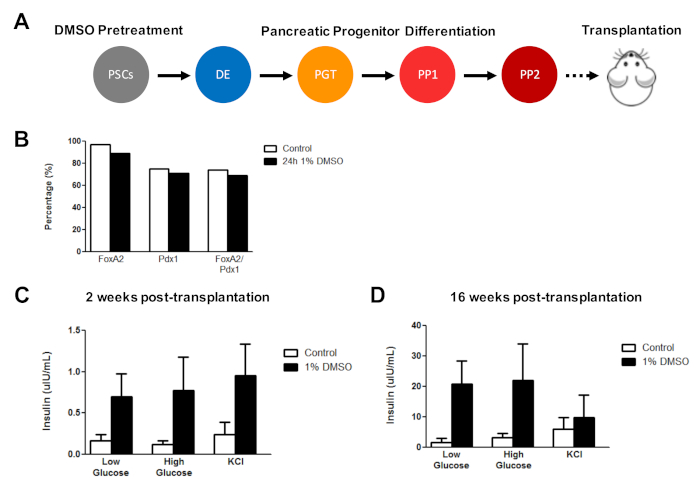
图 5:在体内移植胰腺祖细胞后,对hPSCs的初始DMSO治疗可增强葡萄糖反应能力。(A) HUES8 hESC 进入胰腺祖细胞 (PP 2) 的定向分化(+15 天) 的原理图,无需治疗(对照)或 24 h 1% DMSO 治疗和随后的移植(500 万个细胞)进入免疫缺陷SCID-贝色小鼠。(B) 移植前,在体外定向分化控制和DMSO处理的hESCs(n = 1)后分化成PDX1+和FOXA2+胰腺祖细胞的细胞的百分比。(C) 在胰腺移植后(C) 2 周和 (D) 胰腺移植后 16 周从小鼠血清中测量人体胰岛素的平均 ELISA测量(2.5 mM)或高(15 mM)葡萄糖挑战或氯化钾 (KCl) 刺激祖细胞从对照和DMSO处理的hESCs中区分(误差柱 = SEM;n = 3在2周和16周控制;n = 2周2,DMSO16周)。双向方差分析:p = 0.0051 用于控制,DMSO 在 2 周时;p = 0.0116 用于控制,而 DMSO 在 16 周时。在不同时间点研究的小鼠是不同的。结果改编自切蒂等人3。请点击此处查看此图的较大版本。
讨论
总之,该协议描述了一种简单而廉价的工具,用于增强多能干细胞(PSCs)对所有主要生殖层、各种类型专用祖细胞,甚至体外功能性成熟细胞类型的分化能力和在体内设置。插图是在我们的实验室和其他实验室中有效复制的特定分化协议,但任何选择的分化协议都可以在 DMSO 处理后使用。如表1所示,一些实验室在瞬态DMSO治疗后也证明了PSC分化的增强,使用不同的范例来生成各种其他的终端细胞类型。此外,虽然此处的方法描述了人类PSC的使用,但DMSO预处理可以跨物种使用,并且已被证明在小鼠、兔子和灵长类动物中有效。
虽然高剂量的DMSO已知是细胞毒性,在这种方法中使用的低剂量(1%-2%)暂时性期间导致细胞死亡最小。虽然DMSO治疗后立即导致细胞周期在G1阶段促进细胞周期抑制的DMSO可能减少,但先前的研究表明,在去除后,细胞能够达到与对照培养物相同的汇合水平DMSO3.
DMSO 预处理的百分比和持续时间应针对每个细胞系进行优化。治疗时间应调整,并考虑细胞的循环/倍增时间。例如,鼠标 PSC 的循环时间通常短得多,约为 15 小时;因此,DMSO治疗15小时这些细胞就足够了。一些实验室还发现,DMSO治疗在分化协议期间或浓度较低时有益(见表1)。应该指出的是,一些PSC线更可修改,以区分到特定的谱系。例如,HUES6细胞被证明对分化的宽容程度较低,因此在DMSO处理下有了显著改善(图2)。或者,图4和图5中使用的HUES8细胞已证明具有较高的内皮分化倾向;因此,在控制与DMSO之间,在初始阶段对最终内分度的差异较少。尽管如此,DMSO预处理的增强是观察到在这个细胞系分化的后期阶段(图4B)。DMSO 处理也用途广泛,因为它在 2D 和 3D 细胞培养系统中都有效,可与细胞培养板上的各种涂层材料一起使用,并且适用于不同类型的维护介质,可促进hPSC(例如,mTeSR、E8、MEF 调节介质等)。
更一般地,这些结果表明,多能干细胞的起始状态对初始分化的倾向以及功能细胞类型的终端分化有强烈的影响。我们之前已经表明,DMSO治疗功能通过Rb在hPSCs3,5。Rb在促进终端分化、细胞存活和细胞遗传稳定性方面起着重要作用,因此可以解释对细胞的持续影响区别于经过 DmSO 处理的 hPSC。瞄准这些早期的调节模式,可能会使hPSC走上更好的分化轨道,并最终改善其再生医学的效用。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了斯坦福大学医学院的赠款和授予S.C.的Siebel奖学金的支持。
材料
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 21985023 | |
| 6-well Clear Flat Bottom TC-treated Multiwell Cell Culture Plate | Corning | 353046 | |
| 9-Position stir plate | Chemglass | CLS-4100 | |
| Accutase | Gibco | 11105-01 | |
| Activin A | R&D Systems | 338-AC | |
| Advanced RPMI | Gibco | 12633012 | |
| Alk5i II | Axxora | ALX-270-445 | |
| All-trans retinoic acid | Sigma-Aldrich | R2625 | |
| anti-Brachyury | R&D Systems | AF2085 | No variablity observed across different lot numbers |
| anti-C-peptide | Developmental Studies Hybridoma Bank | GN-ID4 | No variablity observed across different lot numbers |
| anti-FoxA2 | Millipore | 07-633 | No variablity observed across different lot numbers |
| anti-Nkx2.2 | University of Iowa, Developmental Hybridoma Bank | 74.5A5 | No variablity observed across different lot numbers |
| anti-Nkx6.1 | University of Iowa, Developmental Hybridoma Bank; | F55A12-supernatant | No variablity observed across different lot numbers |
| anti-Olig2 | EMD Millipore | MABN50 | No variablity observed across different lot numbers |
| anti-Pax-6 | Biolegend | 901301 | No variablity observed across different lot numbers |
| anti-Pdx1 | R&D Systems | AF2419 | No variablity observed across different lot numbers |
| anti-SOX1 | R&D Systems | AF3369 | No variablity observed across different lot numbers |
| anti-SOX17 | R&D Systems | AF1924 | No variablity observed across different lot numbers |
| B-27 Supplement, minus Vitamin A | Gibco | 12587010 | |
| Basic fibroblast growth factor | Gibco | PHG0264 | |
| Betacellulin | Thermo Fisher Scientific | 50932345 | |
| Chir99021 | Stemgent | 04-000-10 | |
| CMRL 1066 | Corning | 99-603-CV | |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAF1000 | |
| D-(+)-Glucose | Sigma | G7528 | |
| DAPI | Invitrogen | D1306 | |
| Disposable Spinner Flasks | Corning, VWR | 89089-814 | |
| DMEM/F-12 | Gibco | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Essential 6 Media | Gibco | A1516501 | |
| FAF-BSA | Proliant | 68700 | |
| FGF7 | PeproTech | 100-19 | |
| Geltrex | Gibco | A1413202 | |
| GlutaMAX | Gibco | 35050061 | |
| Heparin | Sigma | H3149 | |
| Human Ultrasensitive Insulin ELISA | ALPCO Diagnostics | 80-INSHUU-E01.1 | |
| ITS-X | Invitrogen | 51500056 | |
| KGF | Peprotech | AF-100-19 | |
| Knockout DMEM | Gibco | 10829018 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| L-3,3′,5-Triiodothyronine (T3) | EMD Millipore | 642245 | |
| LDN193189 | Stemgent | 04-0074 | |
| Matrigel Matrix | Corning | 354277 | |
| MCDB-131 | Cellgro | 15-100-CV | |
| MEM NEAA | Gibco | 11140050 | |
| mTeSR 1 | StemCell Technologies | 5850 | |
| N2 Supplement | Life Technologies | 17502048 | |
| NaHCO3 | Sigma | S3817 | |
| Noggin Fc Chimera Protein | R&D Systems | 3344-NG-050 | |
| PdBU | EMD Millipore | 524390 | |
| Penicillin/Streptomycin | Mediatech | 30-002-CI | |
| RPMI | Gibco | 11875-093 | |
| Sant1 | Sigma-Aldrich | S4572 | |
| SB431542 | Stemgent | 04-0010 | |
| Smoothened Agonist, SAG | EMD Millipore | 566660 | |
| StemPro Accutase | Gibco | A1110501 | |
| TrypLE | Gibco | 12604013 | |
| Ultra-Low Attachment Microplates | Corning | 3471 | |
| Vitamin C | Sigma-Aldrich | A4544 | |
| Wnt3a | R&D Systems | 5036-WN | |
| XAV 939 | Tocris | 3748 | |
| XXI | EMD Millipore | 565790 | |
| Y-27632 | StemCell Technologies | 72302 |
参考文献
- Osafune, K., et al. Marked differences in differentiation propensity among human embryonic stem cell lines. Nature Biotechnology. 26 (3), 313-315 (2008).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Review Genetics. 15 (2), 82-92 (2014).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Conklin, J. F., Sage, J. Keeping an eye on retinoblastoma control of human embryonic stem cells. Journal of Cellular Biochemistry. 108 (5), 1023-1030 (2009).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110(2018).
- Hartwell, L. H., Weinert, T. A. Checkpoints: controls that ensure the order of cell cycle events. Science. 246 (4930), 629-634 (1989).
- Pardee, A. B. G1 events and regulation of cell proliferation. Science. 246 (4930), 603-608 (1989).
- Orford, K. W., Scadden, D. T. Deconstructing stem cell self-renewal: genetic insights into cell-cycle regulation. Nature Review Genetics. 9 (2), 115-128 (2008).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453 (7194), 519-523 (2008).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells. 26 (4), 894-902 (2008).
- Duan, Y., et al. Differentiation and characterization of metabolically functioning hepatocytes from human embryonic stem cells. Stem Cells. 28 (4), 674-686 (2010).
- Szkolnicka, D., Farnworth, S. L., Lucendo-Villarin, B., Hay, D. C. Deriving functional hepatocytes from pluripotent stem cells. Current Protocols in Stem Cell Biology. 30, 1-12 (2014).
- Vanhove, J., et al. H3K27me3 Does Not Orchestrate the Expression of Lineage-Specific Markers in hESC-Derived Hepatocytes In Vitro. Stem Cell Reports. 7 (2), 192-206 (2016).
- Kanebratt, K. P., Andersson, T. B. Evaluation of HepaRG cells as an in vitro model for human drug metabolism studies. Drug Metabolism & Disposition. 36 (7), 1444-1452 (2008).
- Nikolaou, N., Green, C. J., Gunn, P. J., Hodson, L., Tomlinson, J. W. Optimizing human hepatocyte models for metabolic phenotype and function: effects of treatment with dimethyl sulfoxide (DMSO). Physiological Reports. 4 (21), (2016).
- Kondo, Y., et al. An efficient method for differentiation of human induced pluripotent stem cells into hepatocyte-like cells retaining drug metabolizing activity. Drug Metabolism Pharmacokinetics. 29 (3), 237-243 (2014).
- Alizadeh, E., et al. The effect of dimethyl sulfoxide on hepatic differentiation of mesenchymal stem cells. Artificial Cells, Nanomedicine, and Biotechnology. 44 (1), 157-164 (2016).
- Czysz, K., Minger, S., Thomas, N. DMSO efficiently down regulates pluripotency genes in human embryonic stem cells during definitive endoderm derivation and increases the proficiency of hepatic differentiation. PLoS One. 10 (2), 0117689(2015).
- Ogaki, S., Morooka, M., Otera, K., Kume, S. A cost-effective system for differentiation of intestinal epithelium from human induced pluripotent stem cells. Scientific Reports. 5, 17297(2015).
- Choi, S. C., et al. Mixl1 and Flk1 Are Key Players of Wnt/TGF-beta Signaling During DMSO-Induced Mesodermal Specification in P19 cells. Journal of Cellular Physiology. 230 (8), 1807-1821 (2015).
- Chetty, S., et al. A Src inhibitor regulates the cell cycle of human pluripotent stem cells and improves directed differentiation. Journal of Cell Biology. 210 (7), 1257-1268 (2015).
- Qiu, Z., et al. Marmoset induced pluripotent stem cells: Robust neural differentiation following pretreatment with dimethyl sulfoxide. Stem Cell Research. 15 (1), 141-150 (2015).
- Swartz, E. W., et al. A Novel Protocol for Directed Differentiation of C9orf72-Associated Human Induced Pluripotent Stem Cells Into Contractile Skeletal Myotubes. Stem Cells Translational Medicine. 5 (11), 1461-1472 (2016).
- Teimourian, S., Moghanloo, E. Thwarting PTEN Expression by siRNA Augments HL-60 Cell Differentiation to Neutrophil-Like Cells by DMSO and ATRA. DNA Cell Biology. 35 (10), 591-598 (2016).
- van den Berg, C. W., Elliott, D. A., Braam, S. R., Mummery, C. L., Davis, R. P. Differentiation of Human Pluripotent Stem Cells to Cardiomyocytes Under Defined Conditions. Methods in Molecular Biology. 1353, 163-180 (2016).
- Deng, F., et al. Combination of retinoic acid, dimethyl sulfoxide and 5-azacytidine promotes cardiac differentiation of human fetal liver-derived mesenchymal stem cells. Cell Tissue Bank. 17 (1), 147-159 (2016).
- Yoon, S. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2018).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637(2018).
- Kroon, E., et al. Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo. Nature Biotechnology. 26 (4), 443-452 (2008).
- Zhang, P., et al. Short-term BMP-4 treatment initiates mesoderm induction in human embryonic stem cells. Blood. 111 (4), 1933-1941 (2008).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Tchieu, J., et al. A Modular Platform for Differentiation of Human PSCs into All Major Ectodermal Lineages. Cell Stem Cell. 21 (3), 399-410 (2017).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Fiore, M., Degrassi, F. Dimethyl sulfoxide restores contact inhibition-induced growth arrest and inhibits cell density-dependent apoptosis in hamster cells. Experimental Cell Research. 251 (1), 102-110 (1999).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Bock, C., et al. Reference Maps of human ES and iPS cell variation enable high-throughput characterization of pluripotent cell lines. Cell. 144 (3), 439-452 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- D'Amour, K. A., et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nature Biotechnology. 24 (11), 1392-1401 (2006).
- Jacks, T., et al. Effects of an Rb mutation in the mouse. Nature. 359 (6393), 295-300 (1992).
- Nguyen, D. X., Baglia, L. A., Huang, S. M., Baker, C. M., McCance, D. J. Acetylation regulates the differentiation-specific functions of the retinoblastoma protein. The EMBO Journal. 23 (7), 1609-1618 (2004).
- Slack, R. S., et al. Cells differentiating into neuroectoderm undergo apoptosis in the absence of functional retinoblastoma family proteins. Journal of Cell Biology. 129 (3), 779-788 (1995).
- Gu, W., et al. Interaction of myogenic factors and the retinoblastoma protein mediates muscle cell commitment and differentiation. Cell. 72 (3), 309-324 (1993).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。