Method Article
Transiente Behandlung von humanen pluripotenten Stammzellen mit DMSO zur Förderung der Differenzierung
In diesem Artikel
Zusammenfassung
Die Generierung differenzierter Zelltypen aus menschlichen pluripotenten Stammzellen (hPSCs) ist sehr therapeutisches Versprechen, bleibt aber herausfordernd. PSCs weisen oft eine inhärente Unfähigkeit auf, sich zu differenzieren, selbst wenn sie mit einem richtigen Satz von Signalen stimuliert werden. Hier wird ein einfaches Tool beschrieben, um die Differenzierung mehrerer Linien über eine Vielzahl von PSC-Linien hinweg zu verbessern.
Zusammenfassung
Trotz des zunehmenden Einsatzes pluripotenter Stammzellen (PSCs) bleiben Herausforderungen bei der effizienten Differenzierung embryonaler und induzierter pluripotenter Stammzellen (ESCs und iPSCs) über verschiedene Abstammungslinien bestehen. Zahlreiche Differenzierungsprotokolle wurden entwickelt, doch Variabilität über Zelllinien hinweg und niedrige Differenzierungsraten stellen herausforderunglichen Herausforderungen bei der erfolgreichen Implementierung dieser Protokolle dar. Hier wird beschrieben, dass die Differenzierungskapazität von PSCs einfach und kostengünstig verbessert werden kann. Es wurde bereits gezeigt, dass die Behandlung von Stammzellen mit einer geringen Konzentration von Dimethylsulfoxid (DMSO) die Neigung einer Vielzahl von PSCs, sich nach gezielter Differenzierung zu verschiedenen Zelltypen zu unterscheiden, signifikant erhöht. Diese Technik hat sich nun bei verschiedenen Arten (z. B. Maus, Primaten und Mensch) in mehreren Linien bewährt, von Neuronen und kortikalen Sphäroiden bis hin zu glatten Muskelzellen und Hepatozyten. Die DMSO-Vorbehandlung verbessert die PSC-Differenzierung, indem sie den Zellzyklus reguliert und Stammzellen grundiert, um besser auf Differenzierungssignale reagieren zu können. Hier ist die detaillierte Methodik für die Verwendung dieses einfachen Werkzeugs als reproduzierbares und weit verbreitetes Mittel zur effizienteren Unterscheidung von PSCs zu jeder Linie ihrer Wahl.
Einleitung
Der Einsatz pluripotenter Stammzellen hat zu zahlreichen Fortschritten in der biomedizinischen Forschung geführt, darunter die Bereiche regenerative Medizin und stammzellbasierte Therapien, Krankheitsmodellierung und Arzneimittelscreening. Es hat auch zu der allgemeinen Aussicht auf mehr übersetzbare Forschung und personalisierte Medizin geführt. Das Aufkommen der induzierten pluripotenten Stammzelltechnologie (iPSC) vor über 20 Jahren hat es Forschern ermöglicht, pluripotente Stammzellen aus somatischen Geweben zu entwickeln und sie in funktionelle Zelltypen zu differenzieren, um eine Vielzahl von Pathologien zu untersuchen, einschließlich Herz-Kreislauf-, neurologischen und immunologischen Erkrankungen. Obwohl bei der Stammzelldifferenzierungstechnologie erhebliche Fortschritte erzielt wurden, bestehen nach wie vor Herausforderungen bei der effektiven Differenzierung menschlicher embryonaler Stammzellen (hESCs) und iPSCs, wodurch der weit verbreitete Einsatz von Stammzelltechnologie in verschiedenen Forschungsprogramme. Die inhärente Variabilität zwischen verschiedenen Zelllinien und Klonen stellt weiterhin Hindernisse für die Unterscheidung von Stammzelllinien auf gewünschte Linages1dar. Darüber hinaus bleibt die Ableitung ausgereifter, terminal differenzierter Funktionszellen aus hPSCs ein mühsamer und ineffizienter Prozess über viele Linien hinweg. Tatsächlich können sich Zellen, die von hPSCs unterschieden, oft nicht endlos in funktionelle Zellen differenzieren2. Bei weiteren, auf Stammzellen basierenden Therapien zur Anwendung bei Patienten ist es notwendig, die Wirksamkeit von Zellen, die aus hPSCs erzeugt werden, zu verbessern und sicherzustellen.
Unser Labor hat ein schnelles, kostengünstiges Tool entwickelt, um die Effizienz der Unterscheidung von iPSCs und ESCs in ausgereifte Zelltypen deutlich zu verbessern. Wir fanden heraus, dass die Vorbehandlung von HiPSCs und hESCs mit dem häufig verwendeten Reagenz Dimethylsulfoxid (DMSO) für 24 h bis 48 h vor der gerichteten Differenzierung zu einer deutlichen Verbesserung der Stammzelldifferenzierungskapazität führt. Die Behandlung mit DMSO erhöht den Anteil von HiPSCs und hESCs in der frühen G1-Phase des Zellzyklus und aktiviert das Retinoblastom-Protein (Rb)3, einen kritischen Regulator für Zellproliferation, Überleben und Differenzierung4. In neueren Arbeiten wurde festgestellt, dass Rb und seine Familienmitglieder für die Pro-Differenzierungseffekte von DMSO erforderlich sind, so dass die vorübergehende Inaktivierung von Rb die Wirkungen von DMSO unterdrückt, während die konstitutive Aktivierung von Rb in vorübergehender Weise Wirkungen von DMSO5. Analog zum Zellzyklus während der embryonalen Entwicklung ist der Zellzyklus von ESCs und iPSCs durch eine abgekürzte G1-Phase gekennzeichnet, die die Selbsterneuerungfördert 6,7,8. Diese abgekürzte G1-Phase ermöglicht eine uneingeschränktere Proliferation, begrenzt aber das Differenzierungspotenzial4,9. Durch die Förderung des Wachstumsstillstands in G1 und die Aktivierung von Checkpoint-Kontrollen im Zellzyklus von hESCs und iPSCs grundiert die DMSO-Behandlung Zellen für Zellschicksale nach gezielter Differenzierung.
Bisher hat sich gezeigt, dass die DMSO-Vorbehandlung die Differenzierungsfähigkeit zu allen drei Keimschichten in über 30 kontroll- und krankheitsspezifischen menschlichen ESC- und iPSC-Zelllinien3,5 sowie die Differenzierung von Stammzellen und anderen Zelllinien zu einer Vielzahl anderer ausgereifter Zelltypen in nachfolgenden Studien10,11,12,13,14,15,16, 17 , 18 , 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 , 27 , 28 (Tabelle 1). Darüber hinaus hat sich gezeigt, dass die DMSO-Behandlung wirksam ist, um die Differenzierung der nichtmenschlichen Primärzellen21,23 (z. B. Maus, Primaten, Kaninchen) zu verbessern, was auf gemeinsame Mechanismen zwischen den Arten hindeutet. Schließlich wurde die DMSO-Vorbehandlung auch auf die Gen-Editing-Technologie ausgedehnt, wobei eine spezielle Studie zeigte, dass die 24-h-DMSO-Vorbehandlung von hESCs/iPSCs die Fähigkeit von Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR) signifikant erhöhte. /CRISPR-assoziiertes Protein-9 (Cas9)-vermittelte Bearbeitungseffizienz von nicht-kodierender DNA ohne unbeabsichtigte Mutationen29. Hier ist eine detaillierte Methodik der DMSO-Vorbehandlung von hESCs und iPSCs für Anwendungen in der Stammzellbiologie und gezielten Differenzierung vorgesehen.
Protokoll
1. Stammzellpflege
HINWEIS: Das unten beschriebene Zellerhaltungsprotokoll gilt für pluipotente Stammzellen (PSCs), die in einer anhaftenden Monoschicht gehalten werden. Medien, andere Reagenzien und Zellkulturplatten, die vor der DMSO-Behandlung verwendet werden, können bei Bedarf angepasst werden. Für alle folgenden Protokolle in diesem Manuskript sollten Zellen unter einem biologischen Sicherheitsschrank behandelt werden.
- Mantel sterile, 6 Brunnen, gewebekulturbehandelte Platten mit einer pluripotenten Stammzell-qualifizierten Matrix oder Substrat, die nach Herstelleranleitung hergestellt und mindestens 1 h in einem CO2-Inkubator (5% CO2, feuchte Atmosphäre) inkubiert werden. Beschichtete Platten können bis zu einer Woche bei 4 °C eingewickelt und gelagert werden.
- Die kryokonservierten PSCs in einem 37 °C-Wasserbad auftauen. Sterilisieren Sie die Durchstechflasche mit Ethanol vor der Einführung in den biologischen Sicherheitsschrank und übertragen Sie die Zellen dann sofort durch Pipettieren in ein steriles konisches Rohr, das 5-10 Bände vorgewärmter Stammzellmedien enthält.
- Zentrifugieren Sie die Zellen bei 300 x g für 5 min bei Raumtemperatur (RT).
- Die Medien ansaugen und das Zellpellet in 1 ml Stammzellmedium, ergänzt durch einen 10-M-ROCK-Hemmer, wie Y-27632, sanft wieder aufsetzen.
- Saugen Sie die Kulturmatrix aus der Platte und säen Sie die Zellen mit der gewünschten Dichte, typischerweise 0,5-1 x 106 Zellen pro Brunnen in mindestens 2 ml Stammzellmedium pro Brunnen.
HINWEIS: Die Beschichtungsdichte kann zwischen verschiedenen Zelllinien und Klone variieren und sollte entsprechend optimiert werden. - Pflegen Sie die Zellen, indem Sie sie täglich durch vorgewärmte Stammzellenmedien ersetzen. Teilen Sie die Zellen bei etwa 70%-80% Konfluenz oder wenn die Zellkolonien beginnen, Kontakt aufzunehmen.
- Zum Spalten von Zellen, aspirieren Sie die Medien und waschen Sie die Zellen einmal mit sterilen PBS. Inkubieren Sie die Zellen mit 1 ml einer Dissoziationsenzymlösung pro Brunnen für 5-10 Minuten bei 37 °C.
- Waschen und suspendieren Sie die Zellen mit vorgewärmten Stammzellmedien und übertragen Sie sie in ein steriles konisches Rohr mit 5-10 Volumen Stammzellmedien. Folgen Sie den Schritten 1.3-1.7, um die Zellen zu verkleben.
2. DMSO Vorbehandlung
HINWEIS: Bei der Beschichtung der Zellen für die DMSO-Vorbehandlung vor der Differenzierung sollte die Anfangsbeschichtungszelldichte unter Berücksichtigung der typischen Wachstumsrate der Stammzelllinie sowie des verwendeten Differenzierungsprotokolls optimiert werden. Validieren Sie Diepuripotenz mit herkömmlichen Markern, je nach Bedarf. Die Zellen sollten nach dem anfänglichen Auftauen vor der Differenzierung mindestens 1x-2x durchgesiepft werden.
-
2D-Kulturdifferenzierung
- Wenn die Zellen eine geeignete Konfluenz erreichen, bereiten Sie beschichtete Platten vor, dissoziieren Sie die Zellen und bereiten Sie eine einzellige Suspension wie oben beschrieben vor.
- Zählen Sie die lebenden Zellen mit einem Hämozytometer oder einem automatischen Zellzähler einschließlich Trypanblau oder einem anderen Lebensfähigkeitsmarker.
- Die Zellen mit dem 10-M-ROCK-Hemmer auf eine beschichtete 6-Well-Platte bei 0,5-1 x 106 Zellen pro Brunnen in Stammzellenmedien geben.
HINWEIS: Für die in unserem Labor getesteten Zelllinien führten diese Dichten in der Regel zu 80%-90% Konfluentzellen innerhalb der 24 h DMSO-Vorbehandlung. - Zellen 24 h bei 37 °C in einem CO2-Inkubator (5% CO2, feuchte Atmosphäre) brüten lassen.
- Bereiten Sie 1%-2% DMSO in vorgewärmten Stammzellenmedien vor (z. B. 100 l DMSO in 10 ml Medien = 1% DMSO-Lösung oder 200 -L DMSO in 10 ml Medien = 2% DMSO-Lösung).
- Nach 24 h Inkubation, aspirieren Sie die Medien aus Zellen und ersetzen Sie es durch DMSO-Lösung.
- Lassen Sie die Zellen vor der Differenzierung 24 h bis 48 h bei 37 °C in einem CO2-Inkubator (5% CO2 , feuchte Atmosphäre) brüten.
HINWEIS: Typischerweise ist eine 24-h-DMSO-Behandlung in der Mehrzahl der menschlichen ESC- und iPSC-Linien ausreichend. Zelllinien mit sehr langsamen Wachstumsraten (lange Verdoppelungszeiten) können von der 48-Stunden-Inkubation mit DMSO profitieren. Für eine 48 h Inkubation mit DMSO können Medien nach den ersten 24 h der Behandlung durch frische Stammzellmedien mit 1%-2% DMSO ersetzt werden.
-
3D-Kulturdifferenzierung:
- Wenn die Zellen eine geeignete Konfluenz erreichen, dissoziieren und sammeln Sie die Zellen in einer Zellsuspension, wie oben beschrieben.
- Zählen Sie die lebenden Zellen mit einem Hämozytometer oder einem automatischen Zellzähler einschließlich eines Lebensfähigkeitsmarkers.
- Die Zellen in einer unbeschichteten, niedrig aufsatzenden 6-Well-Platte bei 0,5-1 x 106 Zellen pro Brunnen in Stammzellmedien mit 10 M ROCK-Hemmer.
HINWEIS: Für die in unserem Labor getesteten Zelllinien führten diese Dichten in der Regel zu einer 3D-hPSC-Kugelbildung innerhalb von 24 h von Einstellzellen. - Zellen 24 h bei 37 °C in einem CO2-Inkubator (5% CO2, feuchte Atmosphäre) brüten lassen.
- Bereiten Sie 1%-2% DMSO in vorgewärmten Stammzellenmedien vor (z. B. 100 l DMSO in 10 ml Medien = 1% DMSO-Lösung oder 200 l DMSO in 10 ml Medien = 2% DMSO-Lösung).
- Ersetzen Sie die Medien nach Standardverfahren (z. B. kippen Sie die Platte in einem 30°-45°-Winkel, damit sich Zellkugeln am Boden des Brunnens absetzen können; übertragen Sie Zellen in ein steriles konisches Rohr und lassen Sie Zellkugeln sich am Boden des Rohres absetzen; oder sammeln Sie Zellen sanft i n Suspension mit einer 5- oder 10-ml-Pipette in ein steriles konisches Rohr und Zentrifugenzellen bei 300 x g für 5 min bei RT).
- Aspirieren Sie die Medien aus Zellen und ersetzen Sie es durch DMSO-Lösung, Pipettierung sanft.
- Zellen vor der Differenzierung 24 h bis 48 h bei 37 °C in einem CO2-Inkubator (5% CO2, feuchte Atmosphäre) brüten lassen.
HINWEIS: Typischerweise ist eine 24-h-DMSO-Behandlung in der Mehrzahl der menschlichen ESC- und iPSC-Linien ausreichend. Zelllinien mit sehr langsamen Wachstumsraten (lange Verdoppelungszeiten) können von der 48-Stunden-Inkubation mit DMSO profitieren. Für eine 48 h Inkubation mit DMSO können Medien nach den ersten 24 h der Behandlung durch frische Stammzellmedien mit 1%-2% DMSO ersetzt werden.
3. Differenzierung zu primären Keimschichten
HINWEIS: Im Folgenden werden Methoden beschrieben, die sich zuvor in unserem Labor für PSCs, die in einer Monoschicht auf 6 Brunnenplatten angebaut wurden, als wirksam erwiesen haben. Jedes Differenzierungsprotokoll nach Wahl sollte nach der DMSO-Behandlung verwendet werden, um die Differenzierung in gewünschte Linien zu fördern. Entfernen Sie die DMSO-Lösung nach einer 24-48 h Behandlung und fahren Sie mit der Differenzierung nach Standardprotokollen fort.
-
Endoderm-Differenzierung (angepasst von Kroon et al.30)
- Pretreat-Zellen mit DMSO, wie oben beschrieben für 2D-Kulturen.
- Bereiten Sie Wnt3a und Activin A Aktienlösungen vor.
- Bereiten Sie Tag 1 endodermale Differenzierungsmedien vor, indem Sie Wnt3a zu einer Endkonzentration von 20 ng/ml und Activin A auf eine Endkonzentration von 100 ng/ml auf das entsprechende Volumen der vorgewärmten RPMI-Medien einteilen.
- Nach DMSO-Vorbehandlung Medien aus den Zellen aspirieren und durch Day 1-Medien ersetzen (z.B. 2 ml pro Brunnen einer 6-Well-Platte).
- Zellen 24 h bei 37 °C in einem CO2-Inkubator (5% CO2, feuchte Atmosphäre) brüten lassen.
- Bereiten Sie Die Tage 2 und 3 endodermalen Differenzierungsmedien vor, indem Sie Activin A zu einer Endkonzentration von 100 ng/ml auf das entsprechende Volumen der vorgewärmten RPMI-Medien einteilen.
- Medien aus den Zellen ansaugen und durch Day 2-Medien ersetzen (z.B. 2 ml pro Brunnen einer 6-Well-Platte).
- Lassen Sie die Zellen 24 h bei 37 °C in einem CO2-Inkubator (5% CO2, feuchte Atmosphäre) brüten.
- Medien aus den Zellen ansaugen und durch Day 3-Medien ersetzen (z.B. 2 ml pro Brunnen einer 6-Well-Platte).
-
Mesoderm-Differenzierung (angepasst von Zhang et al.31)
- Zurückziehen Sie die Zellen mit DMSO, wie oben beschrieben für 2D-Kulturen.
- Bereiten Sie Wnt3a und Activin A Aktienlösungen vor.
- Bereiten Sie mesodermale Differenzierungsmedien vor, indem Sie Wnt3a zu einer Endkonzentration von 20 ng/ml und Activin A zu einer Endkonzentration von 100 ng/ml auf das entsprechende Volumen der vorgewärmten fortgeschrittenen RPMI-Medien hinzufügen.
- Nach DMSO-Vorbehandlung Medien aus Zellen aspirieren und durch Differenzierungsmedien ersetzen (z.B. 2 ml pro Brunnen einer 6-Well-Platte).
- Zellen 24 h bei 37 °C in einem CO2-Inkubator (5% CO2, feuchte Atmosphäre) brüten lassen.
-
Ectoderm-Differenzierung (angepasst von Chambers et al.32)
- Zurückziehen Sie die Zellen mit DMSO, wie oben beschrieben für 2D-Kulturen.
- Bereiten Sie Noggin und SB431542 Aktienlösungen vor.
- Bereiten Sie ektodermale Differenzierungbasismedien vor, indem Sie den Knockout-Serumersatz (KOSR) auf eine endgültige Konzentration von 10% in K.o.-DMEM auflösen.
HINWEIS: Bereiten Sie genügend Basismedien für 3-4 Tage Medienwechsel vor. - Bereiten Sie ektodermale Differenzierungsmedien vor, indem Sie Noggin zu einer Endkonzentration von 500 ng/mL und SB431542 zu einer Endkonzentration von 10 M auf das entsprechende Volumen des vorgewärmten KOSR/Knockout DMEM hinzufügen.
- Nach DMSO-Vorbehandlung Medien aus Zellen aspirieren und durch Differenzierungsmedien ersetzen (z.B. 2 ml pro Brunnen einer 6-Well-Platte).
- Lassen Sie Zellen 3-4 Tage bei 37 °C in einem CO2-Inkubator (5% CO2 , feuchte Atmosphäre) brüten und ersetzen Sie medientäglich durch frisch hinzugefügte Differenzierungsfaktoren.
4. Differenzierung nach Vorläuferzelltypen
Im Folgenden werden Methoden beschrieben, die sich zuvor in unserem Labor für PSCs, die in 2D- oder 3D-Kulturen angebaut wurden, als wirksam erwiesen haben. Jedes Differenzierungsprotokoll nach Wahl sollte nach der DMSO-Behandlung verwendet werden, um die Differenzierung in gewünschte Linien zu fördern. Entfernen Sie die DMSO-Lösung nach einer 24-48 h Behandlung und fahren Sie mit der Differenzierung nach Standardprotokollen fort.
- Neurale Vorläuferzelldifferenzierung (angepasst von Tchieu et al.33)
- Bereiten Sie 6 Wellplatten durch Beschichtung mit einer pluripotenten Stammzell-qualifizierten reduzierten WachstumsfaktorMatrix oder Substrat, nach DenerAnleitung des Herstellers, für mindestens 1 h in einem CO2-Inkubator (5% CO2, feuchte Atmosphäre). Beschichtete Platten können bis zu 1 Woche bei 4 °C eingewickelt und gelagert werden.
- Platten-PSCs, wie oben beschrieben, bei einer Dichte von 0,5-1 x 106 Zellen pro Brunnen in Stammzellmedien, die einen ROCK-Hemmer enthalten.
- Pretreat-Zellen mit DMSO, wie oben beschrieben für 2D-Kulturen.
- Bereiten Sie kleine chemische Inhibitoren LDN193189, SB431542 und XAV939 Stocklösungen vor.
- Bereiten Sie Tage 1-3 Neuroektoderm Differenzierung Medien durch Ergänzung Essential 6 Media mit 500 nM LDN193189, 10 M SB431542 und 2 M XAV939.
- Nach DMSO-Vorbehandlung die Medien aspirieren und durch Tage 1-3 Neuroektodermmedien ersetzen (z.B. 2 ml pro Brunnen einer 6-Well-Platte). Wechseln Sie täglich die Medien.
- Bereiten Sie Tage 4-12 Neuroektoderm Differenzierung Medien durch Ergänzung Essential 6 Media mit 500 nM LDN193189 und 10 M SB431542.
- An Tag 4 der Differenzierung, aspirieren Sie die Medien und ersetzen Sie durch Tage 4-12 Neurodektoderm Medien. Ändern Sie die Medien täglich.
- Nach 12 Tagen Differenzierung sollten differenzierte Zellen geeignete Marker von neuronalen Vorläuferzellen (NPCs) ausdrücken. NPCs können in neuronalen Medien, die DMEM/F-12, 2% B-27, 1% N-2 enthalten, weiter gepflegt und mit dem 10-g/ml-Basis-Fibroblasten-Wachstumsfaktor (bFGF) ergänzt werden. Durchgehen sie die NPCs, wenn sie mit einer Zellablösung konfluent sind, und beschichten Sie NPCs mit 0,5-1 x 106 Zellen pro Bohrkörper.
- Oligodendrozyten-Vorläuferzelldifferenzierung (angepasst von Douvaras und Fossati34)
- Die PSCs wie oben beschrieben mit einer Dichte von 1 x 105 pro Brunnen auf beschichteten 6 Wellplatten in Stammzellmedien, die einen ROCK-Inhibitor enthalten, verplatten.
- Pretreat-Zellen mit DMSO, wie oben beschrieben für 2D-Kulturen.
- Bereiten Sie SB431542, LDN193189, All-Trans-Retinsäure (RA) und geglättete Agonisten (SAG) Lagerlösungen vor.
- Bereiten Sie Tage 0–8 Differenzierungsmedien vor, indem Sie DMEM/F-12 mit 10 M SB431542, 250 nM LDN193189 und 100 nM RA ergänzen.
- Nach DMSO-Vorbehandlung, inkubieren Zellen mit Differenzierungsmedien für 8 Tage, wechselnde Medien täglich mit frisch hinzugefügten Differenzierungsfaktoren (z.B. 2 ml pro Brunnen einer 6-Well-Platte).
- Ersetzen Sie am 8. Tag die Medien durch DMEM/F-12, das 1x MEM-nicht-essentielle Aminosäuren (NEAA) Lösung, 1X L-Glutamin, 2-Mercaptoethanol, Penicillin/Streptomycin und 1x N-2 enthält, die 100 nM RA und 1 M SAG ergänzen. Ändern Sie die Medien täglich.
- Nach 12 Tagen Differenzierung sollten differenzierte Zellen geeignete Marker von Oligodendrozyten-Vorläuferzellen (OPCs) ausdrücken.
- Endokrine Vorläuferzelldifferenzierung (angepasst von Pagliuca et al.35)
- Seed PSCs bei 6 x 105 Zellen/ml in Stammzellenmedien plus 10 'M ROCK-Inhibitor in 500 ml Spinnerkolben, die auf einer 9-Positionen-Rührplatte mit einer Rotationsrate von 70 U/min in einem 37 °C-Inkubator, 5% CO2 und 100% Luftfeuchtigkeit platziert werden.
- Lassen Sie Cluster am unteren Rand des Kolbens absetzen, die Medien aspirieren und dann mit 1%-2% DMSO pretreaten.
- Bereiten Sie Activin A, Chir99021, KGF, Sant1, All-Trans-Retinoinsäure (RA), LDN193189, PdBU, XXI, Alk51, T3 und Betacelluin-Lagerlösungen vor.
- Vorbereiten von Differenzierungsbasismedien basierend auf der Formulierung in Tabelle 3.
- Nach DMSO-Vorbehandlung, Aspirat-Medien und ersetzen durch S1-Medien ergänzt durch 100 ng/ml Activin A und 3 mM Chir99021 (z.B. 500 ml pro Kolben). Inkubation für 24 h zulassen.
- Ersetzen Sie am 2. Tag Medien durch S1-Medien, die durch 100 ng/ml Activin A ergänzt werden. Inkubation für 2 Tage zulassen.
- Ersetzen Sie am 4. Tag Medien durch S2-Medien, die durch 50 ng/mL KGF ergänzt werden. Inkubation für 3 Tage zulassen, Medienwechsel nach den ersten 2 Tagen (Tag 6).
- Ersetzen Sie am 7. Tag Medien durch S3-Medien, ergänzt durch 50 ng/mL KGF, 0,25 mM Sant1, 2 mM RA und 200 nM LDN193189. Inkubation für 24 h zulassen.
- Ersetzen Sie am 8. Tag Medien durch S3-Medien, ergänzt durch 50 ng/mL KGF, 0,25 mM Sant1, 2 mM RA, 200 nM LDN193189 und 500 nM PdBU. Inkubation für 24 h zulassen.
- Ersetzen Sie am 9. Tag Medien durch S3-Medien, ergänzt durch 50 ng/mL KGF, 0,25 mM Sant1 und 100 nM RA. Inkubation für 5 Tage zulassen, Medienwechseln alle 2 Tage (Tag 11 und 13).
- Ersetzen Sie an den Tagen 14 und 16 Medien durch S5-Medien, die mit 0,25 mM Sant1, 100 nM RA, 1 mM XXI, 10 mM Alk5i II, 1 mM T3 und 20 ng/mL Betacellulin (4 Tage Gesamtinkubation) ergänzt werden.
- Ersetzen Sie an den Tagen 18 und 20 Medien durch S5-Medien, die mit 25 nM RA, 1 mM XXI, 10 mM Alk5i II, 1 mM T3 und 20 ng/mL Betacellulin ergänzt werden.
5. Immunzytochemische Validierung der Differenzierung
HINWEIS: Die folgenden Methoden beschreiben ein allgemeines immunzytochemisches Protokoll, das bei Bedarf angepasst werden kann. Primäre Antikörper sind solche, die zuvor in unserem Labor validiert wurden. Es können auch andere Techniken zur Validierung der Differenzierung eingesetzt werden (z. B. Durchflusszytometrie, qPCR, RNA-Sequenzierung, Western Blotting, funktionelle Assays usw.).
-
Immunlabeling-Zellen
- Für 3D-Kulturen in Suspension, Platte ganze Zellcluster oder Cluster in einzellige Suspension auf beschichteten Platten für 18-24 h vor der Fixierung dispergiert.
- Medien aus anhaftenden Zellen ansaugen und kurz mit PBS bei RT auf einem Shaker waschen.
- Zur Zellfixierung, Aspirieren PBS und inkubieren Zellen mit 4% Paraformaldehyd (PFA) in PBS für 20 min bei RT auf Shaker.
ACHTUNG: PFA-Bestände sollten aufgrund ihrer Toxizität unter einer Dunstabzugshaube hergestellt werden. Nicht einatmen und tragen Sie keine geeignete persönliche Schutzausrüstung. - PfA entfernen und im richtigen chemischen Abfallbehälter entsorgen.
- Waschen Sie Zellen 3x mit PBS für mindestens 5 min pro Wäsche bei RT auf einem Shaker.
- Zur Zellpermeabilisation und -blockierung, inkubieren Zellen mit 5% Eselserum in 0,3% Triton-x 100/PBS für 1 h bei RT auf einem Shaker hergestellt.
- Bereiten Sie die primäre Antikörperlösung in derselben Lösung vor, die für die Permeabilisierung/Blockierung verwendet wird.
- Inkubieren Sie in Primärantikörperlösung über Nacht bei 4 °C auf Shaker.
- Nach der nächtlichen Inkubation die Zellen 3x mit PBS für mindestens 5 min pro Wäsche bei RT auf einem Shaker waschen.
- Bereiten Sie sekundäre Antikörperlösung in Permeabilisation /Blocking-Lösung vor.
- In sekundäre Antikörperlösung für 1 h bei RT auf einem Shaker inkubieren lassen.
- Aspirieren Sekundärantikörperlösung und Waschzellen 3x mit PBS für mindestens 5 min pro Wäsche bei RT auf einem Shaker.
- Inkubieren Sie Zellen mit DAPI oder einem anderen bevorzugten Marker für die entsprechende Inkubationszeit, und spülen Sie sie in PBS.
-
Bildquantifizierung
- Erfassen Sie mindestens drei Bilder pro Zustand auf einem Fluoreszenzmikroskop und/oder mit einer hochgehaltigen Screening-Plattform.
- Quantifizieren Sie den Prozentualen Anteil der positiven Zellen für jeden Marker, indem Sie die Gesamtzahl der Antikörper-gefärbten Zellen und die Gesamtzahl der Zellzahlen (basierend auf DAPI/Hoechst-Kernfärbung) mit unvoreingenommener Bildgebungssoftware (z. B. ImageJ) oder einer automatisierten Screening-Plattform für Analysen.
Ergebnisse
Morphologie von DMSO behandelten iPSCs
Menschliche iPSCs, die von Kontrollpersonen abgeleitet wurden, wurden entweder in einer anhaftenden 2D-Monoschicht oder in 3D-Zellkugeln in Suspension kultiviert. Ungefähr 24 h nach der Erstbeschichtung wurden die Zellen entweder mit 1% oder 2% DMSO für 24 h im Wartungsmedium behandelt. Repräsentative Hellfeldbilder nach der DMSO-Behandlung sind in Abbildung 1dargestellt. In Übereinstimmung mit früheren Berichten über iPSCs, die in einer Monoschicht3aufrechterhalten wurden, führte die DMSO-Vorbehandlung zu einer vorübergehenden dosisabhängigen Abnahme der Wachstumsrate im Vergleich zu nicht-DMSO-behandelten Zellen (Abbildung 1A). Diese verminderte Proliferation ist mit einer Zunahme des Zell-zu-Zell-Kontakts verbunden, der besonders ausgeprägt ist in den 2% DMSO behandelten Zellen, die eine erhöhte Bildung von stärker gruppierten Zellkolonien zeigen. Bei anderen Zelltypen wurde gezeigt, dass DMSO-induzierte G1-Abnahme mit einer erhöhten Expression von Proteinen in Verbindung gebracht wird, die an Zell-Zell-Wechselwirkungen beteiligt sind, die kontakthemmungsinduzierte Wachstumsstillstandunterstützen 36. In iPSCs, die als 3D-Zellkugeln beibehalten werden, erhöhte die DMSO-Behandlung in ähnlicher Weise die Anzahl der Zellkugeln (Abbildung 1B). Darüber hinaus führte die DMSO-Behandlung auch zu weniger variablen 3D-Kugelgrößen, was sich bisher als Hinweis auf eine verbesserte Differenzierungskapazität der Zellen37erwiesen hat. Wichtig ist, dass weder 1% oder 2% DMSO zu einer Zelltoxizität führten, gemessen an den Lebensfähigkeitszahlen (n = 3; 2D-Kultur % Lebend = Kontrolle: 80 x 1,3; 1 % DMSO: 82 x 3,7, 2 %: 81 x 2,7; 3D-Kultur % Leben = Kontrolle: 81 x 4,3; 1 % DMSO: 82 , 6,7, 2 %: 82 , 2,7). Insgesamt stimmen diese Ergebnisse mit der Vorstellung überein, dass die DMSO-Behandlung den Zellzyklus und die Wachstumsmuster in kultivierten Stammzellen verändert. Diese Auswirkungen auf die Wachstumshemmung sind reversibel, wenn das DMSO aus dem Medium entfernt wird, wie zuvor gezeigt3.
DMSO-Behandlung verbessert die Differenzierung von ESCs zu den primären Keimschichten
HUES6 hESCs wurden auf beschichteten Platten für 24 h gesät, gefolgt von einer Behandlung mit 2% DMSO für 24 h im Wartungsmedium. Die Zellen wurden dann nach den in Abbildung 2 A30,31,32dargestellten Behandlungsparadigmen in die drei primären Keimschichten differenziert. Differenzierte Zellen wurden dann für prototypische Marker jeder einzelnen Keimschicht fixiert und immunologisch gefärbt (SOX17 für Endoderm, Brachyury für Mesoderm und SOX1 für Ektoderm). Wie in Abbildung 2Bdargestellt, erhöhten 24 h Vorbehandlung mit 2% DMSO den Anteil der Zellen, die jeweils den jeweiligen Keimschichtmarker exdrücken. Dies steht im Einklang mit früheren Berichten aus unserem Labor, die eine erhöhte Immunreaktivität, Genexpression sowie eine absolute Anzahl differenzierter Zellen zu allen Keimschichten in mit DMSO3,5behandelten Stammzellen zeigen. HUES6 ist eine hESC-Linie mit sehr geringer Neigung zur Differenzierung über alle Linien1hinweg , aber die DMSO-Behandlung verbessert ihre Fähigkeit, sich über alle Keimschichten hinweg zu differenzieren, erheblich.
DMSO-Behandlung verbessert die Differenzierung zu Vorläuferzelltypen
Um die Wirkung von DMSO auf die Differenzierung zu ZNS-Vorläuferzelltypen zu untersuchen, wurden menschliche iPSCs entweder zu neuronalen Vorläuferzellen (NPCs) oder Oligodendrozyten-Vorläuferzellen (OPCs) differenziert. Um NPCs zu erzeugen, wurden die Zellen mit 2% DMSO für 24 h im Wartungsmedium vorbehandelt, gefolgt von 12 Tagen gerichteter Differenzierung33 (Abbildung 3A). Wie in Abbildung 3Bdargestellt, erhöhte die 2% DMSO-Vorbehandlung die Expression des NPC-Markers PAX6 im Vergleich zur Kontrolle. Unter Verwendung eines anderen zuvor validierten Protokolls34 (Abbildung 3C) wurden iPSCs 12 Tage lang in OPCs differenziert. Ähnlich wie bei NPCs zeigten OPCs, die von iPSCs abgeleitet wurden, die mit 2% DMSO für 24 h vorbehandelt wurden, einen Anstieg des Anteils der Zellen, die OPC-Marker OLIG2 exdrücken (Abbildung 3D).
Eine erste DMSO-Behandlung bleibt bestehen, um die Differenzierung in ausgereifte Zelltypen zu verbessern
Um die Wirkung von DMSO auf die letzten Stadien eines Differenzierungsprotokolls zu untersuchen, wurden HUES8-HEsCs für 24 h mit 2% DMSO vorderweise mit einer Differenzierung zu 35. HUES8 wurden verwendet, da sie zuvor eine höhere Neigung zur endodermalen Linie1,38haben. Im definitiven Endoderm-Stadium exprimieren die differenzierten Zellen SOX17 und FOXA2, definitive Endoderm(DE) spezifische Marker. Mit weiterer Differenzierung in die Pankreasvorläuferstufe (PP1) exprimieren differenzierte Zellen PDX1 und FOXA2, Marker, die für Pankreasvorläuferzellen charakteristisch sind. In diesen Stadien der Pankreaszelldifferenzierung waren die Effizienzen der Induktion in DE und anschließend in PP1 sowohl für die Kontrolle als auch für DIE DMSO-behandelten hESCs, die in jede dieser Stadien differenziert waren (Abbildung4B, Stufen 1 und 3). Obwohl die HUES8-Zelllinie eine erhöhte Neigung zur Differenzierung in die endodermale Abstammung festgestellt hat, da die Differenzierung weiter in die spezialisierteren Zelltypen in den Endstufen induziert wird, sind die DMSO-behandelten hESCs viel mehr wahrscheinlich reife endokrine Pankreaszellen produzieren. Die Effizienz der Erzeugung von PDX1/NKX6.1+ Pankreasvorläuferzellen, Neurogenin 3+ endokrinen Zellen und NKX6.1/C-Peptid+ SC-B-Zellen war in den DMSO-behandelten hESCs wesentlich höher (Abbildung4B, Stufen 4 und 5). Diese Ergebnisse stehen im Einklang mit der NPC- und OPC-Differenzierung, die zeigt, dass DMSO das Differenzierungspotenzial zu Vorläuferzelltypen erhöht und auch zeigt, dass die Wirkung von DMSO bei der Erzeugung spezialisierterer Zelltypen anhaltend ist. Dies stimmt mit früheren Arbeiten überein, bei denen wir gezeigt haben, dass die anfängliche 24-h-DMSO-Behandlung die Differenzierung in terminale Zelltypen über Keimschichten hinweg erhöht, einschließlich in neuronale Zellen sowie gegen Kardiomyozyten31,39 in Zelllinien mit hohen oder schlechten Neigungen zur Differenzierung3.
Erste DMSO-Behandlung verbessert hESC-abgeleitete Zellfunktion nach In-vivo-Transplantation
Zuvor haben wir die Wirksamkeit der DMSO-Behandlung bei der Verbesserung der Differenzierung von hESCs in funktionelle Pankreasvorläuferzellen nachgewiesen, die später eine deutliche Verbesserung der Insulinsekretion in vivo3zeigen. Mit den zuvor veröffentlichten Protokollen3,30,40, huES8 hESCs wurden mit 1% DMSO für 24 h behandelt, in Bauchspeicheldrüsen-Vorläuferzellen differenziert und in immundefizierte SCID-Beige-Mäuse transplantiert, um (z. B. Insulinsekretion als Reaktion auf eine Glukose-Herausforderung oder KCl-Stimulation) (Abbildung 5A). Während die Effizienz der Differenzierung in FOXA2+ (90%) und PDX1+ (ca. 75%) Pankreasvorläufer waren vergleichbar zwischen Kontroll- und DMSO-behandelten hESCs (Abbildung 5B) für die HUES8 hESC-Linie, die Zellen, die nach einer 24 h 1% DMSO-Behandlung von hESCs unterschieden, hatten eine verbesserte Reaktionsfähigkeit auf Glukose und KCl Stimulation nach In-vivo-Transplantation. Verbesserungen in der Funktionalität waren innerhalb von 2 Wochen nach der Transplantation offensichtlich (Abbildung5C) und dauerten bis zu mindestens 16 Wochen nach der Transplantation (Abbildung 5D). Zusammengenommen deuten diese Ergebnisse darauf hin, dass die DMSO-Vorbehandlung nicht nur die Differenzierungseffizienz von Keimschichten, Vorläuferzellen und reiferen Zelltypen erhöht, sondern auch, dass sie die Funktionalität der differenzierten Zellen in vivo verbessert.
| Differenzierter Zelltyp | Zellentyp starten | %DMSO | Dauer der DMSO-Behandlung | Dauer der DMSO-Behandlung |
| Leberzellen | Esc Hepatom-Zelllinie Esc Esc Mesenchymale Stammzellen iPSCs Esc Esc Hepatom-Zelllinie Esc | 1,0 1,0 1,0 0,5 0,1-2,0 1,0 1,0 0,5 1,0 0,6 | 8 Tage Mehrere Tage 7 Tage 10-14 Tage 7-21 Tage 7 Tage 4 Tage 5 Tage 2-21 Tage überall | Basma et al., 2008 Kanebratt und Andersson, 2008 Hay et al., 2009 Duan et al., 2010 Alizadeh et al., 2014 Kondo et al., 2014 Szkolnicka et al., 2014 Czysz et al., 2015 Nikolaou et al., 2016 Vanhove et al., 2016 |
| Primäre Keimschichten | ESCs und iPSCs hESC hESC | 0,1-2,0 0,5 0,1-2,0 | 24 Stunden 24 Stunden 24 Stunden | Chetty et al., 2013 Chetty et al., 2015 Li et al., 2018 |
| Herzzellen | ESCs und iPSCs P19-Zellen ESCs und iPSCs Fetale mesenchymale Stammzellen | 0,1-2,0 1,0 1,0-2,0 0,8-1,0 | 24 Stunden 4 Tage 24-30 Stunden 24 Stunden | Chetty et al., 2013 Choi et al., 2014 van den Berg et al., 2016 Deng et al., 2017 |
| Pankreaszellen | ESCs und iPSCs hESC | 0,1-2,0 0,5 | 24 Stunden 24 Stunden | Chetty et al., 2013 Chetty et al., 2015 |
| Glatte Muskelzellen | P19-Zellen | 1,0 | 4 Tage | Choi et al., 2014 |
| Endothelzellen | P19-Zellen | 1,0 | 4 Tage | Choi et al., 2014 |
| Enterozyten | iPSCs | 0-1,6 | 4 Tage | Ogaki et al., 2015 |
| Gut-Epithel | iPSCs | 0-1,6 | 4 Tage | Ogaki et al., 2015 |
| Neuralzellen | Marmoset iPSC | 0,05-2,0 | 24 Stunden | Qiu et al., 2015 |
| Neutrophilen | Leukämie-Zelllinie | 1.25 | 6-8 Tage | Teimourian und Moghanloo, 2016 |
| Skelett-Myotuben | iPSCs | 1.5 | 24 Stunden | Swartz et al., 2016 |
| Kortikalorganoid | hiPSCs | 1,0 | 24 Stunden | Yoon et al., 2018 |
Tabelle 1: Zusammenfassung der zuvor veröffentlichten Arbeiten, die die positiven Auswirkungen der DMSO-Behandlung auf die Differenzierung belegen.
| S1 | S2 | S3 | S5 | |
| MCDB131 (L) | 1 | 1 | 1 | 1 |
| Glukose (g) | 0,44 | 0,44 | 0,44 | 3.6 |
| NaHCO3 (g) | 2,46 | 1.23 | 1.23 | 1.754 |
| FAF-BSA (g) | 20 | 20 | 20 | 20 |
| ITS-X (mL) | 0,02 | 0,02 | 5 | 5 |
| Glutamax (ml) | 10 | 10 | 10 | 10 |
| Vitamin C (mg) | 44 | 44 | 44 | 44 |
| Heparin (mg) | 0 | 0 | 0 | 10 |
| P/S (mL) | 10 | 10 | 10 | 10 |
Tabelle 2: Komponenten der endokrine Vorläuferzelldifferenzierung Basismedien.
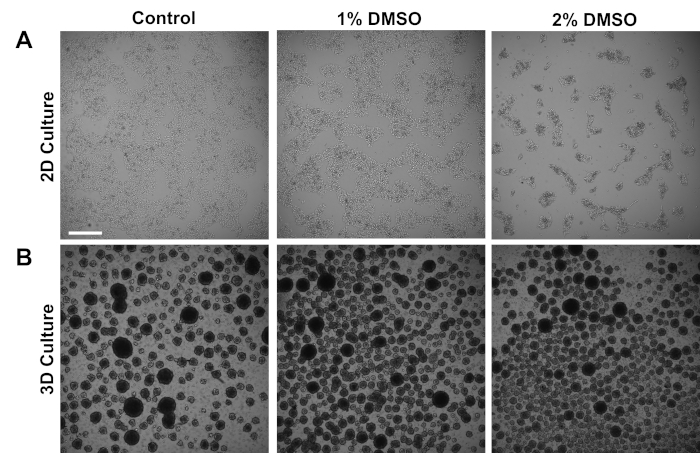
Abbildung 1 : Die DMSO-Behandlung verändert das Wachstum von hPSCs. (A) Repräsentative Hellfeldbilder von HiPSC, die in einer Monoschicht plattiert sind, nachdem sie keine Behandlung (Kontrolle) oder Behandlung mit 1% oder 2% DMSO für 24 h erhalten haben. DMSO fördert eine vorübergehende dosisabhängige wachstumsabhängige Hemmung von iPSCs. (B) Repräsentative Hellfeldbilder von HiPSC, die auf Platten mit geringer Befestigung senkgut verzinnt sind, um die 3D-Kugelbildung nach Erhalt keiner Behandlung (Kontrolle) oder Behandlung mit 1% oder 2% DMSO für 24 h zu ermöglichen. DMSO-Behandlung führt zu einer weniger variablen 3D-Kugelbildung im Vergleich zur Kontrolle. Maßstabsleiste = 500 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
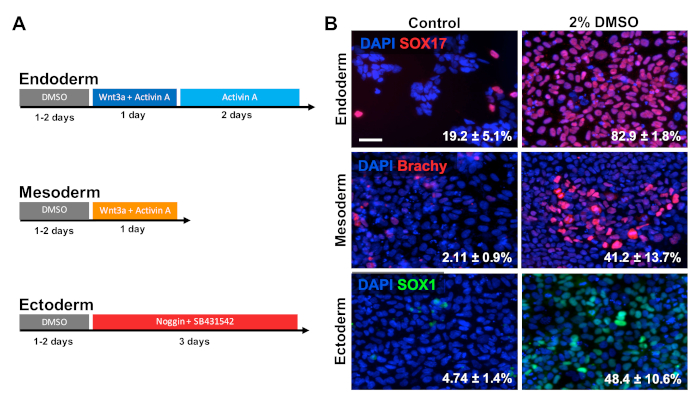
Abbildung 2 : Die DMSO-Behandlung verbessert die Differenzierung von hPSCs zu primären Keimschichten. (A) Schematische Differenzierungsprotokolle zur Erzeugung der drei primären Keimschichten. (B) Repräsentative Bilder von differenzierten HUES6-HESCs, die für SOX17 (Endoderm), Brachyury (Mesoderm) und SOX1 (Ektoderm) immunobrandmarkiert sind. Die Vorbehandlung mit 2% DMSO für 24 h erhöhte die Differenzierungseffizienz über alle drei Keimschichten hinweg. Prozentsätze der Zellen, die sich in SOX17+ endodermal, Brachyury (Brachy)+ mesodermale oder SOX1+ ektodermale Zellen nach gezielter Differenzierung in jede Keimschicht der Kontrolle und DMSO-behandelte hESCs unterscheiden, werden mit SEM von drei biologischen Replikationen . Ungepaarter t-Test: endoderm p = 0.0003; mesoderm p = 0,047; ektoderm p = 0,015. Maßstabsleiste = 50 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
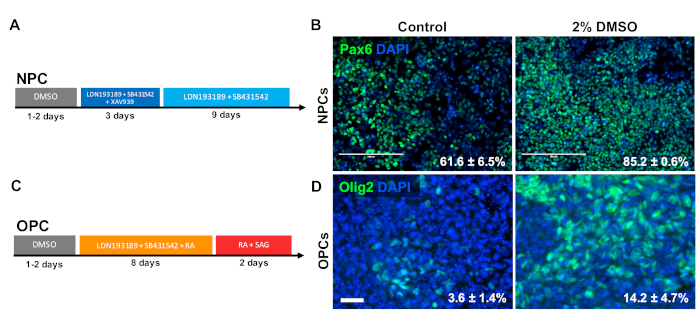
Abbildung 3 : DmSO-Behandlung verbessert die Differenzierung zu neuronalen Vorläuferzelltypen. (A) Schematic des Differenzierungsprotokolls zur Erzeugung neuronaler Vorläuferzellen (NPCs). (B) Repräsentative Bilder menschlicher iPSCs, die in NPCs differenziert sind, die mit dem Immunolabel für Pax6 gekennzeichnet sind. 24 h Vorbehandlung mit 2% DMSO erhöhte die Anzahl PAX6-positive Zellen. Prozentsätze der Zellen, die sich nach gezielter Differenzierung der Kontrolle und DMSO-behandelten humanen iPSCs in Pax6+-NPCs differenzieren, werden mit SEM von drei biologischen Replikationen festgestellt. Unpaired t-Test: p = 0.0225. Skala bar = 200 m. (C) Schematic des Differenzierungsprotokolls zur Erzeugung von Oligodendrozyten-Vorläuferzellen (OPCs). (D) Repräsentative Bilder menschlicher iPSCs, die in OPCs differenziert sind, die für OPC-Marker Olig2 immunolabeliert sind. 24 h der Vorbehandlung mit 2% DMSO erhöhte die Expression beider OPC-Marker im Vergleich zur Kontrolle. Der Anteil der Zellen, die sich nach gezielter Differenzierung der Kontrolle und DMSO-behandelten humanen iPSCs in Olig2+ OPCs differenzieren, wird mit SEM von vier biologischen Replikationen festgestellt. Unpaired t-Test: p = 0.0466. Maßstabsleiste = 50 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
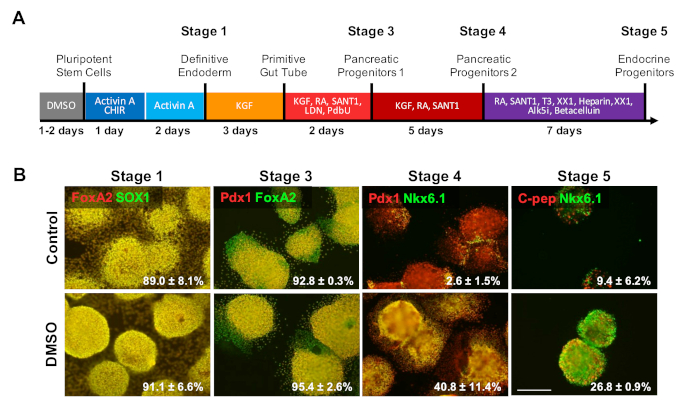
Abbildung 4 : DMSO-Behandlung verbessert das terminale Differenzierungspotenzial von hPSCs. (A) Schemat einer 20-Tage-gesteuerten Differenzierung von HUES8-HESCs in endlos differenzierte endknirschende endokrine Zellen der Bauchspeicheldrüse. (B) Immunostainierung für die angegebenen Marker in jeder Phase der Differenzierung nach gezielter Differenzierung von unbehandelten Kontrollzellen und Zellen, die mit 2% DMSO für 24 h vorbehandelt wurden. Die anfängliche DMSO-Behandlung bleibt bestehen, um die Differenzierung in terminale endokrine Zelltypen in den letzten Stadien der gerichteten Differenzierung zu erhöhen. Der Prozentsatz der Zellen, die in jeder Differenzierungsphase nach gezielter Differenzierung der Kontrolle und DMSO-behandelten hESCs in die angegebenen Marker differenziert sind, wird mit SEM von zwei bis vier biologischen Replikationen festgestellt. Maßstabsleiste = 200 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
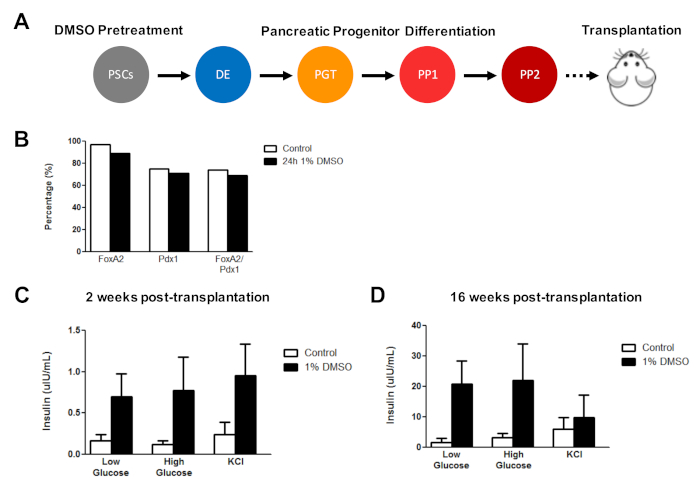
Abbildung 5 : Die anfängliche DMSO-Behandlung von hPSCs verbessert die Glukose-Reaktionsfähigkeit nach der Transplantation von Bauchspeicheldrüsen-Vorläuferzellen in vivo. (A) Schematische schematische Differenzierung (ca. 15 Tage) von HUES8 hESCs in Bauchspeicheldrüsenvorläuferzellen (PP2) nach keiner Behandlung (Kontrolle) oder einer 24 h 1% DMSO-Behandlung und anschließender Transplantation (5 Millionen Zellen) in immundefiziente SCID-Beige-Mäuse. (B) Prozentsatz der Zellen, die sich unmittelbar vor der Transplantation in PDX1+ und FOXA2+ Pankreasvorläuferzellen nach in vitro gerichteter Differenzierung der Kontrolle und DMSO-behandelten hESCs differenzieren (n = 1). (C) Durchschnittliche ELISA-Messungen von Humaninsulin aus dem Serum von Mäusen nach einer niedrigen (2,5 mM) oder hohen (15 mM) Glukose-Herausforderung oder Kaliumchlorid (KCl) Stimulation bei (C) 2 Wochen und (D) 16 Wochen nach der Transplantation der Bauchspeicheldrüse Progenitorzellen unterschieden sich von Kontroll- und DMSO-behandelten hESCs (Fehlerbalken = SEM; n = 3 nach 2 Wochen und 16 Wochen für die Kontrolle; n = 2 bei 2 Wochen und 16 Wochen für DMSO). Zwei-Wege-ANOVA: p = 0,0051 für DieSteuerung vs. DMSO nach 2 Wochen; p = 0,0116 für die Steuerung vs. DMSO nach 16 Wochen. Die zu den verschiedenen Zeitpunkten untersuchten Mäuse sind unterschiedlich. Die Ergebnisse sind von Chetty et al.3angepasst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Zusammenfassend beschreibt dieses Protokoll ein einfaches und kostengünstiges Werkzeug zur Verbesserung der Differenzierungskapazität von pluripotenten Stammzellen (PSCs) zu allen primären Keimschichten, verschiedenen Arten spezialisierter Vorläuferzellen und sogar funktionellen, ausgereiften Zelltypen in in vitro. und in vivo-Einstellungen. Illustriert sind spezifische Differenzierungsprotokolle, die sowohl in unserem Labor als auch in anderen effektiv reproduziert wurden, aber jedes Differenzierungsprotokoll nach der DMSO-Behandlung verwendet werden kann. Wie in Tabelle 1dargestellt, haben eine Reihe von Laboratorien auch eine Verbesserung der PSC-Differenzierung nach vorübergehender DMSO-Behandlung unter Verwendung verschiedener Paradigmen zur Generierung verschiedener anderer Terminalzelltypen gezeigt. Obwohl die hier beschriebenen Methoden die Verwendung menschlicher PSCs beschreiben, kann die DMSO-Vorbehandlung artübergreifend eingesetzt werden und hat sich bei Maus-, Kaninchen- und Primaten-PSCs als wirksam erwiesen.
Obwohl höhere Dosen von DMSO bekannt ermaßen zytotoxisch sind, sind die niedrigen Dosen, die bei dieser Methode verwendet werden (1%-2%) für einen vorübergehenden Zeitraum zu einem minimalen Zelltod führen. Während die Gesamtzellzahlen unmittelbar nach der DMSO-Behandlung aufgrund der DMSO-Förderung des Zellzyklusstillstands in der G1-Phase des Zellzyklus abnehmen können, zeigen frühere Studien, dass Zellen in der Lage sind, das gleiche Maß an Konfluenz wie Kontrollkulturen nach Entfernung von DMSO3.
Der Prozentsatz und die Dauer der DMSO-Vorbehandlung sollten pro Zelllinie optimiert werden. Die Behandlungszeit sollte unter Berücksichtigung der Zyklus-/Verdoppelungszeit der Zellen angepasst werden. Beispielsweise haben Maus-PSCs in der Regel viel kürzere Zykluszeiten von etwa 15 h; daher ist eine DMSO-Behandlung für 15 h für diese Zellen ausreichend. Einige Labore haben auch festgestellt, dass die DMSO-Behandlung vorteilhaft ist, wenn sie während des Differenzierungsprotokolls oder in niedrigeren Konzentrationen fortgesetzt wird (siehe Tabelle 1). Es sei darauf hingewiesen, dass einige PSC-Linien besser für die Differenzierung nach bestimmten Linien geändert werden können. Zum Beispiel haben sich HUES6-Zellen als weniger differenziell erwiesen und hatten daher eine deutliche Verbesserung mit der DMSO-Behandlung (Abbildung 2). Alternativ haben HUES8-Zellen, die in Abbildung 4 und Abbildung 5 verwendet werden, eine höhere Neigung zur endodermalen Differenzierung; daher wurden in den Anfangsphasen weniger Unterschiede zwischen Kontrolle und DMSO zur Differenzierung in Richtung endgültiger Endoderm festgestellt. Nichtsdestotrotz wird die Verbesserung der DMSO-Vorbehandlung in späteren Stadien der Differenzierung in dieser Zelllinie beobachtet (Abbildung 4B). Die DMSO-Behandlung ist auch vielseitig, da sie sowohl in 2D- als auch in 3D-Zellkulturen wirksam ist, sie kann mit verschiedenen Arten von Beschichtungsmaterial auf Zellkulturplatten verwendet werden, und sie arbeitet in verschiedenen Arten von Wartungsmedien, die das Wachstum und die Expansion von hPSCs (z. B. mTeSR, E8, MEF-konditionierte Medien usw.).
Allgemeiner betrachtet deuten diese Ergebnisse darauf hin, dass der Ausgangszustand pluripotenter Stammzellen einen starken Einfluss auf die Neigung zur anfänglichen Differenzierung sowie zur terminalen Differenzierung in funktionelle Zelltypen hat. Wir haben bereits gezeigt, dass die DMSO-Behandlung durch Rb in hPSCs3,5funktioniert. Rb spielt eine wichtige Rolle bei der Förderung der terminalen Differenzierung, des Zellüberlebens und der genetischen Stabilität der Zellen41,42,43,44, und es kann daher die anhaltenden Auswirkungen auf Zellen erklären dmSO-behandelten hPSCs unterschieden. Die Ausrichtung auf diese frühen Regulierungsweisen kann hPSCs auf einen besseren Weg zur Differenzierung bringen und letztlich ihren Nutzen für die regenerative Medizin verbessern.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch Stipendien der Stanford University School of Medicine und ein Siebel Fellowship an S. C. unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 21985023 | |
| 6-well Clear Flat Bottom TC-treated Multiwell Cell Culture Plate | Corning | 353046 | |
| 9-Position stir plate | Chemglass | CLS-4100 | |
| Accutase | Gibco | 11105-01 | |
| Activin A | R&D Systems | 338-AC | |
| Advanced RPMI | Gibco | 12633012 | |
| Alk5i II | Axxora | ALX-270-445 | |
| all-trans retinoic acid | Sigma-Aldrich | R2625 | |
| anti-Brachyury | R&D Systems | AF2085 | No variablity observed across different lot numbers |
| anti-C-peptide | Developmental Studies Hybridoma Bank | GN-ID4 | No variablity observed across different lot numbers |
| anti-FoxA2 | Millipore | 07-633 | No variablity observed across different lot numbers |
| anti-Nkx2.2 | University of Iowa, Developmental Hybridoma Bank | 74.5A5 | No variablity observed across different lot numbers |
| anti-Nkx6.1 | University of Iowa, Developmental Hybridoma Bank; | F55A12-supernatant | No variablity observed across different lot numbers |
| anti-Olig2 | EMD Millipore | MABN50 | No variablity observed across different lot numbers |
| anti-Pax-6 | Biolegend | 901301 | No variablity observed across different lot numbers |
| anti-Pdx1 | R&D Systems | AF2419 | No variablity observed across different lot numbers |
| anti-SOX1 | R&D Systems | AF3369 | No variablity observed across different lot numbers |
| anti-SOX17 | R&D Systems | AF1924 | No variablity observed across different lot numbers |
| B-27 Supplement, minus Vitamin A | Gibco | 12587010 | |
| basic fibroblast growth factor | Gibco | PHG0264 | |
| Betacellulin | Thermo Fisher Scientific | 50932345 | |
| Chir99021 | Stemgent | 04-000-10 | |
| CMRL 1066 | Corning | 99-603-CV | |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAF1000 | |
| D-(+)-Glucose | Sigma | G7528 | |
| DAPI | Invitrogen | D1306 | |
| Disposable Spinner Flasks | Corning, VWR | 89089-814 | |
| DMEM/F-12 | Gibco | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Essential 6 Media | Gibco | A1516501 | |
| FAF-BSA | Proliant | 68700 | |
| FGF7 | PeproTech | 100-19 | |
| Geltrex | Gibco | A1413202 | |
| GlutaMAX | Gibco | 35050061 | |
| Heparin | Sigma | H3149 | |
| Human Ultrasensitive Insulin ELISA | ALPCO Diagnostics | 80-INSHUU-E01.1 | |
| ITS-X | Invitrogen | 51500056 | |
| KGF | Peprotech | AF-100-19 | |
| Knockout DMEM | Gibco | 10829018 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| L-3,3′,5-Triiodothyronine (T3) | EMD Millipore | 642245 | |
| LDN193189 | Stemgent | 04-0074 | |
| Matrigel Matrix | Corning | 354277 | |
| MCDB-131 | Cellgro | 15-100-CV | |
| MEM NEAA | Gibco | 11140050 | |
| mTeSR 1 | StemCell Technologies | 5850 | |
| N2 Supplement | Life Technologies | 17502048 | |
| NaHCO3 | Sigma | S3817 | |
| Noggin Fc Chimera Protein | R&D Systems | 3344-NG-050 | |
| PdBU | EMD Millipore | 524390 | |
| Penicillin/Streptomycin | Mediatech | 30-002-CI | |
| RPMI | Gibco | 11875-093 | |
| Sant1 | Sigma-Aldrich | S4572 | |
| SB431542 | Stemgent | 04-0010 | |
| Smoothened Agonist, SAG | EMD Millipore | 566660 | |
| StemPro Accutase | Gibco | A1110501 | |
| TrypLE | Gibco | 12604013 | |
| Ultra-Low Attachment Microplates | Corning | 3471 | |
| Vitamin C | Sigma-Aldrich | A4544 | |
| Wnt3a | R&D Systems | 5036-WN | |
| XAV 939 | Tocris | 3748 | |
| XXI | EMD Millipore | 565790 | |
| Y-27632 | StemCell Technologies | 72302 |
Referenzen
- Osafune, K., et al. Marked differences in differentiation propensity among human embryonic stem cell lines. Nature Biotechnology. 26 (3), 313-315 (2008).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Review Genetics. 15 (2), 82-92 (2014).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Conklin, J. F., Sage, J. Keeping an eye on retinoblastoma control of human embryonic stem cells. Journal of Cellular Biochemistry. 108 (5), 1023-1030 (2009).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110 (2018).
- Hartwell, L. H., Weinert, T. A. Checkpoints: controls that ensure the order of cell cycle events. Science. 246 (4930), 629-634 (1989).
- Pardee, A. B. G1 events and regulation of cell proliferation. Science. 246 (4930), 603-608 (1989).
- Orford, K. W., Scadden, D. T. Deconstructing stem cell self-renewal: genetic insights into cell-cycle regulation. Nature Review Genetics. 9 (2), 115-128 (2008).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453 (7194), 519-523 (2008).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells. 26 (4), 894-902 (2008).
- Duan, Y., et al. Differentiation and characterization of metabolically functioning hepatocytes from human embryonic stem cells. Stem Cells. 28 (4), 674-686 (2010).
- Szkolnicka, D., Farnworth, S. L., Lucendo-Villarin, B., Hay, D. C. Deriving functional hepatocytes from pluripotent stem cells. Current Protocols in Stem Cell Biology. 30, 1-12 (2014).
- Vanhove, J., et al. H3K27me3 Does Not Orchestrate the Expression of Lineage-Specific Markers in hESC-Derived Hepatocytes In Vitro. Stem Cell Reports. 7 (2), 192-206 (2016).
- Kanebratt, K. P., Andersson, T. B. Evaluation of HepaRG cells as an in vitro model for human drug metabolism studies. Drug Metabolism & Disposition. 36 (7), 1444-1452 (2008).
- Nikolaou, N., Green, C. J., Gunn, P. J., Hodson, L., Tomlinson, J. W. Optimizing human hepatocyte models for metabolic phenotype and function: effects of treatment with dimethyl sulfoxide (DMSO). Physiological Reports. 4 (21), (2016).
- Kondo, Y., et al. An efficient method for differentiation of human induced pluripotent stem cells into hepatocyte-like cells retaining drug metabolizing activity. Drug Metabolism Pharmacokinetics. 29 (3), 237-243 (2014).
- Alizadeh, E., et al. The effect of dimethyl sulfoxide on hepatic differentiation of mesenchymal stem cells. Artificial Cells, Nanomedicine, and Biotechnology. 44 (1), 157-164 (2016).
- Czysz, K., Minger, S., Thomas, N. DMSO efficiently down regulates pluripotency genes in human embryonic stem cells during definitive endoderm derivation and increases the proficiency of hepatic differentiation. PLoS One. 10 (2), 0117689 (2015).
- Ogaki, S., Morooka, M., Otera, K., Kume, S. A cost-effective system for differentiation of intestinal epithelium from human induced pluripotent stem cells. Scientific Reports. 5, 17297 (2015).
- Choi, S. C., et al. Mixl1 and Flk1 Are Key Players of Wnt/TGF-beta Signaling During DMSO-Induced Mesodermal Specification in P19 cells. Journal of Cellular Physiology. 230 (8), 1807-1821 (2015).
- Chetty, S., et al. A Src inhibitor regulates the cell cycle of human pluripotent stem cells and improves directed differentiation. Journal of Cell Biology. 210 (7), 1257-1268 (2015).
- Qiu, Z., et al. Marmoset induced pluripotent stem cells: Robust neural differentiation following pretreatment with dimethyl sulfoxide. Stem Cell Research. 15 (1), 141-150 (2015).
- Swartz, E. W., et al. A Novel Protocol for Directed Differentiation of C9orf72-Associated Human Induced Pluripotent Stem Cells Into Contractile Skeletal Myotubes. Stem Cells Translational Medicine. 5 (11), 1461-1472 (2016).
- Teimourian, S., Moghanloo, E. Thwarting PTEN Expression by siRNA Augments HL-60 Cell Differentiation to Neutrophil-Like Cells by DMSO and ATRA. DNA Cell Biology. 35 (10), 591-598 (2016).
- van den Berg, C. W., Elliott, D. A., Braam, S. R., Mummery, C. L., Davis, R. P. Differentiation of Human Pluripotent Stem Cells to Cardiomyocytes Under Defined Conditions. Methods in Molecular Biology. 1353, 163-180 (2016).
- Deng, F., et al. Combination of retinoic acid, dimethyl sulfoxide and 5-azacytidine promotes cardiac differentiation of human fetal liver-derived mesenchymal stem cells. Cell Tissue Bank. 17 (1), 147-159 (2016).
- Yoon, S. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2018).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637 (2018).
- Kroon, E., et al. Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo. Nature Biotechnology. 26 (4), 443-452 (2008).
- Zhang, P., et al. Short-term BMP-4 treatment initiates mesoderm induction in human embryonic stem cells. Blood. 111 (4), 1933-1941 (2008).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Tchieu, J., et al. A Modular Platform for Differentiation of Human PSCs into All Major Ectodermal Lineages. Cell Stem Cell. 21 (3), 399-410 (2017).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Fiore, M., Degrassi, F. Dimethyl sulfoxide restores contact inhibition-induced growth arrest and inhibits cell density-dependent apoptosis in hamster cells. Experimental Cell Research. 251 (1), 102-110 (1999).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Bock, C., et al. Reference Maps of human ES and iPS cell variation enable high-throughput characterization of pluripotent cell lines. Cell. 144 (3), 439-452 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- D'Amour, K. A., et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nature Biotechnology. 24 (11), 1392-1401 (2006).
- Jacks, T., et al. Effects of an Rb mutation in the mouse. Nature. 359 (6393), 295-300 (1992).
- Nguyen, D. X., Baglia, L. A., Huang, S. M., Baker, C. M., McCance, D. J. Acetylation regulates the differentiation-specific functions of the retinoblastoma protein. The EMBO Journal. 23 (7), 1609-1618 (2004).
- Slack, R. S., et al. Cells differentiating into neuroectoderm undergo apoptosis in the absence of functional retinoblastoma family proteins. Journal of Cell Biology. 129 (3), 779-788 (1995).
- Gu, W., et al. Interaction of myogenic factors and the retinoblastoma protein mediates muscle cell commitment and differentiation. Cell. 72 (3), 309-324 (1993).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten