Method Article
분화를 촉진하기 위해 DMSO를 사용하여 인간 다능성 줄기 세포의 일시적인 치료
요약
인간 다능성 줄기 세포 (hPSCs)에서 분화 된 세포 유형을 생성하는 것은 훌륭한 치료 약속을 보유하고 있지만 여전히 도전적입니다. PSC는 종종 적절한 신호 세트로 자극된 경우에도 차별화할 수 없는 고유한 무능력을 나타냅니다. 여기에 설명된 간단한 도구는 다양한 PSC 라인에서 다중 라인 차별화를 향상시키는 간단한 도구입니다.
초록
다능성 줄기 세포 (PSCs)의 증가 사용에도 불구하고, 다양한 계보에 걸쳐 배아 및 유도 만능 줄기 세포 (ESCs 및 iPSCs)를 효율적으로 분화시키는 도전이 남아 있습니다. 수많은 분화 프로토콜이 개발되었지만 세포주 전반에 걸친 가변성과 분화율이 낮기 때문에 이러한 프로토콜을 성공적으로 구현하는 데 어려움을 겪습니다. 여기서 설명한 것은 PSC의 분화 능력을 향상시키기 위한 쉽고 저렴한 수단이다. 이전에는 디메틸 설폭사이드(DMSO)의 낮은 농도를 가진 줄기 세포를 치료하면 지시된 분화에 따라 상이한 세포 유형으로 분화하는 다양한 PSCs의 성향이 현저히 증가하는 것으로 나타났다. 이 기술은 지금 다른 종에 걸쳐 효과적인 것으로 나타났습니다 (예를 들어, 마우스, 영장류, 그리고 인간) 여러 계보로, 신경 및 피질 구형에서 평활근 세포와 간세포에 이르기까지. DMSO 전처리는 세포 주기를 조절하고 줄기 세포를 차별화 신호에 보다 민감하게 반응하도록 프라이밍하여 PSC 분화를 향상시킵니다. 여기에 제공된 이 간단한 도구를 재현 가능하고 널리 적용할 수 있는 수단으로 사용하여 PSC를 선택한 모든 계보와 보다 효율적으로 차별화하는 방법에 대한 자세한 방법론이 제공됩니다.
서문
다능성 줄기 세포의 사용은 재생 의학 및 줄기 세포 기반 치료, 질병 모델링 및 약물 스크리닝의 분야를 포함하여 생물 의학 연구에서 수많은 발전을 이끌었습니다. 그것은 또한 더 번역 가능한 연구 및 개인화 한 의학의 전반적인 전망으로 이끌어 냈습니다. 20 년 전 유도 만능 줄기 세포 (iPSC) 기술의 출현은 연구원이 체세포조직에서 다능성 줄기 세포를 개발하고 기능성 세포 유형으로 분화하여 다양한 병리를 연구할 수 있게 했습니다. 심혈관, 신경학상 및 면역 학적 질환. 줄기 세포 분화 기술에서 중요한 진전이 있었지만, 인간 배아 줄기 세포 (hESCs)와 iPSCs를 효과적으로 분화시키는 과제는 여전히 지속되어 줄기 세포 기술의 광범위한 사용을 제한합니다. 연구 프로그램을 제공합니다. 상이한 세포주 및 클론에 대한 고유의 가변성은 줄기 세포주를원하는 보리 1로 분화시키는 데 걸림돌이 되고 있습니다. 또한 hPSC에서 성숙하고 말단으로 분화된 기능성 세포를 도출하는 것은 많은 계보에 걸쳐 지루하고 비효율적인 과정으로 남아 있습니다. 사실, hPSCs에서 분화된 세포는 종종 기능적세포 2로 말단으로 분화하지 못합니다. 환자에서 사용하는 줄기 세포 기반 치료법을 이동시키는 데있어, hPSCs에서 생성되는 세포의 효능을 개선하고 보장할 필요가 있다.
우리의 실험실은 iPSCs와 ESC를 성숙한 세포 유형으로 차별화하는 효율성을 크게 향상시키기 위해 빠르고 저렴한 도구를 설립했습니다. 우리는 일반적으로 사용되는 시약 디메틸 설폭사이드(DMSO)를 이용한 hiPSCs 및 hESCs의 전처리가 지시된 분화 이전에 24 시간 에서 48시간 동안 줄기 세포 분화 능력의 현저한 개선을 초래한다는 것을 발견하였다. DMSO를 이의로 한 치료는 세포 주기의 초기 G1 단계에서 hiPSCs 및 hESCs의 비율을 증가시키고 망막모세포종 단백질(Rb)3,세포 증식, 생존 및 분화의 중요한 조절제인4를활성화시킨다. 최근 작업에서 Rb와 그 가족 구성원이 DMSO의 비례 화 효과에 필요한 것으로 나타났습니다. DMSO의 효과5. 배아 발달 동안세포주기와 유사하게, ESCs 및 iPSCs의 세포 주기는 자가 재생을 촉진하는 축약된 G1 상을 특징으로 하며,7,8. 이 축약된 G1 단계는 더 무제한 확산을 허용하지만분화 4,9. G1에서 성장 체포를 촉진하고 hESCs 및 iPSCs의 세포 주기에서 체크포인트 제어를 활성화함으로써, DMSO 치료는 지시된 분화에 따른 세포 운명 변화에 대한 세포를 소수로 한다.
현재까지, DMSO 전처리는 30개 이상의 대조군 및 질병 특이적 인간 ESC 및 iPSC 세포주3,5뿐만 아니라 줄기세포 및 기타의 분화에서 3개의 배아층 모두에 대한 분화 능력을 향상시키는 것으로 나타났다. 후속 연구에서 다른 성숙한 세포 유형의 다양한 세포주10,11,12,13,14,15,16, 17세 , 18세 , 19세 , 20개 , 21세 , 22세 , 23세 , 24세 , 25개 , 26세 , 27세 , 28 (표1). 더욱이, DMSO 치료는 비인간 1차세포(21,23)의 분화를 향상시키는 데 효과적인 것으로 나타났다(예를 들어, 마우스, 영장류, 토끼), 종에 걸쳐 공유 된 메커니즘을 제안. 마지막으로, DMSO 전처리는 또한 유전자 편집 기술로 확장되었습니다, hESCs /iPSCs의 24 시간 DMSO 전처리가 크게 클러스터 된 정기적으로 간격 짧은 Palindromic 반복의 능력을 증가 것을 보여주는 한 특정 연구와 (CRISPR) /CRISPR-관련 단백질-9(Cas9)-의도하지 않은 돌연변이를 통합하지 않고 비코딩DNA의 편집 효율(29). 여기에 제공된 줄기 세포 생물학 및 지시된 분화에 있는 응용을 위한 hESCs 및 iPSCs의 DMSO 전처리의 상세한 방법론이다.
프로토콜
1. 줄기 세포 유지 보수
참고: 아래에 기술된 세포 유지 프로토콜은 부착단층에서 유지되는 pluipotent 줄기 세포(PSC)에 적용된다. DMSO 처리 전에 사용된 배지, 다른 시약 및 세포 배양 플레이트는 필요에 따라 조절될 수 있다. 이 원고의 모든 다음 프로토콜에 대해 세포는 생물학적 안전 캐비닛에서 처리되어야합니다.
- 코팅 멸균, 6 웰, 만능 줄기 세포 정규화 매트릭스 또는 기판을 가진 조직 배양 처리 플레이트는 제조자의 지시에 따라 제조되고CO2 인큐베이터(5% CO2, 습한 분위기)에서 적어도 1시간 동안 배양한다. 코팅된 플레이트는 최대 1주일 동안 4°C에서 필름을 감싸고 보관할 수 있다.
- 37°C 수조에서 냉동 보존 된 PSC를 해동하십시오. 생물학적 안전 캐비닛에 도입하기 전에 에탄올로 바이알을 살균한 다음, 5-10권의 미리 온난한 줄기 세포 매체를 함유한 멸균 원엽 튜브로 피펫팅하여 세포를 즉시 이송합니다.
- 실온(RT)에서 5분 동안 300 x g의 세포를 원심분리합니다.
- 용지를 흡인하고 Y-27632와 같은 10 μM ROCK 억제제와 함께 보충된 줄기 세포 매체의 1 mL에서 세포 펠릿을 부드럽게 재중단시켰다.
- 플레이트로부터 배양 매트릭스를 흡기하고 원하는 밀도로 세포를 종자, 전형적으로 0.5-1 x 106 세포당 적어도 2 mL의 줄기 세포 배지에서 웰당.
참고: 도금 밀도는 세포주마다 다를 수 있으며 클론은 그에 따라 최적화되어야 합니다. - 매일 미리 따뜻해진 줄기 세포 로 대체하여 세포를 유지합니다. 대략 70%-80% confluency에서 또는 세포 식민지가 접촉하기 시작할 때 세포를 분할합니다.
- 세포를 분할하는 경우, 매체를 흡인하고 멸균 된 PBS로 세포를 한 번 씻어. 37°C에서 5-10분 동안 잘 당 1 mL의 해리 효소 용액으로 세포를 배양한다.
- 미리 따뜻해진 줄기 세포 매체로 세포를 세척하고 다시 중단하고 5-10 권의 줄기 세포 매체가있는 멸균 원원관으로 옮김을 옮김. 1.3-1.7 단계를 수행하여 세포를 플레이트합니다.
2. DMSO 전처리
참고: DMSO 전처리를 위한 세포를 분화하기 전에 도금할 때, 시작 도금 세포 밀도는 사용되는 분화 프로토콜뿐만 아니라 줄기 세포줄의 전형적인 성장 속도를 고려하여 최적화되어야 한다. 필요에 따라 기존의 마커를 사용하여 다능성을 검증합니다. 세포는 분화 하기 전에 초기 해동 후 적어도 1x-2x 통과 되어야 한다.
-
2D 문화 차별화
- 세포가 적절한 합의에 도달하면 코팅 된 플레이트를 준비하고 세포를 해리시키고 전술한 바와 같이 단일 세포 현탁액을 준비하십시오.
- 트립판 블루 또는 다른 생존 능력 마커를 포함하는 혈세포계 또는 자동 세포 카운터를 사용하여 살아있는 세포를 계산한다.
- 세포를 10 μM ROCK 억제제와 함께 줄기 세포 매체에서 잘 당 0.5-1 x 106 세포에서 코팅된 6 웰 플레이트 상에 플레이트.
참고: 우리의 실험실에서 시험된 세포주를 위해, 이 밀도는 전형적으로 24 시간 DMSO 전처리 내의 80%-90% confluent 세포 귀착되었습니다. - 세포가 CO2 인큐베이터(5% CO2, 습한 대기)에서 37°C에서 24시간 동안 배양되도록 한다.
- 미리 온난화된 줄기 세포 매체에서 1%-2% DMSO를 준비합니다(예를 들어, 10 mL의 매체 = 1% DMSO 용액에서 DMSO의 100 μL, 또는 10 mL의 매체 = 2% DMSO 용액).
- 24 시간 배양 후, 세포에서 매체를 흡인하고 DMSO 용액으로 대체하십시오.
- 세포가 분화하기 전에 CO2 인큐베이터(5% CO2, 습한 대기)에서 37°C에서 24 시간 에서 48시간 동안 배양되도록 한다.
참고: 전형적으로, 24시간 DMSO 치료는 대부분의 인간 ESC 및 iPSC 라인에 걸쳐 충분하다. 매우 느린 성장 속도 (긴 두 배 시간)를 가진 세포주는 DMSO를 가진 48 시간 배양에서 유익할 수 있습니다. DMSO를 가진 48 시간 배양을 위해, 매체는 처리의 첫번째 24 시간 후에 1%-2% DMSO로 신선한 줄기 세포 매체로 대체될 수 있습니다.
-
3D 문화 차별화:
- 세포가 적절한 합류에 도달하면, 상기와 같이 세포 현탁액에서 세포를 해리하고 수집한다.
- 생존 마커를 포함하는 혈세포계 또는 자동 세포 카운터를 사용하여 살아있는 세포를 계산한다.
- 10 μM ROCK 억제제와 줄기 세포 매체에 잘 당 0.5-1 x 106 세포에서 코팅되지 않은, 낮은 부착 6 웰 플레이트에 세포를 플레이트.
참고: 우리의 실험실에서 시험된 세포주를 위해, 이 밀도는 전형적으로 설정 세포의 24 시간 안에 3D hPSC 구체 대형 귀착되었습니다. - 세포가 CO2 인큐베이터(5% CO2, 습한 대기)에서 37°C에서 24시간 동안 배양되도록 한다.
- 미리 온난화된 줄기 세포 매체에서 1%-2% DMSO를 준비합니다(예를 들어, 10 mL의 매체 = 1% DMSO 용액에서 DMSO의 100 μL, 또는 10 mL의 매체 = 2% DMSO 용액).
- 표준 절차에 따라 매체를 교체하십시오 (예 : 세포 구가 우물 의 바닥에 정착 할 수 있도록 30 ° - 45 ° 각도로 플레이트를 기울이십시오. 멸균 원음 튜브로 세포를 옮기고 세포 구가 튜브의 바닥에 정착하도록 허용하거나 부드럽게 세포를 수집하십시오 i n 서스펜션은 5 또는 10 mL 파이펫을 멸균 원점 튜브 및 원심 분리기 세포에 300 x g에서 RT에서 5 분 동안 사용한다).
- 셀에서 미디어를 흡인하고 부드럽게 파이펫팅, DMSO 솔루션으로 교체합니다.
- 세포가 분화하기 전에CO2 인큐베이터(5% CO2, 습한 대기)에서37°C에서 24 시간 에서 48시간 동안 배양되도록 한다.
참고: 전형적으로, 24시간 DMSO 치료는 대부분의 인간 ESC 및 iPSC 라인에 걸쳐 충분하다. 매우 느린 성장 속도 (긴 두 배 시간)를 가진 세포주는 DMSO를 가진 48 시간 배양에서 유익할 수 있습니다. DMSO를 가진 48 시간 배양을 위해, 매체는 처리의 첫번째 24 시간 후에 1%-2% DMSO로 신선한 줄기 세포 매체로 대체될 수 있습니다.
3. 1차 세균층으로의 분화
참고: 다음은 이전에 6 개의 웰 플레이트에 단층에서 자란 PSC에 대한 실험실에서 효과적인 것으로 나타난 방법에 대해 설명합니다. 선택의 모든 분화 프로토콜은 원하는 계보로 의 분화를 촉진하기 위해 DMSO 처리 후 사용되어야한다. 24-48시간 처리 후 DMSO 용액을 제거하고 표준 프로토콜에 따라 분화를 진행합니다.
-
내배 엽 분화 (크룬 외30에서적응)
- 2D 배양에 대해 전술한 바와 같이 DMSO를 가진 플레트리트는 세포를 갖는다.
- Wnt3a 및 액티브 인 A 주식 솔루션을 준비합니다.
- Wnt3a를 최종 농도 20 ng/mL 및 액티빈 A에 추가하여 1일째 내피 분화 매체를 준비하여 미리 온난화된 RPMI 매체의 적절한 부피에 100 ng/mL의 최종 농도를 가한다.
- DMSO 전처리 후, 세포로부터 의 매질 은 1일차 매체로 대체한다(예를 들어, 6웰 플레이트의 웰당 2 mL).
- 세포가 CO2 인큐베이터(5% CO2, 습한 대기)에서 37°C에서 24시간 동안 배양되도록 한다.
- 100 ng/mL의 최종 농도에 액티빈 A를 첨가하여 일 2 및 3 내피 분화 매체를 준비하여 미리 온난화된 RPMI 매체의 적절한 부피에.
- 세포로부터 의 매질 은 1일차(예를 들어, 6웰 플레이트의 웰당 2 mL)로 대체한다.
- 세포가CO2 인큐베이터(5% CO2, 습한 대기)에서 37°C에서 24시간 동안 배양되도록 한다.
- 세포로부터 의 매질 은 3일째 용지(예를 들어, 6웰 플레이트의 웰당 2 mL)로 대체한다.
-
중두면 차별화 (장 외31에서적응)
- 2D 배양에 대해 전술한 바와 같이 DMSO를 가진 세포를 후퇴시.
- Wnt3a 및 액티브 인 A 주식 솔루션을 준비합니다.
- Wnt3a를 최종 농도 20 ng/mL 및 액티빈 A에 추가하여 중추 분화 매체를 미리 온화된 고급 RPMI 매체의 적절한 부피에 100 ng/mL의 최종 농도로 준비합니다.
- DMSO 전처리 후, 세포로부터 의 매질 및 분화 매체로 대체한다(예를 들어, 6웰 플레이트의 웰당 2 mL).
- 세포가 CO2 인큐베이터(5% CO2, 습한 대기)에서 37°C에서 24시간 동안 배양되도록 한다.
-
이토더름 분화 (챔버 외 에서 적응32)
- 2D 배양에 대해 전술한 바와 같이 DMSO를 가진 세포를 후퇴시.
- Noggin 및 SB431542 재고 솔루션을 준비합니다.
- 녹아웃 혈청 교체(KOSR)를 녹아웃 DMEM에서 최종 농도 10%로 용해시킴으로써 외피 분화 염기를 준비한다.
참고: 미디어 변경 시 3~4일 동안 충분한 기본 미디어를 준비합니다. - 500 ng/mL 및 SB431542의 최종 농도에 Noggin을 추가하여 10 μM의 최종 농도를 미리 온난화된 KOSR/녹아웃 DMEM의 적절한 부피에 추가하여 외피 분화 매체를 준비합니다.
- DMSO 전처리 후, 세포로부터 의 매질 및 분화 매체로 대체한다(예를 들어, 6웰 플레이트의 웰당 2 mL).
- 세포가CO2 인큐베이터(5% CO2, 습한 대기)에서 3-4일 동안 3-4일 동안 배양하고, 매일 미디어를 신선하게 첨가된 분화 인자로 대체합니다.
4. 선조 세포 유형으로의 분화
다음은 이전에 2D 또는 3D 배양에서 자란 PSC에 대한 실험실에서 효과적인 것으로 나타난 방법에 대해 설명합니다. 선택의 모든 분화 프로토콜은 원하는 계보로 의 분화를 촉진하기 위해 DMSO 처리 후 사용되어야한다. 24-48시간 처리 후 DMSO 용액을 제거하고 표준 프로토콜에 따라 분화를 진행합니다.
- 신경 전구 세포 분화 (Tchieu 외33에서적응)
- CO2 인큐베이터(5% CO2, 습한 분위기)에서 적어도 1시간 동안 만능 줄기 세포-적격 감소 성장 인자 매트릭스또는 기판으로 코팅하여 6개의 웰 플레이트를 제조한다. 코팅된 플레이트는 최대 1주일 동안 4°C에서 필름을 감싸고 보관할 수 있다.
- 상술한 바와 같은 플레이트 PSCs는 ROCK 억제제 함유 줄기 세포 매체에서 웰당 0.5-1 x 106 세포의 밀도로 한다.
- 2D 배양에 대해 전술한 바와 같이 DMSO를 가진 플레트리트는 세포를 갖는다.
- LDN193189, SB431542 및 XAV939 재고 솔루션을 준비합니다.
- 에센셜 6 미디어와 500 nM LDN193189, 10 μM SB431542 및 2 μM XAV939를 보충하여 1-3 일 신경 외분화 매체를 준비합니다.
- DMSO 전처리 후, 미디어를 흡인하고 Days 1-3 신경절제술 로 교체합니다(예를 들어, 6웰 플레이트의 웰당 2 mL). 미디어를 매일 변경합니다.
- 에센셜 6 미디어를 500 nM LDN193189 및 10 μM SB431542로 보충하여 4-12일 신경외세포 분화 매체를 준비한다.
- 분화의 4 일째에, 미디어를 흡인하고 일 4-12 신경 데토더미디어로 대체한다. 매일 미디어를 변경합니다.
- 분화 12일 후, 분화된 세포는 신경 전구 세포(NPC)의 적절한 마커를 발현해야 한다. NPC는 DMEM/F-12, 2% B-27, 1% N-2를 함유하는 신경 매체에서 더 유지될 수 있으며, 10 μg/mL 기본 섬유아세포 성장 인자(bFGF)로 보충될 수 있다. NPC를 통과시 셀 분리 용액을 사용하여, 웰당 0.5-1 x 106 셀에서 NPC를 도금한다.
- 올리고젠드로시테 전구 세포 분화 (두바라스와 포사티34에서적응)
- 상기와 같은 PSC를 ROCK 억제제 함유 줄기세포 매체에 코팅된 6웰 플레이트상에 웰당 1 x 10 5의 밀도로 플레이트한다.
- 2D 배양에 대해 전술한 바와 같이 DMSO를 가진 플레트리트는 세포를 갖는다.
- SB431542, LDN193189, 모든 트랜스 레티노산(RA) 및 매끄러운 작용제(SAG) 스톡 솔루션을 준비합니다.
- DMEM/F-12를 10 μM SB431542, 250 nM LDN193189 및 100 nM RA로 보충하여 일 0-8 분화 매체를 준비합니다.
- DMSO 전처리 후, 8일 동안 분화 매체를 가진 세포를 배양하고, 신선하게 첨가된 분화 인자(예를 들어, 6웰 플레이트의 웰당 2 mL)로 매일 매체를 변화시다.
- 8일째에, 1x MEM 비필수 아미노산(NEAA) 용액, 1X L-글루타민, 2-메르카프토에탄올, 페니실린/스트렙토마이신, 1x N-2 보충제 100 nM RA 및 1 μM SAG를 함유한 DMEM/F-12로 미디어를 교체하십시오. 매일 미디어를 변경합니다.
- 분화 12일 후, 분화세포는 올리고젠드로시테 전구세포(OPCs)의 적절한 마커를 발현한다.
- 내분비 전구 세포 분화 (파글리우카 외35에서적응)
- 줄기 세포 매체에서 6 x 105 세포 /mL에서 종자 PSCs 플러스 500 mL 스피너 플라스크에 10 μM ROCK 억제제는 37 °C 인큐베이터, 5 % CO2, 및 100 % 습도에서 70 rpm의 회전 속도로 설정된 9 위치 교반 플레이트에 놓였다.
- 클러스터가 플라스크 의 맨 아래에 정착하고 미디어를 흡인한 다음 1%-2% DMSO로 후퇴하도록 합니다.
- 액티브 에이, Chir99021, KGF, 산트1, 모든 트랜스 레티노산 (RA), LDN193189, PdBU, XXI, Alk51, T3 및 베타 셀루인 주식 솔루션을 준비합니다.
- 제형에 기초하여 분화 베이스 매체를 준비하는 표3.
- DMSO 전처리 후, 흡인 매체를 S1 매체로 교체하고 100 ng/mL 액티브 A 및 3 mM Chir99021(예를 들어, 플라스크당 500 mL)으로 보충하였다. 24 시간 동안 배양하십시오.
- 2일째에는 미디어를 100 ng/mL 액티빈 A. 2일 간 인큐베이션을 허용하는 S1 용지로 교체합니다.
- 4일째에는 미디어를 50ng/mL KGF로 보충한 S2 미디어로 교체합니다. 3일 동안 배양을 허용하고, 처음 2일(6일째) 후에 미디어를 변경한다.
- 7일째에는 미디어를 50ng/mL KGF, 0.25 mM Sant1, 2mM RA 및 200 nM LDN193189로 보충한 S3 용지로 교체합니다. 24 시간 동안 배양하십시오.
- 8일째에는 미디어를 50 ng/mL KGF, 0.25 mM Sant1, 2mM RA, 200 nM LDN193189 및 500 nM PdBU로 보충한 S3 용지로 교체합니다. 24 시간 동안 배양하십시오.
- 9일째에는 미디어를 50 ng/mL KGF, 0.25 mM Sant1 및 100 nM RA로 보충한 S3 용지로 교체합니다. 5일 동안 배양을 허용하고 2일마다(11일 및 13일) 미디어를 변경합니다.
- 14일과 16일에는 0.25 mM Sant1, 100 nM RA, 1 mM XXI, 10 mM Alk5i II, 1 mM T3 및 20 ng/mL 베타셀룰린(총 4일 총 인큐베이션)으로 보충된 S5 매체로 미디어를 교체한다.
- 18일과 20일에는 25 nM RA, 1 mM XXI, 10 mM Alk5i II, 1 mM T3 및 20 ng/mL 베타셀룰린으로 보충된 S5 미디어로 미디어를 교체합니다.
5. 분화의 면역 세포화학 적 검증
참고: 다음 방법은 필요에 따라 조정할 수 있는 일반적인 면역세포화학 프로토콜을 기술한다. 1 차적인 항체는 우리의 실험실에서 이전에 검증된 그들의 입니다. 분화의 검증을 위한 다른 기술도 사용될 수 있다(예를 들어, 유세포분석, qPCR, RNA 염기서열 분석, 웨스턴 블로팅, 기능성 분석법 등).
-
면역 표지 세포
- 현탁액의 3D 배양체의 경우, 고정 전에 18-24시간 동안 단일 셀 현탁액상에 분산된 플레이트 전체 세포 클러스터 또는 클러스터를 코팅합니다.
- 부착 된 세포에서 미디어를 흡인하고 셰이커에 RT에서 PBS로 간략하게 씻어.
- 세포 고정을 위해, PBS를 흡인하고 4% 파라포름알데히드(PFA)를 PBS에서 20분 동안 RT온 셰이커에서 배양한다.
주의 사항: PFA 주식은 독성으로 인해 연기 후드 아래에 준비해야합니다. 적절한 개인 보호 장비를 흡입하고 착용하지 마십시오. - PFA를 제거하고 적절한 화학 폐기물 용기에 버리십시오.
- 쉐이커에서 RT에서 세척당 최소 5분 동안 PBS로 세포를 3x 세척합니다.
- 세포 투과 및 차단을 위해, 5% 당나귀 혈청을 가진 세포를 교양 세포는 쉐이커상에서 RT에서 1시간 동안 0.3% 트리톤-x 100/PBS로 제조하였다.
- 투압/차단에 사용되는 동일한 용액에 1차 항체 용액을 준비합니다.
- 셰이커상에서 4°C에서 1차 항체 용액으로 밤새 배양한다.
- 하룻밤 배양 후, 쉐이커에서 RT에서 1회 이상 5분 동안 PBS로 세포를 3x 세척합니다.
- 투압/차단 용액에서 이차 항체 용액을 준비합니다.
- 셰이커에서 RT에서 1시간 동안 이차 항체 용액으로 배양할 수 있습니다.
- 이차 항체 용액을 흡인하고 쉐이커상에서 RT에서 세척당 적어도 5분 동안 PBS로 세포를 3x 세척한다.
- 적절한 인큐베이션 시간에 대한 DAPI 또는 다른 바람직한 마커로 세포를 배양하고, PBS에서 헹구는다.
-
이미지 정량화
- 형광 현미경 및/또는 높은 함량의 스크리닝 플랫폼을 통해 조건당 최소 3개의 이미지를 수집합니다.
- 편견없는 이미징 소프트웨어 (예를 들어, ImageJ) 또는 자동 스크리닝 플랫폼을 사용하여 항체 염색 세포 및 총 세포 수 (DAPI / Hoechst nuclei 염색 기준)의 총 수를 계산하여 각 마커에 대한 양성 세포의 백분율을 정량화합니다. 분석.
결과
DMSO 처리 된 iPSCs의 형태
대조군 피험자로부터 유래된 인간 iPSCs는 부착된 2D 단층 또는 현탁액의 3D 세포 구체에서 배양되었다. 초기 도금 후 약 24시간, 세포는 유지 매체에서 24시간 동안 1% 또는 2% DMSO로 처리하였다. DMSO 처리 후 대표적인 브라이트필드 이미지는 그림1에 나와 있습니다. 단층 3에서 유지되는 iPSCs에대한 이전 보고서와 일치하여, DMSO 전처리는 비DMSO 처리 된 세포에 비해 성장 속도의 일시적인 투여 의존적 감소를 초래하였다 (도1A). 이러한 감소된 증식은 세포 대 세포 접촉의 증가와 관련이 있으며, 이는 특히 2% DMSO 처리 된 세포에서 두드러져 더 높은 클러스터된 세포 콜로니의 증가된 형성을 나타낸다. 다른 세포 유형에서, DMSO-유도 G1 체포는 접촉 억제 유도 성장 체포를 지원하는 세포 세포 상호작용에 관여하는 단백질의 증가발현과 연관되는 것으로 나타났다36. 3D 세포 구체로 유지되는 iPSCs에서, DMSO 처리는 유사하게 세포 구체의 수를 증가시켰다(도1B). 더욱이, DMSO 처리는 또한 더 적은 가변 3D 구체 크기를 초래하였으며, 이는 이전에세포의 개선된 분화 능력(37)을 나타내는 것으로 나타났다. 중요하게는, 1% 또는 2% DMSO가 생존율 로 측정된 바와 같이 세포 독성을 초래하지 않았다(n= 3; 2D 배양 % 라이브 = 대조군: 80±1.3; 1% DMSO: 82±3.7, 2%: 82±2.7; 3D 배양 % 라이브 = 대조군: 81±4.3; 1% DMSO: 82±2.2±2.2±2.2±2.2±2.2±2.± 2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±2.2±22±22±2.22±22±22±2.22±2.2±2.2±2.2±2.2±2±22±2.2±2.2±2.2±2.2±2.2±2.2±2.2±22±2.2%. 전반적으로, 이러한 결과는 DMSO 치료가 배양 된 줄기 세포에서 세포 주기 및 성장 패턴을 변경한다는 개념과 일치합니다. 성장 억제에 대한 이러한 효과는 DMSO가 배지에서 제거될 때 가역적, 앞서 도시된바와같이 3.
DMSO 치료는 1 차적인 세균 층으로 ESC의 분화를 향상합니다
HUES6 hESCs를 코팅플레이트에 24시간 동안 시드한 후 유지 보수 배지에서 24시간 동안 2% DMSO로 처리하였다. 세포는 도 2A30,31,32에도시된 치료 패러다임에 따라 3가지 1차 생식층으로 분화하였다. 분화 된 세포는 각각의 세균 층의 프로토티 마커를 고정하고 면역학적으로 염색했습니다 (내배엽의 SOX17, 중배엽용 brachyury, 및 ectoderm에 대한 SOX1). 도 2B에 도시된 바와 같이, 2% DMSO를 가진 전처리의 24h는 각각의 생식층 마커를 발현하는 세포의 비율을 증가시다. 이는 DMSO3,5로치료된 줄기세포의 모든 생식층을 향한 분화세포의 절대수뿐만 아니라 면역반응성 증가, 유전자 발현 을 보여주는 실험실의 이전 보고서와 일치한다. HUES6는 모든 계보 1에 걸쳐 분화에 대한 매우낮은 성향을 가진 hESC 라인이지만 DMSO 처리는 모든 세균 층에서 차별화할 수 있는 능력을 실질적으로 향상시킵니다.
DMSO 치료는 전구 세포 유형으로의 분화를 향상시킵니다.
DMSO가 CNS 전구 세포 유형으로의 분화에 미치는 영향을 조사하기 위해, 인간 iPSCs는 신경 전구 세포(NPC) 또는 올리고엔드로시테 전구 세포(OPCs)로 분화하였다. NPC를 생성하기 위해, 세포는 유지 보수 배지에서 2% DMSO로 2% DMSO로 전처리하고 12일 간의 지시분화(도3A)를수행하였다. 도 3B에 도시된 바와 같이, 2% DMSO 전처리는 대조군과 비교하여 Pax6 의 NPC 마커의 발현을 증가시하였다. 이전에 검증된 다른 프로토콜34(그림 3C)를 사용하여 iPSCs를 12일 동안 OPC로 분화시켰습니다. NPC와 유사하게, 24시간 동안 2% DMSO로 전처리된 iPSCs로부터 유래된 Opcs는 OPC 마커 OLIG2를 발현하는 세포의 증가 비율을 입증하였다(도3D).
초기 DMSO 치료는 성숙한 세포 유형으로 분화를 향상시키기 위해 지속
분화 프로토콜의 후기 단계에 대한 DMSO의 효과를 조사하기 위해, HUES8 hESCs는 도4에 기재된 20일 지시된 분화 프로토콜에 이어 β 세포로 분화하기 전에 2% DMSO로 24시간 동안 전처리되었다. 35. HUES8은 이전에 내피 혈통1,38에대한 더 높은 성향을 보였기 때문에 사용되었습니다. 명확한 내배엽 단계에서, 분화된 세포는 SOX17 및 FOXA2, 최종 내배엽(DE) 특이적 마커를 발현한다. 췌장 전구체(PP1)단계로의 추가 분화와 함께, 분화된 세포는 PDX1 및 FOXA2를 발현하고, 췌장 전구 세포의 특징적인 마커를 발현한다. 췌장 세포 분화의 이 단계에서, DE로 유도의 효율성은 이 단계의 각각으로 분화된 제어 및 DMSO 처리된 hESCs 둘 다를 위해 PP1로 유도의 높은 (그림4B,단계 1 및 및 3). HUES8 세포주가 내피 혈통으로 분화하는 성향이 증가한 것으로 지적되었음에도 불구하고, DMSO 처리 된 hESCs는 말단 단계에서 보다 전문화된 세포 유형으로 더 유도됨에 따라 훨씬 더 많은 것들이 성숙한 췌장 내분비 세포를 생성 할 가능성이. PDX1/NKX6.1+ 췌장 전구 세포, Neurogenin 3+ 내분비 세포 및 NKX6.1/C-펩타이드+ SC-β 세포를 생성하는 의 효율은 DMSO 처리 된 hESCs에서 실질적으로 더 높았다 (그림4B, 단계 4 및 5). 이러한 결과는 NPC 및 OPC 분화와 일치하여 DMSO가 전구 세포 유형에 대한 분화 잠재력을 향상시키고 또한 DMSO의 효과가 보다 전문화된 세포 유형을 생성하는 데 지속적임을 입증한다. 이것은 우리가 초기 24 시간 DMSO 처리가 신경 세포로 뿐만 아니라 심근세포를 이길 뿐만 아니라,39를포함하여 세균 층을 통해 말기 세포 모형으로 분화를 증가한다는 것을 보여주었던 이전 작업과 일치합니다,39 분화에 대한 높거나 가난한 성향세포주에서3.
초기 DMSO 치료는 생체 이식 후 hESC 유래 세포 기능을 향상시킵니다.
이전에는 hES를 기능성 췌장 전구 세포로 분화시키는 데 있어 DMSO 치료의 효과를 입증하되, 이는 나중에 생체 내에서인슐린 분비에서 현저한 개선을 보여준다3. 이전에 발표된 프로토콜3,30,40,HUES8 hESCs를 사용하여 24시간 동안 1% DMSO로 처리하고, 췌장 전구 세포로 분화하고, 면역결핍 SCID-베이지 마우스로 이식하여 평가하였다. 기능성(예를 들어, 포도당 도전 또는 KCl 자극에 반응하여 인슐린 분비) (도5A). FOXA2+로의 차별화 효율(~90%) 및 PDX1+ (~75%) 췌장 전구체는 HUES8 hESC 라인에 대한 대조군과 DMSO 처리 된 hESCs (그림5B)사이에 비교되었고, 24 h1% DMSO 치료에 이어 hESCs로부터 분화된 세포는 포도당 및 KCl에 대한 반응성을 향상시켰습니다. 생체 내 이식 후 자극. 기능성 의 개선은 이식 후 2주 이내에 명백하였다(그림5C) 이식 후 적어도 16주까지 지속되었다(그림5D). 종합하면, 이러한 결과는 DMSO 전처리가 생식층, 전구 세포 및 보다 성숙한 세포 유형으로의 분화 효율을 증가시킬 뿐만 아니라 생체 내에서 분화된 세포의 기능을 향상시키기 위해 지속된다는 것을 시사한다.
| 차별화된 세포 유형 | 셀 유형 시작 | %DMSO | DMSO 처리의 길이 | DMSO 처리의 길이 |
| 간 세포 | Esc 간종 세포주 Esc Esc 중간 엽 줄기 세포 아이프시 (주) Esc Esc 간종 세포주 Esc | 1.0 1.0 1.0 0.5 0.1-2.0 1.0 1.0 0.5 1.0 0.6 | 8일 간 며칠 7일 10-14 일 7-21 일 7일 4일 5일 2-21 일 걸쳐 | 바스마 외, 2008년 카네브라트와 앤더슨, 2008 헤이 외, 2009년 두안 외, 2010 알리자데 외, 2014 콘도 외, 2014 2014년 스콜니카 외 Czysz 외, 2015 니콜라우 외, 2016 반호브 외, 2016 |
| 1 차적인 세균 층 | ESC 및 IPSC hESC hESC | 0.1-2.0 0.5 0.1-2.0 | 24시간 24시간 24시간 | 체티 외, 2013 체티 외, 2015 리 외, 2018 |
| 심장 세포 | ESC 및 IPSC P19 세포 ESC 및 IPSC 태아 중간 엽 줄기 세포 | 0.1-2.0 1.0 1.0-2.0 0.8-1.0 | 24시간 4일 24-30시간 24시간 | 체티 외, 2013 최외, 2014 반 덴 베르크 외, 2016 덩 외, 2017 |
| 췌장 세포 | ESC 및 IPSC hESC | 0.1-2.0 0.5 | 24시간 24시간 | 체티 외, 2013 체티 외, 2015 |
| 평활근 세포 | P19 세포 | 1.0 | 4일 | 최외, 2014 |
| 내피 세포 | P19 세포 | 1.0 | 4일 | 최외, 2014 |
| 장세포 | 아이프시 (주) | 0-1.6 | 4일 | 오가키 외, 2015 |
| 장 상피 | 아이프시 (주) | 0-1.6 | 4일 | 오가키 외, 2015 |
| 신경 세포 | 마모셋 iPSC | 0.05-2.0 | 24시간 | 치우 외, 2015 |
| 호중구 | 백혈병 세포주 | 1.25 | 6-8 일 | 테이무리안과 모간루, 2016 |
| 골격 묘튜브 | 아이프시 (주) | 1.5 | 24시간 | 스와츠 외, 2016 |
| 피질 오르가노이드 | 하이프시 | 1.0 | 24시간 | 윤 외, 2018 |
표 1: DMSO 치료의 차별화 효과를 입증하는 이전에 발표된 작업의 요약.
| S1 | S2 | S3 | S5 | |
| MCDB131 (L) | 1개 | 1개 | 1개 | 1개 |
| 포도당 (g) | 0.44 | 0.44 | 0.44 | 3.6 |
| 나코3 (g) | 2.46 | 1.23 | 1.23 | 1.754 |
| FAF-BSA (g) | 20개 | 20개 | 20개 | 20개 |
| ITS-X (mL) | 0.02 | 0.02 | 5개 | 5개 |
| 글루타맥스 (mL) | 10개 | 10개 | 10개 | 10개 |
| 비타민 C (mg) | 44세 | 44세 | 44세 | 44세 |
| 헤파린 (mg) | 0 | 0 | 0 | 10개 |
| P/S(mL) | 10개 | 10개 | 10개 | 10개 |
표 2: 내분비 전구 세포 분화 염기 매체.
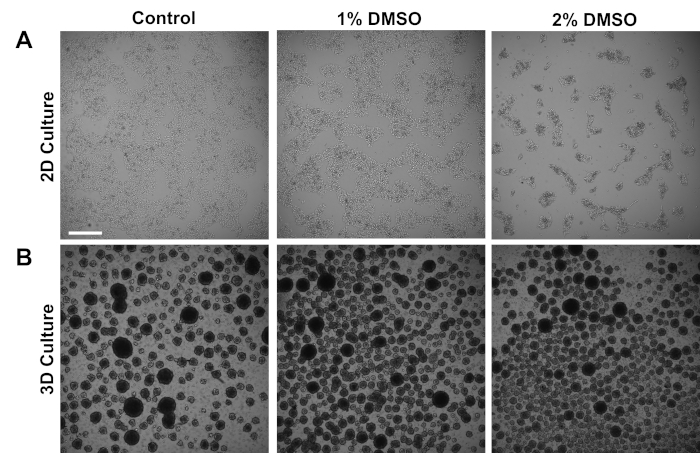
그림 1 : DMSO 처리는 hPSC의 성장을 변화시다. (a) 24시간 동안 1% 또는 2% DMSO로 치료(control) 또는 치료를 받지 않은 후 단층으로 도금된 hiPSCs의 대표적인 브라이트필드 이미지는 iPSCs의 일시적인 용량 의존적 성장 억제를 촉진한다. (B) 낮은 부착 플레이트에 도금된 hiPSCs의 대표적인 브라이트필드 이미지는 24시간 동안 1% 또는 2% DMSO로 치료(제어) 또는 치료를 받은 후 3D 구 형성을 허용합니다. 제어에 비해. 배율 표시줄 = 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
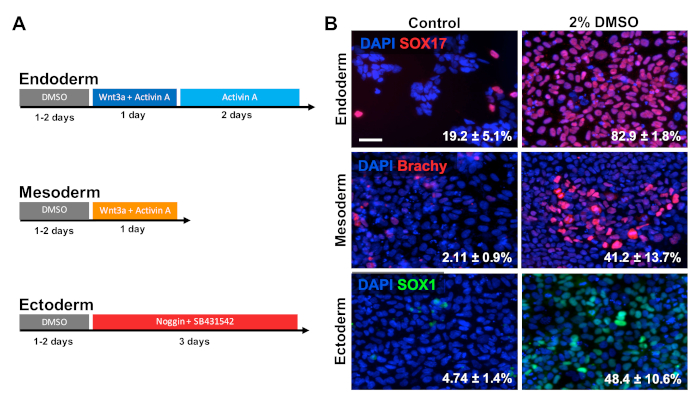
그림 2 : DMSO 트리트먼트를 통해 hPSCs를 1차 생식층으로 분화시킵니다. (a) 3가지 1차 세균 층을 생성하는데 사용되는 분화 프로토콜의 개략적. (B) SOX17(내배엽), 브라치유리(mesoderm) 및 SOX1(ectoderm)에 대해 면역표지된 차별화된 HUES6 hESCs의 대표적인 이미지. 24 시간 동안 2 % DMSO로 전처리는 세 가지 세균 층 모두에 걸쳐 분화 효율을 증가시켰습니다. SOX17+ 내피, Brachyury (Brachy)+ 중간 피이상, 또는 SOX1+ 외피 세포로 분화하는 세포의 백분율은 제어 및 DMSO 처리 된 hESCs의 각 생식 층으로 지시 된 분화에 따라 세 가지 생물학적 복제의 SEM으로 지적됩니다. . 페어링되지 않은 t-검정: 내배엽 p = 0.0003; 중미경 p = 0.047; ectoderm p = 0.015. 배율 표시줄 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
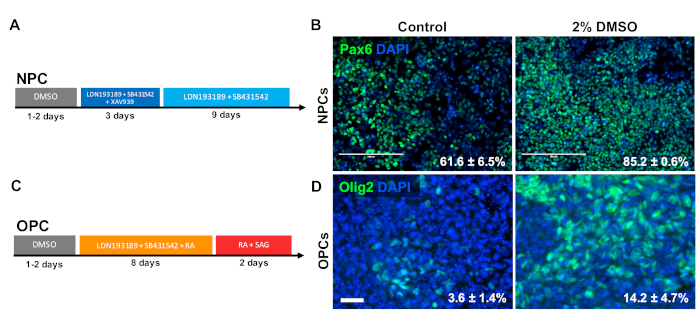
그림 3 : DMSO 트리트먼트를 통해 신경 전구 세포 유형으로의 분화를 개선합니다. (A) 신경 전구 세포(NPC)를 생성하는 데 사용되는 분화 프로토콜의 개질. (B) Pax6에 대한 면역 표지된 NPC로 분화된 인간 iPSCs의 대표적인 이미지. 2% DMSO를 가진 전처리의 24 시간 개 PAX6 양성 세포를 증가시켰습니다. Pax6+ NPC로 분화하는 세포의 백분율은 제어 및 DMSO 처리된 인간 iPSCs의 지시된 분화에 따라 3개의 생물학적 복제물의 SEM으로 지적된다. 페어링되지 않은 t-검정: p = 0.0225. 스케일 바 = 200μm. (C) 올리고엔드로시테 전구 세포(OPCs)를 생성하는 데 사용되는 분화 프로토콜의 회로도. (D) OPC 마커 Olig2에 대한 면역 표지된 OPC로 분화된 인간 iPSCs의 대표적인 이미지. 2% DMSO를 가진 전처리의 24 시간 대조군비교된 두 OPC 마커의 발현을 증가시켰습니다. Olig2+ OPCs로 분화하는 세포의 백분율은 대조군 및 DMSO 처리된 인간 iPSCs의 지시된 분화에 따라 4개의 생물학적 복제의 SEM으로 지적된다. 페어링되지 않은 t-검정: p = 0.0466. 배율 표시줄 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
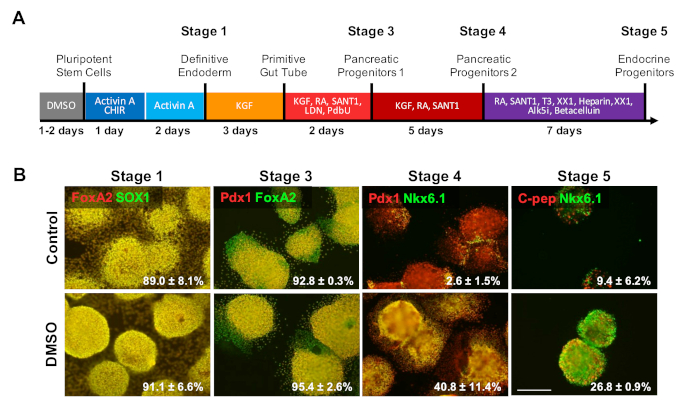
그림 4 : DMSO 처리는 hPSC의 말단 분화 잠재력을 향상시킵니다. (A) ~20일간 HUES8 hESCs를 말단 분화 췌장 내분비 세포로 분화하도록 유도하였다. (b) 24시간 동안 2% DMSO로 전처리된 미처리 대조군 세포 및 세포의 지시된 분화 에 따른 분화의 각 단계에서 표시된 마커에 대한 면역 염색. 초기 DMSO 치료는 지시된 분화의 후기 단계에서 말단 내분비 세포 유형으로의 분화를 증가시키기 위해 지속된다. 대조군 및 DMSO 처리된 hESCs의 지시된 분화 에 따른 분화의 각 단계에서 표시된 마커로 분화하는 세포의 백분율은 2~4개의 생물학적 복제물의 SEM으로 주목된다. 배율 표시줄 = 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
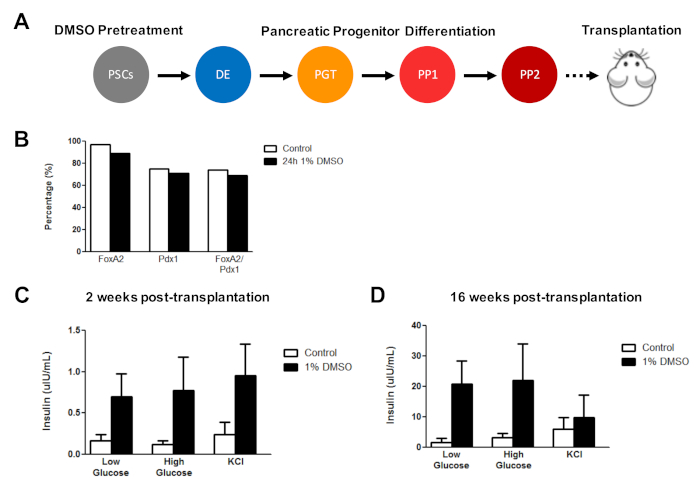
그림 5 : hPSCs의 초기 DMSO 치료는 생체 내에서 췌장 전구 세포의 이식 후 포도당 반응성을 향상시킵니다. (A) HUES8 hESCs를 췌장 전구 세포(PP2)로 의한 분화(~15일) 시골화(약 15일) 후치료(대조군) 또는 24시간 1% DMSO 치료 및 면역결핍으로 의한 후속 이식(500만 세포) SCID-베이지 마우스. (b) PDX1+ 및 FOXA2+ 췌장 전구 세포로 분화하는 세포의 백분율은 시험관 내 지시된 대조군 및 DMSO 처리된 hESCs의 이식 직전에 (n=1). (C) (C) 췌장의 2주 및 (D) 16주 간 에서 낮은(2.5mM) 또는 높은(15mM) 포도당 도전 또는 염화칼륨(KCl) 자극을 따르는 마우스의 혈청으로부터 인간 인슐린의 ELISA 측정을 의미합니다. 전구 세포는 대조군 및 DMSO 처리 된 hESCs로부터 분화 (오류 막대 = SEM; n = 3에서 2 주 및 대조군 16 주; n = 2 주에서 2 주 및 DMSO에 대한 16 주). 양방향 ANOVA: p = 0.0051 제어 대 DMSO 2주; p = 16주 동안 제어 대 DMSO에 대한 0.0116. 상이한 시점에서 연구된 마우스는 다르다. 결과는 Chetty 외3. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
요약하면, 이 프로토콜은 모든 1차 생식층, 다양한 유형의 전문 전구 세포, 심지어 기능적이고 성숙한 세포 유형인 시험관 내 다능성 줄기 세포(PSC)의 분화 능력을 향상시키는 간단하고 저렴한 도구를 설명합니다. 및 생체 내 설정. 그림형은 당사의 실험실뿐만 아니라 다른 실험실에서 효과적으로 재현된 특정 분화 프로토콜이지만, 선택의 임의의 분화 프로토콜은 DMSO 처리 후 사용될 수 있다. 표1에 나타낸 바와 같이, 다수의 실험실은 또한 다양한 다른 말단 세포 유형을 생성하기 위해 상이한 패러다임을 이용한 과도 DMSO 처리 후 PSC 분화의 향상을 입증했다. 더욱이, 여기서 의 방법은 인간 PSCs의 사용을 기술하지만, DMSO 전처리는 종에 걸쳐 이용될 수 있고 마우스, 토끼 및 영장류 PSCs에 효과적인 것으로 나타났다.
DMSO의 더 높은 복용량은 세포 독성 것으로 알려져 있지만, 이 방법에 사용되는 낮은 복용량 (1%-2%) 일시적인 기간 동안 최소한의 세포 사멸을 초래합니다. DMSO 처리 직후 전체 세포 수는 세포 주기의 G1 단계에서 세포 주기 체포의 DMSO 승진으로 인해 감소할 수 있는 반면, 이전 연구는 세포가 제거 후 대조군 배양물과 동일한 수준의 합류에 도달할 수 있음을 보여줍니다. DMSO3.
DMSO 전처리의 백분율 및 지속 시간은 세포주당 최적화되어야 합니다. 치료 시간은 세포의 사이클링 / 두 배 시간을 고려하여 조정해야합니다. 예를 들어, 마우스 PSC는 전형적으로 약 15 시간의 훨씬 더 짧은 사이클링 시간을 가지며; 따라서, 이들 세포에 대한 15시간 동안의 DMSO 처리는 충분하다. 일부 실험실은 또한 DMSO 치료가 분화 프로토콜 동안 또는 더 낮은 농도에서 계속될 때 유익하다는 것을 발견하였다(표 1참조). 일부 PSC 라인은 특정 계보에 대한 차별화를 보다 수정할 수 있다는 점에 유의해야 합니다. 예를 들어, HUES6 세포는 분화에 덜 허용되는 것으로 나타났으며, 따라서 DMSO치료로 개선을 표시하였다(도 2). 대안적으로, 도 4 및 도 5에 사용된 HUES8 세포는 내피 분화쪽으로 더 높은 성향을 보이는 것으로 나타났다; 따라서, 최종 내배엽을 향한 초기 단계에서 분화를 위한 제어와 DMSO 사이에 더 적은 차이가 나타났다. 그럼에도 불구하고, DMSO 전처리의 향상은 이러한 세포주에서의 분화의 후기 단계에서 관찰된다(도4B). DMSO 처리는 또한 2D 및 3D 세포 배양 시스템 모두에서 효과적이며, 세포 배양 판에 다양한 유형의 코팅 물질과 함께 사용할 수 있으며, 성장과 확장을 촉진하는 다양한 유형의 유지 보수 매체에서 작동한다는 점에서 다재다능합니다. hPSCs(예: mTeSR, E8, MEF 컨디셔닝 미디어 등)
보다 일반적으로, 이러한 결과는 다능성 줄기 세포의 시작 상태가 기능성 세포 유형으로의 말단 분화뿐만 아니라 초기 분화성향에 강한 영향을 미친다는 것을 시사한다. 우리는 이전에 hPSCs3,5에서Rb를 통해 DMSO 처리 기능이 있음을 보여주었습니다. Rb는 세포의 말단 분화, 세포 생존 및 유전적 안정성을 촉진하는 데 중요한 역할을하며,따라서세포에 대한 지속적인 효과를 설명할 수 있습니다. DMSO 처리 hPSCs와 차별화됩니다. 규제의 이 초기 모드를 표적으로 하는 것은 분화를 위한 더 나은 궤도에 hPSCs를 두어 궁극적으로 재생 의학을 위한 그들의 유용성을 향상할 수 있습니다.
공개
공개할 것이 없는 저자.
감사의 말
이 작품은 스탠포드 대학 의과 대학의 보조금과 S. C에 수여 시벨 펠로우십에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 21985023 | |
| 6-well Clear Flat Bottom TC-treated Multiwell Cell Culture Plate | Corning | 353046 | |
| 9-Position stir plate | Chemglass | CLS-4100 | |
| Accutase | Gibco | 11105-01 | |
| Activin A | R&D Systems | 338-AC | |
| Advanced RPMI | Gibco | 12633012 | |
| Alk5i II | Axxora | ALX-270-445 | |
| All-trans retinoic acid | Sigma-Aldrich | R2625 | |
| anti-Brachyury | R&D Systems | AF2085 | No variablity observed across different lot numbers |
| anti-C-peptide | Developmental Studies Hybridoma Bank | GN-ID4 | No variablity observed across different lot numbers |
| anti-FoxA2 | Millipore | 07-633 | No variablity observed across different lot numbers |
| anti-Nkx2.2 | University of Iowa, Developmental Hybridoma Bank | 74.5A5 | No variablity observed across different lot numbers |
| anti-Nkx6.1 | University of Iowa, Developmental Hybridoma Bank; | F55A12-supernatant | No variablity observed across different lot numbers |
| anti-Olig2 | EMD Millipore | MABN50 | No variablity observed across different lot numbers |
| anti-Pax-6 | Biolegend | 901301 | No variablity observed across different lot numbers |
| anti-Pdx1 | R&D Systems | AF2419 | No variablity observed across different lot numbers |
| anti-SOX1 | R&D Systems | AF3369 | No variablity observed across different lot numbers |
| anti-SOX17 | R&D Systems | AF1924 | No variablity observed across different lot numbers |
| B-27 Supplement, minus Vitamin A | Gibco | 12587010 | |
| Basic fibroblast growth factor | Gibco | PHG0264 | |
| Betacellulin | Thermo Fisher Scientific | 50932345 | |
| Chir99021 | Stemgent | 04-000-10 | |
| CMRL 1066 | Corning | 99-603-CV | |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAF1000 | |
| D-(+)-Glucose | Sigma | G7528 | |
| DAPI | Invitrogen | D1306 | |
| Disposable Spinner Flasks | Corning, VWR | 89089-814 | |
| DMEM/F-12 | Gibco | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Essential 6 Media | Gibco | A1516501 | |
| FAF-BSA | Proliant | 68700 | |
| FGF7 | PeproTech | 100-19 | |
| Geltrex | Gibco | A1413202 | |
| GlutaMAX | Gibco | 35050061 | |
| Heparin | Sigma | H3149 | |
| Human Ultrasensitive Insulin ELISA | ALPCO Diagnostics | 80-INSHUU-E01.1 | |
| ITS-X | Invitrogen | 51500056 | |
| KGF | Peprotech | AF-100-19 | |
| Knockout DMEM | Gibco | 10829018 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| L-3,3′,5-Triiodothyronine (T3) | EMD Millipore | 642245 | |
| LDN193189 | Stemgent | 04-0074 | |
| Matrigel Matrix | Corning | 354277 | |
| MCDB-131 | Cellgro | 15-100-CV | |
| MEM NEAA | Gibco | 11140050 | |
| mTeSR 1 | StemCell Technologies | 5850 | |
| N2 Supplement | Life Technologies | 17502048 | |
| NaHCO3 | Sigma | S3817 | |
| Noggin Fc Chimera Protein | R&D Systems | 3344-NG-050 | |
| PdBU | EMD Millipore | 524390 | |
| Penicillin/Streptomycin | Mediatech | 30-002-CI | |
| RPMI | Gibco | 11875-093 | |
| Sant1 | Sigma-Aldrich | S4572 | |
| SB431542 | Stemgent | 04-0010 | |
| Smoothened Agonist, SAG | EMD Millipore | 566660 | |
| StemPro Accutase | Gibco | A1110501 | |
| TrypLE | Gibco | 12604013 | |
| Ultra-Low Attachment Microplates | Corning | 3471 | |
| Vitamin C | Sigma-Aldrich | A4544 | |
| Wnt3a | R&D Systems | 5036-WN | |
| XAV 939 | Tocris | 3748 | |
| XXI | EMD Millipore | 565790 | |
| Y-27632 | StemCell Technologies | 72302 |
참고문헌
- Osafune, K., et al. Marked differences in differentiation propensity among human embryonic stem cell lines. Nature Biotechnology. 26 (3), 313-315 (2008).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Review Genetics. 15 (2), 82-92 (2014).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Conklin, J. F., Sage, J. Keeping an eye on retinoblastoma control of human embryonic stem cells. Journal of Cellular Biochemistry. 108 (5), 1023-1030 (2009).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110 (2018).
- Hartwell, L. H., Weinert, T. A. Checkpoints: controls that ensure the order of cell cycle events. Science. 246 (4930), 629-634 (1989).
- Pardee, A. B. G1 events and regulation of cell proliferation. Science. 246 (4930), 603-608 (1989).
- Orford, K. W., Scadden, D. T. Deconstructing stem cell self-renewal: genetic insights into cell-cycle regulation. Nature Review Genetics. 9 (2), 115-128 (2008).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453 (7194), 519-523 (2008).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells. 26 (4), 894-902 (2008).
- Duan, Y., et al. Differentiation and characterization of metabolically functioning hepatocytes from human embryonic stem cells. Stem Cells. 28 (4), 674-686 (2010).
- Szkolnicka, D., Farnworth, S. L., Lucendo-Villarin, B., Hay, D. C. Deriving functional hepatocytes from pluripotent stem cells. Current Protocols in Stem Cell Biology. 30, 1-12 (2014).
- Vanhove, J., et al. H3K27me3 Does Not Orchestrate the Expression of Lineage-Specific Markers in hESC-Derived Hepatocytes In Vitro. Stem Cell Reports. 7 (2), 192-206 (2016).
- Kanebratt, K. P., Andersson, T. B. Evaluation of HepaRG cells as an in vitro model for human drug metabolism studies. Drug Metabolism & Disposition. 36 (7), 1444-1452 (2008).
- Nikolaou, N., Green, C. J., Gunn, P. J., Hodson, L., Tomlinson, J. W. Optimizing human hepatocyte models for metabolic phenotype and function: effects of treatment with dimethyl sulfoxide (DMSO). Physiological Reports. 4 (21), (2016).
- Kondo, Y., et al. An efficient method for differentiation of human induced pluripotent stem cells into hepatocyte-like cells retaining drug metabolizing activity. Drug Metabolism Pharmacokinetics. 29 (3), 237-243 (2014).
- Alizadeh, E., et al. The effect of dimethyl sulfoxide on hepatic differentiation of mesenchymal stem cells. Artificial Cells, Nanomedicine, and Biotechnology. 44 (1), 157-164 (2016).
- Czysz, K., Minger, S., Thomas, N. DMSO efficiently down regulates pluripotency genes in human embryonic stem cells during definitive endoderm derivation and increases the proficiency of hepatic differentiation. PLoS One. 10 (2), 0117689 (2015).
- Ogaki, S., Morooka, M., Otera, K., Kume, S. A cost-effective system for differentiation of intestinal epithelium from human induced pluripotent stem cells. Scientific Reports. 5, 17297 (2015).
- Choi, S. C., et al. Mixl1 and Flk1 Are Key Players of Wnt/TGF-beta Signaling During DMSO-Induced Mesodermal Specification in P19 cells. Journal of Cellular Physiology. 230 (8), 1807-1821 (2015).
- Chetty, S., et al. A Src inhibitor regulates the cell cycle of human pluripotent stem cells and improves directed differentiation. Journal of Cell Biology. 210 (7), 1257-1268 (2015).
- Qiu, Z., et al. Marmoset induced pluripotent stem cells: Robust neural differentiation following pretreatment with dimethyl sulfoxide. Stem Cell Research. 15 (1), 141-150 (2015).
- Swartz, E. W., et al. A Novel Protocol for Directed Differentiation of C9orf72-Associated Human Induced Pluripotent Stem Cells Into Contractile Skeletal Myotubes. Stem Cells Translational Medicine. 5 (11), 1461-1472 (2016).
- Teimourian, S., Moghanloo, E. Thwarting PTEN Expression by siRNA Augments HL-60 Cell Differentiation to Neutrophil-Like Cells by DMSO and ATRA. DNA Cell Biology. 35 (10), 591-598 (2016).
- van den Berg, C. W., Elliott, D. A., Braam, S. R., Mummery, C. L., Davis, R. P. Differentiation of Human Pluripotent Stem Cells to Cardiomyocytes Under Defined Conditions. Methods in Molecular Biology. 1353, 163-180 (2016).
- Deng, F., et al. Combination of retinoic acid, dimethyl sulfoxide and 5-azacytidine promotes cardiac differentiation of human fetal liver-derived mesenchymal stem cells. Cell Tissue Bank. 17 (1), 147-159 (2016).
- Yoon, S. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2018).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637 (2018).
- Kroon, E., et al. Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo. Nature Biotechnology. 26 (4), 443-452 (2008).
- Zhang, P., et al. Short-term BMP-4 treatment initiates mesoderm induction in human embryonic stem cells. Blood. 111 (4), 1933-1941 (2008).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Tchieu, J., et al. A Modular Platform for Differentiation of Human PSCs into All Major Ectodermal Lineages. Cell Stem Cell. 21 (3), 399-410 (2017).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Fiore, M., Degrassi, F. Dimethyl sulfoxide restores contact inhibition-induced growth arrest and inhibits cell density-dependent apoptosis in hamster cells. Experimental Cell Research. 251 (1), 102-110 (1999).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Bock, C., et al. Reference Maps of human ES and iPS cell variation enable high-throughput characterization of pluripotent cell lines. Cell. 144 (3), 439-452 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- D'Amour, K. A., et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nature Biotechnology. 24 (11), 1392-1401 (2006).
- Jacks, T., et al. Effects of an Rb mutation in the mouse. Nature. 359 (6393), 295-300 (1992).
- Nguyen, D. X., Baglia, L. A., Huang, S. M., Baker, C. M., McCance, D. J. Acetylation regulates the differentiation-specific functions of the retinoblastoma protein. The EMBO Journal. 23 (7), 1609-1618 (2004).
- Slack, R. S., et al. Cells differentiating into neuroectoderm undergo apoptosis in the absence of functional retinoblastoma family proteins. Journal of Cell Biology. 129 (3), 779-788 (1995).
- Gu, W., et al. Interaction of myogenic factors and the retinoblastoma protein mediates muscle cell commitment and differentiation. Cell. 72 (3), 309-324 (1993).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유