Method Article
Переходное лечение стволовых клеток человека с DMSO для содействия дифференциации
В этой статье
Резюме
Генерация дифференцированных типов клеток из человеческих плюрипотентных стволовых клеток (hPSCs) имеет большие терапевтические перспективы, но остается сложной задачей. PSCs часто exhibit присущая неспособность продифференцировать даже когда простимулировано с правильным комплектом сигналов. Описанный здесь простой инструмент для повышения дифференциации многолинейных по различным линиям PSC.
Аннотация
Несмотря на растущее использование плюрипотентных стволовых клеток (ПСЦ), проблемы в эффективной дифференциации эмбриональных и индуцированных плюрипотентных стволовых клеток (ESCs и iPSCs) по различным линиям остаются. Были разработаны многочисленные протоколы дифференциации, однако изменчивость между клеточными линиями и низкие показатели дифференциации прививают проблемы в успешной реализации этих протоколов. Описанный здесь является простым и недорогим средством для повышения потенциала дифференциации ЧОПов. Ранее было показано, что лечение стволовых клеток с низкой концентрацией диметилсулькоксида (DMSO) значительно повышает склонность различных ЧоС дифференцироваться к различным типам клеток после направленной дифференциации. Этот метод в настоящее время показано, чтобы быть эффективным для различных видов (например, мышь, примат, и человека) в нескольких линий, начиная от нейронов и корковых сфероидов для гладких мышечных клеток и гепатоцитов. Предварительная обработка DMSO улучшает дифференциацию PSC путем регулировать цикл клетки и priming стволовые клетки для того чтобы быть более чутко к сигналам дифференциации. Здесь приведена подробная методология использования этого простого инструмента в качестве воспроизводимого и широко применимого средства для более эффективного дифференцирования ЧОПов к любой линии выбора.
Введение
Использование плюрипотентных стволовых клеток привело к многочисленным достижениям в области биомедицинских исследований, в том числе в области регенеративной медицины и стволовых клеток на основе терапии, моделирования заболеваний и скрининга наркотиков. Это также привело к общей перспективе более переводимых исследований и персонализированной медицины. Появление индуцированной плюрипотентной технологии стволовых клеток (iPSC) более 20 лет назад позволило исследователям развивать плюрипотентные стволовые клетки из соматических тканей и дифференцировать их в функциональные типы клеток для изучения различных патологий, в том числе сердечно-сосудистых, неврологических и иммунологических заболеваний. Хотя значительные успехи были достигнуты в технологии дифференциации стволовых клеток, проблемы в эффективной дифференциации человеческих эмбриональных стволовых клеток (HESCs) и iPSCs все еще сохраняются, ограничивая широкое использование технологии стволовых клеток по-разному исследовательских программ. Врожденная изменчивость между различными клеточными линиями и клонами продолжает создавать препятствия для дифференциирования линий стволовых клеток до желаемых linages1. Кроме того, вывод зрелых, неизлечимо дифференцированных функциональных клеток из hPSCs остается утомительным и неэффективным процессом во многих линиях. В самом деле, клетки дифференцированы от hPSCs часто не в состоянии неизлечимо дифференцировать в функциональные клетки2. В дальнейшем движущихся стволовых клеток на основе терапии для использования у пациентов, есть необходимость улучшить и обеспечить эффективность клеток, которые генерируются из hPSCs.
Наша лаборатория создала быстрый и недорогой инструмент для значительного повышения эффективности дифференциирования как iPSC, так и ESC на зрелые типы клеток. Мы обнаружили, что предварительная обработка hiPSCs и hESCs с широко используемым реагентом диметилсульксида (DMSO) для 24 ч до 48 h до направленной дифференциации приводит к заметному улучшению потенциала дифференциации стволовых клеток. Лечение ДМСО увеличивает долю HIPSCs и hESCs в начале фазы G1 клеточного цикла и активирует белок ретинобластомы (Rb)3, критический регулятор пролиферации клеток, выживания и дифференциации4. В более поздних работах, было установлено, что Рб и его члены семьи необходимы для про-дифференциации эффекты DMSO, так что преходящая инактивация Rb подавляет эффекты DMSO, в то время как составная активация Rb в преходящем образом усиливает Эффекты DMSO5. Аналогия с клеточным циклом во время эмбрионального развития, клеточный цикл ESCs и iPSCs характеризуетсясокращенной фазой G1, которая способствует самообновлению 6,7,8. Этот сокращенный этап G1 допускает более неограниченное распространение, ноограничивает возможности для дифференциации 4,9. Способствуя аресту роста в G1 и активируя контроль над контрольно-пропускными пунктами в клеточном цикле hESCs и iPSCs, лечение DMSO проселяет клетки для изменения судьбы клеток после направленной дифференциации.
На сегодняшний день, DMSO предварительной обработки было показано, чтобы улучшить дифференциацию потенциала для всех трех слоев зародыша в более чем 30 контроля и конкретных заболеваний человека ESC и iPSC клеточных линий3,5, а также дифференциации стволовых клеток и других клеточных линий к различным другим зрелым типам клеток в последующих исследованиях10,11,12,13,14,15,16, 17 Лет , 18 лет , 19 лет , 20 , 21 год , 22 Г. , 23 , 24 , 25 , 26 , 27 , 28 (Таблица 1). Кроме того, было показано, что лечение DMSO является эффективным в усилении дифференциации нечеловеческих первичных клеток21,23 (например, мышь, примат, кролик), предлагая общие механизмы между видами. Наконец, преобработка DMSO также была распространена на технологию редактирования генов, при этом одно конкретное исследование показало, что 24 ч DMSO предварительной обработки hESCs/iPSCs значительно повысила способность кластерных регулярно межпространственных коротких palindromic повторов (CRISPR) /CRISPR-связанный белок-9 (Cas9)-опосредовано эффективность редактирования некодирующей ДНК без включения непреднамеренных мутаций29. Приведена в этой представлении подробная методология предварительной обработки ГССИ и IPSC DMSO для применения в биологии стволовых клеток и направленная дифференциация.
протокол
1. Обслуживание стволовых клеток
ПРИМЕЧАНИЕ: Протокол обслуживания клеток, описанный ниже, применяется к pluipotent стволовых клеток (PSCs), поддерживаемых в адептативных монослой. Средства массовой информации, другие реагенты и пластины клеточной культуры, используемые до лечения ДМСО, могут быть скорректированы по мере необходимости. Для всех следующих протоколов в этой рукописи, клетки должны быть обработаны в рамках биологической безопасности кабинета.
- Пальто стерильное, 6 хорошо, ткань культуры обработанных пластин с плюрипотентной стволовых клеток квалифицированных матрицы или субстрата подготовлены в инструкции производителя и инкубировать, по крайней мере 1 ч в CO2 инкубатор (5% CO2, влажная атмосфера). Покрытые пластины могут быть завернуты пленкой и храниться при 4 градусах Цельсия в течение одной недели.
- Оттепель криоконсервированных ПЦ в водяной бане 37 градусов по Цельсию. Стерилизовать флакон с этанолом до введения в кабинет биологической безопасности, а затем немедленно передать клетки путем pipetting в стерильной конической трубки, содержащей 5-10 томов предварительно разогретых стволовых клеток.
- Центрифуги клетки на 300 х г в течение 5 мин при комнатной температуре (RT).
- Приготовьте средства массовой информации и осторожно resuspend клеточной гранулы в 1 мл стволовых клеток средств массовой информации дополняется 10 мкм ROCK ингибитор, такие как Y-27632.
- Аспирируй матрицу культуры от плиты и семя клетки на пожеланную плотность, типично 0.5-1 x 106 клеток в наилучшим образом в по крайней мере 2 mL средств стволовой клетки в наилучшим образом.
ПРИМЕЧАНИЕ: Плотность покрытия может варьироваться в разных клеточных линиях и клонах и должна быть оптимизирована соответствующим образом. - Поддерживайте клетки, заменяя предварительно разогретые стволовые клетки сми ежедневно. Разделение клеток примерно на 70%-80% стоек или когда клетки колонии начинают входить в контакт.
- Для расщепления клеток, аспирируют носители и мыть клетки один раз со стерильными PBS. Инкубировать клетки с 1 мл диссоциационистского ферментного раствора на скважину в течение 5-10 минут при 37 градусах Цельсия.
- Вымойте и повторно приостановите клетки с преднагреваемыми средствами стволовых клеток и перенесите в стерильную коническую трубку с 5-10 томами носителей стволовых клеток. Выполните шаги 1.3-1.7, чтобы пластины клеток.
2. Прелечение ДМСО
ПРИМЕЧАНИЕ: При покрытии клеток для предварительной обработки DMSO до дифференциации, начальная плотность клеток покрытия должна быть оптимизирована с учетом типичных темпов роста линии стволовых клеток, а также протокола дифференциации используется. Проверка плюрипотентности с помощью обычных маркеров, по мере необходимости. Клетки должны быть пройден по крайней мере 1x-2x после первоначального оттаивания до дифференциации.
-
2D-дифференциация культуры
- Когда клетки достигают соответствующей стельности, подготовить покрытием пластин, разъединить клетки, и подготовить одноклеточной подвески, как описано выше.
- Подсчитайте живые клетки с помощью гемоцитометра или автоматического счетчика клеток, включая трипан синий или другой маркер жизнеспособности.
- Плита клетки на покрытием 6 хорошо пластины на 0,5-1 х 106 клеток на хорошо в стволовых клетках средств массовой информации с 10 мкм ROCK ингибитор.
ПРИМЕЧАНИЕ: Для клеточных линий, протестированных в нашей лаборатории, эти плотности обычно приводили к 80-90% конфлюентных клеток в 24 ч Предварительной обработке DMSO. - Разрешить клеткам инкубировать в течение 24 ч при 37 градусах По Цельсия в инкубаторе CO2 (5% CO2,влажная атмосфера).
- Подготовка 1%-2% DMSO в прегретых стволовых клеток средств (например, 100 л DMSO в 10 мл средств массовой информации и 1% DMSO решение, или 200 Л Л DMSO в 10 мл средств массовой информации и 2% DMSO решение).
- После 24 ч инкубации, аспирация средств массовой информации из клеток и заменить его раствором DMSO.
- Разрешить клеткам инкубировать от 24 ч до 48 ч при 37 градусах По Цельсия в инкубаторе CO2 (5% CO2,влажная атмосфера) до дифференциации.
ПРИМЕЧАНИЕ: Как правило, 24 ч DMSO лечение достаточно по большинству человеческих линий ESC и iPSC. Сотовые линии с очень медленными темпами роста (долгое удвоение раз) могут извлечь выгоду из 48 ч инкубации с DMSO. Для инкубации 48 ч с DMSO, средства массовой информации могут быть заменены свежими стволовыми клетками с 1%-2% DMSO после первых 24 ч лечения.
-
Дифференциация 3D культуры:
- Когда клетки достигают соответствующей стельности, разъединяйте и собирайте клетки в суспензии клетки как описано выше.
- Подсчитайте живые клетки с помощью гемоцитометра или автоматического счетчика клеток, включая маркер жизнеспособности.
- Плита клетки в непокрытом, с низким уровнем крепления 6 хорошо пластины на 0,5-1 х 106 клеток на хорошо в стволовых клетках средств массовой информации с 10 мкм ROCK ингибитор.
ПРИМЕЧАНИЕ: Для клеточных линий, протестированных в нашей лаборатории, эти плотности обычно приводили к формированию сферы 3D hPSC в пределах 24 ч от установления клеток. - Разрешить клеткам инкубировать в течение 24 ч при 37 градусах По Цельсия в инкубаторе CO2 (5% CO2,влажная атмосфера).
- Подготовка 1%-2% DMSO в предгретых стволовых клетках (например, 100 л DMSO в 10 мл софта в средствах массовой информации и 1% DMSO решение, или 200 Л DMSO в 10 мл средств массовой информации и 2% DMSO решение).
- Замените носители следующих стандартных процедур (например, наклоните пластину под углом 30-45 градусов, чтобы клеточные сферы селились в нижней части колодца; переносите клетки в стерильную коническую трубку и позволяли клеточным сферам селиться в нижней части трубки; или аккуратно собирать клетки i n подвеска с помощью 5 или 10 мл пипетки в стерильной конической трубке и центрифугных ячеек при 300 х г в течение 5 мин на РТ).
- Аспирируйте носители из ячеек и заменяйте его раствором DMSO, мягко прокладывая трубку.
- Разрешить клеткам инкубировать от 24 ч до 48 ч при 37 градусах По Цельсия в инкубаторе CO2 (5% CO2,влажная атмосфера) до дифференциации.
ПРИМЕЧАНИЕ: Как правило, 24 ч DMSO лечение достаточно по большинству человеческих линий ESC и iPSC. Сотовые линии с очень медленными темпами роста (долгое удвоение раз) могут извлечь выгоду из 48 ч инкубации с DMSO. Для инкубации 48 ч с DMSO, средства массовой информации могут быть заменены свежими стволовыми клетками с 1%-2% DMSO после первых 24 ч лечения.
3. Дифференциация на первичные слои зародышей
ПРИМЕЧАНИЕ: Ниже описаны методы, ранее показанные как эффективные в нашей лаборатории для PSCs, выращенных в монослой на 6 скважинных пластинах. Любой протокол дифференциации выбора должен использоваться после лечения DMSO для содействия дифференциации в желаемых линий. Удалить раствор DMSO после обработки 24-48 h и продолжить дифференциацию в соответствии со стандартными протоколами.
-
Дифференциация эндодермов (адаптировано от Kroon et al.30)
- Предлечивая клетки с DMSO, как описано выше для 2D культур.
- Подготовьте решения Wnt3a и Activin A.
- Подготовьте день 1 эндодермальной дифференциации средств массовой информации, добавив Wnt3a к окончательной концентрации 20 нг / мл и Activin A до окончательной концентрации 100 нг/мл к соответствующему объему предварительно разогретых средств массовой информации RPMI.
- После предварительной обработки DMSO, аспирировать средства массовой информации из клеток и заменить его на день 1 средств массовой информации (например, 2 мл на скважину 6 хорошо пластины).
- Разрешить клеткам инкубировать в течение 24 ч при 37 градусах По Цельсия в инкубаторе CO2 (5% CO2,влажная атмосфера).
- Подготовьте дни 2 и 3 эндодермальной дифференциации носителей, добавив Activin A до конечной концентрации 100 нг/мл к соответствующему объему предварительно разогретых носителей RPMI.
- Аспирировать носители из клеток и заменить его на день 2 средств массовой информации (например, 2 мл на колодец 6 хорошо пластины).
- Разрешить клеткам инкубировать в течение 24 ч при 37 градусах По Цельсия в инкубаторе CO2 (5% CO2,влажная атмосфера).
- Аспирировать носители из клеток и заменить на 3-й день носителей (например, 2 мл на скважину из 6 хорошо пластины).
-
Мезодермдия (адаптировано от Чжан и др.31)
- Предобрачие клеток с DMSO, как описано выше для 2D культур.
- Подготовьте решения Wnt3a и Activin A.
- Подготовка мезодермальной дифференциации средств массовой информации, добавив Wnt3a к окончательной концентрации 20 нг / мл и Activin A до окончательной концентрации 100 нг/мл к соответствующему объему предварительно продвинутых средств массовой информации RPMI.
- После предварительной обработки DMSO, аспирировать средства массовой информации из клеток и заменить дифференциации средств (например, 2 мл на скважину 6 хорошо пластины).
- Разрешить клеткам инкубировать в течение 24 ч при 37 градусах По Цельсия в инкубаторе CO2 (5% CO2,влажная атмосфера).
-
Дифференциация эктодермов (адаптировано из Chambers et al.32)
- Предобрачие клеток с DMSO, как описано выше для 2D культур.
- Подготовьте фондовые решения Noggin и SB431542.
- Подготовка эктодермальной дифференциации базовых носителей путем растворения нокаут омлинии замены (KOSR) до окончательной концентрации 10% в нокаут DMEM.
ПРИМЕЧАНИЕ: Подготовьте достаточнобазовых носителей для 3-4 дней изменения мультимедиа. - Подготовьте эктодермальные средства дифференциации, добавив Noggin к конечной концентрации 500 нг/мл и SB431542 до конечной концентрации 10 мкм до соответствующего объема предварительно разогретого KOSR/knockout DMEM.
- После предварительной обработки DMSO, аспирировать средства массовой информации из клеток и заменить дифференциации средств (например, 2 мл на скважину 6 хорошо пластины).
- Разрешить клеткам инкубировать в течение 3-4 дней при 37 градусах Цельсия в инкубаторе CO2 (5% CO2,влажная атмосфера), заменяя средства массовой информации ежедневно свежедобавленными факторами дифференциации.
4. Дифференциация на типы клеток-прародителей
Ниже описаны методы, ранее показанные как эффективные в нашей лаборатории для PSCs, выращенных в 2D или 3D культур. Любой протокол дифференциации выбора должен использоваться после лечения DMSO для содействия дифференциации в желаемых линий. Удалить раствор DMSO после обработки 24-48 h и продолжить дифференциацию в соответствии со стандартными протоколами.
- Дифференциация клеток нейро-прародителя (адаптировано от Tchieu et al.33)
- Подготовка 6 хорошо пластин ы покрытием с плюрипотентной стволовых клеток квалифицированных снижение фактора роста матрицы или субстрата, в инструкции производителя, по крайней мере 1 ч в CO2 инкубатора (5% CO2, влажная атмосфера). Покрытые пластины могут быть завернуты пленкой и храниться при 4 градусах По Цельсию в течение 1 недели.
- Плита PSCs, как описано выше при плотности 0,5-1 х 106 клеток на хорошо в стволовых клеток, содержащих ингибитор ROCK.
- Предлечивая клетки с DMSO, как описано выше для 2D культур.
- Подготовьте небольшие химические ингибиторы LDN193189, SB431542 и XAV939.
- Подготовка Дней 1-3 нейроэктодерм дифференциации средств массовой информации путем дополнения Основные 6 Media с 500 нМ LDN193189, 10 мкм SB431542, и 2 мКМ XAV939.
- После предварительной обработки DMSO, аспирировать средства массовой информации и заменить дни 1-3 нейроэктодерм сми (например, 2 мл на скважину 6 хорошо пластины). Меняйте медиа ежедневно.
- Подготовка Дней 4-12 нейроэктодерм дифференциации средств массовой информации путем дополнения Основные 6 Media с 500 nM LDN193189 и 10 мкм SB431542.
- На 4 день дифференциации, аспирировать средства массовой информации и заменить дни 4-12 neurodectoderm средств массовой информации. Ежедневно меняйте средства массовой информации.
- После 12 дней дифференциации, дифференцированные клетки должны выразить соответствующие маркеры нейронных клеток-прародителей (NPCs). NPC можно и далее поддерживать в нейронных носителях, содержащих DMEM/F-12, 2% B-27, 1% N-2, и дополнены 10 мкг/мл базового фактора роста фибробластов (bFGF). Проход NPCs при слиянии с помощью решения отслоения ячейки, покрытие NPCs на 0,5-1 х 106 ячеек на скважину.
- Дифференциация клеток-прародителей олигодендроцитов (адаптировано от Дуварас и Фоссати34)
- Плита PSCs, как описано выше, при плотности 1 х 105 на хорошо на покрытием 6 хорошо пластин в стволовых клеток средств, содержащих ингибитор ROCK.
- Предлечивая клетки с DMSO, как описано выше для 2D культур.
- Подготовьте SB431542, LDN193189, всетрансретиновую кислоту (РА) и сглаженные агонистические (SAG) стоковые растворы.
- Подготовьте дни 0-8 дифференциации средств массовой информации путем дополнения DMEM / F-12 с 10 мкм SB431542, 250 nM LDN193189, и 100 нм РА.
- После предварительной обработки DMSO, инкубировать клетки с дифференциацией средств в течение 8 дней, изменение средств массовой информации ежедневно с недавно добавил факторов дифференциации (например, 2 мл на хорошо 6 хорошо пластины).
- На 8-й день замените носитель DMEM/F-12, содержащий 1x MEM несущественные аминокислоты (NEAA), 1X L-глютамин, 2-меркаптоэтанол, пенициллин/стрептомицин и 1x N-2, дополненные 100 нМ РА и 1 ММ САГ. Ежедневно меняйте средства массовой информации.
- После 12 дней дифференцации, дифференцированные клетки должны выразить соответствующие маркеры олигодендроцитов клеток-родителей (OPCs).
- Дифференциация клеток эндокринного прародителя (адаптировано от Pagliuca et al.35)
- Семена PSCs на 6 х 105 клеток / мл в стволовых клеток средств массовой информации плюс 10 мкм ROCK ингибитор в 500 мл спиннер фляги размещены на 9-позиционная пластина перемешать набор при скорости вращения 70 оборотов в 37 C инкубатор, 5% CO2, и 100% влажности.
- Разрешить кластеров поселиться в нижней части колбы, аспирировать средства массовой информации, а затем pretreat с 1%-2% DMSO.
- Подготовка Activin A, Chir99021, KGF, Sant1, все-трансретиной кислоты (РА), LDN193189, PdBU, XXI, Alk51, T3, и Betacelluin фондовых решений.
- Подготовка базовых носителей дифференциации на основе формулировки в таблице 3.
- После предварительной обработки DMSO, аспирные носители и заменить S1 сми дополнены 100 нг/мЛ Активин А и 3 мМ Chir99021 (например, 500 мл на колбу). Разрешить инкубацию на 24 ч.
- На второй день, заменить средства массовой информации с S1 СМИ дополнены 100 нг / мЛ Activin A. Разрешить инкубацию в течение 2 дней.
- На 4-й день замените носители S2-мультимедиа, дополненные 50 ng/mL KGF. Разрешить инкубацию в течение 3 дней, меняя носители после первых 2 дней (День 6).
- На 7-й день замените носители S3, дополненные 50 ng/mL KGF, 0.25 mM Sant1, 2 mM RA и 200 nM LDN193189. Разрешить инкубацию на 24 ч.
- На 8-й день замените сми S3-медиа, дополненные 50 ng/mL KGF, 0,25 мМ Sant1, 2 мМ РА, 200 нМ LDN193189 и 500 nM PdBU. Разрешить инкубацию на 24 ч.
- На 9-й день замените носители S3-мультимедиа, дополненные 50 ng/mL KGF, 0.25 mM Sant1 и 100 nM RA. Разрешить инкубацию в течение 5 дней, меняя носители каждые 2 дня (день 11 и 13).
- В дни 14 и 16, заменить средства массовой информации с S5 СМИ дополнены 0,25 мМ Sant1, 100 нм РА, 1 мМ XXI, 10 мМ Alk5i II, 1 мМ T3, и 20 нг /мл бетацеллюлин (4 дня общей инкубации).
- В дни 18 и 20, заменить средства массовой информации с S5 СМИ дополнены 25 нМ РА, 1 мМ XXI, 10 мМ Alk5i II, 1 мМ T3, и 20 нг /мл бетацеллюлин.
5. Иммуноцитохимическая проверка дифференциации
ПРИМЕЧАНИЕ: Следующие методы описывают общий иммуноцитохимический протокол, который может быть скорректирован по мере необходимости. Первичные антитела – это те, которые были ранее проверены в нашей лаборатории. Другие методы проверки дифференциации также могут быть использованы (например, цитометрия потока, qPCR, секвенирование РНК, западные промотирования, функциональные анализы и т.д.).
-
Иммуномаркировка клеток
- Для 3D культур в подвеске, пластины целые клеточные кластеры или кластеры рассеялись в одноклеточной подвески на покрытиепластиных пластин для 18-24 ч до фиксации.
- Аспирируем носители из клеток адептов и кратко мыть с PBS на RT на шейкере.
- Для клеточной фиксации, аспирировать PBS и инкубировать клетки с 4% параформальдегида (PFA) в PBS в течение 20 минут на RT на шейкер.
ПРЕДЕКТО: PFA акции должны быть подготовлены под дымом капот из-за его токсичности. Не вдыхайте и носите надлежащее индивидуальное защитное оборудование. - Удалить PFA и выбросить в надлежащем контейнере химических отходов.
- Вымойте клетки 3x с PBS, по крайней мере 5 мин за стирку на RT на шейкере.
- Для промежности и блокирования клеток инкубируют клетки с 5% сывороткой осла, приготовленные в 0,3% тритона-х 100/PBS за 1 ч при RT на шейкере.
- Подготовка первичного раствора антител в том же растворе, используемом для пермяковизации/блокировки.
- Инкубировать в первичном растворе антитела на ночь при 4 градусах по шейкеру.
- После ночной инкубации, мыть клетки 3x с PBS, по крайней мере 5 минут на мытье на RT на шейкере.
- Подготовка вторичного антитела решение в permeabilization / блокирование решения.
- Разрешить инкубировать во вторичном растворе антитела в течение 1 ч при РТ на шейкере.
- Аспирируй вторичный раствор антитела и мыть клетки 3x с PBS, по крайней мере 5 минут на мытье на RT на шейкере.
- Инкубировать клетки с DAPI или другой предпочтительный маркер для соответствующего времени инкубации, и промыть в PBS.
-
Количественная оценка изображения
- Приобретите минимум три изображения на состояние на флуоресцентном микроскопе и/или с платформой скрининга с высоким содержанием.
- Количественная оценка процента положительных клеток для каждого маркера путем подсчета общего числа окрашенных антител и общего числа клеток (на основе dAPI/Hoechst ядерок окрашивания) с помощью беспристрастного программного обеспечения изображений (например, ImageJ) или автоматизированной платформы скрининга для Анализ.
Результаты
Морфология ДМСО лечится iPSCs
МпСК человека, полученные из контрольных объектов, культивировались либо в адепте 2D монослой, либо в 3D-клеточных сферах в подвеске. Приблизительно 24 ч после первоначального покрытия, клетки были обработаны либо 1% или 2% DMSO для 24 ч в среде обслуживания. Представитель ярко-поля изображения после лечения DMSO показаны на рисунке 1. В соответствии с предыдущими отчетами для iPSCs поддерживается в монослой3, DMSO предварительной обработки привело к переходной дозы зависит снижение темпов роста по сравнению с не-DMSO обработанных клеток (Рисунок 1A). Это снижение пролиферации связано с увеличением контакта между клетками и клетками, что особенно выражено в 2% обработанных клетках DMSO, демонстрирующих повышенное образование более высоко кластерных клеточных колоний. В других типах клеток, DMSO-индуцированных G1 арест был показан, чтобы быть связаны с увеличением экспрессии белков, участвующих в клеточных клеток взаимодействий, которые поддерживают контакт-ингибирование индуцированного роста ареста36. В iPSCs поддерживается как 3D-клеточных сфер, DMSO лечение аналогичным образом увеличилось количество клеточных сфер(Рисунок 1B). Кроме того, лечение DMSO также привело к менее переменным размерам 3D сферы, что ранее было показано, что свидетельствует об улучшенной дифференциации потенциала клеток37. Важно отметить, что ни 1%, ни 2% DMSO не привели к токсичности клеток, измеряемой по количеству жизнеспособности (n No 3; 2D-культура % живой - контроль: 80 и 1,3; 1% ДМСО: 82 и 3,7, 2%: 81 - 2,7; 3D-культура % живые - контроль: 81 - 4,3; 1% DMSO: 82 В целом, эти результаты согласуются с понятием, что лечение DMSO изменяет цикл клеток и модели роста в культивированных стволовых клетках. Эти эффекты на ингибирование роста обратимы, когда DMSO удаляется из среды, как ранее показано3.
Обработка DMSO улучшает дифференциацию ESC к главным образом слоям зародыша
HUES6 hESCs были посеяны на покрытием пластин для 24 ч с последующим лечением с 2% DMSO для 24 ч в среде обслуживания. Клетки были затем дифференцированы в три первичных слоя микробов после парадигмы лечения показано на рисунке 2A30,31,32. Дифференцированные клетки были затем зафиксированы и иммунологически окрашены для прототипических маркеров каждого соответствующего слоя зародыша (SOX17 для эндодерма, brachyury для мезодерма, и SOX1 для эктодерма). Как показано на рисунке 2B, 24 ч предварительной обработки с 2% DMSO увеличилась доля клеток, выражающих каждый соответствующий маркер зародышевого слоя. Это согласуется с предыдущими отчетами из нашей лаборатории, показывающими повышенную иммунореактивность, экспрессию генов, а также абсолютное количество дифференцированных клеток ко всем зародышевым слоям в стволовых клетках, обработанных DMSO3,5. HUES6 является линией hESC с очень низкой склонностьюк дифференциации во всех линиях 1, но лечение DMSO существенно улучшает его способность дифференцироваться во всех слоях микробов.
Лечение DMSO улучшает дифференциацию к типам клеток-прародителей
Для исследования влияния DMSO на дифференциацию типов клеток-прародителей ЦНС, iPSCs человека были дифференцированы либо к нервным клеткам-прародителям (NPC), либо к клеткам-прародителям(OPCs). Для генерации NPC, клетки были предварительно обработаны с 2% DMSO для 24 ч в среде обслуживания следуют 12 дней направленной дифференциации33 (рисунок 3A). Как показано на рисунке 3B, 2% DMSO предварительной обработки увеличили выражение NPC маркер PAX6 по сравнению с контролем. Используя другой ранее проверенный протокол34 (рисунок 3C),iPSCs были дифференцированы в течение 12 дней в OPCs. Как и NPCs, OPCs, полученные из iPSCs предварительно обработанных с 2% DMSO для 24 ч продемонстрировали увеличение доли клеток, выражающих OPC маркеры OLIG2 (Рисунок 3D).
Первоначальная обработка DMSO упорствует для того чтобы увеличить дифференциацию в возмужалые типы клетки
Для исследования влияния DMSO на последние этапы протокола дифференциации, HUES8 hESCs были предварительно обработаны для 24 h с 2% DMSO до дифференциации к клеткам после 20-дневного направленного протокола дифференциации, описанного на рисунке 4a 35. HUES8 были использованы, как они ранее было показано, что имеют более высокую склонность к эндодермальной линии1,38. На определенной стадии эндодерма дифференцированные клетки выражают SOX17 и FOXA2, окончательные эндодермы (DE) специфические маркеры. С более дальнеишной дифференцированием вprogenitors поджелудочной железы (PP 1) этап, дифференцированные клетки выражают PDX1 и FOXA2, маркеры характерные поджелудочная клетки прародителя. На этих стадиях дифференциации клеток поджелудочной железы, эффективность индукции в DE и впоследствии в PP1 были высокими для контроля и DMSO-обработанных ГЭС дифференцированных в каждом из этих этапов (Рисунок 4B, этапы 1 и 3). Даже если HUES8 клеточной линии было отмечено, что повышенная склонность дифференцировать в эндодермальной линии, как дифференциация индуцируется далее в более специализированных типов клеток на терминальных стадиях DMSO-обработанных hESCs гораздо больше может производить зрелые эндокринные клетки поджелудочной железы. Эффективность генерации PDX1/NKX6.1 "клетки-прародители поджелудочной железы, Нейрогенин 3" эндокринных клеток, и NKX6.1/C-пептидные SC-я клетки были значительно выше в DMSO-обработанных ГЭСС(Рисунок 4B, этапы 4 и 5). Эти результаты соответствуют дифференциации NPC и OPC, показывающей, что DMSO повышает потенциал дифференциации типов клеток-прародителей, а также показывает, что эффект ДМСО является устойчивым в генерации более специализированных типов клеток. Это согласуется с предыдущей работой, где мы показали, что начальная обработка DMSO 24 ч увеличивает дифференциацию на типы клеток терминальных клеток в зародышевых слоях, в том числе в нейронные клетки, а также избиение кардиомиоцитов31,39 в клеточных линиях с высокими или плохими склонностями для дифференциации3.
Начальное лечение DMSO улучшает функцию клеток, полученных hESC после трансплантации in vivo
Ранее мы продемонстрировали эффективность лечения ДМСО в повышении дифференциации hESCs в функциональных клеток-прародителей поджелудочной железы, которые позже показывают заметное улучшение секреции инсулина in vivo3. Используя ранее опубликованные протоколы3,30,40, HUES8 hESCs лечились с 1% DMSO для 24 ч, дифференцированы в клетки-предтеча поджелудочной железы, и пересажены в иммунодефицитные SCID-Бежевые мыши для оценки функциональность (например, секреция инсулина в ответ на вызов глюкозы или стимуляции KCl)(рисунок 5А). В то время как эффективность дифференциации в FOXA2 » (90%) и PDX1 ( родословных поджелудочной железы были сопоставимы между контрольом и DMSO-обработанных hESCs(Рисунок 5B) для HUES8 hESC линии, клетки дифференцированы от hESCs после 24 ч 1% DMSO лечение улучшило отзывчивость к глюкозе и KCl стимуляция после трансплантации in vivo. Улучшения в функциональности были очевидны в течение 2 недель после трансплантации(рисунок 5C) и сохраняется до по крайней мере 16 недель после трансплантации (рисунок5D). Взятые вместе, эти результаты показывают, что DMSO предварительной обработки не только увеличивает эффективность дифференциации зародышевых слоев, клеток-прародителей, и более зрелые типы клеток, но и что она сохраняется для повышения функциональности дифференцированных клеток in vivo.
| Дифференцированный тип ячейки | Тип исходной ячейки | %DMSO | Длительность лечения DMSO | Длительность лечения DMSO |
| Печеночные клетки | Esc Линия клеток гепатомы Esc Esc Мезенхимальные стволовые клетки iPSCs Esc Esc Линия клеток гепатомы Esc | 1.0 1.0 1.0 0,5 0,1-2,0 1.0 1.0 0,5 1.0 0,6 | 8 дней Несколько дней 7 дней 10-14 дней 7-21 дней 7 дней 4 дня 5 дней 2-21 дней Течение | Басма и др., 2008 Канебратт и Андерссон, 2008 Hay et al., 2009 Дуань и др., 2010 Ализаде и др., 2014 Кондо и др., 2014 Школьницкая и др., 2014 Czysz et al., 2015 Николау и др., 2016 Vanhove et al., 2016 |
| Первичные слои микробов | ESC и iPSC hESC hESC | 0,1-2,0 0,5 0,1-2,0 | 24 часа 24 часа 24 часа | Chetty et al., 2013 Chetty et al., 2015 Li et al., 2018 |
| Сердечные клетки | ESC и iPSC Ячейки P19 ESC и iPSC Фетальные мезенхимальные стволовые клетки | 0,1-2,0 1.0 1.0-2.0 0,8-1,0 | 24 часа 4 дня 24-30 часов 24 часа | Chetty et al., 2013 Цой и др., 2014 ван ден Берг и др., 2016 Дэн и др., 2017 |
| Клетки поджелудочной железы | ESC и iPSC hESC | 0,1-2,0 0,5 | 24 часа 24 часа | Chetty et al., 2013 Chetty et al., 2015 |
| Гладкие мышечные клетки | Ячейки P19 | 1.0 | 4 дня | Цой и др., 2014 |
| Эндотелиальные клетки | Ячейки P19 | 1.0 | 4 дня | Цой и др., 2014 |
| Энтероцитов | iPSCs | 0-1.6 | 4 дня | Огаки и др., 2015 |
| Гут эпителий | iPSCs | 0-1.6 | 4 дня | Огаки и др., 2015 |
| Нейронные клетки | Мармосет iPSC | 0,05-2,0 | 24 часа | Цю и др., 2015 |
| Нейтрофилов | Линия клеток лейкемии | 1,25 | 6-8 дней | Теймурян и Моганлу, 2016 |
| Скелетные миотубебы | iPSCs | 1,5 | 24 часа | Шварц и др., 2016 |
| Кортический органоид | hiPSCs | 1.0 | 24 часа | Yoon et al., 2018 |
Таблица 1: Резюме ранее опубликованной работы, демонстрирующей благотворное влияние лечения DMSO на дифференциацию.
| S1 | S2 | S3 | S5 | |
| MCDB131 (L) | 1 | 1 | 1 | 1 |
| Глюкоза (г) | 0,44 | 0,44 | 0,44 | 3.6 |
| NaHCO3 (г) | 2.46 | 1.23 | 1.23 | 1.754 |
| ФАФ-БСА (г) | 20 | 20 | 20 | 20 |
| ITS-X (мЛ) | 0,02 | 0,02 | 5 | 5 |
| Глутамакс (мЛ) | 10 Лет | 10 Лет | 10 Лет | 10 Лет |
| Витамин С (мг) | 44 | 44 | 44 | 44 |
| Гепарин (мг) | 0.00 | 0.00 | 0.00 | 10 Лет |
| P/S (мЛ) | 10 Лет | 10 Лет | 10 Лет | 10 Лет |
Таблица 2: Компоненты эндокринные протеже клеточной дифференциации базовых носителей.
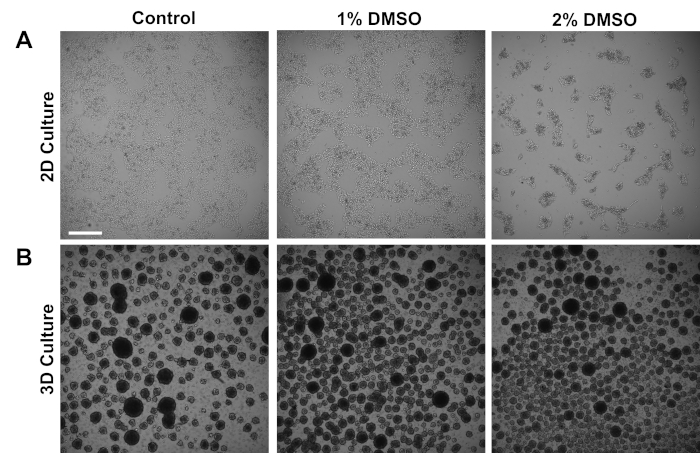
Рисунок 1 : Лечение DMSO изменяет рост HPSCs. (A) Представитель яркие изображения hiPSCs покрытием в монослой после получения лечения (контроля) или лечения с 1% или 2% DMSO для 24 ч. DMSO способствует переходного доза-зависимых ингибирование роста iPSCs. (B) Представитель яркие изображения hiPSCs покрытием на низкой привязанности пластин, чтобы 3D формирование сферы после получения без лечения (контроль) или лечения с 1% или 2% DMSO для 24 ч. DMSO лечение приводит к менее переменной 3D формирования сферы по сравнению с контролем. Шкала бар 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
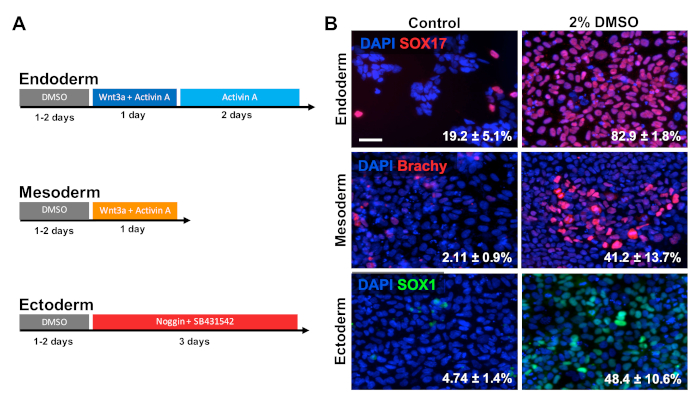
Рисунок 2 : Лечение DMSO улучшает дифференциацию hPSCs к первичным слоям зародыша. (A) Схема протоколов дифференциации, используемых для генерации трех первичных слоев микробов. (B) Репрезентативные изображения дифференцированных HUES6 hESCs иммуномаркировки для SOX17 (эндодерм), brachyury (мезодерм) и SOX1 (эктодерм). Предварительная обработка 2% DMSO на 24 ч повысила эффективность дифференциации во всех трех слоях микробов. Проценты клеток, дифференцирующихся в SOX17 "эндодермальный, Brachyury (Брахи) " мезодермальных, или SOX1" эктодермальных клеток после направленной дифференциации в каждый слой зародыша контроля и DMSO-обработанных hESCs отмечены с SEM из трех биологических репликаций . Непарный t-тест: эндодерм р - 0,0003; мезодерм р - 0,047; эктодерм р 0,015. Шкала бар 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
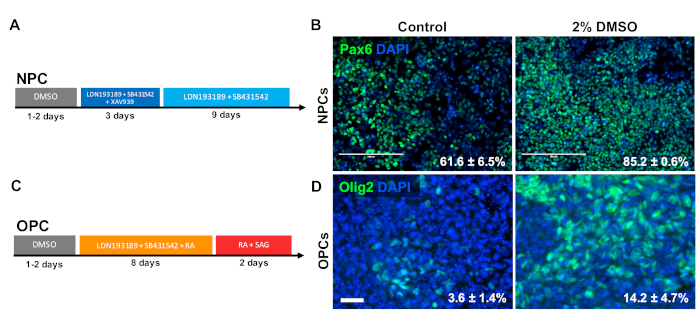
Рисунок 3 : Лечение DMSO улучшает дифференциацию к типам клеток нейронных прародителей. (A) Схема протокола дифференциации, используемая для генерации нейронных клеток-прародителей (NPCs). (B) Репрезентативные изображения человека iPSCs дифференцированы в NPCs иммуномаркировки для Pax6. 24 ч предварительной обработки с 2% DMSO увеличилось количество положительных клеток PAX6. Проценты клеток, дифференивирующихся на Pax6" NPCs после направленной дифференциации контроля и DMSO-обработанных iPSCs человека отмечены с SEM трех биологических репликаций. Неспаренный t-тест: р 0,0225. Шкала бар No 200 мкм. (C) Схема дифференциации протокола, используемого для создания олигодендроцитов клеток-родителей (OPCs). (D) Репрезентативные изображения человека iPSCs дифференцированы в OPCs иммуномаркировки для OPC маркеров Olig2. 24 ч предварительной обработки с 2% DMSO увеличило выражение обоих маркеров OPC по сравнению с контролем. Проценты клеток, дифференивируемых в OPCs Olig2", после направленной дифференциации контроля и обработанных ДМСО iPSCs человека отмечены с SEM четырех биологических репликаций. Неспаренный t-тест: р 0,0466. Шкала бар 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
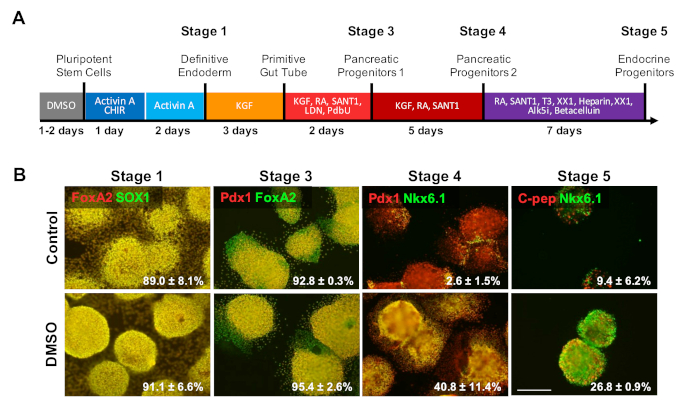
Рисунок 4 : Лечение DMSO повышает потенциал терминальной дифференциации hPSCs. (A) Схема 20 дней направлена дифференциации HUES8 hESCs в неизлечимо дифференцированных эндокринных клеток поджелудочной железы. (B) Иммунопятно для указанных маркеров на каждом этапе дифференциации после направленной дифференциации необработанных контрольных клеток и клеток, предварительно обработанных 2% ДМСО на 24 ч. Первоначальная обработка DMSO упорствует для того чтобы увеличить дифференциацию в терминальные типы эндокринных клеток на последних этапах направленной дифференциации. Проценты клеток, диффереприративающихся в указанные маркеры на каждом этапе дифференциации после направленной дифференциации контроля и Обработанных ДМСО HESCs отмечены с SEM от двух до четырех биологических репликаций. Шкала бар 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
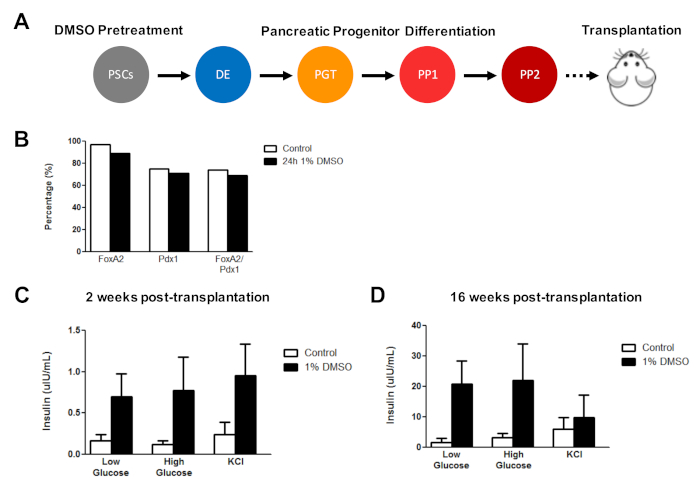
Рисунок 5 : Первоначальная обработка HMSO hPSCs повышает отзывчивость глюкозы после трансплантации клеток-прародителей поджелудочнойжелезы in vivo. (A) Схема направленной дифференциации (15 дней) HUES8 hESCs в клетки-прародители поджелудочной железы (PP2) после отсутствия лечения (контроля) или 24 ч 1% Лечения ДМСО и последующей трансплантации (5 млн. клеток) в иммунодефицитные МЫшей SCID-Beige. (B) Процент клеток, дифференцирующихся в PDX1 и FOXA2 "поджелудочной железы клетки-предтечи после in vitro направлены дифференциации контроля и DMSO-обработанных hESCs непосредственно перед трансплантацией (n No 1). (C) Средние измерения ELISA человеческого инсулина из сыворотки мышей после низкой (2,5 мМ) или высокой (15 мМ) глюкозы вызов или хлорид калия (KCl) стимуляции на (C) 2 недели и (( D) 16 недель после трансплантации поджелудочной железы клетки-прародители дифференцированы от контрольных и обработанных DMSO hESC (ошибки баров SEM; n 3 в 2 недели и 16 недель для контроля; n No 2 в 2 недели и 16 недель для DMSO). Двусторонний ANOVA: стр. 0,0051 для контроля против DMSO в течение 2 недель; р 0,0116 для контроля против DMSO в 16 недель. Мышей, изученных в разных точках времени, отличаются. Результаты адаптированы из Chetty et al.3. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Таким образом, этот протокол описывает простой и недорогой инструмент для повышения дифференциации потенциала плюрипотентных стволовых клеток (PSCs) для всех первичных слоев микробов, различные типы специализированных клеток-прародителей, и даже функциональные, зрелые типы клеток в пробирке и настройки in vivo. Иллюстрированные конкретные протоколы дифференциации, которые были эффективно воспроизведены в нашей лаборатории, а также другие, но любой протокол дифференциации выбора может быть использован после лечения DMSO. Как показано в таблице 1, ряд лабораторий также продемонстрировали повышение дифференциации PSC после переходного лечения DMSO с использованием различных парадигм для создания различных других типов терминальных клеток. Кроме того, хотя методы здесь описывают использование человека PSCs, DMSO предварительной обработки могут быть использованы для различных видов и было показано, чтобы быть эффективным в мыши, кролика и приматов PSCs.
Хотя более высокие дозы ДМСО, как известно, цитотоксические, низкие дозы, используемые в этом методе (1%-2%) для переходного периода приводит к минимальной гибели клеток. В то время как общие номера клеток сразу после лечения DMSO может уменьшиться из-за DMSO поощрения ареста клеточного цикла в фазе G1 клеточного цикла, предыдущие исследования показывают, что клетки способны достичь того же уровня спущения, как контроль культур после удаления DMSO3.
Процент и продолжительность предварительной обработки DMSO должны быть оптимизированы на одну клеточную линию. Время лечения должно быть скорректировано с учетом велосипедного / удвоения времени клеток. Например, мышь PSCs, как правило, имеют гораздо короче время езды на велосипеде около 15 ч; таким образом, лечение DMSO для 15 ч для этих клеток является достаточным. Некоторые лаборатории также обнаружили, что лечение DMSO будет полезным при продолжении протокола дифференциации или при более низких концентрациях (см. таблицу 1). Следует отметить, что некоторые линии ПСК более корректируются в дифференциации к конкретным линиям. Например, клетки HUES6 оказались менее разрешительными для дифференциации и, таким образом, заметно улучшились с помощью лечения ДМСО(рисунок 2). Кроме того, было показано, что клетки HUES8, используемые на рисунке 4 и рисунке 5, имеют более высокую склонность к эндодермальной дифференциации; таким образом, было выявлено меньше различий между контролем и ДМСО в отношении дифференциации на начальных этапах в направлении окончательного эндодерма. Тем не менее, повышение Предварительной обработки DMSO наблюдается на более поздних стадиях дифференциации в этой клеточной линии(рисунок 4B). Обработка DMSO также разносторонни в что она эффективна как в системах 2D и 3D клеточных культур, она может быть использована с различными типами материала покрытия на плитах культуры клетки, и она работает в по-разному типах средства обслуживания которые повышают рост и расширение hPSCs (например, mTeSR, E8, MEF условные носители и т.д.).
В более общем плане эти результаты свидетельствуют о том, что начальное состояние плюрипотентных стволовых клеток оказывает сильное влияние на склонность к первоначальной дифференциации, а также терминальную дифференциацию на функциональные типы клеток. Ранее мы показали, что лечение DMSO функции через Rb в hPSCs3,5. Rb играет важную роль в содействии терминальной дифференциации, выживанию клеток и генетической стабильности клеток41,42,43,44, и поэтому может объяснить постоянное воздействие на клетки дифференцированный от DMSO-обработанных hPSCs. Ориентация на эти ранние способы регулирования может поставить hPSCs на лучшую траекторию для дифференциации и в конечном итоге улучшить их полезность для регенеративной медицины.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантами Школы медицины Стэнфордского университета и стипендией Сибеля, присужденной С.С.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 21985023 | |
| 6-well Clear Flat Bottom TC-treated Multiwell Cell Culture Plate | Corning | 353046 | |
| 9-Position stir plate | Chemglass | CLS-4100 | |
| Accutase | Gibco | 11105-01 | |
| Activin A | R&D Systems | 338-AC | |
| Advanced RPMI | Gibco | 12633012 | |
| Alk5i II | Axxora | ALX-270-445 | |
| all-trans retinoic acid | Sigma-Aldrich | R2625 | |
| anti-Brachyury | R&D Systems | AF2085 | No variablity observed across different lot numbers |
| anti-C-peptide | Developmental Studies Hybridoma Bank | GN-ID4 | No variablity observed across different lot numbers |
| anti-FoxA2 | Millipore | 07-633 | No variablity observed across different lot numbers |
| anti-Nkx2.2 | University of Iowa, Developmental Hybridoma Bank | 74.5A5 | No variablity observed across different lot numbers |
| anti-Nkx6.1 | University of Iowa, Developmental Hybridoma Bank; | F55A12-supernatant | No variablity observed across different lot numbers |
| anti-Olig2 | EMD Millipore | MABN50 | No variablity observed across different lot numbers |
| anti-Pax-6 | Biolegend | 901301 | No variablity observed across different lot numbers |
| anti-Pdx1 | R&D Systems | AF2419 | No variablity observed across different lot numbers |
| anti-SOX1 | R&D Systems | AF3369 | No variablity observed across different lot numbers |
| anti-SOX17 | R&D Systems | AF1924 | No variablity observed across different lot numbers |
| B-27 Supplement, minus Vitamin A | Gibco | 12587010 | |
| basic fibroblast growth factor | Gibco | PHG0264 | |
| Betacellulin | Thermo Fisher Scientific | 50932345 | |
| Chir99021 | Stemgent | 04-000-10 | |
| CMRL 1066 | Corning | 99-603-CV | |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAF1000 | |
| D-(+)-Glucose | Sigma | G7528 | |
| DAPI | Invitrogen | D1306 | |
| Disposable Spinner Flasks | Corning, VWR | 89089-814 | |
| DMEM/F-12 | Gibco | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Essential 6 Media | Gibco | A1516501 | |
| FAF-BSA | Proliant | 68700 | |
| FGF7 | PeproTech | 100-19 | |
| Geltrex | Gibco | A1413202 | |
| GlutaMAX | Gibco | 35050061 | |
| Heparin | Sigma | H3149 | |
| Human Ultrasensitive Insulin ELISA | ALPCO Diagnostics | 80-INSHUU-E01.1 | |
| ITS-X | Invitrogen | 51500056 | |
| KGF | Peprotech | AF-100-19 | |
| Knockout DMEM | Gibco | 10829018 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| L-3,3′,5-Triiodothyronine (T3) | EMD Millipore | 642245 | |
| LDN193189 | Stemgent | 04-0074 | |
| Matrigel Matrix | Corning | 354277 | |
| MCDB-131 | Cellgro | 15-100-CV | |
| MEM NEAA | Gibco | 11140050 | |
| mTeSR 1 | StemCell Technologies | 5850 | |
| N2 Supplement | Life Technologies | 17502048 | |
| NaHCO3 | Sigma | S3817 | |
| Noggin Fc Chimera Protein | R&D Systems | 3344-NG-050 | |
| PdBU | EMD Millipore | 524390 | |
| Penicillin/Streptomycin | Mediatech | 30-002-CI | |
| RPMI | Gibco | 11875-093 | |
| Sant1 | Sigma-Aldrich | S4572 | |
| SB431542 | Stemgent | 04-0010 | |
| Smoothened Agonist, SAG | EMD Millipore | 566660 | |
| StemPro Accutase | Gibco | A1110501 | |
| TrypLE | Gibco | 12604013 | |
| Ultra-Low Attachment Microplates | Corning | 3471 | |
| Vitamin C | Sigma-Aldrich | A4544 | |
| Wnt3a | R&D Systems | 5036-WN | |
| XAV 939 | Tocris | 3748 | |
| XXI | EMD Millipore | 565790 | |
| Y-27632 | StemCell Technologies | 72302 |
Ссылки
- Osafune, K., et al. Marked differences in differentiation propensity among human embryonic stem cell lines. Nature Biotechnology. 26 (3), 313-315 (2008).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Review Genetics. 15 (2), 82-92 (2014).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Conklin, J. F., Sage, J. Keeping an eye on retinoblastoma control of human embryonic stem cells. Journal of Cellular Biochemistry. 108 (5), 1023-1030 (2009).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110 (2018).
- Hartwell, L. H., Weinert, T. A. Checkpoints: controls that ensure the order of cell cycle events. Science. 246 (4930), 629-634 (1989).
- Pardee, A. B. G1 events and regulation of cell proliferation. Science. 246 (4930), 603-608 (1989).
- Orford, K. W., Scadden, D. T. Deconstructing stem cell self-renewal: genetic insights into cell-cycle regulation. Nature Review Genetics. 9 (2), 115-128 (2008).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453 (7194), 519-523 (2008).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells. 26 (4), 894-902 (2008).
- Duan, Y., et al. Differentiation and characterization of metabolically functioning hepatocytes from human embryonic stem cells. Stem Cells. 28 (4), 674-686 (2010).
- Szkolnicka, D., Farnworth, S. L., Lucendo-Villarin, B., Hay, D. C. Deriving functional hepatocytes from pluripotent stem cells. Current Protocols in Stem Cell Biology. 30, 1-12 (2014).
- Vanhove, J., et al. H3K27me3 Does Not Orchestrate the Expression of Lineage-Specific Markers in hESC-Derived Hepatocytes In Vitro. Stem Cell Reports. 7 (2), 192-206 (2016).
- Kanebratt, K. P., Andersson, T. B. Evaluation of HepaRG cells as an in vitro model for human drug metabolism studies. Drug Metabolism & Disposition. 36 (7), 1444-1452 (2008).
- Nikolaou, N., Green, C. J., Gunn, P. J., Hodson, L., Tomlinson, J. W. Optimizing human hepatocyte models for metabolic phenotype and function: effects of treatment with dimethyl sulfoxide (DMSO). Physiological Reports. 4 (21), (2016).
- Kondo, Y., et al. An efficient method for differentiation of human induced pluripotent stem cells into hepatocyte-like cells retaining drug metabolizing activity. Drug Metabolism Pharmacokinetics. 29 (3), 237-243 (2014).
- Alizadeh, E., et al. The effect of dimethyl sulfoxide on hepatic differentiation of mesenchymal stem cells. Artificial Cells, Nanomedicine, and Biotechnology. 44 (1), 157-164 (2016).
- Czysz, K., Minger, S., Thomas, N. DMSO efficiently down regulates pluripotency genes in human embryonic stem cells during definitive endoderm derivation and increases the proficiency of hepatic differentiation. PLoS One. 10 (2), 0117689 (2015).
- Ogaki, S., Morooka, M., Otera, K., Kume, S. A cost-effective system for differentiation of intestinal epithelium from human induced pluripotent stem cells. Scientific Reports. 5, 17297 (2015).
- Choi, S. C., et al. Mixl1 and Flk1 Are Key Players of Wnt/TGF-beta Signaling During DMSO-Induced Mesodermal Specification in P19 cells. Journal of Cellular Physiology. 230 (8), 1807-1821 (2015).
- Chetty, S., et al. A Src inhibitor regulates the cell cycle of human pluripotent stem cells and improves directed differentiation. Journal of Cell Biology. 210 (7), 1257-1268 (2015).
- Qiu, Z., et al. Marmoset induced pluripotent stem cells: Robust neural differentiation following pretreatment with dimethyl sulfoxide. Stem Cell Research. 15 (1), 141-150 (2015).
- Swartz, E. W., et al. A Novel Protocol for Directed Differentiation of C9orf72-Associated Human Induced Pluripotent Stem Cells Into Contractile Skeletal Myotubes. Stem Cells Translational Medicine. 5 (11), 1461-1472 (2016).
- Teimourian, S., Moghanloo, E. Thwarting PTEN Expression by siRNA Augments HL-60 Cell Differentiation to Neutrophil-Like Cells by DMSO and ATRA. DNA Cell Biology. 35 (10), 591-598 (2016).
- van den Berg, C. W., Elliott, D. A., Braam, S. R., Mummery, C. L., Davis, R. P. Differentiation of Human Pluripotent Stem Cells to Cardiomyocytes Under Defined Conditions. Methods in Molecular Biology. 1353, 163-180 (2016).
- Deng, F., et al. Combination of retinoic acid, dimethyl sulfoxide and 5-azacytidine promotes cardiac differentiation of human fetal liver-derived mesenchymal stem cells. Cell Tissue Bank. 17 (1), 147-159 (2016).
- Yoon, S. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2018).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637 (2018).
- Kroon, E., et al. Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo. Nature Biotechnology. 26 (4), 443-452 (2008).
- Zhang, P., et al. Short-term BMP-4 treatment initiates mesoderm induction in human embryonic stem cells. Blood. 111 (4), 1933-1941 (2008).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Tchieu, J., et al. A Modular Platform for Differentiation of Human PSCs into All Major Ectodermal Lineages. Cell Stem Cell. 21 (3), 399-410 (2017).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Fiore, M., Degrassi, F. Dimethyl sulfoxide restores contact inhibition-induced growth arrest and inhibits cell density-dependent apoptosis in hamster cells. Experimental Cell Research. 251 (1), 102-110 (1999).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Bock, C., et al. Reference Maps of human ES and iPS cell variation enable high-throughput characterization of pluripotent cell lines. Cell. 144 (3), 439-452 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- D'Amour, K. A., et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nature Biotechnology. 24 (11), 1392-1401 (2006).
- Jacks, T., et al. Effects of an Rb mutation in the mouse. Nature. 359 (6393), 295-300 (1992).
- Nguyen, D. X., Baglia, L. A., Huang, S. M., Baker, C. M., McCance, D. J. Acetylation regulates the differentiation-specific functions of the retinoblastoma protein. The EMBO Journal. 23 (7), 1609-1618 (2004).
- Slack, R. S., et al. Cells differentiating into neuroectoderm undergo apoptosis in the absence of functional retinoblastoma family proteins. Journal of Cell Biology. 129 (3), 779-788 (1995).
- Gu, W., et al. Interaction of myogenic factors and the retinoblastoma protein mediates muscle cell commitment and differentiation. Cell. 72 (3), 309-324 (1993).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены