Method Article
Traitement transitoire des cellules souches pluripotentes humaines avec DMSO pour promouvoir la différenciation
Dans cet article
Résumé
Générer des types de cellules différenciées des cellules souches pluripotentes humaines (HPSC) est très prometteur sur le plan thérapeutique, mais demeure difficile. Les CFP présentent souvent une incapacité inhérente à se différencier même lorsqu'elles sont stimulées par un bon ensemble de signaux. Décrit ici est un outil simple pour améliorer la différenciation multilinéaire à travers une variété de lignes de PSC.
Résumé
Malgré l'utilisation croissante de cellules souches pluripotentes (CSP), des difficultés demeurent pour différencier efficacement les cellules souches embryonnaires et induites (ESC et iPSC) à travers diverses lignées. De nombreux protocoles de différenciation ont été développés, mais la variabilité entre les lignées cellulaires et les faibles taux de différenciation posent des défis dans la mise en œuvre réussie de ces protocoles. Décrit ici est un moyen facile et peu coûteux pour améliorer la capacité de différenciation des CFP. Il a déjà été démontré que le traitement des cellules souches ayant une faible concentration de sulfoxide de diméthyle (DMSO) augmente considérablement la propension d'une variété de CSP à se différencier de différents types de cellules suivant la différenciation dirigée. Cette technique s'est maintenant avérée efficace entre différentes espèces (p. ex. souris, primateet stupéfères) en plusieurs lignées, allant des neurones et des sphéroïdes corticaux aux cellules musculaires lisses et aux hépatocytes. Le prétraitement DMSO améliore la différenciation de la PSC en régulant le cycle cellulaire et en amorçant les cellules souches pour être plus sensible aux signaux de différenciation. Fourni ici est la méthodologie détaillée pour utiliser cet outil simple comme un moyen reproductible et largement applicable pour différencier plus efficacement LES CFP à toute lignée de choix.
Introduction
L'utilisation de cellules souches pluripotentes a mené à de nombreux progrès dans la recherche biomédicale, y compris les domaines de la médecine régénérative et des thérapies à base de cellules souches, la modélisation des maladies et le dépistage des médicaments. Il a également conduit à la perspective globale d'une recherche plus traduisible et de la médecine personnalisée. L'avènement de la technologie induite des cellules souches pluripotentes (iPSC) il y a plus de 20 ans a permis aux chercheurs de développer des cellules souches pluripotentes à partir de tissus somatiques et de les différencier en types de cellules fonctionnelles pour étudier une variété de pathologies, y compris maladies cardiovasculaires, neurologiques et immunologiques. Bien que des progrès significatifs aient été réalisés dans la technologie de différenciation des cellules souches, des défis ont été relevés dans la différenciation efficace des cellules souches embryonnaires humaines (HESC) et des iPSC, ce qui limite l'utilisation généralisée de la technologie des cellules souches dans différents programmes de recherche. La variabilité inhérente entre les différentes lignées cellulaires et clones continue de poser des obstacles à la différenciation des lignées de cellules souches aux linages désirés1. En outre, la réalisation de cellules fonctionnelles matures et différenciées en phase terminale des hPSC demeure un processus fastidieux et inefficace à travers de nombreuses lignées. En fait, les cellules différenciées des hPSC ne se différencient souvent pas en cellules fonctionnelles2. Dans le déplacement des thérapies à base de cellules souches à utiliser chez les patients, il est nécessaire d'améliorer et d'assurer l'efficacité des cellules qui sont générées à partir de hPSC.
Notre laboratoire a mis en place un outil rapide et peu coûteux pour améliorer considérablement l'efficacité de la différencié des iPSC et des ESC en types de cellules matures. Nous avons constaté que le prétraitement des hiPSCs et des HESC avec le sulfoxide de diméthyle de réactif couramment utilisé (DMSO) pendant 24 h à 48 h avant les résultats dirigés de différenciation dans une amélioration marquée de la capacité de différenciation de cellules souches. Le traitement par DMSO augmente la proportion de hiPSCs et de HESC s'au début de la phase G1 du cycle cellulaire et active la protéine rétinoblastome (Rb)3, un régulateur critique de la prolifération cellulaire, de la survie et de la différenciation4. Dans des travaux plus récents, il a été constaté que Rb et ses membres de la famille sont nécessaires pour les effets pro-différenciation de DMSO, de sorte que l'inactivation transitoire de Rb supprime les effets de DMSO, tandis que l'activation constitutive de Rb d'une manière transitoire améliore Effets de DMSO5. Analogue au cycle cellulaire au cours du développement embryonnaire, le cycle cellulaire des ESC et des iPSC est caractérisé par une phase G1 abrégée qui favorise l'auto-renouvellement6,7,8. Cette phase G1 abrégée permet une prolifération plus illimitée mais limite le potentiel de différenciation4,9. En favorisant l'arrêt de croissance dans G1 et en activant des contrôles de point de contrôle dans le cycle cellulaire des HESC et des iPSC, les cellules de traitement de DMSO des nombres premiers pour des changements de destin de cellules suivant la différenciation dirigée.
À ce jour, il a été démontré que le prétraitement DMSO améliore la capacité de différenciation des trois couches germinales dans plus de 30 lignées cellulaires humaines SPÉCIFIQUES à l'ESC et à l'iPSC3,5 ainsi que la différenciation des cellules souches et d'autres lignées cellulaires à une variété d'autres types de cellules matures dans les études ultérieures10,11,12,13,14,15,16, 17 Annonces , 18 ans, états-unis qui , 19 ans, états-unis qui , 20 Ans, états-unis , 21 Ans, états-unis , 22 Ans , 23 Ans, états-unis , 24 Ans, états-unis , 25 Annonces , 26 Annonces , 27 Annonces , 28 (Tableau 1). En outre, le traitement DMSO s'est avéré efficace pour améliorer la différenciation des cellules primaires non humaines21,23 (p. ex. souris, primate, lapin), suggérant des mécanismes partagés entre les espèces. Enfin, le prétraitement DMSO a également été étendu à la technologie d'édition de gènes, avec une étude particulière montrant que 24 h DMSO prétraitement des HESC / iPSCs considérablement augmenté la capacité de Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR) /CRISPR-associé protéine-9 (Cas9)-mediated efficacité d'édition de l'ADN non-codage sans incorporer des mutations involontaires29. Fourni ici est une méthodologie détaillée du prétraitement DMSO des HESC et iPSCs pour des applications dans la biologie des cellules souches et la différenciation dirigée.
Protocole
1. Entretien des cellules souches
REMARQUE: Le protocole d'entretien cellulaire décrit ci-dessous s'applique aux cellules souches pluipotentes (CSP) maintenues dans une monocouche adhérente. Les médias, autres réactifs et plaques de culture cellulaire utilisés avant le traitement DMSO peuvent être ajustés au besoin. Pour tous les protocoles suivants dans ce manuscrit, les cellules doivent être manipulées sous un coffret de sécurité biologique.
- Enduit des plaques stériles, 6 bien traitées à la culture tissulaire avec une matrice ou un substrat pluripotent qualifié en cellules souches préparé selon les instructions du fabricant et incubé pendant au moins 1 h dans un incubateur de CO2 (5 % CO2, atmosphère humide). Les plaques enduites peuvent être emballées et entreposées à 4 oC pendant une semaine.
- Décongeler les CSP cryoconservés dans un bain d'eau de 37 oC. Stérilisez le flacon à l'éthanol avant l'introduction à l'armoire de sécurité biologique, puis transférez immédiatement les cellules par pipetting à un tube conique stérile contenant 5-10 volumes de supports préchauffés de cellules souches.
- Centrifuger les cellules à 300 x g pendant 5 min à température ambiante (RT).
- Aspirez le support et resuspendez doucement la pastille cellulaire dans 1 ml de support à cellules souches complétée par un inhibiteur de 10 M ROCK, tel que Y-27632.
- Aspirer la matrice de culture de la plaque et semer les cellules à la densité désirée, généralement 0,5-1 x 106 cellules par puits dans au moins 2 ml de cellules souches par puits.
REMARQUE: La densité de placage peut varier selon les lignées cellulaires et les clones et doit être optimisée en conséquence. - Maintenir les cellules en remplaçant par des supports de cellules souches préchauffées tous les jours. Divisez les cellules à environ 70%-80% de confluence ou lorsque les colonies cellulaires commencent à entrer en contact.
- Pour fractionner les cellules, aspirer le support et laver les cellules une fois avec du PBS stérile. Incuber les cellules avec 1 ml d'une solution enzymatique de dissociation par puits pendant 5-10 minutes à 37 oC.
- Laver et resuspendre les cellules avec des cellules souches préchauffées et le transférer dans un tube conique stérile avec 5-10 volumes de cellules souches. Suivez les étapes 1.3-1.7 pour plaquer les cellules.
2. Prétraitement DMSO
REMARQUE: Lors du placage des cellules pour le prétraitement DMSO avant la différenciation, la densité des cellules de placage de départ doit être optimisée en tenant compte du taux de croissance typique de la lignée de cellules souches ainsi que du protocole de différenciation utilisé. Valider la pluripotence à l'aide de marqueurs conventionnels, au besoin. Les cellules doivent être passages au moins 1x-2x après la décongélation initiale avant la différenciation.
-
Différenciation de la culture 2D
- Lorsque les cellules atteignent une confluence appropriée, préparez des plaques enduites, dissociez les cellules et préparez une suspension unicellulaire comme décrit ci-dessus.
- Comptez les cellules vivantes à l'aide d'un hémocytomètre ou d'un compteur cellulaire automatique, y compris le bleu trypan ou un autre marqueur de viabilité.
- Déposer les cellules sur une plaque de 6 puits enduite à 0,5-1 x 106 cellules par puits dans le support des cellules souches avec l'inhibiteur de 10 M ROCK.
REMARQUE: Pour les lignées cellulaires testées en laboratoire, ces densités ont généralement donné lieu à 80 à 90 % des cellules confluentes dans le prétraitement DMSO de 24 h. - Laisser les cellules incuber pendant 24 h à 37 oC dans un incubateur de CO2 (5 % CO2, atmosphère humide).
- Préparer 1 % à 2 % de DMSO dans des supports préchauffés à cellules souches (p. ex., 100 l de DMSO dans 10 mL de supports, 1 % de solution DMSO, ou 200 L DMSO dans 10 mL de médias et une solution DMSO de 2 %).
- Après 24 h d'incubation, aspirez le support des cellules et remplacez-le par la solution DMSO.
- Laisser les cellules incuber de 24 h à 48 h à 37 oC dans un incubateur de CO2 (5 % de CO2,atmosphère humide) avant la différenciation.
REMARQUE: Typiquement, un traitement d'OSDM de 24 h est suffisant dans la majorité des lignées humaines ESC et iPSC. Les lignées cellulaires avec des taux de croissance très lents (longs temps de doublement) peuvent bénéficier de l'incubation de 48 h avec DMSO. Pour une incubation de 48 h avec DMSO, les supports peuvent être remplacés par des supports de cellules souches fraîches avec 1%-2% DeMSO après les 24 premiers heures de traitement.
-
Différenciation de la culture 3D :
- Lorsque les cellules atteignent une confluence appropriée, dissocier et recueillir les cellules dans une suspension cellulaire comme décrit ci-dessus.
- Comptez les cellules vivantes à l'aide d'un hémocytomètre ou d'un compteur cellulaire automatique, y compris un marqueur de viabilité.
- Plaquer les cellules dans une plaque de puits de 6 non couchée et faible ment d'attachement à 0,5-1 x 106 cellules par puits dans un support de cellules souches avec un inhibiteur rock de 10 M.
REMARQUE: Pour les lignées cellulaires testées en laboratoire, ces densités ont généralement entraîné la formation de sphère sPSC 3D dans les 24 h des cellules de réglage. - Laisser les cellules incuber pendant 24 h à 37 oC dans un incubateur de CO2 (5 % CO2, atmosphère humide).
- Préparer 1 % à 2 % de DMSO dans des supports préchauffés à cellules souches (p. ex., 100 l de DMSO dans 10 mL de supports , 1 % de solution DMSO, ou 200 l de DMSO dans 10 mL de supports et 2 % de solution DMSO).
- Remplacer les supports selon les procédures standard (p. ex., incliner la plaque à un angle de 30 à 45 degrés pour permettre aux sphères cellulaires de se déposer au fond du puits; transférer les cellules dans un tube conique stérile et permettre aux sphères cellulaires de se déposer au fond du tube; ou recueillir délicatement les cellules i n suspension à l'aide d'une pipette de 5 ou 10 ml dans un tube conique stérile et des cellules centrifugeuses à 300 x g pendant 5 min à RT).
- Aspirez le support des cellules et remplacez-le par une solution DMSO, en pipetting doucement.
- Laisser les cellules incuber de 24 h à 48 h à 37 oC dans un incubateur de CO2 (5 % de CO2,atmosphère humide) avant la différenciation.
REMARQUE: Typiquement, un traitement d'OSDM de 24 h est suffisant dans la majorité des lignées humaines ESC et iPSC. Les lignées cellulaires avec des taux de croissance très lents (longs temps de doublement) peuvent bénéficier de l'incubation de 48 h avec DMSO. Pour une incubation de 48 h avec DMSO, les supports peuvent être remplacés par des supports de cellules souches fraîches avec 1%-2% DeMSO après les 24 premiers heures de traitement.
3. Différenciation aux couches germinales primaires
REMARQUE: Ce qui suit décrit les méthodes précédemment montrées pour être efficaces dans notre laboratoire pour des PSC cultivés dans une monocouche sur 6 plaques de puits. Tout protocole de différenciation de choix doit être utilisé après le traitement DMSO pour favoriser la différenciation dans les lignées désirées. Retirez la solution DMSO après un traitement de 24-48 h et procédez à la différenciation suivant les protocoles standard.
-
Différenciation endoderm (adapté de Kroon et coll.30)
- Cellules de Pretreat avec DMSO comme décrit ci-dessus pour des cultures 2D.
- Préparer des solutions wnt3a et Activin A stock.
- Préparer le jour 1 médias de différenciation endodermal en ajoutant Wnt3a à une concentration finale de 20 ng/mL et Activin A à une concentration finale de 100 ng/mL au volume approprié de médias RPMI préchauffés.
- Après le prétraitement DMSO, aspirez les supports des cellules et remplacez-les par des supports du jour 1 (p. ex., 2 ml par puits d'une plaque de 6 puits).
- Laisser les cellules incuber pendant 24 h à 37 oC dans un incubateur de CO2 (5 % CO2, atmosphère humide).
- Préparer les jours 2 et 3 médias de différenciation endodermal en ajoutant Activin A à une concentration finale de 100 ng/mL au volume approprié de médias RPMI préchauffés.
- Aspirez les supports des cellules et remplacez-les par des supports du jour 2 (p. ex., 2 ml par puits d'une plaque de 6 puits).
- Laisser les cellules incuber pendant 24 h à 37 oC dans un incubateur de CO2 (5 % CO2, atmosphère humide).
- Aspirez les supports des cellules et remplacez-les par des supports du jour 3 (p. ex., 2 ml par puits d'une plaque de 6 puits).
-
Différenciation Mesoderm (adapté de Zhang et coll.31)
- Pretreat les cellules avec DMSO comme décrit ci-dessus pour les cultures 2D.
- Préparer des solutions wnt3a et Activin A stock.
- Préparer les médias de différenciation mésodermal en ajoutant Wnt3a à une concentration finale de 20 ng/mL et Activin A à une concentration finale de 100 ng/mL au volume approprié des milieux RPMI avancés préchauffés.
- Après le prétraitement DMSO, aspirez les médias des cellules et remplacez-les par des supports de différenciation (p. ex., 2 ml par puits d'une plaque de 6 puits).
- Laisser les cellules incuber pendant 24 h à 37 oC dans un incubateur de CO2 (5 % CO2, atmosphère humide).
-
Différenciation d'Ectoderm (adapté de Chambers et coll.32)
- Pretreat les cellules avec DMSO comme décrit ci-dessus pour les cultures 2D.
- Préparer les solutions d'actions Noggin et SB431542.
- Préparer les médias de base de différenciation ectodermale en dissolvant le remplacement de sérum knock-out (KOSR) à une concentration finale de 10% dans knockout DMEM.
REMARQUE: Préparer suffisamment de médias de base pour 3-4 jours de changement des médias. - Préparer les supports de différenciation ectodermale en ajoutant Noggin à une concentration finale de 500 ng/mL et SB431542 à une concentration finale de 10 M au volume approprié de KOSR/knockout DMEM préchauffé.
- Après le prétraitement DMSO, aspirez les médias des cellules et remplacez-les par des supports de différenciation (p. ex., 2 ml par puits d'une plaque de 6 puits).
- Laisser les cellules incuber pendant 3-4 jours à 37 oC dans un incubateur de CO2 (5 % co2, atmosphère humide), remplaçant les milieux quotidiennement par des facteurs de différenciation fraîchement ajoutés.
4. Différenciation aux types de cellules progénitrices
Ce qui suit décrit les méthodes précédemment montrées pour être efficaces dans notre laboratoire pour des PSC cultivés dans une cultures 2D ou 3D. Tout protocole de différenciation de choix doit être utilisé après le traitement DMSO pour favoriser la différenciation dans les lignées désirées. Retirez la solution DMSO après un traitement de 24-48 h et procédez à la différenciation suivant les protocoles standard.
- Différenciation des cellules progénitrices neuronales (adapté de Tchieu et coll.33)
- Préparer 6 plaques de puits par revêtement avec une matrice ou un substrat de facteur de croissance réduit pluripotent qualifié de cellules souches, selon les instructions du fabricant, pendant au moins 1 h dans un incubateur de CO2 (5 % CO2, atmosphère humide). Les plaques enduites peuvent être emballées et entreposées à 4 oC jusqu'à 1 semaine.
- Plaques PSC telles que décrites ci-dessus à la densité de 0,5-1 x 106 cellules par puits dans les cellules souches contenant un inhibiteur ROCK.
- Cellules de Pretreat avec DMSO comme décrit ci-dessus pour des cultures 2D.
- Préparez de petites solutions d'inhibiteurs chimiques LDN193189, SB431542 et XAV939.
- Préparer les jours 1-3 neuroectoderm médias de différenciation en complétant Essential 6 Media avec 500 nM LDN193189, 10 M SB431542, et 2 XAV939.
- Après le prétraitement DMSO, aspirez les médias et remplacez par des médias neuroectoderm Days 1-3 (p. ex., 2 ml par puits d'une plaque de 6 puits). Changez les médias tous les jours.
- Préparer les jours 4-12 neuroectoderm médias de différenciation en complétant Essential 6 Media avec 500 nM LDN193189 et 10 M SB431542.
- Le jour 4 de la différenciation, aspirer les médias et remplacer par Days 4-12 neurodectoderm médias. Changez les médias tous les jours.
- Après 12 jours de différenciation, les cellules différenciées devraient exprimer des marqueurs appropriés des cellules progénitrices neurales (PNJ). Les PNJ peuvent être maintenus dans les médias neuronaux contenant du DMEM/F-12, 2 % B-27, 1 % N-2, et complétés par un facteur de croissance de base du fibroblaste de 10 g/mL (bFGF). Passer les PNJ lorsque confluent à l'aide d'une solution de détachement cellulaire, placage PNJ à 0,5-1 x 106 cellules par puits.
- Différenciation des cellules progénitrices oligodendrocyte (adapté de Douvaras et Fossati34)
- Plaquer les CSP comme décrit ci-dessus à une densité de 1 x 105 par puits sur 6 plaques de puits enduites dans des cellules souches contenant un inhibiteur ROCK.
- Cellules de Pretreat avec DMSO comme décrit ci-dessus pour des cultures 2D.
- Préparer SB431542, LDN193189, acide rétinoïque tout trans (RA), et des solutions de stock agonistes lissés (SAG).
- Préparer les jours 0 à 8 médias de différenciation en complétant DMEM/F-12 avec 10 M SB431542, 250 nM LDN193189, et 100 nM RA.
- Après le prétraitement DMSO, incuber les cellules avec des supports de différenciation pendant 8 jours, en changeant les médias tous les jours avec des facteurs de différenciation fraîchement ajoutés (par exemple, 2 ml par puits d'une plaque de 6 puits).
- Le jour 8, remplacez les médias par dMEM/F-12 contenant 1x solution d'acides aminés non essentiels MEM (NEAA), 1X L-glutamine, 2-mercaptoethanol, pénicilline/streptomycine, et 1x N-2 complété 100 nM RA et 1 M SAG. Changez les médias tous les jours.
- Après 12 jours de différenciation, les cellules différenciées devraient exprimer des marqueurs appropriés des cellules progénitrices d'oligodendrocyte (OPC).
- Différenciation des cellules progénitrices endocriniennes (adapté de Pagliuca et coll.35)
- Seed PSCs at 6 x 105 cells/mL in stem cell media plus 10 M ROCK inhibitor in 500 mL spinner fasks placed on a 9-position stir plate set at rotation rate of 70 rpm in a 37 'C incubator, 5% CO2, and 100% humidity.
- Laissez les grappes s'installer au fond du flacon, aspirer les médias, puis pretreatavec avec 1%-2% DMSO.
- Préparez Activin A, Chir99021, KGF, Sant1, l'acide rétinoïque tout-trans (RA), LDN193189, PdBU, XXI, Alk51, T3, et Betacelluin stock solutions.
- Préparer les médias de base de différenciation basés sur la formulation du tableau 3.
- Après le prétraitement DMSO, aspirez les médias et remplacez-les par des supports S1 complétés par 100 ng/mL Activin A et 3 mM Chir99021 (p. ex. 500 ml par flacon). Laisser l'incubation pendant 24 h.
- Le jour 2, remplacer les médias par des supports S1 complétés par 100 ng/mL Activin A. Autoriser l'incubation pendant 2 jours.
- Le jour 4, remplacez les médias par des supports S2 complétés par 50 ng/mL KGF. Autoriser l'incubation pendant 3 jours, en changeant de média après les 2 premiers jours (Jour 6).
- Le jour 7, remplacez les médias par des supports S3 complétés par 50 ng/mL KGF, 0,25 mM Sant1, 2 mM RA et 200 nM LDN193189. Laisser l'incubation pendant 24 h.
- Le jour 8, remplacez les médias par des supports S3 complétés par 50 ng/mL KGF, 0,25 mM Sant1, 2 mM RA, 200 nM LDN193189, et 500 nM PdBU. Laisser l'incubation pendant 24 h.
- Le jour 9, remplacez les médias par des supports S3 complétés par 50 ng/mL KGF, 0,25 mM Sant1 et 100 nM RA. Autoriser l'incubation pendant 5 jours, en changeant de support tous les 2 jours (jour 11 et 13).
- Les jours 14 et 16, remplacez les médias par des supports S5 complétés par 0,25 mM Sant1, 100 nM RA, 1 mM XXI, 10 mM Alk5i II, 1 mM T3 et 20 ng/mL de bêtacelluline (4 jours d'incubation totale).
- Les jours 18 et 20, remplacez les médias par des supports S5 complétés par 25 nM RA, 1 mM XXI, 10 mM Alk5i II, 1 mM T3 et 20 ng/mL de bêtacelluline.
5. Validation immunocytochimique de la différenciation
REMARQUE: Les méthodes suivantes décrivent un protocole immunocytochimique général qui peut être ajusté au besoin. Les anticorps primaires sont ceux qui ont déjà été validés dans notre laboratoire. D'autres techniques de validation de la différenciation peuvent également être utilisées (p. ex., cytométrie du débit, qPCR, séquençage de l'ARN, ballonnements occidentaux, essais fonctionnels, etc.).
-
Cellules immunolabeling
- Pour les cultures 3D en suspension, les grappes ou grappes de cellules entières de plaque se sont dispersées dans la suspension unicellulaire sur des plaques enduites pendant 18-24 h avant la fixation.
- Aspirez les médias des cellules adhérentes et lavez brièvement avec PBS à RT sur un shaker.
- Pour la fixation cellulaire, aspirez PBS et incubez les cellules avec 4% de paraformaldéhyde (PFA) en PBS pendant 20 min à RT sur shaker.
MISE EN GARDE: Le stock PFA doit être préparé sous une hotte de fumée en raison de sa toxicité. N'inhalez pas et ne portez pas d'équipement de protection individuelle approprié. - Enlever le PFA et jeter dans le contenant de déchets chimiques approprié.
- Laver les cellules 3x avec PBS pendant au moins 5 min par lavage à RT sur un shaker.
- Pour la perméabilisation cellulaire et le blocage, incuber les cellules avec 5% de sérum d'âne préparé en 0,3% triton-x 100/PBS pour 1 h à RT sur un shaker.
- Préparer la solution d'anticorps primaire dans la même solution utilisée pour la perméabilisation/blocage.
- Incuber dans la solution d'anticorps primaire pendant la nuit à 4 oC sur le shaker.
- Après l'incubation de nuit, laver les cellules 3x avec PBS pendant au moins 5 min par lavage à RT sur un shaker.
- Préparer la solution d'anticorps secondaire dans la solution de perméabilisation/blocage.
- Laisser incuber dans une solution d'anticorps secondaire pendant 1 h à RT sur un shaker.
- Aspirez la solution secondaire d'anticorps et lavez les cellules 3x avec PBS pendant au moins 5 min par lavage à RT sur un shaker.
- Incuber les cellules avec DAPI ou un autre marqueur préféré pour le temps d'incubation approprié, et rincer dans PBS.
-
Quantification de l'image
- Acquérir un minimum de trois images par condition sur un microscope fluorescent et/ou avec une plate-forme de dépistage à haute teneur.
- Quantifier le pourcentage de cellules positives pour chaque marqueur en comptant le nombre total de cellules tachées d'anticorps et le nombre total de cellules (selon la coloration des noyaux DAPI/Hoechst) à l'aide d'un logiciel d'imagerie impartial (p. ex. ImageJ) ou d'une plate-forme de dépistage automatisée pour Analyses.
Résultats
Morphologie des iPSC traités par DMSO
Les iPSC humains dérivés des sujets témoins ont été cultivés dans un monocouche 2D adhérent ou dans des sphères cellulaires 3D en suspension. Environ 24 h après le placage initial, les cellules ont été traitées avec 1% ou 2% DMSO pendant 24 h dans le milieu d'entretien. Des images de brightfield représentatives après le traitement DMSO sont montrées à la figure 1. Conformément aux rapports précédents pour les iPSC maintenus dans une monocouche3, le prétraitement d'EDSO a eu comme conséquence une diminution dose-dépendante transitoire du taux de croissance comparé aux cellules non-DMSO traitées (figure1A). Cette diminution de la prolifération est associée à une augmentation du contact cellule-cellule, qui est particulièrement prononcée dans les cellules traitées DMSO de 2 % affichant une formation accrue de colonies cellulaires plus fortement regroupées. Dans d'autres types de cellules, l'arrestation G1 induite par DMSO a été montrée pour être associée à l'expression accrue des protéines impliquées dans des interactions cellules-cellules qui soutiennent l'arrêt induit de croissance induit e de contact-inhibition36. Dans les iPSC maintenus sous forme de sphères cellulaires 3D, le traitement DMSO a également augmenté le nombre de sphères cellulaires (figure 1B). En outre, le traitement DMSO a également eu comme conséquence des tailles 3D moins variables de sphère, qui a été précédemment montrée pour être indicative de la capacité améliorée de différenciation des cellules37. Fait important, ni 1 % ou 2 % de DMSO n'ont entraîné la toxicité cellulaire, mesurée par les dénombrements de viabilité (n 3; culture 2D % vivant et contrôle : 80 à 1,3; 1 % DMSO : 82 à 3,7, 2 % : 81 à 2,7 % de culture en direct et de contrôle : 81 à 4,3 ; 1 % DMSO : 82 à 6,7, 2 % : 82 à 2,7 ). Dans l'ensemble, ces résultats sont compatibles avec l'idée que le traitement DMSO modifie le cycle cellulaire et les modèles de croissance dans les cellules souches cultivées. Ces effets sur l'inhibition de la croissance sont réversibles lorsque le DMSO est retiré du milieu, comme indiqué précédemment3.
Le traitement DMSO améliore la différenciation des ESC par des couches germinales primaires
Les HUES6 hESC ont été ensepépins sur des plaques enduites pendant 24 h, suivis d'un traitement avec 2 % de DMSO pour 24 h dans le milieu d'entretien. Les cellules ont ensuite été différenciées en trois couches germinales primaires suivant les paradigmes de traitement montrés dans la figure 2A30,31,32. Des cellules différenciées ont alors été fixées et immunologiquement souillées pour des marqueurs prototypic de chaque couche de germe respective (SOX17 pour l'endoderm, brachyury pour le mesoderm, et SOX1 pour l'ectoderm). Comme le montre la figure 2B, 24 h de prétraitement avec 2 % de DMSO ont augmenté la proportion de cellules exprimant chaque marqueur de couche germinale respectif. Ceci est compatible avec les rapports précédents de notre laboratoire montrant l'immunoréactivité accrue, l'expression de gène, aussi bien que le nombre absolu de cellules différenciées vers toutes les couches de germe dans les cellules souches traitées avec DMSO3,5. HUES6 est une ligne hESC avec une propension très faible pour la différenciation entre toutes les lignées1, mais le traitement DMSO améliore considérablement sa capacité à différencier entre toutes les couches germinales.
Le traitement DMSO améliore la différenciation des types de cellules progénitrices
Pour étudier l'effet du DMSO sur la différenciation des types de cellules progénitrices du SNC, les iPSC humains ont été différenciés aux cellules progénitrices neurales (NPC) ou aux cellules progénitrices oligodendrocytes (OPC). Pour générer des PNJ, les cellules ont été prétraitées avec 2 % de DMSO pendant 24 h dans le milieu d'entretien, suivies de 12 jours de différenciation dirigée33 (figure 3A). Comme le montre la figure 3B, le prétraitement du DMSO de 2 % a augmenté l'expression du marqueur DENP PAX6 par rapport au contrôle. À l'aide d'un autre protocole déjà validé34 (figure3C),les cSPE ont été différenciés pendant 12 jours en CPVP. À l'instar des PNJ, les CPVP dérivés des cSPS prétraités avec un DMSO de 2 % pendant 24 h ont démontré une proportion de cellules exprimant des marqueurs OPC OLIG2 (figure3D).
Un traitement DMSO initial persiste pour améliorer la différenciation en types de cellules matures
Pour étudier l'effet du DMSO sur les dernières étapes d'un protocole de différenciation, les HSC HUES8 ont été prétraités pendant 24 h avec 2 % de DMSO avant la différenciation des cellules à la suite d'un protocole de différenciation dirigé de 20 jours décrit à la figure 4a 35. HUES8 ont été utilisés comme on a déjà démontré qu'ils avaient une plus grande propension à la lignée endodermale1,38. Au stade défini de l'endoderm, les cellules différenciées expriment SOX17 et FOXA2, marqueurs spécifiques définitifs d'endoderm (DE). Avec une différenciation supplémentaire dans les progéniteurs pancréatiques (PP1) stade, les cellules différenciées expriment PDX1 et FOXA2, marqueurs caractéristiques des cellules progénitrices pancréatiques. À ces stades de différenciation des cellules pancréatiques, l'efficacité de l'induction dans de l'ED et, par la suite, dans la PP1 était élevée pour les HESC traités par le DMSO et différenciés en chacune de ces étapes (figure4B, stades 1 et 3). Même si la lignée cellulaire HUES8 a été notée pour avoir augmenté la propension à se différencier dans la lignée endodermale, comme différenciation est induite plus loin dans les types de cellules plus spécialisées aux stades terminaux les HESC DMSO-traités sont beaucoup plus susceptibles de produire des cellules endocriniennes pancréatiques matures. L'efficacité de la production de cellules progénitrices pancréatiques PDX1/NKX6.1MD, des cellules endocriniennes Neurogenin 3 et des cellules NKX6.1/C-peptideMD SC-MD était considérablement plus élevée dans les HESCtraités d'OrSM (figure4B, stades 4 et 5). Ces résultats sont conformes à la différenciation du PNJ et du CPVP, ce qui montre que le DMSO améliore le potentiel de différenciation des types de cellules progénitrices et démontre également que l'effet du DMSO persiste à générer des types de cellules plus spécialisées. Ceci est compatible avec les travaux antérieurs, où nous avons montré que le traitement initial de 24 h DMSO augmente la différenciation en types de cellules terminales à travers les couches germinales, y compris dans les cellules neuronales ainsi que battre les cardiomyocytes31,39 dans les lignées cellulaires avec des propensions élevées ou faibles pour la différenciation3.
Le traitement initial de DMSO améliore la fonction cellulaire hESC-dérivée suivant la transplantation in vivo
Précédemment, nous avons démontré l'efficacité du traitement de DMSO en améliorant la différenciation des HESCs en cellules progénitrices pancréatiques fonctionnelles qui montrent plus tard une amélioration marquée de la sécrétion d'insuline in vivo3. Utilisant les protocolesprécédemmentédités 3,30,40, LES HUES8 hESCs ont été traités avec 1% de DMSO pendant 24 h, différenciés en cellules progénitrices pancréatiques, et transplantés en souris immunodéficientes SCID-Beige pour évaluer (p. ex., sécrétion d'insuline en réponse à un défi de glucose ou stimulation du KCl) (Figure 5A). Alors que l'efficacité de la différenciation en FOXA2MD (environ 90 %) et PDX1MD (75 %) les progéniteurs pancréatiques étaient comparables entre le contrôle et les HESCd traités par DMSO (figure 5B) pour la ligne DESH, les cellules différenciées des HESC suivant un traitement DMSO de 24 h 1 % avaient amélioré la réactivité au glucose et au KCl. stimulation à la suite d'une transplantation in vivo. Des améliorations de la fonctionnalité ont été évidentes dans les 2 semaines suivant la transplantation (figure 5C) et ont persisté jusqu'à au moins 16 semaines après la transplantation (figure 5D). Pris ensemble, ces résultats suggèrent que le prétraitement DMSO augmente non seulement l'efficacité de différenciation aux couches germinales, aux cellules progénitrices et aux types de cellules plus matures, mais aussi qu'il persiste à améliorer la fonctionnalité des cellules différenciées in vivo.
| Type de cellule différenciée | Type de cellule de départ | %DMSO (en) | Durée du traitement DMSO | Durée du traitement DMSO |
| Cellules hépatiques | Esc Ligne de cellules d'hépatome Esc Esc Cellules souches mésenchymales iPSCs Esc Esc Ligne de cellules d'hépatome Esc | 1,0 1,0 1,0 0,5 0,1 à 2,0 1,0 1,0 0,5 1,0 0,6 | 8 jours Plusieurs jours 7 jours 10-14 jours 7-21 jours 7 jours 4 jours 5 jours 2-21 jours partout dans | Basma et coll., 2008 Kanebratt et Andersson, 2008 Hay et coll., 2009 Duan et coll., 2010 Alizadeh et coll., 2014 Kondo et coll., 2014 Szkolnicka et coll., 2014 Czysz et coll., 2015 Nikolaou et coll., 2016 Vanhove et coll., 2016 |
| Couches germinales primaires | ESCs et iPSC Hesc Hesc | 0,1 à 2,0 0,5 0,1 à 2,0 | 24 heures 24 heures 24 heures | Chetty et coll., 2013 Chetty et coll., 2015 Li et coll., 2018 |
| Cellules cardiaques | ESCs et iPSC Cellules P19 ESCs et iPSC Cellules souches mésenchymales fœtales | 0,1 à 2,0 1,0 1.0-2.0 0,8 à 1,0 | 24 heures 4 jours 24-30 heures 24 heures | Chetty et coll., 2013 Choi et coll., 2014 van den Berg et coll., 2016 Deng et coll., 2017 |
| Cellules pancréatiques | ESCs et iPSC Hesc | 0,1 à 2,0 0,5 | 24 heures 24 heures | Chetty et coll., 2013 Chetty et coll., 2015 |
| Cellules musculaires lisses | Cellules P19 | 1,0 | 4 jours | Choi et coll., 2014 |
| Cellules endothéliales | Cellules P19 | 1,0 | 4 jours | Choi et coll., 2014 |
| Entocytes | iPSCs | 0 à 1,6 | 4 jours | Ogaki et coll., 2015 |
| Épithélium intestinal | iPSCs | 0 à 1,6 | 4 jours | Ogaki et coll., 2015 |
| Cellules neuronales | Marmoset iPSC | 0,05 à 2,0 | 24 heures | Qiu et coll., 2015 |
| Neutrophiles | Ligne de cellules de leucémie | 1,25 | 6-8 jours | Teimourian et Moghanloo, 2016 |
| Myotubes squelettiques | iPSCs | 1,5 | 24 heures | Swartz et coll., 2016 |
| Organoïde corticale | hiPSCs | 1,0 | 24 heures | Yoon et coll., 2018 |
Tableau 1 : Sommaire des travaux publiés antérieurement démontrant les effets bénéfiques du traitement DMSO sur la différenciation.
| S1 (en) | S2 (en) | S3 (en) | S5 (en) | |
| MCDB131 (D) | 1 Fois | 1 Fois | 1 Fois | 1 Fois |
| Glucose (g) | 0,44 | 0,44 | 0,44 | 3,6 Annonces |
| NaHCO3 (g) | 2,46 | 1.23 | 1.23 | 1.754 Annonces |
| FAF-BSA (g) | 20 Ans, états-unis | 20 Ans, états-unis | 20 Ans, états-unis | 20 Ans, états-unis |
| ITS-X (mL) | 0,02 | 0,02 | 5 Annonces | 5 Annonces |
| Glutamax (mL) | 10 Ans et plus | 10 Ans et plus | 10 Ans et plus | 10 Ans et plus |
| Vitamine C (mg) | 44 Ans, en est à qui | 44 Ans, en est à qui | 44 Ans, en est à qui | 44 Ans, en est à qui |
| Héparine (mg) | 0 (en) | 0 (en) | 0 (en) | 10 Ans et plus |
| P/S (mL) | 10 Ans et plus | 10 Ans et plus | 10 Ans et plus | 10 Ans et plus |
Tableau 2 : Composants de médias de base de différenciation des cellules progénitrices endocriniennes.
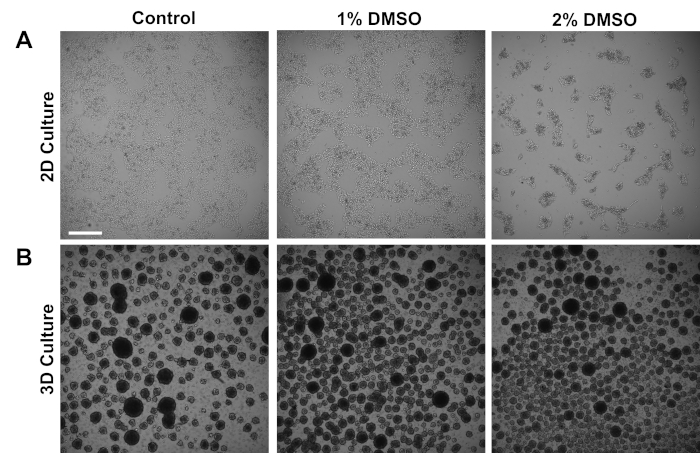
Figure 1 : Le traitement DMSO modifie la croissance des hPSC. (A) Images lumineuses représentatives des hiPSC plaquées dans une monocouche après n'avoir reçu aucun traitement (contrôle) ou traitement avec 1 % ou 2 % de DMSO pendant 24 h. DMSO favorise une inhibition transitoire de la croissance dépendante de la dose des iPSC. (B) Images lumineuses représentatives de hiPSC plaquées sur des plaques à faible attachement pour permettre la formation de sphère3D après n'avoir reçu aucun traitement (contrôle) ou traitement avec 1 % ou 2 % de DMSO pendant 24 h. Le traitement DMSO entraîne une formation de sphère 3D moins variable par rapport au contrôle. Barre d'échelle de 500 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
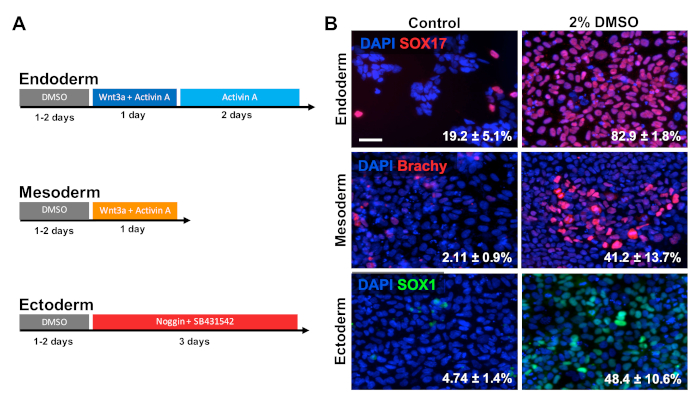
Figure 2 : Le traitement DMSO améliore la différenciation des hPSC aux couches germinales primaires. (A) Schématique des protocoles de différenciation utilisés pour générer les trois couches germinales primaires. (B) Images représentatives de HUES6 hESCs différenciés immunolabeled pour SOX17 (endoderm), brachyury (mesoderm), et SOX1 (ectoderm). Le prétraitement avec 2% de DMSO pour 24 h a augmenté l'efficacité de différenciation à travers chacune des trois couches de germe. Pourcentages de cellules se différenciant en SOX17MD endodermal, Brachyury (Brachy) MD mesodermal, ou SOX1MD cellules ectodermales suivant la différenciation dirigée dans chaque couche germinale de contrôle et les HESC traités par DMSO sont notés avec SEM de trois répliques biologiques . T-test non apparié: endoderm p 0,0003; mesoderm p 0,047; ectoderm p 0,015. Barre d'échelle de 50 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
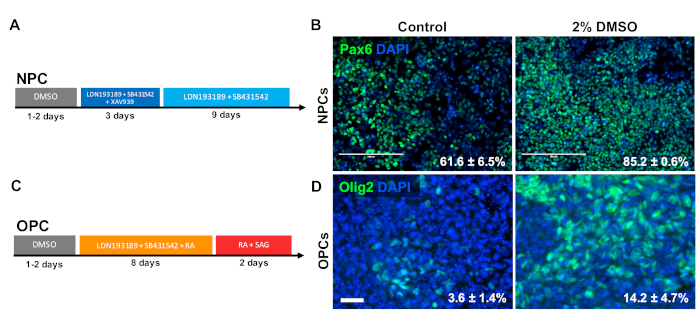
Figure 3 : Le traitement DMSO améliore la différenciation des types de cellules progénitrices neurales. (A) Schématique du protocole de différenciation utilisé pour générer des cellules progénitrices neurales (PNJ). (B) Images représentatives d'iPSC humains différenciées en PNJ immunolabeled pour Pax6. 24 h de prétraitement avec 2% DeMSO ont augmenté le nombre de cellules positives PAX6. Les pourcentages de cellules se différenciant en PNJ De Pax6mD suivant la différenciation dirigée du contrôle et les iPSC humains traités par DMSO sont notés avec SEM de trois répliques biologiques. T-test non apparié : p 0,0225. Barre d'échelle de 200 m. (C) Schéma du protocole de différenciation utilisé pour générer des cellules progénitrices oligodendrocytes (OPC). (D) Images représentatives d'iPSC humains différenciées en CPVP immunolabeld pour les marqueurs OpC Olig2. 24 h de prétraitement avec 2% de DMSO ont augmenté l'expression des deux marqueurs du CPVP par rapport au contrôle. Les pourcentages de cellules se différenciant en CPVP Olig2MD suivant la différenciation dirigée du contrôle et les iPSC humains traités par DMSO sont notés avec SEM de quatre répliques biologiques. T-test non apparié : p 0,0466. Barre d'échelle de 50 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
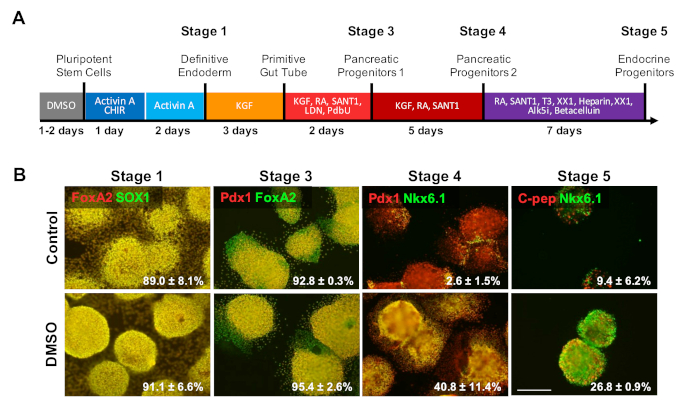
Figure 4 : Le traitement DMSO améliore le potentiel de différenciation terminale des hPSC. (A) Schématique d'un jour de différenciation dirigée de HUES8 hESCs en cellules endocriniennes pancréatiques différenciées en phase terminale. (B) Immunostaining pour les marqueurs indiqués à chaque étape de différenciation suivant la différenciation dirigée des cellules témoins non traitées et des cellules prétraitées avec 2% de DMSO pendant 24 h. Le traitement initial de DMSO persiste pour augmenter la différenciation dans les types de cellules endocriniennes terminales aux derniers stades de la différenciation dirigée. Les pourcentages de cellules se différenciant en marqueurs indiqués à chaque étape de la différenciation suivant la différenciation dirigée du contrôle et les HESC DMSO-traités sont notés avec SEM de deux à quatre répliques biologiques. Barre d'échelle de 200 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
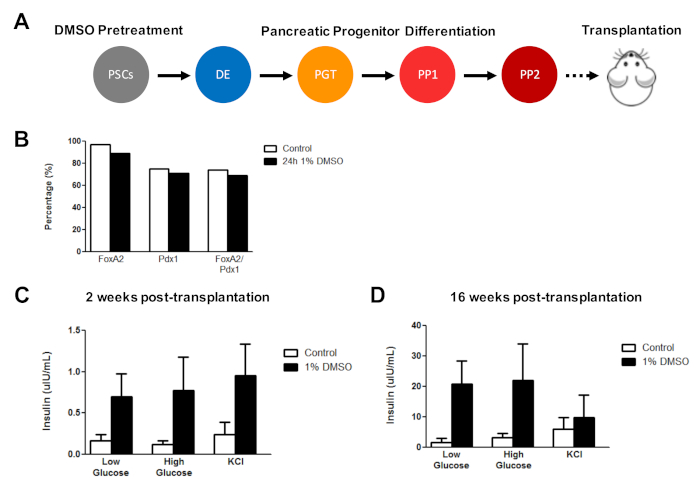
Figure 5 : Le traitement initial de DMSO des hPSCs améliorela réactivité de glucose suivant la transplantation des cellules pancréatiques d'ancêtre in vivo. (A) Schéma de différenciation dirigée (15 jours) de HUES8 hESCs en cellules progénitrices pancréatiques (PP2) après aucun traitement (contrôle) ou un traitement DMSO de 24 h 1 % et une transplantation subséquente (5 millions de cellules) en immunodéficients Souris SCID-Beige. (B) Pourcentage de cellules se distinant en cellules progénitrices pancréatiques PDX1MD et FOXA2MD suivant une différenciation in vitro du contrôle et des HESCtraités d'ALD immédiatement avant la transplantation (n - 1). (C) Mesures moyennes ELISA de l'insuline humaine à partir du sérum des souris après un faible (2,5 mM) ou élevé (15 mM) défi de glucose ou de chlorure de potassium (KCl) stimulation à (C) 2 semaines et (D) 16 semaines après la transplantation du pancréas cellules progénitrices différenciées du contrôle et des HESC d'Un Traitement DMSO (barres d'erreur - SEM ; n - 3 à 2 semaines et 16 semaines pour le contrôle ; n ' 2 à 2 semaines et 16 semaines pour DMSO). ANOVA bidirectionnel : p 0,0051 pour le contrôle par rapport à DMSO à 2 semaines; p - 0,0116 pour le contrôle par rapport à DMSO à 16 semaines. Les souris étudiées aux différents moments sont différentes. Les résultats sont adaptés de Chetty et coll.3. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
En résumé, ce protocole décrit un outil simple et peu coûteux pour améliorer la capacité de différenciation des cellules souches pluripotentes (CSP) à toutes les couches germinales primaires, à divers types de cellules progénitrices spécialisées, et même aux types fonctionnels et matures de cellules in vitro. et les paramètres in vivo. Illustrés sont des protocoles de différenciation spécifiques qui ont été effectivement reproduits dans notre laboratoire ainsi que d'autres, mais tout protocole de différenciation de choix peut être utilisé après le traitement DMSO. Comme le montre le tableau 1, un certain nombre de laboratoires ont également démontré une amélioration de la différenciation de la CFP après un traitement d'Administration numérique transitoire utilisant différents paradigmes pour générer divers autres types de cellules terminales. En outre, bien que les méthodes décrivent ici l'utilisation des CSP humains, le prétraitement DMSO peut être utilisé entre les espèces et s'est avéré efficace chez les cSP de souris, de lapins et de primates.
Bien que des doses plus élevées de DMSO soient connues pour être cytotoxiques, les faibles doses utilisées dans cette méthode (1%-2%) pour une période transitoire entraîner une mort cellulaire minimale. Alors que le nombre global de cellules immédiatement après le traitement DMSO peut diminuer en raison de la promotion DMSO de l'arrêt du cycle cellulaire dans la phase G1 du cycle cellulaire, des études antérieures montrent que les cellules sont en mesure d'atteindre le même niveau de confluence que les cultures témoins après l'ablation de DMSO3.
Le pourcentage et la durée du prétraitement DMSO devraient être optimisés par ligne cellulaire. Le temps de traitement doit être ajusté en tenant compte du temps de cycle/doublement des cellules. Par exemple, les CSP de souris ont généralement des temps de vélo beaucoup plus courts d'environ 15 h; ainsi, le traitement de DMSO pour 15 h pour ces cellules est suffisant. Certains laboratoires ont également constaté que le traitement DMSO était bénéfique lorsqu'il est maintenu pendant le protocole de différenciation ou à des concentrations plus faibles (voir le tableau 1). Il convient de noter que certaines lignes de la CFP sont plus modifiables à la différenciation par rapport à des lignées spécifiques. Par exemple, il a été démontré que les cellules HUES6 sont moins permissives à la différenciation et ont donc connu une amélioration marquée avec le traitement DMSO (figure 2). Alternativement, il a été démontré que les cellules HUES8 utilisées dans la figure 4 et la figure 5 ont une plus grande propension à la différenciation endodermale; ainsi, moins de différences ont été montrées entre le contrôle et DMSO pour la différenciation aux étapes initiales vers l'endoderm définitif. Néanmoins, l'amélioration du prétraitement DMSO est observée à des stades ultérieurs de différenciation dans cette lignée cellulaire (figure 4B). Le traitement DMSO est également polyvalent en ce qu'il est efficace dans les deux systèmes de cultures cellulaires 2D et 3D, il peut être utilisé avec différents types de matériau de revêtement sur les plaques de culture cellulaire, et il fonctionne dans différents types de milieu d'entretien qui favorisent la croissance et l'expansion de hPSC (p. ex. mTeSR, E8, médias conditionnés MEF, etc.).
Plus généralement, ces résultats suggèrent que l'état de départ des cellules souches pluripotentes a une forte influence sur la propension à la différenciation initiale ainsi qu'à la différenciation terminale en types de cellules fonctionnelles. Nous avons précédemment montré que le traitement DMSO fonctionne par rb dans hPSCs3,5. Rb joue un rôle important dans la promotion de la différenciation terminale, la survie cellulaire, et la stabilité génétique des cellules41,42,43,44, et il peut donc expliquer les effets persistants sur les cellules différenciés des hPSC traités par DMSO. Cibler ces premiers modes de régulation peut placer les HPSC sur une meilleure trajectoire de différenciation et, en fin de compte, améliorer leur utilité pour la médecine régénérative.
Déclarations de divulgation
Les auteurs n'ont rien à divulguer.
Remerciements
Ce travail a été soutenu par des subventions de la Stanford University School of Medicine et une bourse Siebel décernée à S. C.
matériels
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 21985023 | |
| 6-well Clear Flat Bottom TC-treated Multiwell Cell Culture Plate | Corning | 353046 | |
| 9-Position stir plate | Chemglass | CLS-4100 | |
| Accutase | Gibco | 11105-01 | |
| Activin A | R&D Systems | 338-AC | |
| Advanced RPMI | Gibco | 12633012 | |
| Alk5i II | Axxora | ALX-270-445 | |
| All-trans retinoic acid | Sigma-Aldrich | R2625 | |
| anti-Brachyury | R&D Systems | AF2085 | No variablity observed across different lot numbers |
| anti-C-peptide | Developmental Studies Hybridoma Bank | GN-ID4 | No variablity observed across different lot numbers |
| anti-FoxA2 | Millipore | 07-633 | No variablity observed across different lot numbers |
| anti-Nkx2.2 | University of Iowa, Developmental Hybridoma Bank | 74.5A5 | No variablity observed across different lot numbers |
| anti-Nkx6.1 | University of Iowa, Developmental Hybridoma Bank; | F55A12-supernatant | No variablity observed across different lot numbers |
| anti-Olig2 | EMD Millipore | MABN50 | No variablity observed across different lot numbers |
| anti-Pax-6 | Biolegend | 901301 | No variablity observed across different lot numbers |
| anti-Pdx1 | R&D Systems | AF2419 | No variablity observed across different lot numbers |
| anti-SOX1 | R&D Systems | AF3369 | No variablity observed across different lot numbers |
| anti-SOX17 | R&D Systems | AF1924 | No variablity observed across different lot numbers |
| B-27 Supplement, minus Vitamin A | Gibco | 12587010 | |
| Basic fibroblast growth factor | Gibco | PHG0264 | |
| Betacellulin | Thermo Fisher Scientific | 50932345 | |
| Chir99021 | Stemgent | 04-000-10 | |
| CMRL 1066 | Corning | 99-603-CV | |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAF1000 | |
| D-(+)-Glucose | Sigma | G7528 | |
| DAPI | Invitrogen | D1306 | |
| Disposable Spinner Flasks | Corning, VWR | 89089-814 | |
| DMEM/F-12 | Gibco | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Essential 6 Media | Gibco | A1516501 | |
| FAF-BSA | Proliant | 68700 | |
| FGF7 | PeproTech | 100-19 | |
| Geltrex | Gibco | A1413202 | |
| GlutaMAX | Gibco | 35050061 | |
| Heparin | Sigma | H3149 | |
| Human Ultrasensitive Insulin ELISA | ALPCO Diagnostics | 80-INSHUU-E01.1 | |
| ITS-X | Invitrogen | 51500056 | |
| KGF | Peprotech | AF-100-19 | |
| Knockout DMEM | Gibco | 10829018 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| L-3,3′,5-Triiodothyronine (T3) | EMD Millipore | 642245 | |
| LDN193189 | Stemgent | 04-0074 | |
| Matrigel Matrix | Corning | 354277 | |
| MCDB-131 | Cellgro | 15-100-CV | |
| MEM NEAA | Gibco | 11140050 | |
| mTeSR 1 | StemCell Technologies | 5850 | |
| N2 Supplement | Life Technologies | 17502048 | |
| NaHCO3 | Sigma | S3817 | |
| Noggin Fc Chimera Protein | R&D Systems | 3344-NG-050 | |
| PdBU | EMD Millipore | 524390 | |
| Penicillin/Streptomycin | Mediatech | 30-002-CI | |
| RPMI | Gibco | 11875-093 | |
| Sant1 | Sigma-Aldrich | S4572 | |
| SB431542 | Stemgent | 04-0010 | |
| Smoothened Agonist, SAG | EMD Millipore | 566660 | |
| StemPro Accutase | Gibco | A1110501 | |
| TrypLE | Gibco | 12604013 | |
| Ultra-Low Attachment Microplates | Corning | 3471 | |
| Vitamin C | Sigma-Aldrich | A4544 | |
| Wnt3a | R&D Systems | 5036-WN | |
| XAV 939 | Tocris | 3748 | |
| XXI | EMD Millipore | 565790 | |
| Y-27632 | StemCell Technologies | 72302 |
Références
- Osafune, K., et al. Marked differences in differentiation propensity among human embryonic stem cell lines. Nature Biotechnology. 26 (3), 313-315 (2008).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Review Genetics. 15 (2), 82-92 (2014).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Conklin, J. F., Sage, J. Keeping an eye on retinoblastoma control of human embryonic stem cells. Journal of Cellular Biochemistry. 108 (5), 1023-1030 (2009).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110 (2018).
- Hartwell, L. H., Weinert, T. A. Checkpoints: controls that ensure the order of cell cycle events. Science. 246 (4930), 629-634 (1989).
- Pardee, A. B. G1 events and regulation of cell proliferation. Science. 246 (4930), 603-608 (1989).
- Orford, K. W., Scadden, D. T. Deconstructing stem cell self-renewal: genetic insights into cell-cycle regulation. Nature Review Genetics. 9 (2), 115-128 (2008).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453 (7194), 519-523 (2008).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells. 26 (4), 894-902 (2008).
- Duan, Y., et al. Differentiation and characterization of metabolically functioning hepatocytes from human embryonic stem cells. Stem Cells. 28 (4), 674-686 (2010).
- Szkolnicka, D., Farnworth, S. L., Lucendo-Villarin, B., Hay, D. C. Deriving functional hepatocytes from pluripotent stem cells. Current Protocols in Stem Cell Biology. 30, 1-12 (2014).
- Vanhove, J., et al. H3K27me3 Does Not Orchestrate the Expression of Lineage-Specific Markers in hESC-Derived Hepatocytes In Vitro. Stem Cell Reports. 7 (2), 192-206 (2016).
- Kanebratt, K. P., Andersson, T. B. Evaluation of HepaRG cells as an in vitro model for human drug metabolism studies. Drug Metabolism & Disposition. 36 (7), 1444-1452 (2008).
- Nikolaou, N., Green, C. J., Gunn, P. J., Hodson, L., Tomlinson, J. W. Optimizing human hepatocyte models for metabolic phenotype and function: effects of treatment with dimethyl sulfoxide (DMSO). Physiological Reports. 4 (21), (2016).
- Kondo, Y., et al. An efficient method for differentiation of human induced pluripotent stem cells into hepatocyte-like cells retaining drug metabolizing activity. Drug Metabolism Pharmacokinetics. 29 (3), 237-243 (2014).
- Alizadeh, E., et al. The effect of dimethyl sulfoxide on hepatic differentiation of mesenchymal stem cells. Artificial Cells, Nanomedicine, and Biotechnology. 44 (1), 157-164 (2016).
- Czysz, K., Minger, S., Thomas, N. DMSO efficiently down regulates pluripotency genes in human embryonic stem cells during definitive endoderm derivation and increases the proficiency of hepatic differentiation. PLoS One. 10 (2), 0117689 (2015).
- Ogaki, S., Morooka, M., Otera, K., Kume, S. A cost-effective system for differentiation of intestinal epithelium from human induced pluripotent stem cells. Scientific Reports. 5, 17297 (2015).
- Choi, S. C., et al. Mixl1 and Flk1 Are Key Players of Wnt/TGF-beta Signaling During DMSO-Induced Mesodermal Specification in P19 cells. Journal of Cellular Physiology. 230 (8), 1807-1821 (2015).
- Chetty, S., et al. A Src inhibitor regulates the cell cycle of human pluripotent stem cells and improves directed differentiation. Journal of Cell Biology. 210 (7), 1257-1268 (2015).
- Qiu, Z., et al. Marmoset induced pluripotent stem cells: Robust neural differentiation following pretreatment with dimethyl sulfoxide. Stem Cell Research. 15 (1), 141-150 (2015).
- Swartz, E. W., et al. A Novel Protocol for Directed Differentiation of C9orf72-Associated Human Induced Pluripotent Stem Cells Into Contractile Skeletal Myotubes. Stem Cells Translational Medicine. 5 (11), 1461-1472 (2016).
- Teimourian, S., Moghanloo, E. Thwarting PTEN Expression by siRNA Augments HL-60 Cell Differentiation to Neutrophil-Like Cells by DMSO and ATRA. DNA Cell Biology. 35 (10), 591-598 (2016).
- van den Berg, C. W., Elliott, D. A., Braam, S. R., Mummery, C. L., Davis, R. P. Differentiation of Human Pluripotent Stem Cells to Cardiomyocytes Under Defined Conditions. Methods in Molecular Biology. 1353, 163-180 (2016).
- Deng, F., et al. Combination of retinoic acid, dimethyl sulfoxide and 5-azacytidine promotes cardiac differentiation of human fetal liver-derived mesenchymal stem cells. Cell Tissue Bank. 17 (1), 147-159 (2016).
- Yoon, S. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2018).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637 (2018).
- Kroon, E., et al. Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo. Nature Biotechnology. 26 (4), 443-452 (2008).
- Zhang, P., et al. Short-term BMP-4 treatment initiates mesoderm induction in human embryonic stem cells. Blood. 111 (4), 1933-1941 (2008).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Tchieu, J., et al. A Modular Platform for Differentiation of Human PSCs into All Major Ectodermal Lineages. Cell Stem Cell. 21 (3), 399-410 (2017).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Fiore, M., Degrassi, F. Dimethyl sulfoxide restores contact inhibition-induced growth arrest and inhibits cell density-dependent apoptosis in hamster cells. Experimental Cell Research. 251 (1), 102-110 (1999).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Bock, C., et al. Reference Maps of human ES and iPS cell variation enable high-throughput characterization of pluripotent cell lines. Cell. 144 (3), 439-452 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- D'Amour, K. A., et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nature Biotechnology. 24 (11), 1392-1401 (2006).
- Jacks, T., et al. Effects of an Rb mutation in the mouse. Nature. 359 (6393), 295-300 (1992).
- Nguyen, D. X., Baglia, L. A., Huang, S. M., Baker, C. M., McCance, D. J. Acetylation regulates the differentiation-specific functions of the retinoblastoma protein. The EMBO Journal. 23 (7), 1609-1618 (2004).
- Slack, R. S., et al. Cells differentiating into neuroectoderm undergo apoptosis in the absence of functional retinoblastoma family proteins. Journal of Cell Biology. 129 (3), 779-788 (1995).
- Gu, W., et al. Interaction of myogenic factors and the retinoblastoma protein mediates muscle cell commitment and differentiation. Cell. 72 (3), 309-324 (1993).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon