Method Article
Tratamento transitório de células-tronco pluripotentes humanas com DMSO para promover a diferenciação
Neste Artigo
Resumo
A geração de tipos de células diferenciadas a partir da célula-tronco pluripotente humana (hPSCs) possui grande promessa terapêutica, mas permanece desafiadora. PSCs muitas vezes exibem uma incapacidade inerente para diferenciar mesmo quando estimulado com um conjunto adequado de sinais. Descrito aqui é uma ferramenta simples para melhorar a diferenciação multilinhagem através de uma variedade de linhas PSC.
Resumo
Apesar do uso crescente de pilhas de haste pluripotentes (PSCs), os desafios em diferenciar eficientemente as pilhas de haste pluripotentes embrionárias e induzidas (ESCs e iPSCs) através das várias linhagens permanecem. Inúmeros protocolos de diferenciação foram desenvolvidos, mas a variabilidade entre as linhas celulares e as baixas taxas de diferenciação concebe desafios na implementação bem-sucedida desses protocolos. Descrito aqui é um meio fácil e barato para aumentar a capacidade de diferenciação de PSCs. Tem sido mostrado previamente que o tratamento de pilhas de haste com uma baixa concentração de dimetil sulfóxido (DMSO) aumenta significativamente a propensão de uma variedade de PSCs para diferenciar-se aos tipos diferentes da pilha que seguem a diferenciação dirigida. Esta técnica foi mostrada agora para ser eficaz através das espécies diferentes (por exemplo, rato, primata, e ser humano) em linhagens múltiplas, variando dos neurônios e dos esferoides corticais às pilhas de músculo lisas e aos hepatocytes. O pré-tratamento de DMSO melhora a diferenciação do PSC regulando o ciclo de pilha e as pilhas de haste de escorva para ser mais responsivo aos sinais da diferenciação. Fornecido aqui é a metodologia detalhada para usar esta ferramenta simples como um meio reprodutível e extensamente aplicável para diferenciar mais eficientemente PSCs a toda a linhagem da escolha.
Introdução
O uso de células-tronco pluripotentes levou a inúmeros avanços na pesquisa biomédica, incluindo os campos de medicina regenerativa e terapias baseadas em células-tronco, modelagem de doenças e triagem de drogas. Conduziu também à perspectiva global de uma investigação mais traduzível e de uma medicina personalizada. O advento da tecnologia de células-tronco pluripotentes induzidas (iPSC) há mais de 20 anos permitiu que pesquisadores desenvolvessem células-tronco pluripotentes a partir de tecidos somáticos e diferenciá-los em tipos de células funcionais para estudar uma variedade de patologias, incluindo doenças cardiovasculares, neurológicas e imunológicas. Embora avanços significativos tenham sido feitos na tecnologia de diferenciação de células-tronco, os desafios na diferenciação efetiva de células-tronco embrionárias humanas (hESCs) e iPSCs ainda persistem, limitando o uso generalizado da tecnologia de células-tronco em diferentes programas de pesquisa. A variabilidade inerente em diferentes linhagens celulares e clones continua a representar obstáculos para diferenciar as linhagens de células-tronco para as linagens desejadas1. Além disso, derivar células funcionais, terminalmente diferenciadas de hPSCs continua sendo um processo tedioso e ineficiente em muitas linhagens. Na verdade, as células diferenciadas de hPSCs muitas vezes não conseguem se diferenciar terminalmente em células funcionais2. Em outras terapias baseadas em células-tronco em movimento para uso em pacientes, há uma necessidade de melhorar e garantir a eficácia das células que são geradas a partir de hPSCs.
Nosso laboratório estabeleceu uma ferramenta rápida e barata para aumentar significativamente a eficiência de diferenciar iPSCs e ESCs em tipos de células maduras. Nós encontramos que o pré-tratamento de hipscs e de hESCs com o dimetil sulfóxido comumente usado do reagente (DMSO) para 24 h a 48 h antes da diferenciação dirigida conduz a uma melhoria marcada na capacidade da diferenciação da pilha de haste. O tratamento com DMSO aumenta a proporção de hiPSCs e hESCs na fase inicial do G1 do ciclo celular e ativa a proteína de retinoblastoma (RB)3, um regulador crítico de proliferação celular, sobrevivência e diferenciação4. Em trabalhos mais recentes, verificou-se que RB e seus membros da família são necessários para os efeitos pró-diferenciação do DMSO, de modo que a inativação transitória do RB suprime os efeitos do DMSO, enquanto a ativação constitutiva do RB de forma transitória aumenta Efeitos do DMSO5. Análoga ao ciclo celular durante o desenvolvimento embrionário, o ciclo celular de ESCS e iPSCs é caracterizado por uma fase abreviada do G1 que promove a autorenovação6,7,8. Esta fase abreviada do G1 permite uma proliferação mais irrestrita, mas limita o potencial de diferenciação de4,9. Promovendo a apreensão do crescimento em G1 e ativando controles do ponto de verificação no ciclo de pilha de hESCs e de iPSCs, o tratamento de DMSO primos pilhas para mudanças do destino da pilha que seguem a diferenciação dirigida.
Até o momento, o pré-tratamento com DMSO demonstrou melhorar a capacidade de diferenciação para todas as três camadas germinativas em mais de 30 controle e as linhas de células ESC e IPSC humanas específicas da doença3,5 , bem como a diferenciação de células-tronco e outras linhas celulares para uma variedade de outros tipos de células maduras em estudos subsequentes10,11,12,13,14,15,16, 17 anos de , 18 anos de , 19 anos de , 20 anos de , 21 anos de , 22 anos de , 23 anos de , 24 de cada , 25 anos de , 26 anos de , 27 anos de , 28 (tabela 1). Além disso, o tratamento com DMSO demonstrou ser eficaz no aprimoramento da diferenciação de células primárias não humanas21,23 (por exemplo, mouse, Primaz, coelho), sugerindo mecanismos compartilhados entre espécies. Por fim, o pré-tratamento com DMSO também foi estendido para a tecnologia de edição de genes, com um estudo específico mostrando que 24 h de pré-tratamento de DMSO de hESCs/iPSCs aumentaram significativamente a capacidade de repetições Palindromicas curtas agrupadas regularmente Interespaçadas (CRISPR) /Proteína-9 associada (Cas9)-eficiência de edição mediada de DNA não-codificante sem incorporar mutações não intencionais29. Aqui é fornecida uma metodologia detalhada do pré-tratamento do DMSO de hESCs e iPSCs para aplicações em biologia de células-tronco e diferenciação direcionada.
Protocolo
1. manutenção de células-tronco
Nota: O protocolo de manutenção celular descrito abaixo se aplica às células-tronco pluipotentes (PSCs) mantidas em monocamada aderente. A mídia, outros reagentes e placas de cultura de células usadas antes do tratamento com DMSO podem ser ajustadas conforme necessário. Para todos os protocolos a seguir neste manuscrito, as células devem ser tratadas um gabinete de segurança biológica.
- Revestimento estéril, 6 bem, placas cultura-tratadas do tecido com uma matriz ou uma carcaça célula-qualificada pluripotente da haste preparada por instruções do fabricante e incubar pelo menos 1 h em uma incubadora do CO2 (5% co2, atmosfera húmida). As chapas revestidas podem ser enroladas em filme e armazenadas a 4 ° c por até uma semana.
- Descongele os PSCs criopreservados em um banho de água de 37 ° c. Esterilize o frasco com etanol antes da introdução ao armário de segurança biológico, a seguir transfira imediatamente as pilhas pipetando a um tubo cônico estéril que contem 5-10 volumes de meios pré-aquecido da pilha de haste.
- Centrifugue as células a 300 x g durante 5 min à temperatura ambiente (RT).
- Aspirar a mídia e ressuscite suavemente o pellet celular em 1 mL de suportes de células-tronco suplementados com um inibidor de 10 μM ROCK, como Y-27632.
- Aspirar a matriz de cultura da placa e semente as células na densidade desejada, tipicamente 0,5-1 x 106 células por poço em pelo menos 2 ml de suportes de células estaminais por poço.
Nota: A densidade do chapeamento pode variar através das linhas de pilha diferentes, e os clones e devem ser aperfeiçoados conformemente. - Manter as células, substituindo com pré-aquecido mídia de células-tronco diariamente. Divida as células em cerca de 70%-80% confluência ou quando as colônias de células começam a fazer contato.
- Para dividir as células, aspirar a mídia e lavar as células uma vez com PBS estéril. Incubar as células com 1 mL de uma solução enzimática de dissociação por poço por 5-10 minutos a 37 ° c.
- Lave e ressuspender as pilhas com meios pré-aquecidos da pilha de haste e transferência a um tubo cónico estéril com 5-10 volumes de meios da pilha de haste. Siga os passos 1.3-1.7 para a placa das células.
2. DMSO pré-tratamento
Nota: Ao galvanizar as células para o pré-tratamento com DMSO antes da diferenciação, a densidade de células de chapeamento inicial deve ser otimizada com a consideração da taxa de crescimento típica da linha de células-tronco, bem como o protocolo de diferenciação que está sendo usado. Validar a pluripotência usando marcadores convencionais, conforme necessário. As células devem ser passadas pelo menos 1x-2x após a descongelar inicial antes da diferenciação.
-
diferenciação da cultura 2D
- Quando as células atingem uma confluência adequada, prepare placas revestidas, dissociar as células, e preparar uma suspensão de uma única célula como descrito acima.
- Conte as células ao vivo usando um hemociômetro ou contador automático de células, incluindo o azul de Tripan ou outro marcador de viabilidade.
- Placa as pilhas em uma placa revestida de 6 poços em 0.5-1 x 106 pilhas por bem em meios da pilha de haste com o inibidor da rocha de 10 μm.
Nota: Para as linhagens celulares testadas em nosso laboratório, essas densidades tipicamente resultaram em 80%-90% de células confluentes dentro do pré-tratamento de 24 h DMSO. - Permitir que as células incubar por 24 h a 37 ° c em uma incubadora de CO2 (5% co2, atmosfera úmida).
- Prepare 1%-2% DMSO em meios de células-tronco pré-aquecidos (por exemplo, 100 μL de DMSO em 10 mL de mídia = 1% DMSO solução, ou 200 μL DMSO em 10 mL de mídia = 2% DMSO solução).
- Após 24 h incubação, aspirar a mídia de células e substituí-lo com DMSO solução.
- Permitir que as células incubar por 24 h a 48 h a 37 ° c em uma incubadora de CO2 (5% co2, atmosfera úmida) antes da diferenciação.
Nota: Tipicamente, um tratamento de DMSO de 24 h é suficiente através de uma maioria de linhas humanas do ESC e do iPSC. As linhas celulares com taxas de crescimento muito lentas (tempos de duplicação longos) podem se beneficiar da incubação de 48 h com DMSO. Para uma incubação de 48 h com DMSO, os meios podem ser substituídos com os meios frescos da pilha de haste com o DMSO de 1%-2% após os primeiros 24 h do tratamento.
-
diferenciação da cultura 3D:
- Quando as células atingem uma confluência apropriada, dissociam e coletam as células em uma suspensão celular, como descrito acima.
- Conte as células ao vivo usando um hemociômetro ou contador automático de células, incluindo um marcador de viabilidade.
- Placa as células em um não revestido, baixo-anexo 6 placa bem em 0,5-1 x 106 células por poço em suportes de células-tronco com 10 μm de inibidor de rocha.
Nota: Para as linhas celulares testadas em nosso laboratório, essas densidades tipicamente resultaram em formação de esfera 3D hPSC dentro de 24 h de células de ajuste. - Permitir que as células incubar por 24 h a 37 ° c em uma incubadora de CO2 (5% co2, atmosfera úmida).
- Prepare 1%-2% DMSO em suportes pré-aquecidos de células estaminais (por exemplo, 100 μL de DMSO em 10 mL de Media = 1% DMSO solução, ou 200 μL de DMSO em 10 mL de Media = 2% DMSO solução).
- Substitua a mídia seguindo os procedimentos padrão (por exemplo, incline a placa em um ângulo de 30 °-45 ° para permitir que as esferas das células se instalem na parte inferior do poço; células de transferência para um tubo cônico estéril e permitir que as esferas das células se instalem na parte inferior do tubo; ou gentilmente coletar células i n suspensão usando uma pipeta de 5 ou 10 mL em um tubo cônico estéril e células centrífugas em 300 x g por 5 min em RT).
- Aspirar a mídia de células e substituí-lo com DMSO solução, pipetagem suavemente.
- Permitir que as células incubar por 24 h a 48 h a 37 ° c em uma incubadora de CO2 (5% co2, atmosfera úmida) antes da diferenciação.
Nota: Tipicamente, um tratamento de DMSO de 24 h é suficiente através de uma maioria de linhas humanas do ESC e do iPSC. As linhas celulares com taxas de crescimento muito lentas (tempos de duplicação longos) podem se beneficiar da incubação de 48 h com DMSO. Para uma incubação de 48 h com DMSO, os meios podem ser substituídos com os meios frescos da pilha de haste com o DMSO de 1%-2% após os primeiros 24 h do tratamento.
3. diferenciação para camadas germinativas primárias
Nota: O seguinte descreve os métodos mostrados previamente para ser eficazes em nosso laboratório para PSCs crescidos em um monocamada em 6 placas do poço. Qualquer protocolo de diferenciação de escolha deve ser utilizado após o tratamento com DMSO para promover a diferenciação em linhagens desejadas. Remova a solução de DMSO após um tratamento de 24-48 h e prossiga com a diferenciação que segue protocolos padrão.
-
Diferenciação endoderma (adaptado de Kroon et al.30)
- Pré-trate células com DMSO como descrito acima para culturas 2D.
- Prepare Wnt3a e activin uma solução de ações.
- Prepare o dia 1 meios de diferenciação endodermal adicionando Wnt3a a uma concentração final de 20 ng/ml e de activin a a uma concentração final de 100 ng/ml ao volume apropriado de meios pré-aquecido de RPMI.
- Após o pré-tratamento com DMSO, aspirar meios das células e substituí-lo por meio do dia 1 (por exemplo, 2 mL por poço de uma placa de 6 poços).
- Permitir que as células incubar por 24 h a 37 ° c em uma incubadora de CO2 (5% co2, atmosfera úmida).
- Prepare os dias 2 e 3 meios de diferenciação endodermal adicionando activin a a uma concentração final de 100 ng/ml ao volume apropriado de meios pré-aquecido de RPMI.
- Aspirar a mídia das células e substituí-lo com mídia dia 2 (por exemplo, 2 mL por poço de uma placa de 6 poços).
- Permitir que as células incubar por 24 h a 37 ° c em uma incubadora de CO2 (5% co2, atmosfera úmida).
- Aspirar meios das pilhas e substituir com meios do dia 3 (por exemplo, 2 mL por o poço de uma placa de 6 poços).
-
Diferenciação mesoderma (adaptado de Zhang et al.31)
- Pretrate as células com DMSO como descrito acima para culturas 2D.
- Prepare Wnt3a e activin uma solução de ações.
- Prepare meios de diferenciação Mesodermal adicionando Wnt3a a uma concentração final de 20 ng/ml e de activin a a uma concentração final de 100 ng/ml ao volume apropriado de meios avançados pré-aquecido de RPMI.
- Após o pré-tratamento com DMSO, aspirar meios de células e substituir com meios de diferenciação (por exemplo, 2 mL por poço de uma placa de 6 poços).
- Permitir que as células incubar por 24 h a 37 ° c em uma incubadora de CO2 (5% co2, atmosfera úmida).
-
Diferenciação de ectoderma (adaptado de Chambers et al.32)
- Pretrate as células com DMSO como descrito acima para culturas 2D.
- Prepare soluções de ações Noggin e SB431542.
- Prepare meios de base da diferenciação ectodérmica dissolvendo a recolocação do soro do nocaute (KOSR) a uma concentração final de 10% no nocaute DMEM.
Nota: Prepare mídia base suficiente para 3-4 dias de mudança de mídia. - Prepare meios de diferenciação ectodérmicos adicionando Noggin a uma concentração final de 500 ng/ml e SB431542 a uma concentração final de 10 μm ao volume apropriado de kosr/Knockout pré-aquecido DMEM.
- Após o pré-tratamento com DMSO, aspirar meios de células e substituir com meios de diferenciação (por exemplo, 2 mL por poço de uma placa de 6 poços).
- Permitir que as células incubar por 3-4 dias a 37 ° c em uma incubadora de CO2 (5% co2, atmosfera úmida), substituindo mídia diária com fatores de diferenciação recém-adicionados.
4. diferenciação para tipos de células progenitoras
O seguinte descreve os métodos mostrados previamente para ser eficazes em nosso laboratório para PSCs crescidos em umas culturas 2D ou 3D. Qualquer protocolo de diferenciação de escolha deve ser utilizado após o tratamento com DMSO para promover a diferenciação em linhagens desejadas. Remova a solução de DMSO após um tratamento de 24-48 h e prossiga com a diferenciação que segue protocolos padrão.
- Diferenciação de células progenitoras neurais (adaptado de Tchieu et al.33)
- Prepare 6 placas de poço por revestimento com uma matriz ou substrato de fator de crescimento qualificado de células-tronco pluripotentes, de acordo com as instruções do fabricante, por pelo menos 1 h em uma incubadora de CO2 (5% co2, atmosfera úmida). As chapas revestidas podem ser enroladas em filme e armazenadas a 4 ° c por até 1 semana.
- Placas PSCs como descrito acima na densidade de 0.5-1 x 106 pilhas por bem em meios da pilha de haste que contêm um inibidor da rocha.
- Pré-trate células com DMSO como descrito acima para culturas 2D.
- Prepare pequenos inibidores químicos LDN193189, SB431542, e XAV939 soluções de ações.
- Prepare dias 1-3 meios de diferenciação do neuroectoderma completando 6 meios essenciais com 500 nanômetro LDN193189, 10 μM SB431542, e 2 μM XAV939.
- Após o pré-tratamento com DMSO, aspirar os meios de comunicação e substituir os meios de neuroectoderma Days 1-3 (por exemplo, 2 mL por poço de uma placa de 6 poços). Mude a mídia diariamente.
- Prepare dias 4-12 meios da diferenciação do neuroectoderma completando 6 meios essenciais com 500 nanômetro LDN193189 e 10 μM SB431542.
- No dia 4 de diferenciação, aspirar a mídia e substituir com dias 4-12 meios de neurodectoderm. Mude a mídia diariamente.
- Após 12 dias de diferenciação, as células diferenciadas devem expressar marcadores apropriados de células progenitoras neurais (NPCs). Os NPCs podem ser mantidos em meios neurais contendo DMEM/F-12, 2% B-27, 1% N-2 e suplementados com fator de crescimento básico de fibroblastos de 10 μg/mL (bFGF). Passagem dos NPCs quando confluentes usando uma solução de descolamento celular, chapeamento NPCs em 0,5-1 x 106 células por poço.
- Diferenciação das células progenitoras Oligodendrócito (adaptado de Douvaras e Fossati34)
- Placa os PSCs como descrito acima em uma densidade de 1 x 105 por bem em 6 placas revestidas do poço em meios da pilha de haste que contêm um inibidor da rocha.
- Pré-trate células com DMSO como descrito acima para culturas 2D.
- Prepare SB431542, LDN193189, todo-trans ácido retinóico (RA), e suavizada agonista (SAG) soluções de ações.
- Prepare dias 0 – 8 meios de diferenciação completando DMEM/F-12 com 10 μM SB431542, 250 nM LDN193189 e 100 nM RA.
- Após o pré-tratamento com DMSO, incubar células com meios de diferenciação por 8 dias, mudando a mídia diariamente com fatores de diferenciação recém-adicionados (por exemplo, 2 mL por poço de uma placa de 6 poços).
- No dia 8, substitua a mídia por DMEM/F-12 contendo 1x MEM não essenciais aminoácidos (NEAA) solução, 1X L-glutamina, 2-Mercaptoetanol, penicilina/estreptomicina, e 1x N-2 suplementado 100 nM RA e 1 μM SAG. Mude a mídia diariamente.
- Após 12 dias da diferenciação, as pilhas diferenciadas devem expressar marcadores apropriados de pilhas do progenitor do oligodendrocyte (OPCs).
- Diferenciação de células progenitoras endócrinas (adaptado de Pagliuca et al.35)
- Sementes de PSCs a 6 x 105 células/ml em suportes de células estaminais mais 10 μm de inibidor de rocha em frascos de spinner de 500 ml colocados em uma placa de agitação de 9 posições definida na taxa de rotação de 70 rpm em uma incubadora de 37 ° c, 5% co2e 100% de umidade.
- Permitir que os clusters se instalem na parte inferior do balão, aspirar a mídia e, em seguida, pré-tratar com 1%-2% DMSO.
- Prepare as soluções de ações activin A, Chir99021, KGF, Sant1, all-trans retinóico Acid (RA), LDN193189, PdBU, XXI, Alk51, T3 e Betacelluin.
- Prepare a mídia base de diferenciação com base na formulação na tabela 3.
- Após o pré-tratamento com DMSO, aspirar meios de comunicação e substituir com A mídia S1 suplementado com 100 ng/mL activin A e 3 mM Chir99021 (por exemplo, 500 mL por balão). Permitir incubação para 24 h.
- No dia 2, substitua a mídia com mídia S1 suplementada com 100 ng/mL activin A. permitir incubação por 2 dias.
- No dia 4, substitua a mídia pela mídia S2 suplementada com 50 ng/mL KGF. Permitir incubação por 3 dias, mudando de mídia após os primeiros 2 dias (dia 6).
- No dia 7, substitua mídia com mídia S3 suplementada com 50 ng/mL KGF, 0,25 mM Sant1, 2 mM RA e 200 nM LDN193189. Permitir incubação para 24 h.
- No dia 8, substitua mídia com mídia S3 suplementada com 50 ng/mL KGF, 0,25 mM Sant1, 2 mM RA, 200 nM LDN193189 e 500 PdBU nM. Permitir incubação para 24 h.
- No dia 9, substitua mídia com mídia S3 suplementada com 50 ng/mL KGF, 0,25 mM Sant1 e 100 nM RA. Permitir incubação por 5 dias, mudando a mídia a cada 2 dias (dia 11 e 13).
- Nos dias 14 e 16, substitua a mídia com a mídia S5 suplementada com 0,25 mM Sant1, 100 nM RA, 1 mM XXI, 10 mM Alk5i II, 1 mM T3 e 20 ng/mL de betacellulin (4 dias de incubação total).
- Nos dias 18 e 20, substitua a mídia com a mídia S5 suplementada com 25 nM RA, 1 mM XXI, 10 mM Alk5i II, 1 mM T3 e 20 ng/mL de betacellulin.
5. validação Immunocytochemical da diferenciação
Nota: Os métodos a seguir descrevem um protocolo Immunocytochemical geral que pode ser ajustado conforme necessário. Os anticorpos primários são aqueles que foram previamente validados em nosso laboratório. Outras técnicas de validação da diferenciação também podem ser utilizadas (por exemplo, citometria de fluxo, qPCR, sequenciamento de RNA, western blotting, ensaios funcionais, etc.).
-
Células imunolabeling
- Para culturas 3D em suspensão, placas de células inteiras aglomerados ou clusters dispersos em uma única célula de suspensão em placas revestidas para 18-24 h antes da fixação.
- Aspirar meios de células aderentes e lavar brevemente com PBS em RT em uma coqueteleira.
- Para fixação celular, aspirar PBS e incubar células com paraformaldeído a 4% (PFA) em PBS por 20 min em RT na coqueteleira.
Atenção: O estoque de PFA deve ser preparado uma capa das emanações devido a sua toxicidade. Não inalar e usar equipamento de proteção pessoal adequado. - Remover PFA e descarte no recipiente de resíduos químicos adequados.
- Lave as células 3x com PBS por pelo menos 5 min por lavagem em RT em uma coqueteleira.
- Para a permeabilização celular e bloqueio, incubar células com 5% de soro de burro preparado em 0,3% Triton-x 100/PBS para 1 h em RT em uma coqueteleira.
- Prepare a solução de anticorpos primários na mesma solução utilizada para a permeabilização/bloqueio.
- Incubar na solução do anticorpo preliminar durante a noite em 4 ° c no abanador.
- Após a incubação durante a noite, lave as células 3x com PBS por pelo menos 5 min por lavagem em RT em uma coqueteleira.
- Prepare solução de anticorpos secundários em solução de permeabilização/bloqueio.
- Deixe incubar na solução secundária do anticorpo por 1 h em RT em um abanador.
- Aspirar solução de anticorpos secundários e células de lavagem 3x com PBS por pelo menos 5 min por lavagem em RT em um Shaker.
- Incubar células com DAPI ou outro marcador preferencial para o tempo de incubação adequado, e enxaguar em PBS.
-
Quantificação da imagem
- Adquira um mínimo de três imagens por condição em um microscópio fluorescente e/ou com uma plataforma de triagem de alto conteúdo.
- Quantificar o percentual de células positivas para cada marcador contando o número total de células manchadas de anticorpos e números de células totais (com base na coloração de núcleos DAPI/Hoechst) usando softwares de imagens não tendenciosos (por exemplo, ImageJ) ou uma plataforma de triagem automatizada para Análises.
Resultados
Morfologia dos iPSCs tratados com DMSO
As iPSCs humanas derivadas de indivíduos de controle foram cultivadas em uma monocamada 2D aderente ou em esferas de células 3D em suspensão. Aproximadamente 24 h após o chapeamento inicial, as pilhas foram tratadas com o DMSO de 1% ou de 2% para 24 h no meio da manutenção. As imagens representativas do brightfield após o tratamento com DMSO são mostradas na Figura 1. Consistente com os relatórios precedentes para iPSCs mantidos em um monocamada3, o pré-tratamento de DMSO conduziu a uma diminuição dose-dependente transiente na taxa de crescimento em comparação às pilhas não-DMSO tratadas (Figura 1a). Esta proliferação diminuída é associada com um aumento no contato Cell-to-Cell, que é pronunciado especial nas pilhas tratadas DMSO de 2% que indicam a formação aumentada de umas colônias mais altamente aglomeradas da pilha. Em outros tipos de células, a parada G1 induzida pelo DMSO demonstrou estar associada ao aumento da expressão de proteínas envolvidas nas interações célula-célula que suportam a parada de crescimento induzida por inibição de contato36. Nos iPSCs mantidos como esferas de células 3D, o tratamento com DMSO aumentou de forma semelhante o número de esferas celulares (Figura 1B). Além disso, o tratamento com DMSO também resultou em tamanhos de esfera 3D menos variáveis, o que tem sido mostrado anteriormente como indicativo de melhoria da capacidade de diferenciação das células37. Importante, nem 1% ou 2% DMSO resultou em toxicidade celular, medida por contagens de viabilidade (n = 3; cultura 2D% ao vivo = controle: 80 ± 1,3; 1% DMSO: 82 ± 3,7, 2%: 81 ± 2,7; cultura 3D% ao vivo = controle: 81 ± 4,3; 1% DMSO: 82 ± 6,7, 2%: 82 ± 2,7). Globalmente, esses resultados são consistentes com a noção de que o tratamento com DMSO altera o ciclo celular e os padrões de crescimento em células-tronco cultivadas. Estes efeitos na inibição do crescimento são reversíveis quando o DMSO é removido do meio, como mostrado previamente3.
O tratamento com DMSO melhora a diferenciação de ESCs nas camadas germinativas primárias
HUES6 hESCs foram semeados em placas revestidas por 24 h seguidos de tratamento com DMSO 2% por 24 h no meio de manutenção. As células foram então diferenciadas nas três camadas germinativas primárias seguindo os paradigmas de tratamento mostrados na Figura 2a30,31,32. As pilhas diferenciadas foram fixadas então e manchadas imunologicamente para marcadores prototípica de cada camada germinal respectiva (SOX17 para o endoderm, o brachyury para o mesoderm, e o SOX1 para o ectoderm). Como mostrado na Figura 2B, 24 h de pré-tratamento com DMSO de 2% aumentaram a proporção de células expressando cada marcador de camada germinal respectivo. Isto é consistente com os relatórios precedentes de nosso laboratório que mostram o immunoreactivity aumentado, a expressão de Gene, assim como o número absoluto de pilhas diferenciadas para todas as camadas germinais em pilhas de haste tratadas com o DMSO3,5. HUES6 é uma linha de hESC com propensão muito baixa para a diferenciação através de todas as linhagens1, contudo o tratamento do DMSO melhora substancialmente sua capacidade para diferenciar-se através de todas as camadas do germe.
O tratamento com DMSO melhora a diferenciação com os tipos de células progenitoras
Para investigar o efeito do DMSO na diferenciação aos tipos da pilha do progenitor do CNS, os iPSCs humanos foram diferenciados às pilhas de progenitor neural (NPCs) ou às pilhas do progenitor do oligodendrocyte (OPCs). Para a geração de NPCs, as células foram pré-tratadas com DMSO 2% por 24 h no meio de manutenção seguida de 12 dias de diferenciação direcionada33 (Figura 3A). Como mostrado na Figura 3B, o pré-tratamento com DMSO de 2% aumentou a expressão do marcador NPC PAX6 em relação ao controle. Usando outro protocolo previamente validado34 (Figura 3C), os iPSCs foram diferenciados por 12 dias em OPCS. Semelhante aos NPCs, os OPCs derivados de iPSCs pré-tratados com DMSO 2% por 24 h demonstraram uma proporção de aumento de células que expressam marcadores OPC OLIG2 (Figura 3D).
Um tratamento DMSO inicial persiste para realçar a diferenciação em tipos maduros da pilha
Para investigar o efeito do DMSO nos últimos estágios de um protocolo de diferenciação, HUES8 hESCs foram pré-tratados por 24 h com DMSO 2% antes da diferenciação para as células β após um protocolo de diferenciação dirigido por 20 dias descrito na Figura 4a 35. HUES8 foram utilizados, pois mostraram-se previamente com maior propensão à linhagem endodérmica1,38. No estágio definitivo do endoderme, as pilhas diferenciadas expressam SOX17 e FOXA2, marcadores específicos do endoderme definitivo (DE). Com diferenciação mais adicional no estágio dos progenitores pancreatic (PP1), as pilhas diferenciadas expressam PDX1 e FOXA2, marcadores característicos de pilhas pancreatic do progenitor. Nessas fases de diferenciação das células pancreáticas, as eficiências de indução em DE e posteriormente em PP1 foram elevadas tanto para o controle quanto para as hESCs tratadas com DMSO diferenciadas em cada uma dessas etapas (Figura 4B, estágios 1 e 3). mesmo que a linha celular de HUES8 tenha sido anotada para ter a propensão aumentada para diferenciar-se na linhagem endodermal, porque a diferenciação é induzida mais mais nos tipos mais especializados da pilha nos estágios terminais os hESCs DMSO-tratados são muito mais probabilidade de produzir células endócrinas pancreáticas maduras. As eficiências de geração de células progenitoras pancreáticas PDX1/NKX 6.1 +, Neurogenin 3 + células endócrinas e células NKX 6.1/C-peptide + SC-β foram substancialmente maiores nas hESCs tratadas com DMSO (Figura 4B, estágios 4 e 5). Estes resultados estão em consonância com a diferenciação NPC e OPC mostrando que o DMSO aumenta o potencial de diferenciação para os tipos de células progenitoras e também demonstra que o efeito do DMSO é persistente na geração de tipos de células mais especializados. Isto é consistente com o trabalho prévio, onde temos demonstrado que o tratamento inicial de 24 h DMSO aumenta a diferenciação em tipos de células terminais através de camadas germinativas, incluindo em células neuronais, bem como batendo cardiomiócitos31,39 em linhas celulares com propensões elevadas ou pobres para diferenciação3.
O tratamento inicial de DMSO melhora a função de célula derivada de hESC após transplante in vivo
Previamente, nós Demonstramos a eficácia do tratamento do DMSO em realçar a diferenciação de hESCs em pilhas pancreatic funcionais do progenitor que mostram mais tarde uma melhoria marcada na secreção do insulin in vivo3. Usando os protocolos previamente publicados3,30,40, HUES8 hESCs foram tratados com o DMSO de 1% para 24 h, diferenciados em pilhas pancreatic do progenitor, e transplantados em ratos scid-bege imuno-deficientes para avaliar (por exemplo, secreção de insulina em resposta a um desafio de glicose ou estimulação KCl) (Figura 5a). Enquanto as eficiências de diferenciação em FOXA2 + (~ 90%) e PDX1 + (~ 75%) os progenitores pancreatic eram comparáveis entre o controle e o DMSO-tratou hESCs (Figura 5B) para a linha de HUES8 hESC, as pilhas diferenciadas dos hESCs que seguem um tratamento de 24 h 1% DMSO tinham melhorado a compreensibilidade à glicose e ao KCl estimulação após o transplante in vivo. Melhorias na funcionalidade foram evidentes dentro de 2 semanas após o transplante (Figura 5C) e persistiu até pelo menos 16 semanas após o transplante (Figura 5D). Tomados conjuntamente, estes resultados sugerem que o pré-tratamento de DMSO aumente não somente a eficiência da diferenciação às camadas do germe, às pilhas do progenitor, e aos tipos mais maduros da pilha, mas igualmente que persiste para realçar a funcionalidade das pilhas diferenciadas in vivo.
| Tipo de célula diferenciado | Iniciando o tipo de célula | % DMSO | Comprimento do tratamento DMSO | Comprimento do tratamento DMSO |
| Células hepáticas | Esc Linha celular hepatoma Esc Esc Células-tronco mesenquimais iPSCs Esc Esc Linha celular hepatoma Esc | 1,0 1,0 1,0 0,5 0.1-2,0 1,0 1,0 0,5 1,0 0,6 | de 8 dias Vários dias de 7 dias 10-14 dias 7-21 dias de 7 dias de 4 dias de 5 dias 2-21 dias Ao longo | Basma et al., 2008 Kanebratt e Andersson, 2008 Hay et al., 2009 Duan et al., 2010 Alizadeh et al., 2014 Kondo et al., 2014 Szkolnicka et al., 2014 Czysz et al., 2015 Nikolaou et al., 2016 VANHOVE et al., 2016 |
| Camadas germinativas primárias | ESCs e iPSCs hESC hESC | 0.1-2,0 0,5 0.1-2,0 | 24 horas 24 horas 24 horas | Chetty et al., 2013 Chetty et al., 2015 Li et al., 2018 |
| Células cardíacas | ESCs e iPSCs P19 células ESCs e iPSCs Células-tronco mesenquimais fetais | 0.1-2,0 1,0 1,0-2,0 0,8-1,0 | 24 horas de 4 dias 24-30 horas 24 horas | Chetty et al., 2013 Choi et al., 2014 Van den Berg et al., 2016 Deng et al., 2017 |
| Células pancreáticas | ESCs e iPSCs hESC | 0.1-2,0 0,5 | 24 horas 24 horas | Chetty et al., 2013 Chetty et al., 2015 |
| Células musculares lisas | P19 células | 1,0 | de 4 dias | Choi et al., 2014 |
| Células endoteliais | P19 células | 1,0 | de 4 dias | Choi et al., 2014 |
| Enterócitos | iPSCs | 0-1,6 | de 4 dias | Ogaki et al., 2015 |
| Epitélio intestinal | iPSCs | 0-1,6 | de 4 dias | Ogaki et al., 2015 |
| Células neurais | Marmoset iPSC | 0,05-2,0 | 24 horas | Qiu et al., 2015 |
| Neutrófilos | Linha celular de leucemia | 1,25 | 6-8 dias | Teimourian e Moghanloo, 2016 |
| Miotubos esqueléticos | iPSCs | 1,5 | 24 horas | Swartz et al., 2016 |
| Organoide cortical | os hiPSCs | 1,0 | 24 horas | Yoon et al., 2018 |
Tabela 1: Resumo do trabalho previamente publicado demonstrando os efeitos benéficos do tratamento com DMSO na diferenciação.
| S1 | S2 | S3 | S5 | |
| MCDB131 (L) | 1 | 1 | 1 | 1 |
| Glicose (g) | 0,44 | 0,44 | 0,44 | 3,6 |
| NaHCO3 (g) | 2,46 | 1,23 | 1,23 | 1,754 |
| FAF-BSA (g) | 20 | 20 | 20 | 20 |
| ITS-X (mL) | 0, 2 | 0, 2 | 5 | 5 |
| Glutamax (mL) | 10 | 10 | 10 | 10 |
| Vitamina C (mg) | 44 | 44 | 44 | 44 |
| Heparina (mg) | 0 | 0 | 0 | 10 |
| P/S (mL) | 10 | 10 | 10 | 10 |
Tabela 2: componentes do medias da base da diferenciação da pilha do progenitor da glândula endócrina.
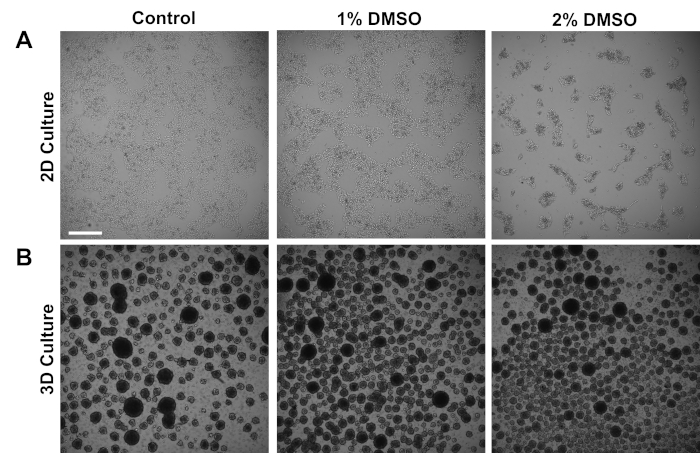
Figura 1 : O tratamento DMSO altera o crescimento de hPSCs. (A) imagens representativas do brightfield de hipscs chapeadas em um monocamada após ter recebido nenhum tratamento (controle) ou tratamento com 1% ou 2% DMSO para 24 h. DMSO promove uma inibição de crescimento dose-dependente transiente de iPSCs. (B) imagens representativas do brightfield de hipscs chapeadas em placas do baixo-acessório para permitir a formação da esfera 3D após ter recebido nenhum tratamento (controle) ou tratamento com 1% ou 2% DMSO para 24 h. o tratamento de DMSO conduz à formação menos variável da esfera 3D comparado ao controle. Barra de escala = 500 μm. por favor clique aqui para ver uma versão maior desta figura.
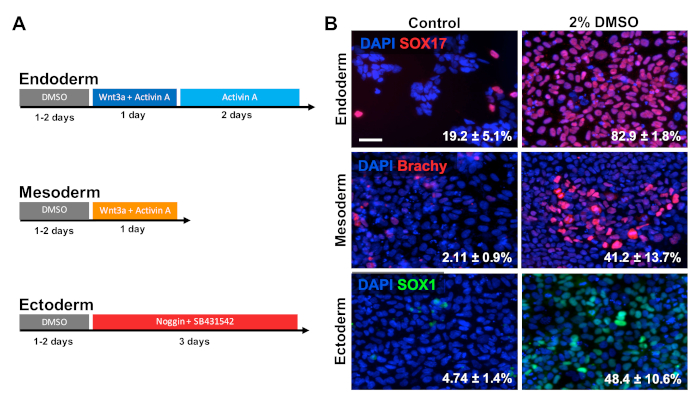
Figura 2 : O tratamento DMSO melhora a diferenciação de hPSCs para camadas germinativas primárias. (A) esquema de protocolos de diferenciação utilizados para gerar as três camadas germinativas primárias. (B) imagens representativas de HUES6 hESCs diferenciados imunolabeled para SOX17 (endoderma), brachyury (mesoderma), e SOX1 (ectoderma). O pré-tratamento com DMSO de 2% para 24 h aumentou a eficiência da diferenciação através de todas as três camadas do germe. Porcentagens de células diferenciando-se em SOX17 + endodérmica, brachyury (Brachy) + mesodérmica, ou SOX1 + células ectodérmicas após a diferenciação direcionada em cada camada germinativa de controle e os hESCs tratados com DMSO são observados com SEM de três repetições biológicas . Teste t não pareado: endoderma p = 0, 3; mesoderma p = 0, 47; ectoderma p = 0, 15. Barra de escala = 50 μm. por favor clique aqui para ver uma versão maior desta figura.
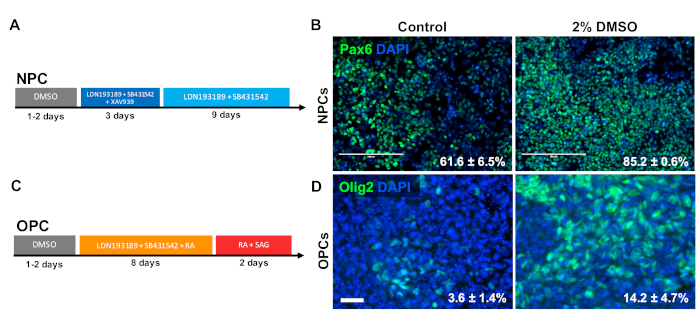
Figura 3 : O tratamento com DMSO melhora a diferenciação para os tipos de células progenitoras neurais. (A) esquema de protocolo de diferenciação utilizado para gerar células progenitoras neurais (NPCs). (B) imagens representativas de iPSCs humanos diferenciadas em NPCs imunolabeled para Pax6. 24 h de pré-tratamento com 2% de DMSO aumentou o número PAX6 células positivas. As porcentagens das pilhas que diferenciam em Pax6 + NPCs que seguem a diferenciação dirigida do controle e os iPSCs humanos DMSO-tratados são anotados com SEM de três repetições biológicas. Teste t não pareado: p = 0, 225. Barra de escala = 200 μm. (C) esquema de protocolo de diferenciação utilizado para gerar células progenitoras de Oligodendrócito (OPCS). (D) imagens representativas de iPSCs humanos diferenciadas em OPCS imunolabeled para marcadores OPC Olig2. 24 h de pré-tratamento com DMSO 2% aumentaram a expressão de ambos os marcadores OPC em comparação com o controle. As porcentagens das pilhas que diferenciam em Olig2 + OPCs que seguem a diferenciação dirigida do controle e os iPSCs humanos DMSO-tratados são anotados com SEM de quatro repetições biológicas. Teste t não pareado: p = 0, 466. Barra de escala = 50 μm. por favor clique aqui para ver uma versão maior desta figura.
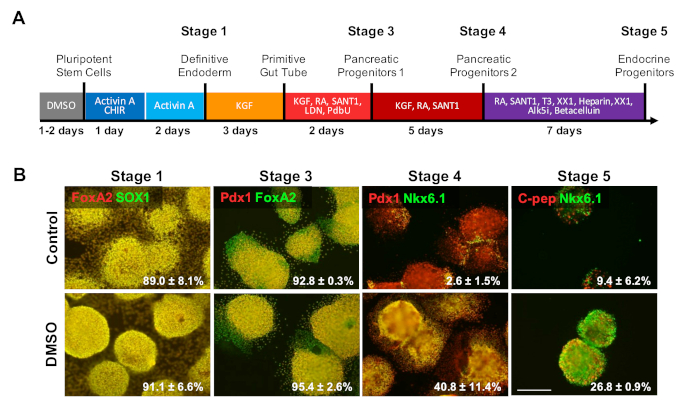
Figura 4 : O tratamento DMSO aumenta o potencial de diferenciação terminal de hPSCs. (A) esquema de uma diferenciação dirigida de ~ 20 dias de HUES8 hESCs em pilhas pancreatic terminalmente diferenciadas da glândula endócrina. (B) imunocoloração para os marcadores indicados em cada estágio de diferenciação após a diferenciação direcionada de células de controle não tratadas e células pré-tratadas com DMSO a 2% durante 24 h. O tratamento inicial do DMSO persiste para aumentar a diferenciação em tipos terminais da pilha da glândula endócrina nos últimos estágios da diferenciação dirigida. As porcentagens de células diferenciando-se nos marcadores indicados em cada estágio de diferenciação após a diferenciação direcionada de controle e as hESCs tratadas com DMSO são observadas com MEV de duas a quatro repetições biológicas. Barra de escala = 200 μm. por favor clique aqui para ver uma versão maior desta figura.
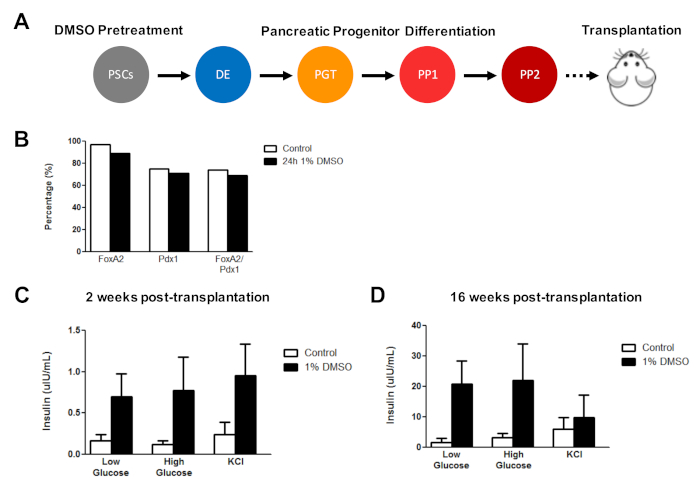
Figura 5 : O tratamento inicial de DMSO de hPSCs realça a resposta da glicose depois da transplantação de pilhas pancreatic do progenitor in vivo. (A) esquema de diferenciação dirigida (~ 15 dias) de HUES8 hESCs em células progenitoras PANCREÁTICAS (PP2) após nenhum tratamento (controle) ou um tratamento DMSO de 24 h 1% e subsequente transplante (5 milhões células) em imunodeficiências Camundongos SCID-bege. (B) percentual de células diferenciando-se em células progenitoras PANCREÁTICAS PDX1 + e FOXA2 + após a diferenciação dirigida in vitro de controle e hESCs tratados com DMSO imediatamente antes do transplante (n = 1). (C) medidas Elisa médias da insulina humana do soro de camundongos após um desafio de glicose baixa (2,5 mm) ou alta (15 mm) ou cloreto de potássio (KCl) a (c) 2 semanas e (D) 16 semanas após o transplante de pâncreas células progenitoras diferenciadas de controle e hESCs tratados com DMSO (barras de erro = SEM; n = 3 em 2 semanas e 16 semanas para controle; n = 2 em 2 semanas e 16 semanas para DMSO). ANOVA bidirecional: p = 0, 51 para controle versus DMSO em 2 semanas; p = 0, 116 para controle vs. DMSO às 16 semanas. Os camundongos estudados nos diferentes pontos temporais são diferentes. Os resultados são adaptados de Chetty et al.3. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Em resumo, este protocolo descreve uma ferramenta simples e barata para realçar a capacidade da diferenciação de pilhas de haste pluripotentes (PSCs) a todas as camadas de germe preliminares, vários tipos de pilhas especializadas do progenitor, e mesmo os tipos funcionais, maduros da pilha dentro in vitro e configurações in vivo. Ilustrados são protocolos específicos de diferenciação que foram efetivamente reproduzidos em nosso laboratório, bem como outros, mas qualquer protocolo de diferenciação de escolha pode ser usado após o tratamento DMSO. Como mostrado na tabela 1, vários laboratórios também demonstraram um aprimoramento da diferenciação do PSC após o tratamento com DMSO transiente usando diferentes paradigmas para gerar vários outros tipos de células terminais. Além disso, embora os métodos aqui descrevam o uso de PSCs humanos, o pré-tratamento com DMSO pode ser utilizado em todas as espécies e demonstrou ser efetivo em PSCs de camundongo, coelho e primatas.
Embora doses mais elevadas de DMSO sejam conhecidas como citotóxicas, as baixas doses utilizadas neste método (1%-2%) por um período transitório resultam em morte celular mínima. Quando os números de pilha totais imediatamente depois que o tratamento de DMSO pode diminuir devido à promoção do DMSO da apreensão do ciclo de pilha na fase G1 do ciclo de pilha, os estudos precedentes mostram que as pilhas podem alcangar o mesmo nível de confluência como culturas do controle após a remoção de DMSO3.
A porcentagem e a duração do pré-tratamento de DMSO devem ser otimizadas por linha celular. O tempo de tratamento deve ser ajustado com consideração para o tempo de ciclagem/duplicação das pilhas. Por exemplo, os PSCs do mouse normalmente têm tempos de ciclismo muito mais curtos de cerca de 15 h; assim, o tratamento de DMSO para 15 h para estas pilhas é suficiente. Alguns laboratórios também descobriram que o tratamento com DMSO é benéfico quando continuado durante o protocolo de diferenciação ou em concentrações mais baixas (ver tabela 1). Deve-se notar que algumas linhas do PSC são mais modificáveis à diferenciação para linhagens específicas. Por exemplo, as células HUES6 mostraram-se menos permissivas à diferenciação e, portanto, apresentaram melhora acentuada com o tratamento com DMSO (Figura 2). Alternativamente, as células HUES8 utilizadas na Figura 4 e na Figura 5 demonstraram ter uma maior propensão para a diferenciação endodérmica; assim, menos diferenças foram mostradas entre o controle e o DMSO para a diferenciação nos estágios iniciais para o endoderma definitivo. No entanto, o realce do pré-tratamento com DMSO é observado em estágios posteriores de diferenciação nesta linha celular (Figura 4B). O tratamento DMSO também é versátil em que é eficaz em ambos os sistemas de culturas de células 2D e 3D, ele pode ser usado com vários tipos de material de revestimento em placas de cultura celular, e funciona em diferentes tipos de meio de manutenção que promovem o crescimento e expansão de hPSCs (por exemplo, mTeSR, e8, mídia climatizada de MEF, etc.).
Mais geralmente, esses resultados sugerem que o estado inicial de células-tronco pluripotentes tem forte influência na propensão para diferenciação inicial, bem como na diferenciação terminal em tipos de células funcionais. Nós mostramos previamente que o tratamento DMSO funciona com o RB em hpscs3,5. RB desempenha um papel importante na promoção da diferenciação terminal, sobrevivência celular, e a estabilidade genética das células41,42,43,44, e pode, portanto, explicar os efeitos persistentes sobre as células diferenciado dos hPSCs tratados com DMSO. Visando esses primeiros modos de regulação pode colocar hPSCs em uma melhor trajetória para a diferenciação e, finalmente, melhorar a sua utilidade para a medicina regenerativa.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado por subvenções da faculdade de medicina da Universidade de Stanford e uma bolsa Siebel concedida a S. C.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 21985023 | |
| 6-well Clear Flat Bottom TC-treated Multiwell Cell Culture Plate | Corning | 353046 | |
| 9-Position stir plate | Chemglass | CLS-4100 | |
| Accutase | Gibco | 11105-01 | |
| Activin A | R&D Systems | 338-AC | |
| Advanced RPMI | Gibco | 12633012 | |
| Alk5i II | Axxora | ALX-270-445 | |
| All-trans retinoic acid | Sigma-Aldrich | R2625 | |
| anti-Brachyury | R&D Systems | AF2085 | No variablity observed across different lot numbers |
| anti-C-peptide | Developmental Studies Hybridoma Bank | GN-ID4 | No variablity observed across different lot numbers |
| anti-FoxA2 | Millipore | 07-633 | No variablity observed across different lot numbers |
| anti-Nkx2.2 | University of Iowa, Developmental Hybridoma Bank | 74.5A5 | No variablity observed across different lot numbers |
| anti-Nkx6.1 | University of Iowa, Developmental Hybridoma Bank; | F55A12-supernatant | No variablity observed across different lot numbers |
| anti-Olig2 | EMD Millipore | MABN50 | No variablity observed across different lot numbers |
| anti-Pax-6 | Biolegend | 901301 | No variablity observed across different lot numbers |
| anti-Pdx1 | R&D Systems | AF2419 | No variablity observed across different lot numbers |
| anti-SOX1 | R&D Systems | AF3369 | No variablity observed across different lot numbers |
| anti-SOX17 | R&D Systems | AF1924 | No variablity observed across different lot numbers |
| B-27 Supplement, minus Vitamin A | Gibco | 12587010 | |
| Basic fibroblast growth factor | Gibco | PHG0264 | |
| Betacellulin | Thermo Fisher Scientific | 50932345 | |
| Chir99021 | Stemgent | 04-000-10 | |
| CMRL 1066 | Corning | 99-603-CV | |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAF1000 | |
| D-(+)-Glucose | Sigma | G7528 | |
| DAPI | Invitrogen | D1306 | |
| Disposable Spinner Flasks | Corning, VWR | 89089-814 | |
| DMEM/F-12 | Gibco | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Essential 6 Media | Gibco | A1516501 | |
| FAF-BSA | Proliant | 68700 | |
| FGF7 | PeproTech | 100-19 | |
| Geltrex | Gibco | A1413202 | |
| GlutaMAX | Gibco | 35050061 | |
| Heparin | Sigma | H3149 | |
| Human Ultrasensitive Insulin ELISA | ALPCO Diagnostics | 80-INSHUU-E01.1 | |
| ITS-X | Invitrogen | 51500056 | |
| KGF | Peprotech | AF-100-19 | |
| Knockout DMEM | Gibco | 10829018 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| L-3,3′,5-Triiodothyronine (T3) | EMD Millipore | 642245 | |
| LDN193189 | Stemgent | 04-0074 | |
| Matrigel Matrix | Corning | 354277 | |
| MCDB-131 | Cellgro | 15-100-CV | |
| MEM NEAA | Gibco | 11140050 | |
| mTeSR 1 | StemCell Technologies | 5850 | |
| N2 Supplement | Life Technologies | 17502048 | |
| NaHCO3 | Sigma | S3817 | |
| Noggin Fc Chimera Protein | R&D Systems | 3344-NG-050 | |
| PdBU | EMD Millipore | 524390 | |
| Penicillin/Streptomycin | Mediatech | 30-002-CI | |
| RPMI | Gibco | 11875-093 | |
| Sant1 | Sigma-Aldrich | S4572 | |
| SB431542 | Stemgent | 04-0010 | |
| Smoothened Agonist, SAG | EMD Millipore | 566660 | |
| StemPro Accutase | Gibco | A1110501 | |
| TrypLE | Gibco | 12604013 | |
| Ultra-Low Attachment Microplates | Corning | 3471 | |
| Vitamin C | Sigma-Aldrich | A4544 | |
| Wnt3a | R&D Systems | 5036-WN | |
| XAV 939 | Tocris | 3748 | |
| XXI | EMD Millipore | 565790 | |
| Y-27632 | StemCell Technologies | 72302 |
Referências
- Osafune, K., et al. Marked differences in differentiation propensity among human embryonic stem cell lines. Nature Biotechnology. 26 (3), 313-315 (2008).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Review Genetics. 15 (2), 82-92 (2014).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Conklin, J. F., Sage, J. Keeping an eye on retinoblastoma control of human embryonic stem cells. Journal of Cellular Biochemistry. 108 (5), 1023-1030 (2009).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110 (2018).
- Hartwell, L. H., Weinert, T. A. Checkpoints: controls that ensure the order of cell cycle events. Science. 246 (4930), 629-634 (1989).
- Pardee, A. B. G1 events and regulation of cell proliferation. Science. 246 (4930), 603-608 (1989).
- Orford, K. W., Scadden, D. T. Deconstructing stem cell self-renewal: genetic insights into cell-cycle regulation. Nature Review Genetics. 9 (2), 115-128 (2008).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453 (7194), 519-523 (2008).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells. 26 (4), 894-902 (2008).
- Duan, Y., et al. Differentiation and characterization of metabolically functioning hepatocytes from human embryonic stem cells. Stem Cells. 28 (4), 674-686 (2010).
- Szkolnicka, D., Farnworth, S. L., Lucendo-Villarin, B., Hay, D. C. Deriving functional hepatocytes from pluripotent stem cells. Current Protocols in Stem Cell Biology. 30, 1-12 (2014).
- Vanhove, J., et al. H3K27me3 Does Not Orchestrate the Expression of Lineage-Specific Markers in hESC-Derived Hepatocytes In Vitro. Stem Cell Reports. 7 (2), 192-206 (2016).
- Kanebratt, K. P., Andersson, T. B. Evaluation of HepaRG cells as an in vitro model for human drug metabolism studies. Drug Metabolism & Disposition. 36 (7), 1444-1452 (2008).
- Nikolaou, N., Green, C. J., Gunn, P. J., Hodson, L., Tomlinson, J. W. Optimizing human hepatocyte models for metabolic phenotype and function: effects of treatment with dimethyl sulfoxide (DMSO). Physiological Reports. 4 (21), (2016).
- Kondo, Y., et al. An efficient method for differentiation of human induced pluripotent stem cells into hepatocyte-like cells retaining drug metabolizing activity. Drug Metabolism Pharmacokinetics. 29 (3), 237-243 (2014).
- Alizadeh, E., et al. The effect of dimethyl sulfoxide on hepatic differentiation of mesenchymal stem cells. Artificial Cells, Nanomedicine, and Biotechnology. 44 (1), 157-164 (2016).
- Czysz, K., Minger, S., Thomas, N. DMSO efficiently down regulates pluripotency genes in human embryonic stem cells during definitive endoderm derivation and increases the proficiency of hepatic differentiation. PLoS One. 10 (2), 0117689 (2015).
- Ogaki, S., Morooka, M., Otera, K., Kume, S. A cost-effective system for differentiation of intestinal epithelium from human induced pluripotent stem cells. Scientific Reports. 5, 17297 (2015).
- Choi, S. C., et al. Mixl1 and Flk1 Are Key Players of Wnt/TGF-beta Signaling During DMSO-Induced Mesodermal Specification in P19 cells. Journal of Cellular Physiology. 230 (8), 1807-1821 (2015).
- Chetty, S., et al. A Src inhibitor regulates the cell cycle of human pluripotent stem cells and improves directed differentiation. Journal of Cell Biology. 210 (7), 1257-1268 (2015).
- Qiu, Z., et al. Marmoset induced pluripotent stem cells: Robust neural differentiation following pretreatment with dimethyl sulfoxide. Stem Cell Research. 15 (1), 141-150 (2015).
- Swartz, E. W., et al. A Novel Protocol for Directed Differentiation of C9orf72-Associated Human Induced Pluripotent Stem Cells Into Contractile Skeletal Myotubes. Stem Cells Translational Medicine. 5 (11), 1461-1472 (2016).
- Teimourian, S., Moghanloo, E. Thwarting PTEN Expression by siRNA Augments HL-60 Cell Differentiation to Neutrophil-Like Cells by DMSO and ATRA. DNA Cell Biology. 35 (10), 591-598 (2016).
- van den Berg, C. W., Elliott, D. A., Braam, S. R., Mummery, C. L., Davis, R. P. Differentiation of Human Pluripotent Stem Cells to Cardiomyocytes Under Defined Conditions. Methods in Molecular Biology. 1353, 163-180 (2016).
- Deng, F., et al. Combination of retinoic acid, dimethyl sulfoxide and 5-azacytidine promotes cardiac differentiation of human fetal liver-derived mesenchymal stem cells. Cell Tissue Bank. 17 (1), 147-159 (2016).
- Yoon, S. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2018).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637 (2018).
- Kroon, E., et al. Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo. Nature Biotechnology. 26 (4), 443-452 (2008).
- Zhang, P., et al. Short-term BMP-4 treatment initiates mesoderm induction in human embryonic stem cells. Blood. 111 (4), 1933-1941 (2008).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Tchieu, J., et al. A Modular Platform for Differentiation of Human PSCs into All Major Ectodermal Lineages. Cell Stem Cell. 21 (3), 399-410 (2017).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Fiore, M., Degrassi, F. Dimethyl sulfoxide restores contact inhibition-induced growth arrest and inhibits cell density-dependent apoptosis in hamster cells. Experimental Cell Research. 251 (1), 102-110 (1999).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Bock, C., et al. Reference Maps of human ES and iPS cell variation enable high-throughput characterization of pluripotent cell lines. Cell. 144 (3), 439-452 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- D'Amour, K. A., et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nature Biotechnology. 24 (11), 1392-1401 (2006).
- Jacks, T., et al. Effects of an Rb mutation in the mouse. Nature. 359 (6393), 295-300 (1992).
- Nguyen, D. X., Baglia, L. A., Huang, S. M., Baker, C. M., McCance, D. J. Acetylation regulates the differentiation-specific functions of the retinoblastoma protein. The EMBO Journal. 23 (7), 1609-1618 (2004).
- Slack, R. S., et al. Cells differentiating into neuroectoderm undergo apoptosis in the absence of functional retinoblastoma family proteins. Journal of Cell Biology. 129 (3), 779-788 (1995).
- Gu, W., et al. Interaction of myogenic factors and the retinoblastoma protein mediates muscle cell commitment and differentiation. Cell. 72 (3), 309-324 (1993).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados