Method Article
DMSOを用したヒト多能性幹細胞の一過性治療による分化を促進
要約
ヒト多能性幹細胞(hPSC)から分化した細胞型を生成することは、大きな治療上の約束を持っていますが、依然として困難なままです。PSCは、多くの場合、適切な信号のセットで刺激された場合でも、区別することができない固有の不能を示します。ここでは、さまざまな PSC ライン間の多系統分化を強化する簡単なツールを説明します。
要約
多能性幹細胞(PSC)の使用が増加しているにもかかわらず、様々な系統にわたって胚および誘導多能性幹細胞(ESCおよびiPSC)を効率的に分化する課題が残っています。多数の分化プロトコルが開発されていますが、細胞株間の変動性と分化率の低さは、これらのプロトコルの実装に関する課題を与えています。ここで説明するのは、PSC の差別化能力を高めるための簡単で安価な手段です。ジメチルスルホキシド(DMSO)の濃度が低い幹細胞の治療は、指示分化後に異なる細胞型に分化する様々なPSCの傾向を有意に増加することが以前に示されている。この技術は、ニューロンや皮質スフェロイドから平滑筋細胞や肝細胞に至るまで、異なる種(例えば、マウス、霊長類、ヒト)に対して有効であることが示されています。DMSO前処理は、細胞周期を調節し、分化シグナルに対してより応答性の高い幹細胞をプライミングすることにより、PSC分化を改善します。ここでは、PSCを選択の系統とより効率的に区別するための再現性と広く適用可能な手段として、この単純なツールを使用するための詳細な方法論を提供します。
概要
多能性幹細胞の使用は、再生医療や幹細胞ベースの治療、疾患モデリング、薬物スクリーニングなどの生物医学研究の多くの進歩につながっています。また、より翻訳可能な研究とパーソナライズされた医療の全体的な見通しにつながっています。20年以上前に誘導された多能性幹細胞(iPSC)技術の出現により、研究者は体組織から多能性幹細胞を開発し、機能性細胞型に分化し、様々な病態を研究することができました。心血管疾患、神経疾患、免疫疾患。幹細胞分化技術では大きな進歩が見られましたが、ヒト胚性幹細胞(hESC)とiPSCを効果的に分化する上での課題は依然として残っており、異なる幹細胞技術の広範な使用を制限しています。研究プログラム。異なる細胞株とクローン間の固有の変動性は、幹細胞株を所望の線子1に分化するための障害を引き続き提起し続ける。さらに、hPSCから成熟した末期分化機能細胞を導出することは、多くの系統にわたって退屈で非効率的なプロセスのままである。実際、hPSCから分化した細胞は、多くの場合、機能性細胞2に終端的に分化することができない。患者に使用する幹細胞ベースの治療法をさらに動かすには、hPSCから生成される細胞の有効性を改善し、確実にする必要がある。
私たちの研究室は、iPSCとESCの両方を成熟した細胞タイプに分ける効率を大幅に高めるための迅速で安価なツールを確立しました。指向分化前の24時間から48時間の一般的な試薬ジメチルスルホキシド(DMSO)によるhiPSCおよびHESCの前処理は、幹細胞分化能力の顕著な改善をもたらすことがわかった。DMSOによる治療は、細胞周期の初期のG1期におけるhiPSCおよびHESCの割合を増加させ、細胞増殖、生存、分化の重要な調節子であるレチノブ芽腫タンパク質(Rb)3を活性化する。より最近の研究では、Rbとその家族がDMSOのプロ分化効果に必要であることが判明し、Rbの一時的な不活性化はDMSOの効果を抑制し、一時的な方法でRbの構成的活性化が強化される。DMSOの効果5.胚発生時の細胞周期と同様に、ESCおよびiPSCの細胞周期は、自己再生6、7、8を促進する略語G1相によって特徴付される。この省略されたG1フェーズは、より無制限の増殖を可能にしますが、分化4、9の可能性を制限します。G1での増殖停止を促進し、hESCおよびiPSCの細胞周期におけるチェックポイント制御を活性化することにより、DMSO治療は、指示された分化に続く細胞の運命の変化に対する細胞のプライムをプライムする。
現在までに、DMSO前処理は、30以上の対照および疾患特異的ヒトESCおよびiPSC細胞株3、5、ならびに幹細胞および他の分化における3つの生殖層すべてに対する分化能力を改善することが示されている。その後の研究における他の様々な成熟細胞型に対する細胞株10,11,12,13,14,15,16,17歳,18歳,19歳,20歳,21歳,22歳,23歳,24歳,25名,26歳,27歳,28 (表1)さらに、DMSO治療は、非ヒト原発細胞21、23(例えば、マウス、霊長類、ウサギ)の分化を増強するのに有効であることが示されており、種間の共有メカニズムを示唆している。最後に、DMSO前処理は遺伝子編集技術にも拡張されており、ある特定の研究では、hESC/iPSCの24時間DMSO前処理がクラスター化規則的に間隔を空けた短いパリドロミックリピート(CRISPR)の能力を有意に増加させたことを示しています。/CRISPR関連タンパク質-9(Cas9)-意図しない突然変異を組み込むことなく非コードDNAの編集効率29.ここでは、幹細胞生物学および指向性分化におけるアプリケーションのためのHESCおよびiPSCのDMSO前処理の詳細な方法論を提供する。
プロトコル
1. 幹細胞のメンテナンス
注:以下に説明する細胞維持プロトコルは、付着単層に維持される多能性幹細胞(PSC)に適用される。DMSO処理の前に使用される培養剤、他の試薬、および細胞培養プレートは、必要に応じて調整することができる。この原稿のすべての以下のプロトコルのために、細胞は生物学的安全キャビネットの下で処理されるべきです。
- コート滅菌、6ウェル、多能性幹細胞修飾マトリックスまたは基板を用いた組織培養処理プレートを製造業者の指示に従って調製し、CO2インキュベーター(5%CO2、湿気雰囲気)で少なくとも1時間インキュベートする。 コーティングされたプレートは、フィルム包装され、最大1週間4°Cで保存することができます。
- 37°Cの水浴で凍結保存PSCを解凍します。生物学的安全キャビネットへの導入前にエタノールでバイアルを殺菌し、その後、すぐに前発幹細胞培養物の5〜10ボリュームを含む無菌円錐形チューブにピペッティングすることによって細胞を転送します。
- 室温(RT)で5分間300xgで細胞を遠心分離します。
- 培剤を吸引し、Y-27632などの10μM ROCK阻害剤を補充した幹細胞培養剤の1mLで細胞ペレットを静かに再中断する。
- 培養マトリックスをプレートから吸引し、所望の密度で細胞を播種し、典型的にはウェル当たり0.5-1 x 106細胞をウェル当たり少なくとも2mLの幹細胞培地当たりウェル当たり。
注:めっき密度は、異なる細胞株間で異なる場合があり、クローンはそれに応じて最適化する必要があります。 - 毎日、あらかじめ温められた幹細胞培温に置き換えて細胞を維持します。約70%-80%の合流で、または細胞コロニーが接触し始めるときに細胞を分割します。
- 細胞を分割するには、培体を吸引し、無菌PBSで一度細胞を洗浄します。37°Cで5〜10分間、溶解酵素溶液の1mLで細胞をインキュベートします。
- 予め温めた幹細胞培った細胞を洗浄し、再懸濁し、5〜10量の幹細胞培養物を含む無菌円錐管に移す。手順 1.3~1.7 に従って細胞をプレートします。
2. DMSO前処理
注:分化前にDMSO前処理用の細胞をめっきする場合、開始めっき細胞密度は、幹細胞株の典型的な増殖速度と使用される分化プロトコルを考慮して最適化されるべきである。必要に応じて、従来のマーカーを使用して多能性を検証します。細胞は、分化前に最初の解凍後に少なくとも1x-2xを通過する必要があります。
-
2D文化分化
- 細胞が適切な合流に達したら、コーティングされたプレートを調製し、細胞を解離し、上述のように単細胞懸濁液を調製する。
- トレーパンブルーまたは別の生存率マーカーを含むヘモサイトメーターまたは自動細胞カウンターを使用して生細胞をカウントします。
- 10 μM ROCK阻害剤を用いた幹細胞培地で、0.5-1 x 106細胞でコーティングされた6ウェルプレートに細胞をプレートします。
注:我々の実験室で試験された細胞株の場合、これらの密度は典型的に24時間DMSO前処理内の80%〜90%のコンフルエント細胞をもたらした。 - CO2インキュベーター(5%CO2、湿度の高い雰囲気)で37°Cで24時間インキュベートできます。
- 予備発温幹細胞培中に1%-2%DMSOを調製します(例えば、10mLのメディアで100 μLのDMSO=1%DMSO溶液、10mLのメディアで200 μL DMSO=2%DMSO溶液)。
- 24時間インキュベーション後、細胞から培温を吸引し、DMSO溶液に置き換えます。
- 分化前にCO2インキュベーター(5%CO2、湿度の高い雰囲気)で37°Cで24時間~48時間インキュベートできます。
注:典型的には、24h DMSO処理は、ヒトESCおよびiPSCラインの大部分にわたって十分である。非常に遅い成長速度(長い倍増時間)を持つ細胞株は、DMSOとの48時間インキュベーションの恩恵を受けることができます。DMSOによる48時間のインキュベーションでは、治療の最初の24時間後に1%-2%DMSOで新鮮な幹細胞培温に置き換えることができます。
-
3D カルチャーの差別化:
- 細胞が適切な合流に達すると、上述したように細胞懸濁液中の細胞を解離して集める。
- 生存マーカーを含むヘモサイトメーターまたは自動細胞カウンターを使用して生細胞をカウントします。
- 10 μM ROCK阻害剤を用いた幹細胞培地中の0.5-1 x 106細胞で、コーティングされていない低アタッチメント6ウェルプレートで細胞をプレートします。
注:本研究室で試験した細胞株では、これらの密度は通常、設定細胞の24時間以内に3D hPSC球体形成をもたらした。 - CO2インキュベーター(5%CO2、湿度の高い雰囲気)で37°Cで24時間インキュベートできます。
- 予備発温幹細胞培中に1%-2%DMSOを調製する(例えば、10mLのメディアで100μLのDMSO=1%DMSO溶液、10mLのメディアで200 μLのDMSO=2%DMSO溶液)。
- 標準的な手順に従ってメディアを交換する(例えば、30°-45°の角度でプレートを傾けて、細胞球がウェルの底部に落ち着くようにする;細胞球を滅菌円錐形の管に移し、細胞球が管の底部に落ち着くことを可能にする;または細胞を穏やかに集める)。n 5または10 mLピペットを無菌円錐管および遠心分離細胞に使用するn懸濁液をRTで5分間300 x gで示す)
- セルからメディアを吸引し、DMSO溶液に置き換え、穏やかにピペッティングします。
- 分化前にCO2インキュベーター(5%CO2、湿度の高い雰囲気)で37°Cで24時間~48時間インキュベートできます。
注:典型的には、24h DMSO処理は、ヒトESCおよびiPSCラインの大部分にわたって十分である。非常に遅い成長速度(長い倍増時間)を持つ細胞株は、DMSOとの48時間インキュベーションの恩恵を受けることができます。DMSOによる48時間のインキュベーションでは、治療の最初の24時間後に1%-2%DMSOで新鮮な幹細胞培温に置き換えることができます。
3. 原発生殖層との分化
注:以下は、6ウェルプレート上の単層で成長したPSCに対して、我々の研究室で有効であることが示された方法について説明する。選択の任意の分化プロトコルは、所望の系統への分化を促進するためにDMSO処理後に使用されるべきです。24-48時間の処理後にDMSO溶液を取り出し、標準プロトコルに従って分化を進めます。
-
内皮分化(クローンら30)
- 2D培養に対して上述したようにDMSOを用いる細胞。
- Wnt3a およびアクティブ化 A ストック ソリューションを準備します。
- 1日目の内皮分化培温を準備し、Wnt3aを20ng/mLの最終濃度に加え、アクティビンAを100ng/mLの最終濃度に加えて、予め温めたRPMI培温の適切な量に調製する。
- DMSO前処理後、細胞から培地を吸引し、1日目の培地(例えば、6ウェルプレートのウェルあたり2mL)に置き換える。
- CO2インキュベーター(5%CO2、湿度の高い雰囲気)で37°Cで24時間インキュベートできます。
- 2日目と3日目の内皮分化培温を準備し、アクティビンAを100ng/mLの最終濃度に加えて、予備のRPMI培温の適切な容積に加えます。
- 細胞から培地を吸引し、2日目の培地(例えば、6ウェルプレートのウェルあたり2mL)に置き換えます。
- CO2インキュベーター(5%CO2、湿度の高い雰囲気)で37°Cで24時間インキュベートする細胞を許可します。
- 細胞から培地を吸引し、3日目の培地(例えば、6ウェルプレートのウェルあたり2mL)に置き換えます。
-
メソダーム分化(Zhang et al.31から適応)
- 2D培養に関して前述したように、DMSOを用いて細胞を引き続き引き出す。
- Wnt3a およびアクティブ化 A ストック ソリューションを準備します。
- 20 ng/mL の最終濃度に Wnt3a を加え、100 ng/mL の最終濃度に 100 ng/mL を加えて、予め温められた高度なRPMIメディアの適切な量に中間体分化媒体を準備する。
- DMSO前処理後、細胞から培地を吸引し、分化培地(例えば、6ウェルプレートのウェルあたり2mL)に置き換える。
- CO2インキュベーター(5%CO2、湿度の高い雰囲気)で37°Cで24時間インキュベートできます。
-
エクトーマ分化(チェンバースら32)
- 2D培養に関して前述したように、DMSOを用いて細胞を引き続き引き出す。
- Noggin および SB431542 ストック ソリューションを準備します。
- ノックアウト血清置換(KOSR)をノックアウトDMEMで10%の最終濃度に溶解することにより、外皮分化ベースメディアを調作する。
注:メディア変更の 3 ~ 4 日間に十分な基本メディアを準備します。 - 500 ng/mLおよびSB431542の最終濃度にノギンを加えて外皮分化媒体を準備し、10 μMの最終濃度を予め温めたKOSR/ノックアウトDMEMの適切な容積に加える。
- DMSO前処理後、細胞から培地を吸引し、分化培地(例えば、6ウェルプレートのウェルあたり2mL)に置き換える。
- CO2インキュベーター(5%CO2、湿度の高い雰囲気)で37°Cで3~4日間インキュベートし、毎日培った分化因子を加えた分化因子で培養します。
4. 前駆細胞型との分化
以下は、2Dまたは3D培養で成長したPSCに対して、当研究室で有効であることが示された方法について説明する。選択の任意の分化プロトコルは、所望の系統への分化を促進するためにDMSO処理後に使用されるべきです。24-48時間の処理後にDMSO溶液を取り出し、標準プロトコルに従って分化を進めます。
- 神経前駆細胞分化(Tchieu et al.33より適応)
- 多能性幹細胞修飾減生因子マトリックスまたは基板でコーティングして6枚のウェルプレートを調製し、製造元の指示に従って、CO2インキュベーター(5%CO2、湿度の高い雰囲気)で少なくとも1時間を使用します。コーティングされたプレートは、フィルム包装され、最大1週間4°Cで保存することができます。
- 上述したプレートPSCは、ROCK阻害剤を含有する幹細胞培地中のウェル当たり0.5-1x106細胞の密度で。
- 2D培養に対して上述したようにDMSOを用いる細胞。
- 小型化学阻害剤LDN193189、SB431542、およびXAV939ストックソリューションを調調します。
- 500 nM LDN193189、10 μM SB431542、および 2 μM XAV939 でエッセンシャル 6 メディアを補充することにより、1-3 日の神経切除分化メディアを調製します。
- DMSO前処理後、培地を吸引し、1-3日目の神経摘出剤(例えば、6ウェルプレートのウェルあたり2mL)に置き換える。毎日メディアを変更します。
- 500 nM LDN193189および10 μM SB431542でエッセンシャル6培メを補って、日4-12神経切除分化培法を調製する。
- 分化の4日目に、メディアを吸引し、デイズ4-12神経デトダームメディアに置き換えます。毎日メディアを変更します。
- 分化の12日後、分化した細胞は神経前駆細胞(NPC)の適切なマーカーを発現する必要があります。NPCは、DMEM/F-12、2%B-27、1%N-2を含むニューラルメディアにおいてさらに維持することができ、10μg/mLの塩基性線維芽細胞増殖因子(bFGF)を補充することができる。細胞剥離液を用いてコンフルエントな場合にNPCを通過させ、ウェル当たり0.5-1 x 106セルでNPCをめっきする。
- オリゴデンドロサイト前駆細胞分化(ドゥバラスとフォッサティ34から適応)
- 上述のようにPSCを、ROCK阻害剤を含む幹細胞培地に6ウェルプレートを塗り付けた上にウェル当たり1x105の密度でプレートする。
- 2D培養に対して上述したようにDMSOを用いる細胞。
- SB431542、LDN193189、オールトランスレチノイン酸(RA)、および平滑化アゴニスト(SAG)ストック溶液を調製する。
- DMEM/F-12を10 μM SB431542、250 nM LDN193189、および100 nM RAで補充して、0~8日分化メディアを準備します。
- DMSO前処理後、分化培地で細胞を8日間インキュベートし、新たに加えた分化因子(例えば、6ウェルプレートのウェルあたり2mL)で毎日培地を変化させる。
- 8日目に、1x MEM非必須アミノ酸(NEAA)溶液、1X L-グルタミン、2-メルカプトエタノール、ペニシリン/ストレプトマイシン、および1x N-2を補充した1x NM RAおよび1 μM SAGを含むDMEM/F-12で培地を交換してください。毎日メディアを変更します。
- 分化の12日後、分化した細胞は、オリゴデンドロサイト前駆細胞(OpC)の適切なマーカーを発現する必要があります。
- 内分泌前駆細胞分化(Pagliucaら35から適応)
- 幹細胞培地中の6 x 105細胞/mLの種子PSCに加えて、37°Cインキュベーターで70rpmの回転速度で設定された9位置の攪拌プレート上に置かれた500 mLスピナーフラスコに10 μM ROCK阻害剤を加え、5%CO2、および100%の湿度を求める。
- クラスタがフラスコの底に落ち着き、メディアを吸引し、1%-2%のDMSOで後退できるようにします。
- アクチビンA、Chir99021、KGF、Sant1、全トランスレチノイン酸(RA)、LDN193189、PdBU、XXI、Alk51、T3、およびベータセルインストックソリューションを調製する。
- 表3の製剤に基づいて分化ベースメディアを準備する。
- DMSO前処理後、吸引媒体を100 ng/mLアクティビンAおよび3 mM Chir99021(例えば、フラスコ当たり500mL)で補充したS1メディアに置き換える。24時間のインキュベーションを許可します。
- 2日目に、100 ng/mLアクティビンA.インキュベーションを2日間許可するS1メディアにメディアを置き換えます。
- 4日目に、50 ng/mL KGFを補完したS2メディアでメディアを交換します。インキュベーションを3日間許可し、最初の2日後(6日目)以降に培温を変更します。
- 7 日目に、メディアを 50 ng/mL KGF、0.25 mM Sant1、2 mM RA、および 200 nM LDN 193189 で補足した S3 メディアに置き換えます。24時間のインキュベーションを許可します。
- 8 日目に、メディアを 50 ng/mL KGF、0.25 mM Sant1、2 mM RA、200 nM LDN193189、および 500 nM PdBU で補充した S3 メディアに置き換えます。24時間のインキュベーションを許可します。
- 9 日目に、メディアを 50 ng/mL KGF、0.25 mM Sant1、および 100 nM RA で補充した S3 メディアに置き換えます。インキュベーションを5日間許可し、2日ごとにメディアを変更します(11日目と13日目)。
- 14日目と16日目に、0.25 mM Sant1、100 nM RA、1mM XXI、10 mM Alk5i II、1mM T3、および20 ng/mLベータセルリン(4日間の総インキュベーション)を補充したS5メディアにメディアを置き換える。
- 18日目と20日目に、メディアを25nM RA、1mM XXI、10 mM Alk5i II、1mM T3、および20 ng/mLベータセルリンで補充したS5メディアに置き換えます。
5. 分化の免疫細胞化学的検証
注:以下の方法は、必要に応じて調整することができる一般的な免疫細胞化学プロトコルを説明する。一次抗体は、当社の研究室で以前に検証された抗体です。分化の検証のための他の技術も使用することができる(例えば、フローサイトメトリー、qPCR、RNAシーケンシング、ウェスタンブロッティング、機能アッセイなど)。
-
免疫標識細胞
- 懸濁液中の3D培養物の場合、固定前に18~24時間、単一セル懸濁液に分散したプレート全セルクラスターまたはクラスター。
- 付着細胞からメディアを吸引し、シェーカー上のRTでPBSで簡単に洗浄します。
- 細胞固定のために、吸引PBSとシェーカー上のRTで20分間PBSで4%パラホルムアルデヒド(PFA)で細胞をインキュベートします。
注意:PFAストックは、その毒性のためにヒュームフードの下に準備する必要があります。適切な個人用保護具を吸入して着用しないでください。 - PFAを取り出し、適切な化学廃棄物容器に捨てます。
- シェーカー上のRTで洗浄当たり少なくとも5分間PBSで細胞3xを洗浄します。
- 細胞透過性および遮断のために、シェーカー上のRTで0.3%トリトンx 100/PBSで調製した5%ロバ血清で細胞をインキュベートする。
- 透過化/遮断に使用されるのと同じ溶液中に一次抗体溶液を調記する。
- 一次抗体溶液をシェーカー上で4°Cで一晩インキュベートする。
- 一晩インキュベーションの後、シェーカー上のRTで洗浄当たり少なくとも5分間PBSで細胞3xを洗浄する。
- 透過化/ブロッキング溶液中に二次抗体溶液を調記する。
- シェーカー上のRTで1時間の二次抗体溶液中でインキュベートすることを可能にする。
- 二次抗体溶液を吸引し、シェーカー上のRTで洗浄当たり少なくとも5分間PBSで細胞を3x洗浄する。
- DAPIまたは別の好ましいマーカーで細胞をインキュベートし、適切なインキュベーション時間を与え、PBSですすいで下す。
-
画像定量
- 蛍光顕微鏡および/または高含有量のスクリーニングプラットフォームで条件ごとに最低3枚の画像を取得します。
- 非バイアスイメージングソフトウェア(例えば、ImageJ)または自動スクリーニングプラットフォームを使用して、抗体染色細胞の総数と総細胞数(DAPI/Hoechst核染色に基づく)を数えることによって、各マーカーの陽性細胞の割合を定量化する分析。
結果
DMSO処理iPSCの形態
対照被験者に由来するヒトiPSCを、付着した2D単層または懸濁液中の3D細胞球で培養した。初期めっき後約24時間、細胞を維持培地中で24時間1%または2%のDMSOのいずれかで処理した。DMSO処理後の代表的な明視野画像を図1に示します。単層3で維持されたiPSCに関する以前の報告と一致して、DMSO前処理は非DMSO処理細胞と比較して一時的な用量依存的な増殖速度の減少をもたらした(図1A)。この増殖の減少は、細胞間接触の増加に関連しており、これは、より高度にクラスター化された細胞コロニーの形成の増加を示す2%DMSO処理細胞において特に顕著である。他の細胞型において、DMSO誘発G1停止は、接触阻害誘発増殖停止36を支持する細胞相互作用に関与するタンパク質の発現の増加に関連することが示されている。3D細胞球として維持されたiPSCでは、DMSO処理は同様に細胞球数を増加させた(図1B)。さらに、DMSO処理はまた、可変的な3D球サイズの小ささをもたらし、これは以前に細胞37の分化能力の改善を示すことが示された。重要なことに、1%または2%のDMSOは、生存率カウントによって測定された細胞毒性をもたらさ(n = 3;2D培養%ライブ=コントロール:80±1.3;1%DMSO:82±3.7、2%:81±2.7、3D培養%ライブ=コントロール:81±4.3;±1%±72%)。全体的に、これらの結果は、DMSO治療が培養幹細胞の細胞周期および増殖パターンを変化させるという概念と一致している。成長阻害に対するこれらの影響は、前に示したように、DMSOが培地から除去されたときに可逆的である。
DMSO処理は、一次胚芽層へのESCの分化を改善します
HUES6 hESCを24時間コーティングプレート上に播種し、続いてメンテナンス培地で2%DMSOを2%処理した。次いで、図2A30、31、32に示す治療パラダイムに続いて、細胞を3つの一次生殖層に分化させた。次いで、分化細胞を固定し、それぞれの生殖層の原生細胞マーカー(内皮用SOX17、中胚芽用ブラチウリー、エクトーダーム用SOX1)に対して免疫学的に染色した。図2Bに示すように、2%DMSOによる前処理の24時間は、それぞれの生殖層マーカーを発現する細胞の割合を増加させた。これは、DMSO 3,5で処理された幹細胞のすべての生殖層に向かって、免疫反応性の増加、遺伝子発現、ならびに分化細胞の絶対数を示す当社の研究室からの以前の報告と一致しています。HUES6は、すべての系統1間の分化の傾向が非常に低いhESCラインですが、DMSO処理は、すべての生殖層を区別する能力を大幅に向上させます。
DMSO治療は前駆細胞タイプへの分化を改善する
CNS前駆細胞型との分化に対するDMSOの効果を調べた上で、ヒトiPSCは神経前駆細胞(NPC)またはオリゴデンドロサイト前駆細胞(OpC)のいずれかに分化した。NPCを生成するために、細胞をメンテナンス培地で24時間2%DMSOで前処理し、続いて12日間の指向分化33(図3A)を行った。図3Bに示すように、2%DMSO前処理は、対照と比較してNPCマーカーPAX6の発現を増加させた。以前に検証された別のプロトコル34(図3C)を用いて、iPSCを12日間OPCに分化した。NPCと同様に、24時間の2%DMSOで前処理されたiPSC由来のOPCは、OPCマーカーOLIG2を発現する細胞の増加率を示した(図3D)。
初期のDMSO治療は、成熟細胞型への分化を増強するために持続する
分化プロトコルの後期段階に対するDMSOの影響を調べるため、HUES8 hESCは、図4に記載された20日間の指向分化プロトコルに続くβ細胞への分化前に2%DMSOで24時間前処理を行った。35. HUES8は、以前に内皮系統1,38に対して高い傾向を持つことが示されているように用いられた。確定的な内皮段階では、分化細胞はSOX17およびFOXA2、決定的内視鏡(DE)特異的マーカーを発現する。膵臓前駆体(PP1)段階へのさらなる分化により、分化細胞はPDX1およびFOXA2を発現し、膵臓前駆細胞に特徴的なマーカーを発現する。膵臓細胞分化のこれらの段階では、DEへの誘導の効率が高く、その後PP1に誘導し、制御とDMSO処理されたHESCの両方がこれらの各段階に分化した(図4B、ステージ1および3)HUES8細胞株は、内皮系統に分化する傾向が高まっていることが指摘されているが、後相段階でより特殊な細胞型に分化が誘導されるにつれて、DMSO処理されたhESCははるかに多くの成熟した膵臓内分泌細胞を産生する可能性が高い。PDX1/NKX6.1+膵臓前駆細胞、ニューロジェニン3+内分泌細胞、およびNKX6.1/C-ペプチド+SC-β細胞の生成効率は、DMSO処理されたHESCにおいて実質的に高かった(図4B、ステージ4および5)。これらの結果は、DMSOが前駆細胞型に対する分化電位を高め、DMSOがより専門的な細胞タイプを生成する上で持続的であることを示すNPCおよびOPCの分化と一致している。これは、最初の24時間DMSO治療が、神経細胞への影響や心筋細胞31、39を打つことを含む生殖細胞層間の末端細胞型への分化を増加させることを示した以前の研究と一致している。分化3のための高いまたは悪いプロピプティを持つ細胞株で。
初期DMSO治療は、生体内移植に続くhESC由来細胞機能を改善する
これまで、我々は、後に生体内3におけるインスリン分泌の顕著な改善を示す機能性膵臓前駆細胞へのHESCの分化を増強する上でDMSO治療の有効性を実証した。以前に公開されたプロトコル3、30、40、HUES8 hESCを24時間1%DMSOで処理し、膵臓前駆細胞に分化し、免疫不備のSCID-ベージュマウスに移植して評価した。機能性(例えば、グルコースチャレンジまたはKCl刺激に応答するインスリン分泌)(図5A)。FOXA2+ への差別化の効率 (~90%)および PDX1+ (約 75%)膵臓前駆体は、HUES8 hESCラインに対する対照とDMSO処理HESC(図5B)との間で比較可能であったが、24時間1%のDMSO処理後にHESCから分化した細胞は、グルコースおよびKClに対する応答性を向上させた。生体内移植に続く刺激。機能性の改善は移植後2週間以内に明らかであった(図5C)、移植後少なくとも16週間まで持続した(図5D)。これらの結果をまとめると、DMSO前処理は生殖層、前駆細胞、およびより成熟した細胞型に対する分化効率を高めるだけでなく、生体内の分化細胞の機能性を高めるために持続することを示唆している。
| 分化セルタイプ | セルの種類の開始 | %DMSO | DMSO治療の長さ | DMSO治療の長さ |
| 肝細胞 | Esc キー 肝腫細胞株 Esc キー Esc キー 間葉系幹細胞 iPSC Esc キー Esc キー 肝腫細胞株 Esc キー | 1.0年 1.0年 1.0年 0.5年 0.1~2.0 1.0年 1.0年 0.5年 1.0年 0.6年 | 8 日間 数日 7 日間 10-14 日 7-21 日 7 日間 4日間 5 日間 2-21 日 全体 | バスマら, 2008 カネブラットとアンダーソン、2008 ヘイら,2009 ドゥアンら, 2010 アリザデら, 2014 近藤ら, 2014 Szkolnicka et al., 2014 Czysz et al., 2015 ニコラウら, 2016 ヴァンホーヴら, 2016 |
| 一次胚芽層 | ESC および iPSC hESC hESC | 0.1~2.0 0.5年 0.1~2.0 | 24 時間 24 時間 24 時間 | チェッティら, 2013 チェッティら, 2015 Li et al., 2018 |
| 心臓細胞 | ESC および iPSC P19 セル ESC および iPSC 胎児間葉系幹細胞 | 0.1~2.0 1.0年 1.0~2.0 0.8-1.0 | 24 時間 4日間 24-30時間 24 時間 | チェッティら, 2013 チョイら, 2014 ヴァン・デン・ベルクら, 2016 Deng et al., 2017 |
| 膵臓細胞 | ESC および iPSC hESC | 0.1~2.0 0.5年 | 24 時間 24 時間 | チェッティら, 2013 チェッティら, 2015 |
| 平滑筋細胞 | P19 セル | 1.0年 | 4日間 | チョイら, 2014 |
| 内皮細胞 | P19 セル | 1.0年 | 4日間 | チョイら, 2014 |
| 腸細胞 | iPSC | 0-1.6 | 4日間 | 大垣ら, 2015 |
| 腸上皮 | iPSC | 0-1.6 | 4日間 | 大垣ら, 2015 |
| 神経細胞 | マーモセット iPSC | 0.05-2.0 | 24 時間 | Qiu et al., 2015 |
| 好 中球 | 白血病細胞株 | 1.25 | 6-8日 | テイモリアンとモガンルー、2016 |
| 骨格筋チューブ | iPSC | 1.5年 | 24 時間 | スワルツら, 2016 |
| 皮質オルガノイド | ヒプス | 1.0年 | 24 時間 | ユンら, 2018 |
表1:DMSO治療が分化に及ぼす有益な効果を示す以前に発表された研究の概要。
| S1 | S2 | S3 | S5 | |
| MCDB131 (L) | 1 | 1 | 1 | 1 |
| ブドウ糖 (g) | 0.44分 | 0.44分 | 0.44分 | 3.6年 |
| ナコ3 (g) | 2.46分 | 1.23 | 1.23 | 1.754の |
| FAF-BSA (g) | 20歳 | 20歳 | 20歳 | 20歳 |
| ITS-X (mL) | 0.02 | 0.02 | 5 | 5 |
| グルタバックス (mL) | 10歳 | 10歳 | 10歳 | 10歳 |
| ビタミンC (mg) | 44歳 | 44歳 | 44歳 | 44歳 |
| ヘパリン (mg) | 0 | 0 | 0 | 10歳 |
| P/S (mL) | 10歳 | 10歳 | 10歳 | 10歳 |
表 2: のコンポーネント内分泌前駆細胞分化塩基媒体。
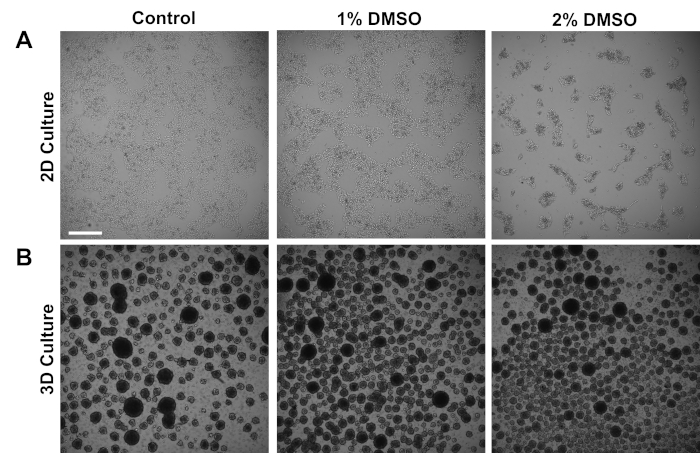
図 1: DMSO治療はhPSCの成長を変える。(A)24時間のDMSOに対して1%または2%のDMSOで治療(対照)または治療を受けた後に単層にめっきされたhiPSCの代表的な明視野画像は、iPSCの一過性用量依存的増殖抑制を促進する。(B)低アタッチメントプレート上にメッキされたhiPSCの代表的な明視野画像は、24時間のDMSO処理で1%または2%のDMSO処理を受け取らない後に3D球形成を可能にする、より可変的な3D球形成をもたらすコントロールと比較して。スケールバー = 500 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
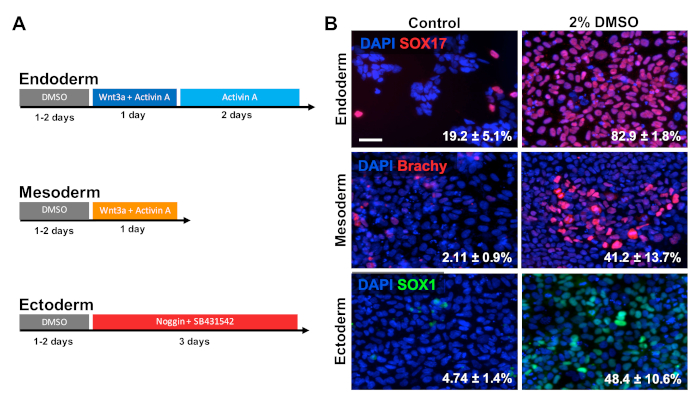
図 2: DMSO治療は、hPSCと原発性胚生殖層の分化を改善します。(A) 3つの一次生殖層を生成するために使用される分化プロトコルの概略図。(B) SOX17(内皮)、ブラチウリー(中皮)、およびSOX1(エクトーダーム)用に標識された分化HUES6 hESCの代表的な画像。24時間の2%DMSOによる前処理は、3つの胚芽層すべてにおける分化効率を向上させた。SOX17+内皮、ブラチウリー(ブラシー)+メソダーマル、またはコントロールおよびDMSO処理されたHESCの各生殖層への指示分化後のSOX1+外皮細胞に分化する細胞の割合は、3つの生物学的複製のSEMで注目される.ペアリングされていないt検定: 内皮 p = 0.0003;メソダーム p = 0.047;エクトダーム p = 0.015。スケールバー = 50 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
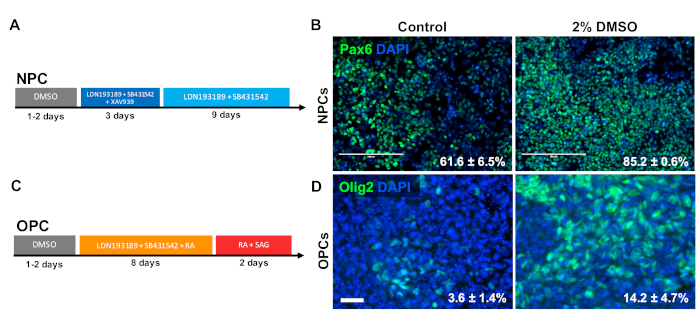
図 3: DMSO治療は、神経前駆細胞型との分化を改善する。(A) 神経前駆細胞(NPC)の生成に用いられる分化プロトコルの概略図。(B) Pax6用免疫標識NPCに分化したヒトiPSCの代表的な画像。2%DMSOによる前処理の24時間はPAX6陽性細胞数を増加させた。コントロールおよびDMSO処理ヒトiPSCの指向分化に続いてPax6+NPCに分化する細胞の割合は、3つの生物学的反復のSEMで注目される。ペアリングされていない t 検定: p = 0.0225。スケールバー = 200 μm. (C) オリゴデンドロサイト前駆細胞(OpCs)を生成するために使用される分化プロトコルの回路図。(D) OPCマーカー用に標識されたOPCに分化したヒトiPSCの代表的な画像をOlig2に対して免疫標識した。2%DMSOによる前処理の24時間は、対照と比較して両方のOPCマーカーの発現を増加させた。コントロールおよびDMSO処理ヒトiPSCの指向分化に続いてOlig2+OpCに分化する細胞の割合は、4つの生物学的反復のSEMで注目される。ペアリングされていない t 検定: p = 0.0466。スケールバー = 50 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
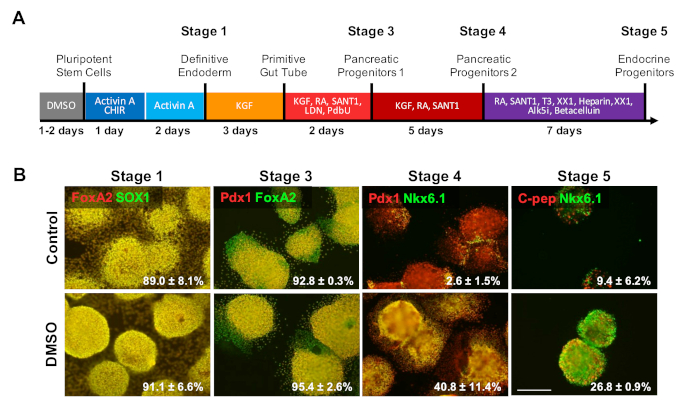
図 4:DMSO処理は、hPSCの末端分化電位を高めます。(A)約20日間の概略図は、末端分化膵内分泌細胞へのHUES8 hESCの分化を指示した。(B)未処理対照細胞および細胞の指向分化後の分化の各段階における示されたマーカーに対する免疫染色を24時間2%DMSOで前処理した。初期のDMSO治療は、指向分化の後期段階で末端内分泌細胞型への分化を増加させるために持続する。対照およびDMSO処理されたHESCの指示分化後の分化の各段階で示されたマーカーに分化する細胞の割合は、2〜4つの生物学的反復のSEMで注目される。スケールバー = 200 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
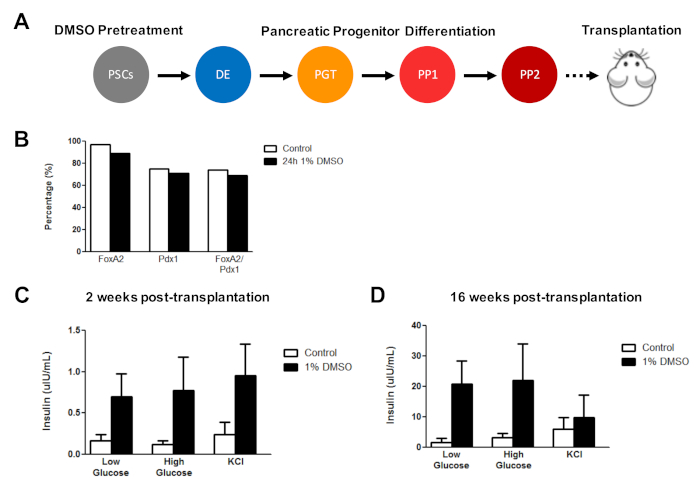
図 5: hPSCの初期DMSO治療は、生体内の膵臓前駆細胞移植後のグルコース応答性を高める。(A) HUES8 hESCの膵臓前駆細胞(PP2)への指向性分化(~15日)の概略図は、治療(対照)または24時間1%DMSO治療およびその後の移植(500万細胞)を免疫不全にSCIDベージュマウス。(B) PDX1+およびFOXA2+膵臓前駆細胞に分化する細胞の割合は、移植直前の対照およびDMSO処理HESCの分化を指示した(n=1)。(C) 低(2.5mM)または高(15mM)グルコースチャレンジまたは塩化カリウム(KCl)刺激(C)2週間および(D)膵臓移植後16週間後のマウスの血清からのヒトインスリンの平均ELISA測定前駆細胞は対照およびDMSO処理されたHESCから分化した(誤差バー=SEM;n=対2週および対照16週間で3、n=2週で2週間、DMSOに対して16週間)。双方向分散分析: p = 0.0051 対コントロール対 DMSO 2 週間;p = 16週間で対コントロール対DMSOのための0.0116。異なる時点で研究されたマウスは異なっている。結果はChettyら3から適応される。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
要約すると、このプロトコルは、すべての原発性胚芽層、種々のタイプの特殊な前駆細胞、さらにはインビトロの機能的な成熟細胞タイプに対する多能性幹細胞(PSC)の分化能力を高めるためのシンプルで安価なツールを説明します。と生体内の設定で。図示は、私たちの研究室だけでなく、他の研究室で効果的に再現されている特定の分化プロトコルですが、選択した任意の分化プロトコルは、DMSO処理に続いて使用することができます。表1に示すように、多くの研究室は、異なるパラダイムを用いて一時的なDMSO処理後のPSC分化の増強を実証し、他の様々な末端細胞タイプを生成する。さらに、ここでの方法はヒトPSCの使用を説明するが、DMSO前処理は種間で利用することができ、マウス、ウサギ、霊長類PSCに有効であることが示されている。
DMSOの高用量は細胞傷害性であることが知られているが、この方法で使用される低用量(1%-2%)一過性の期間のために最小限の細胞死をもたらす。DMSO治療直後の全体的な細胞数は、細胞周期のG1期における細胞周期停止のDMSO促進のために減少する可能性があるが、以前の研究は、細胞が除去後の制御培養物と同じレベルの合流に達できることを示している。DMSO3.
DMSO前処理のパーセントと持続時間は、細胞株ごとに最適化する必要があります。治療時間は、細胞のサイクリング/倍増時間を考慮して調整する必要があります。例えば、マウスPSCのサイクリング時間は通常約15時間と短くなります。したがって、これらの細胞に対して15時間のDMSO処理で十分である。一部のラボでは、分化プロトコル中または低濃度で継続した場合にDMSO治療が有益であることが判明しています(表1参照)。一部のPSCラインは、特定の系統との差別化により修正可能である点に留意すべきである。例えば、HUES6細胞は分化に対する寛容性が低く、DMSO処理で顕著な改善が見られた(図2)。あるいは、図4および図5で使用されるHUES8細胞は、内皮分化に対して高い傾向を示している。したがって、決定的な内皮に向かう初期段階での分化のためのコントロールとDMSOの間の相違点が少なかった。それにもかかわらず、DMSO前処理の増強は、この細胞株における分化の後の段階で観察される(図4B)。DMSO処理は、2Dおよび3D細胞培養システムの両方に有効であるという点でも汎用性があり、細胞培養プレート上の様々なタイプのコーティング材料で使用することができ、成長と拡大を促進するさまざまなタイプのメンテナンス培地で動作します。hPSC(例えば、mTeSR、E8、MEF条件付きメディアなど)。
より一般的には、これらの結果は、多能性幹細胞の開始状態が、機能性細胞型への末端分化と同様に初期分化の傾向に強い影響を及ぼすことを示唆している。我々は以前に、DMSO治療がhPSC3、5のRbを介して機能することを示した。Rbは末端分化、細胞生存、および細胞41、42、43、44の遺伝的安定性を促進する上で重要な役割を果たし、したがって、細胞に対する持続的な影響を説明し得る。DMSO処理されたhPSCと区別されます。これらの初期の規制モードをターゲットにすることは、hPSCを差別化のためのより良い軌道に置き、最終的には再生医療の有用性を向上させる可能性があります。
開示事項
著者は何も開示する必要はありません。
謝辞
この研究は、スタンフォード大学医学部の助成金と、S.C.に授与されたシーベル・フェローシップによって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 21985023 | |
| 6-well Clear Flat Bottom TC-treated Multiwell Cell Culture Plate | Corning | 353046 | |
| 9-Position stir plate | Chemglass | CLS-4100 | |
| Accutase | Gibco | 11105-01 | |
| Activin A | R&D Systems | 338-AC | |
| Advanced RPMI | Gibco | 12633012 | |
| Alk5i II | Axxora | ALX-270-445 | |
| All-trans retinoic acid | Sigma-Aldrich | R2625 | |
| anti-Brachyury | R&D Systems | AF2085 | No variablity observed across different lot numbers |
| anti-C-peptide | Developmental Studies Hybridoma Bank | GN-ID4 | No variablity observed across different lot numbers |
| anti-FoxA2 | Millipore | 07-633 | No variablity observed across different lot numbers |
| anti-Nkx2.2 | University of Iowa, Developmental Hybridoma Bank | 74.5A5 | No variablity observed across different lot numbers |
| anti-Nkx6.1 | University of Iowa, Developmental Hybridoma Bank; | F55A12-supernatant | No variablity observed across different lot numbers |
| anti-Olig2 | EMD Millipore | MABN50 | No variablity observed across different lot numbers |
| anti-Pax-6 | Biolegend | 901301 | No variablity observed across different lot numbers |
| anti-Pdx1 | R&D Systems | AF2419 | No variablity observed across different lot numbers |
| anti-SOX1 | R&D Systems | AF3369 | No variablity observed across different lot numbers |
| anti-SOX17 | R&D Systems | AF1924 | No variablity observed across different lot numbers |
| B-27 Supplement, minus Vitamin A | Gibco | 12587010 | |
| Basic fibroblast growth factor | Gibco | PHG0264 | |
| Betacellulin | Thermo Fisher Scientific | 50932345 | |
| Chir99021 | Stemgent | 04-000-10 | |
| CMRL 1066 | Corning | 99-603-CV | |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAF1000 | |
| D-(+)-Glucose | Sigma | G7528 | |
| DAPI | Invitrogen | D1306 | |
| Disposable Spinner Flasks | Corning, VWR | 89089-814 | |
| DMEM/F-12 | Gibco | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Essential 6 Media | Gibco | A1516501 | |
| FAF-BSA | Proliant | 68700 | |
| FGF7 | PeproTech | 100-19 | |
| Geltrex | Gibco | A1413202 | |
| GlutaMAX | Gibco | 35050061 | |
| Heparin | Sigma | H3149 | |
| Human Ultrasensitive Insulin ELISA | ALPCO Diagnostics | 80-INSHUU-E01.1 | |
| ITS-X | Invitrogen | 51500056 | |
| KGF | Peprotech | AF-100-19 | |
| Knockout DMEM | Gibco | 10829018 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| L-3,3′,5-Triiodothyronine (T3) | EMD Millipore | 642245 | |
| LDN193189 | Stemgent | 04-0074 | |
| Matrigel Matrix | Corning | 354277 | |
| MCDB-131 | Cellgro | 15-100-CV | |
| MEM NEAA | Gibco | 11140050 | |
| mTeSR 1 | StemCell Technologies | 5850 | |
| N2 Supplement | Life Technologies | 17502048 | |
| NaHCO3 | Sigma | S3817 | |
| Noggin Fc Chimera Protein | R&D Systems | 3344-NG-050 | |
| PdBU | EMD Millipore | 524390 | |
| Penicillin/Streptomycin | Mediatech | 30-002-CI | |
| RPMI | Gibco | 11875-093 | |
| Sant1 | Sigma-Aldrich | S4572 | |
| SB431542 | Stemgent | 04-0010 | |
| Smoothened Agonist, SAG | EMD Millipore | 566660 | |
| StemPro Accutase | Gibco | A1110501 | |
| TrypLE | Gibco | 12604013 | |
| Ultra-Low Attachment Microplates | Corning | 3471 | |
| Vitamin C | Sigma-Aldrich | A4544 | |
| Wnt3a | R&D Systems | 5036-WN | |
| XAV 939 | Tocris | 3748 | |
| XXI | EMD Millipore | 565790 | |
| Y-27632 | StemCell Technologies | 72302 |
参考文献
- Osafune, K., et al. Marked differences in differentiation propensity among human embryonic stem cell lines. Nature Biotechnology. 26 (3), 313-315 (2008).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Review Genetics. 15 (2), 82-92 (2014).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Conklin, J. F., Sage, J. Keeping an eye on retinoblastoma control of human embryonic stem cells. Journal of Cellular Biochemistry. 108 (5), 1023-1030 (2009).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110(2018).
- Hartwell, L. H., Weinert, T. A. Checkpoints: controls that ensure the order of cell cycle events. Science. 246 (4930), 629-634 (1989).
- Pardee, A. B. G1 events and regulation of cell proliferation. Science. 246 (4930), 603-608 (1989).
- Orford, K. W., Scadden, D. T. Deconstructing stem cell self-renewal: genetic insights into cell-cycle regulation. Nature Review Genetics. 9 (2), 115-128 (2008).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453 (7194), 519-523 (2008).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells. 26 (4), 894-902 (2008).
- Duan, Y., et al. Differentiation and characterization of metabolically functioning hepatocytes from human embryonic stem cells. Stem Cells. 28 (4), 674-686 (2010).
- Szkolnicka, D., Farnworth, S. L., Lucendo-Villarin, B., Hay, D. C. Deriving functional hepatocytes from pluripotent stem cells. Current Protocols in Stem Cell Biology. 30, 1-12 (2014).
- Vanhove, J., et al. H3K27me3 Does Not Orchestrate the Expression of Lineage-Specific Markers in hESC-Derived Hepatocytes In Vitro. Stem Cell Reports. 7 (2), 192-206 (2016).
- Kanebratt, K. P., Andersson, T. B. Evaluation of HepaRG cells as an in vitro model for human drug metabolism studies. Drug Metabolism & Disposition. 36 (7), 1444-1452 (2008).
- Nikolaou, N., Green, C. J., Gunn, P. J., Hodson, L., Tomlinson, J. W. Optimizing human hepatocyte models for metabolic phenotype and function: effects of treatment with dimethyl sulfoxide (DMSO). Physiological Reports. 4 (21), (2016).
- Kondo, Y., et al. An efficient method for differentiation of human induced pluripotent stem cells into hepatocyte-like cells retaining drug metabolizing activity. Drug Metabolism Pharmacokinetics. 29 (3), 237-243 (2014).
- Alizadeh, E., et al. The effect of dimethyl sulfoxide on hepatic differentiation of mesenchymal stem cells. Artificial Cells, Nanomedicine, and Biotechnology. 44 (1), 157-164 (2016).
- Czysz, K., Minger, S., Thomas, N. DMSO efficiently down regulates pluripotency genes in human embryonic stem cells during definitive endoderm derivation and increases the proficiency of hepatic differentiation. PLoS One. 10 (2), 0117689(2015).
- Ogaki, S., Morooka, M., Otera, K., Kume, S. A cost-effective system for differentiation of intestinal epithelium from human induced pluripotent stem cells. Scientific Reports. 5, 17297(2015).
- Choi, S. C., et al. Mixl1 and Flk1 Are Key Players of Wnt/TGF-beta Signaling During DMSO-Induced Mesodermal Specification in P19 cells. Journal of Cellular Physiology. 230 (8), 1807-1821 (2015).
- Chetty, S., et al. A Src inhibitor regulates the cell cycle of human pluripotent stem cells and improves directed differentiation. Journal of Cell Biology. 210 (7), 1257-1268 (2015).
- Qiu, Z., et al. Marmoset induced pluripotent stem cells: Robust neural differentiation following pretreatment with dimethyl sulfoxide. Stem Cell Research. 15 (1), 141-150 (2015).
- Swartz, E. W., et al. A Novel Protocol for Directed Differentiation of C9orf72-Associated Human Induced Pluripotent Stem Cells Into Contractile Skeletal Myotubes. Stem Cells Translational Medicine. 5 (11), 1461-1472 (2016).
- Teimourian, S., Moghanloo, E. Thwarting PTEN Expression by siRNA Augments HL-60 Cell Differentiation to Neutrophil-Like Cells by DMSO and ATRA. DNA Cell Biology. 35 (10), 591-598 (2016).
- van den Berg, C. W., Elliott, D. A., Braam, S. R., Mummery, C. L., Davis, R. P. Differentiation of Human Pluripotent Stem Cells to Cardiomyocytes Under Defined Conditions. Methods in Molecular Biology. 1353, 163-180 (2016).
- Deng, F., et al. Combination of retinoic acid, dimethyl sulfoxide and 5-azacytidine promotes cardiac differentiation of human fetal liver-derived mesenchymal stem cells. Cell Tissue Bank. 17 (1), 147-159 (2016).
- Yoon, S. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2018).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637(2018).
- Kroon, E., et al. Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo. Nature Biotechnology. 26 (4), 443-452 (2008).
- Zhang, P., et al. Short-term BMP-4 treatment initiates mesoderm induction in human embryonic stem cells. Blood. 111 (4), 1933-1941 (2008).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Tchieu, J., et al. A Modular Platform for Differentiation of Human PSCs into All Major Ectodermal Lineages. Cell Stem Cell. 21 (3), 399-410 (2017).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Fiore, M., Degrassi, F. Dimethyl sulfoxide restores contact inhibition-induced growth arrest and inhibits cell density-dependent apoptosis in hamster cells. Experimental Cell Research. 251 (1), 102-110 (1999).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Bock, C., et al. Reference Maps of human ES and iPS cell variation enable high-throughput characterization of pluripotent cell lines. Cell. 144 (3), 439-452 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- D'Amour, K. A., et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nature Biotechnology. 24 (11), 1392-1401 (2006).
- Jacks, T., et al. Effects of an Rb mutation in the mouse. Nature. 359 (6393), 295-300 (1992).
- Nguyen, D. X., Baglia, L. A., Huang, S. M., Baker, C. M., McCance, D. J. Acetylation regulates the differentiation-specific functions of the retinoblastoma protein. The EMBO Journal. 23 (7), 1609-1618 (2004).
- Slack, R. S., et al. Cells differentiating into neuroectoderm undergo apoptosis in the absence of functional retinoblastoma family proteins. Journal of Cell Biology. 129 (3), 779-788 (1995).
- Gu, W., et al. Interaction of myogenic factors and the retinoblastoma protein mediates muscle cell commitment and differentiation. Cell. 72 (3), 309-324 (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved