Method Article
Trattamento transitorio delle cellule staminali pluripotenti umane con DMSO per promuovere la differenziazione
In questo articolo
Riepilogo
La generazione di tipi di cellule differenziate dalle cellule staminali pluripotenti umane (hPSCs) mantiene grandi promesse terapeutiche, ma rimane impegnativo. I PSC spesso presentano un'inerente a differenziarsi anche se stimolati con un set adeguato di segnali. Descritto qui è un semplice strumento per migliorare la differenziazione multilineage attraverso una varietà di linee PSC.
Abstract
Nonostante il crescente uso di cellule staminali pluripotenti (PSC), permangono sfide nel differenziare in modo efficiente le cellule staminali pluripotenti embrionali e indotte (ESC e iPSC) attraverso vari lignaggi. Sono stati sviluppati numerosi protocolli di differenziazione, ma la variabilità attraverso le linee cellulari e i bassi tassi di differenziazione richiedono difficoltà nell'implementazione di questi protocolli. Descritto qui è un mezzo facile ed economico per migliorare la capacità di differenziazione dei PSC. È stato precedentemente dimostrato che il trattamento delle cellule staminali con una bassa concentrazione di solforo dimetilo (DMSO) aumenta significativamente la propensione di una varietà di PSC a differenziarsi a diversi tipi di cellule in seguito alla differenziazione diretta. Questa tecnica ha dimostrato ora di essere efficace in diverse specie (ad esempio, topo, primate e umani) in più lignaggi, che vanno dai neuroni e sferoidi corticali alle cellule muscolari lisce e gli epatociti. Il pretrattamento DMSO migliora la differenziazione del PSC regolando il ciclo cellulare e innescondo le cellule staminali in modo che siano più reattive ai segnali di differenziazione. Qui è fornita la metodologia dettagliata per l'utilizzo di questo semplice strumento come mezzo riproducibile e ampiamente applicabile per differenziare in modo più efficiente i PSC a qualsiasi lignaggio di scelta.
Introduzione
L'uso di cellule staminali pluripotenti ha portato a numerosi progressi nella ricerca biomedica, tra cui i campi della medicina rigenerativa e delle terapie basate su cellule staminali, la modellazione delle malattie e lo screening farmacologico. Ha anche portato alla prospettiva generale di una ricerca più traducibile e di una medicina personalizzata. L'avvento della tecnologia indotta di cellule staminali pluripotenti (iPSC) oltre 20 anni fa ha permesso ai ricercatori di sviluppare cellule staminali pluripotenti da tessuti somatici e differenziarle in tipi di cellule funzionali per studiare una varietà di patologie, tra cui malattie cardiovascolari, neurologiche e immunologiche. Sebbene siano stati compiuti progressi significativi nella tecnologia di differenziazione delle cellule staminali, persistono sfide nel differenziare efficacemente le cellule staminali embrionali umane (hESC) e gli iPSC, limitando l'uso diffuso della tecnologia delle cellule staminali tra programmi di ricerca. La variabilità intrinseca attraverso diverse linee cellulari e cloni continua a rappresentare ostacoli per differenziare le linee di cellule staminali ai linages desiderati1. Inoltre, derivare cellule funzionali mature e differenziate terminalmente da hPSC rimane un processo noioso e inefficiente attraverso molti lignaggi. Infatti, le cellule differenziate dagli hPSC spesso non si differenziano terminalmente in celle funzionali2. Nell'ulteriore spostamento delle terapie basate sulle cellule staminali da utilizzare nei pazienti, è necessario migliorare e garantire l'efficacia delle cellule generate dagli hPSC.
Il nostro laboratorio ha creato uno strumento rapido ed economico per migliorare significativamente l'efficienza di differenziare sia gli iPSC che gli ESC in tipi di cellule mature. Abbiamo scoperto che il pretrattamento di hiPSC e hESC con il solfuro ditilico (DMSO) reagente comunemente usato per 24 h a 48 h prima dei risultati diretti di differenziazione comporta un netto miglioramento della capacità di differenziazione delle cellule staminali. Il trattamento con DMSO aumenta la percentuale di hiPSC e hESC nella prima fase G1 del ciclo cellulare e attiva la proteina del retinoblastoma (Rb)3, un regolatore critico della proliferazione cellulare, della sopravvivenza e della differenziazione4. Nel lavoro più recente, si è scoperto che Rb e i suoi familiari sono necessari per gli effetti pro-differenziazione della DMSO, in modo tale che l'inattivazione transitoria di Rb sopprime gli effetti del DMSO, mentre l'attivazione coniugale di Rb in modo transitorio migliora Effetti di DMSO5. Analogo al ciclo cellulare durante lo sviluppo embrionale, il ciclo cellulare di ESC e iPSC è caratterizzato da una fase G1 abbreviata che promuove l'auto-rinnovamento6,7,8. Questa fase G1 abbreviata consente una proliferazione più illimitata ma limita il potenziale di differenziazione4,9. Promuovendo l'arresto della crescita nel G1 e attivando i controlli dei checkpoint nel ciclo cellulare di hESC e iPSC, il trattamento DMSO primes cellule per i cambiamenti del destino cellulare a seguito di differenziazione diretta.
Ad oggi, il pretrattamento DMSO ha dimostrato di migliorare la capacità di differenziazione a tutti e tre gli strati germinali in oltre 30 linee di controllo e cellule umane specifiche della malattia3,5, nonché la differenziazione delle cellule staminali e di altri linee cellulari a una varietà di altri tipi di cellule mature negli studi successivi10,11,12,13,14,15,16, 17 mi lato , 18 mi lato , 19 del 12 , 20 anni , 21 Mieto , 22 Milia , 23 del 23 o , 24 Mi lasa' di , 25 mi lato , 26 del sistema di , 27 mi lapiùdel , 28 (Tabella 1). Inoltre, il trattamento Con DMSO ha dimostrato di essere efficace nel migliorare la differenziazione delle cellule primarie non umane21,23 (ad esempio, topo, primate, coniglio), suggerendo meccanismi condivisi tra le specie. Infine, il pretrattamento DMSO è stato esteso anche alla tecnologia di editing genetico, con uno studio particolare che mostra che il pretrattamento DMSO di 24 h di hESC/iPSC ha aumentato significativamente la capacità delle ripetizioni palindromiche brevi a pacchetto (CRISPR) /CRISPR-associate proteina 9 (Cas9) mediato efficienza di editing del DNA non codificante senza incorporare mutazioni indesiderate29. A condizione qui è fornita una metodologia dettagliata del pretrattamento DMSO di HESC e iPSC per applicazioni in biologia delle cellule staminali e differenziazione diretta.
Protocollo
1. Manutenzione delle cellule staminali
NOT: Il protocollo di manutenzione cellulare descritto di seguito si applica alle cellule staminali pluipotenti (PSC) mantenute in un monostrato aderente. Supporti, altri reagenti e piastre di coltura cellulare utilizzate prima del trattamento DMSO possono essere regolati in base alle esigenze. Per tutti i seguenti protocolli in questo manoscritto, le cellule devono essere trattate sotto un armadietto di sicurezza biologica.
- Coat sterile, 6 pozzetti trattati con coltura tissutale con una matrice pluripotente qualificata per cellule staminali o substrato preparato secondo le istruzioni del produttore e incubare per almeno 1 h in un incubatore di CO2 (5% CO2, atmosfera umida). Le lastre rivestite possono essere avvolte e conservate a 4 gradi centigradi per un massimo di una settimana.
- Scongelare i PSC crioconservati in un bagno d'acqua a 37 gradi centigradi. Sterilizzare fiala con etanolo prima dell'introduzione all'armadietto di sicurezza biologica, quindi trasferire immediatamente le cellule tramite pipettaggio su un tubo conico sterile contenente 5-10 volumi di supporti preriscaldati di cellule staminali.
- Centrifugare le cellule a 300 x g per 5 min a temperatura ambiente (RT).
- Aspirare i supporti e risospendere delicatamente il pellet cellulare in 1 mL di supporti di cellule staminali integrati con un inibitore ROCK di 10 M, come Y-27632.
- Aspirare la matrice di coltura dalla piastra e semina le cellule alla densità desiderata, in genere 0,5-1 x 106 cellule per pozzo in almeno 2 mL di supporti per cellule staminali per bene.
NOT: La densità di placcatura può variare su diverse linee cellulari e cloni e deve essere ottimizzata di conseguenza. - Mantenere le cellule sostituendo con supporti di cellule staminali preriscaldate ogni giorno. Dividere le cellule a circa il 70%-80% di confluenza o quando le colonie cellulari iniziano a prendere contatto.
- Per la scissione delle cellule, aspirare il supporto e lavare le cellule una volta con PBS sterile. Incubare le cellule con 1 mL di una soluzione enzimatica di dissociazione per pozzo per 5-10 minuti a 37 .
- Lavare e sospendere le cellule con supporti di cellule staminali preriscaldate e trasferirle in un tubo conico sterile con 5-10 volumi di supporti di cellule staminali. Seguire i passaggi da 1,3 a 1,7 per placcare le celle.
2. Pretrattamento DMSO
NOT: Quando si placcano le cellule per il pretrattamento DMSO prima della differenziazione, la densità cellulare di placcatura iniziale deve essere ottimizzata tenendo conto del tasso di crescita tipico della linea di cellule staminali e del protocollo di differenziazione utilizzato. Convalidare la pluripotenza utilizzando marcatori convenzionali, se necessario. Le cellule devono essere passaggiate almeno 1x-2x dopo lo scongelamento iniziale prima della differenziazione.
-
Differenziazione della cultura 2D
- Quando le cellule raggiungono una confluenza appropriata, preparare piastre rivestite, dissociare le cellule e preparare una sospensione a cella singola come descritto sopra.
- Contare le cellule vive utilizzando un emocitometro o un contatore cellulare automatico, incluso il blu trypan o un altro marcatore di vitalità.
- Placcare le cellule su una piastra di 6 pozzetti rivestita a 0,5-1 x 106 cellule per bene nel supporto delle cellule staminali con l'inibitore di 10 M ROCK.
NOT: Per le linee cellulari testate nel nostro laboratorio, queste densità in genere hanno provocato 80%-90% cellule confluenti all'interno del 24 h pretrattamento DMSO. - Permettere alle cellule di incubare per 24 h a 37 gradi centigradi in un'incubatrice di CO2 (5% CO2, atmosfera umida).
- Preparare 1%-2% DMSO su supporti di cellule staminali preriscaldate (ad es., 100 L di DMSO in 10 mL di media , 1% soluzione DMSO, o 200 DMSO l'L in 10 mL di media - soluzione DMSO 2%.
- Dopo 24 h incubazione, aspirare i supporti dalle cellule e sostituirli con la soluzione DMSO.
- Lasciare che le cellule incubano per 24 h a 48 h a 37 gradi centigradi in un'incubatrice di CO2 (5% CO2, atmosfera umida) prima della differenziazione.
NOT: In genere, un trattamento DMSO di 24 ore su 24 h è sufficiente nella maggior parte delle linee umane ESC e iPSC. Le linee cellulari con tassi di crescita molto lenti (lunghi tempi di raddoppio) possono beneficiare dell'incubazione di 48 h con DMSO. Per un'incubazione di 48 h con DMSO, i supporti possono essere sostituiti con supporti con cellule staminali fresche con 1%-2% DMSO dopo i primi 24 h di trattamento.
-
Differenziazione della cultura 3D:
- Quando le cellule raggiungono una confluenza appropriata, dissociare e raccogliere le cellule in una sospensione cellulare come descritto sopra.
- Contare le cellule vive utilizzando un emocitometro o un contatore cellulare automatico, incluso un marcatore di vitalità.
- Placcare le cellule in una piastra non rivestita e a basso attaccamento 6 pozzetti a 0,5-1 x 106 cellule per bene in supporti di cellule staminali con 10 inibitori di ROCK.
NOT: Per le linee cellulari testate nel nostro laboratorio, queste densità in genere hanno portato alla formazione di una sfera hPSC 3D entro 24 h dall'impostazione delle cellule. - Permettere alle cellule di incubare per 24 h a 37 gradi centigradi in un'incubatrice di CO2 (5% CO2, atmosfera umida).
- Preparare 1%-2% DMSO su supporti di cellule staminali preriscaldate (ad es., 100 L di DMSO in 10 mL di media , 1% soluzione DMSO, o 200 DiL di DMSO in 10 mL di media - soluzione DMSO 2%.
- Sostituire i supporti seguendo le procedure standard (ad es. inclinare la piastra con un angolo di 30-45 gradi per consentire alle sfere cellulari di depositarsi nella parte inferiore del pozzo; trasferire le cellule in un tubo conico sterile e consentire alle sfere cellulari di depositarsi nella parte inferiore del tubo; o raccogliere delicatamente le cellule i n sospensione con una pipetta da 5 o 10 mL in un tubo conico sterile e cellule centrifugate a 300 x g per 5 min a RT).
- Aspirare i supporti dalle celle e sostituirli con la soluzione DMSO, pipetting delicatamente.
- Consentire alle cellule di incubare per 24 h a 48 h a 37 gradi centigradi in un'incubatrice di CO2 (5% CO2, atmosfera umida) prima della differenziazione.
NOT: In genere, un trattamento DMSO di 24 ore su 24 h è sufficiente nella maggior parte delle linee umane ESC e iPSC. Le linee cellulari con tassi di crescita molto lenti (lunghi tempi di raddoppio) possono beneficiare dell'incubazione di 48 h con DMSO. Per un'incubazione di 48 h con DMSO, i supporti possono essere sostituiti con supporti con cellule staminali fresche con 1%-2% DMSO dopo i primi 24 h di trattamento.
3. Differenziazione ai livelli germinali primari
NOT: Di seguito sono descritti i metodi precedentemente indicati per essere efficaci nel nostro laboratorio per PSC cresciuti in un monostrato su 6 piastre di pozzo. Qualsiasi protocollo di differenziazione scelto deve essere utilizzato dopo il trattamento DMSO per promuovere la differenziazione nei lignaggi desiderati. Rimuovere la soluzione DMSO dopo un trattamento di 24-48 h e procedere con la differenziazione seguendo i protocolli standard.
-
Differenziazione dell'endoderma (adattato da Kroon et al.30)
- Pretrattare le cellule con DMSO come descritto in precedenza per le colture 2D.
- Preparare le soluzioni azionarie Wnt3a e Activin A.
- Preparare i supporti di differenziazione endodermica del giorno 1 aggiungendo Wnt3a a una concentrazione finale di 20 ng/mL e Activin A a una concentrazione finale di 100 ng/mL al volume appropriato di supporti RPMI preriscaldati.
- Dopo il pretrattamento DMSO, aspirare i supporti dalle cellule e sostituirli con supporti giorno 1 (ad esempio, 2 mL per pozzo di un 6 pozzetti).
- Permettere alle cellule di incubare per 24 h a 37 gradi centigradi in un'incubatrice di CO2 (5% CO2, atmosfera umida).
- Preparare i giorni 2 e 3 supporti di differenziazione endodermica aggiungendo Activin A a una concentrazione finale di 100 ng/mL al volume appropriato di supporti RPMI preriscaldati.
- Aspirare i supporti dalle celle e sostituirli con supporti giorno 2 (ad esempio, 2 mL per pozzo di una piastra di 6 pozzetti).
- Lasciare che le cellule incubano per 24 h a 37 gradi centigradi in un'incubatrice di CO2 (5% CO2, atmosfera umida).
- Aspirare i supporti dalle celle e sostituirli con i supporti Giorno 3 (ad esempio, 2 mL per pozzo di un 6 pozzetti).
-
Differenziazione del mesoderma (adattato da .hang et al.31)
- Pretrattare le cellule con DMSO come descritto in precedenza per le colture 2D.
- Preparare le soluzioni azionarie Wnt3a e Activin A.
- Preparare i supporti di differenziazione mesodermica aggiungendo Wnt3a a una concentrazione finale di 20 ng/mL e Activin A ad una concentrazione finale di 100 ng/mL al volume appropriato di supporti RPMI avanzati preriscaldati.
- Dopo il pretrattamento del DMSO, aspirare i supporti dalle cellule e sostituirli con supporti di differenziazione (ad esempio, 2 mL per pozzo di una piastra 6).
- Permettere alle cellule di incubare per 24 h a 37 gradi centigradi in un'incubatrice di CO2 (5% CO2, atmosfera umida).
-
Differenziazione dell'ectoderma (adattato da Chambers et al.32)
- Pretrattare le cellule con DMSO come descritto in precedenza per le colture 2D.
- Preparare le soluzioni stock Noggin e SB431542.
- Preparare i supporti di base di differenziazione ectodermica sciogliendo la sostituzione del siero a eliminazione diretta (KOSR) a una concentrazione finale del 10% nel DMEM ad eliminazione diretta.
NOT: Preparare un numero sufficiente di supporti di base per 3-4 giorni di modifica dei supporti. - Preparare i supporti di differenziazione ectodermica aggiungendo Noggin ad una concentrazione finale di 500 ng/mL e SB431542 ad una concentrazione finale di 10 M al volume appropriato di DMEM KOSR/knockout preriscaldato.
- Dopo il pretrattamento del DMSO, aspirare i supporti dalle cellule e sostituirli con supporti di differenziazione (ad esempio, 2 mL per pozzo di una piastra 6).
- Lasciare che le cellule incubano per 3-4 giorni a 37 gradi centigradi in un'incubatrice di CO2 (5% CO2, atmosfera umida), sostituendo i media ogni giorno con fattori di differenziazione appena aggiunti.
4. Differenziazione ai tipi di cellule progenitori
Di seguito vengono descritti i metodi precedentemente dimostrati efficaci nel nostro laboratorio per PSC cresciuti in una coltura 2D o 3D. Qualsiasi protocollo di differenziazione scelto deve essere utilizzato dopo il trattamento DMSO per promuovere la differenziazione nei lignaggi desiderati. Rimuovere la soluzione DMSO dopo un trattamento di 24-48 h e procedere con la differenziazione seguendo i protocolli standard.
- Differenziazione delle cellule progenitrici neurali (adattato da Tchieu et al.33)
- Preparare 6 pozzetti rivestindo con una matrice o substrato ridotto di cellule staminali pluripotenti, secondo le istruzioni del produttore, per almeno 1 h in un'incubatrice di CO2 (5% CO2, atmosfera umida). Le lastre rivestite possono essere avvolte e conservate a 4 gradi centigradi per un massimo di 1 settimana.
- Piatto PSC come descritto sopra a densità di 0,5-1 x 106 cellule per bene in supporti di cellule staminali contenenti un inibitore ROCK.
- Pretrattare le cellule con DMSO come descritto in precedenza per le colture 2D.
- Preparare piccole soluzioni chimiche inibitori LDN193189, SB431542 e XAV939.
- Preparare i supporti di differenziazione dei neuroectodermi delle giornate 1-3 integrando Essential 6 Media con 500 nM LDN193189, 10 M SB431542 e 2 XAV939.
- Dopo il pretrattamento Del DMSO, aspirare i media e sostituire con i media neuroectodermi giorni 1-3 (ad esempio, 2 mL per pozzo di un 6 bene). Cambiare i media ogni giorno.
- Preparare i giorni 4-12 supporti di differenziazione neuroectodermi integrando Essential 6 Media con 500 nM LDN193189 e 10 SB431542.
- Il giorno 4 della differenziazione, aspirare i media e sostituire con giorni 4-12 supporti neurodectoderm. Cambiare il supporto ogni giorno.
- Dopo 12 giorni di differenziazione, le cellule differenziate dovrebbero esprimere marcatori appropriati delle cellule progenitrici neurali (NPC). I PNG possono essere ulteriormente mantenuti in supporti neurali contenenti DMEM/F-12, 2% B-27, 1% N-2, e integrati con 10 fattori di crescita fibroblasti di base (bFGF). Passare i PNG quando confluente utilizzando una soluzione di distacco cellulare, placcatura NPC a 0,5-1 x 106 cellule per bene.
- Differenziazione delle cellule progenitorioli oligodendrociti (adattato da Douvaras e Fossati34)
- Piastrare i PSC come descritto sopra ad una densità di 1 x 105 per bene su 6 lastre di pozzo rivestite in supporti di cellule staminali contenenti un inibitore ROCK.
- Pretrattare le cellule con DMSO come descritto in precedenza per le colture 2D.
- Preparare SB431542, LDN193189, soluzioni di stock di acido retinoico (RA) e agonista levigato (SAG).
- Preparare i giorni 0–8 supporti di differenziazione completando DMEM/F-12 con 10 sB431542, 250 nM LDN193189 e 100 nM RA.
- Dopo il pretrattamento del DMSO, incubare cellule con supporti di differenziazione per 8 giorni, cambiando i media ogni giorno con fattori di differenziazione appena aggiunti (ad esempio, 2 mL per pozzo di una piastra di 6 pozzetti).
- Il giorno 8, sostituire i supporti con DMEM/F-12 contenente 1x MEM soluzione di aminoacidi non essenziali (NEAA), 1X L-glutamine, 2-mercaptoetanolo, penicillina/streptomicina, e 1x N-2 integrato 100 nM RA e 1 SAG. Cambiare il supporto ogni giorno.
- Dopo 12 giorni di differenziazione, le cellule differenziate devono esprimere marcatori appropriati delle cellule progenitrici oligodendrocite (OPC).
- Differenziazione delle cellule progenitori endocrine (adattato da Pagliuca et al.35)
- PSC di semi a 6 x 105 cellule/mL nei supporti delle cellule staminali più 10 - inibitore ROCK in flaconi da 500 mL posizionati su una piastra di agitazione a 9 posizioni impostata alla velocità di rotazione di 70 giri in un'incubatrice di 37 gradi centigradi, 5% di CO2e 100% di umidità.
- Consentire ai cluster di depositarsi nella parte inferiore del pallone, aspirare il supporto, quindi pretrattare con 1%-2% DMSO.
- Preparare Activin A, Chir99021, KGF, Sant1, all-trans retinoic acid (RA), LDN193189, PdBU, XXI, Alk51, T3 e Betacelluin stock soluzioni.
- Preparare i supporti di base di differenziazione in base alla formulazione nella tabella 3.
- Dopo il pretrattamento Del DMSO, aspirare i supporti e sostituire con supporti S1 integrati con 100 ng/mL Activin A e 3 mM Chir99021 (ad esempio, 500 mL per fiaschetta). Lasciare l'incubazione per 24 ore.
- Il giorno 2, sostituire i media con i media S1 integrati con 100 ng/mL Activin A. Consentire l'incubazione per 2 giorni.
- Il giorno 4, sostituire i supporti con supporti S2 integrati con 50 ng/mL KGF. Lasciare l'incubazione per 3 giorni, cambiando i media dopo i primi 2 giorni (Giorno 6).
- Il giorno 7, sostituire i supporti con supporti S3 integrati con 50 ng/mL KGF, 0,25 mM Sant1, 2 mM RA e 200 nM LDN193189. Lasciare l'incubazione per 24 ore.
- Il giorno 8, sostituire i supporti con supporti S3 integrati con 50 ng/mL KGF, 0,25 mM Sant1, 2 mM RA, 200 nM LDN193189 e 500 nM PdBU. Lasciare l'incubazione per 24 ore.
- Il giorno 9, sostituire i supporti con supporti S3 integrati con 50 ng/mL KGF, 0,25 mM Sant1 e 100 nM RA. Consentire l'incubazione per 5 giorni, cambiando i media ogni 2 giorni (giorno 11 e 13).
- Nei giorni 14 e 16, sostituire i supporti con supporti S5 integrati con 0,25 mM Sant1, 100 nM RA, 1 mM XXI, 10 mM Alk5i II, 1 mM T3 e 20 ng/mL betacellulin (4 giorni di incubazione totale).
- Nei giorni 18 e 20, sostituisci i supporti con supporti S5 integrati con 25 nM RA, 1 mM XXI, 10 mM Alk5i II, 1 mM T3 e 20 ng/mL betacellulin.
5. Convalida immunocitochimica della differenziazione
NOT: I seguenti metodi descrivono un protocollo immunocitochimico generale che può essere regolato in base alle esigenze. Gli anticorpi primari sono quelli che sono stati precedentemente convalidati nel nostro laboratorio. Possono essere utilizzate anche altre tecniche per la convalida della differenziazione (ad esempio, citometria di flusso, qPCR, sequenziamento dell'RNA, gonfiore occidentale, saggi funzionali, ecc.).
-
Cellule di immunoetichettatura
- Per le colture 3D nelle sospensioni, piastra a grisciolo intero cellulare o cluster dispersi in sospensioni monocellulare su piastre rivestite per 18-24 h prima della fissazione.
- Aspirati i supporti dalle cellule aderenti e lavati brevemente con PBS a RT su uno shaker.
- Per la fissazione delle cellule, aspirare PBS e incubare le cellule con 4% paraformaldeide (PFA) in PBS per 20 min a RT su shaker.
ATTENZIONE: Lo stock di PFA dovrebbe essere preparato sotto una cappa di fumi a causa della sua tossicità. Non inalare e indossare attrezzature protettive personali adeguate. - Rimuovere la PFA e scartare nel contenitore di rifiuti chimici appropriato.
- Lavare le cellule 3x con PBS per almeno 5 min per lavaggio a RT su uno shaker.
- Per la permeabilizzazione e il blocco cellulare, incubare le cellule con il siero d'asino del 5% preparato in 0,3% triton-x 100/PBS per 1 h a RT su uno shaker.
- Preparare la soluzione anticorpale primaria nella stessa soluzione utilizzata per la permeabilizzazione/blocco.
- Incubare nella soluzione anticorpale primaria durante la notte a 4 gradi centigradi su shaker.
- Dopo l'incubazione notturna, lavare le cellule 3x con PBS per almeno 5 min per lavaggio a RT su uno shaker.
- Preparare la soluzione anticorpale secondaria in una soluzione di permeabilizzazione/blocco.
- Lasciare incubare nella soluzione anticorpale secondaria per 1 h a RT su uno shaker.
- Soluzione anticorpale secondaria aspirato e lavare le cellule 3x con PBS per almeno 5 min per lavaggio a RT su uno shaker.
- Incubare cellule con DAPI o un altro marcatore preferito per un tempo di incubazione appropriato e risciacquare in PBS.
-
Quantificazione delle immagini
- Acquisire un minimo di tre immagini per condizione al microscopio fluorescente e/o con una piattaforma di screening ad alto contenuto.
- Quantificare la percentuale di cellule positive per ogni marcatore contando il numero totale di cellule colorate degli anticorpi e i numeri di cellule totali (in base alla colorazione dei nuclei DAPI/Hoechst) utilizzando un software di imaging imparziale (ad esempio, ImageJ) o una piattaforma di screening automatizzato per Analisi.
Risultati
Morfologia degli iPPC trattati con DMSO
Gli iPPOsCS umani derivati da soggetti di controllo sono stati coltivati in un monostrato 2D aderente o in sfere cellulari 3D in sospensione. Circa 24 h dopo la placcatura iniziale, le cellule sono state trattate con 1% o 2% DMSO per 24 h nel mezzo di manutenzione. Le immagini rappresentative del campo luminoso dopo il trattamento DMSO sono mostrate nella Figura 1. Coerentemente con le precedenti relazioni per gli iPSC mantenuti in un monostrato3, il pretrattamento DMSO ha provocato una diminuzione transitoria del tasso di crescita dipendente dalla dose rispetto alle cellule trattate con non DMSO (Figura 1A). Questa diminuzione della proliferazione è associata ad un aumento del contatto tra cellule, che è particolarmente pronunciato nelle cellule trattate con DMSO del 2% che mostrano una maggiore formazione di colonie cellulari più altamente raggruppate. In altri tipi di cellule, l'arresto di G1 indotto dalla DMSO ha dimostrato di essere associato a una maggiore espressione delle proteine coinvolte nelle interazioni cellula-cellula che supportano l'arresto della crescita indotto dal contatto-inibizione36. Negli iPSC mantenuti come sfere cellulari 3D, il trattamento DMSO ha aumentato allo stesso modo il numero di sfere cellulari (Figura 1B). Inoltre, il trattamento Con DMSO ha comportato dimensioni meno variabili della sfera 3D, che in precedenza si è dimostrato essere indicativo di una migliore capacità di differenziazione delle cellule37. È importante sottolineare che né l'1% o il 2% di DMSO ha comportato la tossicità cellulare, misurata in base ai conteggi di fattibilità (n , 3D culture % live - controllo: 80 - 1,3; 1% DMSO: 82 3,7, 2%: 81 - 2,7; 3D culture % live - controllo: 81 - 4,3; 1% DMSO: 82 6,7, 2%: 82 2,7). Nel complesso, questi risultati sono coerenti con la nozione che il trattamento DMSO altera il ciclo cellulare e i modelli di crescita nelle cellule staminali coltivate. Questi effetti sull'inibizione della crescita sono reversibili quando il DMSO viene rimosso dal mezzo, come mostrato in precedenza3.
Il trattamento DMSO migliora la differenziazione delle ESC agli strati primari di germinali
HUES6 hESC sono stati seminati su piastre rivestite per 24 h seguiti da trattamento con 2% DMSO per 24 h nel mezzo di manutenzione. Le cellule sono state poi differenziate nei tre strati germinali primari seguendo i paradigmi di trattamento illustrati nella Figura 2A30,31,32. Le cellule differenziate sono state quindi fissate e macchiate immunologicamente per marcatori prototippici di ogni rispettivo strato germinale (SOX17 per endoderma, brachyury per il mesoderma e SOX1 per l'ectoderm). Come mostrato nella Figura 2B, 24 h di pretrattamento con 2% DMSO aumentato la proporzione di cellule che esprimono ogni rispettivo marcatore di livello germinale. Questo è coerente con i precedenti rapporti del nostro laboratorio che mostrano una maggiore immunoreattività, espressione genica, così come il numero assoluto di cellule differenziate verso tutti gli strati germinali in cellule staminali trattate con DMSO3,5. HUES6 è una linea hESC con una propensione moltobassa per la differenziazione tra tutti i linge 1, ma il trattamento DMSO migliora sostanzialmente la sua capacità di differenziarsi tra tutti gli strati germinali.
Il trattamento DMSO migliora la differenziazione ai tipi di cellule progenitorie
Per studiare l'effetto della DMSO sulla differenziazione ai tipi di cellule progenitrici del CNS, gli iPSC umani sono stati differenziati in cellule progenitrici neurali (NPC) o cellule progenitrici oligodendrocite (OPC). Per generare PNG, le cellule sono state pretrattate con 2% DMSO per 24 h nel mezzo di manutenzione seguito da 12 giorni di differenziazione diretta33 (Figura 3A). Come mostrato nella Figura 3B, 2% DMSO pretrattamento ha aumentato l'espressione del marcatore NPC PAX6 rispetto al controllo. Utilizzando un altro protocollo convalidato in precedenza34 (Figura 3C), gli iPSC sono stati differenziati per 12 giorni in OPC. Simile ai PNG, gli OPC derivati da iPSC pretrattati con 2% DMSO per 24 h hanno dimostrato una percentuale di aumento delle cellule che esprimono marcatori OPC OLIG2 (Figura 3D).
Un trattamento DMSO iniziale persiste per migliorare la differenziazione nei tipi di cellule mature
Per studiare l'effetto della DMSO sulle ultime fasi di un protocollo di differenziazione, gli HUES8 hESC sono stati pretrattati per 24 h con 2% DMSO prima della differenziazione alle cellule in base a un protocollo di differenziazione diretto di 20 giorni descritto nella Figura 4a 35. Gli HUES8 sono stati utilizzati in quanto in precedenza hanno dimostrato di avere una maggiore propensione verso il lignaggio endodermico1,38. Nella fase endoderma definita, le cellule differenziate esprimono SOX17 e FOXA2, marcatori specifici per l'endoderm definitivo (DE). Con un'ulteriore differenziazione nello stadio progenitori pancreatico (PP1),le cellule differenziate esprimono PDX1 e FOXA2, marcatori caratteristici delle cellule progenitrici pancreatiche. In queste fasi di differenziazione delle cellule pancreatiche, l'efficienza dell'induzione in DE e successivamente nel PP1 era elevata sia per il controllo che per gli HESC trattati con DMSO si differenziavano in ciascuna di queste fasi (Figura 4B, stadi 1 e 3). Anche se si nota che la linea cellulare HUES8 ha aumentato la propensione a differenziarsi nel lignaggio endodermico, poiché la differenziazione viene indotta ulteriormente nei tipi di cellule più specializzati nelle fasi terminali, gli hESC trattati con DMSO sono molto più probabilità di produrre cellule endocrine pancreatiche mature. Le efficienze di generazione di cellule progenitrici PDX1/NKX6.1, Neurogenin 3 e cellule endocrine di NKX6.1/C-peptide sono state sostanzialmente più elevate nelle cellule hESC trattate dal DMSO (Figura4B, stadi 4 e 5). Questi risultati sono in linea con la differenziazione NPC e OPC che mostra che il DMSO migliora il potenziale di differenziazione per i tipi di cellule progenitrici e dimostra anche che l'effetto del DMSO è persistente nella generazione di tipi di cellule più specializzati. Questo è coerente con il lavoro precedente, dove abbiamo dimostrato che il trattamento DMSO iniziale 24 h aumenta la differenziazione nei tipi di cellule terminali attraverso gli strati di germinali, anche nelle cellule neuronali e superando i cardiomiociti31,39 nelle linee cellulari con propensioni elevate o scarse per la differenziazione3.
Il trattamento DMSO iniziale migliora la funzione cellulare derivata dall'HESC dopo il trapianto in vivo
In precedenza, abbiamo dimostrato l'efficacia del trattamento DMSO nel migliorare la differenziazione degli HESC in cellule progenitrici pancreatiche funzionali che in seguito mostrano un netto miglioramento della secrezione di insulina in vivo3. Utilizzando protocolli3,30,40, HUES8 hESC sono stati trattati con 1% DMSO per 24 h, differenziati in cellule progenitrici pancreatiche e trapiantati in topi SCID-Beige immunodeficienti per valutare (ad esempio, secrezione di insulina in risposta a una sfida al glucosio o stimolazione KCl) (Figura 5A). Mentre l'efficienza della differenziazione in FOXA2 PDX1 (75%) I progenitori pancreatici erano comparabili tra il controllo e gli HESC trattati con DMSO (Figura 5B) per la linea HUES8 hESC, le cellule differenziate dagli hESC a seguito di un trattamento DMSO 24 h% avevano migliorato la reattività al glucosio e al KCl stimolazione dopo il trapianto in vivo. I miglioramenti nella funzionalità sono stati evidenti entro 2 settimane dopo il trapianto (Figura 5C) e persistito fino ad almeno 16 settimane dopo il trapianto (Figura 5D). Nel loro insieme, questi risultati suggeriscono che il pretrattamento DMSO non solo aumenta l'efficienza di differenziazione agli strati germinali, alle cellule progenitrici e ai tipi di cellule più mature, ma continua anche a migliorare la funzionalità delle cellule differenziate in vivo.
| Tipo di cella differenziata | Tipo di cella iniziale | %DMSO | Durata del trattamento DMSO | Durata del trattamento DMSO |
| Cellule epatiche | Esc Linea cellulare epatoma Esc Esc Cellule staminali mesenchimale iPSC Esc Esc Linea cellulare epatoma Esc | 1,0 1 (in questo stato) 1,0 1 (in questo stato) 1,0 1 (in questo stato) 0,5 0,5 0.1-2.0 1,0 1 (in questo stato) 1,0 1 (in questo stato) 0,5 0,5 1,0 1 (in questo stato) 0,6 (in inglese) | 8 giorni Diversi giorni 7 giorni 10-14 giorni 7-21 giorni 7 giorni 4 giorni 5 giorni 2-21 giorni per l'intera durata | Basma et al., 2008 Kanebratt e Andersson, 2008 Hay et al., 2009 Duan et al., 2010 Alizadeh et al., 2014 Kondo et al., 2014 Szkolnicka et al., 2014 Czysz et al., 2015 Nikolaou et al., 2016 Vanhove et al., 2016 |
| Strati germinali primari | ESC e iPSC hESC (informazioni in ucraina) hESC (informazioni in ucraina) | 0.1-2.0 0,5 0,5 0.1-2.0 | 24 ore su 24 24 ore su 24 24 ore su 24 | Chetty et al., 2013 Chetty et al., 2015 Li et al., 2018 |
| Cellule cardiache | ESC e iPSC Cellule P19 ESC e iPSC Cellule staminali mesenchymale fetali | 0.1-2.0 1,0 1 (in questo stato) 1.0-2.0 0,8-1,0 | 24 ore su 24 4 giorni 24-30 ore 24 ore su 24 | Chetty et al., 2013 Choi et al., 2014 van den Berg et al., 2016 Deng et al., 2017 |
| Cellule pancreatiche | ESC e iPSC hESC (informazioni in ucraina) | 0.1-2.0 0,5 0,5 | 24 ore su 24 24 ore su 24 | Chetty et al., 2013 Chetty et al., 2015 |
| Cellule muscolari lisce | Cellule P19 | 1,0 1 (in questo stato) | 4 giorni | Choi et al., 2014 |
| Cellule endoteliche | Cellule P19 | 1,0 1 (in questo stato) | 4 giorni | Choi et al., 2014 |
| Enterociti | iPSC | 0-1,6 | 4 giorni | Ogaki et al., 2015 |
| Epitelio intestinale | iPSC | 0-1,6 | 4 giorni | Ogaki et al., 2015 |
| Celle neurali | Marmoset iPSC | 0,05-2,0 | 24 ore su 24 | Qiu et al., 2015 |
| Neutrofili | Linea cellulare della leucemia | 1.25 (in vie del 12) | 6-8 giorni | Teimourian e Moghanloo, 2016 |
| Myotubes scheletrici | iPSC | 1.5 1. | 24 ore su 24 | Swartz et al., 2016 |
| Organoide Corticale | hiPSCs | 1,0 1 (in questo stato) | 24 ore su 24 | Yoon et al., 2018 |
Tabella 1: Sintesi del lavoro pubblicato in precedenza che dimostra gli effetti benefici del trattamento DMSO sulla differenziazione.
| S1 (in modo sin) | S2 | S3 | S5 | |
| MCDB131 (L) | 1 : il nome del | 1 : il nome del | 1 : il nome del | 1 : il nome del |
| Glucosio (g) | 0,44 (in questo da 44) | 0,44 (in questo da 44) | 0,44 (in questo da 44) | 3.6 |
| NaHCO3 (g) | 2.46 | 1.23 (in vie del documento di sin fa | 1.23 (in vie del documento di sin fa | 1.754 (in questo: 754) |
| FAF-BSA (g) | 20 anni | 20 anni | 20 anni | 20 anni |
| ITS-X (mL) | 0,02 (in linguaggio 02) | 0,02 (in linguaggio 02) | 5 Del numero 3( | 5 Del numero 3( |
| Glutamax (mL) | 10 del sistema | 10 del sistema | 10 del sistema | 10 del sistema |
| Vitamina C (mg) | 44 (di sistema) | 44 (di sistema) | 44 (di sistema) | 44 (di sistema) |
| Eparina (mg) | 0 (in vie | 0 (in vie | 0 (in vie | 10 del sistema |
| P/S (mL) | 10 del sistema | 10 del sistema | 10 del sistema | 10 del sistema |
Tabella 2: Componenti di supporti di base di differenziazione delle cellule progenitori endocrine.
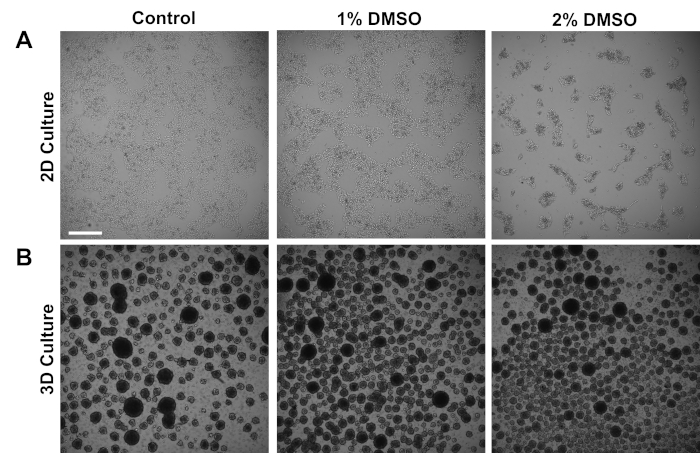
Figura 1 : il trattamento DMSO altera la crescita degli hPSC. (A) Immagini rappresentative del campo luminoso degli hiPSCs placcati in un monostrato dopo non aver ricevuto alcun trattamento (controllo) o trattamento con 1% o 2% DMSO per 24 h. DMSO promuove un'inibizione transitoria della crescita dipendente dalla dose degli iPSC. (B) Immagini rappresentative del campo luminoso di hiPSC placcate su piastre a basso attaccamento per consentire la formazione di sfere 3D dopo non aver ricevuto alcun trattamento (controllo) o trattamento con 1% o 2% DMSO per 24 h. Il trattamento DMSO comporta una formazione di sfere 3D meno variabile rispetto al controllo. Barra di scala - 500 m. Fare clic qui per visualizzare una versione più grande di questa figura.
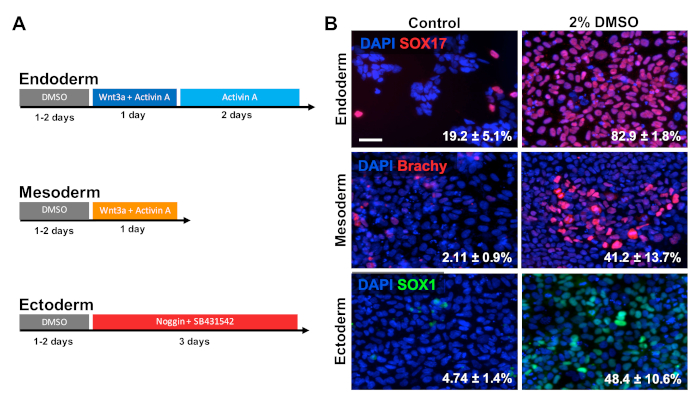
Figura 2 : il trattamento DMSO migliora la differenziazione degli hPSC agli strati germinali primari. (A) Schematica dei protocolli di differenziazione utilizzati per generare i tre strati germinali primari. (B) Immagini rappresentative di HUES6 hESC differenziati immunoetichettati per SOX17 (endoderm), brachyurury (mesoderm) e SOX1 (ectoderm). Il pretrattamento del 2% di DMSO per 24 h ha aumentato l'efficienza di differenziazione in tutti e tre gli strati germinali. Le percentuali di cellule che si differenziano nelle cellule endodermiche SOX17, Brachyury (Brachy) - mesodermiche, o SOX1 ectodermiche a seguito di differenziazione diretta in ogni strato di controllo germico e HESC trattati con DMSO sono notati con SEM di tre repliche biologiche . Test t non accoppiato: endoderm p - 0.0003; mesoderma p - 0.047; ectoderm p - 0,015. Barra di scala : 50 m. Fare clic qui per visualizzare una versione più grande di questa figura.
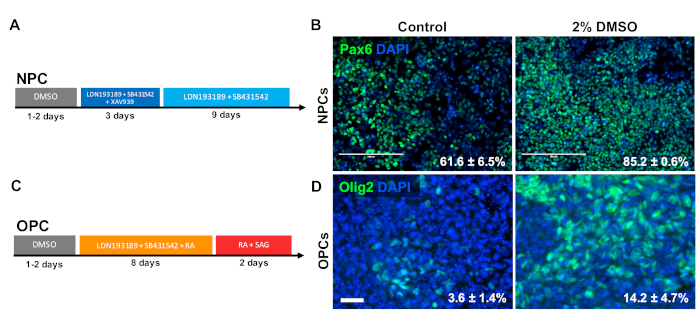
Figura 3 : il trattamento DMSO migliora la differenziazione ai tipi di cellule progenitrici neurali. (A) Schematica del protocollo di differenziazione utilizzato per generare cellule progenitrici neurali (NPC). (B) Immagini rappresentative di iPSC umani differenziate in PNG immunoetichettate per Pax6. 24 h di pretrattamento con 2% DMSO aumentato il numero di cellule positive PAX6. Le percentuali di cellule che si differenziano nei PNG Pax6, a seguito della differenziazione diretta del controllo e degli iPSC umani trattati con DMSO, sono notate con SEM di tre repliche biologiche. Test t non accoppiato: p - 0,0225. Barra di scala - Schemadi differenziazione di 200 m. (C) Schema di sistema di differenziazione utilizzato per generare cellule progenitrici di oligodendrociti (OPC). (D) Immagini rappresentative di iPSC umani differenziate in OPC immunoetichettate per i marcatori OPC Olig2. 24 h di pretrattamento con 2% DMSO aumentato l'espressione di entrambi i marcatori OPC rispetto al controllo. Le percentuali di cellule che si differenziano negli OPC Olig2 a seguito della differenziazione diretta del controllo e degli iPSC umani trattati con DMSO sono notate con SEM di quattro repliche biologiche. Test t non accoppiato: p - 0,0466. Barra di scala : 50 m. Fare clic qui per visualizzare una versione più grande di questa figura.
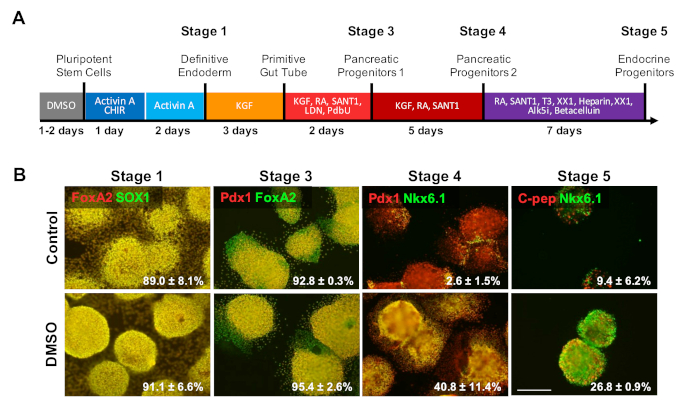
Figura 4 : il trattamento DMSO aumenta il potenziale di differenziazione dei terminali degli hPSC. (A) Schematico di una differenziazione diretta di 20 giorni di HESC in cellule endocrine pancreatiche differenziate terminalmente. (B) Immunostaining per i marcatori indicati in ogni fase di differenziazione in seguito alla differenziazione diretta di cellule di controllo non trattate e cellule pretrattate con 2% DMSO per 24 h. Il trattamento DMSO iniziale persiste per aumentare la differenziazione in tipi di cellule endocrine terminali nelle ultime fasi della differenziazione diretta. Percentuali di cellule che si differenziano nei marcatori indicati in ogni fase della differenziazione in seguito alla differenziazione diretta del controllo e hESC trattati con DMSO sono noti con SEM di due o quattro repliche biologiche. Barra di scala 200 m. Fare clic qui per visualizzare una versione più grande di questa figura.
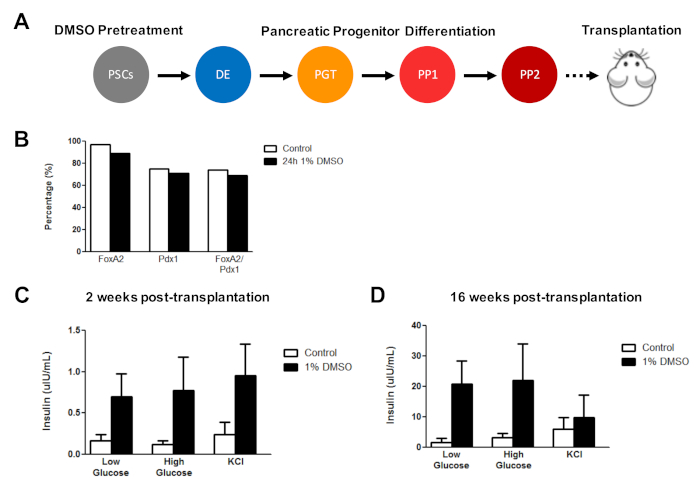
Figura 5 : Il trattamento DMSO iniziale degli hPSC migliora la reattività del glucosio dopo il trapianto di cellule progenitrici pancreatiche invivo. (A) Schematico della differenziazione diretta (15 giorni) degli HUES8 hESC nelle cellule progenitrici pancreatiche (PP2)a seguito di nessun trattamento (controllo) o di 24 h 1% di trattamento DMSO e successivo trapianto (5 milioni di cellule) in immunodeficient Topi SCID-Beige. (B) Percentuale di cellule che si differenziano nelle cellule del progenitore pancreatico PDX1 e FOXA2, in seguito a differenziazione in vitro del controllo e di HESC trattati con DMSO immediatamente prima del trapianto (n . 1). (C) Misurazioni mediche ELISA di insulina umana dal siero di topi a seguito di una sfida di glucosio bassa (2,5 mM) o alta (15 mM) o stimolazione al cloruro di potassio (KCl) a (C) 2 settimane e (D) 16 settimane dopo il trapianto di pancreatica cellule progenitrici differenziate dal controllo e HESC trattati con DMSO (barre di errore : SEM; n - 3 a 2 settimane e 16 settimane per il controllo; n - 2 a 2 settimane e 16 settimane per DMSO). ANOVA bidirezionale: p - 0,0051 per il controllo rispetto a DMSO a 2 settimane; p - 0,0116 per il controllo rispetto a DMSO a 16 settimane. I topi studiati nei diversi punti temporali sono diversi. I risultati sono adattati da Chetty et al. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
In sintesi, questo protocollo descrive uno strumento semplice e poco costoso per migliorare la capacità di differenziazione delle cellule staminali pluripotenti (PSC) a tutti gli strati germinali primari, vari tipi di cellule progenitrici specializzate e persino tipi di cellule mature funzionali in vitro e in vivo. Illustrati sono protocolli di differenziazione specifici che sono stati riprodotti efficacemente nel nostro laboratorio e altri, ma qualsiasi protocollo di differenziazione scelto dopo il trattamento DMSO. Come mostrato nella Tabella 1, alcuni laboratori hanno anche dimostrato un miglioramento della differenziazione del PSC dopo il trattamento DMSO transitorio utilizzando diversi paradigmi per generare vari altri tipi di cellule terminali. Inoltre, anche se i metodi qui descritti l'uso di PSC umani, il pretrattamento DMSO può essere utilizzato in tutte le specie e ha dimostrato di essere efficace nei PSC di topo, coniglio e primati.
Anche se dosi più elevate di DMSO sono noti per essere citotossico, le basse dosi utilizzate in questo metodo (1%-2%) per un periodo transitorio si traducono in una morte minima delle cellule. Mentre il numero complessivo di cellule immediatamente dopo il trattamento DMSO può diminuire a causa della promozione DMSO dell'arresto del ciclo cellulare nella fase G1 del ciclo cellulare, studi precedenti dimostrano che le cellule sono in grado di raggiungere lo stesso livello di confluenza delle colture di controllo dopo la rimozione DMSO3.
La percentuale e la durata del pretrattamento DMSO devono essere ottimizzate per ogni linea cellulare. Il tempo di trattamento deve essere regolato tenendo conto del tempo di ciclismo/raddoppio delle cellule. Ad esempio, i PSC del mouse hanno in genere tempi di ciclo molto più brevi di circa 15 h; pertanto, il trattamento DMSO per 15 h per queste cellule è sufficiente. Alcuni laboratori hanno anche ritenuto che il trattamento DMSO sia vantaggioso se continuato durante il protocollo di differenziazione o a concentrazioni più basse (cfr. tabella 1). Va notato che alcune linee PSC sono più modificabili alla differenziazione a specifici lignaggi. Ad esempio, le cellule HUES6 hanno dimostrato di essere meno permissive alla differenziazione e quindi hanno avuto un netto miglioramento con il trattamento DMSO (Figura 2). In alternativa, è stato dimostrato che le celle HUES8 utilizzate nella Figura 4 e nella Figura 5 hanno una maggiore propensione verso la differenziazione endodermica; pertanto, sono state mostrate meno differenze tra controllo e DMSO per la differenziazione nelle fasi iniziali verso l'endodermo definitivo. Tuttavia, il miglioramento del pretrattamento DMSO è osservato nelle fasi successive di differenziazione in questa linea cellulare (Figura 4B). Il trattamento DMSO è anche versatile in quanto è efficace sia nei sistemi di colture cellulari 2D che 3D, può essere utilizzato con vari tipi di materiale di rivestimento su piastre di coltura cellulare e funziona in diversi tipi di mezzi di manutenzione che promuovono la crescita e l'espansione di hPSC (ad es. mTeSR, E8, supporti condizionati MEF, ecc.).
Più in generale, questi risultati suggeriscono che lo stato iniziale delle cellule staminali pluripotenti ha una forte influenza sulla propensione alla differenziazione iniziale e la differenziazione terminale nei tipi di cellule funzionali. Abbiamo dimostrato in precedenza che il trattamento DMSO funziona attraverso Rb in hPSCs3,5. Rb svolge un ruolo importante nel promuovere la differenziazione terminale, la sopravvivenza cellulare, e la stabilità genetica delle cellule41,42,43,44, e può quindi spiegare gli effetti persistenti sulle cellule differenziati dagli hPSC trattati con DMSO. Il targeting di queste prime modalità di regolazione può collocare gli hPSC su una traiettoria migliore per la differenziazione e, in ultima analisi, migliorare la loro utilità per la medicina rigenerativa.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni della Stanford University School of Medicine e di una Siebel Fellowship assegnata a S. C.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Gibco | 21985023 | |
| 6-well Clear Flat Bottom TC-treated Multiwell Cell Culture Plate | Corning | 353046 | |
| 9-Position stir plate | Chemglass | CLS-4100 | |
| Accutase | Gibco | 11105-01 | |
| Activin A | R&D Systems | 338-AC | |
| Advanced RPMI | Gibco | 12633012 | |
| Alk5i II | Axxora | ALX-270-445 | |
| All-trans retinoic acid | Sigma-Aldrich | R2625 | |
| anti-Brachyury | R&D Systems | AF2085 | No variablity observed across different lot numbers |
| anti-C-peptide | Developmental Studies Hybridoma Bank | GN-ID4 | No variablity observed across different lot numbers |
| anti-FoxA2 | Millipore | 07-633 | No variablity observed across different lot numbers |
| anti-Nkx2.2 | University of Iowa, Developmental Hybridoma Bank | 74.5A5 | No variablity observed across different lot numbers |
| anti-Nkx6.1 | University of Iowa, Developmental Hybridoma Bank; | F55A12-supernatant | No variablity observed across different lot numbers |
| anti-Olig2 | EMD Millipore | MABN50 | No variablity observed across different lot numbers |
| anti-Pax-6 | Biolegend | 901301 | No variablity observed across different lot numbers |
| anti-Pdx1 | R&D Systems | AF2419 | No variablity observed across different lot numbers |
| anti-SOX1 | R&D Systems | AF3369 | No variablity observed across different lot numbers |
| anti-SOX17 | R&D Systems | AF1924 | No variablity observed across different lot numbers |
| B-27 Supplement, minus Vitamin A | Gibco | 12587010 | |
| Basic fibroblast growth factor | Gibco | PHG0264 | |
| Betacellulin | Thermo Fisher Scientific | 50932345 | |
| Chir99021 | Stemgent | 04-000-10 | |
| CMRL 1066 | Corning | 99-603-CV | |
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | AMQAF1000 | |
| D-(+)-Glucose | Sigma | G7528 | |
| DAPI | Invitrogen | D1306 | |
| Disposable Spinner Flasks | Corning, VWR | 89089-814 | |
| DMEM/F-12 | Gibco | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Essential 6 Media | Gibco | A1516501 | |
| FAF-BSA | Proliant | 68700 | |
| FGF7 | PeproTech | 100-19 | |
| Geltrex | Gibco | A1413202 | |
| GlutaMAX | Gibco | 35050061 | |
| Heparin | Sigma | H3149 | |
| Human Ultrasensitive Insulin ELISA | ALPCO Diagnostics | 80-INSHUU-E01.1 | |
| ITS-X | Invitrogen | 51500056 | |
| KGF | Peprotech | AF-100-19 | |
| Knockout DMEM | Gibco | 10829018 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| L-3,3′,5-Triiodothyronine (T3) | EMD Millipore | 642245 | |
| LDN193189 | Stemgent | 04-0074 | |
| Matrigel Matrix | Corning | 354277 | |
| MCDB-131 | Cellgro | 15-100-CV | |
| MEM NEAA | Gibco | 11140050 | |
| mTeSR 1 | StemCell Technologies | 5850 | |
| N2 Supplement | Life Technologies | 17502048 | |
| NaHCO3 | Sigma | S3817 | |
| Noggin Fc Chimera Protein | R&D Systems | 3344-NG-050 | |
| PdBU | EMD Millipore | 524390 | |
| Penicillin/Streptomycin | Mediatech | 30-002-CI | |
| RPMI | Gibco | 11875-093 | |
| Sant1 | Sigma-Aldrich | S4572 | |
| SB431542 | Stemgent | 04-0010 | |
| Smoothened Agonist, SAG | EMD Millipore | 566660 | |
| StemPro Accutase | Gibco | A1110501 | |
| TrypLE | Gibco | 12604013 | |
| Ultra-Low Attachment Microplates | Corning | 3471 | |
| Vitamin C | Sigma-Aldrich | A4544 | |
| Wnt3a | R&D Systems | 5036-WN | |
| XAV 939 | Tocris | 3748 | |
| XXI | EMD Millipore | 565790 | |
| Y-27632 | StemCell Technologies | 72302 |
Riferimenti
- Osafune, K., et al. Marked differences in differentiation propensity among human embryonic stem cell lines. Nature Biotechnology. 26 (3), 313-315 (2008).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Review Genetics. 15 (2), 82-92 (2014).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Conklin, J. F., Sage, J. Keeping an eye on retinoblastoma control of human embryonic stem cells. Journal of Cellular Biochemistry. 108 (5), 1023-1030 (2009).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110(2018).
- Hartwell, L. H., Weinert, T. A. Checkpoints: controls that ensure the order of cell cycle events. Science. 246 (4930), 629-634 (1989).
- Pardee, A. B. G1 events and regulation of cell proliferation. Science. 246 (4930), 603-608 (1989).
- Orford, K. W., Scadden, D. T. Deconstructing stem cell self-renewal: genetic insights into cell-cycle regulation. Nature Review Genetics. 9 (2), 115-128 (2008).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453 (7194), 519-523 (2008).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells. 26 (4), 894-902 (2008).
- Duan, Y., et al. Differentiation and characterization of metabolically functioning hepatocytes from human embryonic stem cells. Stem Cells. 28 (4), 674-686 (2010).
- Szkolnicka, D., Farnworth, S. L., Lucendo-Villarin, B., Hay, D. C. Deriving functional hepatocytes from pluripotent stem cells. Current Protocols in Stem Cell Biology. 30, 1-12 (2014).
- Vanhove, J., et al. H3K27me3 Does Not Orchestrate the Expression of Lineage-Specific Markers in hESC-Derived Hepatocytes In Vitro. Stem Cell Reports. 7 (2), 192-206 (2016).
- Kanebratt, K. P., Andersson, T. B. Evaluation of HepaRG cells as an in vitro model for human drug metabolism studies. Drug Metabolism & Disposition. 36 (7), 1444-1452 (2008).
- Nikolaou, N., Green, C. J., Gunn, P. J., Hodson, L., Tomlinson, J. W. Optimizing human hepatocyte models for metabolic phenotype and function: effects of treatment with dimethyl sulfoxide (DMSO). Physiological Reports. 4 (21), (2016).
- Kondo, Y., et al. An efficient method for differentiation of human induced pluripotent stem cells into hepatocyte-like cells retaining drug metabolizing activity. Drug Metabolism Pharmacokinetics. 29 (3), 237-243 (2014).
- Alizadeh, E., et al. The effect of dimethyl sulfoxide on hepatic differentiation of mesenchymal stem cells. Artificial Cells, Nanomedicine, and Biotechnology. 44 (1), 157-164 (2016).
- Czysz, K., Minger, S., Thomas, N. DMSO efficiently down regulates pluripotency genes in human embryonic stem cells during definitive endoderm derivation and increases the proficiency of hepatic differentiation. PLoS One. 10 (2), 0117689(2015).
- Ogaki, S., Morooka, M., Otera, K., Kume, S. A cost-effective system for differentiation of intestinal epithelium from human induced pluripotent stem cells. Scientific Reports. 5, 17297(2015).
- Choi, S. C., et al. Mixl1 and Flk1 Are Key Players of Wnt/TGF-beta Signaling During DMSO-Induced Mesodermal Specification in P19 cells. Journal of Cellular Physiology. 230 (8), 1807-1821 (2015).
- Chetty, S., et al. A Src inhibitor regulates the cell cycle of human pluripotent stem cells and improves directed differentiation. Journal of Cell Biology. 210 (7), 1257-1268 (2015).
- Qiu, Z., et al. Marmoset induced pluripotent stem cells: Robust neural differentiation following pretreatment with dimethyl sulfoxide. Stem Cell Research. 15 (1), 141-150 (2015).
- Swartz, E. W., et al. A Novel Protocol for Directed Differentiation of C9orf72-Associated Human Induced Pluripotent Stem Cells Into Contractile Skeletal Myotubes. Stem Cells Translational Medicine. 5 (11), 1461-1472 (2016).
- Teimourian, S., Moghanloo, E. Thwarting PTEN Expression by siRNA Augments HL-60 Cell Differentiation to Neutrophil-Like Cells by DMSO and ATRA. DNA Cell Biology. 35 (10), 591-598 (2016).
- van den Berg, C. W., Elliott, D. A., Braam, S. R., Mummery, C. L., Davis, R. P. Differentiation of Human Pluripotent Stem Cells to Cardiomyocytes Under Defined Conditions. Methods in Molecular Biology. 1353, 163-180 (2016).
- Deng, F., et al. Combination of retinoic acid, dimethyl sulfoxide and 5-azacytidine promotes cardiac differentiation of human fetal liver-derived mesenchymal stem cells. Cell Tissue Bank. 17 (1), 147-159 (2016).
- Yoon, S. J., et al. Reliability of human cortical organoid generation. Nature Methods. 16 (1), 75-78 (2018).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637(2018).
- Kroon, E., et al. Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo. Nature Biotechnology. 26 (4), 443-452 (2008).
- Zhang, P., et al. Short-term BMP-4 treatment initiates mesoderm induction in human embryonic stem cells. Blood. 111 (4), 1933-1941 (2008).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Tchieu, J., et al. A Modular Platform for Differentiation of Human PSCs into All Major Ectodermal Lineages. Cell Stem Cell. 21 (3), 399-410 (2017).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Fiore, M., Degrassi, F. Dimethyl sulfoxide restores contact inhibition-induced growth arrest and inhibits cell density-dependent apoptosis in hamster cells. Experimental Cell Research. 251 (1), 102-110 (1999).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Bock, C., et al. Reference Maps of human ES and iPS cell variation enable high-throughput characterization of pluripotent cell lines. Cell. 144 (3), 439-452 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), 1848-1857 (2012).
- D'Amour, K. A., et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nature Biotechnology. 24 (11), 1392-1401 (2006).
- Jacks, T., et al. Effects of an Rb mutation in the mouse. Nature. 359 (6393), 295-300 (1992).
- Nguyen, D. X., Baglia, L. A., Huang, S. M., Baker, C. M., McCance, D. J. Acetylation regulates the differentiation-specific functions of the retinoblastoma protein. The EMBO Journal. 23 (7), 1609-1618 (2004).
- Slack, R. S., et al. Cells differentiating into neuroectoderm undergo apoptosis in the absence of functional retinoblastoma family proteins. Journal of Cell Biology. 129 (3), 779-788 (1995).
- Gu, W., et al. Interaction of myogenic factors and the retinoblastoma protein mediates muscle cell commitment and differentiation. Cell. 72 (3), 309-324 (1993).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon