Method Article
荧光钙成像及其后续原位杂交,用于异种性前体特征
摘要
我们提出了一个两部分的协议,将荧光钙成像与原位杂交相结合,使实验者能够将钙活性模式与单细胞水平上的基因表达谱相关联。
摘要
自发的细胞内钙活性可以观察到各种细胞类型,并被认为在各种生理过程中起着关键作用。特别是,在胚胎生成过程中适当调节钙活动模式对于脊椎动物神经发育的许多方面是必要的,包括适当的神经管闭合、突触发生和神经递质表型规范。虽然钙活性模式在频率和振幅上可能有所不同的观察表明,这些通量可能通过这种机制将编码信号传输到下游效应器并调节基因表达,但现有人口一级的方法缺乏进一步探讨这种可能性所需的精确性。此外,这些方法限制了对细胞-细胞相互作用作用的研究,排除了在没有细胞-细胞接触的情况下测定神经元确定状态的能力。因此,我们建立了一个实验工作流程,将分离的神经元外植的延时钙成像与荧光原位杂交测定,允许钙活性模式与分子的明确关联单细胞水平上的表型。我们成功地利用这种方法分别区分和描述与区分神经细胞和神经祖细胞相关的特定钙活动模式;然而,除此之外,本文中描述的实验框架可以很容易地加以调整,以研究任何时间序列活动概况与感兴趣的基因或基因表达之间的相关性。
引言
自由细胞钙对各种生物过程至关重要,从细胞增殖和迁移到凋亡和自噬1,2,3。在这些途径中,钙通过与钙结合域相互作用,诱导调节蛋白质活性和相互作用的构象变化,从而对基因表达产生下游效应。例如,一个神经元钙传感器称为下游调节元素拮抗剂调制器(DREAM)被钙结合时,被保持在展开的中间构象中,防止它与蛋白质和DNA靶点4相互作用。然而,除了作为一个简单的信号分子,细胞内钙瞬变的动态特性允许这些活动模式编码更复杂的振幅或基于频率的信号5,6。激活T细胞(NFAT)转录因子核因子的核移位通过高频钙振荡得到增强,但受到低频振荡7的抑制。引人注目的是,最近的研究表明,NFAT实际上可能对累积的钙暴露8作出反应。降钙素和Ca2+/卡莫多林依赖性蛋白激酶II(CaMKII)也表现出对特定频率、持续时间或振幅9的钙瞬变的不同反应。为了增加一个监管复杂性,计算模型表明,许多下游的钙结合蛋白由于存在或没有结合的竞争对手10,11而或多或少地变得频率依赖性。
在发育中的神经系统中,钙活动行为的两大类被定义并与特定的生物过程相关。如果钙流入发生在单个细胞内,在五秒内达到基线的±400%的峰值强度,并表现出双指数衰减12,则被归类为"尖峰"。这种类型的信号主要与神经递质表型规范13相关。相反,"波"被定义为更慢、更不极端的钙瞬变,其中细胞内钙浓度在30秒或更长时间内上升到基线的±200%,然后在几分钟内衰变12。这些信号经常传播在多个相邻的细胞,它们的存在与神经素生长和细胞增殖14,15相关。然而,虽然这两个类是基于特征动力学轮廓定义的,但仍然不清楚这些模式的哪些特征实际上被细胞检测到并由下游效应器转换。
了解细胞内钙振荡和基因表达之间的关系,将使人们对确保神经系统适当发育和模式化的调节机制之一有重要的洞察力。为此,对胚胎脊髓的研究表明,发育过程中钙尖活性增加与抑制神经元水平较高有关,而钙尖活动减少与兴奋神经元的较高水平相关。然而,这些群体水平的测定尚未用于将钙活性与单细胞水平上的基因表达联系起来。
在单个单元级别上处理这些问题,与以前的工作相比,具有几个明显的优势。其一,评估许多细胞中的钙活性和基因表达的能力允许观察各种不同活动模式的完整情况,而无需被批量测量混淆。此外,在单细胞初级培养中研究这些关系意味着钙活性和基因表达之间的细胞自主联系将保持不变,而需要细胞-细胞通信的相互作用将被废除。因此,这种方法允许单独研究这些细胞自主机制。然而,它也允许非细胞自主钙活性的作用被阐明和询问。例如,细胞可以在神经板阶段从胚胎中解剖,培养直到兄弟姐妹控制达到神经管阶段,然后与从神经管阶段胚胎中新解剖的细胞进行比较。这允许将关键发育期间保留细胞-细胞通信的细胞与消除细胞-细胞通信的细胞与细胞-细胞通信直接进行比较。
为了解决先前实验方法的局限性,我们开发了一种方案,能够评估单个神经祖细胞中的钙活性和基因表达,促进特定活动模式与后续分化程序的相关性。神经组织在神经发育的不同阶段从Xenopus laevis被解剖,分离成单个细胞,并在荧光钙指示器存在的情况下通过共聚焦显微镜进行成像。在活细胞成像后,通过荧光原位杂交(FISH)对样品进行固定和检测,以检测感兴趣的基因或异构体表达。重要的是,单个细胞可以在两个成像实验中被跟踪,这意味着细胞的钙活性特征和基因表达水平可以相互关联(图1)。这里报道的协议旨在探讨钙活性模式和基因表达之间的关系,在胚胎神经发育的Xenopus laevis。然而,更广泛的实验框架(单细胞时间过程成像,然后是FISH和图像共登记)可以修改并应用于几乎任何细胞类型、荧光报告器和感兴趣的基因。
研究方案
所有涉及动物的工作都按照威廉和玛丽学院机构动物护理和使用委员会(IACUC)批准的协议进行。
1. 动物护理和胚胎处理
- 通过给人类胆囊性腺激素(HCG)进行皮下注射,以600U的剂量为雌性,400U为雄性,诱导自然交配。
- 注射后,将至少一只雄性青蛙和一只雌性青蛙放在室温罐中过夜。产卵通常在 HCG 管理后 9-12 小时开始。
- 收集胚胎。用2%半胱氨酸(pH 8.0)轻轻洗涤2-4分钟。
- 在 0.1x Mark 的改性振铃器溶液 (MMR) 中冲洗胚胎 3 倍(100 mM NaCl,2 mM KCl,1 mM MgSO4, 2 mM CaCl2, 5 mM HEPES, pH 调整为 7.4×7.6)。
- 将胚胎转移到含有0.1x MMR和50 μg/mL的金霉素的100毫米玻璃培养皿中。每个板50-100个胚胎的密度是适当的。
- 在14°C~22°C孵育菜肴,让胚胎发育,直到达到所需的发育阶段。用塑料转移移液器定期去除未受精的细胞和坏死或异常发育的胚胎。
注:为确保一致性,根据Nieuwkoop和Faber16定义的形态学标准进行发育分期。感兴趣的阶段会因实验焦点而异。例如,关键的神经发育地标与阶段 14(神经发育开始)、第 18 阶段(神经管闭合开始)和第 22 阶段(尾芽伸长开始)相关。
2. 胚胎解剖和样品制备
- 解决方案准备
- 准备 2 mM Ca2+溶液,包含 116 mM NaCl、0.67 mM KCl、2 mM CaCl2+2H 2O、1.31 mM MgSO4和 4.6 mM Tris。对于每100 mL溶液,加入1 mL的青霉素/链霉素(10,000 U/mL青霉素;10,000 μg/mL链霉素)。将 pH 调整到 7.8 并进行过滤消毒。
- 通过组合 116 mM NaCl、0.67 mM KCl、4.6 mM Tris 和 0.4 mM EDTA 来制备无钙和镁 (CMF) 溶液。将pHH调节至7.8和高压灭菌器进行灭菌。对于每100 mL溶液,加入1 mL的青霉素/链霉素(10,000 U/mL青霉素;10,000 μg/mL链霉素)。将 pH 调整到 7.8 并进行过滤消毒。
- 用于解剖和成像的板的制备
- 紫外线消毒两个35毫米塑料培养皿和一个35毫米细胞培养皿(见材料表)。
- 在层流罩中工作时,准备两个 50 mL 塑料锥形管,每个管材包含 10 mL 的 2 mM Ca2+溶液。
- 留在层流罩中工作,在一个 35 mm 塑料培养皿中加入 2 mM Ca2+溶液,将 2 mL 的 2 mM Ca2+溶液添加到一个 35 mm 细胞培养盘中,将 2 mL 的 CMF 溶液添加到一个 35 mm 塑料培养皿中。
- 在层流罩外,用 0.1x MMR 填充两个 100 mm 塑料培养皿和一个 35 mm 塑料培养皿,并加装温霉素 (50 μg/mL)。用70%乙醇填充60毫米塑料培养皿。
- 在解剖前,将0.01克胶原酶B加入含有Ca2+溶液的50 mL管之一。混合良好,并将溶液转移到新鲜的 60 mm 塑料培养皿中。
- 在解剖显微镜的帮助下,识别所需发育阶段的胚胎。使用无菌转移移液器将至少6个合适的胚胎转移到步骤2.2.4中制备的含有0.1x MMR+根霉素的100毫米板之一。这将作为保持板。
- 使用无菌转移移液器将一个胚胎移植到含有 0.1x MMR + 根霉素的第二个 100 mm 板。这将作为解剖板。
- 如果解剖足够老的胚胎移动(大约阶段 23 或以上),在解剖前将每个胚胎转移到含有 0.1% 3-氨基酸乙酯的培养皿中,用文他霉素 (50 μg/mL) 稀释 0.1x MMR。一旦胚胎被固定,将其移植回含有0.1x MMR的培养皿,并结合文他霉素(50微克/mL),继续解剖。
- 小心地去除胚胎周围的膜膜。这最容易通过使用一对钝钳稳定胚胎,同时使用一对细钳抓住膜。小心地用细钳拉,将玻璃膜剥开。
- 使用细钳分离胚胎的背和腹区域。这可以通过使用钳子沿着前后轴"捏"胚胎,将其切成两半来实现。使用无菌转移移液器,使用步骤 2.2.5 中制备的胶原酶溶液将背部分转移到 60 mm 板。丢弃腹腔部分。
- 允许背外植物在室温下在胶原酶溶液中孵育1⁄2分钟。轻轻地将其移回解剖板。
- 通过仔细去除外皮的假定神经组织中的所有残留内皮和中皮污染来完成解剖。对于阶段 22 或更岁以上的胚胎,神经管也应被移除和丢弃。
注:如有必要,在解剖过程中,步骤2.2.4中制备的70%乙醇的碟子可用于清除或重新消毒钳子。 - 解剖完成后,轻轻地将外植转移到步骤 2.2.3 中准备的 35 mm Ca2+溶液板。
- 重复步骤 2.4-2.9,直到收集了四个外苗。
- 使用 P1000 微移液器将所有四个外植转移到含有 CMF 溶液的 35 mm 板中,注意避免外部与空气-水界面之间的任何接触。轻轻旋转盘子,使所有的外植聚集在盘子的中心。
- 在室温下孵育1小时,使外植分离。
注: 为了帮助解脱,0.025%~0.01%胰蛋白酶可以添加到CMF溶液中。这可能是有效分离较旧胚胎(阶段22岁及以上)所必需的。 - 此时,至少两个适当分级的胚胎应留在保持板上。将这些胚胎转移到一个新鲜菜中,里面装满了0.1x MMR,其中含有步骤2.2.4中制备的文他霉素,并使它们能够不受干扰地与覆盖的菜一起与外栽菜相配。这些胚胎将作为兄弟姐妹的对照。
- 使用超胶将微规则盖玻片(参见材料表)连接到步骤 2.2.3 中准备的 35 mm 细胞培养皿的底部。
注:在盖玻片边缘周围放置一小块超级胶水,然后用力按压细胞培养皿的底面。位置标记将在胶水接触网格的任何位置被遮盖,因此保持盖玻片的中央网格部分没有粘合剂非常重要。 - 外植1小时后,使用P100微液管将其转移到细胞培养皿。为了在盘子的网格部分上盘出尽可能多的电池,将移液器放在靠近盘子表面的浅角,将移液器尖端置于网格的角落,朝内,并牢固地将细胞悬架排出网格状的面板。理想情况下,细胞会稳定在一个密密化的簇中。
- 在室温下孵育1小时,使细胞粘附在板上。当这种孵育开始时,确定并记录兄弟姐妹控制胚胎的发育阶段。
- 将 5 μL 1 mM Fluo-4 AM(参见材料表)与 2 μL 的 10% 普鲁尼克 F-127 酸混合。
注:Fluo-4 AM 对光敏感,应始终保存在防光管或铝箔覆盖管中。 - 孵育完成后,将样品盘移到暗室或其他受光线保护的位置。使用微移液器从盘边缘去除 100 μL 溶液。将此溶液添加到 Fluo-4 AM/Pluronic F-127 酸的等分中,上下移液以混合,并将全部体积返回到样品盘。轻轻旋转以混合。
- 用铝箔盖住板,在室温下孵育1小时。当这种孵育开始时,确定并记录兄弟姐妹控制胚胎的发育阶段。
- 在孵育结束时,使用剩余的锥形管 2 mM Ca2+以下列方式执行三次介质洗洗:1) 从培养皿中取出 1 mL 溶液,添加 3 mL 的新鲜溶液,2) 从培养皿中取出 3 mL 溶液,添加 3 mL 的新鲜溶液,3) 从培养皿中取出 3 mL 溶液,添加 3 mL 的新鲜溶液。
3. 钙成像
注:钙成像是使用倒置共聚焦显微镜(材料表)进行的。
- 将样品板放在显微镜台上,注意保护样品板免受环境光照射。固定板后,使用标记标记板的前点,以便在后续成像中找到相同的视野。
- 在显微镜下找到样品(先是 10 倍,然后是 20 倍放大率)并选择适当的视场进行成像。理想的视野是细胞密集,但密度不是如此密集,以至于细胞被凝结或难以单独区分。
- 调整显微镜对焦,使网格规则的封面滑动可见。封面上标记的数字用作特定网格轨迹的唯一标识符,可用于定位相同的视场以进行其他成像。如果最初选定的视场不与任何数字重叠,请重新调整,直到在帧中出现可识别的数字。
- 拍摄所选视场的明亮场图像,并聚焦网格规则的封面。
- 调整对焦设置,并在对焦单元格的情况下拍摄所选视场的明亮场图像。
- 在细胞层聚焦时,使用 488 nm 激光照亮样品。可以针对每个实验优化 HV 和偏移值,以确保在 FITC 通道上检测到荧光的动态范围。
- 对于两小时的映像,请修改映像配置以记录 901 帧,扫描时间为 3.93 秒,间隔为 8 秒。运行配置以获取映像。
- 成像完成后,从显微镜阶段取出板。从板中取出 1 mL 溶液,并将其替换为 1 mL 的 2x MEMFA(200 mM MOPS、2 mM EGTA 和 2 mM MgSO 4,7.4% 甲醛)。
- 在室温下孵育板2小时,或在4°C下孵育。当这种孵育开始时,确定并记录兄弟姐妹控制胚胎的发育阶段。
- 固定完成后,从板中取出所有溶液,并将其替换为 2 mL 的 1x PBS。将板储存在 4°C 下,以便进一步加工。
4. 基因表达分析:探针合成
- 如下所述,生成用于原位杂交的反义RNA探针。此外,为同一基因生成检测探针,用作阴性对照。
- 为了纯化含有探针模板序列的质粒DNA,用含有模板质粒的细菌甘油储存150 mL的LB汤。在37°C孵育,在一夜之间或直到文化浑浊。
- 使用您选择的方法从细菌培养中纯化质粒DNA。
注:我们使用麦克纳里-纳格尔中皮制备试剂盒获得高产量的质粒DNA。 - 为了确认质粒包含预期的插入物,执行限制消化并分析胶质胶上的产品。未切割的质粒也可以在胶原体凝胶上进行分析,以检查基因组DNA污染。
- 要使模板DNA线性化,建立一个100μL限制反应,其中包含20μg质粒DNA、2μL适当限制性酶和1x适当缓冲液。在37°C孵育至少2小时。
- 通过执行苯酚/氯仿提取,然后提取氯仿提取,提取线性DNA。
- 用100%乙醇沉淀DNA。这可以通过在样品中加入两卷冷乙醇并在-80°C下孵育,直到其凝固(15-30分钟)快速完成。
- 使用冷冻离心机在12,000 x g/4 °C下旋转20分钟,以颗粒DNA。
- 去除上清液,用200 μL的70%乙醇清洗颗粒。在 12,000 x g/4 °C 下旋转 5 分钟。
- 去除上清液和风干颗粒约5分钟,在20 μL的1x TE中重新悬浮,并储存在4°C,直到进一步使用。
- 要合成和纯化反义RNA探针,请结合15 μL的10 mM rCTP、15 μL的10 mM rGTP、15 μL的10 mM rATP、9.75 μL的10 mM rUTP和5.25 μL的10mm dig-11 UTP(参见材料表)。
- 从步骤 4.2-4.10 设置包含 4 μg 线性模板 DNA 的 50 μL 体外转录反应, 步骤 4.11 的 15 μL rNTP 混合物,5x 转录缓冲液的 10 μL,0.1 M DTT 的 5 μL,0.5 μL 的RNA酶抑制剂 (20 U/μL),以及 1.5 μL 的相应 RNA 聚合酶(T3、T7 或 SP6)。在37°C下孵育1小时。
- 在反应中加入额外的1.5μLRNA聚合酶,并返回到37°C,再延长一小时。
- 在反应中加入1μL的RQ1脱氧核糖核酸酶,并在37°C孵育10分钟,降解DNA模板。
- 在样品中加入30 μL的7.5 M LiCl溶液。移液器在-20°C下混合和孵育至少1小时。
- 使用冷冻离心机,在14,000 x g/4°C下旋转样品25分钟。
- 去除上清液,用 500 μL 的 70% 乙醇冲洗颗粒。在 14,000 x g/4 °C 下旋转 5 分钟。
- 去除上清液和风干颗粒约5分钟,在20μL无核酸酶水中重新悬浮。
- 在 10 倍的探针液中,将样品稀释到混合化缓冲液中浓度为 10 纳克/μL(50% 形式酰胺), 5x SSC(盐碱-柠子钠;750 mM NaCl,75 mM柠酸钠,pH 7.0),1mg/mL托鲁拉RNA,0.1%补间-20,1x登哈特溶液,0.1%CHAPS,10mM EDTA和100 μg/mL肝素)。储存在-20°C,直到进一步使用。
5. 基因表达分析:原位荧光杂交
注:所有冲液均应使用无菌、单独包装的转移移液器使用约 1 mL 溶液进行。拆卸或添加溶液时,移液器应放置在板的边缘,并应尽可能轻柔地进行清理,以确保细胞不会从板表面脱落和丢失。
- 从板中取出 1x PBS(从步骤 3.10 开始)。用新鲜的1x PBS更换,在室温下孵育5分钟。
- 将 25 mL 的 0.1 M 三乙醇胺 (pH 8.0) 与 62.5 μL 的醋酸氢化物结合。混合好。用此溶液清洗盘子 10 分钟。
- 用 1x SSC 清洗板 5 分钟。
- 用 0.02 M HCl 清洗板 10 分钟以渗透细胞。
- 用1x PBS洗2次,每次5分钟。
- 取出溶液并添加1 mL的混合缓冲液(50% 形式酰胺, 5x SSC (750 mM NaCl, 75 mM 柠子酸钠, pH 7.0), 1 mg/mL 托鲁拉 RNA, 0.1% 补间-20, 1x 登哈特溶液, 0.1% CHAPS, 10 mM EDTA, 和 100 μg/mL 肝素) 到板.在60°C下孵育至少6小时。
- 去除杂交缓冲液,用750 μL的1xRNA探针溶液(稀释形成步骤4.19中生产的10倍库存)。感RNA探针可用作负控制。
- 在60°C下孵育8-14小时。
- 拆下探头并储存在 -20°C。
注:1x 探头稀释可在丢弃前重复使用最多三次。 - 用 0.2x SSC 冲洗盘子。
- 在 60°C 下用新鲜的 0.2x SSC 清洗 1 小时。
- 将板移到室温中,并平衡 5 分钟。
- 用 0.2x SSC 清洗板 5 分钟。
- 用 1x PBT 清洗盘子 15 分钟。
- 用 2% H2O2在 1x PBT (0.1% Triton-x-100) 清洗板 1 小时。
注:此解决方案对光敏感,因此每个实验都应新鲜,并不受光线遮挡。板块也应在孵化过程中遮挡光或被挫败。 - 用 1x TBST(150 mM NaCl、50 mM Tris-HCl、pH 7.5、0.1%补间-20)清洗板 15 分钟。
- 稀释阻滞试剂至2%的雄性酸缓冲液(100 mM雄酸,150 mM NaCl,pH 7.5)。在室温下,将这种混合物中的细胞块住至少1小时。
- 用在马累酸缓冲液中稀释1:1,000在2%阻断试剂中的抗二氧基-POD抗体取代阻断溶液。在4°C下孵育过夜。
- 用 1x TBST 冲洗板 3 倍。
- 用 2mL 的 1x TBST 洗涤 4 倍,每次洗涤至少 15 分钟,并连续摇动。
- 用 1x PBT 洗涤 2 次,每次至少 10 分钟,并连续摇动。
- 稀释 Cy3 结合的 tyramide 1:25 在 1x PBT 中。用 750 μL 稀释 5 分钟清洗板。
注:此溶液对光非常敏感,在实验的剩余时间内,应保持板材的箔片或挡光,以避免信号变坏。 - 在此溶液中加入 2.5 μL 的 H2O2,并在室温下通过连续摇动孵育 40 分钟。
- 用 1x TBST 洗涤 4 次,每次至少 15 分钟,持续摇动。
- 用 1x PBT 冲洗。
- 在室温下以1x MEMFA(100mM MOPS、1 mM EGTA和1mM MgSO4在3.7%甲醛)中孵育1小时,修复细胞。
- 取出溶液,用 1x PBS 替换。将板材储存在4°C的箔容器中,直到进一步加工。
6. 成像细胞
注:成像是使用倒置共聚焦显微镜进行的。
- 将样品板放在显微镜台上,将步骤 3.1 中制作的标记与舞台前部对齐。
- 对图像进行聚焦,使网格衬里的覆盖唇可见,并使用步骤 3.4 中拍摄的网格图像作为参考,调整视野以匹配钙图像中捕获的视场(第 3 节)。
- 获取网格和单元格的亮场图像。
- 使用 595 nm TRITC 激光照亮样品。调整增益值,使用图像和负控制单元正确区分信号和背景,并获取静止图像。
注:理想情况下,背景荧光水平基于与非定向感RNA探针并行处理的负控制板确定。增益设置进行调整,使该板显示为完全黑色(对应于背景水平),然后保持恒定的其他板从该实验批次成像。
7. 数据处理
注:数据处理是使用尼康元素软件执行的。
- 从步骤 3.7 打开 2 h 钙图像。通过选择二进制>污点检测>亮点来识别对应于每个单个单元格的像素。确保已选择 FITC 通道。
- 生成此图层后,彩色圆圈将显示在单个单元格上。调整单元格分布和大小参数,以便识别尽可能多的单元格并与唯一标识符相关联。
- 通过导航到"查看>分析控件>跟踪选项"来跟踪图像所有帧的单元格。将 5 帧设置为轨道之间的最大间隙,删除与小于 600 帧关联的对象,然后选择"缩小间隙"选项。选择"跟踪二进制文件"以将单元格跟踪应用于图像。
- 跟踪单元格后,手动删除与单个单元格不对应的任何对象(例如,单元格群)。然而,数据点不应排除在基于钙活性轨迹的形态的进一步分析之外。
- 在"图像"窗格中,选择"查看叠加>显示二进制对象 ID"。滚动到图像的末尾(帧 901),然后选择"编辑>创建视图快照(8 位 RGB)">当前帧>确定。这将创建图像的最后一帧的快照,每个单元格的关联二进制 ID 都可见。保存此映像。
- 通过选择所有对象,然后导出数据导出到 Excel来导出时间序列数据。将输出另存为 CSV 文件。
- 打开 FISH 图像。使用 TRITC 通道而不是 FITC 通道,优化现场检测,如步骤 7.1_7.2 中一样。手动删除任何分配错误的二进制文件,然后选择自动测量结果>更新测量以计算每个像元的信号强度。通过重复步骤 7.5 和 7.6 导出映像快照和数据表。
- 创建一个电子表格,其中列 A 标记为FISH 二进制 ID,列 B 标记为钙二进制 ID。打开步骤 7.5 和 7.7 中导出的图像。对于 FISH 图像(步骤 7.7)中标识的每个对象,在列 A 中记录二进制 ID。然后,在钙图像(步骤 7.5)中找到相应的单元格,并在 B 列中记录该二进制 ID。
注: 使用照片编辑程序(如 Adobe Photoshop 或 GIMP 图像编辑器)打开两个图像,使一个半透明图像,并将其叠加到其伙伴图像上,以便更轻松地识别和链接与每个单元格关联的两个二进制 ID,这非常有用。 - 对于每个已识别的细胞,整理(手动或使用脚本)其时间序列钙数据(与钙二进制 ID 关联并在步骤 7.6 中导出)及其基因表达数据(与 FISH 二进制 ID 关联,并在步骤 7.7 中导出)。
注:下游数据处理和分析可能涉及将这些数据整理到单个数据表中,并应用一系列分析技术,包括尖峰计数、分形分析和马尔可万熵,使调查人员能够辨别钙活性17、18的新模式。
结果
图2A中可以看到为钙成像制备的分离细胞的成功例子。细胞是密集镀层的,允许从每个图像中收集最大数量的信息,但不要太密集地镀层,以至于单个细胞无法自信地相互区分。在 2 h 成像周期内,每个已定义的细胞检测到荧光。包含实验中记录的所有细胞的轨迹的复合图的可视化揭示了批量或总体测量可以掩盖更细微的尖峰行为模式的程度(图2B)。当分离出单个细胞的记录轮廓时,可以清楚地识别神经祖细胞不规则的尖峰活动特征的例子。与成熟的神经元不同,胚胎神经元细胞表现出钙活性的不规则、高度可变和复杂的性质(图2B)。为了量化这种复杂性,应用了不同的数据分析方法,包括定义尖峰的各种参数(图2C)。
通过将实验板与具有非结合感RNA对照的的背景对照进行比较,可以评估成功的原位荧光杂交,包括反义mRNA探针的成功设计和合成(图3A,B)。通过处理已知以可检测水平表达目标mRNA的细胞类型,也可以执行阳性探针控制。
在钙和FISH成像中识别同一细胞,要求在探针杂交和处理过程中,细胞保持大致相同的位置。如果板材处理不当或处理太有力,细胞可能会从板表面脱落,当溶液被丢弃或沉积在板上的不同位置时,细胞可能会丢失,因此无法跨图像进行匹配(图4A)。如果此中断仅影响视场中的某些单元,则仍可能检测和分配图像中的一些单元(图 4B)。但是,从仔细执行 FISH 且图像之间丢失或重新定位的单元的实验中获得了最大数据量(图 4C)。
一旦收集数据来描述感兴趣发育阶段合理数量的细胞的钙活性和基因表达,可以进行进一步分析,以评估这两个特征之间的相关性(图1)。许多指标已被应用来量化钙活动模式,包括尖峰计数/频率,平均功率,赫斯特指数估计,和马尔科维安熵测量17,18。基因表达可以由绝对荧光水平定量定义,也可以根据二进制(是/否)尺度进行分级,具体取决于要解决的实验问题。
实验结果整理钙活性与神经祖细胞标记基因的表达,揭示了钙活性的特定模式和神经递质表型之间的许多关联。在神经板阶段(阶段14),GABAergic细胞表达抑制神经元标记gad1.1表现出钙活性,比缺乏gad1.1表达的细胞更规律和更高的振幅(图5A)。此外,虽然这些Gad1.1-表达细胞与较高水平的高振幅尖刺有关,但低振幅尖刺在表达兴奋神经元标记slc17a7的谷胱甘肽细胞中更为常见。
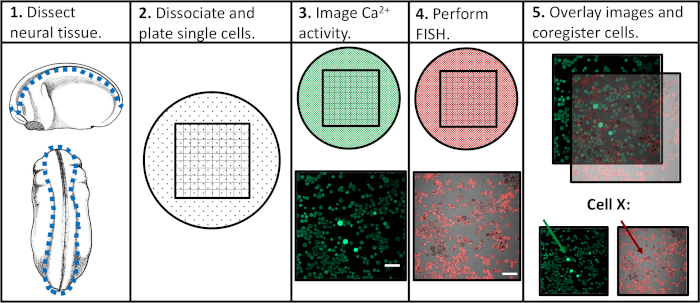
图1:实验工作流程原理图。刻度条 = 100 μm。面板3-5的图像是从Paudel等人(2019年)17。请点击此处查看此图的较大版本。
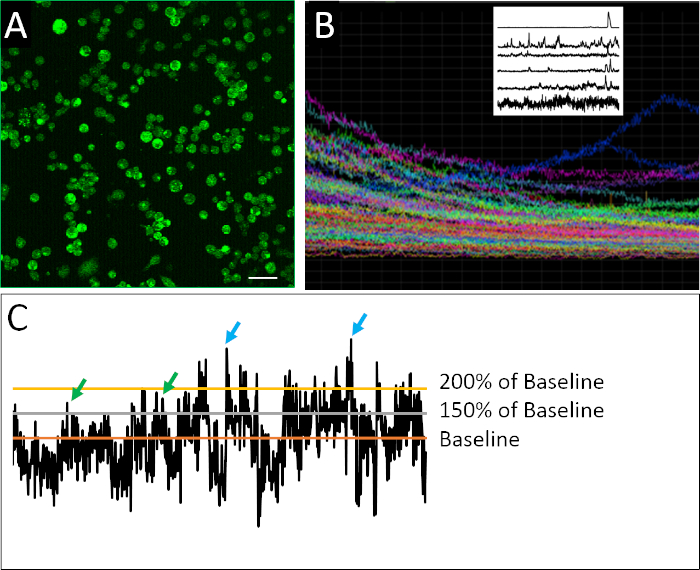
图2:钙成像和示例活动概况。(A) Fluo4-AM 报告的细胞内钙活性.每 2 小时图像由 901 帧组成,此处显示一个代表性帧。(B) 图像视场内所有细胞随时间随时间而合成荧光强度的复合图。痕迹清楚地表明指示染料 (Fluo4) 超时的光漂白。左上角的栅格图显示了在应用由Eilers和Boelen19开发的去趋势算法后钙活性的代表性痕迹,其中所示的细胞表现出不同的喷头行为模式。(C) 应用不同的阈值(基线的 150% 和 200%,基线是去趋势荧光强度的平均值)来定义尖峰(绿色和蓝色箭头)。刻度条 = 100 μm。请点击此处查看此图的较大版本。
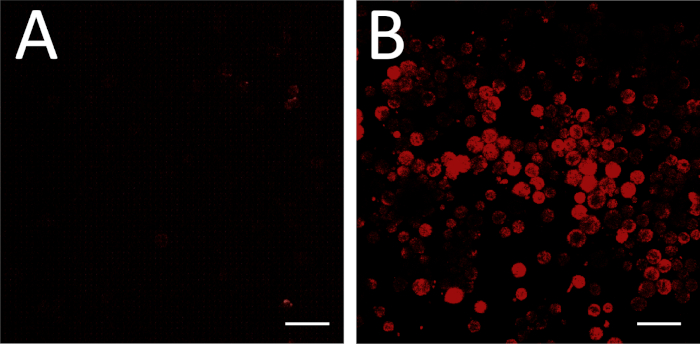
图3:FISH成像。(A) FISH 使用非结合感RNA探针作为阴性对照进行。成像设置已调整,以便没有单元格出现荧光。某些视场可能包括具有某些荧光的非细胞碎屑,例如(A) 的右上角和右下角所示;对于背景设置,可以忽略这些。(B) 相同的成像设置然后用于成像实验板(反义RNA探针)。这些条件下的荧光对应于上述背景的基因表达。刻度条 = 100 μm。请点击此处查看此图的较大版本。

图 4:图像叠加和共注册。为钙活性(由填充的绿色圆圈表示的细胞)和FISH(由带底的红色圆圈表示的细胞)的样本的图形表示。(A) 在样品处理和处理过程中移动显著的细胞不能可靠地识别两个图像。(B) 细胞中断可能只影响视野中的一些细胞。有些细胞可以在两个图像中清楚地识别,而其他细胞则无法自信地匹配。(C) 如果仔细处理样本,大多数细胞将保持不受干扰,并可在两个图像中识别。请点击此处查看此图的较大版本。
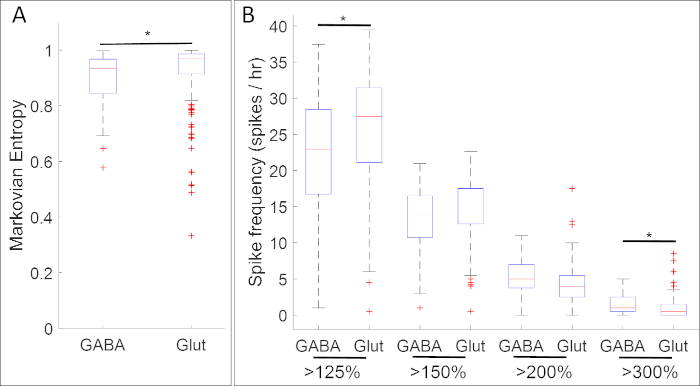
图5:该方法应用的一个示例,显示神经板阶段Xenopus laevis中钙活性与基因表达(GAD1.1和slc17a7基因分别为GADA和Gglut)之间的关联。在阶段 14, gad1.1 后向细胞 (GABA) 表现出更高的振幅和更规律的钙活性 , 由 (A) 马尔可奥安熵18和 (B) 尖峰计数使用阈值 125, 150, 200% 和 300% 的平均值的去趋势荧光强度 (基线)17比slc17a7阳性细胞 (Glut).根据 Bonferroni 校正的双样本 Kolmogorov_Smirnov 测试 (p < 0.05) 和 Cohen 的 d 统计效果大小(n = 5 个培养体和 >100 个单元格;= 0.2 = {d} < 0.5),星星表示具有统计显著性的差异。这个数字是重新绘制和改编从Paudel等人17的数据集。请点击此处查看此图的较大版本。
讨论
在构成发育中的神经系统的细胞中观察到钙活性的特征模式,与不同的神经发育过程相关的特定活动类型。然而,进一步了解这些信息密集的活动模式转化为转录反应的机制,需要用单细胞分辨率收集有关钙活性和基因表达的信息。虽然表现出更定型钙活性的系统,如成熟的神经元,可以在批量水平上合理测定,但胚胎神经系统的不规则模式很容易被不太精确的记录掩盖。
该协议中建立的实验框架很容易适应各种细胞类型和荧光报告器。含有几乎任何细胞类型或细胞类型组合的组织可以从感兴趣的模型有机体中解剖,并镀为单细胞成像。除了允许细胞识别和隔离细胞自主过程的影响外,主要细胞培养方法还允许实验者根据需要定义介质组件。例如,对2 mM Ca2+溶液中神经元前体活性进行对比的实验,以研究在不受细胞-细胞相互作用13、20的影响的情况下,胚胎脊髓中的尖峰频率和神经递质表型之间的关系是否可以重述。
虽然该协议利用荧光标记Fluo4-AM检测细胞内钙活性,但根据选择标准,用户可以选择其他市售标记21,包括基因编码的钙指标。同样,替代标记可用于监测目标电团浓度的动态变化(包括K+、Na+和Zn2+)、膜电位或细胞pH。可以根据需要修改成像设置和图像持续时间。
尽管我们将钙活性和神经元表型作为特定应用,但该方法也适用于各种其他细胞特性。例如,荧光原位杂交可以通过针对任何感兴趣的基因的探针进行,包括神经元标记ChAT或转录因子Engrailed,从而能够敏感地检测mRNA物种的可定制面板。这些探头可以设计为等形特异性,如果需要,支持额外的目标特异性。双FISH可以使用与几个不同荧光道结合的探针进行,从而可以同时评估多个基因的表达。然而,这种类型的实验所需的额外处理与细胞损失或运动的机会增加有关,并且需要经验和美味才能成功执行。
无论对该协议进行任何特定于实验的修改,都有几个关键步骤需要仔细注意。解剖应小心清除所有污染组织或细胞群;因为当外植分离时空间模式丢失,任何来自邻近组织的剩余细胞将穿插在感兴趣的细胞中,并且无法区分。细胞镀后,样品应尽可能轻柔地处理,以防止细胞脱落。最重要的是,这意味着所有溶液的更换都应缓慢而仔细地执行,在拆卸和添加溶液时,将移液器放在板的边缘。这将确保细胞可以在钙和FISH图像中自信地识别。如果细胞在处理过程中中断,则可能无法识别两个图像之间的部分或全部相应单元格。我们建议在这些分配时谨慎行事,以便仅使用明确对应的单元格进行进一步分析。
根据正在处理的生物问题,各种分析方法可能是适当的。时间序列钙活性可以通过多种方式进行处理和量化,实验者灵活选择去趋势参数、分析指标和分析参数(例如,用于定义钙尖峰的基线阈值百分比)。钙活性和基因表达水平之间的相关性可以通过分析基因表达作为从FISH图像中提取的绝对或相对荧光值来绘制。或者,可以通过为阳性基因表达信号定义荧光阈值并为单个细胞分配"是"或"否"标识符来绘制钙活性和基因表达(存在/不存在)之间的相关性。总体而言,该实验模式为收集和初步分析时间序列数据以及细胞匹配基因表达数据提供了极其灵活的管道。这些实验对于更好地理解细胞动力学和转录变化之间的复杂关系至关重要,例如识别胚胎Xenopus laevis中抑制性脂肪和兴奋性-排泄性神经元前体的钙活性模式特征。
披露声明
未声明任何利益冲突。
致谢
我们感谢温迪·赫布斯特和林赛·施莱弗为制定这些议定书所作的贡献。这项工作得到了国家卫生研究院(1R15NS067566-01、1R15HD077624-01和1R15HD096415-01)对MSS的资助。
材料
| Name | Company | Catalog Number | Comments |
| For Animal Husbandry & Cell Culture | |||
| CHORULON (chorionic gonodotropin) | Merck Animal Health | ||
| Gentamycin sulfate salt | Millipore Sigma | G1264 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Pyrex petri dishes, 100 mm x 20 mm | Millipore Sigma | CLS3160102 | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 35mm | Fisher Scientific | 08-772A | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 60mm | Fisher Scientific | 08-772F | |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | |
| Thermo Scientifc Nunc Cell Culture / Petri Dishes, 35x10mm Dish, Nunclon Delta | Fisher Scientific | 12-565-90 | |
| Fisherbrand Standard Disposable Transfer Pipettes, Nongraduated; Length: 5.875 in.; Capacity: 7.7 mL | Fisher Scientific | 13-711-7M | |
| Ethyl 3-aminobenzoate methanesulfonate | Millipore Sigma | E10521 | |
| Collagenase B | Millipore Sigma | 11088807001 | |
| Dumont #55 Forceps, Dumostar | Fine Science Tools | 11295-51 | |
| Dumont #5 Forceps, Dumostar | Fine Science Tools | 11295-00 | |
| Cellattice Micro-Ruled Cell Culture Surface | Nexcelom Bioscience | CLS5-25D-050 | |
| For Calcium Imaging | |||
| Fluo-4, AM, cell permeant | Thermo Fisher Scientific | F14201 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | Thermo Fisher Scientific | P6866 | |
| For RNA Probe Generation | |||
| PureYield Plasmid Miniprep System | Promega | A1222 | |
| rATP | Promega | P1132 | |
| rCTP | Promega | P1142 | |
| rGTP | Promega | P1152 | |
| rUTP | Promega | P1162 | |
| Digoxigenin-11-UTP | Millipore Sigma | 3359247910 | |
| Rnase Inhibitor | Thermo Fisher Scientific | N8080119 | |
| T3 RNA Polymerase | Promega | P2083 | |
| T7 RNA Polymerase | Promega | P2075 | |
| SP6 RNA Polymerase | Promega | P1085 | |
| RQ1 Rnase-Free Dnase | Promega | M6101 | |
| LiCl Precipitation Solution (7.5 M) | Thermo Fisher Scientific | AM9480 | |
| For Fluorescence In Situ Hybridization | |||
| Acetic Anhydride | Thermo Fisher Scientific | 320102 | |
| Blocking Reagent | Millipore Sigma | 11096176001 | |
| Anti-Digoxigenin-POD, Fab fragments | Millipore Sigma | 11207733910 | |
| Cy3 Mono-Reactive NHS Ester | Millipore Sigma | GEPA13105 | |
| Solution Components | |||
| Calcium chloride, 96% extra pure, powder, anhydrous, ACROS Organixs | Fisher Scientific | AC349610 | |
| Calcium chloride dihydrate | Millipore Sigma | C3306 | |
| CHAPS hydrate | Millipore Sigma | C3023 | |
| Denhardt's Solution (50X) | Thermo Fisher Scientific | 750018 | |
| DTT, Molecular Grade (DL-Dithiothreitol) | Promega | P1171 | |
| Ethylenediaminetetraacetic Acid, Disodium Salt Dihydrate | Fisher Scientific | S311 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid | Millipore Sigma | E3889 | |
| Formamide (Deionized) | Thermo Fisher Scientific | AM9342 | |
| Herparin sodium salt from porcine intestinal mucosa | Millipore Sigma | H3393 | |
| HEPES (Ultra Pure) | Thermo Fisher Scientific | 11344041 | |
| Hydrogen peroxide solution | Millipore Sigma | H1109 | |
| L-Cysteine | Millipore Sigma | 168149 | |
| Magnesium chloride, pure, ACROS Organics | Fisher Scientific | AC223211000 | |
| Magnesium sulfate, 97% pure, ACROS Organixs, anhydrous | Fisher Scientific | AC413480050 | |
| Maleic Acid, 99%, ACROS Organics | Fisher Scientific | ACS125231000 | |
| MOPS (Fine White Crystals/Molecular Biology), Fisher BioReagents | Fisher Scientific | BP308 | |
| Potassium chloride | Millipore Sigma | P9541 | |
| Ribonucleic acid from torula yeast, Type IX | Millipore Sigma | R3629 | |
| Sodium chloride | Millipore Sigma | S7653 | |
| Triethanolamine | Millipore Sigma | 90279 | |
| Tris | Millipore Sigma | GE17-1321-01 | |
| TWEEN 20 | Millipore Sigma | P9416 | |
| Equipment | |||
| Laminar Flow Hood | model of choice | ||
| Dissecting Microscope | model of choice | ||
| Inverted Fluorescence Microscope | Nikon | TE200 | |
| NIS-Elements Imaging Software | Nikon | ||
| Shaking Incubator | model of choice | ||
| Refrigerated Centrifuge | model of choice | ||
| Miscellaneous | |||
| Corning bottle-top vaccum filter system, 0.22 μm pore, 500 mL bottle capacity | Millipore Sigma | CLS430769 | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 |
参考文献
- Humeau, J., et al. Calcium signaling and cell cycle: Progression or death. Cell Calcium. 70, 3-15 (2017).
- Kim, J. M., Lee, M., Kim, N., Heo, W. D. Optogenetic toolkit reveals the role of Ca2+ sparklets in coordinated cell migration. PNAS. 112 (21), 5951-5957 (2016).
- Orrenius, S., Zhivotovsky, B., Nicotera, P. Regulation of cell death: the calcium-apoptosis link. Nature Reviews Molecular Cell Biology. 4 (7), 552-565 (2003).
- Pham, K., et al. Ca2+ and Mg2+ module conformational dynamics and stability of downstream regulatory element antagonist modulator. Protein Science. 24 (5), 741-751 (2015).
- Smedler, E., Uhlén, P. Frequency decoding of calcium oscillations. Biochimica et Biophysica Acta. 1840 (3), 964-969 (2014).
- Moreau, M., Néant, I., Webb, S. E., Miller, A. L., Riou, J. F., Leclerc, C. Ca(2+) coding and decoding strategies for the specification of neural and renal precursor cells during development. Cell Calcium. 59 (2-3), 75-83 (2016).
- Tomida, T., Hirose, K., Takizawa, A., Shibasaki, F., Iino, M. NFAT functions as a working memory of Ca2+ signals in decoding Ca2+ oscillation. EMBO. 22 (15), 3825-3832 (2003).
- Hannanta-Anan, P., Chow, B. Y. Optogenetic Control of Calcium Oscillation Waveform Defines NFAT as an Integrator of Calcium Load. Cell Systems. 2 (4), 283-288 (2016).
- Li, L., Stefan, M. I. Le Novère N. Calcium input frequency, duration and amplitude differentially module the relative activation of calcineurin and CaMKII. PLoS One. 7 (9), 43810 (2012).
- Romano, D. R., Pharris, M. C., Patel, N. M., Kinzer-Ursem, T. L. Competitive tuning: Competition's role in setting the frequency-dependence of Ca2+-dependent proteins. PLoS Computational Biology. 13 (11), 1005820 (2017).
- Pharris, M. C., Patel, N. M., Kinzer-Ursen, T. L. Competitive Tuning Among Ca2+/Calmodulin-Dependent Proteins: Analysis of in silico Model Robustness and Parameter Variability. Cellular and Molecular Bioengineering. 11 (5), 353-365 (2018).
- Gu, X., Olson, E. C., Spitzer, N. C. Spontaneous neuronal calcium spikes during early differentiation. Journal of Neuroscience. 14 (11), 6325-6335 (1994).
- Borodinsky, L. N., Root, C. M., Cronin, J. A., Sann, S. B., Gu, X., Spitzer, N. C. Activity-dependent homeostatic specification of transmitter expression in embryonic neurons. Nature. 429 (6991), 523-530 (2004).
- Ciccolini, F., Collins, T. J., Sudhoelter, J., Lipp, P., Berridge, M. J., Bootman, M. D. Local and Global Spontaneous Calcium Events Regulate Neurite Outgrowth and Onset of GABAergic Phenotype during Neural Precursor Differentiation. Journal of Neuroscience. 23 (1), 103-111 (2003).
- Weissman, T. A., Riquelme, P. A., Ivic, L., Flint, A. C., Kriegstein, A. R. Calcium Waves Propagate through Radial Glial Cells and Modulate Proliferation in the Developing Neocortex. Neuron. 43 (5), 647-661 (2004).
- Nieuewkoop, P. D., Faber, J. . The stages of Xenopus embryonic development. Normal Table of Xenopus laevis. , (1994).
- Paudel, S., et al. Calcium Activity Dynamics Correlate with Neuronal Phenotype at a Single Cell Level and in a Threshold-Dependent Manner. International Journal of Molecular Science. 20 (8), 1880 (2019).
- Marken, J. P., et al. A Markovian Entropy Measure for the Analysis of Calcium Activity Time Series. PLoS One. 11 (12), 0168342 (2016).
- Eilers, P. H. C., Boelens, H. F. M. Baseline Correction with Asymmetric Least Squares Smoothing. Leiden University Medical Centre Report. , (2005).
- Guemez-Gamboa, A., et al. Non-cell-autonomous mechanism of activity-dependent neurotransmitter switching. Neuron. 82 (5), 1004-1016 (2014).
- Paredes, R., Madelaine, , et al. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。