Method Article
제노푸스 라에비스의 신경 전구체 특성화를 위한 형광 칼슘 이미징 및 후속 시토 혼성화
요약
우리는 형광 칼슘 화상 진찰을 계면 혼성화에서 결합하는 2개의 부분 프로토콜을 제시합니다, 실험자가 단하나 세포 수준에 유전자 발현 단면도와 칼슘 활동의 패턴을 상호 연관시키는 것을 허용하.
초록
자발적인 세포내 칼슘 활성은 다양한 세포 유형에서 관찰될 수 있으며 다양한 생리학적 과정에서 중요한 역할을 하는 것으로 제안된다. 특히, 배아 발생 시 칼슘 활성 패턴의 적절한 조절은 적절한 신경관 폐쇄, 시냅토제네시스 및 신경전달물질 표현형 사양을 포함한 척추동물 신경 발달의 많은 양상에 필요하다. 칼슘 활동 패턴이 주파수와 진폭 모두에서 다를 수 있다는 관측은 이러한 플럭스가 인코딩된 신호를 다운스트림 이펙터에 전달하고 유전자 발현을 조절할 수 있는 강력한 메커니즘을 시사합니다. 인구 수준 접근 방식은 이러한 가능성을 더 탐구하는 데 필요한 정밀도가 부족했습니다. 더욱이, 이러한 접근법은 세포-세포 접촉이 없는 상태에서 신경 측정 상태를 분석하는 능력을 배제함으로써 세포-세포 상호작용의 역할에 대한 연구를 제한한다. 따라서, 우리는 계종 혼성화 분석실험에서 형광과 해리된 신경 이종의 시간 경과 칼슘 이미징을 결합하는 실험 워크플로우를 수립하여 칼슘 활성 패턴과 분자간의 명확한 상관관계를 허용했습니다. 단일 세포 수준에서 표현형. 우리는 성공적으로 신경 세포와 신경 전구 세포를 분화와 관련된 특정 칼슘 활동 패턴을 구별하고 특성화하기 위해이 방법을 사용할 수 있었다, 각각; 그러나, 이 문서에서 기술된 실험 프레임워크는 임의의 시계열 활성 프로필과 관심 있는 유전자 또는 유전자의 발현 사이의 상관관계를 조사하기 위해 쉽게 적응될 수 있다.
서문
자유 세포질 칼슘은 세포 증식 및 이동에서 세포 사멸 및 자가 포식1,2,3에이르기까지 다양한 생물학적 과정에 매우 중요합니다. 이 통로 내의, 칼슘은 단백질 활동 및 상호 작용을 조절하는 구조물 변경을 유도하기 위하여 칼슘 결합 도메인과 상호 작용해서 유전자 발현에 다운스트림 효력을 발휘할 수 있습니다. 예를 들어, 하류 조절 요소 길항제 변조기 (DREAM)로 알려진 신경 칼슘 센서는 칼슘에 의해 결합 될 때 전개 된 중간 형태에서 개최되어 단백질 및 DNA 표적과 상호 작용하는 것을방지합니다 4. 그러나 단순한 신호 분자로서의 역할을 넘어, 세포내 칼슘 과도의 동적 성질은 이러한 활성 패턴을 보다 복잡한 진폭 또는 주파수 기반 신호5,6을인코딩할 수 있게 한다. 활성화된 T 세포(NFAT)의 전사 인자 핵 인자의 핵 전좌는 고주파 칼슘 진동에 의해 강화되지만 저주파 진동에 의해억제된다 7. 설득력있게, 최근 연구는 NFAT가 실제로 누적 칼슘노출에반응 할 수 있음을 제안했다 8 . 칼시뉴린과Ca2+/칼모둘린 의존성 단백질 키나아제 II(CaMKII)는 또한 특정 주파수, 지속 시간 또는 진폭9의칼슘 과도에 대한 뚜렷한 반응을 나타낸다. 규제 복잡성의 추가 수준을 추가하기 위해, 전산 모델은 많은 다운스트림 칼슘 결합 단백질이 결합 경쟁자의 존재 또는 부재에 반응하여 더 많거나 적은 주파수 의존체가 될 것을 제안한다10,11.
개발 신 경계 내에서, 칼슘 활동 행동의 두 가지 주요 클래스 정의 하 고 특정 생물 학적 과정과 관련 된. 칼슘 유입은 개별 세포 내에서 발생하는 경우 "스파이크"로 분류되며, 5초 이내에 기준선의 400%의 피크 강도에 도달하고, 이중 지수 붕괴12를나타낸다. 신호의 이 모형은 신경 전달물질 표현형명세서 13와13와 주로 연관됩니다. 대조적으로, "파도"는 세포의 세포 내 칼슘 농도가 30 초 이상 동안 기준선의 ~ 200 %로 상승한 다음 몇 분동안 12에걸쳐 부패하는 더 느리고 덜 극단적 인 칼슘 과도성으로 정의됩니다. 이러한 신호는 종종 여러 인접 세포에 걸쳐 전파되며, 그들의 존재는 신경외 세포 증식14,15와연관되어 있다. 그러나, 이 2개의 종류는 특징적인 운동 단면도에 근거를 둔 정의되었더라도, 이 패턴의 어떤 특성이 실제로 세포에 의해 검출되고 다운스트림 이펙터에 의해 번역되고 있는지 정확하게 불분명하게 남아 있습니다.
세포내 칼슘 진동과 유전자 발현 사이의 관계를 이해하면 신경계의 적절한 발달과 패터닝을 보장하는 규제 메커니즘 중 하나에 대한 중요한 통찰력을 제공할 수 있습니다. 이를 위해, 배아 척수의 연구는 개발 중 칼슘 스파이크 활성이 증가하면 억제 뉴런의 상부와 연관되어 있음을 입증했으며, 반면 감소된 칼슘 스파이크 활동은 흥분성 뉴런의 상부와 연관되어13. 그러나, 이러한 인구 수준 분석은 단세포 수준에 유전자 발현과 칼슘 활동을 연관시키기 위하여 이용되지 않았습니다.
단일 셀의 수준에서 이러한 질문에 접근하는 것은 이전 작업에 비해 몇 가지 뚜렷한 장점을 제공합니다. 하나, 많은 세포에서 칼슘 활성 및 유전자 발현을 개별적으로 평가하는 능력은 벌크 레벨 측정에 의해 난독화되지 않고 독특한 활성 패턴의 전체 레퍼토리를 관찰 할 수 있습니다. 추가적으로, 단세포 1 차적인 문화에서 이 관계를 공부하는 것은 칼슘 활동과 유전자 발현 사이 세포 자율적인 링크가 유지된다는 것을 의미합니다, 세포 세포 통신을 요구하는 상호 작용은 중단될 것입니다 동안. 그러므로, 이 접근은 이 세포 자율적인 기계장치를 격리에서 공부하는 것을 허용합니다. 그러나, 그것은 또한 비 세포 자율 적인 칼슘 활동의 역할을 해명 하 고 심문 할 수 있습니다. 예를 들어, 세포는 신경 판 단계에서 배아로부터 해부될 수 있고, 형제 대조가 신경관 단계에 도달할 때까지 배양된 다음, 신경관 단계 배아로부터 갓 해부된 세포와 비교될 수 있다. 이것은 세포 세포 통신이 폐지된 것과 중요한 발달 기간에 걸쳐 세포 세포 통신을 유지하는 세포의 직접적인 비교를 허용합니다.
이전 실험 접근법의 한계를 해결하기 위해, 우리는 개별 신경 전구 세포에서 칼슘 활성과 유전자 발현을 모두 평가할 수 있는 프로토콜을 개발하여 후속 분화 프로그램과 특정 활성 패턴의 상관 관계를 촉진했습니다. 신경 조직은 신경 발달의 다양한 단계에서 제노푸스 laevis에서 해부되고, 단일 세포로 해리되고, 형광 칼슘 지표가있는 공초점 현미경을 통해 이미지화되었습니다. 살아있는 세포 화상 진찰에 따라, 견본은 관심있는 유전자 의 발현 또는 이소포름을 검출하기 위하여 사이투 혼성화 (FISH)에 있는 형광을 통해 고쳐지고 분석되었습니다. 중요한 것은, 개별적인 세포는 두 화상 진찰 실험을 통해 추적될 수 있습니다, 세포의 칼슘 활동 단면도 및 그것의 유전자 발현 수준이 서로 연관될 수 있다는 것을 의미합니다(그림 1). 여기에서 보고된 프로토콜은 제노푸스 laevis에있는 배아 신경 발달을 통해 칼슘 활동 패턴 그리고 유전자 발현 사이 관계를 탐구하기 위한 것입니다. 그러나, 더 넓은 실험 적인 틀 (물고기와 화상 공동 등록에 선행된 단세포 시간 과정 화상 진찰)는 거의 모든 세포 모형, 형광 리포터 및 관심있는 유전자에 수정되고 적용될 수 있습니다.
프로토콜
동물과 관련된 모든 작업은 윌리엄과 메리 대학의 기관 동물 관리 및 사용위원회 (IACUC)가 승인 한 프로토콜에 따라 수행되었습니다.
1. 동물 관리 및 배아 취급
- 인간 융모성 생식샘 자극호르몬(HCG)의 피하 주사를 성인 제노푸스 라에비스의 등쪽 림프낭에 투여하여 여성의 경우 600 U, 남성의 경우 400 U를 투여하여 자연스러운 짝짓기를 유도한다.
- 주입 후, 하룻밤 동안 실온 보유 탱크에 적어도 한 명의 수컷과 한 명의 암컷 개구리를 놓는다. 계란 누워 는 일반적으로 HCG 투여 후 9-12 h를 시작합니다.
- 배아를 수집합니다. 2% 시스테인(pH 8.0)으로 2-4분간 부드럽게 세척하여 데젤리를 드넬리.
- 배아를 0.1x 마크의 변형 링거 용액(MMR)(100 mM NaCl, 2 mM KCl, 1 mM MgSO4,2 mM CaCl2,5 mM HEPES, pH 7.4-7.6으로 조정)으로 헹구다.
- 배아를 0.1x MMR 및 50 μg/mL 젠타마이신을 함유한 100 mm 유리 페트리 접시로 옮긴다. 판당 50-100개의 배아의 밀도가 적절하다.
- 14 °C-22 °C에서 접시를 배양하고 배아가 원하는 발달 단계에 도달 할 때까지 발전 할 수 있도록하십시오. 주기적으로 플라스틱 전달 파이펫으로 비옥한 세포와 괴사 또는 비정상적으로 발달하는 배아를 제거합니다.
참고: 일관성을 보장하기 위해 Nieuwkoop 및 Faber16에의해 정의된 형태학적 기준에 따라 개발 스테이징이 수행됩니다. 관심 단계는 실험적 초점에 따라 달라집니다. 예를 들어, 주요 신경 발달 랜드 마크는 단계 와 관련 된 14 (신경 의 발병), 단계 18 (신경 관 폐쇄의 발병), 그리고 단계 22 (테일 버드 신장의 발병).
2. 배아 해부 및 샘플 준비
- 솔루션 준비
- 116 mM NaCl, 0.67 mM KCl, 2 mM CaCl2·2H2O,1.31 mM MgSO4,4.6 mM 트리스를 포함하는 2 mMCa2+ 용액을 준비합니다. 100 mL 용액마다 페니실린/스트렙토마이신 1mL(10,000 U/mL 페니실린; 10,000 μg/mL 스트렙토마이신)를 추가합니다. pH를 7.8로 조정하고 필터 멸균합니다.
- 116 mM NaCl, 0.67 mM KCl, 4.6 mM 트리스 및 0.4 mM EDTA를 결합하여 칼슘 및 마그네슘이없는 (CMF) 용액을 준비하십시오. pH를 7.8로 조정하고 오토클레이브를 사용하여 살균합니다. 100 mL 용액마다 페니실린/스트렙토마이신 1mL(10,000 U/mL 페니실린; 10,000 μg/mL 스트렙토마이신)를 추가합니다. pH를 7.8로 조정하고 필터 멸균합니다.
- 해부 및 이미징용 플레이트 준비
- UV 살균 2 35mm 플라스틱 페트리 접시와 1 개의 35mm 세포 배양 접시 (재료 표참조).
- 층류 후드에서 작업하는 동안 각각 2mM Ca 2+ 용액 10 mL을 포함하는 2 개의 50 mL 플라스틱 원유튜브를 준비하십시오.
- 층류 후드에서 계속 작업하고 35mm 플라스틱 페트리 접시 하나에 2 mL의 2 mL을 추가, 하나의 35mm 세포 배양 접시에 2 mMCa2+ 용액, 하나의 35mm 플라스틱 페트리 접시에 CMF 용액 2 mL.
- 층류 후드 의 외부, 젠타 마이신 (50 μg / mL)와 0.1x MMR와 두 개의 100mm 플라스틱 페트리 접시와 하나의 35mm 플라스틱 페트리 접시를 채웁니다. 70% 에탄올로 60mm 플라스틱 페트리 접시를 채웁니다.
- 해부 직전에, 0.01 g의 콜라게나아제 B를Ca2+ 용액을 함유한 50 mL 튜브 중 하나에 넣습니다. 잘 섞어서 용액을 신선한 60mm 플라스틱 페트리 접시에 옮김을 옮김.
- 해부 현미경의 도움으로 원하는 발달 단계의 배아를 식별하십시오. 멸균 전사 파이펫을 사용하여 2.2.4단계에서 제조된 0.1x MMR+ 젠타마이신을 함유하는 100 mm 플레이트 중 하나에 적어도 6개의 적절한 배아를 이송한다. 이것은 홀딩 플레이트역할을 할 것이다.
- 멸균 전사 파이펫을 사용하여 1개의 배아를 0.1x MMR + 젠타마이신을 함유하는 두 번째 100 mm 플레이트로 옮김을 옮김을 사용한다. 이것은 해부 판역할을 할 것이다.
- 배아를 충분히 해부하는 경우(약 23단계 이상), 0.1% 3-아미노벤조산 에틸 에스테르를 함유한 접시에 젠타마이신(50 μg/mL)으로 희석한 접시로 옮겨 해부하기 전에 각 배아를 마취시금한다. 배아가 움직이지 않게 되면, 젠타마이신(50 μg/mL)으로 0.1x MMR을 함유한 접시로 다시 옮기고 해부를 계속한다.
- 배아를 둘러싸는 비텔린 막을 조심스럽게 제거하십시오. 이것은 막을 잡기 위하여 정밀한 집게의 쌍을 사용하는 동안 태아를 안정시키기 위하여 무딘 집게의 쌍을 사용하여 가장 쉽게 할 수 있습니다. 미세한 집게로 조심스럽게 당겨 비텔린 멤브레인을 벗겨냅니다.
- 미세 한 집게를 사용 하 여 배아의 등지와 복부 영역을 분리 합니다. 이것은 전방 후방 축을 따라 배아를 '꼬집기'로 집게하여 반으로 절단함으로써 수행 할 수 있습니다. 멸균 전사 파이펫을 사용하여 등쪽 부분을 2.2.5단계에서 제조된 콜라게나제 용액으로 60mm 플레이트에 옮김을 전달합니다. 복부 부분을 폐기하십시오.
- 등쪽 이식이 실온에서 1-2 분 동안 콜라겐 액에 배양되도록하십시오. 부드럽게 해부 플레이트에 다시 전송합니다.
- 외배엽의 추정 신경 조직에서 모든 잔류 내피 및 중피 오염을 조심스럽게 제거하여 해부를 완료하십시오. 단계 22 이상에 배아를 위해, 신경관은 또한 제거하고 폐기되어야 합니다.
참고: 해부 중에 필요한 경우, 2.2.4단계에서 제조된 70% 에탄올의 접시를 집게를 치우거나 재살균하는데 사용할 수 있다. - 해부가 완료되면, 2.2.3 단계에서 제조된Ca2+ 용액의 35 mm 플레이트로 부드럽게 이식을 전달한다.
- 4개의 이식이 수집될 때까지 2.4-2.9단계를 반복합니다.
- P1000 마이크로파이펫을 사용하여 4개의 이식을 CMF 용액을 함유한 35mm 플레이트로 옮기고, 이식과 공기-물 인터페이스 사이의 접촉을 방지하십시오. 접시의 중앙에 모든 이식 클러스터되도록 부드럽게 접시를 소용돌이.
- 이식이 해리될 수 있도록 실온에서 1h를 배양합니다.
참고 : 해리를 돕기 위해 0.025 % - 0.01 % 트립신을 CMF 솔루션에 첨가 할 수 있습니다. 이것은 오래된 태아의 능률적인 해리를 위해 필요할 지도 모릅니다 (단계 22 이상). - 이 시점에서, 적어도 2 개의 적절 하 게 준비 된 배아 보유 플레이트에 남아 있어야 합니다. 이 배아를 2.2.4 단계에서 준비된 젠타마이신으로 0.1x MMR로 채워진 신선한 접시로 옮기고 이식 접시에 맞게 덮인 접시로 방해받지 않고 개발할 수 있도록 하십시오. 이 태아는 형제 통제로 봉사할 것입니다.
- 2.2.3단계에서 제조된 35mm 셀 배양 접시의 바닥에 마이크로 룰커버슬립(재료 표참조)을 부착하기 위해 수퍼글루를 사용하십시오.
참고: 커버슬립 가장자리에 작은 수퍼글루를 두드린 다음 셀 배양 접시의 밑면에 단단히 누릅니다. 위치 표시는 접착제가 그리드에 닿는 곳이면 어디든 가려지므로 커버슬립의 중앙 격자 부분을 접착제로부터 멀리 하는 것이 중요합니다. - 이식이 1시간 동안 해리된 후, P100 마이크로파이펫을 사용하여 세포 배양 접시로 옮김을 옮김을 옮김을 옮김을 사용한다. 접시의 격자 부분에 가능한 한 많은 셀을 플레이트하기 위해, 접시의 표면에 가까운 얕은 각도로 파이펫을 잡고, 파이펫 팁을 안쪽을 향한 격자의 모서리에 배치하고, 단단히 격자 아르에 걸쳐 셀 현탁액을 추방 ea. 이상적으로, 세포는 단단한 조밀한 클러스터에서 정착할 것입니다.
- 실온에서 1 시간 동안 배양하여 세포가 플레이트에 부착 될 수 있도록합니다. 이 배양이 시작될 때 형제 대조군 배아의 발달 단계를 결정하고 기록합니다.
- 5 μL 1 mM 플루오-4 AM (재료 표참조)과 10 % 플루론F-127 산의 2 μL을 결합하십시오.
참고: Fluo-4 AM은 가볍고 민감하며 항상 가벼운 안전 또는 호일로 덮인 튜브에 보관해야 합니다. - 배양이 완료된 후 샘플 접시를 암실 또는 기타 조명 보호 위치로 옮습니다. 마이크로파이펫을 사용하여 접시 가장자리에서 용액 100 μL을 제거합니다. 이 용액을 Fluo-4 AM/Pluronic F-127 산의 양치에 추가하고 파이펫을 위아래로 섞고 전체 부피를 샘플 접시에 반환합니다. 부드럽게 소용돌이섞으세요.
- 알루미늄 호일로 접시를 덮고 실온에서 1 시간 동안 배양하십시오. 이 배양이 시작될 때 형제 대조군 배아의 발달 단계를 결정하고 기록합니다.
- 배양의 끝에서, 다음과 같은 방법으로 세 가지 매체 세척을 수행하기 위해 2mMCa2 +의 나머지 원추형 튜브를 사용하여 : 1) 접시에서 용액 1 mL을 제거하고, 신선한 용액의 3 mL을 추가하고, 3) 접시에서 3 mL의 용액을 제거하고, 3) 접시에서 3 mL의 용액을 제거하고, 3 mL의 신선한 용액을 추가하십시오.
3. 칼슘 이미징
참고: 칼슘 이미징은 거꾸로 된 공초점현미경(물자 표)을사용하여 수행하였다.
- 현미경 단계에 견본 격판을 놓고, 주위 빛 노출에서 그것을 보호하기 위하여 주의를 기울이기. 플레이트가 고정되면 마커를 사용하여 플레이트의 전면 점에 라벨을 부착하여 후속 이미징에서 동일한 시야를 찾을 수 있도록 합니다.
- 현미경으로 샘플을 찾은 다음 먼저 10X에서 20배 배율로 시료를 찾고 이미징에 적합한 시야를 선택합니다. 이상적인 시야는 세포 밀도가 높지만 세포가 뭉치거나 개별적으로 구별하기 어렵기 때문에 밀도가 높지 않습니다.
- 격자 지배 커버슬립이 보이게 되도록 현미경 초점을 조정합니다. 커버슬립에 표시된 숫자는 특정 그리드 궤적에 대한 고유 식별자로 사용되며 추가 이미징을 위해 동일한 시야를 찾는 데 사용할 수 있습니다. 원래 선택한 뷰 필드가 숫자와 겹치지 않으면 식별 가능한 숫자가 프레임에 있을 때까지 다시 정의합니다.
- 그리드 가형 커버슬립에 초점을 맞추어 선택한 시야의 밝은 필드 이미지를 찍습니다.
- 초점 설정을 조정하고 셀이 포커스를 조정하여 선택한 시야의 밝은 필드 이미지를 찍습니다.
- 세포 층에 초점을 맞추어 488 nm 레이저로 샘플을 조명합니다. 각 실험에 대해 HV 및 오프셋 값을 최적화하여 FITC 채널에서 동적 형광 범위가 감지되도록 할 수 있습니다.
- 2시간 이미지의 경우 이미징 구성을 수정하여 스캔 시간이 3.93s이고 간격이 8s로 901프레임을 기록하여 이미지를 획득합니다.
- 이미징이 완료되면 현미경 단계에서 플레이트를 제거하십시오. 플레이트에서 용액 1 mL을 제거하고 2x MEMFA (200 mM MOPS, 2 mM EGTA 및 7.4 % 포름 알데히드에서 2 mM MgSO4)의 1 mL로 교체하십시오.
- 실온에서 2시간 동안 또는 4°C에서 하룻밤 동안 플레이트를 배양합니다. 이 배양이 시작될 때 형제 대조군 배아의 발달 단계를 결정하고 기록합니다.
- 고정이 완료된 후 플레이트에서 모든 용액을 제거하고 1x PBS 의 2 mL로 교체하십시오. 추가 처리를 위해 플레이트를 4°C에서 보관하십시오.
4. 유전자 발현 분석 : 프로브 합성
- 하기보다 설명한 바와 같이, 옥시 혼성화에 대한 안티센스 RNA 프로브를 생성한다. 부가적으로, 음성 대조군으로 사용하기 위해 동일한 유전자에 대한 센스 프로브를 생성한다.
- 프로브 템플릿 서열을 포함하는 플라스미드 DNA를 정화하기 위해, 템플릿 플라스미드를 함유하는 세균성 글리세롤 스톡으로 LB 국물 150 mL을 접종하였다. 37°C에서 밤새 또는 배양이 혼탁될 때까지 흔들어 서 배양합니다.
- 당신의 선택 방법을 사용하여 세균 배양에서 플라스미드 DNA를 정화하십시오.
참고 : 우리는 플라스미드 DNA의 높은 수율을 얻기 위해 McNary-Nagel 미디 준비 키트를 사용합니다. - 플라스미드가 예상 인서트를 포함하고 있음을 확인하려면, 제한 다이제스트를 수행하고 아가로즈 겔의 제품을 분석한다. 절단되지 않은 플라스미드는 또한 게놈 DNA 오염을 검사하기 위하여 아가로즈 젤에 분석될 수 있습니다.
- 템플릿 DNA를 선형화하기 위해, 플라스미드 DNA 20 μg, 적절한 제한 효소 2 μL, 1x 적절한 완충액을 포함하는 100 μL 제한 다이제스트 반응을 설정하였다. 37°C에서 2시간 이상 배양한다.
- 페놀/클로로포름 추출을 수행한 다음 클로로포름 추출을 수행하여 선형화된 DNA를 추출합니다.
- 100 % 에탄올로 DNA를 침전시. 이것은 시료에 2 부적의 차가운 에탄올을 첨가하고 고화될 때까지 -80 °C에서 배양하여 신속하게 수행 할 수 있습니다 (15-30 분).
- 12,000 x g/4°C에서 20분 동안 회전하여 펠릿 DNA에 냉장 원심분리기를 사용하십시오.
- 상급제를 제거하고 70 % 에탄올의 200 μL로 펠릿을 씻으십시오. 12,000 x g/4°C에서 5분 간 회전합니다.
- 상층 및 공기 건조 펠릿을 약 5 분 동안 제거하십시오. 1x TE의 20 μL에서 다시 일시 중단하고 추가 사용이 될 때까지 4 °C에서 보관하십시오.
- 안티센스 RNA 프로브를 합성하고 정화하기 위해 10 mM rCTP의 15 μL, 10 mM rGTP의 15 μL, 10 mM rATP의 15 μL, 10 mM rUTP의 9.75 μL, 및 10 mM의 5.25μL의 10mm rNTP를 결합하여 2.5 mM rNTP 믹스를 생성한다(10 mM rUTP의 9.75 μL, 및 10 mM 의 5.25μL 의 10mM rNTP).
- 단계 4.2-4.10으로부터 4 μg의 선형화된 템플릿 DNA를 포함하는 시험관내 전사 반응 50 μL을 설정하고, 15 μL의 2.5 mM rNTP 혼합물 단계 4.11, 5x 전사 완충제의 10 μL, 0.1 M DTT의 5 μL, RNAse 억제제의 0.5 μL (20 U/μL), 및 1.5 μL의 적절한 RNA 폴리머라제 (T3, T7, 또는 SP6). 37 °C에서 1 시간 배양.
- 반응에 1.5 μL의 RNA 폴리머라아제를 추가하고 추가 시간 동안 37°C로 되돌아갑니다.
- RQ1 DNAse 1 μL을 반응에 넣고 DNA 템플릿을 저하시키기 위해 10 분 동안 37 °C에서 배양하십시오.
- 시료에 7.5M LiCl 용액 30 μL을 추가합니다. 피펫을 -20°C에서 적어도 1시간 동안 혼합하고 배양한다.
- 냉장 원심분리기를 사용하여 샘플을 14,000 x g/4°C에서 25분 간 회전시다.
- 상급체를 제거하고 70 % 에탄올500 μL로 펠릿을 헹구십시오. 14,000 x g/4°C에서 5분 간 회전합니다.
- 약 5분 동안 상류 및 공기 건조 펠릿을 제거합니다.
- 하이브리드화 버퍼에서 샘플을 10 ng/μL의 농도로 희석하여 10x 프로브 스톡으로 생성(50% 포름아미드, 5x SSC (식염수 - 구연산나트륨, 750 mM NaCl, 75mMM 구연산염, pH 7.0), 1 mg / mL 토룰라 RNA, 0.1 % 트웬-20, 1 x 덴하르트 용액, 0.1 % CHAPS, 10 mM EDTA 및 100 μg / mL. 추가 사용이 될 때까지 -20°C에서 보관하십시오.
5. 유전자 발현 분석 : 시투 혼성화에서형광
참고: 모든 세안은 개별적으로 포장된 멸균 된 전사 파이펫을 사용하여 약 1 mL의 용액으로 수행해야합니다. 파이펫은 용액을 제거하거나 첨가할 때 플레이트 가장자리에 배치되어야 하며, 세안은 가능한 한 부드럽게 수행하여 세포가 플레이트 표면에서 빠지지 않고 손실되지 않도록 해야 합니다.
- 플레이트에서 1x PBS를 제거합니다(3.10단계에서). 신선한 1x PBS로 교체하고 실온에서 5분 동안 배양합니다.
- 0.1 M 트리에탄올라민(pH 8.0)의 25 mL와 아세트산 비하이드라이드 62.5 μL을 결합합니다. 잘 섞으세요. 이 용액으로 접시를 10 분 동안 씻으소서.
- 접시를 1x SSC로 5분 동안 씻으소서.
- 0.02 M HCl로 플레이트를 10 분 동안 씻어 세포를 투과시하십시오.
- 각각 5분 동안 1x PBS로 2x를 씻으소서.
- 용액을 제거하고 1 mL의 혼성화 버퍼를 추가하십시오 (50 % 포름 아미드, 5x SSC (750 mM NaCl, 75 mM 구연산나트륨, pH 7.0), 1 mg / mL 토룰라 RNA, 0.1 % 트웬-20, 1 x 덴하르트 용액, 0.1 % CHAPS, 10 mM EDTA 및 100 μg / mL 헤파린 플레이트. 60 °C에서 적어도 6 시간 동안 흔들어 서 배양하십시오.
- 혼성화 버퍼를 제거하고 1x RNA 프로브 용액의 750 μL로 교체하십시오 (4.19 단계에서 만든 10 x 스톡을 희석 한 형태) 센스 RNA 프로브는 음성 대조군으로서 사용될 수 있다.
- 60 °C에서 8-14 시간 동안 흔들어 서 배양하십시오.
- 프로브를 제거하고 -20°C에서 보관하십시오.
참고: 1x 프로브 희석은 폐기되기 전에 최대 3회재사용가능합니다. - 0.2x SSC로 플레이트를 헹구고 있습니다.
- 60 °C에서 1 시간 동안 신선한 0.2x SSC로 씻으소서.
- 플레이트를 실온으로 옮기고 5분 동안 평형화합니다.
- 접시를 0.2x SSC로 5 분 동안 씻으소서.
- 15 분 동안 1x PBT로 접시를 씻으소서.
- 1x PBT(0.1% 트리톤-x-100)에서 2% H2O2로 플레이트를 1시간 동안 세척합니다.
참고: 이 솔루션은 빛에 민감하므로 각 실험마다 신선하게 만들고 빛으로부터 보호해야 합니다. 플레이트는 또한 이 배양 중에 빛으로부터 보호되거나 포일되어야 합니다. - 1x TBST (150 mM NaCl, 50 mM Tris-HCl, pH 7.5, 0.1 % 트위넨-20)로 15 분 동안 접시를 씻으소서.
- 말레산 완충제에서 2%로 차단 시약을 희석 (100 mM 말산, 150 mM NaCl, pH 7.5). 실온에서 적어도 1 시간 동안이 혼합물의 세포를 차단하십시오.
- 말레산 완충제의 2% 차단 시약에서 1:1,000을 희석한 안티 디그산소-POD 항체로 차단 용액을 교체하십시오. 4 °C에서 밤새 배양.
- 플레이트를 1x TBST로 3x 헹구어 보시고 자합니다.
- 연속 흔들림으로 세척당 최소 15분 동안 1x TBST의 2mL로 4x를 세척하십시오.
- 연속 흔들림으로 세척당 적어도 10분 동안 1x PBT로 2x를 씻으소서.
- 1x PBT에서 Cy3-컨쥬게이드 티라미드 1:25희석. 이 희석물의 750 μL로 접시를 5 분 동안 씻으소서.
참고: 이 솔루션은 매우 가벼운 민감성이며, 신호 열화를 방지하기 위해 나머지 실험 기간 동안 플레이트를 빛으로부터 보호하거나 포일 처리해야 합니다. - 이 용액에 0.3% H2O2의 2.5 μL을 추가하고 실온에서 추가로 40 분 동안 연속 흔들기로 배양하십시오.
- 연속 흔들림으로 세척당 최소 15분 동안 1x TBST로 4x를 세척하십시오.
- 1x PBT로 헹구고 자합니다.
- 1x MEMFA (100 mM MOPS, 1 mM EGTA, 및 3.7 % 포름알데히드에서 1 mM MgSO4)에서 실온에서 1 시간 동안 배양하여 세포를 고정시.
- 용액을 제거하고 1x PBS로 교체합니다. 플레이트를 포일 용기에 넣고 추가 처리될 때까지 4°C에 보관하십시오.
6. 이미징 셀
참고: 이미징은 거꾸로 된 공초점 현미경을 사용하여 수행되었다.
- 샘플 플레이트를 현미경 스테이지에 놓고 3.1 단계에서 만든 마크를 스테이지 의 전면에 정렬합니다.
- 그리드 라이닝 커버슬립이 보이도록 이미지에 초점을 맞추고, 3.4단계에서 촬영한 그리드 이미지를 참조로 사용하여, 칼슘 이미지에서 캡처한 시야에 맞게 시야를 조정합니다(섹션 3).
- 그리드와 셀의 밝은 필드 이미지를 수집합니다.
- 595 nm TRITC 레이저로 샘플을 조명합니다. 게인 값을 조정하여 음수 제어 셀의 이미지를 사용하여 신호를 배경과 적절히 구분하고 스틸 이미지를 수집합니다.
참고: 이상적으로, 배경 형광 수준은 비 표적감각 RNA 프로브와 병렬로 처리된 음성 대조판에 기초하여 결정된다. 게인 설정은 이 플레이트가 완전히 검은색으로 나타나도록 조정된 다음(배경 수준에 해당) 실험 배치에서 이미지된 다른 플레이트에 대해 일정하게 유지됩니다.
7. 데이터 처리
참고: 데이터 처리는 Nikon Elements 소프트웨어를 사용하여 수행되었습니다.
- 3.7단계에서 2시간 칼슘 이미지를 엽니다. 이진 > 스팟 감지 및 밝은 반점을선택하여 각 개별 셀에 해당하는 픽셀을 식별합니다. FITC 채널이 선택되어 있는지 확인합니다.
- 이 레이어가 생성된 후 개별 셀 위에 컬러 원이 나타납니다. 가능한 한 많은 셀이 식별자와 인식되고 연관되도록 셀 분포 및 크기 매개 변수를 조정합니다.
- 보기 및 분석 컨트롤 > 추적 옵션으로이동하여 이미지의 모든 프레임에서 셀을 추적합니다. 5프레임을 트랙 사이의 최대 간격으로 설정하고, 600프레임 미만으로 연결된 객체를 삭제하고, 간격 닫기 옵션을 선택합니다. 바이너리 추적을 선택하여 이미지에 셀 추적을 적용합니다.
- 셀을 추적한 후 개별 셀(예: 셀 덩어리)에 해당하지 않는 개체를 수동으로 삭제합니다. 그러나, 데이터 포인트는 칼슘 활동 추적의 형태에 근거한 추가 분석에서 제외되어서는 안됩니다.
- 이미지 창에서 뷰 오버레이 및 이진 오브젝트 ID 표시를선택합니다. 이미지의 끝으로 스크롤 (프레임 901) 및 선택 편집 > 보기 스냅 샷 만들기 (8비트 RGB)> 현재 프레임 > 확인. 이렇게 하면 각 셀의 연결된 이진 ID가 표시되는 이미지의 마지막 프레임의 스냅샷이 생성됩니다. 이 이미지를 저장합니다.
- 모든 개체다음에 데이터를 Excel로 내보내기를 선택하여시간계 데이터를 내보냅니다. 출력을 CSV 파일로 저장합니다.
- FISH 이미지를 엽니다. FITC 채널 대신 TRITC 채널을 사용하여 7.1-7.2 단계와 같이 스팟 감지를 최적화합니다. 잘못 할당된 바이너리를 수동으로 삭제한 다음 자동 측정 결과 > 업데이트 측정을 선택하여 각 셀의 신호 강도를 계산합니다. 7.5 및 7.6 단계를 반복하여 이미지 스냅샷 및 데이터 테이블을 내보냅니다.
- 열 A가 FISH 이진 ID로 레이블이 지정되고 열 B에 칼슘 이진 ID로레이블이 지정되는 스프레드시트를 만듭니다. 7.5 단계 및 7.7단계로 내보낸 이미지를 엽니다. FISH 이미지(7.7단계)에서 식별된 각 개체에 대해 열 A에 이진 ID를 기록합니다. 그런 다음 칼슘 이미지(단계 7.5)에서 해당 셀을 찾아 두 이미지에서 자신 있게 식별할 수 없는 열 B. 셀에 이진 ID를 기록하면 스프레드시트에 추가해서는 안 됩니다.
참고: Adobe Photoshop 또는 김프 이미지 편집기와 같은 사진 편집 프로그램을 사용하여 두 이미지를 모두 열고, 반투명하게 만들고, 파트너 이미지에 오버레이하여 각 셀과 연결된 두 개의 바이너리 ID를 보다 쉽게 식별하고 연결할 수 있습니다. - 확인된 각 세포에 대해, 그 타임시리즈 칼슘 데이터(칼슘 이진 ID와 연관되고 7.6단계로 내보내진) 및 유전자 발현 데이터(FISH Binary ID와 연관되고 7.7단계로 내보낸)를 대조한다.
참고: 다운스트림 데이터 처리 및 분석은 이러한 데이터를 단일 데이터 테이블에 정렬하고 스파이크 카운트, 프랙탈 분석 및 마르코비안 엔트로피를 포함한 분석 기법의 배열을 적용하여 조사자가 칼슘 활성의 새로운 패턴을 식별할 수 있도록 하는 17,18.
결과
칼슘 이미징을 위해 제조된 해리세포의 성공적인 예는 도 2A에서볼 수 있다. 셀은 조밀하게 도금되어 각 이미지에서 최대 양의 정보를 수집할 수 있지만 개별 셀을 자신있게 구별할 수 없을 정도로 조밀하게 도금되지는 않습니다. 형광은 2 시간 화상 진찰 기간 동안 각 정의된 세포에 대해 검출됩니다. 실험에 기록된 모든 셀에 대한 추적을 포함하는 복합 플롯의 시각화는 대량 또는 모집단 측정이 스파이크 동작의 미묘한 패턴을 모호하게 할 수 있는 정도를보여줍니다(그림 2B). 개별 세포의 기록된 프로파일이 분리될 때, 신경 전구 세포의 불규칙한 스파이크 활성 특성의 예는 명확하게 규명될 수 있다. 성숙한 뉴런과는 달리, 배아 뉴런 세포는 불규칙하고, 매우 가변적이며 복잡한 칼슘 활성의 특성을나타낸다(그림 2B). 이러한 복잡성을 정량화하기 위해, 스파이크를 정의하기 위한 다양한 파라미터를 포함하는 다양한 데이터 분석 방법의 적용이17,18로적용되었다(도2C).
안티센스 mRNA 프로브의 성공적인 설계 및 합성을 포함하는 현장에서의 성공적인 형광은, 비결합 센스 RNA 대조군으로 배양된 배경 대조군과 실험판을 비교하여 평가될 수있다(도 3A,B). 양성 프로브 제어는 또한 검출 가능한 수준에서 표적 mRNA를 발현하는 것으로 알려진 세포 유형을 처리함으로써 수행될 수 있다.
칼슘과 FISH 화상 진찰을 통해 동일 세포의 확인은 세포가 프로브 혼성화 및 가공 도중 대략 동일한 위치를 유지하도록 요구합니다. 플레이트를 거칠게 다루거나 너무 강력하게 수행되는 경우, 플레이트 표면에서 세포가 빠지거나 용액이 플레이트의 다른 위치에 버려지거나 증착될 때 손실될 수 있으므로 이미지 간에 일치하는 것이 불가능합니다(그림4A). 이러한 중단이 시야의 일부 셀에만 영향을 주는 경우 이미지 내의 일부 셀을 감지하고 할당할 수있습니다(그림 4B). 그러나 FISH가 신중하게 수행되고 이미지 간에 손실되거나 재배치되는 실험에서 최대 데이터 양이 얻습니다(그림4C).
일단 관심 있는 발달 단계에서 적당한 수의 세포의 칼슘 활성 및 유전자 발현을 모두 설명하기 위해 데이터가 수집되면, 추가 분석은 이들 두 가지 특징들 사이의 상관관계를 평가하기 위해 수행될 수있다(도 1). 스파이크 카운트/주파수, 평균 전력, 허스트 지수 추정 및 마르코비안 엔트로피 측정17,18을포함한 칼슘 활성 패턴을 정량화하기 위해 다수의 메트릭이 적용되었다. 유전자 발현은 절대 형광 수준에 의해 정량적으로 정의되거나 해결되는 실험 적 질문에 따라 이진(예/아니오) 척도로 채점될 수 있다.
신경 전구 마커 유전자의 발현과 칼슘 활동을 콜라화하는 실험결과 칼슘 활성과 신경 전달 물질 표현형의 특정 패턴 사이의 수많은 연관성이 밝혀졌습니다. 신경판 단계(Stage 14)에서, 억제 뉴런 마커 gad1.1을 발현하는 GABAergic 세포는 gad1.1 발현이 부족한 세포보다 더 규칙적이고 더 높은 진폭인 칼슘 활성을 나타낸다(도5A). 더욱이, 이들 gad1.1-발현세포는 높은 수준의 높은 진폭 스파이크와 연관되는 반면, 저진폭 스파이크는 흥분성 뉴런 마커 slc17a7을발현하는 글루타마테르지성 세포에서 더 빈번하다.
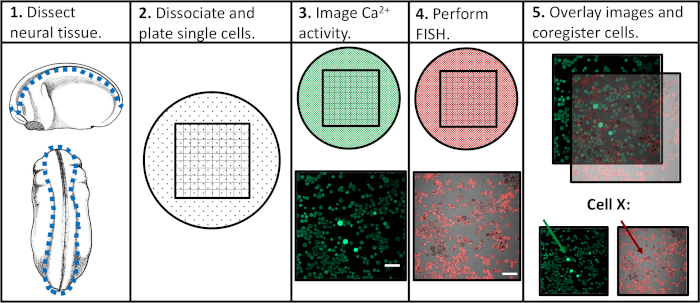
그림 1: 실험 워크플로우의 회로도입니다. 배율 막대 = 100 μm. 패널 3-5의 이미지는 Paudel 외(2019)17에서찍은 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
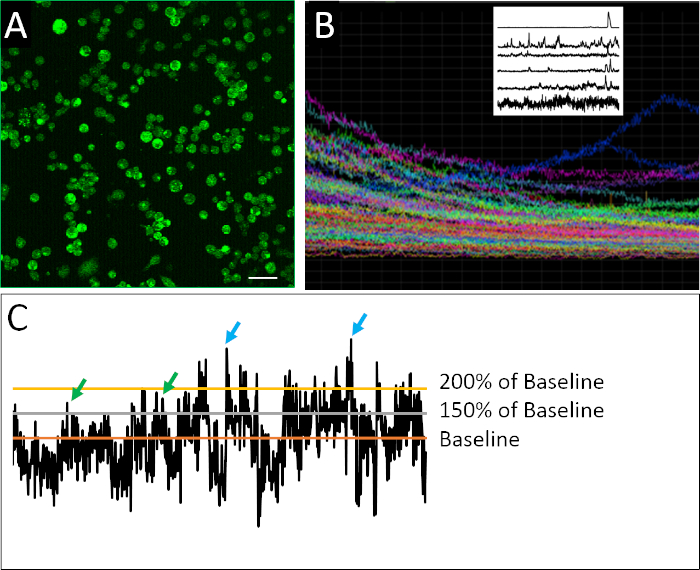
그림 2: 칼슘 이미징 및 예제 활동 프로필. (A)Fluo4-AM에 의해 보고된 세포내 칼슘 활성. 각 2시간 이미지는 901프레임으로 구성되며, 하나의 대표 프레임이 여기에 표시됩니다. (B)이미지된 시야 내의 모든 셀에서 시간에 따라 형광 강도의 복합 플롯. 흔적은 표시염료(Fluo4) 초과 근무의 광표백을 명확하게 나타냅니다. 왼쪽 상단에 있는 래스터 플롯은 Eilers와 Boelen19가개발한 디트렌드 알고리즘을 적용한 후 칼슘 활성의 대표적인 흔적을 보여 주며, 여기서 여기에 표시된 세포는 다양한 스파이킹 행동 패턴을 나타낸다. (C)상이한 임계값(기준선의 150% 및 200%를 적용하여 기준선이 디트렌드 형광 강도의 평균인 경우) 스파이크(녹색 및 파란색 화살표)를 정의합니다. 배율 막대 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
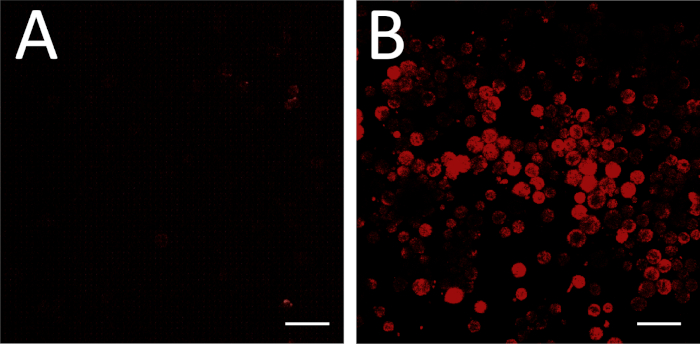
그림 3: 물고기 이미징. (a)물고기는 음성 대조군으로서 비결합 센스 RNA 프로브로 수행하였다. 어떤 세포가 형광으로 나타나지 않도록 화상 진찰 조정이 조정되었습니다. 일부 시야에는 (A)의 오른쪽 상단 및 하단 모서리에서 볼 수 있는 것과 같은 일부 형광을 가진 비세포 파편이 포함될 수 있습니다. 이러한 백그라운드 설정을 위해 무시할 수 있습니다. (B)동일한 이미징 설정을 사용하여 실험판(antisense RNA 프로브)을 이미지화한다. 이러한 조건하에서 형광은 배경 위의 유전자 발현에 해당한다. 배율 막대 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 이미지 오버레이 및 공동 등록. 칼슘 활성(채워진 녹색 원으로 표시된 세포) 및 FISH(그늘진 적색 원으로 표시되는 세포)에 대해 이미지된 샘플의 개략적 표현. (A)샘플 처리 및 처리 중에 크게 이동한 셀은 두 이미지에서 안정적으로 식별할 수 없습니다. (B)세포 중단은 시야의 일부 셀에만 영향을 줄 수 있습니다. 일부 셀은 두 이미지에서 명확하게 식별할 수 있지만 다른 셀은 자신있게 일치시킬 수 없습니다. (C)샘플을 신중하게 처리하는 경우 대부분의 셀은 방해받지 않고 유지되며 두 이미지 모두에서 식별할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
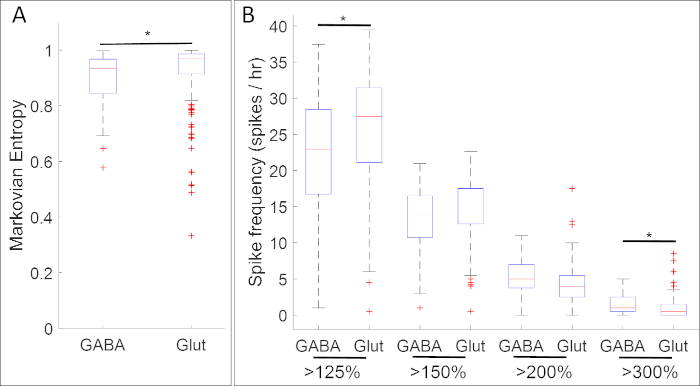
도 5: 이 방법의 적용예로서, 신경판 단계 제노푸스 라비스에서 칼슘 활성과 유전자 발현(GABA 및 glut for genes gad1.1 및 slc17a7)의 연관성을 보여주는 박스플롯. 14단계에서, gad1.1-postive 세포(GABA)는(A)마르코비안 엔트로피18 및(B)스파이크 카운트에 의해 정의된 바와 같이 더 높은 진폭 및 더 많은 규칙적인 칼슘 활성을 나타내며, 임계값을 사용하여 125%, 150%, 200%, 200% 및 300%의 평균 의 디트트렌드 형광 강도(baseline)s17lc s17lc보다. 별은 본페로니 보정 된 두 샘플 콜모고로프 - 스미르 노프 테스트 (p & 0.05) 및 효과 크기에 대한 코헨의 d 통계 (n = 5 배양 및 >100 셀; * 0.2 ≤ | d | & 0.5)에 따라 통계적으로 유의한 차이를 나타냅니다. 이 그림은 Paudel 등에서 얻은 데이터 세트에서 다시 그려지고17. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
칼슘 활동의 특징적인 패턴은 개발 신경계를 구성하는 세포에서 관찰되었으며, 특정 유형의 활동은 뚜렷한 신경 발달 과정과 관련이 있습니다. 그러나, 이러한 정보 조밀한 활동 패턴이 전사 반응으로 번역되는 메커니즘에 대한 추가 이해는 단세포 분해능으로 수집될 칼슘 활성 및 유전자 발현에 대한 정보를 필요로 한다. 성숙한 뉴런과 같이 더 많은 고정관념적인 칼슘 활성을 나타내는 시스템은 벌크 수준에서 합리적으로 분석될 수 있지만, 배아 신경계를 특징짓는 불규칙한 패턴은 덜 정확한 기록으로 쉽게 가려집니다.
이 프로토콜에 확립된 실험 프레임워크는 다양한 세포 유형 및 형광 리포터에 쉽게 적응할 수 있습니다. 세포 모형의 거의 모든 세포 모형 또는 조합을 포함하는 조직은 관심있는 모형 유기체로부터 해부되고 단세포 화상 진찰을 위해 도금될 수 있습니다. 세포 식별을 허용하고 세포 자율 적 과정의 효과를 분리하는 것 외에도, 1 차적인 세포 배양 접근법은 실험자가 원하는 대로 배지 성분을 정의할 수 있게 합니다. 예를 들어, 2 mMCa2+ 용액에서 뉴런 전구체의 활성을 비교한 실험은 배아 척수에서 스파이크 주파수와 신경전달물질 표현형 사이의 관계가 세포-세포 상호작용13,20의영향 없이 재봉화될 수 있는지 여부를 조사하기 위해 수행되었다.
이 프로토콜은 형광 마커 Fluo4-AM을 활용하여 세포내 칼슘 활성을 검출하는 반면, 사용자는 유전자 인코딩된 칼슘 지표를 포함하여 시판되는 다른 마커21을선택할 수 있다. 유사하게, 대체 마커는 관심 있는 이온의 농도에 대한 동적 변화를 모니터링하는 데 사용될 수 있습니다(K+, Na+및 Zn2+를 포함),막 전위, 또는 세포 pH. 이미징 설정 및 이미지 지속 시간은 필요에 따라 수정할 수 있습니다.
우리는 특정 응용 프로그램으로 칼슘 활동 및 신경 표현형을 상관하지만,이 방법은 또한 다양한 다른 세포 특성에 적용 할 수 있습니다. 예를 들어, 사이트 혼성화에서형광은 신경 마커 ChAT 또는 전사 인자 Engrailed를 포함하여 관심 있는 임의의 유전자에 대하여 프로브로 수행될 수 있으며, 이를 통해 mRNA 종의 맞춤형 패널의 민감한 검출을 가능하게 한다. 이러한 프로브는 이소폼에 특이적이라고 설계할 수 있으며 원하는 경우 추가적인 표적 특이성을 지원합니다. 이중 FISH는 여러 개의 서로 다른 형광단에 공액된 프로브를 사용하여 수행될 수 있으며, 이는 여러 유전자의 발현을 동시에 평가할 수 있도록 한다. 그러나, 이러한 유형의 실험에 필요한 추가 적인 세차는 세포 손실 또는 운동의 증가 기회와 관련 되 고 경험 및 섬세 한 성공적으로 수행 될 필요.
이 프로토콜에 대한 실험별 수정에 관계없이 주의해야 하는 몇 가지 주요 단계가 있습니다. 해부는 모든 오염 조직 또는 세포 집단을 제거하기 위하여 주의해서 수행되어야 합니다; 이식이 해리될 때 공간 패터닝이 손실되기 때문에 이웃 조직의 나머지 세포는 관심 있는 세포와 산재하고 구별할 수 없게 됩니다. 세포가 도금된 후에는 세포가 빠지지 않도록 가능한 한 부드럽게 샘플을 처리해야 합니다. 가장 중요한 것은 솔루션이 제거되고 추가될 때 파이펫을 플레이트 가장자리에 배치하여 모든 솔루션 변경을 천천히 신중하게 수행해야 한다는 것입니다. 이것은 세포가 칼슘과 FISH 심상 둘 다에서 자신있게 확인될 수 있다는 것을 보장할 것입니다. 처리 중에 세포가 중단되면 두 이미지 간에 해당 셀의 일부 또는 전부를 식별하는 것이 불가능할 수 있습니다. 이러한 할당에 주의를 기울이면 명확하지 않은 해당 셀만 추가 분석을 위해 사용되는 것이 좋습니다.
해결되는 생물학적 질문에 따라 다양한 분석 접근법이 적절할 수 있습니다. 타임시리즈 칼슘 활성은 다양한 방법으로 처리 및 정량화될 수 있으며, 실험자는 추세 가감소 매개변수, 분석 메트릭 및 분석 매개변수(예: 칼슘 스파이크를 정의하는 데 사용되는 기준선 임계값%)를 선택할 수 있는 유연성을 제공합니다. 칼슘 활성과 유전자 발현 수준 사이의 상관관계는 FISH 이미지로부터 추출된 절대 또는 상대형형광값으로서 유전자 발현을 분석함으로써 그려질 수 있다. 양자택일로, 칼슘 활동과 유전자 발현 사이 상관관계 (존재/부재) 양성 유전자 발현 신호에 대한 형광 임계값을 정의하고 개별 세포에 '예' 또는 '아니오' 식별자를 할당해서 그릴 수 있습니다. 전체적으로 이 실험 스키마는 세포 일치 유전자 발현 데이터와 함께 타임시리즈 데이터의 수집 및 예비 분석을 위한 매우 유연한 파이프라인을 제공합니다. 이러한 실험은 배아 제노푸스 라에비스에서억제-운명 및 흥분성 신경 지방 전구체의 특징인 칼슘 활성 패턴의 식별에 의해 예시된 바와 같이 세포 역학 및 전사 변화 사이의 복잡한 관계를 더 잘 이해하는 데 매우 중요할 것이다.
공개
이해 상충이 선언되지 않았습니다.
감사의 말
우리는 이러한 프로토콜의 개발에 기여에 대한 웬디 허스트와 린지 슐라이퍼에게 감사드립니다. 이 작품은 국립 보건원 (1R115NS06756-01, 1R15HD077624-01 및 1R15HD096415-01)에서 MSS에 대한 보조금에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| For Animal Husbandry & Cell Culture | |||
| CHORULON (chorionic gonodotropin) | Merck Animal Health | ||
| Gentamycin sulfate salt | Millipore Sigma | G1264 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Pyrex petri dishes, 100 mm x 20 mm | Millipore Sigma | CLS3160102 | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 35mm | Fisher Scientific | 08-772A | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 60mm | Fisher Scientific | 08-772F | |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | |
| Thermo Scientifc Nunc Cell Culture / Petri Dishes, 35x10mm Dish, Nunclon Delta | Fisher Scientific | 12-565-90 | |
| Fisherbrand Standard Disposable Transfer Pipettes, Nongraduated; Length: 5.875 in.; Capacity: 7.7 mL | Fisher Scientific | 13-711-7M | |
| Ethyl 3-aminobenzoate methanesulfonate | Millipore Sigma | E10521 | |
| Collagenase B | Millipore Sigma | 11088807001 | |
| Dumont #55 Forceps, Dumostar | Fine Science Tools | 11295-51 | |
| Dumont #5 Forceps, Dumostar | Fine Science Tools | 11295-00 | |
| Cellattice Micro-Ruled Cell Culture Surface | Nexcelom Bioscience | CLS5-25D-050 | |
| For Calcium Imaging | |||
| Fluo-4, AM, cell permeant | Thermo Fisher Scientific | F14201 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | Thermo Fisher Scientific | P6866 | |
| For RNA Probe Generation | |||
| PureYield Plasmid Miniprep System | Promega | A1222 | |
| rATP | Promega | P1132 | |
| rCTP | Promega | P1142 | |
| rGTP | Promega | P1152 | |
| rUTP | Promega | P1162 | |
| Digoxigenin-11-UTP | Millipore Sigma | 3359247910 | |
| Rnase Inhibitor | Thermo Fisher Scientific | N8080119 | |
| T3 RNA Polymerase | Promega | P2083 | |
| T7 RNA Polymerase | Promega | P2075 | |
| SP6 RNA Polymerase | Promega | P1085 | |
| RQ1 Rnase-Free Dnase | Promega | M6101 | |
| LiCl Precipitation Solution (7.5 M) | Thermo Fisher Scientific | AM9480 | |
| For Fluorescence In Situ Hybridization | |||
| Acetic Anhydride | Thermo Fisher Scientific | 320102 | |
| Blocking Reagent | Millipore Sigma | 11096176001 | |
| Anti-Digoxigenin-POD, Fab fragments | Millipore Sigma | 11207733910 | |
| Cy3 Mono-Reactive NHS Ester | Millipore Sigma | GEPA13105 | |
| Solution Components | |||
| Calcium chloride, 96% extra pure, powder, anhydrous, ACROS Organixs | Fisher Scientific | AC349610 | |
| Calcium chloride dihydrate | Millipore Sigma | C3306 | |
| CHAPS hydrate | Millipore Sigma | C3023 | |
| Denhardt's Solution (50X) | Thermo Fisher Scientific | 750018 | |
| DTT, Molecular Grade (DL-Dithiothreitol) | Promega | P1171 | |
| Ethylenediaminetetraacetic Acid, Disodium Salt Dihydrate | Fisher Scientific | S311 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid | Millipore Sigma | E3889 | |
| Formamide (Deionized) | Thermo Fisher Scientific | AM9342 | |
| Herparin sodium salt from porcine intestinal mucosa | Millipore Sigma | H3393 | |
| HEPES (Ultra Pure) | Thermo Fisher Scientific | 11344041 | |
| Hydrogen peroxide solution | Millipore Sigma | H1109 | |
| L-Cysteine | Millipore Sigma | 168149 | |
| Magnesium chloride, pure, ACROS Organics | Fisher Scientific | AC223211000 | |
| Magnesium sulfate, 97% pure, ACROS Organixs, anhydrous | Fisher Scientific | AC413480050 | |
| Maleic Acid, 99%, ACROS Organics | Fisher Scientific | ACS125231000 | |
| MOPS (Fine White Crystals/Molecular Biology), Fisher BioReagents | Fisher Scientific | BP308 | |
| Potassium chloride | Millipore Sigma | P9541 | |
| Ribonucleic acid from torula yeast, Type IX | Millipore Sigma | R3629 | |
| Sodium chloride | Millipore Sigma | S7653 | |
| Triethanolamine | Millipore Sigma | 90279 | |
| Tris | Millipore Sigma | GE17-1321-01 | |
| TWEEN 20 | Millipore Sigma | P9416 | |
| Equipment | |||
| Laminar Flow Hood | model of choice | ||
| Dissecting Microscope | model of choice | ||
| Inverted Fluorescence Microscope | Nikon | TE200 | |
| NIS-Elements Imaging Software | Nikon | ||
| Shaking Incubator | model of choice | ||
| Refrigerated Centrifuge | model of choice | ||
| Miscellaneous | |||
| Corning bottle-top vaccum filter system, 0.22 μm pore, 500 mL bottle capacity | Millipore Sigma | CLS430769 | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 |
참고문헌
- Humeau, J., et al. Calcium signaling and cell cycle: Progression or death. Cell Calcium. 70, 3-15 (2017).
- Kim, J. M., Lee, M., Kim, N., Heo, W. D. Optogenetic toolkit reveals the role of Ca2+ sparklets in coordinated cell migration. PNAS. 112 (21), 5951-5957 (2016).
- Orrenius, S., Zhivotovsky, B., Nicotera, P. Regulation of cell death: the calcium-apoptosis link. Nature Reviews Molecular Cell Biology. 4 (7), 552-565 (2003).
- Pham, K., et al. Ca2+ and Mg2+ module conformational dynamics and stability of downstream regulatory element antagonist modulator. Protein Science. 24 (5), 741-751 (2015).
- Smedler, E., Uhlén, P. Frequency decoding of calcium oscillations. Biochimica et Biophysica Acta. 1840 (3), 964-969 (2014).
- Moreau, M., Néant, I., Webb, S. E., Miller, A. L., Riou, J. F., Leclerc, C. Ca(2+) coding and decoding strategies for the specification of neural and renal precursor cells during development. Cell Calcium. 59 (2-3), 75-83 (2016).
- Tomida, T., Hirose, K., Takizawa, A., Shibasaki, F., Iino, M. NFAT functions as a working memory of Ca2+ signals in decoding Ca2+ oscillation. EMBO. 22 (15), 3825-3832 (2003).
- Hannanta-Anan, P., Chow, B. Y. Optogenetic Control of Calcium Oscillation Waveform Defines NFAT as an Integrator of Calcium Load. Cell Systems. 2 (4), 283-288 (2016).
- Li, L., Stefan, M. I. Le Novère N. Calcium input frequency, duration and amplitude differentially module the relative activation of calcineurin and CaMKII. PLoS One. 7 (9), 43810 (2012).
- Romano, D. R., Pharris, M. C., Patel, N. M., Kinzer-Ursem, T. L. Competitive tuning: Competition's role in setting the frequency-dependence of Ca2+-dependent proteins. PLoS Computational Biology. 13 (11), 1005820 (2017).
- Pharris, M. C., Patel, N. M., Kinzer-Ursen, T. L. Competitive Tuning Among Ca2+/Calmodulin-Dependent Proteins: Analysis of in silico Model Robustness and Parameter Variability. Cellular and Molecular Bioengineering. 11 (5), 353-365 (2018).
- Gu, X., Olson, E. C., Spitzer, N. C. Spontaneous neuronal calcium spikes during early differentiation. Journal of Neuroscience. 14 (11), 6325-6335 (1994).
- Borodinsky, L. N., Root, C. M., Cronin, J. A., Sann, S. B., Gu, X., Spitzer, N. C. Activity-dependent homeostatic specification of transmitter expression in embryonic neurons. Nature. 429 (6991), 523-530 (2004).
- Ciccolini, F., Collins, T. J., Sudhoelter, J., Lipp, P., Berridge, M. J., Bootman, M. D. Local and Global Spontaneous Calcium Events Regulate Neurite Outgrowth and Onset of GABAergic Phenotype during Neural Precursor Differentiation. Journal of Neuroscience. 23 (1), 103-111 (2003).
- Weissman, T. A., Riquelme, P. A., Ivic, L., Flint, A. C., Kriegstein, A. R. Calcium Waves Propagate through Radial Glial Cells and Modulate Proliferation in the Developing Neocortex. Neuron. 43 (5), 647-661 (2004).
- Nieuewkoop, P. D., Faber, J. . The stages of Xenopus embryonic development. Normal Table of Xenopus laevis. , (1994).
- Paudel, S., et al. Calcium Activity Dynamics Correlate with Neuronal Phenotype at a Single Cell Level and in a Threshold-Dependent Manner. International Journal of Molecular Science. 20 (8), 1880 (2019).
- Marken, J. P., et al. A Markovian Entropy Measure for the Analysis of Calcium Activity Time Series. PLoS One. 11 (12), 0168342 (2016).
- Eilers, P. H. C., Boelens, H. F. M. Baseline Correction with Asymmetric Least Squares Smoothing. Leiden University Medical Centre Report. , (2005).
- Guemez-Gamboa, A., et al. Non-cell-autonomous mechanism of activity-dependent neurotransmitter switching. Neuron. 82 (5), 1004-1016 (2014).
- Paredes, R., Madelaine, , et al. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유