Method Article
Флуоресцентные изображения кальция и последующей на месте гибридизации для нейрональной характеристики прекурсоров в Xenopus laevis
В этой статье
Резюме
Мы представляем двухчастичную протокол, которая сочетает в себе флуоресцентную визуализацию кальция с гибридизацией на месте, позволяя экспериментатору соотносить закономерности активности кальция с профилями экспрессии генов на одноклеточном уровне.
Аннотация
Спонтанная внутриклеточная активность кальция наблюдается в различных типах клеток и предлагается играть важную роль в различных физиологических процессах. В частности, для многих аспектов развития нервной системы позвоночника необходима соответствующая регуляция моделей активности кальция во время эмбриогенеза, включая правильное закрытие нервной трубки, синаптогенез и спецификацию нейромедиатогенеса. В то время как наблюдение о том, что модели активности кальция могут отличаться как по частоте, так и по амплитуде, предполагает убедительный механизм, с помощью которого эти потоки могут передавать закодированные сигналы эффекторам вниз по течению и регулировать экспрессию генов, существующие подходы на уровне населения не имеют точности, необходимой для дальнейшего изучения этой возможности. Кроме того, эти подходы ограничивают исследования роли клеточных взаимодействий, исключая способность ассоциировать состояние определения нейронов при отсутствии контакта клеток. Таким образом, мы создали экспериментальный рабочий процесс, который пар замедленной визуализации кальция диссоциированных нейронных вышинс с флуоресценцией на месте гибридизации анализ, что позволяет недвусмысленное корреляции кальция картина активности с молекулярной фенотип на одноклеточном уровне. Мы успешно смогли использовать этот подход, чтобы различать и охарактеризовать специфические модели активности кальция, связанные с дифференциацией нервных клеток и нейронных клеток-прародителей, соответственно; помимо этого, однако, экспериментальные рамки, описанные в этой статье, могут быть легко адаптированы для изучения корреляций между любым профилем активности временных рядов и выражением гена или генов, представляющих интерес.
Введение
Бесплатный цитосолико кальций имеет решающее значение для различных биологических процессов, начиная от пролиферации клеток и миграции до апоптоза и аутофагии1,2,3. В рамках этих путей, кальций может оказывать вниз по течению влияние на экспрессию генов, взаимодействуя с кальцием связывания доменов, чтобы вызвать конформационные изменения, которые модулировать активность белка и взаимодействий. Например, нейрональный датчик кальция, известный как downstream Регуляторный элемент Модульатор (DREAM) проводится в развернутой промежуточной конформации при связке кальция, предотвращая его от взаимодействия с его белка и ДНК цели4. Помимо выступающей в качестве простой сигнальной молекулы, однако, динамический характер внутриклеточного кальция переходных позволяет этим тенденциям деятельности кодировать более сложные амплитуды или частотные сигналы5,6. Ядерная транскрипционная транскрипционная транскрипция фактора ядерного фактора активированных Т-клеток (НФА) усиливается высокочастотными колебаниями кальция, но тормозится низкочастотными колебаниями7. Принудительно, недавняя работа предложила что NFAT может фактически реагировать к кумулятивному выдержке кальция8. Оба кальциневрина и Ca 2 "/calmodulin-зависимых белка киназы II (CaMKII) также обладают четкой реакции на кальций переходных конкретных частот, продолжительность, или амплитуды9. Чтобы добавить дополнительный уровень нормативной сложности, вычислительные модели предполагают, что многие ниже по течению кальция связывающих белков становятся более или менее частотно-зависимых в ответ на наличие или отсутствие связывания конкурентов10,11.
В развивающейся нервной системе были определены два основных класса поведения активности кальция, которые связаны с конкретными биологическими процессами. Приток кальция классифицируются как "шипы", если они происходят в отдельных клетках, достигают пиковой интенсивности в 400% от базового значения в течение пяти секунд, и проявляют двойной экспоненциальный распад12. Этот тип сигнала связан в первую очередь с нейромедиатором фенотип спецификации13. В отличие от этого, "волны" определяются как медленнее, менее экстремальные переходные кальция, в которых внутриклеточная концентрация кальция клетки поднимается до 200% от исходного уровня в течение тридцати секунд или более, а затем распадается в течение нескольких минут12. Эти сигналы часто распространяются по нескольким соседним клеткам, и их присутствие было связано с невритом и пролиферацией клеток14,15. Однако, хотя эти два класса были определены на основе характерных кинетических профилей, остается неясным, какие именно характеристики этих моделей на самом деле обнаруживаются клетками и переводятся эффекторами вниз по течению.
Понимание взаимосвязи между внутриклеточными колебаниями кальция и экспрессией генов даст решающее представление об одном из регулятивных механизмов, обеспечивающих надлежащее развитие и узорирование нервной системы. С этой целью исследования эмбрионального спинного мозга показали, что повышенная активность всплеска кальция во время развития связана с более высокимуровней ингибирующих нейронов, в то время как снижение активности всплеска кальция связано с более высокими уровнями возбуждательных нейронов13. Однако эти анализы на уровне населения не использовались для ассоциированной активности кальция с экспрессией генов на одноклеточном уровне.
Подходкя к этим вопросам на уровне одной ячейки предлагает несколько явных преимуществ по сравнению с предыдущей работой. С одной стороны, способность оценивать активность кальция и экспрессию генов во многих клетках индивидуально позволяет наблюдать полный репертуар различных моделей активности, не будучи запутываемым измерением навалом. Кроме того, изучение этих отношений в одноклеточной первичной культуре означает, что клеточная автономная связь между активностью кальция и экспрессией генов будет сохранена, в то время как взаимодействия, требующие связи клеток, будут отменены. Таким образом, этот подход позволяет изучить эти клеточные механизмы в изоляции. Тем не менее, он также позволяет выяснить и допросить роль неклеточной активности кальция. Например, клетки могут быть расчленены из эмбриона на стадии нервной пластины, культивируется до тех пор, пока брат управления достичь стадии нервной трубки, а затем по сравнению с клетками, которые были недавно расчленены из нервной трубки стадии эмбриона. Это позволяет прямое сравнение клеток, которые сохранили связь клеток в ключевой период развития, с теми, в которых связь сотовой клетки была отменена.
Стремясь устранить ограничения предыдущих экспериментальных подходов, мы разработали протокол, который позволил бы оценивать как активность кальция, так и экспрессию генов в отдельных нейронных клетках-прародителях, облегчая корреляцию конкретных моделей активности с последующими программами дифференциации. Нейронная ткань была расчленена из Xenopus laevis на различных стадиях развития нервной системы, разделена на одиночные клетки и изображена с помощью конфокальной микроскопии в присутствии флуоресцентного индикатора кальция. После визуализации живых клеток, образцы были исправлены и анализировались с помощью флуоресценции на месте гибридизации (FISH) для обнаружения экспрессии гена или изоформы интереса. Важно отметить, что отдельные клетки могут быть отслежены в обоих экспериментах изображений, а это означает, что профиль активности кальция клетки и ее уровень экспрессии генов могут быть связаны друг с другом(Рисунок 1). Протокол сообщил здесь предназначен для зондирования взаимосвязи между структурой активности кальция и экспрессии генов через эмбриональной нейроразвития в Xenopus laevis. Тем не менее, более широкие экспериментальные рамки (одноклеточные временные изображения с последующим FISH и корегистрацией изображений) могут быть изменены и применены практически к любому типу клеток, флуоресцентному репортеру и гену, представляющим интерес.
протокол
Все работы с участием животных были выполнены в соответствии с протоколами, утвержденными Институциональным комитетом по уходу за животными и использованию (IACUC) в Колледже Уильяма и Мэри.
1. Уход за животными и обработка эмбрионов
- Индуцируйте естественное спаривание путем введения подкожной инъекции человеческого хорионического гонадотропина (HCG) в спинной лимфатический мешок взрослого Xenopus laevis в дозе 600 U для женщин и 400 U для мужчин.
- После инъекции поместите по крайней мере одного самца и одну самку лягушки в комнатно-температурный бак на ночь. Яйцекладка обычно начинается 9-12 ч после введения ХГЧ.
- Собирайте эмбрионы. Dejelly, аккуратно мыть с 2% цистеина (pH 8.0) в течение 2-4 мин.
- Промыть эмбрионы 3x в 0.1x Марк модифицированный Ringer's раствор (MMR) (100 мм NaCl, 2 мМ KCl, 1 мМ MgSO4, 2 мМ CaCl2, 5 мм HEPES, рН скорректированы до 7,4-7,6).
- Перенесите эмбрионы на 100 мм стекла Петри блюда, содержащие 0,1x MMR и 50 мкг /мл гентамицина. Плотность 50-100 эмбрионов на тарелку является целесообразным.
- Инкубировать блюда при 14 градусах Цельсия и позволить эмбрионам развиваться до тех пор, пока они не достигнут желаемой стадии развития (ы). Периодически удаляйте неоплодотрянные клетки и некротические или аномально развивающиеся эмбрионы с помощью пластиковой перекладины.
ПРИМЕЧАНИЕ: Для обеспечения согласованности, постановка развития осуществляется в соответствии с морфологическими критериями, определенными Nieuwkoop и Faber16. Этапы интереса будут варьироваться в зависимости от экспериментального фокуса. Например, ключевые ориентиры нейроразвития связаны с этапом 14 (начало нейруляции), этапом 18 (начало закрытия нервной трубки) и 22-й стадией (начало удлинения заднего бутона).
2. Вскрытие эмбрионов и подготовка образцов
- Подготовка решения
- Подготовьте 2 мМ Ca2' раствор, содержащий 116 мМ NaCl, 0,67 мМ KCl, 2 мМ CaCl22H2O, 1,31 мМ MgSO4и 4,6 мм Трис. Для каждого раствора 100 мл добавьте 1 мл пенициллина/стрептомицина (10 000 u/mL пенициллина; 10 000 мкг/мл стрептомицина). Отрегулируйте рН до 7,8 и фильтр-стерилизовать.
- Приготовьте раствор без кальция и магния (CMF), объединив 116 мМ NaCl, 0,67 мМ KCl, 4,6 мм Tris и 0,4 мм EDTA. Отрегулируйте рН до 7,8 и автоклав для стерилизации. Для каждого раствора 100 мл добавьте 1 мл пенициллина/стрептомицина (10 000 u/mL пенициллина; 10 000 мкг/мл стрептомицина). Отрегулируйте рН до 7,8 и фильтр-стерилизовать.
- Приготовление пластин для вскрытия и визуализации
- УФ-стерилизовать две 35 мм пластиковые блюда Петри и один 35 мм Сотовая культура Блюдо (см. Таблица материалов).
- Во время работы в ламинарном капоте, подготовить два 50 мл пластиковых конических труб, содержащих 10 мл 2 мМ Ca2 "решение каждый.
- Оставайтесь работающим в ламинарном капоте потока и добавьте 2 мл 2 мм 2 мм Ca2'раствор к одному 35 мм пластиковому блюду Петри, 2 мл 2 мМ Ca2'раствора к одному 35-мм блюду культуры клеток и 2 мл раствора CMF к одному 35-мм пластиковому блюду Петри.
- За пределами ламинарного капота заполните две 100-мм пластиковые блюда Петри и одну 35-мм пластиковую чашку Петри 0,1x MMR с гентамицином (50 мкг/мл). Заполните 60 мм пластиковые Петри блюдо с 70% этанола.
- Непосредственно перед вскрытием добавьте 0,01 г коллагеназы B в одну из 50-мл трубок, содержащих раствор Ca2. Хорошо перемешать и перенести раствор на свежее 60 мм пластиковое блюдо Петри.
- С помощью рассекающего микроскопа выявляют эмбрионы желаемой стадии развития. Используйте стерильную передачу пипетки для переноса по крайней мере шести подходящих эмбрионов на одну из 100-мм пластин, содержащих 0,1x MMR и гентамицин, подготовленный в шаге 2.2.4. Это будет служить в качестве удерживающих пластины.
- Используйте стерильную передачу пипетки для переноса одного эмбриона на вторую 100-мм пластину, содержащую 0,1x MMR и гентамицин. Это будет служить в качестве вскрытия пластины.
- При вскрытии эмбрионов достаточно стар, чтобы двигаться (приблизительно стадия 23 или старше), анестезируйте каждый эмбрион до вскрытия, передавая его в блюдо, содержащее 0,1% 3-аминобензоиновой кислоты этилового эфира, разбавленного в 0,1x MMR с гентамицином (50 мкг/мл). После того, как эмбрион обездвижен, перенесите его обратно в блюдо, содержащее 0.1x MMR с гентамицином (50 мкг/мл) и продолжайте вскрытие.
- Тщательно удалите вительлинную мембрану, которая окружает эмбрион. Это можно легко сделать с помощью пары тупых щипцы для стабилизации эмбриона при использовании пары тонких щипцы, чтобы захватить мембрану. Тщательно потяните с тонкими щипками, чтобы очистить вительлин мембраны друг от друга.
- Используйте тонкие щипцы, чтобы отделить дорсальные и брюшные области эмбриона. Это может быть сделано с помощью щипцы, чтобы "щепотку" эмбриона вдоль передней задней оси, разрезая его пополам. С помощью стерильной переносной пипетки перенесите сокровеную часть на 60-мм пластину с коллагенеза, приготовленным в шаге 2.2.5. Откажитесь от брюшной части.
- Разрешить дорсальный explant инкубировать в растворе коллагенеза в течение 1-2 мин при комнатной температуре. Аккуратно перенесите его обратно в пластину вскрытия.
- Завершите вскрытие, тщательно удалив все остаточные эндодермальные и мезодермальные загрязнения из предполагаемой нервной ткани эктодерма. Для эмбрионов на этапе 22 или старше, нейронная трубка также должна быть удалена и отбрасываются.
ПРИМЕЧАНИЕ: При необходимости во время вскрытия, блюдо 70% этанола, приготовленного в шаге 2.2.4, может быть использовано для очистки или повторной стерилизации щипц. - После того, как вскрытие завершено, аккуратно перенесите эксплант на 35-мм пластину раствора Ca2, подготовленного в шаге 2.2.3.
- Повторите шаги 2.4-2.9 до тех пор, пока не будут собраны четыре эксплантирований.
- Используйте микропайпет P1000 для передачи всех четырех экстенсов на 35-мм пластину, содержащую раствор CMF, заботясь о том, чтобы избежать контакта между экстенсами и интерфейсом воздушной воды. Аккуратно закружить блюдо так, чтобы все explants кластера в центре пластины.
- Инкубировать 1 ч при комнатной температуре, чтобы позволить эксламтам разъединяться.
ПРИМЕЧАНИЕ: Для помощи в диссоциации, 0,025%-0,01% трипсин может быть добавлен в решение CMF. Это может быть необходимо для эффективной диссоциации старых эмбрионов (этап 22 и старше). - На данный момент, по крайней мере два надлежащим образом поставил эмбрионы должны оставаться на пластине проведения. Перенесите эти эмбрионы в свежее блюдо, наполненное 0,1x MMR с гентамицином, приготовленным в шаге 2.2.4 и дайте им развиваться спокойно с блюдом, покрытым, чтобы соответствовать блюду explant. Эти эмбрионы будут служить в качестве братьев контроля.
- Используйте суперклей, чтобы прикрепить микро-управляемый coverslip (см. Таблица материалов)к нижней части 35 мм Cell Culture Блюдо подготовлено в шаге 2.2.3.
ПРИМЕЧАНИЕ: Поместите небольшие мазки суперклея по краям крышки, а затем нажмите его твердо против нижней части cell Culture Блюдо. Позиционная маркировка будет затемнена в любом месте клей контактов сетки, поэтому важно сохранить центральную сетку часть coverslip свободной от клея. - После того, как экспланты разъединяются в течение 1 ч, используйте микропайпет P100, чтобы передать их в Блюдо культуры клеток. Для того, чтобы пластины как можно больше клеток, как это возможно на сетке часть блюда, держать пипетку под неглубоким углом близко к поверхности блюда, положение пипетки наконечник в углу сетки лицом внутрь, и твердо изгнать ячейки подвески через сетки ар ea. В идеале клетки будут оседать в плотном плотном скоплении.
- Инкубировать в течение 1 ч при комнатной температуре, чтобы клетки придерживаться пластины. Определите и запишите стадию развития эмбрионов для контроля братьев и сестер, когда начинается эта инкубация.
- Смешайте 5 л 1 мм Фтор-4 AM (см. Таблица Материалов)с 2 qL 10% Pluronic F-127 кислоты.
ПРИМЕЧАНИЕ: Fluo-4 AM является светочувствительным и должен храниться в светобезопасной или фольги покрытые трубки во все времена. - После завершения инкубации переместите образец блюда в темную комнату или другое светозащищенное место. Используйте микропипетт, чтобы удалить 100 л раствора с края блюда. Добавьте это решение к aliquot Fluo-4 AM/Pluronic F-127 кислоты, пипетки вверх и вниз, чтобы смешать, и вернуть полный объем образца блюдо. Вихрь осторожно перемешать.
- Накройте тарелку алюминиевой фольгой и дайте инкубировать в течение 1 ч при комнатной температуре. Определите и запишите стадию развития эмбрионов для контроля братьев и сестер, когда начинается эта инкубация.
- В конце инкубации используйте оставшуюся коническую трубку 2 мМ Ca2, чтобы выполнить три медийных стирок следующим образом: 1) удалить 1 мл раствора из блюда, добавить 3 мл свежего раствора, 2) удалить 3 мл раствора из блюда, добавить 3 мл свежего раствора, 3 мл раствора.
3. Изображения кальция
ПРИМЕЧАНИЕ: Изображение кальция было выполнено с помощью перевернутого конфокального микроскопа(Таблица материалов).
- Поместите образец пластины на стадии микроскопа, заботясь, чтобы защитить его от воздействия окружающего света. После того, как пластина защищена, используйте маркер для обозначения передней точки пластины так, чтобы то же поле зрения можно найти в последующей визуализации.
- Найдите образец под микроскопом - сначала в 10X, а затем при увеличении 20X - и выберите соответствующее поле зрения для визуализации. Идеальное поле зрения является клеточным, но не настолько плотным, что клетки слипаются или трудно различить по отдельности.
- Отрегулируйте фокус микроскопа так, чтобы была видна управляемое сеткой крышка. Номера, отмеченные на обложке, служат уникальными идентификаторами для конкретного сетчатого локуса и могут использоваться для определения того же поля зрения для дополнительной визуализации. Если первоначально выбранное поле представления не пересекается с любыми числами, сыт по плану до тех пор, пока идентифицируемое число не будет в кадре.
- Возьмите ярко-поле изображение выбранного поля зрения с сеткой правилcoverslip в фокусе.
- Отрегулируйте настройки фокусировки и снизьте яркое поле выбранного поля зрения с помощью фокуса.
- С клеточным слоем в фокусе, осветить образцы с лазером 488 nm. Значения HV и Offset могут быть оптимизированы для каждого эксперимента, чтобы гарантировать, что динамический диапазон флуоресценции обнаружен на канале FITC.
- Для двухчасового изображения измените конфигурацию изображения для записи 901 кадров со временем сканирования 3,93 с и интервалом 8 s. Run конфигурации для получения изображения.
- Как только изображение завершено, удалите пластину со стадии микроскопа. Удалите 1 мл раствора из пластины и замените его 1 мл 2x MEMFA (200 мМ MOPS, 2 мМ EGTA и 2 мМ MgSO4 в 7,4% формальдегида).
- Инкубировать тарелку в течение 2 ч при комнатной температуре или на ночь при температуре 4 градусов по Цельсию. Определите и запишите стадию развития эмбрионов для контроля братьев и сестер, когда начинается эта инкубация.
- После завершения фиксации снимите все растворы с пластины и замените его 2 мл 1x PBS. Храните тарелки при 4 градусах по Цельсию для дальнейшей обработки.
4. Анализ экспрессии генов: Синтез зонда
- Как описано ниже, генерировать антисмысловую РНК-зонд для гибридизации in situ. Дополнительно, произвести зонд чувства для такого же гена для пользы как отрицательный контроль.
- Для очистки плазмидной ДНК, содержащей последовательность шаблонов зонда, прививать 150 мл бульона LB бактериальными глицеролом, содержащими шаблон плазмид. Инкубировать при 37 градусах Цельсия с тряской на ночь или до тех пор, пока культура не будет мутной.
- Очистите плазмидную ДНК от бактериальной культуры с помощью метода выбора.
ПРИМЕЧАНИЕ: Мы используем макнари-Нагель миди-подготовитель комплект для получения высоких урожаев плазмидной ДНК. - Чтобы подтвердить, что плазмида содержит ожидаемую вставку, выполните ограничение дайджест и проанализировать продукты на гель агарозы. Невырезанная плазмида также может быть проанализирована на геле агарозы, чтобы проверить наличие геномного загрязнения ДНК.
- Для линейной днк шаблона установите реакцию дайджеста с ограничением 100 л, содержащую 20 мкг плазмидной ДНК, 2 злитара соответствующего фермента ограничения и 1x соответствующий буфер. Инкубировать при 37 градусах По Цельсию не менее 2 ч.
- Извлекайте линейную ДНК, выполняя экстракцию фенола/хлороформа с последующей экстракции хлороформа.
- Осаждает ДНК 100% этанолом. Это можно сделать быстро, добавив два тома холодного этанола в образец и инкубируя его при -80 градусов по Цельсию, пока он не затвердеет (15-30 мин).
- Используйте охлажденный центрифугу для гранул ДНК, вращаясь в течение 20 мин при 12000 х г/4 градусов по Цельсию.
- Удалить супернатант и промыть гранулы с 200 зл 70% этанола. Спин в течение 5 мин при 12 000 х г/4 кв.
- Удалите супернатант и воздух-сухой гранулы в течение примерно 5 мин. Resuspend в 20 Зл 1x TE и хранить при 4 кв С до дальнейшего использования.
- Для синтеза и очистки антисмыслового зонда РНК создайте смесь rNTP объемом 2,5 мМ, объединив 15 мКм 10 мМ rCTP, 15 мКм rGTP, 15 л из 10 мМ rATP, 9,75 мМ rNTP, и 5,25 мЛ 10 м.
- Настройка реакции транскрипции 50 л, содержащей 4 мкг линейной ДНК шаблона с шага 4.2-4.10, 15 мЛ 2,5 мМ rNTP смесь от шага 4,11, 10 л 5x транскрипции буфера, 5 л 0,1 М DTT, 0,5 л ингибитора РНК (20 U / Л), и 1,5 л соответствующей РНК-полимеразы (T3, T7, или SP6). Инкубировать 1 ч при 37 градусах Цельсия.
- Добавьте дополнительные 1,5 л ПОЛимеразы РНК к реакции и вернитесь к 37 градусов по Цельсию в течение дополнительного часа.
- Добавьте 1 кЛ R-1 DNAse к реакции и инкубировать при 37 градусах по Цельсию в течение 10 минут, чтобы ухудшить шаблон ДНК.
- Добавьте 30 юл из 7,5 M LiCl раствор для образца. Пипетка смешивать и инкубировать при -20 градусов по Цельсию, по крайней мере 1 ч.
- Используя охлажденный центрифугу, вращайте образец 25 мин при 14 000 х г/4 градусов по Цельсию.
- Удалить супернатант и промыть гранулы с 500 зл и 70% этанола. Спин в течение 5 мин при 14000 х г/4 КС.
- Удалите супернатант и воздух-сухой гранулы в течение примерно 5 мин. Resuspend в 20 зл и безнущеки воды.
- Создать на 10x запас зонда, разбавляя образец до концентрации 10 нг / Л в гибридизации буфера (50% формамида, 5x SSC (солин-натриевый цитрат; 750 мМ NaCl, 75 мМ цитрат натрия, pH 7.0), 1 мг/мл торула РНК, 0,1 % Tween-20, 1x Денхардт решение, 0,1% CHAPS, 10 мМ EDTA, и 100 мкг/мл гепарин). Хранить при -20 градусов до дальнейшего использования.
5. Анализ экспрессии генов: Флуоресценция в гибридизации ситу
ПРИМЕЧАНИЕ: Все мойки должны быть выполнены примерно с 1 мл раствора с использованием стерильной, индивидуально обернутой передачи пипетки. Пипетка должна быть расположена на краю пластины при удалении или добавлении раствора, и мойки должны быть выполнены как можно более мягко, чтобы клетки не выбили из поверхности пластины и потерял.
- Удалить 1x PBS из пластины (от шага 3.10). Замените свежим 1x PBS и инкубировать 5 мин при комнатной температуре.
- Смешайте 25 мл 0,1 М триэтаноламин (pH 8.0) с 62,5 л уксусного ангидрида. Хорошо перемешать. Вымойте тарелку этим раствором в течение 10 мин.
- Вымойте тарелку 1x SSC в течение 5 мин.
- Вымойте пластину с 0,02 М HCl в течение 10 минут, чтобы проницательно клеток.
- Вымойте 2x с 1x PBS для 5 мин каждый.
- Удалить раствор и добавить 1 мл буфера гибридизации (50% формамида, 5x SSC (750 мМ NaCl, 75 мМ цитрат натрия, рН 7,0), 1 мг/мл торула РНК, 0,1% Tween-20, 1x Денхардт решение, 0,1% CHAPS, 10 мМ EDTA, и 100 мкг/мл гепарина) к пластине. Инкубировать с встряхиванием, по крайней мере 6 ч при 60 градусах Цельсия.
- Удалить буфер гибридизации и заменить 750 л 1x РНК-зонд решение (разбавленная форма 10x акции, сделанные в шаге 4.19. Чувство РНК зонды могут быть использованы в качестве отрицательного контроля.
- Инкубировать с встряхиванием в течение 8-14 ч при 60 градусах Цельсия.
- Снимите зонд и храните при -20 градусов по Цельсию.
ПРИМЕЧАНИЕ: 1x разбавления зонда могут быть повторно использованы до трех раз, прежде чем отбрасываются. - Промыть тарелку 0,2x SSC.
- Вымойте свежим 0,2x SSC на 1 ч при 60 градусах Цельсия.
- Переместите пластины до комнатной температуры и уравновешиваете в течение 5 мин.
- Вымойте тарелку 0,2x SSC в течение 5 мин.
- Вымойте тарелку 1x PBT в течение 15 мин.
- Вымойте тарелку с 2% H2O2 в 1x PBT (0,1% Тритон-x-100) за 1 ч.
ПРИМЕЧАНИЕ: Это решение является светочувствительным, поэтому оно должно быть свежим для каждого эксперимента и защищено от света. Плиты также должны быть защищены от света или фольги во время этой инкубации. - Вымойте тарелку 1x TBST (150 мм NaCl, 50 мм Tris-HCl, рН 7,5, 0,1%Tween-20) за 15 мин.
- Разбавлять блокирующий реагент до 2% в мужской кислоте (100 мм мужской кислоты, 150 мМ NaCl, рН 7.5). Блок клетки в этой смеси, по крайней мере 1 ч при комнатной температуре.
- Замените блокирующий раствор анти-дигоксигенин-POD антитела разбавленной 1:1,000 в 2% Блокирующий реагент в Maleic кислоты буфера. Инкубировать на ночь при 4 градусах Цельсия.
- Промыть пластину 3x с 1x TBST.
- Вымойте 4x с 2мл 1x TBST, по крайней мере 15 минут на стирку с непрерывным качания.
- Вымойте 2x с 1x PBT, по крайней мере 10 минут на стирку с непрерывным качания.
- Разбавить Cy3-конъюгированный тирамад 1:25 в 1x PBT. Вымойте тарелку с 750 л этого разбавления в течение 5 мин.
ПРИМЕЧАНИЕ: Это решение является чрезвычайно светочувствительным, и пластины должны быть сорваны или защищены от света на оставшуюся часть эксперимента, чтобы избежать ухудшения сигнала. - Добавьте к этому раствору 2,5 л 0,3% H2O2 и инкубируйте с непрерывным раскачиванием еще 40 минут при комнатной температуре.
- Вымойте 4x с 1x TBST, по крайней мере 15 минут на стирку с непрерывным качания.
- Промыть 1x ПБТ.
- Исправьте клетки, инкубируя 1 ч при комнатной температуре в 1x MEMFA (100 мМ МЭС, 1 мМ EGTA, и 1 мМ MgSO4 в 3,7% формальдегида).
- Удалите раствор и замените 1x PBS. Храните пластины в фольгированном контейнере при 4 градусах Цельсия до дальнейшей обработки.
6. Изображения клеток
ПРИМЕЧАНИЕ: Визуализация была выполнена с помощью перевернутого конфокального микроскопа.
- Поместите образец пластины на стадии микроскопа, выравнивание знака, сделанного в шаге 3.1 к передней части сцены.
- Сосредоточьте изображение так, чтобы облицовка сетки была видна, и, используя изображение сетки, сделанное в шаге 3.4 в качестве эталона, отрегулируйте поле зрения, чтобы соответствовать поле зрения, захваченное на изображении кальция (раздел 3).
- Приобретите яркие полевые изображения как сетки, так и ячеек.
- Осветите образцы лазером TRITC 595 нм. Отрегулируйте значения усиления, чтобы соответствующим образом отличить сигнал от фона, используя изображения от отрицательных контрольных ячеек, и приобрести неподвижное изображение.
ПРИМЕЧАНИЕ: В идеале, фоновые уровни флуоресценции определяются на основе отрицательной контрольной пластины, обрабатываемой параллельно с нетаргетационным зондом РНК.. Настройки усиления корректируются таким образом, чтобы эта пластина отображалась полностью черной (соответствующей фоновым уровням), а затем удерживалась постоянной для других пластин, изображенных из этой экспериментальной партии.
7. Обработка данных
ПРИМЕЧАНИЕ: Обработка данных осуществлялась с использованием программного обеспечения Nikon Elements.
- Откройте изображение кальция 2 ч от шага 3.7. Определите пикселей, соответствующие каждой отдельной ячейке, выбрав двоичные Убедитесь, что выбран канал FITC.
- Цветные круги появятся над отдельными ячейками после того, как этот слой будет создан. Отрегулируйте параметры распределения и размера ячейки таким образом, чтобы как можно больше клеток распознавались и ассоциировались с уникальным идентификатором.
- Отслеживайте клетки во всех кадрах изображения, перемещаясь по виду Установите 5 кадров в качестве максимального зазора между треками, удалите объекты, связанные с менее чем 600 кадрами, и выберите опцию «Закрыть пробелы». Выберите бинари Track, чтобы применить отслеживание ячейки к изображению.
- После того, как ячейки были отслежены, вручную удалите любой объект, который не соответствует отдельной ячейке (например, скопление ячеек). Однако точки данных не должны исключаться из дальнейшего анализа, основанного на морфологии следа активности кальция.
- На панели изображения, выберите Просмотр Наложения (gt; Показать идентификатор двоичного объекта. Прокрутите до конца изображения (Frame 901) и выберите Edit Это создаст снимок последнего кадра изображения с видимым бинарным идентификатором каждой ячейки. Сохранить это изображение.
- Экспорт данных временных рядов, выбрав все объекты, за которыми следуют данные об экспорте в Excel. Сохранить выход как файл CSV.
- Откройте изображение FISH. Оптимизируйте обнаружение точек, как в шагах 7.1-7.2, используя канал TRITC вместо канала FITC. Вручную удалите любые неправильно назначенные бинарные файлы, а затем выберите Автоматизированные результаты измерения ( и обновление измерения для расчета интенсивности сигнала каждой ячейки. Экспорт изображения моментального снимка и таблицы данных, повторяя шаги 7.5 и 7.6.
- Создайте электронную таблицу, где столбец А помечен как FISH Binary ID, а колонка B помечена как идентификатор кальция Binary ID. Откройте изображения, экспортированные в шагах 7.5 и 7.7. Для каждого объекта, идентифицированного на изображении FISH (шаг 7.7), запишите двоичный идентификатор в колонке А. Затем найдите соответствующую ячейку на изображении кальция (шаг 7.5) и запишите, что двоичный идентификатор в колонке B. Клетки, которые не могут быть уверенно идентифицированы в обоих изображениях, не должны быть добавлены в электронную таблицу.
ПРИМЕЧАНИЕ: Это может быть полезно использовать программу редактирования фотографий, такие как Adobe Photoshop или GIMP редактор изображений, чтобы открыть оба изображения, сделать один полупрозрачный, и наложить его на изображение партнера, чтобы легче определить и связать два двоичных идентиматологов, связанных с каждой ячейкой. - Для каждой идентифицированной клетки, сопрягать (либо вручную или со сценарием) свои временные ряды данных кальция (связанные с кальциевым двоичным идентификатором и экспортируется в шаге 7.6) и его данные экспрессии генов (связанные с BINARY ID FISH и экспортируется в шаге 7.7).
ПРИМЕЧАНИЕ: Вниз по течению обработки данных и анализа может включать в себя сопоставление этих данных в единую таблицу данных и применения массива аналитических методов, включая подсчет спаек, фрактальный анализ, и Марковская энтропия, которые позволяют следователю различить новые модели активности кальция 17,18.
Результаты
Успешный пример разъединенных клеток, подготовленных для визуализации кальция, можно увидеть на рисунке 2А. Клетки плотно покрыты, что позволяет максимальное количество информации, которое будет собрано с каждого изображения, но не так плотно покрыта, что отдельные клетки не могут быть уверенно отличаются форме друг друга. Флуоресценция обнаруживается для каждой определенной клетки в течение 2 ч периода изображения. Визуализация композитного участка, содержащего следы для всех клеток, записанных в эксперименте, показывает, в какой степени объемные или популяционные измерения могут скрывать более тонкие закономерности пикирования поведения(рисунок 2B). Когда записанные профили отдельных клеток изолированы, можно четко определить примеры нерегулярной активности пик, характерной для нейронных клеток-прародителей. В отличие от зрелых нейронов, эмбриональные нейронные клетки обладают нерегулярным, весьма изменчивым и сложным характером активности кальция(рисунок 2B). Для того, чтобы количественно эту сложность, применение различных методов анализа данных были применены17,18, в том числе различные параметры для определения всплеска(рисунок 2C).
Успешная флуоресценция на месте гибридизации, в том числе успешный дизайн и синтез антисмыслового зонда мРНК, можно оценить путем сравнения экспериментальной пластины на фоне управления инкубируется с необязательным чувством управления РНК (Рисунок 3A, B). Положительный контроль зонда также может быть выполнен путем обработки типа клеток, известных для выражения целевой мРНК на обнаруживаемых уровнях.
Идентификация одной и той же клетки через кальций и FISH изображений требует, чтобы клетки сохраняют примерно то же положение во время гибридизации зонда и обработки. Если пластины обрабатываются примерно или мойки выполняются слишком решительно, клетки могут быть выбиты из поверхности пластины и либо потеряли, когда решение отбрасывается или на хранение в другом месте на пластине, что делает невозможным для них, чтобы быть сопоставлены на изображениях (Рисунок 4A). Если это нарушение влияет только на некоторые из ячеек в поле зрения, все еще может быть возможно обнаружить и назначить некоторые клетки в изображении (Рисунок 4B). Тем не менее, максимальный объем данных, полученных в результате эксперимента, в котором FISH выполняется тщательно и несколько ячеек теряются или перемещаются между изображениями (Рисунок 4C).
После того, как данные были собраны для описания как активности кальция и экспрессии генов разумного числа клеток на стадии развития (ы) интерес, дальнейший анализ может быть выполнен для оценки корреляции между этими двумя функциями (Рисунок 1). Ряд метрик были применены для количественной оценки структуры активности кальция, в том числе подсчета шипов / частоты, средняя мощность, Херст экспонентной оценки, и Марковская энтропия измерения17,18. Выражение гена может быть количественно определено абсолютным уровнем флуоресценции или оценено по бинарной (да/нет) шкале, в зависимости от рассматриваемых экспериментальных вопросов.
Результаты экспериментов, сопожатактивность активности кальция с экспрессией нейронных генов маркера-прародителя, выявили многочисленные связи между специфическими паттернами активности кальция и нейромедиаторскими фенотипами. На стадии нервной пластины (Этап 14), ГАМК-клетки, выражающие ингибирующее нейрона маркер gad1.1 экспонат активности кальция, который является более регулярным и более высоким амплитудой, чем у клеток, которые не имеют gad1.1 выражение (Рисунок 5A). Кроме того, в то время как эти gad1.1-выражениеклетки связаны с более высоким уровнем высокой амплитуды spiking, с низкой амплитудой пики чаще в глутамерных клеток, выражающих возбуждающий нейрон маркер slc17a7.
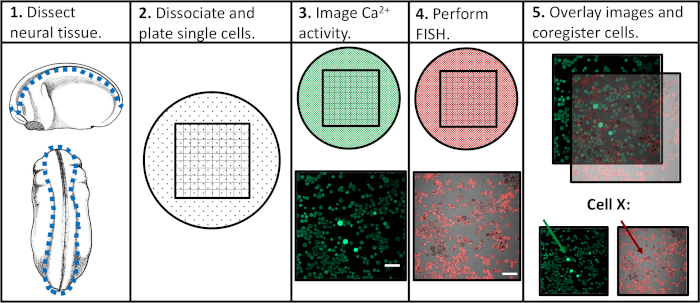
Рисунок 1: Схема экспериментального рабочего процесса. Шкала бар 100 мкм. Изображения в панелях 3-5 были взяты из Paudel et al. (2019)17. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
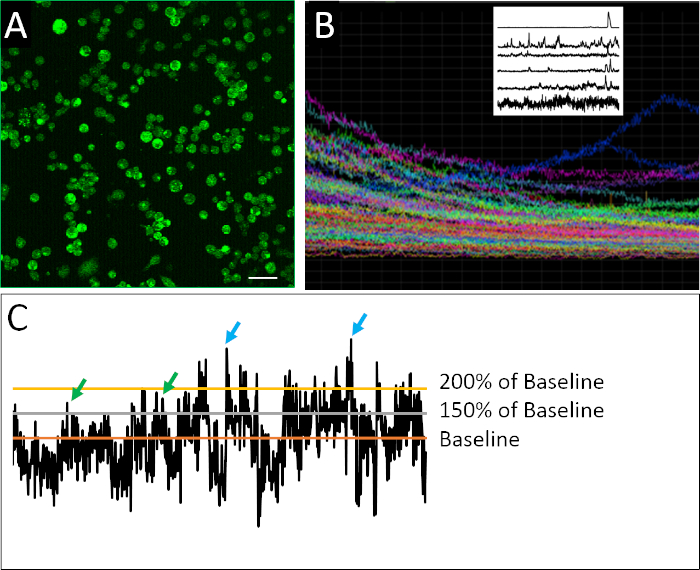
Рисунок 2: Изображения кальция и примеры профилей активности. (A) Внутриклеточная активность кальция, как сообщает Fluo4-AM. Каждое изображение 2 ч состоит из 901 кадров, с одним репрезентативным кадром. (B) Композитный участок интенсивности флуоресценции с течением времени во всех клетках в изображении поля зрения. Следы ясно указывают на фотоотраблирование красителя индикатора (Fluo4) сверхурочно. Raster участок на верхнем левом показывает репрезентативные следы активности кальция после применения де-трендового алгоритма, разработанного Эйлерс и Boelen19, где клетки, показанные здесь, демонстрируют различную модель пикового поведения. (C) Применение различных пороговых значений (150% и 200% от базового уровня, где базовым является среднее детрендового флуоресцентного интенсивности) для определения всплеска (зеленые и синие стрелки). Шкала бар 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
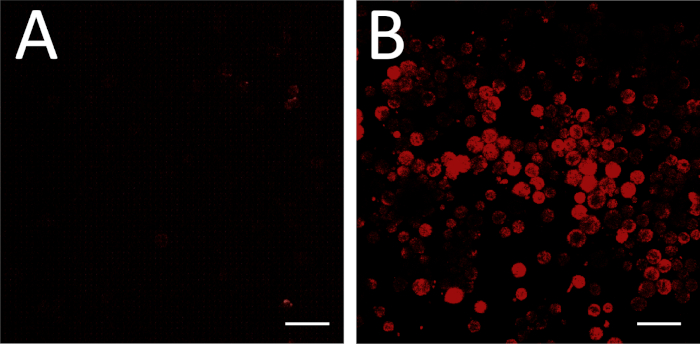
Рисунок 3: FISH изображений. (A) FISH выполняется с необязательным смысле РНК зонд в качестве отрицательного контроля. Настройки изображения были скорректированы таким образом, чтобы ни один из клеток не появлялся флуоресцентным. Некоторые поля зрения могут включать неклеточный мусор с некоторой флуоресценцией, например, в правом верхнем и нижнем углу (A); они могут быть проигнорированы с целью настройки фона. (B) Те же настройки изображения затем используются для изображения экспериментальной пластины (антисмыслОВого ЗОНДа РНК). Флуоресценция в этих условиях соответствует экспрессии гена выше фона. Шкала бар 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Наложение изображения и корегистрация. Схематические представления образца, изображенного для активности кальция (клетки, представленные заполненными зелеными кругами) и после FISH (клетки, представленные затененных красными кругами). (A)Клетки, которые значительно переместились во время обработки и обработки образцов, не могут быть надежно идентифицированы на двух изображениях. (B) Нарушение ячейки может повлиять только на некоторые ячейки в поле зрения. Некоторые клетки могут быть четко идентифицированы на обоих изображениях, в то время как другие не могут быть уверенно сопоставлены. (C) Если образцы обрабатываются тщательно, большинство клеток будет оставаться нетронутым и могут быть идентифицированы в обоих изображениях. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
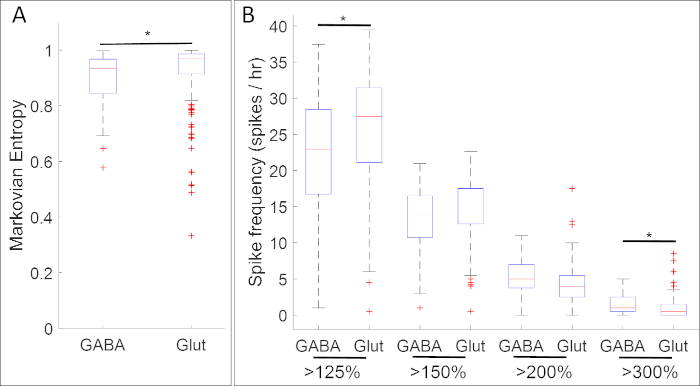
Рисунок 5: Пример применения этого метода, boxplots показаны ассоциации между активностью кальция и экспрессией гена (ГАМК и Glut для генов gad1.1 и slc17a7 соответственно) в нервной стадии пластины Xenopus laevis. На стадии 14, gad1.1-postive клеток (ГАМК) обладают более высокой амплитуды и более регулярной активности кальция, как это определено (A) Марковская энтропия18 и(B ) всплеск рассчитывает с помощью порогов 125%, 150%, 200% и 300% от среднего де-трендов флуоресцентной интенсивности (базовый)17, чем s1lc7. Звезды указывают на статистически значимые различия в соответствии с обоими Совторно-скорректированными двумя образцами Колмогорова-Смирнова (p'lt; 0.05) и статистикой Коэна d для размера эффекта (n no 5 культур и nogt;100 клеток; 0,2 Цифра была перерисована и адаптирована из набора данных, полученных от Paudel et al.17. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Характерные модели активности кальция наблюдались в клетках, которые составляют развивающуюся нервную систему, с конкретными видами деятельности, связанными с различными процессами нейроразвития. Однако дальнейшее понимание механизмов, с помощью которых эти информационно-плотные модели деятельности преобразуются в транскрипционные реакции, требует сбора информации о активности кальция и экспрессии генов с одноклеточным разрешением. В то время как системы, которые демонстрируют более стереотипную активность кальция, такие как зрелые нейроны, могут быть разумно анализированы на уровне навалом, нерегулярные модели, которые характеризуют эмбриональную нервную систему, легко маскируются менее точными записями.
Экспериментальная основа, созданная в этом протоколе, легко адаптируется к широкому спектру типов клеток и флуоресцентных репортеров. Ткань, содержащая практически любой тип клеток или комбинацию типов клеток, может быть расчленена из интересуемого модельного организма и покрыта для одноклеточной визуализации. В дополнение к разрешению идентификации клеток и изоляции эффекта клеточных процессов, подход первичной культуры клеток позволяет экспериментатору определять компоненты мультимедиа по желанию. Например, эксперименты, сравнивающие активность нейрональных прекурсоров в 2 мМ Ca2 "решение были выполнены, чтобы исследовать, является ли связь между частотой всплеска и нейромедиатора фенотипа в эмбриональном спинном мозге могут быть recapitulated без влияния клеток-клеток взаимодействия13,20.
В то время как этот протокол использует флуоресцентный маркер Fluo4-AM для обнаружения внутриклеточной активности кальция, в зависимости от критериев отбора, пользователи могут выбрать другие коммерчески доступные маркеры21, включая генетически закодированные показатели кальция. Аналогичным образом, альтернативные маркеры могут быть использованы для мониторинга динамических изменений в концентрации иона интереса (в том числе Kq,Na, и "N2"), мембранный потенциал, или клеточный рН. Настройки изображения и продолжительность изображения могут быть изменены по мере необходимости.
Хотя мы коррелировали активность кальция и нейрональный фенотип в качестве конкретного приложения, этот метод также применим для целого ряда других клеточных свойств. Например, флуоресценция на месте гибридизации может быть выполнена с зондами против любого гена интереса, в том числе нейронов маркер АТ или транскрипции фактор Engrailed, что позволяет чувствительное обнаружение настраиваемой панели мРНК видов. Эти зонды могут быть разработаны, чтобы быть изоформным, поддерживая дополнительную целевую специфику при желании. Двойной FISH может быть выполнен с помощью зондов, спряжение нескольких различных флюорофоров, что позволяет одновременной оценки экспрессии нескольких генов. Тем не менее, дополнительные стир, требуемые этим типом эксперимента, связаны с повышенным шансом потери клеток или движения и требуют опыта и деликатности, которые должны быть выполнены успешно.
Независимо от каких-либо конкретных изменений, внесенных в этот протокол, есть несколько ключевых шагов, которые требуют пристального внимания. Вскрытие должно проводиться с осторожностью, чтобы удалить все загрязняющие ткани или популяции клеток; потому что пространственное узор теряется, когда экспланты разобщены, все оставшиеся клетки из соседних тканей будут перемежаться с и неотличимы от клеток, представляющих интерес. После того, как клетки покрыны, образцы должны быть обработаны как можно более мягко, чтобы предотвратить клетки от выбива. Самое главное, это означает, что все изменения решения должны быть выполнены медленно и осторожно, с пипеткой, помещенной на краю пластины, когда раствор удаляется и добавляется. Это гарантирует, что клетки могут быть уверенно определены в кальций и FISH изображения. Если клетки нарушаются во время обработки, может быть невозможно определить некоторые или все соответствующие ячейки между двумя изображениями. Мы советуем замешательствовать на стороне осторожности с этими назначениями, таким образом, что только однозначно соответствующие клетки используются для дальнейшего анализа.
В зависимости от рассматриваемого биологического вопроса может быть целесообразным провести целый ряд подходов к анализу. Активность кальция временных рядов может обрабатываться и количественно определяться различными способами, при этом гибкость экспериментатора в выборе параметров, определяющих тенденции, метрик и параметров анализа (например, процент от базового порога, используемого для определения всплеска кальция). Корреляции между активностью кальция и уровнем экспрессии генов можно нарисовать путем анализа экспрессии генов как абсолютного или относительного значения флуоресценции, извлеченного из изображения FISH. Кроме того, корреляции между активностью кальция и экспрессией генов (присутствие/отсутствие) можно нарисовать путем определения порога флуоресценции для положительного сигнала экспрессии генов и присвоения идентификаторам "да" или "нет" отдельным клеткам. В целом, эта экспериментальная схема обеспечивает невероятно гибкий конвейер для сбора и предварительного анализа данных временных рядов в сочетании с клеточными данными экспрессии генов. Такие эксперименты будут иметь решающее значение для лучшего понимания сложных взаимосвязей между клеточной динамикой и транскрипционными изменениями, о чем свидетельствует выявление моделей активности кальция, характерных для ингибирующих сужденотелых и возбуждающих нейронных прекурсоров в эмбриональных Xenopus laevis.
Раскрытие информации
Конфликта интересов не было заявлено.
Благодарности
Мы благодарим Венди Хербст и Линдси Шлейфер за их вклад в разработку этих протоколов. Эта работа была поддержана грантами Национальных институтов здравоохранения (1R15NS067566-01, 1R15HD077624-01 и 1R15HD096415-01) для MSS.
Материалы
| Name | Company | Catalog Number | Comments |
| For Animal Husbandry & Cell Culture | |||
| CHORULON (chorionic gonodotropin) | Merck Animal Health | ||
| Gentamycin sulfate salt | Millipore Sigma | G1264 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Pyrex petri dishes, 100 mm x 20 mm | Millipore Sigma | CLS3160102 | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 35mm | Fisher Scientific | 08-772A | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 60mm | Fisher Scientific | 08-772F | |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | |
| Thermo Scientifc Nunc Cell Culture / Petri Dishes, 35x10mm Dish, Nunclon Delta | Fisher Scientific | 12-565-90 | |
| Fisherbrand Standard Disposable Transfer Pipettes, Nongraduated; Length: 5.875 in.; Capacity: 7.7 mL | Fisher Scientific | 13-711-7M | |
| Ethyl 3-aminobenzoate methanesulfonate | Millipore Sigma | E10521 | |
| Collagenase B | Millipore Sigma | 11088807001 | |
| Dumont #55 Forceps, Dumostar | Fine Science Tools | 11295-51 | |
| Dumont #5 Forceps, Dumostar | Fine Science Tools | 11295-00 | |
| Cellattice Micro-Ruled Cell Culture Surface | Nexcelom Bioscience | CLS5-25D-050 | |
| For Calcium Imaging | |||
| Fluo-4, AM, cell permeant | Thermo Fisher Scientific | F14201 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | Thermo Fisher Scientific | P6866 | |
| For RNA Probe Generation | |||
| PureYield Plasmid Miniprep System | Promega | A1222 | |
| rATP | Promega | P1132 | |
| rCTP | Promega | P1142 | |
| rGTP | Promega | P1152 | |
| rUTP | Promega | P1162 | |
| Digoxigenin-11-UTP | Millipore Sigma | 3359247910 | |
| Rnase Inhibitor | Thermo Fisher Scientific | N8080119 | |
| T3 RNA Polymerase | Promega | P2083 | |
| T7 RNA Polymerase | Promega | P2075 | |
| SP6 RNA Polymerase | Promega | P1085 | |
| RQ1 Rnase-Free Dnase | Promega | M6101 | |
| LiCl Precipitation Solution (7.5 M) | Thermo Fisher Scientific | AM9480 | |
| For Fluorescence In Situ Hybridization | |||
| Acetic Anhydride | Thermo Fisher Scientific | 320102 | |
| Blocking Reagent | Millipore Sigma | 11096176001 | |
| Anti-Digoxigenin-POD, Fab fragments | Millipore Sigma | 11207733910 | |
| Cy3 Mono-Reactive NHS Ester | Millipore Sigma | GEPA13105 | |
| Solution Components | |||
| Calcium chloride, 96% extra pure, powder, anhydrous, ACROS Organixs | Fisher Scientific | AC349610 | |
| Calcium chloride dihydrate | Millipore Sigma | C3306 | |
| CHAPS hydrate | Millipore Sigma | C3023 | |
| Denhardt's Solution (50X) | Thermo Fisher Scientific | 750018 | |
| DTT, Molecular Grade (DL-Dithiothreitol) | Promega | P1171 | |
| Ethylenediaminetetraacetic Acid, Disodium Salt Dihydrate | Fisher Scientific | S311 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid | Millipore Sigma | E3889 | |
| Formamide (Deionized) | Thermo Fisher Scientific | AM9342 | |
| Herparin sodium salt from porcine intestinal mucosa | Millipore Sigma | H3393 | |
| HEPES (Ultra Pure) | Thermo Fisher Scientific | 11344041 | |
| Hydrogen peroxide solution | Millipore Sigma | H1109 | |
| L-Cysteine | Millipore Sigma | 168149 | |
| Magnesium chloride, pure, ACROS Organics | Fisher Scientific | AC223211000 | |
| Magnesium sulfate, 97% pure, ACROS Organixs, anhydrous | Fisher Scientific | AC413480050 | |
| Maleic Acid, 99%, ACROS Organics | Fisher Scientific | ACS125231000 | |
| MOPS (Fine White Crystals/Molecular Biology), Fisher BioReagents | Fisher Scientific | BP308 | |
| Potassium chloride | Millipore Sigma | P9541 | |
| Ribonucleic acid from torula yeast, Type IX | Millipore Sigma | R3629 | |
| Sodium chloride | Millipore Sigma | S7653 | |
| Triethanolamine | Millipore Sigma | 90279 | |
| Tris | Millipore Sigma | GE17-1321-01 | |
| TWEEN 20 | Millipore Sigma | P9416 | |
| Equipment | |||
| Laminar Flow Hood | model of choice | ||
| Dissecting Microscope | model of choice | ||
| Inverted Fluorescence Microscope | Nikon | TE200 | |
| NIS-Elements Imaging Software | Nikon | ||
| Shaking Incubator | model of choice | ||
| Refrigerated Centrifuge | model of choice | ||
| Miscellaneous | |||
| Corning bottle-top vaccum filter system, 0.22 μm pore, 500 mL bottle capacity | Millipore Sigma | CLS430769 | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 |
Ссылки
- Humeau, J., et al. Calcium signaling and cell cycle: Progression or death. Cell Calcium. 70, 3-15 (2017).
- Kim, J. M., Lee, M., Kim, N., Heo, W. D. Optogenetic toolkit reveals the role of Ca2+ sparklets in coordinated cell migration. PNAS. 112 (21), 5951-5957 (2016).
- Orrenius, S., Zhivotovsky, B., Nicotera, P. Regulation of cell death: the calcium-apoptosis link. Nature Reviews Molecular Cell Biology. 4 (7), 552-565 (2003).
- Pham, K., et al. Ca2+ and Mg2+ module conformational dynamics and stability of downstream regulatory element antagonist modulator. Protein Science. 24 (5), 741-751 (2015).
- Smedler, E., Uhlén, P. Frequency decoding of calcium oscillations. Biochimica et Biophysica Acta. 1840 (3), 964-969 (2014).
- Moreau, M., Néant, I., Webb, S. E., Miller, A. L., Riou, J. F., Leclerc, C. Ca(2+) coding and decoding strategies for the specification of neural and renal precursor cells during development. Cell Calcium. 59 (2-3), 75-83 (2016).
- Tomida, T., Hirose, K., Takizawa, A., Shibasaki, F., Iino, M. NFAT functions as a working memory of Ca2+ signals in decoding Ca2+ oscillation. EMBO. 22 (15), 3825-3832 (2003).
- Hannanta-Anan, P., Chow, B. Y. Optogenetic Control of Calcium Oscillation Waveform Defines NFAT as an Integrator of Calcium Load. Cell Systems. 2 (4), 283-288 (2016).
- Li, L., Stefan, M. I. Le Novère N. Calcium input frequency, duration and amplitude differentially module the relative activation of calcineurin and CaMKII. PLoS One. 7 (9), 43810(2012).
- Romano, D. R., Pharris, M. C., Patel, N. M., Kinzer-Ursem, T. L. Competitive tuning: Competition's role in setting the frequency-dependence of Ca2+-dependent proteins. PLoS Computational Biology. 13 (11), 1005820(2017).
- Pharris, M. C., Patel, N. M., Kinzer-Ursen, T. L. Competitive Tuning Among Ca2+/Calmodulin-Dependent Proteins: Analysis of in silico Model Robustness and Parameter Variability. Cellular and Molecular Bioengineering. 11 (5), 353-365 (2018).
- Gu, X., Olson, E. C., Spitzer, N. C. Spontaneous neuronal calcium spikes during early differentiation. Journal of Neuroscience. 14 (11), 6325-6335 (1994).
- Borodinsky, L. N., Root, C. M., Cronin, J. A., Sann, S. B., Gu, X., Spitzer, N. C. Activity-dependent homeostatic specification of transmitter expression in embryonic neurons. Nature. 429 (6991), 523-530 (2004).
- Ciccolini, F., Collins, T. J., Sudhoelter, J., Lipp, P., Berridge, M. J., Bootman, M. D. Local and Global Spontaneous Calcium Events Regulate Neurite Outgrowth and Onset of GABAergic Phenotype during Neural Precursor Differentiation. Journal of Neuroscience. 23 (1), 103-111 (2003).
- Weissman, T. A., Riquelme, P. A., Ivic, L., Flint, A. C., Kriegstein, A. R. Calcium Waves Propagate through Radial Glial Cells and Modulate Proliferation in the Developing Neocortex. Neuron. 43 (5), 647-661 (2004).
- Nieuewkoop, P. D., Faber, J. The stages of Xenopus embryonic development. Normal Table of Xenopus laevis. , North Holland Publishing Company. (1994).
- Paudel, S., et al. Calcium Activity Dynamics Correlate with Neuronal Phenotype at a Single Cell Level and in a Threshold-Dependent Manner. International Journal of Molecular Science. 20 (8), 1880(2019).
- Marken, J. P., et al. A Markovian Entropy Measure for the Analysis of Calcium Activity Time Series. PLoS One. 11 (12), 0168342(2016).
- Eilers, P. H. C., Boelens, H. F. M. Baseline Correction with Asymmetric Least Squares Smoothing. Leiden University Medical Centre Report. , (2005).
- Guemez-Gamboa, A., et al. Non-cell-autonomous mechanism of activity-dependent neurotransmitter switching. Neuron. 82 (5), 1004-1016 (2014).
- Paredes, R., Madelaine,, et al. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены