Method Article
Xenopus laevis'te Nöronal Öncül Karakterizasyonu için Floresan Kalsiyum Görüntüleme ve Daha Sonra Yerinde Hibridizasyon
Bu Makalede
Özet
Floresan kalsiyum görüntülemeile in situ hibridizasyonunu birleştiren ve deneycinin kalsiyum aktivitesi modellerini tek hücreli düzeyde gen ekspresyonu profilleriyle ilişkilendirmesine olanak tanıyan iki parçalı bir protokol salıyoruz.
Özet
Spontan hücre içi kalsiyum aktivitesi çeşitli hücre tiplerinde görülebilir ve çeşitli fizyolojik süreçlerde kritik roller oynaması önerilmektedir. Özellikle, embriyogenez sırasında kalsiyum aktivite kalıplarının uygun düzenlenmesi uygun nöral tüp kapatma, sinaptogenez ve nörotransmitter fenotip özellikleri de dahil olmak üzere omurgalı nöral gelişim, birçok yönü için gereklidir. Kalsiyum aktivite kalıplarının hem frekans hem de genlik açısından farklılık gösterdiği gözlem, bu aksların kodlanmış sinyalleri aşağı akım efektörlerine iletebileceği ve gen ekspresyonunu düzenleyebileceği zorlayıcı bir mekanizmayı işaret etse de, mevcut nüfus düzeyindeki yaklaşımlar bu olasılığı daha fazla araştırmak için gereken hassasiyetten yoksundur. Ayrıca, bu yaklaşımlar hücre-hücre teması yokluğunda nöronal tayini devlet tayini yeteneği engelleyerek hücre-hücre etkileşimlerinin rolü çalışmaları sınırlamak. Bu nedenle, dissociated nöronal eksplorasyonların zaman atlamalı kalsiyum görüntülemesini yerinde hibridizasyon analizinde bir floresan ile eşleştiren deneysel bir iş akışı oluşturduk ve kalsiyum aktivite deseninin moleküler tek hücredüzeyinde fenotip. Bu yaklaşımı, sırasıyla nöral hücreler ve nöral progenitor hücreleri ayırt etmek ve karakterize etmek için başarılı bir şekilde kullanabildik; bunun ötesinde, ancak, bu makalede açıklanan deneysel çerçeve kolayca herhangi bir zaman serisi aktivite profili ve bir gen veya ilgi genlerin ekspresyonu arasındaki korelasyonları araştırmak için uyarlanabilir.
Giriş
Serbest sitozolik kalsiyum, hücre çoğalması ve apoptosis ve otofaji1,2,3arasında değişen biyolojik süreçler çeşitli için önemlidir. Bu yollar içinde, kalsiyum protein aktivitesi ve etkileşimleri modüle konformasyonel değişiklikler eneden kalsiyum bağlayıcı etki alanları ile etkileşim egörebilirsiniz gen ekspresyonu üzerinde downstream etkileri uygulayabilirsiniz. Örneğin, Downstream Düzenleyici Element Antagonist Modulator (DREAM) olarak bilinen bir nöronal kalsiyum sensörü, kalsiyum ile bağlı olduğunda açılmamış bir ara konformasyon tutulur, onun protein ve DNA hedefleri ile etkileşimi engelleyen4. Basit bir sinyal molekülü olarak hizmet ötesinde, ancak, hücre içi kalsiyum geçici dinamik doğası bu aktivite desenleri daha karmaşık genlik kodlamak için izin verir- veya frekans tabanlı sinyalleri5,6. Aktive T-hücrelerinin transkripsiyon faktörü nükleer translokasyon (NFAT) yüksek frekanslı kalsiyum salınımları ile geliştirilmiş ancak düşük frekanslı salınımlar tarafından inhibe7. Zorlayıcı, son çalışma NFAT aslında kümülatif kalsiyum maruziyeti8yanıt verebilir ileri sürmüştür. Hem kalsinurin ve Ca2 +/ calmodulin bağımlı protein kizide II (CaMKII) da belirli bir frekans, süre veya genlik kalsiyum geçici farklı tepkiler sergiler9. Düzenleyici karmaşıklık ek bir düzey eklemek için, hesaplamalı modeller birçok downstream kalsiyum bağlayıcı proteinler inaktif proteinlerin varlığı veya bağlayıcı rakiplerin yokluğuna yanıt olarak daha fazla veya daha az frekansa bağımlı haleöneririz 10,11.
Gelişen sinir sistemi içinde, kalsiyum aktivite davranışlarının iki ana sınıf tanımlanmış ve belirli biyolojik süreçler ile ilişkili. Kalsiyum akınları, tek tek hücreler içinde meydana gelirse , beş saniye içinde bazal ~ % 400 bir pik yoğunluğuna ulaşmak ve çift üstel çürüme12sergileyen "sivri" olarak sınıflandırılır. Sinyal Bu tür öncelikle nörotransmitter fenotip özellikleri ile ilişkilidir13. Buna karşılık, "dalgalar" bir hücre içi kalsiyum konsantrasyonu otuz saniye veya daha fazla bir süre içinde bazal ~ % 200 yükselir, daha sonra birkaç dakika12üzerinde bozunur yavaş, daha az aşırı kalsiyum geçici olarak tanımlanır. Bu sinyaller genellikle birden fazla komşu hücreler arasında yayılır ve onların varlığı nötrit büyüme ve hücre çoğalması ile ilişkili olmuştur14,15. Ancak, bu iki sınıf karakteristik kinetik profillere göre tanımlanmış olsa da, bu desenlerin hangi özelliklerinin aslında hücreler tarafından algılandığı ve aşağı akım efektörleri tarafından tercüme edildiği tam olarak belirsizliğini korumaktadır.
Hücre içi kalsiyum salınımları ile gen ekspresyonu arasındaki ilişkinin anlaşılması, sinir sisteminin uygun gelişimini ve desenlemesini sağlayan düzenleyici mekanizmalardan birine önemli bir bakış açısı sağlayacaktır. Bu amaçla, embriyonik omurilik çalışmaları geliştirme sırasında artan kalsiyum başak aktivitesi inhibitör nöronların daha yüksek seviyeleri ile ilişkili olduğunu göstermiştir, azalmış kalsiyum başak aktivitesi uyarıcı nöronların daha yüksek seviyeleri ile ilişkili iken13. Ancak, bu popülasyon düzeyindeki tahliller kalsiyum aktivitesini tek hücredüzeyinde gen ekspresyonu ile ilişkilendirmek için kullanılmamıştır.
Bu sorulara tek hücre düzeyinde yaklaşmak önceki çalışmalara göre birkaç farklı avantaj sunar. İlk olarak, birçok hücredeki kalsiyum aktivitesini ve gen ekspresyonunu tek tek değerlendirebilme yeteneği, toplu seviye ölçümü ile gizlenmeden farklı aktivite kalıplarının tam repertoiresinin gözlenmesini sağlar. Ayrıca, bu ilişkilerin tek hücreli birincil kültürde incelenmesi, kalsiyum aktivitesi ile gen ekspresyonu arasındaki hücre özerk bağlarının korunacağı, hücre-hücre iletişimini gerektiren etkileşimlerin ortadan başlayacağı anlamına gelir. Bu nedenle, bu yaklaşım bu hücre özerk mekanizmaları izole çalışılmasına olanak sağlar. Ancak, aynı zamanda hücre özerk olmayan kalsiyum aktivitesinin rolünün açıklığa kavuşturulmasını ve sorgulanmasını sağlar. Örneğin, hücreler nöral plaka aşamasında bir embriyo dan kesilebilir, kardeş kontrolleri nöral tüp aşamasına ulaşana kadar kültürlü, ve daha sonra yeni bir nöral tüp aşamasından embriyo dan parçalanmış olan hücrelerle karşılaştırıldığında. Bu, hücre-hücre iletişiminin önemli bir gelişim dönemi boyunca tuttuğu hücrelerin hücre-hücre iletişiminin kaldırıldığı hücrelerle doğrudan karşılaştırılmasına olanak tanır.
Önceki deneysel yaklaşımların sınırlamalarını ele almak amacıyla, bireysel nöral progenitör hücrelerinde hem kalsiyum aktivitesinin hem de gen ekspresyonunun değerlendirilmesini sağlayacak ve belirli aktivite kalıplarının sonraki farklılaşma programları ile korelasyonunu kolaylaştıracak bir protokol geliştirdik. Nöral doku, nöral gelişimin çeşitli aşamalarında Xenopus laevis'ten kesildi, tek hücrelere bölündü ve floresan kalsiyum indikatunun varlığında konfokal mikroskopi ile görüntülendi. Canlı hücre görüntülemesinin ardından, numuneler bir genin veya ilginin izoformunu saptamak için floresan ile yerinde hibridizasyon (FISH) ile tespit edildi. Daha da önemlisi, her iki görüntüleme deneyi boyunca tek tek hücreler izlenebilir, yani bir hücrenin kalsiyum aktivite profili ve gen ekspresyonu düzeyi birbiriyle ilişkilendirilebilir(Şekil 1). Burada bildirilen protokol, Xenopus laevis'teembriyonik nörogelişim boyunca kalsiyum aktivite kalıpları ile gen ekspresyonu arasındaki ilişkileri araştırmak için tasarlanmıştır. Ancak, daha geniş deneysel çerçeve (FISH ve görüntü ortak kaydı nın ardından tek hücreli zaman-kurs görüntüleme) değiştirilebilir ve hemen hemen her hücre tipine, floresan muhabire ve ilgi genine uygulanabilir.
Protokol
Hayvanları içeren tüm çalışmalar, William ve Mary Koleji'ndeki Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanan protokollere uygun olarak gerçekleştirilmiştir.
1. Hayvan Bakımı ve Embriyo Kullanımı
- Yetişkin Xenopus laevis dorsal lenf kesesi içine insan koryonik gonadotropin bir deri altı enjeksiyon (HCG) uygulayarak doğal çiftleştirme indüklemek 600 U bir dozda kadınlar için ve 400 U erkekler için.
- Enjeksiyondan sonra, bir gece boyunca oda sıcaklığında tutma tankına en az bir erkek ve bir dişi kurbağa yerleştirin. Yumurtlama genellikle HCG uygulamasından sonra 9-12 saat başlar.
- Embriyoları topla. 2-4 dk için % 2 sistein (pH 8.0) ile hafifçe yıkanarak dejelly.
- Embriyoları 0,1x Mark'ın Modifiye Ringer çözeltisi (MMR) (100 mM NaCl, 2 mM KCl, 1 mM MgSO4, 2 mM CaCl2,5 mM HEPES, pH 7.4-7.6'ya ayarlanmış olarak durulayın.
- Embriyoları 0.1x MMR ve 50 μg/mL gentamisin içeren 100 mm cam Petri kaplarına aktarın. Plaka başına 50-100 embriyo yoğunluğu uygundur.
- 14 °C-22°C'de kuluçkaya yatve embriyoların istenilen gelişim evresine ulaşınceye kadar gelişmelerine izin verin. Periyodik olarak döllenmemiş hücreleri ve nekrotik veya anormal bir plastik transfer pipet ile embriyolar gelişmekte kaldırmak.
NOT: Tutarlılık sağlamak için Nieuwkoop ve Faber16tarafından tanımlanan morfolojik kriterlere göre gelişimsel evreleme yapılmaktadır. İlgi aşamaları deneysel odaklamaya bağlı olarak değişir. Örneğin, önemli nörogelişimsel yapılar Evre 14 (nörülasyon başlangıcı), Evre 18 (nöral tüp kapatma başlangıcı) ve Evre 22 (tailbud uzaması başlangıcı) ile ilişkilidir.
2. Embriyo Diseksiyon ve Örnek Hazırlama
- Çözüm hazırlama
- 116 mM NaCl, 0,67 mM KCl, 2 mM CaCl2·2H2O, 1,31 mM MgSO4ve 4,6 mM Tris içeren 2 mM Ca2+ çözelti hazırlayın. Her 100 mL çözelti için 1 mL penisilin/streptomisin (10.000 U/mL penisilin; 10.000 μg/mL streptomisin) ekleyin. pH'ı 7.8'e ayarlayın ve filtresterilize edin.
- 116 mM NaCl, 0,67 mM KCl, 4,6 mM Tris ve 0,4 mM EDTA'yı birleştirerek kalsiyum ve magnezyumsuz (CMF) çözelti hazırlayın. Sterilize etmek için pH'ı 7.8'e ayarlayın ve otoklav. Her 100 mL çözelti için 1 mL penisilin/streptomisin (10.000 U/mL penisilin; 10.000 μg/mL streptomisin) ekleyin. pH'ı 7.8'e ayarlayın ve filtresterilize edin.
- Diseksiyon ve görüntüleme için plakaların hazırlanması
- UV-sterilize iki 35 mm plastik Petri yemekleri ve bir 35 mm Hücre Kültür Çanak (Malzeme Tablosubakınız).
- Laminar akış kaputunda çalışırken, her biri 10 mL 2 MM Ca2+ çözelti içeren iki adet 50 mL plastik konik tüp hazırlayın.
- Laminar akış kaputunda çalışmaya devam edin ve bir 35 mm plastik Petri kabına 2 mL 2 mM Ca2+ çözelti, bir adet 35 mm Hücre Kültürü Kabına 2 mL 2 mL Ca2+ çözelti ve 35 mm plastik Petri kabına 2 mL CMF çözelti ekleyin.
- Laminar akış kaputunun dışında, iki adet 100 mm plastik Petri kabı ve bir adet 35 mm plastik Petri kabını 0,1 x MMR ve gentamisin (50 μg/mL) doldurun. 60 mm plastik Petri kabını %70 etanolle doldurun.
- Diseksiyondan hemen önce, Ca2+ çözeltisi içeren 50 mL tüpten birine 0,01 g Kollajenaz B ekleyin. İyi bir şekilde karıştırın ve çözeltiyi 60 mm'lik taze plastik Petri kabına aktarın.
- Bir diseksiyon mikroskobu yardımıyla, istenilen gelişim aşamasında embriyoları tanımlayın. Adım 2.2.4'te hazırlanan 0.1x MMR + gentamisin içeren 100 mm plakadan birine en az altı uygun embriyo aktarmak için steril transfer pipetkullanın. Bu tutma plakası olarak hizmet edecektir.
- Bir embriyoyu 0,1x MMR + gentamisin içeren ikinci 100 mm plakaya aktarmak için steril transfer pipetkullanın. Bu diseksiyon plakası olarak hizmet edecektir.
- Embriyoların hareket edecek kadar yaşlı olması (yaklaşık evre 23 veya daha büyük), her embriyoyu diseksiyondan önce , 0,1% 3-aminobenzoik asit etil ester içeren bir çanağa transfer ederek anestezi kelebeğin 0.1x MMR'de gentamisin (50 μg/mL) ile seyreltilir. Embriyo hareketsiz hale getirildikten sonra, 0.1x MMR içeren tabağa gentamisin (50 g/mL) ile geri aktarın ve diseksiyona devam edin.
- Dikkatle embriyo çevreleyen vitellin membran kaldırın. Bu en kolay membran kavramak için ince forceps bir çift kullanırken embriyo stabilize etmek için künt forceps bir çift kullanılarak yapılabilir. Vitellin membranını ayırmak için ince pratisyen etlerle dikkatlice çekin.
- Embriyonun dorsal ve ventral bölgelerini ayırmak için ince çerkesler kullanın. Bu ön-posterior ekseni boyunca embriyo 'çimdik' için çaksiler kullanılarak yapılabilir, yarısında kesme. Steril transfer pipeti ile dorsal kısmı adım 2.2.5'te hazırlanan kollajenaz çözeltisi ile 60 mm plakaya aktarın. Ventral kısmını atın.
- Dorsal eksplant Oda sıcaklığında 1-2 dakika kollajenaz çözeltisi içinde kuluçkaya izin verin. Yavaşça diseksiyon plakasına geri aktarın.
- Ektodermin varsayımsal nöral dokusundan kalan tüm endodermal ve mezodermal kontaminasyonu dikkatlice çıkararak diseksiyonu tamamlayın. Evre 22 veya daha büyük embriyolar için, nöral tüp de kaldırılmalı ve atılmalıdır.
NOT: Diseksiyon sırasında gerekirse, 2.2.4 adımda hazırlanan %70 etanollü çanak, çifenlerin temizlenmesi veya yeniden sterilize edilmesi için kullanılabilir. - Diseksiyon tamamlandıktan sonra, ekstrüzyonu adım 2.2.3'te hazırlanan 35 mm'lik Ca2+ çözeltisine yavaşça aktarın.
- Dört ekstesi toplanana kadar 2.4-2.9 adımlarını tekrarlayın.
- Dört eksplabitkiyi de CMF solüsyonu içeren 35 mm plakaya aktarmak için bir P1000 mikropipet kullanın, ekstesiler ile hava-su arabirimi arasında herhangi bir temasından kaçınmaya özen. Yavaşça çanak girdap böylece tüm ekstenler plakanın ortasında küme.
- Ekstremiteler ayrıştırmak için oda sıcaklığında 1 saat kuluçka.
NOT: Dissosiyasyonda yardımcı olmak için CMF çözeltisine %0.025-0.01 tripsin eklenebilir. Bu, eski embriyoların (Evre 22 ve daha büyük) verimli bir şekilde dissosiyanasyonu için gerekli olabilir. - Bu noktada, en az iki uygun sahnelenmiş embriyolar tutma plaka üzerinde kalmalıdır. Adım 2.2.4 hazırlanan gentamisin ile 0.1x MMR ile dolu taze bir çanak bu embriyolar aktarın ve onları explant çanak maç için kaplı çanak ile bozulmamış geliştirmek için izin. Bu embriyolar kardeş kontrolleri olarak hizmet verecek.
- Adım 2.2.3'te hazırlanan 35 mm Hücre Kültürü Çanağı'nın altına mikro kurallı bir kapak kayması (Bkz. Malzeme Tablosu)takmak için süper yapıştırıcı kullanın.
NOT: Kapak kapağının kenarlarına küçük yapıştırıcılar yerleştirin, ardından Hücre Kültürü Çanağı'nın alt tarafına sıkıca bastırın. Konumsal işaretler tutkal ızgara ile temas ettiği her yerde gizlenecektir, bu nedenle kapağın merkezi ızgaralı kısmının yapışkandan uzak tutulması önemlidir. - Ekstesiler 1 saat için ayrıldıktan sonra, Hücre Kültür Çanağı'na aktarmak için p100 mikropipet kullanın. Yemeğin ızgaralı kısmına mümkün olduğunca çok hücre yitirmek için, pipeti kabın yüzeyine yakın sığ bir açıda tutun, pipet ucunu ızgaranın köşesine içe bakacak şekilde yerleştirin ve hücre süspansiyonunu ızgaralı ar boyunca sıkıca dışarı atlayın ea. İdeal olarak, hücreler sıkı bir yoğun kümeye yerleşir.
- Hücrelerin tabağa yapışmasını sağlamak için oda sıcaklığında 1 saat kuluçka. Bu kuluçka başladığında kardeş kontrol embriyolarının gelişim evresini belirleyin ve kaydedin.
- 5 μL 1 mM Fluo-4 'yi (bkz. Malzeme Tablosu)2 μL %10 Pluronik F-127 asitle birleştirin.
NOT: Fluo-4 ışığa duyarlıdır ve her zaman ışık la ilgili veya folyo kaplı bir tüpte tutulmalıdır. - Kuluçka tamamlandıktan sonra, örnek tabağı karanlık bir odaya veya ışığa karşı korumalı başka bir konuma taşıyın. Yemeğin kenarından 100 μL çözeltiyi çıkarmak için bir mikropipet kullanın. Fluo-4 AM/Pluronic F-127 asit, pipet yukarı ve aşağı karıştırmak için aliquot bu çözeltiyi ekleyin ve örnek çanak tam hacmi dönmek. Karıştırmak için yavaşça girdap.
- Alüminyum folyo ile plaka kapağı ve oda sıcaklığında 1 saat kuluçka ya da izin verin. Bu kuluçka başladığında kardeş kontrol embriyolarının gelişim evresini belirleyin ve kaydedin.
- Kuluçka sonunda, 2 mM Ca2+ kalan konik tüpü kullanarak aşağıdaki şekilde üç adet ortam yıkama sıcağı sıcağı sıcağı sıcayın 1 mL'sini çıkarın, 3 mL taze çözelti ekleyin, 2) 3 mL çözeltiyi yemekten çıkarın, 3 mL taze çözelti ekleyin, 3) 3 mL çözeltiyi yemekten çıkarın, 3 mL taze çözelti ekleyin.
3. Kalsiyum Görüntüleme
NOT: Kalsiyum görüntüleme ters konfokal mikroskop(Malzeme Tablosu)kullanılarak gerçekleştirildi.
- Numune plakasını mikroskop aşamasına yerleştirin ve ortam ışığına maruz kalmasına karşı korumaya özen duyun. Plaka sabitlendikten sonra, aynı görüş alanının sonraki görüntülemede bulunabilmesi için plakanın ön noktasını etiketlemek için bir işaretçi kullanın.
- Örneği mikroskop altında (önce 10X' te, sonra 20X büyütmede) bulun ve görüntüleme için uygun bir görüş alanı seçin. İdeal bir görüş alanı hücre yoğundur, ancak hücrelerin kümelenmiş veya ayrı ayrı ayırt edilmesi zor olacak kadar yoğun değildir.
- Mikroskop odağı, ızgara yönetimindeki kapak kaymasının görünür olması için ayarlayın. Kapak ta işaretli sayılar, belirli ızgara lokusu için benzersiz tanımlayıcılar olarak hizmet vermektedir ve ek görüntüleme için aynı görüş alanını bulmak için kullanılabilir. Başlangıçta seçili görünüm alanı herhangi bir sayıyla çakışmıyorsa, tanımlanabilir bir sayı çerçevede olana kadar yeniden gözden kalım.
- Odakta ızgara kurallı kapak kayma ile seçilen görüş alanının parlak alan görüntüsünü alın.
- Odak ayarlarını ayarlayın ve seçili görüş alanının parlak alan görüntüsünü odaktaki hücrelerle alın.
- Odak hücre tabakası ile, 488 nm lazer ile örnekleri aydınlatmak. FITC kanalında dinamik bir floresan aralığıalgıldığından emin olmak için her deneme için HV ve Ofset değerleri optimize edilebilir.
- İki saatlik görüntü için, görüntü elde etmek için 3,93 s'lik bir taramayı ve 8 s. Çalıştır yapılandırmasına sahip 901 kareyi kaydacak şekilde görüntüleme yapılandırmasını değiştirin.
- Görüntüleme tamamlandıktan sonra, plakayı mikroskop aşamasından çıkarın. 1 mL çözeltiyi plakadan çıkarın ve 1 mL 2x MEMFA (200 mM MOPS, 2 mM EGTA ve 2 mM MgSO4% 7.4 formaldehit) ile değiştirin.
- Plakayı oda sıcaklığında veya gece boyunca 4 °C'de 2 saat kuluçkaya yatırın. Bu kuluçka başladığında kardeş kontrol embriyolarının gelişim evresini belirleyin ve kaydedin.
- Fiksasyon tamamlandıktan sonra, plakadaki tüm çözeltiyi çıkarın ve 2 mL 1x PBS ile değiştirin. Daha fazla işleme için plakaları 4 °C'de saklayın.
4. Gen Ekspresyonu Analizi: Prob Sentezi
- Aşağıda açıklandığı gibi, in situ hibridizasyon için bir antisense RNA prob oluşturmak. Ayrıca, negatif kontrol olarak kullanılmak üzere aynı gen için bir duyu prob oluşturmak.
- Prob şablon dizisini içeren plazmid DNA'sını arındırmak için, 150 mL LB suyu ile şablon plazmid içeren bakteriyel gliserol stokları ile aşılanın. 37 °C'de bir gecede veya kültür bulanık olana kadar sallayarak kuluçkaya yatırın.
- Seçtiğiniz yöntemi kullanarak bakteri kültüründen plazmid DNA arındırın.
NOT: Biz plazmid DNA yüksek verim elde etmek için McNary-Nagel midi-hazırlık kiti kullanın. - Plazmid beklenen eklemek içerdiğini doğrulamak için, bir kısıtlama sindirmek gerçekleştirmek ve bir agarose jel üzerinde ürünleri analiz. Kesilmemiş plazmid de genomik DNA kontaminasyonu kontrol etmek için bir agarose jel üzerinde analiz edilebilir.
- Şablon DNA'sını doğrusallaştırmak için, 20 g plazmid DNA, 2 μL uygun restriksiyon enzimi ve 1 x uygun tampon içeren 100 μL'lik bir sindirimi reaksiyonu ayarlayın. En az 2 saat boyunca 37 °C'de kuluçkaya yatırın.
- Bir fenol /kloroform ekstraksiyonu ve ardından kloroform ekstraksiyonu yaparak doğrusallaştırılmış DNA ayıklayın.
- %100 etanol ile DNA'yı çökeltin. Bu, numuneye iki hacim soğuk etanol eklenerek ve katılanıncaya kadar -80 °C'de kuluçkaya yatırılarak hızlı bir şekilde yapılabilir (15-30 dk).
- 12.000 x g/4 °C'de 20 dakika eğilerek DNA'yı peletlemek için soğutulmuş bir santrifüj kullanın.
- Supernatant çıkarın ve% 70 etanol 200 μL ile pelet yıkayın. 12.000 x g/4 °C'de 5 dk spin.
- Supernatant ve hava-kuru pelet için yaklaşık 5 dakika çıkarın. 20 μL 1x TE resuspend ve daha fazla kullanıma kadar 4 °C'de saklayın.
- Antisense RNA probu sentezlemek ve arındırmak için 10 mM rCTP'nin 15 μL'si, 10 mM rGTP'nin 15 μL'si, 10 mM rATP'nin 15 0mL'si, 10 mM rUTP'nin 9,75 555 μL'si ve 5,25mL 10 mM dig-11 Malzeme (UTP'nin)5,25m L'lik bir karışımını birleştirerek 2,5 mM rNTP karışımı oluşturun.
- Adım 4.2-4.10'dan 4 μg doğrusallaştırılmış şablon DNA içeren 50 μL in vitro transkripsiyon reaksiyonu ayarlayın, Adım 4.11'den 2,5 mM rNTP karışımının 15'i, 5x transkripsiyon tamponunun 10'u, 0,1 M DTT'nin 5 0,5 l'si, 0,5 μL RNa inhibitörü (20 U/μL) ve 1,5 μL uygun RNA polimeraz (T3, T7 veya SP6). 37 °C'de kuluçka 1 saat.
- Reaksiyona 1,5°L rNA polimeraz ekleyin ve bir saat ek olarak 37 °C'ye geri dönün.
- Reaksiyona 1 μL RQ1 DNae ekleyin ve DNA şablonunu düşürmek için 10 dakika boyunca 37 °C'de kuluçkaya yatırın.
- Numuneye 30 μL 7,5 M LiCl çözeltisi ekleyin. Pipet en az 1 saat boyunca -20 °C'de karıştırıp kuluçkaya yatırın.
- Soğutulmuş bir santrifüj kullanarak, numuneyi 14.000 x g/4 °C'de 25 dk çevirin.
- Supernatant çıkarın ve% 70 etanol 500 μL ile pelet durun. 14.000 x g/4 °C'de 5 dk spin.
- Yaklaşık 5 dk. Nükleaz içermeyen su 20 μL resuspend için supernatant ve hava-kuru pelet çıkarın.
- Hibridizasyon Tamponunda numuneyi 10 ng/μL konsantrasyona seyrelterek 10x prob stoku oluşturun (%50 formamid, 5x SSC (tuzlu-sodyum sitrat; 750 mM NaCl, 75 mM sodyum sitrat, pH 7.0), 1 mg/mL torula RNA, %0.1 Ara-20, 1x Denhardt'ın Solüsyonu, %0.1 CHAPS, 10 mM EDTA ve 100 μg/mL heparin). Daha fazla kullanım alakadar -20 °C'de saklayın.
5. Gen Ekspresyonu Analizi: Floresan In Situ Hibridizasyon
NOT: Tüm yıkarlar steril, ayrı ayrı sarılmış transfer pipeti kullanılarak yaklaşık 1 mL çözelti ile yapılmalıdır. Pipet çıkarKen veya çözelti eklerken plakanın kenarına yerleştirilmeli ve hücrelerin plaka yüzeyinden çıkarılmaması ve kaybolması için yıkarlar mümkün olduğunca nazikçe yapılmalıdır.
- 1x PBS'yi plakadan çıkarın (adım 3.10'dan). Taze 1x PBS ile değiştirin ve oda sıcaklığında 5 dakika kuluçka.
- 25 mL 0,1 M trietanolamine (pH 8.0) ile 62.5 μL asetik anhidriti birleştirin. İyi bir şekilde karıştırın. 10 dk bu çözelti ile plakayı yıkayın.
- 5 dakika boyunca 1x SSC ile plakayı yıkayın.
- Hücreleri permeabilize etmek için 10 dakika boyunca 0,02 M HCl ile plakayı yıkayın.
- Her biri 5 dakika boyunca 1x PBS ile 2x yıkayın.
- Çözeltiyi çıkarın ve 1 mL Hibridizasyon Tamponu ekleyin (%50 formamid, 5x SSC (750 mM NaCl, 75 mM sodyum sitrat, pH 7.0), 1 mg/mL torula RNA, %0.1 Ara-20, 1x Denhardt's Solution, %0.1 CHAPS, 10 mM EDTA ve 100 μg/mL heparin) plakaya. 60 °C'de en az 6 saat sallayarak inküble.
- Hibridizasyon Tamponunu çıkarın ve 750 μL 1x RNA Probu çözeltisi (seyreltilmiş form 10x stok adım 4.19 yapılan değiştirin. Sense RNA probları negatif kontrol olarak kullanılabilir.
- 60 °C'de 8-14 saat sallayarak inküböz.
- Probu çıkarın ve -20 °C'de saklayın.
NOT: 1x probu seyreltme atılmadan önce üç kez kadar yeniden kullanılabilir. - Plakayı 0.2x SSC ile durulayın.
- 60 °C'de 1 saat boyunca taze 0,2x SSC ile yıkayın.
- Plakaları oda sıcaklığına taşıyın ve 5 dakika boyunca dengeleyin.
- Plakayı 0,2x SSC ile 5 dakika yıkayın.
- 15 dakika boyunca 1x PBT ile plakayı yıkayın.
- 1 saat boyunca 1x PBT'de %2 H2O2 (%0,1 Triton-x-100) ile plakayı yıkayın.
NOT: Bu çözelti ışığa duyarlıdır, bu nedenle her deney için taze yapılmalı ve ışıktan korunmalıdır. Plakalar da ışıktan korunmalıdır veya bu kuluçka sırasında engellenmelidir. - 15 dakika boyunca 1x TBST (150 mM NaCl, 50 mM Tris-HCl, pH 7.5, 0.1%Tween-20) ile plakayı yıkayın.
- Maleik Asit Tamponda %2'ye Kadar Seyreltik Bloke Reaktif (100 mM maleik asit, 150 mM NaCl, pH 7.5). Oda sıcaklığında en az 1 saat için bu karışımdaki hücreleri engelleyin.
- Bloke çözeltisini , Maleik Asit Tamponunda %2 Blokajlı Reaktifte seyreltilmiş 1:1.000 anti-digoksijenin-POD antikorile değiştirin. Gece boyunca 4 °C'de kuluçkaya yatırın.
- 1x TBST ile plaka 3x durulayın.
- Yıkama başına en az 15 dakika boyunca sürekli sallanan 1x TBST 2mL ile 4x yıkayın.
- 2x 1x PBT ile yıkama başına en az 10 dakika boyunca sürekli sallanan.
- Seyreltik Cy3-konjuge tyramide 1:25 1x PBT içinde. 5 dakika boyunca bu seyreltme 750 μL ile plakayı yıkayın.
NOT: Bu çözelti son derece ışığa duyarlıdır ve sinyal bozulmasını önlemek için plakalar deneyin geri kalanında engellenmeli veya ışıktan korunmalıdır. - Bu çözeltiye %0,3 H2O2'lik 2,5 00 000 000'lik bir ek katila ve oda sıcaklığında 40 dakika boyunca sürekli sallanma ile inkübed.
- Yıkama başına en az 15 dakika boyunca 1x TBST ile 4x yıkayın sürekli sallanan.
- 1x PBT ile durula.
- Hücreleri 1x MEMFA'da (100 mM MOPS, 1 mM EGTA ve 1 mM MgSO4% 3.7 formaldehit) oda sıcaklığında 1 saat kuluçkaya yatırın.
- Çözeltiyi çıkarın ve 1x PBS ile değiştirin. Plakaları 4 °C'de folyolu bir kapta, daha fazla işleme konana kadar saklayın.
6. Görüntüleme Hücreleri
NOT: Görüntüleme ters konfokal mikroskop kullanılarak gerçekleştirildi.
- Örnek plakayı mikroskop aşamasına yerleştirin ve adım 3.1'de yapılan işareti sahnenin önüne hizalayın.
- Görüntüyü ızgara kaplı kapak kaymasının görünür olması için odaklayın ve 3.4.
- Hem ızgaranın hem de hücrelerin parlak alan görüntülerini edinin.
- Örnekleri 595 nm TRITC lazerile aydınlatın. Negatif kontrol hücrelerinden görüntüleri kullanarak sinyali arka plandan uygun şekilde ayırt etmek ve hareketsiz bir görüntü elde etmek için kazanç değerlerini ayarlayın.
NOT: İdeal olarak, arka plan floresan düzeyleri, hedeflemeyen bir duyu RNA probuile paralel olarak işlenen negatif kontrol plakası esas alınarak belirlenir. Kazanç ayarları, bu plakanın tamamen siyah görünmesi (arka plan seviyelerine karşılık gelen) şekilde ayarlanır ve daha sonra bu deneysel toplu işlemden görüntülenen diğer plakalar için sabit tutulur.
7. Veri İşleme
NOT: Veri işleme Nikon Elements yazılımı kullanılarak gerçekleştirilmiştir.
- Adım 3.7 2 saat kalsiyum görüntü açın. İkili > Nokta Algılama > Parlak Noktalar'ı seçerek her bir hücreye karşılık gelen pikselleri tanımlayın. FITC kanalının seçildiğinden emin olun.
- Bu katman oluşturulduktan sonra tek tek hücrelerin üzerinde renkli daireler görünür. Hücre dağıtımını ve boyut parametrelerini, mümkün olduğunca çok hücrenin tanınması ve benzersiz bir tanımlayıcıyla ilişkilendirilmeleri için ayarlayın.
- Görüntü > Çözümleme Denetimleri > İzleme Seçenekleri'ne yönlendirerek görüntünün tüm karelerinde hücreleri izleyin. Parçalar arasındaki en büyük boşluk olarak 5 kare ayarlayın, 600'den az kareyle ilişkili nesneleri silin ve Boşlukları Kapat seçeneğini belirleyin. Görüntüye hücre izlemeyi uygulamak için İkili Leri Takip Et'i seçin.
- Hücreler izlendikten sonra, tek bir hücreye karşılık gelen nesneleri el ile silin (örneğin bir hücre yığını). Ancak, kalsiyum aktivitesi izmorfolojisi dayalı veri noktaları daha fazla analiz dışında tutulamaz.
- Resim bölmesinde, Yer Kaplamasını Görüntüle > İkili Nesne Kimliğini Göster'iseçin. Görüntünün sonuna gidin (Frame 901) ve Edit > Create View Snapshot (8bit RGB)> Geçerli Çerçeve > Tamam'ıseçin. Bu, her hücrenin ilişkili ikili kimliği görünür olan görüntünün son çerçevesinin anlık görüntüsünü oluşturur. Bu görüntüyü kaydedin.
- Zaman serisi verilerini excel'e veri aktarıncaizlenen tüm nesneleri seçerek dışa aktarma. Çıktıyı CSV dosyası olarak kaydedin.
- FISH görüntüsünü açın. FITC kanalı yerine TRITC kanalını kullanarak 7.1-7.2 adımlarında olduğu gibi nokta algılamayı optimize edin. Yanlış atanan ikili leri el ile silin, ardından her hücrenin sinyal yoğunluğunu hesaplamak için Otomatik Ölçüm Sonuçları > Güncelleştirme Ölçümü'nü seçin. 7.5 ve 7.6 adımlarını yineleyerek görüntü anlık görüntü ve veri tablosunu dışa aktarın.
- A sütununun FISH İkili Kimliği ve B sütununun Kalsiyum İkili Kimliğiolarak etiketlendiği bir elektronik tablo oluşturun. 7.5 ve 7.7 adımlarında dışa aktarılan görüntüleri açın. FISH görüntüsünde tanımlanan her nesne için (adım 7.7), ikili kimliği A sütununa kaydedin. Daha sonra, ilgili hücreyi kalsiyum görüntüsünde bulun (adım 7.5) ve B sütunundaki ikili kimliği kaydedin.
NOT: Her iki görüntüyü de açmak, bir yarı saydam yapmak ve her hücreyle ilişkili iki ikili kimliği daha kolay tanımlamak ve bağlamak için iş ortağı resmine bindirmek için Adobe Photoshop veya GIMP görüntü düzenleyicisi gibi bir fotoğraf düzenleme programı kullanmak yararlı olabilir. - Tanımlanan her hücre için, harmanlama (el ile veya komut dosyası ile) zaman serisi kalsiyum verileri (Kalsiyum İkili Kimliği ile ilişkili ve adım 7.6'da dışa aktarılan) ve gen ifade verileri (FISH İkili Kimliği ile ilişkili ve adım 7.7'de dışa aktarılan).
NOT: Downstream veri işleme ve analizi tek bir veri tablosu nda bu verileri harmanlama ve ani sayma, fraktal analiz ve araştırmacı kalsiyum aktivitesi 17,18yeni desenler ayırt etmek için izin Markovian entropi de dahil olmak üzere analitik teknikler bir dizi uygulayarak içerebilir.
Sonuçlar
Kalsiyum görüntüleme için hazırlanan ayrışmış hücrelerin başarılı bir örneği Şekil 2A'dagörülebilir. Hücreler yoğun bir şekilde kaplanır, her görüntüden toplanacak maksimum bilgi miktarına izin verilir, ancak tek tek hücrelerin birbirinden emin bir şekilde ayırt edilemeyecek kadar yoğun bir şekilde kaplanmamasını sağlar. Floresan 2 saat görüntüleme süresi boyunca her tanımlanmış hücre için tespit edilir. Bir deneyde kaydedilen tüm hücrelerin izlerini içeren bileşik bir çizimin görselleştirilmesi, toplu veya popülasyon ölçümlerinin daha nüanslı davranış modellerini gizleme derecesini ortaya koymaktadır(Şekil 2B). Tek tek hücrelerin kaydedilmiş profilleri izole edildiğinde, nöral progenitor hücrelerinin düzensiz spiking aktivite karakteristik örnekleri açıkça tespit edilebilir. Olgun nöronların aksine, embriyonik nöronal hücreler kalsiyum aktivitesinin düzensiz, son derece değişken ve karmaşık doğasını sergilerler(Şekil 2B). Bu karmaşıklığı ölçmek için, farklı veri analizi yöntemleri nin uygulanması17,18, bir başak tanımlamak için çeşitli parametreler de dahil olmak üzere uygulanmıştır ( Şekil2C).
Bir antisense mRNA probubaşarılı tasarımı ve sentezi de dahil olmak üzere yerinde hibridizasyonda başarılı floresan, bağlayıcı olmayan bir duyu RNA kontrolü ile inkübe edilmiş bir arka plan kontrolü ile deneysel plaka karşılaştırılarak değerlendirilebilir (Şekil 3A,B). Pozitif sonda kontrolü, hedef mRNA'yı algılanabilir düzeylerde ifade ettiği bilinen bir hücre türünü işleyerek de gerçekleştirilebilir.
Kalsiyum ve FISH görüntüleme genelinde aynı hücrenin tanımlanması, hücrelerin prob hibridizasyonu ve işleme sırasında kabaca aynı pozisyonda tutmalarını gerektirir. Plakalar kabaca işlenirse veya yıkar lar çok güçlü bir şekilde yapılırsa, hücreler plaka yüzeyinden çıkarılabilir ve çözelti atıldığında veya plaka üzerinde farklı bir yere yatırıldığında kaybedilebilir, bu da görüntüler arasında eşleşmelerini imkansız hale getirir(Şekil 4A). Bu bozulma görüş alanındaki hücrelerin yalnızca bazılarını etkiliyorsa, görüntü içindeki bazı hücreleri algılamak ve atamak yine de mümkün olabilir(Şekil 4B). Ancak, FISH'in dikkatle gerçekleştirildiği ve birkaç hücrenin kaybolduğu veya görüntüler arasında yeniden konumlandırıldığı bir deneyden maksimum veri elde edilir(Şekil 4C).
İlgi çekici olan gelişim evresinde makul sayıda hücrenin kalsiyum aktivitesini ve gen ekspresyonunu tanımlamak için veriler toplandıktan sonra, bu iki özellik arasındaki korelasyonları değerlendirmek için daha fazla analiz yapılabilir(Şekil 1). Ani sayım/frekans, ortalama güç, Hurst üs tahmini ve Markovian entropi ölçümü17,18dahil olmak üzere kalsiyum aktivite kalıplarını ölçmek için bir dizi ölçüm uygulanmıştır. Gen ekspresyonu, ele alınmakta olan deneysel sorulara bağlı olarak mutlak floresan düzeyi ile nicel olarak tanımlanabilir veya ikili (evet/hayır) ölçeğinde derecelendirilebilir.
Kalsiyum aktivitesini nöral progenitor marker genlerinin ekspresyonu ile harmanlayan deneylerin sonuçları, kalsiyum aktivitesinin belirli paternleri ile nörotransmitter fenotipler arasında çok sayıda ilişki olduğunu ortaya koymuştur. Nöral plaka evresinde (Evre 14), inhibitör nöron belirteci gad1.1 ifade gabaerjik hücreler gad1.1 ekspresyonu olmayan hücrelerin daha düzenli ve daha yüksek genlikli kalsiyum aktivitesi sergiler (Şekil 5A). Ayrıca, bu gad1.1-ifade hücreleri yüksek genlik spiking yüksek seviyeleri ile ilişkili iken, düşük genlik spiking uyarıcı nöron belirteci slc17a7ifade glutamaterjik hücrelerde daha sıktır .
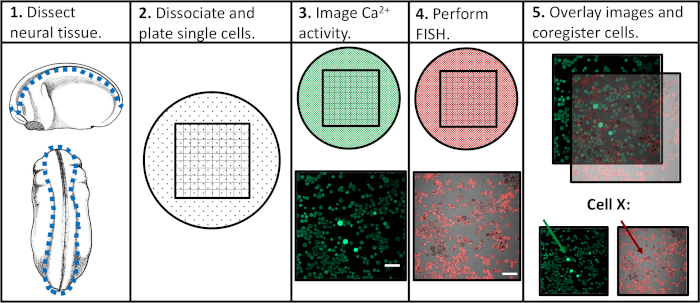
Şekil 1: Deneysel iş akışının şeması. Ölçek çubuğu = 100 μm. Panellerde 3-5 görüntüler Paudel et al alınmıştır (2019)17. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
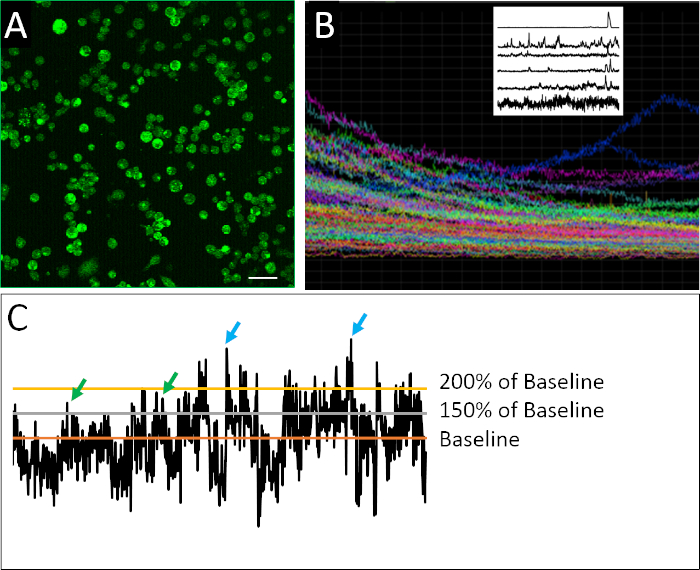
Şekil 2: Kalsiyum görüntüleme ve örnek aktivite profilleri. (A) Fluo4-AM tarafından bildirilen hücre içi kalsiyum aktivitesi. Her 2 saat görüntü 901 kare, burada bir temsili çerçeve gösterisi ile oluşur. (B) Görüntülenmiş görüş alanı içindeki tüm hücrelerde zaman içinde floresan yoğunluğunun bileşik çizimi. İzler, gösterge boyasının (Fluo4) fazla mesainin fotobeyazlama olduğunu açıkça gösterir. Sol üstteki Raster çizimi, Eilers ve Boelen19tarafından geliştirilen ve burada gösterilen hücrelerin farklı spiking davranışı deseni sergilediği bir de-trending algoritmasının uygulanmasından sonra kalsiyum aktivitesinin temsili izlerini gösterir. (C) Farklı eşiklerin uygulanması (temel in %150 ve %200'ü, taban çizgisi de-trended floresan yoğunluğunun ortalamasıdır) bir başak tanımlamak için (yeşil ve mavi oklar). Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
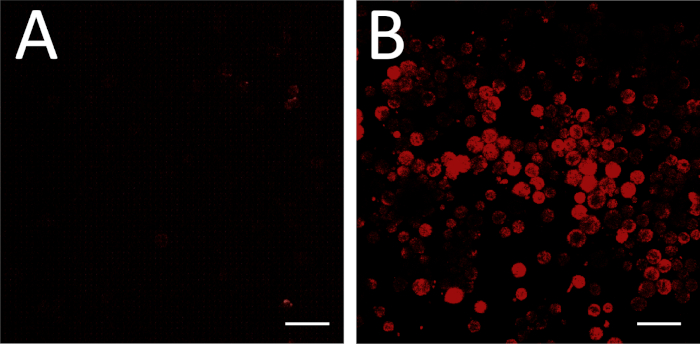
Şekil 3: FISH görüntüleme. (A) FISH negatif kontrol olarak bağlayıcı olmayan bir anlamda RNA probu ile yapılır. Görüntüleme ayarları, hiçbir hücrenin floresan görünmeyebilecek şekilde ayarlandı. Bazı görüş alanları, (A)'nın sağ üst ve alt köşelerinde görüldüğü gibi, bazı floresan hücre dışı enkazları içerebilir; bunlar arka plan ayarı amacıyla yoksayılabilir. (B) Aynı görüntüleme ayarları daha sonra deneysel bir plaka (antisense RNA prob) görüntü için kullanılır. Bu koşullar altında floresan arka plan üzerinde gen ekspresyonuna karşılık gelir. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Görüntü bindirme ve birlikte kayıt. Kalsiyum aktivitesi (dolgulu yeşil daireler tarafından temsil edilen hücreler) ve FISH'ten sonra (gölgeli kırmızı dairelerle temsil edilen hücreler) için resmedilen bir örneğin şematik gösterimleri. (A) Örnek işleme ve işleme sırasında önemli ölçüde hareket eden hücreler iki görüntü arasında güvenilir bir şekilde tanımlanamaz. (B) Hücre bozulması görüş alanındaki yalnızca bazı hücreleri etkileyebilir. Bazı hücreler her iki görüntüde de açıkça tanımlanabilirken, diğerleri güvenle eşleştirilemez. (C) Örnekler dikkatle ele alınırsa, çoğu hücre rahatsız edilmeden kalır ve her iki görüntüde de tanımlanabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
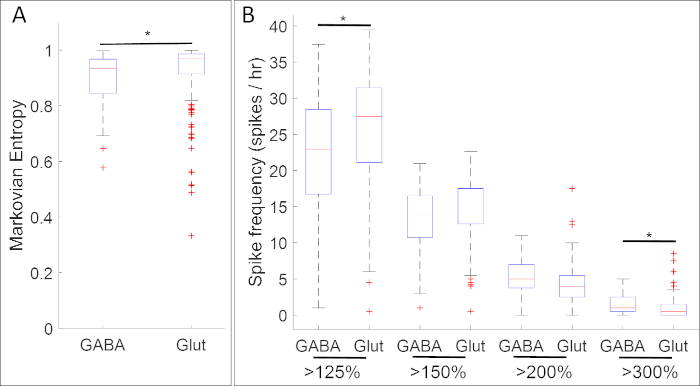
Şekil 5: Bu yöntemin uygulanmasına bir örnek, nöral plaka evresi Xenopus laevis'te kalsiyum aktivitesi ve gen ekspresyonu (sırasıyla gad1.1 ve slc17a7 genleri için GABA ve Glut) arasındaki ilişkileri gösteren kutu çizimleri. Evre 14'te, gad1.1-postif hücreler (GABA) (A) Markovian entropi18 ve (B) eşikleri kullanarak daha yüksek genlik ve daha düzenli kalsiyum aktivitesi sergiler ler 125%, 150%, 200% ve% 300 de-trended floresan yoğunluğu ortalama (bazal)17 slc17a pozitif hücreler (Gluthücreler). Yıldızlar, Bonferroni düzeltilmiş iki örnekli Kolmogorov-Smirnov Testi (p < 0.05) ve Cohen'in etki boyutu (n = 5 kültürler ve >100 hücreleri; * 0.2 ≤ |d| < 0.5) d istatistiklerine göre istatistiksel olarak anlamlı farklılıklar gösterir. Rakam yeniden çizilmiş ve Paudel ve ark.17elde edilen veri kümesinden uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Gelişmekte olan sinir sistemini oluşturan hücrelerde karakteristik kalsiyum aktivitesi paternleri gözlenmiştir ve farklı nörogelişimsel süreçlerle ilişkili belirli aktivite türleri vardır. Ancak, bu bilgi yoğun aktivite kalıplarının transkripsiyonel yanıtlara çevrilme mekanizmalarının daha iyi anlaşılması, kalsiyum aktivitesi ve gen ekspresyonu hakkında bilgilerin tek hücreli çözünürlükle toplanmasını gerektirir. Olgun nöronlar gibi daha basmakalıp kalsiyum aktivitesi sergileyen sistemler toplu düzeyde makul bir şekilde tetkik edilebilirken, embriyonik sinir sistemini karakterize eden düzensiz desenler daha az hassas kayıtlarla kolayca maskelenir.
Bu protokolde yer alan deneysel çerçeve, çok çeşitli hücre tiplerine ve floresan muhabirlere kolayca uyarlanabilir. Hemen hemen herhangi bir hücre tipi veya hücre tiplerinin kombinasyonunu içeren doku, ilgi çekici bir organizmadan kesilebilir ve tek hücreli görüntüleme için kaplanabilir. Hücre tanımlamasına izin vermenin ve hücre özerk süreçlerinin etkisini yalıtmaya ek olarak, birincil hücre kültürü yaklaşımı deneycinin ortam bileşenlerini istenilen şekilde tanımlamasına olanak tanır. Örneğin, 2 mM Ca2+ çözeltisindeki nöronal öncüllerin aktivitesini karşılaştıran deneyler, embriyonik omurilikteki ani frekans ve nörotransmitter fenotip arasındaki ilişkilerin hücre-hücre etkileşimlerinin etkisi olmadan tekrar kapılıp yapılamayacağını araştırmak için yapılmıştır13,20.
Bu protokol, hücre içi kalsiyum aktivitesini saptamak için floresan belirteç Fluo4-AM'den yararlanırken, kullanıcılar genetik olarak kodlanmış kalsiyum göstergeleri de dahil olmak üzere diğer ticari olarak kullanılabilen belirteçleri21'iseçebilirler. Benzer şekilde, alternatif belirteçler ilgi bir iyon konsantrasyonu dinamik değişiklikleri izlemek için kullanılabilir (Kdahil +, Na+, ve Zn2 +), membran potansiyeli, veya hücresel pH. Görüntüleme ayarları ve görüntü süresi gerektiğinde değiştirilebilir.
Kalsiyum aktivitesi ve nöronal fenotip ile spesifik bir uygulama olarak ilişkili olmamıza rağmen, bu yöntem çeşitli hücresel özellikler için de geçerlidir. Örneğin, yerinde hibridizasyonda floresan, nöronal marker ChAT veya transkripsiyon faktörü Engrailed dahil olmak üzere herhangi bir gen karşı problar ile yapılabilir, mRNA türlerinin özelleştirilebilir bir panel hassas algılama sağlayan. Bu problar izoforma özgü olacak şekilde tasarlanabilir ve istenirse ek hedef özgüllüğünü destekler. Çift BALIK birkaç farklı florofore konjuge problar kullanılarak yapılabilir, birden fazla genin ekspresyonunun eşzamanlı olarak değerlendirilmesine olanak sağlar. Ancak, bu tür deneylerin gerektirdiği ek yıkıntılar hücre kaybı veya hareket etme şansının artmasıyla ilişkilidir ve deneyim ve incelik gerektirir.
Bu protokolde yapılan deneye özgü değişikliklerden bağımsız olarak, dikkatli dikkat gerektiren birkaç önemli adım vardır. Diseksiyonlar tüm kontamine dokuları veya hücre popülasyonlarını gidermek için özenle yapılmalıdır; uzamsal desenleme ekspertiz dissociated zaman kaybolur çünkü, komşu dokulardan kalan hücreler serpiştirilmiş ve ilgi hücrelerinden ayırt edilemez hale gelecektir. Hücreler kaplandıktan sonra, hücrelerin yerinden olmasını önlemek için numuneler mümkün olduğunca nazik bir şekilde ele alınmalıdır. En önemlisi, bu, çözelti çıkarılırken ve eklenirken pipet plakanın kenarına yerleştirilirken, tüm çözüm değişikliklerinin yavaş ve dikkatli bir şekilde yapılması gerektiği anlamına gelir. Bu, hücrelerin hem kalsiyum hem de FISH görüntülerinde güvenle tanımlanabilmesini sağlayacaktır. İşlem sırasında hücreler bozulursa, iki görüntü arasında karşılık gelen hücrelerin bazılarını veya tümünün tanımlanması imkansız olabilir. Bu atamalarda dikkatli olmanızı öneriyoruz, ancak daha fazla analiz için sadece kesin olarak karşılık gelen hücreler kullanılır.
Ele alınması gereken biyolojik soruya bağlı olarak, çeşitli analiz yaklaşımları uygun olabilir. Zaman serisi kalsiyum aktivitesi çeşitli şekillerde işlenebilir ve ölçülebilir, de-trending parametreleri, analiz ölçümleri ve analiz parametreleri seçiminde deneyci esnekliği ile (örneğin, bir kalsiyum başak tanımlamak için kullanılan temel eşik %). Gen ekspresyonunun FISH görüntüsünden elde edilen mutlak veya bağıl floresan değeri olarak analiz edilerek kalsiyum aktivitesi ile gen ekspresyonu düzeyi arasındaki korelasyonlar çizilebilir. Alternatif olarak, pozitif gen ekspresyonu sinyali için floresan eşiği tanımlayarak ve tek tek hücrelere 'evet' veya 'hayır' tanımlayıcıları atayarak kalsiyum aktivitesi ve gen ekspresyonu (varolma/yokluk) arasındaki korelasyonlar çizilebilir. Bir bütün olarak, bu deneysel şema hücre uyumlu gen ekspresyonu verileri ile birlikte zaman serisi verilerin toplanması ve ön analizi için inanılmaz esnek bir boru hattı sağlar. Bu tür deneyler hücresel dinamikler ve transkripsiyonel değişiklikler arasındaki karmaşık ilişkileri daha iyi anlamak için kritik olacaktır, embriyonik Xenopus laevisinhibitör-fated ve uyarıcı-fated nöronal öncüllerin karakteristik kalsiyum aktivite kalıplarının belirlenmesi ile örneklenmiştir .
Açıklamalar
Çıkar çatışması bildirilmemiş.
Teşekkürler
Wendy Herbst ve Lindsay Schleifer'e bu protokollerin geliştirilmesine olan katkılarından dolayı teşekkür ederiz. Bu çalışma MsS'e Ulusal Sağlık Enstitüleri (1R15NS067566-01, 1R15HD07624-01 ve 1R15HD096415-01) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| For Animal Husbandry & Cell Culture | |||
| CHORULON (chorionic gonodotropin) | Merck Animal Health | ||
| Gentamycin sulfate salt | Millipore Sigma | G1264 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Pyrex petri dishes, 100 mm x 20 mm | Millipore Sigma | CLS3160102 | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 35mm | Fisher Scientific | 08-772A | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 60mm | Fisher Scientific | 08-772F | |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | |
| Thermo Scientifc Nunc Cell Culture / Petri Dishes, 35x10mm Dish, Nunclon Delta | Fisher Scientific | 12-565-90 | |
| Fisherbrand Standard Disposable Transfer Pipettes, Nongraduated; Length: 5.875 in.; Capacity: 7.7 mL | Fisher Scientific | 13-711-7M | |
| Ethyl 3-aminobenzoate methanesulfonate | Millipore Sigma | E10521 | |
| Collagenase B | Millipore Sigma | 11088807001 | |
| Dumont #55 Forceps, Dumostar | Fine Science Tools | 11295-51 | |
| Dumont #5 Forceps, Dumostar | Fine Science Tools | 11295-00 | |
| Cellattice Micro-Ruled Cell Culture Surface | Nexcelom Bioscience | CLS5-25D-050 | |
| For Calcium Imaging | |||
| Fluo-4, AM, cell permeant | Thermo Fisher Scientific | F14201 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | Thermo Fisher Scientific | P6866 | |
| For RNA Probe Generation | |||
| PureYield Plasmid Miniprep System | Promega | A1222 | |
| rATP | Promega | P1132 | |
| rCTP | Promega | P1142 | |
| rGTP | Promega | P1152 | |
| rUTP | Promega | P1162 | |
| Digoxigenin-11-UTP | Millipore Sigma | 3359247910 | |
| Rnase Inhibitor | Thermo Fisher Scientific | N8080119 | |
| T3 RNA Polymerase | Promega | P2083 | |
| T7 RNA Polymerase | Promega | P2075 | |
| SP6 RNA Polymerase | Promega | P1085 | |
| RQ1 Rnase-Free Dnase | Promega | M6101 | |
| LiCl Precipitation Solution (7.5 M) | Thermo Fisher Scientific | AM9480 | |
| For Fluorescence In Situ Hybridization | |||
| Acetic Anhydride | Thermo Fisher Scientific | 320102 | |
| Blocking Reagent | Millipore Sigma | 11096176001 | |
| Anti-Digoxigenin-POD, Fab fragments | Millipore Sigma | 11207733910 | |
| Cy3 Mono-Reactive NHS Ester | Millipore Sigma | GEPA13105 | |
| Solution Components | |||
| Calcium chloride, 96% extra pure, powder, anhydrous, ACROS Organixs | Fisher Scientific | AC349610 | |
| Calcium chloride dihydrate | Millipore Sigma | C3306 | |
| CHAPS hydrate | Millipore Sigma | C3023 | |
| Denhardt's Solution (50X) | Thermo Fisher Scientific | 750018 | |
| DTT, Molecular Grade (DL-Dithiothreitol) | Promega | P1171 | |
| Ethylenediaminetetraacetic Acid, Disodium Salt Dihydrate | Fisher Scientific | S311 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid | Millipore Sigma | E3889 | |
| Formamide (Deionized) | Thermo Fisher Scientific | AM9342 | |
| Herparin sodium salt from porcine intestinal mucosa | Millipore Sigma | H3393 | |
| HEPES (Ultra Pure) | Thermo Fisher Scientific | 11344041 | |
| Hydrogen peroxide solution | Millipore Sigma | H1109 | |
| L-Cysteine | Millipore Sigma | 168149 | |
| Magnesium chloride, pure, ACROS Organics | Fisher Scientific | AC223211000 | |
| Magnesium sulfate, 97% pure, ACROS Organixs, anhydrous | Fisher Scientific | AC413480050 | |
| Maleic Acid, 99%, ACROS Organics | Fisher Scientific | ACS125231000 | |
| MOPS (Fine White Crystals/Molecular Biology), Fisher BioReagents | Fisher Scientific | BP308 | |
| Potassium chloride | Millipore Sigma | P9541 | |
| Ribonucleic acid from torula yeast, Type IX | Millipore Sigma | R3629 | |
| Sodium chloride | Millipore Sigma | S7653 | |
| Triethanolamine | Millipore Sigma | 90279 | |
| Tris | Millipore Sigma | GE17-1321-01 | |
| TWEEN 20 | Millipore Sigma | P9416 | |
| Equipment | |||
| Laminar Flow Hood | model of choice | ||
| Dissecting Microscope | model of choice | ||
| Inverted Fluorescence Microscope | Nikon | TE200 | |
| NIS-Elements Imaging Software | Nikon | ||
| Shaking Incubator | model of choice | ||
| Refrigerated Centrifuge | model of choice | ||
| Miscellaneous | |||
| Corning bottle-top vaccum filter system, 0.22 μm pore, 500 mL bottle capacity | Millipore Sigma | CLS430769 | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 |
Referanslar
- Humeau, J., et al. Calcium signaling and cell cycle: Progression or death. Cell Calcium. 70, 3-15 (2017).
- Kim, J. M., Lee, M., Kim, N., Heo, W. D. Optogenetic toolkit reveals the role of Ca2+ sparklets in coordinated cell migration. PNAS. 112 (21), 5951-5957 (2016).
- Orrenius, S., Zhivotovsky, B., Nicotera, P. Regulation of cell death: the calcium-apoptosis link. Nature Reviews Molecular Cell Biology. 4 (7), 552-565 (2003).
- Pham, K., et al. Ca2+ and Mg2+ module conformational dynamics and stability of downstream regulatory element antagonist modulator. Protein Science. 24 (5), 741-751 (2015).
- Smedler, E., Uhlén, P. Frequency decoding of calcium oscillations. Biochimica et Biophysica Acta. 1840 (3), 964-969 (2014).
- Moreau, M., Néant, I., Webb, S. E., Miller, A. L., Riou, J. F., Leclerc, C. Ca(2+) coding and decoding strategies for the specification of neural and renal precursor cells during development. Cell Calcium. 59 (2-3), 75-83 (2016).
- Tomida, T., Hirose, K., Takizawa, A., Shibasaki, F., Iino, M. NFAT functions as a working memory of Ca2+ signals in decoding Ca2+ oscillation. EMBO. 22 (15), 3825-3832 (2003).
- Hannanta-Anan, P., Chow, B. Y. Optogenetic Control of Calcium Oscillation Waveform Defines NFAT as an Integrator of Calcium Load. Cell Systems. 2 (4), 283-288 (2016).
- Li, L., Stefan, M. I. Le Novère N. Calcium input frequency, duration and amplitude differentially module the relative activation of calcineurin and CaMKII. PLoS One. 7 (9), 43810(2012).
- Romano, D. R., Pharris, M. C., Patel, N. M., Kinzer-Ursem, T. L. Competitive tuning: Competition's role in setting the frequency-dependence of Ca2+-dependent proteins. PLoS Computational Biology. 13 (11), 1005820(2017).
- Pharris, M. C., Patel, N. M., Kinzer-Ursen, T. L. Competitive Tuning Among Ca2+/Calmodulin-Dependent Proteins: Analysis of in silico Model Robustness and Parameter Variability. Cellular and Molecular Bioengineering. 11 (5), 353-365 (2018).
- Gu, X., Olson, E. C., Spitzer, N. C. Spontaneous neuronal calcium spikes during early differentiation. Journal of Neuroscience. 14 (11), 6325-6335 (1994).
- Borodinsky, L. N., Root, C. M., Cronin, J. A., Sann, S. B., Gu, X., Spitzer, N. C. Activity-dependent homeostatic specification of transmitter expression in embryonic neurons. Nature. 429 (6991), 523-530 (2004).
- Ciccolini, F., Collins, T. J., Sudhoelter, J., Lipp, P., Berridge, M. J., Bootman, M. D. Local and Global Spontaneous Calcium Events Regulate Neurite Outgrowth and Onset of GABAergic Phenotype during Neural Precursor Differentiation. Journal of Neuroscience. 23 (1), 103-111 (2003).
- Weissman, T. A., Riquelme, P. A., Ivic, L., Flint, A. C., Kriegstein, A. R. Calcium Waves Propagate through Radial Glial Cells and Modulate Proliferation in the Developing Neocortex. Neuron. 43 (5), 647-661 (2004).
- Nieuewkoop, P. D., Faber, J. The stages of Xenopus embryonic development. Normal Table of Xenopus laevis. , North Holland Publishing Company. (1994).
- Paudel, S., et al. Calcium Activity Dynamics Correlate with Neuronal Phenotype at a Single Cell Level and in a Threshold-Dependent Manner. International Journal of Molecular Science. 20 (8), 1880(2019).
- Marken, J. P., et al. A Markovian Entropy Measure for the Analysis of Calcium Activity Time Series. PLoS One. 11 (12), 0168342(2016).
- Eilers, P. H. C., Boelens, H. F. M. Baseline Correction with Asymmetric Least Squares Smoothing. Leiden University Medical Centre Report. , (2005).
- Guemez-Gamboa, A., et al. Non-cell-autonomous mechanism of activity-dependent neurotransmitter switching. Neuron. 82 (5), 1004-1016 (2014).
- Paredes, R., Madelaine,, et al. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır