Method Article
סידן פלואורסצנטי הדמיה ובעקבות היברידיזציה באתרו לאפיון עצבי בלתי מבשר בקספוס זריזה
In This Article
Summary
אנו מציגים פרוטוקול דו-חלקי המשלב הדמיה של סידן פלורסנט עם היברידיזציה באתרו, ומאפשר לניסויים לתאם דפוסים של פעילות הסידן עם פרופילי ביטוי גנים ברמה של תא אחד.
Abstract
פעילות סידן תאיים הספונטנית ניתן לצפות במגוון של סוגי תאים והוא מוצע לשחק תפקידים קריטיים במגוון של תהליכים פיזיולוגיים. בפרט, התקנה מתאימה של דפוסי פעילות הסידן במהלך embryogenesis הוא הכרחי עבור היבטים רבים של התפתחות עצבית בעלי חוליות, כולל הסגר שפופרת עצביים נכונה, synaptogenesis, ו-מפרט הנוירוטרנסמיטור. בעוד ההבחנה כי דפוסי הפעילות סידן יכול להיות שונה הן בתדר והן משרעת מציע מנגנון משכנע שבו הפלוסים האלה עשויים לשדר אותות מקודדים לתוך המטה ולווסת ביטוי גנים, קיים לגישות ברמת האוכלוסיה לא הייתה הדיוק הנחוצה כדי לבחון את האפשרות הזאת. יתרה מזאת, גישות אלה מגבילות את מחקרי התפקיד של האינטראקציות של תאי התא על-ידי כך שהיא מנעה את היכולת לקבוע את מצב ההגדרה העצבית בהיעדר מגע תאי התא. לכן, הקמנו זרימת עבודה ניסיונית שזוגות הדמיה של הזמן לפקיעה סידן של האקריות נוירואליות עצביים עם זריחה בתוך ההיברידיזציה באתרו, המאפשר קורלציה חד משמעית של דפוס הפעולה סידן עם מולקולרי פנוטיפ ברמה של תא בודד. הצלחנו בהצלחה להשתמש בגישה זו כדי להבחין ולאפיין דפוסים ספציפיים של פעילות הסידן הקשורים לתאי העצבים המבדילים ולתאים העצביים, בהתאמה; מעבר לכך, לעומת זאת, המסגרת הניסיונית המתוארת במאמר זה יכולה להתאים בקלות לחקירת מערכת יחסים בין פרופיל פעילות של סדרת זמן וביטוי של גנים או גנים מעניינים.
Introduction
סידן ציטוסולג בחינם הוא קריטי למגוון של תהליכים ביולוגיים, החל התפשטות התא והגירה ל אפופטוזיס ו-הבחירה האוטומטית1,2,3. בתוך מסלולים אלה, סידן יכול להפעיל את השפעות הזרם על ביטוי הגנים על ידי אינטראקציה עם כריכת סידן תחומים כדי לגרום לשינויים שינויים לווסת את פעילות החלבון ואינטראקציות. לדוגמה, חיישן סידן עצבי הידוע בשם המטה אלמנט היריב מאפטור (DREAM) מוחזק בתוך היווצרות ביניים מחודש כאשר הוא כרוך על ידי סידן, ומונע ממנו לקיים אינטראקציה עם החלבון שלה ומטרות ה-DNA4. מעבר לשרת כמו מולקולה איתות פשוט, עם זאת, האופי הדינמי של מעבר סידן תאיים מאפשר דפוסי הפעילות הללו כדי לקודד משרעת מורכבים יותר-או מבוססי תדר מסוג5,6. טרנסלוקציה גרעינית של מקדם התמלול גורם גרעיני של T-תאים מופעלים (NFAT) מוגברת על ידי תנודות סידן בתדר גבוה אך מעוכבים על ידי תנודות בתדר נמוך7. בסדר, העבודה האחרונה הציעה כי NFAT עשוי בעצם להגיב על חשיפה לסידן מצטבר8. שניהם קלסנורים ו-Ca2 +/calמודוליני-התלות חלבון קינאז II (camkii) גם להפגין תגובות ברורים ארעיות סידן של תדר ספציפי, משך, או משרעת9. כדי להוסיף רמה נוספת של מורכבות רגולטוריות, מודלים חישוביים מצביעים על כך שרבים מהחלבונים בזרם הסידן הופכים להיות פחות מותנים בשכיחות התגובה לנוכחות או להעדר המתחרים המחייבים10,11.
בתוך מערכת העצבים המתפתחת, שני מחלקות עיקריות של התנהגויות פעילות הסידן הוגדרו וקשורים בתהליכים ביולוגיים ספציפיים. השפעה סידן מסווגים כמו "קוצים" אם הם מתרחשים בתוך תאים בודדים, להגיע לעוצמת שיא של ~ 400% של בסיסית בתוך חמש שניות, ומוצג מעריכי הדעיכה כפולה12. סוג זה של אות משויך בעיקר עם הנוירוטרנסמיטר פנוטיפ מפרט13. לעומת זאת, "גלים" מוגדרים איטית יותר, מעבר סידן קיצוניים שבהם ריכוז הסידן התאיים של התא עולה ל ~ 200% של הבסיס לאורך תקופה של שלושים שניות או יותר, ולאחר מכן מדקנת על פני מספר דקות12. אותות אלה מופצים לעתים קרובות על פני תאים שכנים מרובים, ונוכחותם היתה קשורה neurite מוצלח ו התפשטות התא14,15. עם זאת, למרות ששני כיתות אלה הוגדרו על בסיס פרופילים קינטית אופייניים, זה נשאר ברור בדיוק אילו מאפיינים של דפוסים אלה מזוהים למעשה על ידי תאים ומתורגם על ידי המטה במורד.
הבנת הקשר בין תנודות הסידן התאיים וביטוי הגנים יספקו תובנה מכרעת לאחד ממנגנוני הרגולציה המבטיחה פיתוח מתאים והבנת מערכת העצבים. למטרה זו, מחקרים של חוט השדרה העובריים הוכיחו כי מוגברת הפעילות ספייק הסידן במהלך הפיתוח קשורה לרמות גבוהות יותר של נוירונים מעכבות, בעוד ירידה בפעילות הסידן משויך רמות גבוהות יותר של נוירונים מרגש13. עם זאת, מאמר זה ברמת האוכלוסייה לא שימשו כדי לשייך פעילות סידן עם ביטוי גנטי ברמה של תא בודד.
מתקרבים לשאלות אלה ברמה של תא בודד מציע מספר יתרונות ברורים על פני העבודה הקודמת. עבור אחד, היכולת להעריך את פעילות הסידן ואת הביטוי הגנטי בתאים רבים בנפרד מאפשר את הרפרטואר המלא של דפוסי הפעילות ברורים להיות נצפתה מבלי לערפל על ידי מדידה ברמה גורפת. בנוסף, לימוד מערכות יחסים אלה בתוך התרבות הראשית של התא היחיד פירושו כי הקישורים האוטונומית התאים בין פעילות הסידן לבין ביטוי הגנים יישמרו, בעוד שאינטראקציות הדורשות תקשורת תא תא תהיה מתועבנה. לפיכך, גישה זו מאפשרת לחקור את המנגנונים האוטונומית האלה בבידוד. עם זאת, היא גם מאפשרת את תפקידה של פעילות הסידן האוטונומית הבלתי-תאית להיות מובהר ונחקר. לדוגמה, ניתן לגזור את התאים מעובר בשלב הלוחית העצבית, שהוא מתורבת עד שולט האחים להגיע לשלב הצינור העצבי, ולאחר מכן בהשוואה לתאים שנעשו טריים מעובר בשלב העצבי-שפופרת. הדבר מאפשר השוואה ישירה בין התאים ששמרו על תקשורת תא תא לאורך תקופה התפתחותית מרכזית לאלה שבהם בוטלה תקשורת תא תא.
בשאיפה להתמודד עם מגבלות הגישות הנסיוניות הקודמות, פיתחנו פרוטוקול שיאפשר הערכה של פעילות הסידן והביטוי הגנטי בתאי מחולל קדמון בודדים, המאפשרים התאמה של דפוסי פעילות ספציפיים עם תוכניות בידול עוקבות. הרקמה העצבית הייתה מבועלת בשלבים שונים של התפתחות עצבית, והיא הפכה לתאים בודדים, והפכה באמצעות מיקרוסקופיה קונפוקלית בנוכחות מחוון סידן פלורסנט. בעקבות הדמיה של תא חי, הדגימות היו קבועות ומובחנות באמצעות היברידיזציה באתרו (דג) כדי לזהות ביטוי של גן או איזוצורה של ריבית. מעבר לכך, ניתן לעקוב אחר תאים בודדים בשני ניסויי דימות, כלומר, פרופיל פעילות הסידן של התא ורמת ביטוי הגנים שלו יכולים להיות משויכים זה לזה (איור 1). הפרוטוקול המדווח כאן נועד לחקור את היחסים בין דפוסי הפעולה סידן וביטוי גנים על פני התפתחות נוירופוס מתחלקים ב xenopus זריזה. עם זאת, המסגרת הניסיונית רחבה יותר (הדמיה בודדת של תא בזמן, ובעקבות הרישום של הדגים והתמונה) ניתן לשנות ולהחיל כמעט כל סוג תא, כתבת פלורסנט, וגנים של עניין.
Protocol
כל העבודה הכרוכה בבעלי חיים בוצעה בהתאם לפרוטוקולים שאושרו על ידי הוועדה המוסדית לטיפול בבעלי חיים (IACUC) במכללה של ויליאם ומרי.
1. טיפול בבעלי חיים וטיפול בעובר
- לגרום ההזדווגות הטבעית על ידי ניהול הזרקה תת עורית של גונדוטרופין כוריוני אנושי (HCG) לתוך שק לימפה החלק הלבן של xenopus זריזה במינון של 600 u עבור נקבות ו 400 u עבור זכרים.
- לאחר ההזרקה, מניחים לפחות זכר אחד וצפרדע נקבה אחת במיכל המחזיק בטמפרטורת החדר למשך הלילה. ביצה הנחת בדרך כלל מתחיל 9-12 h לאחר הממשל HCG.
- לאסוף עוברים. Dejelly על ידי שטיפת בעדינות עם 2% ציסטאין (pH 8.0) עבור 2-4 דקות.
- לשטוף את העוברים 3x ב 0.1 x מארק שונה הפתרון של הצלצול (MMR) (100 מ"מ, 2 מ"מ KCl, 1 מ"מ MgSO4, 2 מ"מ cacl2, 5 מ"מ hepes, pH מותאם ל 7.4 – 7.6).
- העברת העוברים אל 100 מנות מזכוכית פטרי מכיל 0.1 x MMR ו 50 μg/mL בג. צפיפות של 50-100 עוברים לכל צלחת מתאימה.
- מודחלת את הכלים ב -14 ° c – 22 ° c ומאפשרים לעוברים להתפתח עד שיגיעו לשלב ההתפתחותי הרצוי. מדי פעם להסיר תאים מופרית, נמק או באופן חריג העוברים לפתח עם פיפטה העברה פלסטיק.
הערה: כדי להבטיח עקביות, ההיערכות ההתפתחותית מבוצעת בהתאם לקריטריונים מורפולוגיים שהוגדרו על-ידי ניוקופ ופבר16. שלבי הריבית ישתנו בהתאם למיקוד הניסיוני. לדוגמה, ציוני דרך מרכזיים התפתחותיים משויכים לשלב 14 (התפרצות עצבים), שלב 18 (התפרצות של הסגר העצבי שפופרת), ו שלב 22 (תחילתה של התארכות זנב).
2. ניתוח העובר והכנת המדגם
- הכנה לפתרון
- להכין 2 מ"מ Ca2 + פתרון המכיל 116 מ"מ היאl, 0.67 Mm kcl, 2 מ מ"מ cacl2· 2h2O, 1.31 mm mgso4, ו 4.6 טריס mM. עבור כל פתרון 100 mL, להוסיף 1 mL של פניצילין/סטרפטומיצין (10,000 U/mL פניצילין; 10,000 μg/mL סטרפטומיצין). התאימו את ה-pH ל 7.8 והמסנן-חטא.
- הכנת פתרון סידן-ומגנזיום (CMF) על-ידי שילוב 116 מ"מ, 0.67 mM KCl, 4.6 mM Tris ו 0.4 מילימטר EDTA. להתאים את ה-pH ל 7.8 ו האוטוקלב לחטא. עבור כל פתרון 100 mL, להוסיף 1 mL של פניצילין/סטרפטומיצין (10,000 U/mL פניצילין; 10,000 μg/mL סטרפטומיצין). התאימו את ה-pH ל 7.8 והמסנן-חטא.
- הכנת צלחות לחיתוך והדמיה
- UV-לחטא 2 35 מ"מ מנות מפלסטיק פטרי ו 1 35 מילימטר התרבות תאים מאכל (ראה לוח חומרים).
- בזמן העבודה במכסה של זרם למינארי, להכין 2 50 mL שפופרות מפלסטיק המכיל 10 mL של 2 מ"מ Ca2 + פתרון כל.
- להישאר עובד במכסה הזרם למינארי ולהוסיף 2 מ מ 2 מילימטר Ca2 + פתרון 1 35 מ"מ צלחת פטרי, 2 מ מ 2 מילימטר ca2 + פתרון 1 35 Mm התרבות תא צלחת, ו 2 מ ל של פתרון cmf ל 1 35 מילימטר מפלסטיק צלחת פטרי.
- מחוץ למכסה המנוע של הזרם, ממלאים 2 100 מ"מ מנות פטרי מפלסטיק ו 1 35 צלחת פטרי מפלסטיק עם 0.1 x MMR עם גנאמיצין (50 μg/mL). מילוי צלחת פטרי 60 מ"מ עם 70% אתנול.
- מיד לפני הניתוח, להוסיף 0.01 g של קולאגנאז B לאחד הצינורות 50 mL המכיל Ca2 + פתרון. מערבבים היטב ומעבירים את הפתרון לצלחת פטרי טרייה מפלסטיק 60 מ"מ.
- בעזרת מיקרוסקופ מבתר, זהה עוברים בשלב ההתפתחותי הרצוי. השתמש בפיפטה העברה סטרילית כדי להעביר לפחות שישה עוברים מתאימים לאחד 100 מ"מ לוחות המכילים 0.1 x MMR + בג הכין בשלב 2.2.4. . זה ישמש כלוחית האחיזה
- השתמש בצנרת העברה סטרילית כדי להעביר עובר אחד לצלחת 100 mm השני המכיל 0.1 x MMR + בג. . זה ישמש כלוחית הניתוח
- אם מבתר את העוברים מספיק כדי לעבור (בערך בשלב 23 או יותר), מורדם כל עובר לפני הניתוח על ידי העברת אותו למנה המכילה 0.1% 3-האמיזואיקון חומצה אתיל אסתר מדולל ב 0.1 x MMR עם גנאמיצין (50 μg/mL). לאחר העובר הוא ללא קיבוע, להעביר אותו בחזרה למנה המכילה 0.1 x MMR עם הג (50 μg/mL) ולהמשיך עם הקרע.
- הסר בזהירות את קרום vitelline המקיף את העובר. זה יכול בקלות ביותר להיעשות באמצעות זוג מלקחיים קהה לייצב את העובר תוך שימוש בזוג מלקחיים עדינים כדי לתפוס את הקרום. למשוך בזהירות עם מלקחיים עדינים לקלף את קרום vitelline בנפרד.
- השתמש מלקחיים עדינים כדי להפריד את האזורים האלה ואת החלק הגייתי של העובר. זה יכול להיעשות באמצעות מלקחיים כדי ' לצבוט ' העובר לאורך הציר האחורי הקדמי, חיתוך אותו לחצי. עם פיפטה העברה סטרילית, להעביר את החלק ה2.2.5 לצלחת 60 mm עם הפתרון הקולגן מוכן בשלב. התעלם מהחלק הגחוני.
- אפשר לחקור את המטה כדי הדגירה בתמיסה הקולגן עבור 1 – 2 דקות בטמפרטורת החדר. העבירו אותו בעדינות. ללוחית הניתוח
- להשלים את הניתוח על ידי הסרת בזהירות את כל שרידי זיהום שיורית ומזועורי מרקמת הרקמה העצבית השוערת של האקטועור. עבור עוברים בשלב 22 או מעלה, הצינור העצבי צריך גם להיות מוסר ונמחק.
הערה: אם יש צורך במהלך הניתוח, את הצלחת של 70% אתנול מוכן בשלב 2.2.4 ניתן להשתמש כדי לנקות או לחטא מחדש את הלקחיים. - לאחר הניתוח יושלם, בעדינות להעביר את ההסבר לצלחת 35 mm של Ca2 + פתרון מוכן בשלב 2.2.3.
- חזור על שלבים 2.4-2.9 עד לאיסוף ארבעה מפעלים.
- השתמש P1000 מיקרופיפטה כדי להעביר את כל ארבע explants לצלחת 35 מ"מ המכיל את הפתרון CMF, לטפל כדי למנוע כל קשר בין explants וממשק מים אוויר. מערבולת בעדינות את המנה כך כל אשכול explants במרכז הצלחת.
- מודלת 1 h בטמפרטורת החדר כדי לאפשר explants לנתק.
הערה: כדי לסייע בדיסוציאציה, 0.025% – 0.01% טריפסין ניתן להוסיף לפתרון CMF. הדבר עשוי להיות הכרחי לדיסוציאציה יעילה של עוברים מבוגרים (שלב 22 ומעלה). - בשלב זה, לפחות שני עוברים מבוים כראוי צריך להישאר על צלחת ההחזקה. להעביר את העוברים האלה לתבשיל טרי מלא עם 0.1 x MMR עם הטוב ביותר בשלב 2.2.4 ולאפשר להם לפתח ללא הפרעה עם הצלחת מכוסה להתאים את הצלחת לחקור. העוברים האלה ישמשו כבקרת אחים.
- השתמש בדבק על מנת לצרף שמיכות מיקרו הנשלט (ראה טבלת חומרים) לחלק התחתון של 35 Mm התרבות תא תבשיל הכין בשלב 2.2.3.
הערה: המקום דבס קטן של דבק סביב הקצוות של שמיכות, ואז ללחוץ אותו בחוזקה על החלק התחתון של המנה תרבות התא. הסימונים המיקום יהיה מוסתר בכל מקום את אנשי הקשר הדבק את הרשת, כך חשוב לשמור את החלק המרכזי של gridded של coverslip ללא דבק. - לאחר explants יש הנתק עבור 1 h, השתמש P100 מיקרופיפטה כדי להעביר אותם לצלחת תרבות התא. על מנת לוחית כמו תאים רבים ככל האפשר על החלק gridded של המנה, להחזיק את הפיפטה בזווית רדודה קרוב לפני השטח של המנה, מיקום את העצה הפיפטה בפינה של הרשת פונה פנימה, ובחוזקה לגרש את ההשעיה התא על פני gridded. ea. באופן אידיאלי, תאים יהיה ליישב באשכול צפוף הדוק.
- דגירה של 1 h בטמפרטורת החדר כדי לאפשר לתאים לדבוק לצלחת. קבע ותעד את השלב ההתפתחותי של העוברים בקרת אחים כאשר הדגירה מתחילה.
- לשלב 5 μL 1 מילימטר Fluo-4 AM ( לראות את הטבלה של חומרים) עם 2 μl של 10% בצורת הריבוי של F-127 חומצה.
הערה: Fluo-4 AM הוא רגיש בהיר ויש לשמור בשפופרת בטוחה או מכוסה בנייר כסף בכל עת. - לאחר שהדגירה תושלם, הזז את המנה המדגם לחדר חושך או למיקום אחר המוגן באור. השתמש מיקרופיפטה כדי להסיר את 100 μL של פתרון מקצה המנה. הוסף את הפתרון הזה כדי להוריד את התמיסה של Fluo-4 AM/הפלורליסטית F-127 חומצה, פיפטה למעלה ולמטה כדי לערבב, ולהחזיר את הנפח המלא למנה לדוגמה. מערבולת בעדינות לערבב.
- לכסות את הצלחת עם רדיד אלומיניום ולאפשר דגירה של 1 h בטמפרטורת החדר. קבע ותעד את השלב ההתפתחותי של העוברים בקרת אחים כאשר הדגירה מתחילה.
- , בסוף הדגירה להשתמש בצינור החרוט הנותרים של 2 מ"מ Ca2 + כדי לבצע שלוש שוטף מדיה בדרך הבאה: 1) להסיר 1 ml של פתרון ממנה, להוסיף 3 מ ל של פתרון טרי, 2) להסיר 3 מ ל של הצלחת, להוסיף 3 מ ל של פתרון טרי, 3) להסיר 3 מ ל של המנה, ל
3. סידן הדמיה
הערה: הדמיה בסידן בוצעה באמצעות מיקרוסקופ קונקמיות הפוך (טבלת חומרים).
- מניחים את צלחת המדגם על הבמה במיקרוסקופ, מטפלת להגן עליו מפני חשיפה לאור סביבתי. לאחר הצלחת מאובטח, השתמש סמן כדי לסמן את הנקודה הקדמית של הלוח כך שאותו שדה של השקפה ניתן למצוא הדמיה הבאים.
- אתר את המדגם מתחת למיקרוסקופ-ראשית ב-10X ולאחר מכן בהגדלה של 20X-ובחר בשדה תצוגה מתאים לדימות. שדה תצוגה אידיאלי הוא תא צפוף, אך לא כל כך צפוף שתאים מצופפים או קשים להבחנה בנפרד.
- כוונן את מוקד המיקרוסקופ כך שהמסווה שנשלט על-ידי הרשת יהיה גלוי. המספרים המסומנים על הכיסויים משמשים כמזהים ייחודיים עבור מקור רשת מסוים וניתן להשתמש בהם כדי לאתר את אותו שדה תצוגה עבור הדמיה נוספת. אם השדה המקורי של התצוגה שנבחר אינו חופף למספרים כלשהם, המשך לקרוא רק עד שמספר הזיהוי יהיה במסגרת.
- קח תמונה של שדה בהיר של השדה הנבחר של התצוגה עם שמיכות הרשת הנשלטת בפוקוס.
- כוונן את הגדרות המיקוד ובנה תמונה בעלת שדה בהיר של שדה התצוגה הנבחר כאשר התאים בפוקוס.
- עם שכבת התא בפוקוס, להאיר את הדגימות עם לייזר 488 ננומטר. ערכי HV ו-היסט יכולים להיות ממוטבים עבור כל ניסוי כדי להבטיח שטווח דינמי של פלואורסצנטית מזוהה בערוץ ה-FITC.
- עבור תמונה של שעתיים, לשנות את תצורת ההדמיה כדי להקליט 901 מסגרות עם זמן סריקה של 3.93 s ומרווח של 8 s. הפעל את התצורה כדי לרכוש תמונה.
- לאחר הדמיה הושלמה, להסיר את הצלחת משלב המיקרוסקופ. הסרת 1 mL של הפתרון מלוחית ולהחליף אותו עם 1 מ ל של 2x MFA (200 mM מגבים, 2 מ"מ EGTA, ו 2 מ"מ m Gso4 ב 7.4% פורמלדהיד).
- מודקת את הצלחת עבור 2 h בטמפרטורת החדר או לילה ב 4 ° c. קבע ותעד את השלב ההתפתחותי של העוברים בקרת אחים כאשר הדגירה מתחילה.
- לאחר קיבעון הושלמה, להסיר את כל הפתרון מלוחית ולהחליף אותו עם 2 מ ל של 1x PBS. חנות צלחות ב -4 ° צ' לעיבוד נוסף.
4. ביטוי גנטי ניתוח: בדיקה סינתזה
- כפי שמתואר להלן, ליצור בדיקת RNA אנטי תחושה עבור היברידיזציה באתרו. בנוסף, ליצור בדיקה הגיוני לאותו גן לשימוש כפקד שלילי.
- כדי לטהר את ה-DNA המכיל את רצף התבנית בדיקה, האיחסן 150 mL של ציר LB עם מניות גלירול בקטריאלי המכיל את התבנית פלבאמצע. מודטה ב 37 ° c עם טלטול של לילה או עד התרבות הוא turbid.
- לטהר את הדנ א הפלסטי מהתרבות. החיידקית באמצעות שיטת הבחירה שלך
הערה: אנו משתמשים בערכת ההכנה midi-Nagel כדי לקבל תשואה גבוהה של דנ א פלמיד. - כדי לוודא כי הפלסמיד מכיל את ההכנסה הצפויה, לבצע תקציר הגבלה ולנתח את המוצרים על ג'ל agarose. פלביניים נימול ניתן גם לנתח על ג'ל agarose לבדוק זיהום DNA גנומית.
- כדי להתאים את ה-DNA של התבנית, להגדיר התגובה תקציר 100 μL הגבלה המכילה 20 μg של דנ א פלמיד, 2 μL של אנזים הגבלה מתאים, ו-1x מאגר המתאים. מודטה ב 37 ° c עבור לפחות 2 h.
- לחלץ דנ א ליניאריות על ידי ביצוע חילוץ פנול/כלורופורם ואחריו חילוץ כלורופורם.
- . מזרז דנ א עם 100% אתנול זה יכול להיעשות במהירות על ידי הוספת שני כרכים של אתנול קר כדי לדגום את זה ב-80 ° צ' עד שהוא מתגבש (15-30 דקות).
- השתמש צנטריפוגה בקירור כדי כדור DNA על ידי ספינינג עבור 20 דקות ב 12,000 x g/4 ° צ'.
- הסר את supernatant ולשטוף את הגלולה עם 200 μL של 70% אתנול. ספין עבור 5 דקות ב 12,000 x/4 ° c.
- הסר את הגלולה הסופרנטאנט והאוויר היבש במשך כ-5 דקות. השהה מחדש ב -20 μL של 1x TE ואחסן ב-4 ° צ' עד לשימוש נוסף.
- כדי לסנתז ולטהר אנטי היגיון בדיקה RNA, ליצור מיקס 2.5 mM rNTP ידי שילוב 15 μL של 10 מ"מ rCTP, 15 μL של 10 מ"מ rGTP, 15 μL של 10 מ"מ rATP, 9.75 μL של 10 מ"מ rUTP, ו 5.25 μL של 10 מ"מ לחפור -11 UTP (ראה לוח חומרים)
- הגדר את 50 μL בתגובה לתמלול ושעתוק מבחנה המכילה 4 μg של DNA תבנית לינבית משלב 4.2-4.10, 15 μL של 2.5 mM rNTP ערבוב משלב 4.11, 10 μL של מאגר תמלול 5x, 5 μL של 0.1 M DTT, 0.5 μL של מעכב RNAse (20 U/μL), ו-1.5 μL של RNA פולימו (T3, T7, או SP6). מודטה 1 h ב 37 ° c.
- הוסף 1.5 נוסף μL של RNA פולימראז לתגובה ולחזור 37 ° c לשעה נוספת.
- הוסף 1 μL של RQ1 DNAse לתגובה ו-דגירה ב 37 ° צ' עבור 10 דקות לבזות תבנית DNA.
- הוסף 30 μL של 7.5 ליטר פתרון למדגם. בפיפטה לערבב ולהדגירה ב-20 ° c לפחות 1 h.
- באמצעות צנטריפוגה בקירור, לסובב את המדגם 25 דקות ב 14,000 x g/4 ° c.
- הסר את supernatant ולשטוף את הגלולה עם 500 μL של 70% אתנול. ספין עבור 5 דקות ב 14,000 x/4 ° c.
- הסר את הגלולה הסופרנטאנט והאוויר היבש במשך כ-5 דקות. השהה מחדש ב -20 μL של המים ללא שכירות.
- צור במלאי בדיקה 10x על ידי דילול המדגם לריכוז של 10 ng/μL במאגר היברידיזציה (50% הטופסאחר, 5x מתחת למטה (מלוחים-נתרן ציטראט; 750 מ"מ היום, 75 mM נתרן ציטראט, pH 7.0), 1 מ"ג/mL torula RNA, 0.1% ברצף-20, 1x הפתרון של Denhardt, 0.1% ברנשים, 10 מ"מ EDTA, ו 100 μg/mL הפארין). אחסן ב-20 ° c עד שימוש נוסף.
5. גנטית ביטוי ניתוח: קרינה פלואורסצנטית היברידיזציה
הערה: יש לבצע את כל הניקוי עם כ-1 מ ל של פתרון באמצעות מעטפת סטרילי, העברה עטופה בנפרד. יש למקם את הפיפטה בקצה הצלחת בעת הסרה או הוספה של פתרון, ושוטפים יש לבצע בעדינות ככל האפשר כדי להבטיח שתאים לא ייעברו ממשטח הצלחת ויאבדו.
- הסר 1x PBS מלוחית (משלב 3.10). החלף עם חדש 1x PBS ו הדגירה 5 דקות בטמפרטורת החדר.
- שילוב 25 מ ל של 0.1 M ידרוקסיאתיל (pH 8.0) עם 62.5 μl של אנהידריד אצטית. . תערבב היטב לשטוף את הצלחת עם הפתרון הזה עבור 10 דקות.
- שטוף את הצלחת באמצעות מידע מהאס. פי.
- לשטוף את הצלחת עם 0.02 M HCl עבור 10 דקות כדי לחדור תאים.
- שטוף 2x ב-1x PBS עבור 5 דקות כל אחד.
- הסר את הפתרון ולהוסיף 1 מ ל של מאגר היברידיזציה (50% מתוך הטופסה, 5x למטה (750 mM הנרוג, 75 מ"מ נתרן ציטראט, pH 7.0), 1 מ"ג/mL-RNA, 0.1% ברצף-20, 1x הפתרון של Denhardt, 0.1% ברנשים, 10 מ"מ EDTA, ו דגירה עם טלטול לפחות 6 h ב 60 ° c.
- הסרת מאגר הכלאה ולהחליף עם 750 μL של 1 x RNA פתרון בדיקה (מדולל טופס מלאי 10x עשה בשלב 4.19. לחוש בבדיקות RNA ניתן להשתמש כשליטה שלילית.
- מודטה עם טלטול עבור 8-14 h ב 60 ° c.
- הסר את הגשוש ואחסן ב-20 ° c.
הערה: ניתן להשתמש בדילול בדיקה של 1x עד שלוש פעמים לפני המחיקה. - לשטוף את הצלחת עם 0.2 x היבריס.
- שוטפים עם המלון בשעה 60 מעלות צלזיוס של 0.2 x.
- הזיזו את הצלחות לטמפרטורת החדר ולטמפרטורה של 5 דקות.
- לשטוף את הצלחת עם היבריס 0.2 x עבור 5 דקות.
- לשטוף את הצלחת עם PBT 1x עבור 15 דקות.
- לשטוף את הצלחת עם 2% H2O2 ב 1x pbt (0.1% טריטון-x-100) עבור 1 H.
הערה: פתרון זה הוא רגיש לאור, כך שהוא צריך להיות טרי עבור כל ניסוי מוגן מפני אור. כמו כן, יש לסוכך על הלוחות מפני אור או במהלך הדגירה. - לשטוף את הצלחת עם 1 x TBST (150 מ"מ היאl, 50 mM טריס-HCl, pH 7.5, 0.1% רצף-20) עבור 15 דקות.
- לדלל את חסימת מגיב 2% במאגר חומצה מלפימית (100 מ"מ חומצה מלפיאית, 150 מ"מ הנאל, pH 7.5). לחסום את התאים בתערובת זו לפחות 1 h בטמפרטורת החדר.
- החלף פתרון חסימה עם נוגדן אנטי digoxygenin-POD מדולל 1:1000 ב 2% חסימת מגיב במאגר חומצה מלפימית. המלון משלב בין לילה ב -4 ° c.
- שטפו את הצלחת 3x עם ה-TBST 1.
- שטוף 4x עם 2mL של 1 x TBST עבור לפחות 15 דקות לשטוף עם נדנדה רציפה.
- לשטוף 2x עם PBT 1x עבור לפחות 10 דקות לשטוף עם נדנדה רציפה.
- לדלל Cy3 מעלה מצודה 1:25 ב 1x PBT. לשטוף את הצלחת עם 750 μL של דילול זה 5 דקות.
הערה: פתרון זה הוא רגיש ביותר באור, ולוחיות הרישוי צריכות להישמר מאור לשארית הניסוי כדי למנוע בליית אותות. - הוסף 2.5 μL של 0.3% H2O2 כדי לפתור את הפתרון הזה ואת הדגירה עם נדנדה רציפה עבור 40 נוספים מינימום בטמפרטורת החדר.
- לשטוף 4x עם TBST 1 x עבור לפחות 15 דקות לשטוף עם נדנדה רציפה.
- לשטוף עם PBT 1x.
- תקן את התאים על-ידי המאגררות עבור 1 h בטמפרטורת החדר ב-1x MFA (100 מ"מ ביותר, 1 מ"מ EGTA, ו-1 מ"מ m4 ב 3.7% פורמלדהיד).
- הסר את הפתרון והחלף ב-1x PBS. אחסן את הלוחות במיכל שאינו מכיל ב-4 ° צ' עד לעיבוד נוסף.
6. הדמיה תאים
הערה: הדמיה בוצעה באמצעות מיקרוסקופ קונפוקלית וקד הפוך.
- מניחים את לוחית המדגם על הבמה במיקרוסקופ, יישור הסימון עשה בשלב 3.1 לקדמת הבמה.
- למקד את התמונה כך את הרשת מרופדת coverslip גלוי, באמצעות תמונת הרשת נלקח בשלב 3.4 כהפניה, להתאים את שדה התצוגה כדי להתאים את שדה התצוגה שנתפסו בתמונת הסידן (סעיף 3).
- לרכוש תמונות בשדה בהיר של הרשת והן את התאים.
- להאיר את הדגימות עם לייזר TRITC 595 ננומטר. התאימו את ערכי הרווח כדי להבדיל כראוי לאות מהרקע באמצעות התמונות מתאי הבקרה השליליים ורוכשים תמונת סטילס.
הערה: באופן אידיאלי, רמות הזריחה ברקע נקבעים על בסיס לוחית שליטה שלילית מעובד במקביל עם בדיקה ללא מיקוד תחושה RNA. הגדרות הרווח מותאמות כך שלוחית זו תופיע לגמרי שחורה (המתאימה לרמות הרקע), ולאחר מכן הוחזק קבוע עבור לוחות אחרים הנמצאים בתמונה מתוך האצווה הניסיונית.
7. עיבוד נתונים
הערה: עיבוד נתונים בוצע באמצעות תוכנת ניקון אלמנטס.
- פתח את התמונה 2 h סידן משלב 3.7. זהה את הפיקסלים המתאימים לכל תא בודד על-ידי בחירה באפשרות זיהוי ספוט בינארי ≫ > נקודות בהירות. ודא שערוץ ה-FITC נבחר.
- עיגולים צבעוניים יופיעו מעל תאים בודדים לאחר ששכבה זו נוצרה. התאם את פרמטרי ההפצה והגודל של התא כך שתאים רבים ככל האפשר יזוהו וישויך למזהה ייחודי.
- עקוב אחר התאים על-פני כל מסגרות התמונה על-ידי ניווט כדי להציג ≫ פקדי ניתוח > אפשרויות מעקב. הגדר 5 מסגרות כפער המירבי בין רצועות, מחק אובייקטים המשויכים לפחות מ-600 מסגרות ובחר באפשרות סגור פערים . בחר ' עקוב אחר קבצים בינאריים ' כדי להחיל מעקב אחר תאים על התמונה.
- לאחר מעקב אחר התאים, מחק ידנית כל אובייקט שאינו תואם לתא בודד (לדוגמה, גוש תאים). עם זאת, אין להוציא נקודות נתונים מניתוח נוסף בהתבסס על המבנה של מעקב פעילות הסידן.
- בחלונית ' תמונה ', בחר ' הצג כיסוי > הצג מזהה אובייקט בינארי'. גלול לסוף התמונה (מסגרת 901) ובחר ' עריכה ' ≫ יצירת תמונת תצוגה (8bit RGB)≫ סגרת נוכחית > אישור. פעולה זו תיצור תמונת תמונה של המסגרת האחרונה של התמונה עם המזהה הבינארי המשויך של כל תא גלוי. . שמור את התמונה הזו
- יצא נתוני סידרת זמן על-ידי בחירת כל האובייקטים ואחריהם ייצוא נתונים ל-Excel. שמירת פלט כקובץ CSV.
- פתח את תמונת הדג. מטב את זיהוי הספוט כמו בשלבים 7.1 – 7.2, באמצעות ערוץ TRITC במקום בערוץ FITC. מחק ידנית את כל הקבצים הבינאריים שהוקצו בצורה שגויה ולאחר מכן בחר באפשרות תוצאות מדידה אוטומטיות > עדכן מדידה כדי לחשב את עוצמת האות של כל תא. יצא תמונת תמונה וטבלת נתונים על-ידי שלבים חוזרים 7.5 ו-7.6.
- צור גיליון אלקטרוני שבו עמודה A נקראת מזהה בינארי של דגים ועמודה B נקראת מזהה סידן בינארי. פתח את התמונות שיוצאו בשלבים 7.5 ו 7.7. עבור כל אובייקט המזוהה בתמונת הדג (שלב 7.7), הקלט את המזהה הבינארי בעמודה A. לאחר מכן, אתר את התא המתאים בתמונת הסידן (שלב 7.5) והקלט את המזהה הבינארי בעמודה B. תאים שלא ניתן לזהותם בביטחון בשתי התמונות לא יתווספו לגיליון האלקטרוני.
הערה: ייתכן שיהיה שימושי להשתמש בתוכנית לעריכת תמונות כגון Adobe Photoshop או עורך תמונות GIMP כדי לפתוח את שתי התמונות, להפוך אחד שקוף למחצה, ולערוך אותו על התמונה התאומה שלו כדי לזהות בקלות רבה יותר את שני המזהים הבינאריים המשויכים לכל תא. - עבור כל תא מזוהה, לאסוף (באופן ידני או עם סקריפט) את נתוני הסידן של סדרת הזמן (משויך מזהה בינארי סידן ומיוצא בשלב 7.6) ואת הנתונים הגנים שלה ביטוי (משויך מזהה בינארי של הדג ומיוצא בשלב 7.7).
הערה: עיבוד וניתוח נתונים במורד הזרם עשוי לכלול איסוף נתונים אלה לתוך טבלת נתונים יחידה והחלת מערך של טכניקות אנליטיות, לרבות ספירת ספייק, ניתוח פרקטלית ואנטרופיה של markovian המאפשרים לחוקר להבחין בדפוסי הרומן של פעילות הסידן 17,18.
תוצאות
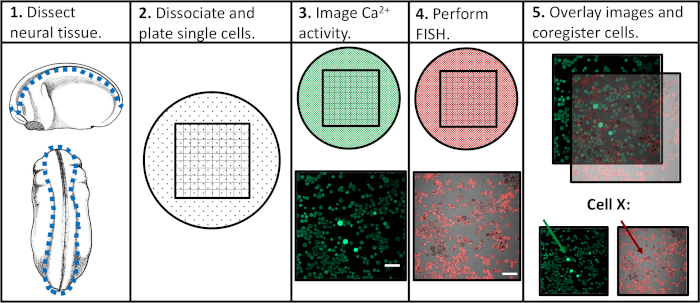
דוגמה מוצלחת של תאים הניתנים לנתק המוכן הדמיה סידן ניתן לראות באיור 2א. תאים הם מצופים בצפיפות, המאפשר את הכמות המירבית של מידע לאסוף מכל תמונה, אבל לא מצופה כל כך בצפיפות כי תאים בודדים לא יכול להיות מכובד בביטחון אחד את השני. הקרינה הפלואורסצנטית מזוהה עבור כל תא מוגדר בתקופת ההדמיה 2 h. הדמיה של מזימה מורכבת המכילה את העקבות של כל התאים שנרשמו בניסוי מגלה את מידת המידה שבה מדידות הצובר או האוכלוסיה יכולות לטשטש דפוסי התנהגות קופצים (איור 2ב'). כאשר הפרופילים המוקלטת של תאים בודדים מבודדים, דוגמאות לפעילות העולה בלתי סדירה האופיינית לתאים מחולל קדמון יכולים להיות מזוהים בבירור. שלא כמו נוירונים בוגרים, תאים עצביים עובריים התערוכה לא סדירה, משתנה מאוד וטבע מורכב של פעילות סידן (איור 2ב). על מנת לכמת את המורכבות הזו, היישום של שיטות ניתוח נתונים שונות הוחל17,18, כולל פרמטרים מגוונים כדי להגדיר ספייק (איור 2ג).
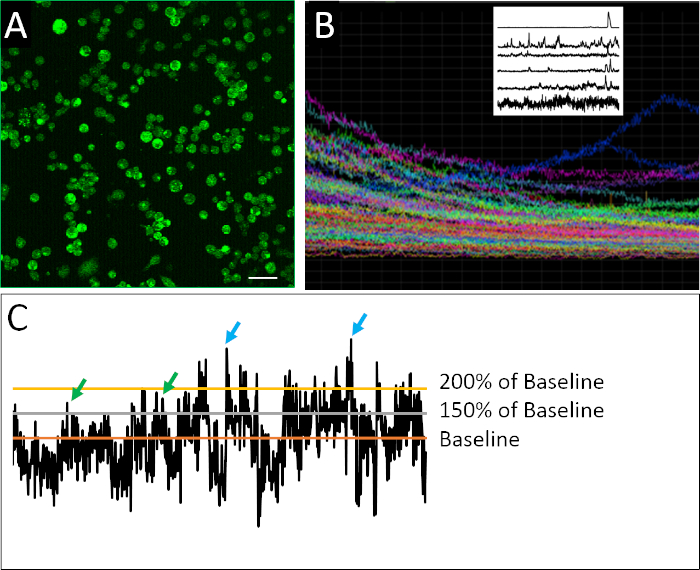
זריחה מוצלחת היברידיזציה באתרו, כולל עיצוב מוצלח סינתזה של בדיקה antisense של אנטי תחושה, ניתן להעריך על ידי השוואת לוחית ניסיוני נגד בקרת רקע מודדת עם שליטה לא מחייב RNA בקרת (איור 3a, B). בקרת בדיקה חיובית יכולה להתבצע גם על ידי עיבוד סוג תא ידוע לבטא את mRNA היעד ברמות הניתן לזיהוי.
זיהוי של אותו תא באמצעות סידן והדמיה דגים דורש כי התאים לשמור בערך את אותו מיקום במהלך הכלאה בדיקה ועיבוד. אם הצלחות מטופלות בערך או שוטף מתבצעות בכוח רב מדי, תאים ניתן להיפטר ממשטח הצלחת או לאיבוד כאשר הפתרון נמחק או מופקד על מיקום אחר על הצלחת, מה שהופך את זה בלתי אפשרי להם להיות תואמים על פני תמונות (איור 4א). אם הפרעה זו משפיעה רק על חלק מהתאים בשדה התצוגה, ייתכן שעדיין ניתן יהיה לזהות ולהקצות מספר תאים בתמונה (איור 4ב). עם זאת, כמות הנתונים המרבית מושגת מניסוי שבו מבוצעת האפשרות FISH בקפידה, ומספר תאים אובדים או משנים את מיקומן בין תמונות (איור 4ג).
פעם אחת הנתונים נאספו כדי לתאר את פעילות הסידן ואת הביטוי הגנטי של מספר סביר של תאים בשלב ההתפתחותי (s) של עניין, ניתוח נוסף ניתן לבצע כדי להעריך את היחסים בין שתי תכונות אלה (איור 1). מספר מדדים הוחלו על ככמת דפוסי פעילות סידן, כולל ספירת/תדר ספייק, כוח ממוצע, אומדן מעריך הרסט, ואת מדידה האנטרופיה של markovian17,18. ביטוי גנטי ניתן להגדיר ככמת על ידי רמת הזריחה המוחלטת או מדורגים על סולם בינארי (כן/לא), בהתאם לשאלות ניסיוני התייחס.
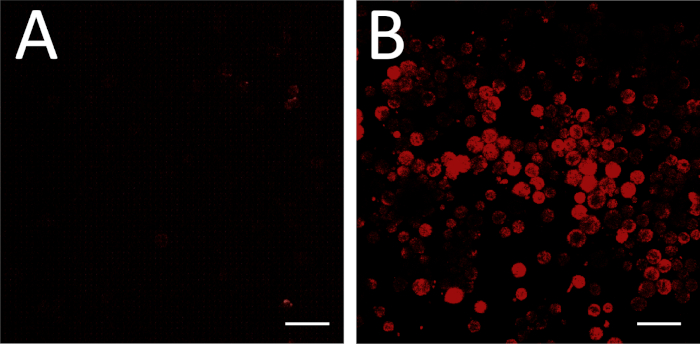
תוצאות של ניסויים איסוף פעילות הסידן עם הביטוי של גנים הסמן העצבי קדמון חשף שיוכים רבים בין דפוסים ספציפיים של פעילות הסידן פנוטיפים הנוירוטרנסמיטר. בשלב הצלחת העצבית (שלב 14), תאים GABAergic ביטוי תא העצב מעכבות סמן גד 1.1 פעילות סידן התערוכה הוא יותר רגיל משרעת יותר מאשר זה של תאים שחסרים גד 1.1 ביטוי(איור 5א). יתר על כן, בעוד אלה גד 1.1המבטא תאים משויכים רמות גבוהות יותר של העלייה משרעת גבוהה, משרעת נמוכה העולה הוא תכופים יותר בתאי glutamatergic לבטא את הslc17a7המרגש לסמן תא העצב.
איור 1: סכמטית של זרימת העבודה הניסיונית. סרגל קנה מידה = 100 μm. תמונות בפאנלים 3-5 נלקחו מ-Paudel et al. (2019)17. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 2: הדמיית סידן ופרופילי פעילות לדוגמה. (א) פעילות סידן תאיים כפי שדווח על ידי FLUO4-AM. כל תמונה 2 h מורכב 901 מסגרות, עם מסגרת נציג אחד כאן. (ב) מגרש מורכב של עוצמה פלואורסצנטית לאורך זמן בכל התאים בתוך שדה התצוגה של התמונה. העקבות מצביעים בבירור על הלבנה של צבע אינדיקטור (Fluo4) שעות נוספות. העלילה סריקה על השמאלית העליונה מציג עקבות נציג של פעילות הסידן לאחר יישום של אלגוריתם דה מגמות שפותחו על ידי האלירס ו Boelen19, שבו תאים הראו כאן מוצג דפוס מגוונות של התנהגות העולה. (ג) יישום של ספי שונות (150% ו 200% של בסיס הבסיס, כאשר הבסיס הוא הממוצע של עוצמת פלורסנט דה-מרין) כדי להגדיר יתד (חיצים ירוקים וכחולים). סרגל קנה מידה = 100 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 3: הדמיית דגים. (א) דג ביצע עם בדיקה לא מחייב RNA התחושה כפקד שלילי. הגדרות הדמיה הותאמו כך שתאים לא יופיעו בפלורסנט. שדות תצוגה מסוימים עשויים לכלול הריסות שאינן תאים עם מספר קרינה פלואורסצנטית, כגון לראות בפינות הימניות העליונות והתחתונות של (א); ניתן להתעלם מאלה למטרת הגדרת רקע. (ב) הגדרות הדמיה זהה משמשות לאחר מכן לתמונה צלחת ניסיוני (אנטי היגיון בדיקה RNA). הקרינה הפלואורסצנטית תחת תנאים אלה תואמת הביטוי גנים מעל הרקע. סרגל קנה מידה = 100 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: שכבת-על של תמונה ורישום כיסוי. ייצוגים סכמטית של תמונה מדגם עבור פעילות הסידן (תאים המיוצגים על ידי עיגולים ירוקים מלאים) ואחרי דגים (תאים המיוצגים על ידי עיגולים אדומים מוצללים). (א) תאים שהועברו באופן משמעותי במהלך הטיפול במדגם והעיבוד לא ניתן לזיהוי מהימן על-פני שתי התמונות. (ב) שיבוש תאים עלול להשפיע על תאים מסוימים בלבד בשדה התצוגה. תאים מסוימים יכולים להיות מזוהים בבירור בשתי התמונות, בעוד שלאחרים אין אפשרות להתאים בביטחון. (ג) אם מטפלים בדגימות בזהירות, רוב התאים יישארו ללא הפרעה וניתן יהיה לזהותו בשתי התמונות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 5: דוגמה ליישום של שיטה זו, מגרשים המציגים שיוכים בין פעילות הסידן וביטוי הגנים (נגבה ו Glut עבור גנים גד 1.1 ו slc17a7 בהתאמה) בשלב הלוחית העצבית קסנפוס laevis. בשלב 14, גד 1.1-תאים מתטיבי (נגבה) התערוכה משרעת גבוהה יותר ופעילות סידן רגילה כפי שהוגדר על ידי (A) markovian entropy18 ו-(ב) ספייק ספירות באמצעות ספי 125%, 150%, 200% ו 300% מהממוצע של עוצמת הפלורסנט de-trended (בסיס)17 מאשר slc17a7 תאים חיוביים (glu כוכבים מצביעים על הבדלים משמעותיים סטטיסטית על פי שני בונפררוני-תיקון שתי לדוגמה Kolmogorov – סמירנוף מבחן (p < 0.05) ו-d של כהן סטטיסטיקה עבור גודל אפקט (n = 5 תרבויות ו-> 100 תאים; * 0.2 ≤ | d | < 0.5). הדמות הותאמה מצויר והותאם מערכת הנתונים שהתקבלו מ-Paudel et al.17. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
דפוסים אופייניים של פעילות הסידן נצפו בתאים העושים את מערכת העצבים המתפתחת, עם סוגים ספציפיים של פעילות הקשורים תהליכים נוירוהתפתחותיים ברורים. עם זאת, הבנה נוספת של מנגנונים שבהם מידע זה דפוסי פעילות צפופה מתורגמים לתגובות הטרנססקריפט דורש מידע על פעילות הסידן ביטוי גנים להיות נאסף עם רזולוציה תא בודד. בעוד מערכות שהפגין פעילות הסידן סטריאוטיפית, כגון נוירונים בוגרים, יכול להיות מתוח באופן סביר ברמה גורפת, דפוסים חריגים המאפיינות את מערכת העצבים העובריים מוסווה בקלות על ידי הקלטות פחות מדויקות.
המסגרת הניסיונית שהוקמה בפרוטוקול זה ניתנת להתאמה בקלות למגוון רחב של סוגי תאים וכתבים פלורסצנט. רקמות המכילות כמעט כל סוג תא או שילוב של סוגי תאים ניתן לגזור מן האורגניזם מודל של עניין מצופה עבור הדמיה תא יחיד. בנוסף להתרת זיהוי תאים ובידוד ההשפעה של תהליכים מבוססי תא, גישה לתרבות התא הראשית מאפשרת לניסויים להגדיר רכיבי מדיה כרצונך. לדוגמה, ניסויים בהשוואת הפעילות של מקדים עצביים ב 2 מ"מ Ca2 + פתרון בוצעו כדי לחקור אם את היחסים בין תדר ספייק ו מעצבי הראש בחוט השדרה העובריים יכול להיות לכידה ללא השפעה של אינטראקציות תא תא13,20.
בעוד פרוטוקול זה ממנף את סמן פלורסנט Fluo4-AM כדי לזהות פעילות סידן תאיים, בהתאם לקריטריוני הבחירה, משתמשים יכולים לבחור סמנים מסחרית זמינים אחרים21, כולל מחווני סידן מקודד גנטית. באופן דומה, סמנים חלופיים יכול לשמש כדי לנטר שינויים דינמיים לריכוז של יון של עניין (כולל K+, Na+, ו zn2 +), ממברנה פוטנציאל, או pH סלולרי. ניתן לשנות את הגדרות ההדמיה ואת משך התמונה לפי הצורך.
למרות שאנו מתואמים את פעילות הסידן והפנוטיפ העצבי כיישום ספציפי, שיטה זו ישימה גם עבור מגוון רחב של תכונות סלולריות אחרות. למשל, הזריחה באתרו היברידיזציה ניתן לבצע עם בדיקות נגד כל גן של עניין, כולל הסמן העצבי צ'אט או הגורם שעתוק נחרה, המאפשר זיהוי רגיש של פאנל להתאמה אישית של מינים mRNA. בדיקה אלה יכול להיות מתוכנן כדי להיות הספציפי isoform, תמיכה ספציפיות ליעד נוסף במידת הצורך. דגים כפולים ניתן לבצע באמצעות הבדיקות מצובעות למספר שני fluorophores שונים, המאפשר הערכה סימולטני של הביטוי של גנים מרובים. עם זאת, השטיפות הנוספות הנדרשות על-ידי סוג זה של ניסוי משויכות לסיכוי מוגבר של אובדן או תנועה של תאים ודורשות ניסיון ועדינות להתבצע בהצלחה.
ללא קשר לשינויים ספציפיים לניסוי שבוצעו בפרוטוקול זה, קיימים מספר שלבים מרכזיים הדורשים תשומת לב מדוקדקת. הניתוח צריך להתבצע בזהירות כדי להסיר את כל הרקמות הממזהם או אוכלוסיות התאים; מכיוון שהמפנג המרחבי אובד כאשר האקסוצמחים ממונתק, כל התאים הנותרים מרקמות שכנות יהפכו להיות ביחד עם התאים המעניינים והזהים אותם. לאחר שתאים מצופים, יש לטפל בדגימות בעדינות ככל האפשר כדי למנוע את העובדה שתאים אינם ממקומם. והכי חשוב, משמעות הדבר היא כי כל השינויים בפתרון צריך להתבצע לאט ובזהירות, עם הפיפטה ממוקם בקצה הצלחת כאשר הפתרון הוא הוסר והוסיף. זה יבטיח כי תאים יכולים להיות מזוהים בביטחון הן בתמונות הסידן והדגים. אם התאים מופרנים במהלך העיבוד, ייתכן שיהיה בלתי אפשרי לזהות חלק מהתאים המתאימים או את כולם בין שתי התמונות. אנו מייעצים על הצד של זהירות עם משימות אלה, כך שרק תאים מקבילים באופן משמעי משמשים לניתוח נוסף.
בהתאם לשאלה הביולוגית הנדונה, מגוון של גישות ניתוח עשוי להיות מתאים. ניתן לעבד את פעילות הסידן של סדרת הזמן ולכמת אותה במגוון דרכים, בעזרת המערכת הכוללת גמישות בבחירת פרמטרים מסוג דה-מגמות, מדדי ניתוח ופרמטרי ניתוח (לדוגמה,% הסף הבסיסי המשמש להגדרת מדקר סידן). היחסים בין הסידן והרמה של ביטוי הגנים יכולים להיות מצוירים על ידי ניתוח ביטוי הגנים כערך מוחלט או זריחה יחסית שחולצו מתמונת הדג. לחילופין, היחסים בין הסידן וביטוי הגנים (נוכחות/היעדרות) יכול להיות מצויר על ידי הגדרת סף של זריחה עבור האות ביטוי גנים חיוביים והקצאת ' כן ' או ' לא ' מזהים לתאים בודדים. כמכלול, הסכימה הניסיונית הזאת מספקת צינור גמיש מאוד לאיסוף וניתוח ראשוני של נתוני סדרת הזמן בשילוב עם נתוני ביטוי הגנים התואמים לתא. ניסויים כאלה יהיה קריטי להבנת טוב יותר את היחסים המורכבים בין דינמיקה תאית לבין שינויים משתנים, כפי שניתן להבין על ידי זיהוי דפוסי הפעילות של הסידן אופייני מעכבות ומרגש הנגזר המכריע של הדיכוי העצבי ב- Xenopus העובריים.
Disclosures
אין קונפליקטים של עניין מוצהר.
Acknowledgements
אנו מודים לוונדי הרבסט ו לינדזי שלייפר על תרומתם לפיתוח פרוטוקולים אלה. עבודה זו נתמכת על ידי מענקים מן המוסדות הלאומיים לבריאות (1R15NS067566-01, 1R15NS067566-01 ו-1R15NS067566-01) כדי MSS.
Materials
| Name | Company | Catalog Number | Comments |
| For Animal Husbandry & Cell Culture | |||
| CHORULON (chorionic gonodotropin) | Merck Animal Health | ||
| Gentamycin sulfate salt | Millipore Sigma | G1264 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Pyrex petri dishes, 100 mm x 20 mm | Millipore Sigma | CLS3160102 | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 35mm | Fisher Scientific | 08-772A | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 60mm | Fisher Scientific | 08-772F | |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | |
| Thermo Scientifc Nunc Cell Culture / Petri Dishes, 35x10mm Dish, Nunclon Delta | Fisher Scientific | 12-565-90 | |
| Fisherbrand Standard Disposable Transfer Pipettes, Nongraduated; Length: 5.875 in.; Capacity: 7.7 mL | Fisher Scientific | 13-711-7M | |
| Ethyl 3-aminobenzoate methanesulfonate | Millipore Sigma | E10521 | |
| Collagenase B | Millipore Sigma | 11088807001 | |
| Dumont #55 Forceps, Dumostar | Fine Science Tools | 11295-51 | |
| Dumont #5 Forceps, Dumostar | Fine Science Tools | 11295-00 | |
| Cellattice Micro-Ruled Cell Culture Surface | Nexcelom Bioscience | CLS5-25D-050 | |
| For Calcium Imaging | |||
| Fluo-4, AM, cell permeant | Thermo Fisher Scientific | F14201 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | Thermo Fisher Scientific | P6866 | |
| For RNA Probe Generation | |||
| PureYield Plasmid Miniprep System | Promega | A1222 | |
| rATP | Promega | P1132 | |
| rCTP | Promega | P1142 | |
| rGTP | Promega | P1152 | |
| rUTP | Promega | P1162 | |
| Digoxigenin-11-UTP | Millipore Sigma | 3359247910 | |
| Rnase Inhibitor | Thermo Fisher Scientific | N8080119 | |
| T3 RNA Polymerase | Promega | P2083 | |
| T7 RNA Polymerase | Promega | P2075 | |
| SP6 RNA Polymerase | Promega | P1085 | |
| RQ1 Rnase-Free Dnase | Promega | M6101 | |
| LiCl Precipitation Solution (7.5 M) | Thermo Fisher Scientific | AM9480 | |
| For Fluorescence In Situ Hybridization | |||
| Acetic Anhydride | Thermo Fisher Scientific | 320102 | |
| Blocking Reagent | Millipore Sigma | 11096176001 | |
| Anti-Digoxigenin-POD, Fab fragments | Millipore Sigma | 11207733910 | |
| Cy3 Mono-Reactive NHS Ester | Millipore Sigma | GEPA13105 | |
| Solution Components | |||
| Calcium chloride, 96% extra pure, powder, anhydrous, ACROS Organixs | Fisher Scientific | AC349610 | |
| Calcium chloride dihydrate | Millipore Sigma | C3306 | |
| CHAPS hydrate | Millipore Sigma | C3023 | |
| Denhardt's Solution (50X) | Thermo Fisher Scientific | 750018 | |
| DTT, Molecular Grade (DL-Dithiothreitol) | Promega | P1171 | |
| Ethylenediaminetetraacetic Acid, Disodium Salt Dihydrate | Fisher Scientific | S311 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid | Millipore Sigma | E3889 | |
| Formamide (Deionized) | Thermo Fisher Scientific | AM9342 | |
| Herparin sodium salt from porcine intestinal mucosa | Millipore Sigma | H3393 | |
| HEPES (Ultra Pure) | Thermo Fisher Scientific | 11344041 | |
| Hydrogen peroxide solution | Millipore Sigma | H1109 | |
| L-Cysteine | Millipore Sigma | 168149 | |
| Magnesium chloride, pure, ACROS Organics | Fisher Scientific | AC223211000 | |
| Magnesium sulfate, 97% pure, ACROS Organixs, anhydrous | Fisher Scientific | AC413480050 | |
| Maleic Acid, 99%, ACROS Organics | Fisher Scientific | ACS125231000 | |
| MOPS (Fine White Crystals/Molecular Biology), Fisher BioReagents | Fisher Scientific | BP308 | |
| Potassium chloride | Millipore Sigma | P9541 | |
| Ribonucleic acid from torula yeast, Type IX | Millipore Sigma | R3629 | |
| Sodium chloride | Millipore Sigma | S7653 | |
| Triethanolamine | Millipore Sigma | 90279 | |
| Tris | Millipore Sigma | GE17-1321-01 | |
| TWEEN 20 | Millipore Sigma | P9416 | |
| Equipment | |||
| Laminar Flow Hood | model of choice | ||
| Dissecting Microscope | model of choice | ||
| Inverted Fluorescence Microscope | Nikon | TE200 | |
| NIS-Elements Imaging Software | Nikon | ||
| Shaking Incubator | model of choice | ||
| Refrigerated Centrifuge | model of choice | ||
| Miscellaneous | |||
| Corning bottle-top vaccum filter system, 0.22 μm pore, 500 mL bottle capacity | Millipore Sigma | CLS430769 | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 |
References
- Humeau, J., et al. Calcium signaling and cell cycle: Progression or death. Cell Calcium. 70, 3-15 (2017).
- Kim, J. M., Lee, M., Kim, N., Heo, W. D. Optogenetic toolkit reveals the role of Ca2+ sparklets in coordinated cell migration. PNAS. 112 (21), 5951-5957 (2016).
- Orrenius, S., Zhivotovsky, B., Nicotera, P. Regulation of cell death: the calcium-apoptosis link. Nature Reviews Molecular Cell Biology. 4 (7), 552-565 (2003).
- Pham, K., et al. Ca2+ and Mg2+ module conformational dynamics and stability of downstream regulatory element antagonist modulator. Protein Science. 24 (5), 741-751 (2015).
- Smedler, E., Uhlén, P. Frequency decoding of calcium oscillations. Biochimica et Biophysica Acta. 1840 (3), 964-969 (2014).
- Moreau, M., Néant, I., Webb, S. E., Miller, A. L., Riou, J. F., Leclerc, C. Ca(2+) coding and decoding strategies for the specification of neural and renal precursor cells during development. Cell Calcium. 59 (2-3), 75-83 (2016).
- Tomida, T., Hirose, K., Takizawa, A., Shibasaki, F., Iino, M. NFAT functions as a working memory of Ca2+ signals in decoding Ca2+ oscillation. EMBO. 22 (15), 3825-3832 (2003).
- Hannanta-Anan, P., Chow, B. Y. Optogenetic Control of Calcium Oscillation Waveform Defines NFAT as an Integrator of Calcium Load. Cell Systems. 2 (4), 283-288 (2016).
- Li, L., Stefan, M. I. Le Novère N. Calcium input frequency, duration and amplitude differentially module the relative activation of calcineurin and CaMKII. PLoS One. 7 (9), 43810 (2012).
- Romano, D. R., Pharris, M. C., Patel, N. M., Kinzer-Ursem, T. L. Competitive tuning: Competition's role in setting the frequency-dependence of Ca2+-dependent proteins. PLoS Computational Biology. 13 (11), 1005820 (2017).
- Pharris, M. C., Patel, N. M., Kinzer-Ursen, T. L. Competitive Tuning Among Ca2+/Calmodulin-Dependent Proteins: Analysis of in silico Model Robustness and Parameter Variability. Cellular and Molecular Bioengineering. 11 (5), 353-365 (2018).
- Gu, X., Olson, E. C., Spitzer, N. C. Spontaneous neuronal calcium spikes during early differentiation. Journal of Neuroscience. 14 (11), 6325-6335 (1994).
- Borodinsky, L. N., Root, C. M., Cronin, J. A., Sann, S. B., Gu, X., Spitzer, N. C. Activity-dependent homeostatic specification of transmitter expression in embryonic neurons. Nature. 429 (6991), 523-530 (2004).
- Ciccolini, F., Collins, T. J., Sudhoelter, J., Lipp, P., Berridge, M. J., Bootman, M. D. Local and Global Spontaneous Calcium Events Regulate Neurite Outgrowth and Onset of GABAergic Phenotype during Neural Precursor Differentiation. Journal of Neuroscience. 23 (1), 103-111 (2003).
- Weissman, T. A., Riquelme, P. A., Ivic, L., Flint, A. C., Kriegstein, A. R. Calcium Waves Propagate through Radial Glial Cells and Modulate Proliferation in the Developing Neocortex. Neuron. 43 (5), 647-661 (2004).
- Nieuewkoop, P. D., Faber, J. . The stages of Xenopus embryonic development. Normal Table of Xenopus laevis. , (1994).
- Paudel, S., et al. Calcium Activity Dynamics Correlate with Neuronal Phenotype at a Single Cell Level and in a Threshold-Dependent Manner. International Journal of Molecular Science. 20 (8), 1880 (2019).
- Marken, J. P., et al. A Markovian Entropy Measure for the Analysis of Calcium Activity Time Series. PLoS One. 11 (12), 0168342 (2016).
- Eilers, P. H. C., Boelens, H. F. M. Baseline Correction with Asymmetric Least Squares Smoothing. Leiden University Medical Centre Report. , (2005).
- Guemez-Gamboa, A., et al. Non-cell-autonomous mechanism of activity-dependent neurotransmitter switching. Neuron. 82 (5), 1004-1016 (2014).
- Paredes, R., Madelaine, , et al. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved