Method Article
Imagem fluorescente de cálcio e subsequente hibridização em Situ para caracterização do precursor neuronal em xenopus laevis
Neste Artigo
Resumo
Apresentamos um protocolo de duas partes que combina imagens fluorescentes de cálcio com hibridização in situ, permitindo que o experimentador correlacione padrões de atividade de cálcio com perfis de expressão genética em um nível unicelular.
Resumo
A atividade espontânea de cálcio intracelular pode ser observada em uma variedade de tipos de células e é proposta para desempenhar papéis críticos em uma variedade de processos fisiológicos. Em particular, a regulação adequada dos padrões de atividade de cálcio durante a embriongênese é necessária para muitos aspectos do desenvolvimento neural vertebrado, incluindo fechamento adequado de tubos neurais, sinaptogênese e especificação do fenótipo neurotransmissor. Embora a observação de que os padrões de atividade de cálcio possam diferir tanto na frequência quanto na amplitude sugere um mecanismo convincente pelo qual esses fluxos podem transmitir sinais codificados para os efeitos a jusante e regular a expressão genética, existente abordagens de nível populacional não têm a precisão necessária para explorar ainda mais essa possibilidade. Além disso, essas abordagens limitam os estudos sobre o papel das interações celular-células, impedindo a capacidade de reafirmar o estado de determinação neuronal na ausência de contato celular-célula. Por isso, estabelecemos um fluxo de trabalho experimental que combina imagens de cálcio de lapso de tempo de explantas neuronais dissociadas com uma fluorescência no ensaio de hibridização situ, permitindo a correlação inequívoca do padrão de atividade de cálcio com molecular fenótipo em um nível de célula única. Conseguimos usar essa abordagem com sucesso para distinguir e caracterizar padrões específicos de atividade de cálcio associados a células neurais diferenciais e células progenitoras neurais, respectivamente; além disso, no entanto, a estrutura experimental descrita neste artigo poderia ser prontamente adaptada para investigar correlações entre qualquer perfil de atividade de série temporal e expressão de um gene ou genes de interesse.
Introdução
O cálcio citosólico livre é fundamental para uma variedade de processos biológicos, que vão desde a proliferação celular e migração até apoptose e autofagia1,2,3. Dentro dessas vias, o cálcio pode exercer efeitos a jusante na expressão genética interagindo com domínios de ligação de cálcio para induzir mudanças conformaçãois que modulam a atividade e as interações proteicas. Por exemplo, um sensor neuronal de cálcio conhecido como O Modulador Antagonista do Elemento Regulatório Downstream (DREAM) é mantido em uma conformação intermediária desdobrada quando vinculado ao cálcio, impedindo-o de interagir com suas metas de proteína e DNA4. Além de servir como uma molécula de sinalização simples, no entanto, a natureza dinâmica dos transitórios intracelulares de cálcio permite que esses padrões de atividade codificassem sinais mais complexos baseados em amplitude ou frequência5,6. A translocação nuclear do fator de transcrição fator nuclear fator nuclear das células T ativadas (NFAT) é reforçada por oscilações de cálcio de alta frequência, mas inibida por oscilações de baixa frequência7. Convincentemente, trabalhos recentes sugerem que o NFAT pode realmente responder à exposição cumulativa de cálcio8. Tanto a calcineurina quanto a proteína Ca2+/calmodulin-dependente de proteínas kinase II (CaMKII) também apresentam respostas distintas aos transitórios de cálcio de uma frequência, duração ou amplitudeespecífica 9. Para adicionar um nível adicional de complexidade regulatória, os modelos computacionais sugerem que muitas proteínas de ligação de cálcio a jusante tornam-se mais ou menos dependentes de frequência em resposta à presença ou ausência de concorrentes vinculantes10,11.
Dentro do sistema nervoso em desenvolvimento, duas classes principais de comportamentos de atividade de cálcio foram definidas e associadas a processos biológicos específicos. Os influxos de cálcio são classificados como "picos" se ocorrerem dentro de células individuais, atingem uma intensidade máxima de ~400% da linha de base em cinco segundos, e exibem dupla decadência exponencial12. Este tipo de sinal está associado principalmente à especificação do fenótipo neurotransmissor13. Em contraste, as "ondas" são definidas como transitórios de cálcio mais lentos e menos extremos em que a concentração intracelular de cálcio de uma célula sobe para ~200% da linha de base durante um período de trinta segundos ou mais, depois diminui ao longo de vários minutos12. Esses sinais geralmente se propagam em várias células vizinhas, e sua presença tem sido associada ao crescimento neurite e à proliferação celular14,15. No entanto, embora essas duas classes tenham sido definidas com base em perfis cinéticos característicos, ainda não está claro exatamente quais características desses padrões estão realmente sendo detectadas pelas células e traduzidas por efeitos a jusante.
Entender a relação entre oscilações intracelulares de cálcio e expressão genética forneceria uma visão crucial de um dos mecanismos regulatórios que garante o desenvolvimento adequado e a padronização do sistema nervoso. Para isso, estudos da medula espinhal embrionária demonstraram que o aumento da atividade do pico de cálcio durante o desenvolvimento está associado a níveis mais elevados de neurônios inibidores, enquanto a diminuição da atividade do pico de cálcio está associada a níveis mais elevados de neurônios excitatórios13. No entanto, esses ensaios em nível populacional não foram usados para associar a atividade de cálcio com a expressão genética em um nível unicelular.
Abordar essas questões no nível da única célula oferece várias vantagens distintas em relação ao trabalho anterior. Por um lado, a capacidade de avaliar a atividade de cálcio e a expressão genética em muitas células individualmente permite que o repertório completo de padrões de atividade distintos seja observado sem ser ofuscado por uma medição de nível a granel. Além disso, estudar essas relações na cultura primária unicelular significa que as ligações autônomas entre a atividade de cálcio e a expressão genética serão mantidas, enquanto as interações que requerem comunicação celular-célula serão revogadas. Portanto, essa abordagem permite que esses mecanismos autônomos sejam estudados isoladamente. No entanto, também permite que o papel da atividade de cálcio não-autônomo seja elucidado e interrogado. Por exemplo, as células podem ser dissecadas a partir de um embrião no estágio da placa neural, cultivada até que os controles dos irmãos atinjam o estágio do tubo neural e, em seguida, comparados com células que foram recentemente dissecadas a partir de um embrião em estágio neural-tubo. Isso permite a comparação direta das células que retiveram a comunicação celular-célula em um período de desenvolvimento fundamental para aqueles em que a comunicação celular-célula foi abolida.
Ao buscar abordar as limitações das abordagens experimentais anteriores, desenvolvemos um protocolo que permitiria a avaliação da atividade de cálcio e da expressão genética em células progenitoras neurais individuais, facilitando a correlação de padrões de atividade específicos com programas de diferenciação subsequentes. O tecido neural foi dissecado a partir de laevis xenopus em vários estágios do desenvolvimento neural, dissociado em células únicas, e imageed via microscopia confocal na presença de um indicador de cálcio fluorescente. Após a imagem de células vivas, as amostras foram fixadas e ensaios via fluorescência na hibridização situ (FISH) para detectar a expressão de um gene ou isoforme de interesse. É importante ressaltar que as células individuais podem ser rastreadas em ambos os experimentos de imagem, o que significa que o perfil de atividade de cálcio de uma célula e seu nível de expressão genética podem ser associados entre si(Figura 1). O protocolo relatado aqui tem o objetivo de sondar relações entre padrões de atividade de cálcio e expressão genética em neurodesenvolvimento embrionário em Xenopus laevis. No entanto, a estrutura experimental mais ampla (imagem de curso de tempo unicelular seguida de FISH e coregistro de imagem) pode ser modificada e aplicada a praticamente qualquer tipo de célula, repórter fluorescente e gene de interesse.
Protocolo
Todo o trabalho envolvendo animais foi realizado de acordo com protocolos aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) do Colégio William e Maria.
1. Cuidados com animais e manuseio de embriões
- Induzir o acasalamento natural administrando uma injeção subcutânea de gonadotropina chorionica humana (HCG) no saco linfático dorsal do adulto Xenopus laevis em uma dose de 600 U para fêmeas e 400 U para machos.
- Após a injeção, coloque pelo menos um macho e um sapo fêmea em um tanque de espera de temperatura ambiente durante a noite. A colocação de ovos normalmente começa de 9-12 h após a administração do HCG.
- Coletar embriões. Degeleia lavando suavemente com 2% de cisteína (pH 8.0) por 2-4 min.
- Enxágüe os embriões 3x em 0,1x A solução modificada do Ringer (MMR) de Mark (100 mM NaCl, 2 mM KCl, 1 mM MgSO4, 2 mM CaCl2, 5 mM HEPES, pH ajustado para 7,4-7,6).
- Transfira os embriões para placas de petri de vidro de 100 mm contendo 0,1x MMR e 50 μg/mL gentamicina. Uma densidade de 50-100 embriões por prato é apropriada.
- Incubar os pratos a 14 °C-22°C e permitir que os embriões se desenvolvam até chegarem ao estágio de desenvolvimento desejado. Remova periodicamente células não fertilizadas e embriões necrosados ou anormalmente em desenvolvimento com uma pipeta de transferência plástica.
NOTA: Para garantir a consistência, o desenvolvimento é realizado de acordo com critérios morfológicos definidos por Nieuwkoop e Faber16. As etapas de interesse variarão com base no foco experimental. Por exemplo, os principais marcos neurodesenvolvimentísticos estão associados ao Estágio 14 (início da neurulação), estágio 18 (início do fechamento do tubo neural) e estágio 22 (início de alongamento do botão de cauda).
2. Dissecação de embriões e preparação de amostras
- Preparação de soluções
- Prepare 2 mM Ca2+ solução contendo 116 mM NaCl, 0,67 mM KCl, 2 mM CaCl2·2H2O, 1,31 mM MgSO4e 4,6 mM Tris. Para cada solução de 100 mL, adicione 1 mL de penicilina/estreptomia (10.000 penicilina U/mL; 10.000 μg/mL estreptomicina). Ajuste o pH para 7,8 e esterilize o filtro.
- Prepare a solução sem cálcio e magnésio (CMF) combinando 116 mM NaCl, 0,67 mM KCl, 4,6 mM Tris e 0,4 mM EDTA. Ajuste o pH para 7,8 e autoclave para esterilizar. Para cada solução de 100 mL, adicione 1 mL de penicilina/estreptomia (10.000 penicilina U/mL; 10.000 μg/mL estreptomicina). Ajuste o pH para 7,8 e esterilize o filtro.
- Preparação de placas para dissecação e imagem
- UV-esterilizar dois pratos de Petri de plástico de 35 mm e um Prato de Cultura Celular de 35 mm (ver Tabela de Materiais).
- Enquanto trabalha em um capô de fluxo laminar, prepare dois tubos cônicos plásticos de 50 mL contendo 10 mL de 2 mM Ca2+ solução cada.
- Continue trabalhando na capa de fluxo de laminar e adicione 2 mL de 2 mM Ca2+ solução a uma placa de Petri de plástico de 35 mm, 2 mL de 2 mM Ca2+ solução para um Prato de Cultura Celular de 35 mm e 2 mL de solução CMF para uma placa de Petri de plástico de 35 mm.
- Fora do capô de fluxo laminar, encha duas placas de Petri de 100 mm de plástico e uma placa de Petri de 35 mm de plástico com 0,1x MMR com gentamicina (50 μg/mL). Encha uma placa de Petri de plástico de 60 mm com 70% de etanol.
- Imediatamente antes da dissecação, adicione 0,01 g de Collagenase B a um dos tubos de 50 mL contendo solução Ca2+. Misture bem e transfira a solução para uma placa de Petri de plástico de 60 mm.
- Com a ajuda de um microscópio dissecando, identifique embriões do estágio de desenvolvimento desejado. Use uma pipeta de transferência estéril para transferir pelo menos seis embriões apropriados para uma das placas de 100 mm contendo 0,1x MMR + gentamicina preparada na etapa 2.2.4. Isso servirá como a placa de detenção.
- Use uma pipeta de transferência estéril para transferir um embrião para a segunda placa de 100 mm contendo 0,1x MMR + gentamicina. Isso servirá como placa de dissecção.
- Se dissecar embriões com idade suficiente para mover (aproximadamente estágio 23 ou mais), anestesiar cada embrião antes da dissecação transferindo-o para um prato contendo 0,1% 3-aminobenzoicácido etil ester diluído em 0,1x MMR com gentamicina (50 μg/mL). Uma vez que o embrião é imobilizado, transfira-o de volta para o prato contendo 0,1x MMR com gentamicina (50 μg/mL) e continue com a dissecação.
- Remova cuidadosamente a membrana vitellina que circunda o embrião. Isso pode ser feito mais facilmente usando um par de fórceps contundentes para estabilizar o embrião enquanto usa um par de fórceps finos para agarrar a membrana. Puxe cuidadosamente com os fórceps finos para descascar a membrana de vitellina.
- Use fórceps finos para separar as regiões dorsal e ventral do embrião. Isso pode ser feito usando os fórceps para 'beliscar' o embrião ao longo do eixo anterior-posterior, cortando-o ao meio. Com uma pipeta de transferência estéril, transfira a porção dorsal para a placa de 60 mm com solução colagenase preparada na etapa 2.2.5. Descarte a porção ventral.
- Permita que a explanta dorsal incubar na solução colagenase por 1-2 min à temperatura ambiente. Transfira-o suavemente de volta para a placa de dissecção.
- Complete a dissecação removendo cuidadosamente toda a contaminação endódrmica e mesodérmica residual do tecido neural presuntivo do ectoderm. Para embriões no Estágio 22 ou mais, o tubo neural também deve ser removido e descartado.
NOTA: Se necessário durante a dissecção, o prato de 70% de etanol preparado na etapa 2.2.4 pode ser usado para limpar ou reesterilizar os fórceps. - Uma vez que a dissecação esteja completa, transfira suavemente a explanta para a placa de 35 mm de solução Ca2+ preparada na etapa 2.2.3.
- Repita as etapas 2.4-2.9 até que quatro explantas sejam coletadas.
- Use uma micropipette P1000 para transferir todas as quatro explantas para a placa de 35 mm contendo solução CMF, tomando cuidado para evitar qualquer contato entre as explantas e a interface ar-água. Gire suavemente o prato para que todas as explants se aglomeram no centro da placa.
- Incubar 1 h à temperatura ambiente para permitir que explants se dissociam.
NOTA: Para auxiliar na dissociação, pode ser adicionada a tentação de 0,02% a 0,01% à solução CMF. Isso pode ser necessário para uma dissociação eficiente de embriões mais antigos (estágio 22 ou mais). - Neste ponto, pelo menos dois embriões devidamente encenados devem permanecer na placa de detenção. Transfira esses embriões para um prato fresco recheado com 0,1x MMR com gentamicina preparado na etapa 2.2.4 e permita que eles se desenvolvam sem ser incomodado com o prato coberto para combinar com o prato explant. Esses embriões servirão como controles de irmãos.
- Use supercola para anexar um deslizamento de cobertura micro-governado (ver Tabela de Materiais) na parte inferior do Prato de Cultura Celular de 35 mm preparado na etapa 2.2.3.
NOTA: Coloque pequenos dabs de supercola ao redor das bordas do deslizamento de cobertura, em seguida, pressione-o firmemente contra a parte inferior do Prato de Cultura Celular. As marcas posicionais serão obscurecidas em qualquer lugar que a cola entre em contato com a grade, por isso é importante manter a parte central do deslizamento de cobertura livre de adesivos. - Depois que as explantas se dissociaram por 1h, use uma micropipette P100 para transferi-las para o Prato de Cultura Celular. A fim de emplacar o maior número possível de células na porção gridded do prato, segure a pipeta em um ângulo raso perto da superfície do prato, posicione a ponta pipette no canto da grade voltada para dentro, e expulse firmemente a suspensão da célula através do ar gridded ea. Idealmente, as células se estabelecerão em um aglomerado apertado e denso.
- Incubar por 1h à temperatura ambiente para permitir que as células aderem à placa. Determine e registre o estágio de desenvolvimento dos embriões de controle de irmãos quando essa incubação começa.
- Combine 5 μL 1 mM Fluo-4 AM (ver Tabela de Materiais) com 2 μL de 10% ácido F-127 plurônico.
NOTA: Fluo-4 AM é sensível à luz e deve ser mantido em um tubo leve ou coberto de papel alumínio o tempo todo. - Depois que a incubação estiver completa, mova o prato de amostra para uma sala escura ou outro local protegido pela luz. Use uma micropipette para remover 100 μL de solução da borda do prato. Adicione esta solução à alíquota do fluo-4 AM/Ácido F-127, pipette para cima e para baixo para misturar, e devolver o volume completo ao prato de amostra. Redemoinho suavemente para misturar.
- Cubra a placa com papel alumínio e deixe incubar por 1h à temperatura ambiente. Determine e registre o estágio de desenvolvimento dos embriões de controle de irmãos quando essa incubação começa.
- No final da incubação, use o tubo cônico remanescente de 2 mM Ca2+ para realizar três lavantes de mídia da seguinte forma: 1) remova 1 mL de solução do prato, adicione 3 mL de solução fresca, 2) remova 3 mL de solução do prato, adicione 3 mL de solução fresca, 3) remova 3 mL de solução do prato, adicione 3 mL de solução fresca.
3. Imagem de cálcio
NOTA: A imagem de cálcio foi realizada utilizando um microscópio confocal invertido (Tabela de Materiais).
- Coloque a placa de amostra no estágio do microscópio, tomando cuidado para protegê-la da exposição à luz ambiente. Uma vez que a placa esteja presa, use um marcador para rotular o ponto frontal da placa para que o mesmo campo de visão possa ser encontrado em imagens subsequentes.
- Localize a amostra o microscópio — primeiro em 10X e depois na ampliação de 20X — e selecione um campo de visão apropriado para imagens. Um campo de visão ideal é denso celular, mas não tão denso que as células são agrupadas ou difíceis de distinguir individualmente.
- Ajuste o foco do microscópio para que o deslizamento de cobertura com tampa da grade seja visível. Os números marcados no deslizamento de cobertura servem como identificadores exclusivos para locus de grade particular e podem ser usados para localizar o mesmo campo de visão para imagens adicionais. Se o campo de visão originalmente selecionado não se sobrepor a nenhum número, reajuste até que um número identificável esteja no quadro.
- Tire uma imagem de campo brilhante do campo de visão selecionado com o deslizamento de cobertura governado pela grade em foco.
- Ajuste as configurações de foco e tire uma imagem de campo brilhante do campo de visão selecionado com as células em foco.
- Com a camada celular em foco, ilumine as amostras com um laser de 488 nm. Os valores de HV e Offset podem ser otimizados para cada experimento para garantir que uma gama dinâmica de fluorescência seja detectada no canal FITC.
- Para uma imagem de duas horas, modifique a configuração de imagem para gravar 901 quadros com um tempo de varredura de 3,93 s e um intervalo de configuração de 8 s. Executar para adquirir imagem.
- Uma vez que a imagem esteja completa, remova a placa do estágio do microscópio. Remova 1 mL de solução da placa e substitua-a por 1 mL de MEMFA 2x (MOPS de 200 mM, 2 mM EGTA e 2 mM MgSO4 em 7,4% formaldeído).
- Incubar a placa por 2 h à temperatura ambiente ou durante a noite a 4°C. Determine e registre o estágio de desenvolvimento dos embriões de controle de irmãos quando essa incubação começa.
- Após a fixação estiver completa, remova toda a solução da placa e substitua-a por 2 mL de 1x PBS. Guarde placas a 4 °C para posterior processamento.
4. Análise de Expressão Genética: Síntese de sondas
- Como descrito abaixo, gere uma sonda antisense rna para hibridização in situ. Além disso, gerar uma sonda de sentido para o mesmo gene para uso como controle negativo.
- A fim de purificar o DNA plasmídeo contendo a sequência do modelo de sonda, inocular 150 mL de caldo LB com estoques de glicerol bacteriano contendo o plasmídeo do modelo. Incuba-se a 37 °C com tremor durante a noite ou até que a cultura seja turva.
- Purificar o DNA plasmídeo da cultura bacteriana usando seu método de escolha.
NOTA: Usamos o kit mcnary-nagel midi-prep para obter altos rendimentos de DNA plasmídeo. - Para confirmar que o plasmídeo contém a inserção esperada, realize uma restrição de digestão e analise os produtos em um gel de agarose. Plasmídeo sem cortes também pode ser analisado em um gel de agarose para verificar se há contaminação de DNA genômica.
- Para linearizar o DNA do modelo, configure uma reação de digestão de restrição de 100 μL contendo 20 μg de DNA plasmídeo, 2 μL de enzima de restrição apropriada e 1x tampão apropriado. Incubar a 37 °C por pelo menos 2h.
- Extrair DNA linearizado realizando uma extração fenol/clorofórmio seguida de uma extração de clorofórmio.
- Precipitar DNA com 100% de etanol. Isso pode ser feito rapidamente adicionando dois volumes de etanol frio à amostra e incubando-o a -80 °C até que se solidifique (15-30 min).
- Use uma centrífuga refrigerada para o DNA de pelotas girando por 20 min a 12.000 x g/4 °C.
- Retire o supernatant e lave a pelota com 200 μL de 70% de etanol. Gire por 5 min a 12.000 x g/4 °C.
- Remova a pelota supernatant e seca a ar por aproximadamente 5 min. Resuspender em 20 μL de 1x TE e armazene a 4 °C até o uso posterior.
- Para sintetizar e purificar sonda antisense RNA, crie uma mistura rNTP de 2,5 mM combinando 15 μL de 10 mM rCTP, 15 μL de 10 mM rGTP, 15 μL de 10 mM rATP, 9,75 μL de 10 mM rUTP, e 5,25 μL de 10 m dig-11 UTP (Ver Materiais de Mesa).
- Configure uma reação de transcrição in vitro de 50 μL contendo 4 μg de DNA linearizado do modelo da etapa 4.2-4.10, 15 μL de mistura rNTP de 2,5 mM a partir da etapa 4.11, 10 μL de buffer de transcrição de 5x, 5 μL de 0,1 M DTT, 0,5 μL de inibidor RNAse (20 U/μL) e 1,5 μL de polimerase RNA apropriada (T3, T7 ou SP6). Incuba1 1 h a 37 °C.
- Adicione um adicional de 1,5 μL de polímero de RNA à reação e volte a 37 °C por mais uma hora.
- Adicione 1 μL de RQ1 DNAse à reação e incuba a 37 °C por 10 min para degradar o modelo de DNA.
- Adicione 30 μL de solução LiCl de 7,5 M para provar. Pipette para misturar e incubar a -20 °C por pelo menos 1h.
- Usando uma centrífuga refrigerada, gire a amostra de 25 min a 14.000 x g/4 °C.
- Retire o supernatant e enxágue a pelota com 500 μL de 70% de etanol. Gire por 5 min a 14.000 x g/4 °C.
- Remova a pelota supernatant e seca a ar por aproximadamente 5 min. Resuspender em 20 μL de água livre de nuca.
- Crie em 10x o estoque de sondas diluindo a amostra a uma concentração de 10 ng/μL em Buffer de Hibridização (50% de formamide, 5x SSC (citrato salino-sódio; 750 mM NaCl, 75 mM de citrato de sódio, pH 7.0), 1 mg/mL torula RNA, 0,1 % Tween-20, 1x Denhardt's Solution, 0,1% CHAPS, 10 mM EDTA e 100 μg/mL heparin). Guarde a -20 °C até mais uso.
5. Análise de Expressão Genética: Fluorescência na Hibridização situ
NOTA: Todas as lavas devem ser realizadas com aproximadamente 1 mL de solução usando uma tubulata de transferência estéril e embrulhada individualmente. A pipeta deve ser posicionada na borda da placa ao remover ou adicionar solução, e as lavas devem ser executadas da forma mais suave possível para garantir que as células não sejam desalojadas da superfície da placa e perdidas.
- Remova 1x PBS da placa (a partir da etapa 3.10). Substitua por 1x PBS fresco e incuba 5 min em temperatura ambiente.
- Combine 25 mL de trietanolamina de 0,1 M (pH 8.0) com 62,5 μL de anidreto acético. Misture bem. Lave a placa com esta solução por 10 min.
- Lave a placa com 1x SSC por 5 min.
- Lave a placa com 0,02 M HCl por 10 min para permeabilizar células.
- Lave 2x com 1x PBS por 5 min cada.
- Remova a solução e adicione 1 mL de Buffer de Hibridização (50% de formamide, 5x SSC (750 mM NaCl, 75 mM de citrato de sódio, pH 7.0), 1 mg/mL torula RNA, 0,1% Tween-20, 1x Denhardt's Solution, 0,1% CHAPS, 10 mM EDTA e 100 μg/mL heparin) para placa. Incubar com tremor por pelo menos 6h a 60 °C.
- Remova o Buffer de Hibridização e substitua por 750 μL da solução 1x RNA Probe (forma diluída do estoque de 10x feito na etapa 4.19. As sondas de RNA do sentido podem ser usadas como um controle negativo.
- Incubar com tremor por 8-14 h a 60 °C.
- Remova a sonda e armazene a -20 °C.
NOTA: Diluição de sonda 1x pode ser reutilizada até três vezes antes de ser descartada. - Enxágüe a placa com 0,2x SSC.
- Lave com SSC fresco de 0,2x por 1h a 60 °C.
- Mova as placas para temperatura ambiente e equilibre por 5 min.
- Lave a placa com 0,2x SSC por 5 min.
- Lave a placa com 1x PBT por 15 min.
- Lave a placa com 2% H2O2 em 1x PBT (0,1% Triton-x-100) por 1 h.
NOTA: Esta solução é sensível à luz, por isso deve ser feita fresca para cada experimento e protegida da luz. As placas também devem ser protegidas da luz ou frustradas durante esta incubação. - Lave a placa com 1x TBST (150 mM NaCl, 50 mM Tris-HCl, pH 7.5, 0,1%Tween-20) por 15 min.
- Diluição de bloqueio de reagente para 2% em Tampão ácido maleico (100 mM ácido maleico, 150 mM NaCl, pH 7,5). Bloqueie as células nesta mistura por pelo menos 1h à temperatura ambiente.
- Substitua a solução de bloqueio por anticorpo anti-digoxygenin-POD diluído 1:1.000 em 2% de bloqueio de reagente em Tampão ácido maleico. Incubar durante a noite a 4°C.
- Enxágüe a placa 3x com 1x TBST.
- Lave 4x com 2mL de 1x TBST por pelo menos 15 min por lavagem com balanço contínuo.
- Lave 2x com 1x PBT por pelo menos 10 min por lavagem com balanço contínuo.
- Diluir tyramida conjugado cy3 1:25 em 1x PBT. Lave a placa com 750 μL desta diluição por 5 min.
NOTA: Esta solução é extremamente sensível à luz, e as placas devem ser mantidas frustradas ou protegidas da luz para o restante do experimento para evitar a deterioração do sinal. - Adicione 2,5 μL de 0,3% H2O2 a esta solução e incuba com balanço contínuo por mais 40 min à temperatura ambiente.
- Lave 4x com 1x TBST por pelo menos 15 min por lavagem com balanço contínuo.
- Enxágüe com 1x PBT.
- Fixar as células incubando por 1h à temperatura ambiente em 1x MEMFA (100 mM MOPS, 1 mM EGTA e 1 mM MgSO4 em 3,7% formaldeído).
- Remova a solução e substitua por 1x PBS. Guarde as placas em um recipiente frustrado a 4 °C até o processamento posterior.
6. Células de imagem
NOTA: A imagem foi realizada usando um microscópio confocal invertido.
- Coloque a placa de amostra no palco do microscópio, alinhando a marca feita na etapa 3.1 à frente do palco.
- Concentre a imagem para que o deslizamento de cobertura forrado na grade seja visível e, usando a imagem da grade feita no passo 3.4 como referência, ajuste o campo de visão para combinar com o campo de visão capturado na imagem de cálcio (Seção 3).
- Adquirir imagens de campo brilhante tanto da grade quanto das células.
- Ilumine as amostras com um laser TRITC de 595 nm. Ajuste os valores de ganho para distinguir adequadamente o sinal do fundo usando as imagens das células de controle negativas e adquirir uma imagem parada.
NOTA: Idealmente, os níveis de fluorescência de fundo são determinados com base em uma placa de controle negativa processada em paralelo com uma sonda RNA de sentido não-direcionada. As configurações de ganho são ajustadas para que esta placa pareça completamente preta (correspondente aos níveis de fundo), em seguida, mantida constante para outras placas imagens desse lote experimental.
7. Processamento de dados
NOTA: O processamento de dados foi realizado usando o software Nikon Elements.
- Abra a imagem de cálcio de 2 h a partir da etapa 3.7. Identifique os pixels correspondentes a cada célula individual selecionando Binary > Spot Detection > Bright Spots. Certifique-se de que o canal FITC está selecionado.
- Círculos coloridos aparecerão sobre células individuais depois que essa camada for gerada. Ajuste os parâmetros de distribuição e tamanho da célula para que o maior número possível de células sejam reconhecidos e associados a um identificador único.
- Rastreie as células em todos os quadros da imagem navegando para View > Analysis Controls > Tracking Options. Defina 5 quadros como a diferença máxima entre as faixas, exclua objetos associados a menos de 600 quadros e selecione a opção Fechar lacunas. Selecione Binários de Rastreamento para aplicar rastreamento celular à imagem.
- Depois que as células forem rastreadas, exclua manualmente qualquer objeto que não corresponda a uma célula individual (por exemplo, um aglomerado de células). No entanto, os pontos de dados não devem ser excluídos de análises posteriores com base na morfologia do traço de atividade de cálcio.
- No painel de imagem, selecione View Overlay > Mostrar ID de objeto binário. Role até o final da imagem (Quadro 901) e selecione Editar > Criar Exibir Snapshot (8bitRGB)> Quadro atual > OK. Isso criará um instantâneo do último quadro da imagem com o ID binário associado de cada célula visível. Salve esta imagem.
- Exportar dados da série de tempo selecionando todos os objetos seguidos por Dados de Exportação para Excel. Salvar a saída como um arquivo CSV.
- Abra a imagem DO PEIXE. Otimize a detecção de pontos como nas etapas 7.1-7.2, usando o canal TRITC em vez do canal FITC. Exclua manualmente quaisquer binários atribuídos incorretamente e selecione Resultados de Medição Automatizadas > Medição de atualização para calcular a intensidade do sinal de cada célula. Exporte um instantâneo de imagem e tabela de dados repetindo as etapas 7.5 e 7.6.
- Crie uma planilha onde a Coluna A é rotulada de FISH Binary ID e a Coluna B é rotulada de ID Bináriode Cálcio . Abra as imagens exportadas nas etapas 7.5 e 7.7. Para cada objeto identificado na imagem FISH (passo 7.7), registre o ID binário na Coluna A. Em seguida, localize a célula correspondente na imagem de cálcio (passo 7.5) e registre que o ID binário na Coluna B. As células que não podem ser identificadas com confiança em ambas as imagens não devem ser adicionadas à planilha.
NOTA: Pode ser útil usar um programa de edição de fotos como o Adobe Photoshop ou editor de imagens GIMP para abrir ambas as imagens, tornar uma semitransparente e sobrepor-as à sua imagem parceira para identificar e vincular mais facilmente os dois IDs binários associados a cada célula. - Para cada célula identificada, coleto (manualmente ou com um script) seus dados de cálcio em série de tempo (associados ao ID Binário de Cálcio e exportados na etapa 7.6) e seus dados de expressão genética (associados ao ID binário FISH e exportados na etapa 7.7).
NOTA: O processamento e análise de dados a jusante podem envolver a repartimento desses dados em uma única tabela de dados e a aplicação de uma série de técnicas analíticas, incluindo contagem de picos, análise fractal e entropia markovian que permitem ao pesquisador discernir novos padrões de atividade de cálcio 17,18.
Resultados
Um exemplo bem sucedido de células dissociadas preparadas para imagens de cálcio pode ser visto na Figura 2A. As células são densamente banhadas, permitindo que a quantidade máxima de informações seja coletada de cada imagem, mas não tão densamente banhadas que as células individuais não podem ser confiantemente distintas umas às outras. A fluorescência é detectada para cada célula definida durante o período de imagem de 2h. A visualização de um enredo composto contendo os traços para todas as células registradas em um experimento revela o grau em que as medições a granel ou populacional podem obscurecer padrões mais nuances de comportamento espetado(Figura 2B). Quando os perfis registrados de células individuais são isolados, exemplos da atividade irregular característica das células progenitoras neurais podem ser claramente identificados. Ao contrário dos neurônios maduros, as células neuronais embrionárias apresentam natureza irregular, altamente variável e complexa de atividade de cálcio (Figura 2B). Para quantificar essa complexidade, a aplicação de diferentes métodos de análise de dados foi aplicada17,18, incluindo parâmetros diversos para definir um pico (Figura 2C).
Fluorescência bem-sucedida na hibridização situ, incluindo design bem sucedido e síntese de uma sonda antisense mRNA, pode ser avaliada comparando a placa experimental com um controle de fundo incubado com um controle de RNA de sentido não vinculante(Figura 3A,B). Um controle positivo da sonda também pode ser realizado processando um tipo de célula conhecido por expressar o alvo mRNA em níveis detectáveis.
A identificação da mesma célula através da imagem de cálcio e PEIXE exige que as células mantenham aproximadamente a mesma posição durante a hibridização e processamento da sonda. Se as placas forem manuseadas de forma mais ou as lavas forem executadas com muita força, as células podem ser desalojadas da superfície da placa e perdidas quando a solução é descartada ou depositada em um local diferente na placa, tornando impossível que elas sejam combinadas entre imagens(Figura 4A). Se essa interrupção afetar apenas algumas das células do campo de visão, ainda pode ser possível detectar e atribuir algumas células dentro da imagem (Figura 4B). No entanto, a quantidade máxima de dados é obtida a partir de um experimento no qual o PEIXE é realizado cuidadosamente e poucas células são perdidas ou reposicionadas entre imagens (Figura 4C).
Uma vez coletados dados para descrever tanto a atividade de cálcio quanto a expressão genética de um número razoável de células no estágio de desenvolvimento(s) de interesse, novas análises podem ser realizadas para avaliar correlações entre essas duas características (Figura 1). Várias métricas foram aplicadas para quantificar padrões de atividade de cálcio, incluindo contagem/frequência de pico, potência média, estimativa expoente hurst e medição de entropia markovian17,18. A expressão genética pode ser definida quantitativamente pelo nível absoluto de fluorescência ou classificada em uma escala binária (sim/não), dependendo das questões experimentais que estão sendo abordadas.
Resultados de experimentos que colam atividade de cálcio com a expressão de genes de marcadores progenitores neurais revelaram inúmeras associações entre padrões específicos de atividade de cálcio e fenótipos neurotransmissores. No estágio da placa neural (Estágio 14), as células GABAergicas expressando o marcador de neurônio inibidor gad1.1 exibem atividade de cálcio mais regular e mais alta do que a das células que carecem de expressão gad1.1 (Figura 5A). Além disso, enquanto essas células gad1.1-expressação estão associadas a níveis mais altos de espiagem de alta amplitude, o espiking de baixa amplitude é mais frequente em células glutamatergicas expressando o marcador de neurônio slc17a7.
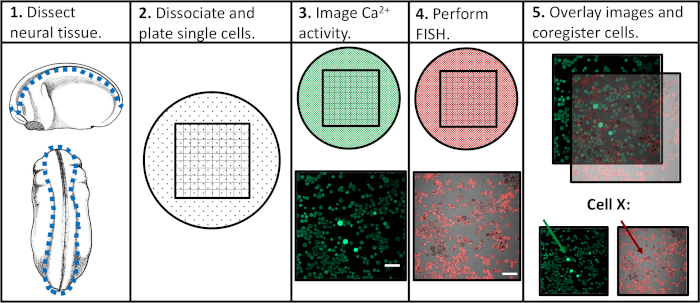
Figura 1: Esquema de fluxo de trabalho experimental. Barra de escala = 100 μm. Imagens em painéis 3-5 foram tiradas de Paudel et al. (2019)17. Clique aqui para ver uma versão maior deste valor.
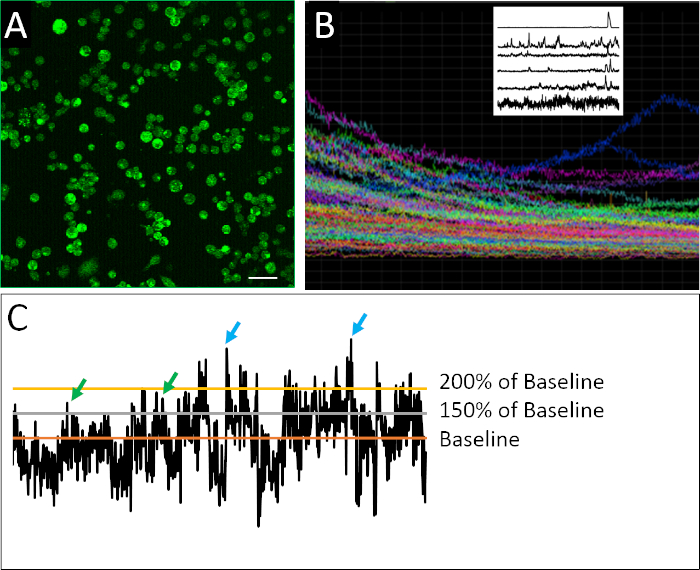
Figura 2: Imagem de cálcio e perfis de atividade de exemplo. (A) Atividade intracelular de cálcio conforme relatado pelo Fluo4-AM. Cada imagem de 2h é composta de 901 quadros, com um quadro representativo aqui. (B)Parcela composta de intensidade de fluorescência ao longo do tempo em todas as células dentro do campo de visão imagemd. Os traços indicam claramente o fotobranqueamento do dique indicador (Fluo4) horas extras. A trama de Raster no canto superior esquerdo mostra traços representativos da atividade de cálcio após a aplicação de um algoritmo de destendência desenvolvido por Eilers e Boelen19, onde as células aqui mostradas exibem um padrão diversificado de comportamento espetado. (C) Aplicação de diferentes limiares (150% e 200% da linha de base, onde a linha de base é a média de intensidade fluorescente destendência) para definir um pico (setas verdes e azuis). Barra de escala = 100 μm. Clique aqui para ver uma versão maior deste valor.
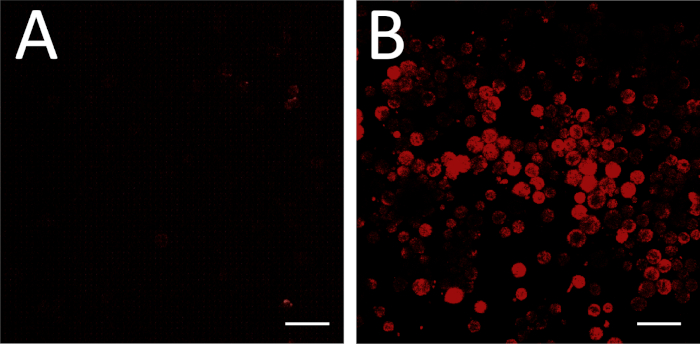
Figura 3: Imagem de PEIXE. (A)FISH realizado com uma sonda RNA de sentido não vinculante como um controle negativo. As configurações de imagem foram ajustadas para que nenhuma célula pareça fluorescente. Alguns campos de visão podem incluir detritos não celulares com alguma fluorescência, como visto nos cantos superiores direito e inferior direito de (A); estes podem ser ignorados com o propósito de configuração de fundo. (B)As mesmas configurações de imagem são então usadas para visualizar uma placa experimental (sonda Antisense RNA). Fluorescência nessas condições corresponde à expressão genética acima do fundo. Barra de escala = 100 μm. Clique aqui para ver uma versão maior deste valor.

Figura 4: Sobreposição de imagem e co-registro. Representações esquemmáticas de uma amostra imaged para atividade de cálcio (células representadas por círculos verdes preenchidos) e depois de FISH (células representadas por círculos vermelhos sombreados). (A)As células que se moveram significativamente durante o manuseio e processamento de amostras não podem ser identificadas de forma confiável entre as duas imagens. (B)A interrupção celular pode afetar apenas algumas células no campo de visão. Algumas células podem ser claramente identificadas em ambas as imagens, enquanto outras não podem ser combinadas com confiança. (C) Se as amostras forem tratadas cuidadosamente, a maioria das células permanecerá intacta e poderá ser identificada em ambas as imagens. Clique aqui para ver uma versão maior deste valor.
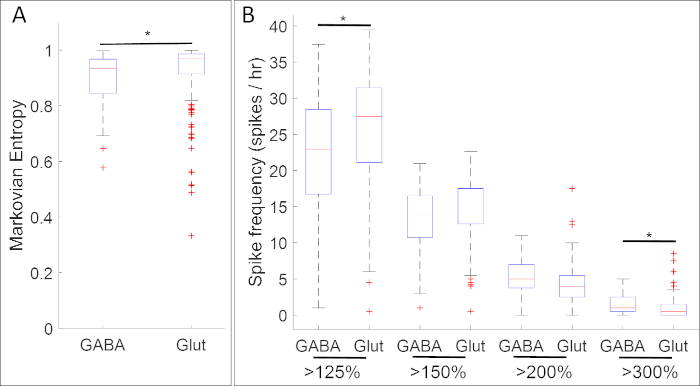
Figura 5: Um exemplo de aplicação deste método, boxplots mostrando associações entre atividade de cálcio e expressão genética (GABA e Glut para genes gad1.1 e slc17a7, respectivamente) em fase de placa neural Xenopus laevis. Na etapa 14, as células gad1.1 postive (GABA) apresentam maior amplitude e atividade de cálcio mais regular definida por (A) entropia18 markoviana e (B) conta com limiares 125%, 150%, 200% e 300% da média da intensidade fluorescente desnatada (linha de base)17 do que as células positivas slc17a7 (Glut). As estrelas indicam diferenças estatisticamente significativas de acordo com tanto o Teste kolmogorov-Smirnov corrigido por Bonferroni (p < 0,05) quanto as estatísticas d de Cohen para o tamanho do efeito (n = 5 culturas e >100 células; * 0,2 ≤ |d| < 0,5). O número foi redesenhado e adaptado a partir de conjunto de dados obtido sem Paudel et al.17. Clique aqui para ver uma versão maior deste valor.
Discussão
Padrões característicos de atividade de cálcio têm sido observados nas células que compõem o sistema nervoso em desenvolvimento, com tipos específicos de atividade associados a processos neurodesenvolvimentísticos distintos. No entanto, uma compreensão adicional dos mecanismos pelos quais esses padrões de atividade densas de informação são traduzidos em respostas transcrições requer informações sobre atividade de cálcio e expressão genética a serem coletadas com resolução unicelular. Embora sistemas que exibem atividade sucrotípica de cálcio, como neurônios maduros, possam ser razoavelmente ensaios em um nível a granel, os padrões irregulares que caracterizam o sistema nervoso embrionário são facilmente mascarados por gravações menos precisas.
A estrutura experimental estabelecida neste protocolo é facilmente adaptável a uma grande variedade de tipos de células e repórteres fluorescentes. Tecido contendo praticamente qualquer tipo celular ou combinação de tipos de células pode ser dissecado a partir de um organismo modelo de interesse e banhado para imagens unicelulares. Além de permitir a identificação celular e isolar o efeito dos processos autônomos de células, uma abordagem primária da cultura celular permite que o experimentador defina componentes de mídia como desejado. Por exemplo, experimentos comparando a atividade de precursores neuronais em solução de 2 mM Ca2+ foram realizados para investigar se as relações entre frequência de espigão e fenótipo neurotransmissor na medula espinhal embrionária podem ser recapituladas sem a influência das interações celular-célula13,20.
Enquanto este protocolo aproveita o marcador fluorescente Fluo4-AM para detectar atividade sucroalcelular, dependendo dos critérios de seleção, os usuários podem selecionar outros marcadores disponíveis comercialmente21,incluindo indicadores de cálcio geneticamente codificados. Da mesma forma, marcadores alternativos poderiam ser usados para monitorar mudanças dinâmicas na concentração de um íon de interesse (incluindo K+, Na+e Zn2+), potencial de membrana ou pH celular. As configurações de imagem e a duração da imagem podem ser modificadas conforme necessário.
Embora correlacionamos a atividade de cálcio e o fenótipo neuronal como uma aplicação específica, este método também é aplicável para uma variedade de outras propriedades celulares. Por exemplo, a fluorescência na hibridização situ pode ser realizada com sondas contra qualquer gene de interesse, incluindo o marcador neuronal ChAT ou o fator de transcrição Engrailed, permitindo a detecção sensível de um painel personalizável de espécies mRNA. Essas sondas podem ser projetadas para serem específicas do isoform, suportando especificidade sumida de alvo adicional, se desejar. Peixe duplo pode ser realizado usando sondas conjugadas a vários dois fluorofóbicos diferentes, permitindo a avaliação simultânea da expressão de múltiplos genes. No entanto, as lavas adicionais exigidas por esse tipo de experimento estão associadas a uma maior chance de perda ou movimento celular e requerem experiência e delicadeza a serem realizadas com sucesso.
Independentemente de quaisquer modificações específicas do experimento feitas neste protocolo, existem vários passos-chave que requerem atenção cuidadosa. As dissecções devem ser realizadas com cuidado para remover todos os tecidos contaminantes ou populações celulares; porque a padronização espacial é perdida quando as explantas são dissociadas, todas as células remanescentes dos tecidos vizinhos ficarão intercaladas e indistinguíveis das células de interesse. Depois que as células são banhadas, as amostras devem ser manuseadas da forma mais suave possível para evitar que as células sejam desalojadas. Mais importante, isso significa que todas as mudanças de solução devem ser realizadas de forma lenta e cuidadosa, com a pipeta colocada na borda da placa quando a solução está sendo removida e adicionada. Isso garantirá que as células possam ser identificadas com confiança em imagens de cálcio e PEIXE. Se as células forem interrompidas durante o processamento, pode ser impossível identificar algumas ou todas as células correspondentes entre as duas imagens. Aconselhamos errar no lado da cautela com essas tarefas, de tal forma que apenas células inequivocamente correspondentes são usadas para análise si só.
Dependendo da questão biológica que está sendo abordada, uma variedade de abordagens de análise podem ser apropriadas. A atividade de cálcio em série de tempo pode ser processada e quantificada de várias maneiras, com flexibilidade experimentadorna na escolha de parâmetros de destendência, métricas de análise e parâmetros de análise (por exemplo, o % do limiar de linha de base usado para definir um pico de cálcio). Correlações entre a atividade de cálcio e o nível de expressão genética podem ser desenhadas analisando a expressão genética como um valor absoluto ou relativo de fluorescência extraído da imagem FISH. Alternativamente, as correlações entre a atividade de cálcio e a expressão genética (presença/ausência) podem ser desenhadas definindo um limiar de fluorescência para sinal de expressão genética positiva e atribuindo identificadores "sim" ou "não" às células individuais. Como um todo, este esquema experimental fornece um pipeline incrivelmente flexível para a coleta e análise preliminar de dados da série de tempo em conjunto com dados de expressão genética compatível com células. Tais experimentos serão fundamentais para entender melhor as complexas relações entre dinâmicacelular e mudanças transcritivas, como exemplificado pela identificação de padrões de atividade de cálcio característicos de precursores neuronais com gordura inibitória e excitatória em laevis xenopus embrionárias.
Divulgações
Nenhum conflito de interesses declarado.
Agradecimentos
Agradecemos wendy Herbst e Lindsay Schleifer por suas contribuições para o desenvolvimento desses protocolos. Este trabalho foi apoiado por subsídios dos Institutos Nacionais de Saúde (1R15NS067566-01, 1R15HD077624-01 e 1R15HD096415-01) para MSS.
Materiais
| Name | Company | Catalog Number | Comments |
| For Animal Husbandry & Cell Culture | |||
| CHORULON (chorionic gonodotropin) | Merck Animal Health | ||
| Gentamycin sulfate salt | Millipore Sigma | G1264 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Pyrex petri dishes, 100 mm x 20 mm | Millipore Sigma | CLS3160102 | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 35mm | Fisher Scientific | 08-772A | |
| Corning Falcon Easy-Grip Tissue Culture Dishes, 60mm | Fisher Scientific | 08-772F | |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | |
| Thermo Scientifc Nunc Cell Culture / Petri Dishes, 35x10mm Dish, Nunclon Delta | Fisher Scientific | 12-565-90 | |
| Fisherbrand Standard Disposable Transfer Pipettes, Nongraduated; Length: 5.875 in.; Capacity: 7.7 mL | Fisher Scientific | 13-711-7M | |
| Ethyl 3-aminobenzoate methanesulfonate | Millipore Sigma | E10521 | |
| Collagenase B | Millipore Sigma | 11088807001 | |
| Dumont #55 Forceps, Dumostar | Fine Science Tools | 11295-51 | |
| Dumont #5 Forceps, Dumostar | Fine Science Tools | 11295-00 | |
| Cellattice Micro-Ruled Cell Culture Surface | Nexcelom Bioscience | CLS5-25D-050 | |
| For Calcium Imaging | |||
| Fluo-4, AM, cell permeant | Thermo Fisher Scientific | F14201 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | Thermo Fisher Scientific | P6866 | |
| For RNA Probe Generation | |||
| PureYield Plasmid Miniprep System | Promega | A1222 | |
| rATP | Promega | P1132 | |
| rCTP | Promega | P1142 | |
| rGTP | Promega | P1152 | |
| rUTP | Promega | P1162 | |
| Digoxigenin-11-UTP | Millipore Sigma | 3359247910 | |
| Rnase Inhibitor | Thermo Fisher Scientific | N8080119 | |
| T3 RNA Polymerase | Promega | P2083 | |
| T7 RNA Polymerase | Promega | P2075 | |
| SP6 RNA Polymerase | Promega | P1085 | |
| RQ1 Rnase-Free Dnase | Promega | M6101 | |
| LiCl Precipitation Solution (7.5 M) | Thermo Fisher Scientific | AM9480 | |
| For Fluorescence In Situ Hybridization | |||
| Acetic Anhydride | Thermo Fisher Scientific | 320102 | |
| Blocking Reagent | Millipore Sigma | 11096176001 | |
| Anti-Digoxigenin-POD, Fab fragments | Millipore Sigma | 11207733910 | |
| Cy3 Mono-Reactive NHS Ester | Millipore Sigma | GEPA13105 | |
| Solution Components | |||
| Calcium chloride, 96% extra pure, powder, anhydrous, ACROS Organixs | Fisher Scientific | AC349610 | |
| Calcium chloride dihydrate | Millipore Sigma | C3306 | |
| CHAPS hydrate | Millipore Sigma | C3023 | |
| Denhardt's Solution (50X) | Thermo Fisher Scientific | 750018 | |
| DTT, Molecular Grade (DL-Dithiothreitol) | Promega | P1171 | |
| Ethylenediaminetetraacetic Acid, Disodium Salt Dihydrate | Fisher Scientific | S311 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid | Millipore Sigma | E3889 | |
| Formamide (Deionized) | Thermo Fisher Scientific | AM9342 | |
| Herparin sodium salt from porcine intestinal mucosa | Millipore Sigma | H3393 | |
| HEPES (Ultra Pure) | Thermo Fisher Scientific | 11344041 | |
| Hydrogen peroxide solution | Millipore Sigma | H1109 | |
| L-Cysteine | Millipore Sigma | 168149 | |
| Magnesium chloride, pure, ACROS Organics | Fisher Scientific | AC223211000 | |
| Magnesium sulfate, 97% pure, ACROS Organixs, anhydrous | Fisher Scientific | AC413480050 | |
| Maleic Acid, 99%, ACROS Organics | Fisher Scientific | ACS125231000 | |
| MOPS (Fine White Crystals/Molecular Biology), Fisher BioReagents | Fisher Scientific | BP308 | |
| Potassium chloride | Millipore Sigma | P9541 | |
| Ribonucleic acid from torula yeast, Type IX | Millipore Sigma | R3629 | |
| Sodium chloride | Millipore Sigma | S7653 | |
| Triethanolamine | Millipore Sigma | 90279 | |
| Tris | Millipore Sigma | GE17-1321-01 | |
| TWEEN 20 | Millipore Sigma | P9416 | |
| Equipment | |||
| Laminar Flow Hood | model of choice | ||
| Dissecting Microscope | model of choice | ||
| Inverted Fluorescence Microscope | Nikon | TE200 | |
| NIS-Elements Imaging Software | Nikon | ||
| Shaking Incubator | model of choice | ||
| Refrigerated Centrifuge | model of choice | ||
| Miscellaneous | |||
| Corning bottle-top vaccum filter system, 0.22 μm pore, 500 mL bottle capacity | Millipore Sigma | CLS430769 | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 |
Referências
- Humeau, J., et al. Calcium signaling and cell cycle: Progression or death. Cell Calcium. 70, 3-15 (2017).
- Kim, J. M., Lee, M., Kim, N., Heo, W. D. Optogenetic toolkit reveals the role of Ca2+ sparklets in coordinated cell migration. PNAS. 112 (21), 5951-5957 (2016).
- Orrenius, S., Zhivotovsky, B., Nicotera, P. Regulation of cell death: the calcium-apoptosis link. Nature Reviews Molecular Cell Biology. 4 (7), 552-565 (2003).
- Pham, K., et al. Ca2+ and Mg2+ module conformational dynamics and stability of downstream regulatory element antagonist modulator. Protein Science. 24 (5), 741-751 (2015).
- Smedler, E., Uhlén, P. Frequency decoding of calcium oscillations. Biochimica et Biophysica Acta. 1840 (3), 964-969 (2014).
- Moreau, M., Néant, I., Webb, S. E., Miller, A. L., Riou, J. F., Leclerc, C. Ca(2+) coding and decoding strategies for the specification of neural and renal precursor cells during development. Cell Calcium. 59 (2-3), 75-83 (2016).
- Tomida, T., Hirose, K., Takizawa, A., Shibasaki, F., Iino, M. NFAT functions as a working memory of Ca2+ signals in decoding Ca2+ oscillation. EMBO. 22 (15), 3825-3832 (2003).
- Hannanta-Anan, P., Chow, B. Y. Optogenetic Control of Calcium Oscillation Waveform Defines NFAT as an Integrator of Calcium Load. Cell Systems. 2 (4), 283-288 (2016).
- Li, L., Stefan, M. I. Le Novère N. Calcium input frequency, duration and amplitude differentially module the relative activation of calcineurin and CaMKII. PLoS One. 7 (9), 43810(2012).
- Romano, D. R., Pharris, M. C., Patel, N. M., Kinzer-Ursem, T. L. Competitive tuning: Competition's role in setting the frequency-dependence of Ca2+-dependent proteins. PLoS Computational Biology. 13 (11), 1005820(2017).
- Pharris, M. C., Patel, N. M., Kinzer-Ursen, T. L. Competitive Tuning Among Ca2+/Calmodulin-Dependent Proteins: Analysis of in silico Model Robustness and Parameter Variability. Cellular and Molecular Bioengineering. 11 (5), 353-365 (2018).
- Gu, X., Olson, E. C., Spitzer, N. C. Spontaneous neuronal calcium spikes during early differentiation. Journal of Neuroscience. 14 (11), 6325-6335 (1994).
- Borodinsky, L. N., Root, C. M., Cronin, J. A., Sann, S. B., Gu, X., Spitzer, N. C. Activity-dependent homeostatic specification of transmitter expression in embryonic neurons. Nature. 429 (6991), 523-530 (2004).
- Ciccolini, F., Collins, T. J., Sudhoelter, J., Lipp, P., Berridge, M. J., Bootman, M. D. Local and Global Spontaneous Calcium Events Regulate Neurite Outgrowth and Onset of GABAergic Phenotype during Neural Precursor Differentiation. Journal of Neuroscience. 23 (1), 103-111 (2003).
- Weissman, T. A., Riquelme, P. A., Ivic, L., Flint, A. C., Kriegstein, A. R. Calcium Waves Propagate through Radial Glial Cells and Modulate Proliferation in the Developing Neocortex. Neuron. 43 (5), 647-661 (2004).
- Nieuewkoop, P. D., Faber, J. The stages of Xenopus embryonic development. Normal Table of Xenopus laevis. , North Holland Publishing Company. (1994).
- Paudel, S., et al. Calcium Activity Dynamics Correlate with Neuronal Phenotype at a Single Cell Level and in a Threshold-Dependent Manner. International Journal of Molecular Science. 20 (8), 1880(2019).
- Marken, J. P., et al. A Markovian Entropy Measure for the Analysis of Calcium Activity Time Series. PLoS One. 11 (12), 0168342(2016).
- Eilers, P. H. C., Boelens, H. F. M. Baseline Correction with Asymmetric Least Squares Smoothing. Leiden University Medical Centre Report. , (2005).
- Guemez-Gamboa, A., et al. Non-cell-autonomous mechanism of activity-dependent neurotransmitter switching. Neuron. 82 (5), 1004-1016 (2014).
- Paredes, R., Madelaine,, et al. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados