需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用免疫荧光对患有TNBS诱导克罗恩病的小鼠结肠雌激素受体的可视化
摘要
该协议提出了完整的经验证的克罗恩病TNBS诱导的鼠模型,以及利用嵌入在石蜡中的正式固定结肠部分的免疫荧光,通过免疫组织化学对雌激素受体进行可视化的方法。
摘要
克罗恩病是诊断最多的炎症性肠病。肠道中发育的慢性炎症导致蠕动紊乱和肠道粘膜损伤,似乎与结肠肿瘤转化风险增加有关。累积证据表明,雌激素和雌激素受体不仅影响对激素敏感的组织,还影响与雌激素没有直接关系的其他组织,如肺或结肠。在这里,我们描述了从TNBS诱发的克罗恩病的鼠模型中获得结肠雌激素受体成功免疫荧光染色的规程。提供了小鼠和肠道制剂中克罗恩病诱导的详细方案,以及使用正式固定石蜡内嵌肠部分的逐步免疫组织化学程序。所述方法不仅可用于体内雌激素受体检测和雌激素信号研究,还可用于可能参与结肠炎发展的其他蛋白质。
引言
克罗恩病 (CD) 是一种炎症性肠病 (IBD),表现为慢性肠道炎症。CD的病因知之甚少,但似乎有几个主要因素导致CD发育,包括肠道微生物群,以及遗传和环境因素,如饮食或压力1。为了更好地理解克罗恩病的发病机制,使用了几种肠道炎症模型,2、3、4、5、6、7。2,3,4,5,6,7在本文中,我们介绍了从2,4,6-三硝基苯磺酸(TNBS)诱导的CD的鼠模型中获得的结果。
据记载,雌激素能够调节慢性肠道炎症898,9,10,11,12。10,11,12,雌激素的生物活性由同源受体介导,其中包括核雌激素受体(ERs),即ER®(基因ESR1)和ER®(基因ESR2),以及G蛋白耦合雌激素受体,即G蛋白耦合雌激素受体,即GPER(基因GPER1),称为膜结合ER13,14。,14有几种方法可以确定雌激素受体的水平,但只有一些可用于在肠道中可视化它们。
免疫组织化学(IHC)是一种广泛用于临床和基础研究的方法,用于检测具有氟铬偶联抗体的细胞或组织中的某些抗原。IHC似乎是组织结构可视化以及特定蛋白质的识别和定位的重要方法,对于了解结肠炎的发展可能至关重要。在这里,我们提出了一个完整的和验证的方案,用于免疫荧光对肠道中雌激素受体的免疫组织化学可视化。
研究方案
动物研究是根据欧洲议会和理事会2010年9月22日第2010/63/欧盟指令以及机构建议,在地方伦理委员会(28/[B29/2016)》同意下进行的。
1. 克罗恩病的TNBS诱导的鼠型
注:本协议使用雄性BALB/C小鼠体重25-28克。动物被安置在恒定温度(22-24 °C)和相对湿度55×5%,并保持在12小时光/暗周期,免费获得标准粒状物和自来水。
- 将鼠标放入感应室并紧紧闭盖子。用等氟拉涅对鼠标进行短暂麻醉(25% O2,O 2流速为 1.5-2 L/min)。
注:呼吸速率应保持有节奏,比正常速度慢,不应因刺激的刺激而改变。 - 在0.9%NaCl中注入0.1毫升30%乙醇的TNBS,在0.9%NaCl中注入0.1mL乙醇,在0.9%NaCl中注入0.1mL的30%乙醇,作为通过导管进入远端结肠的车辆控制。
注:导管应小心地引入约3厘米的anus。 - 每天从第二天到第八天监测小鼠的临床参数,包括体重、直肠出血、粪便一致性和死亡率。
- 第八天,通过宫颈错位对老鼠进行安乐死。
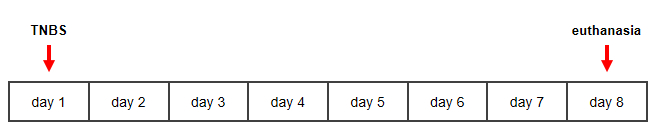
图1:克罗恩病TNBS诱导的鼠型的时间线。请点击此处查看此图形的较大版本。
2. 结肠的分离和宏观评价
注:结肠分离前一天,在1 mL磷酸盐缓冲盐水(PBS)中稀释100μL的抗生素,并在4°C下过夜。
- 使用 75% 乙醇和无菌纱布清洁腹部的皮肤。
- 使用无菌剪刀和钳子将腹壁从胸骨切到anus。
- 尽可能靠近anus和cecum的结肠被切断。
- 将结肠放在培养皿上。将冒号从Anus切入头端。在冷抗生素-PBS溶液中清洁和清洗结肠2-4次。
- 根据表 1使用卡钳执行宏镜评估。
注:组织粘附[和红斑/出血]、 粪便血*和腹泻*须接受视觉评估.*组织粘附评估使用三点刻度(0:结肠无组织粘附,1:结肠与中度组织粘附,2:结肠与广泛的组织粘附);*基于红斑/出血、粪便血和腹泻的缺席 (0) 或存在 (1)。
| 附着力| | 埃里塞马/出血| | 粪血| | 腹泻| | 溃疡长度 | 结肠厚度 | 结肠长度 |
| 点 (0 + 2) | 点 (0 + 1) | 点 (0 + 1) | 点 (0 + 1) | 厘米/点 | 毫米/点 | 厘米/点 |
| 0 = 缺席 | 0 = 缺席 | 0 = 缺席 | 0 = 缺席 | 0.5 厘米 × 0.5 点 | n毫米 = n点 | 0 = +<10% 比控制短 |
| 1 = 中等 | 1 = 存在 | 1 = 存在 | 0.5 = 轻微/松弛凳子 | 1 = 比控制短 10 到 20% | ||
| 2 = 存在 | 1 = 存在 | 2 = 比控制短 20% 以上 |
表1:具有TNBS诱导克罗恩病模型小鼠肠道的宏观评分。
- 将溃疡的长度(以厘米为单位)转换为点刻度,即每 0.5 厘米溃疡计为 0.5 点。将冒号(以毫米为单位)的厚度转换为点刻度,即每n mm 对应于n点。
- 在三点刻度上转换冒号的长度(以厘米为单位)。从每只小鼠获得与TNBS引起的克罗恩病的结肠长度根据对照组的平均结肠长度进行评估(0:<10%比对照组短,1:比对照短10%至20%,2:超过20%短,然后控制)。
- 根据方程计算总宏观分数:总宏观分数 = 附着力(点) = 红斑/出血(点) • 粪便血 (点) • 腹泻(点) • 溃疡长度 (点) = 结肠厚度 (点) = 结肠长度 (点)。
3. 结肠样品制备
- 将结肠切成 1-2 厘米的片段,并将每个片段放在海绵上,放在贴有适当标记的组织学盒中。
注:用于组织盒的海绵可防止在脱水和液体石蜡中孵育期间结肠折叠。 - 将结肠片段放入4%甲醛中,并在4°C下孵育至少24小时。
- 仅制备和编程1小时孵育的组织处理器在50%、70%、90%、95%、100%乙醇、二甲苯/100%乙醇(1:1;v/v)和二甲苯中,以及液体石蜡中至少3小时的孵育。
注:脱水必须在乙醇和二甲苯浓度增加时进行,但乙醇的浓度可以改性。建议使用二甲苯/乙醇混合物,但不需要。 - 将结肠片段转移到组织学盒中,并放置在预编程的组织处理器中。
- 运行组织处理器。
- 孵化步骤后,将结肠碎片放入金属模具中,使结肠的两端处于直立位置,用液体石蜡填充三分之一的模具。
- 将模具置于冷却区域 (-5 °C) 中几秒钟,然后将模具移到加热区域 (70 °C)。放置在组织框的底部,用液体石蜡覆盖整个结肠碎片。
- 将金属模具与石蜡中的结肠碎片留在石蜡中几分钟。从石蜡块中取出金属模具,在4°C下孵育至少24小时。
- 从块中取出多余的石蜡,并将其插入全自动旋转微体中。
注:石蜡块可在 -20°C 下储存几分钟,然后此步骤。 - 将结肠碎片切成 5 μm 部分。
- 将结肠部分转移到预热到 40°C 的水浴。
- 使用标记的玻璃幻灯片从水浴中取出冒号部分。
注: 冒号部分浮在水面上。将贴有标签的玻璃滑板放入冒号部分下的水中,并小心地取出玻璃滑轨。 - 在室温下,将玻璃滑道保持 24 小时。对于长期储存,在室温下孵育24小时后,将玻璃滑动保持在4°C。
4. 免疫性作用化学与免疫荧光染色
注: 在过程中,不要让冒号部分在任何步骤下干燥。
- 将玻璃滑板孵育在二甲苯中 5 分钟,取出石蜡。重复此步骤三次。
- 将玻璃滑板放入二甲苯/100%乙醇(1:1;v/v)中 5 分钟。重复此步骤三次。
- 在一系列降低乙醇浓度(即70%、50%、30%和10%乙醇5分钟内)中对结肠部分进行再加水。
- 在自来水下冲洗玻璃滑道 5 分钟。
- 预热抗原回收缓冲液(10 mM柠度柠度钠;0.05%Tween 20,pH 6.0)至95-98°C,并在沸腾抗原回收溶液中加热玻璃滑片10分钟。
注: 抗原检索步骤是可选的,但建议执行。解罩溶液应根据实验中使用的抗体进行优化。 - 使用疏水笔在冒号部分周围画一个圆圈。
注: 此步骤是可选的,但建议执行。疏水笔通过将液体集中在小块内标记圆内,防止试剂的浪费。 - 在3%的水溶液中孵育过10分钟的过氧化氢。
- 洗涤液(50 mM Tris-HCl,pH 7.4;150 mM NaCl;0.05% 补间20)5分钟。
- 在阻滞溶液中孵育(5%正常山羊血清;50 mM Tris-HCl,pH 7.4;150 mM NaCl;0.05% Triton X-100),室温下1小时。
注:在阻断溶液中,正常血清必须来自与二次抗体相同的物种。在需要孵育的阶段,将玻璃滑板放在湿度室中,以防止过度蒸发。 - 去除阻滞溶液,在1%牛血清白蛋白中加入20-50μL的原抗体,对ER®、ER®或GPER稀释,50 mM Tris-HCl,pH 7.4,150 mM NaCl,0.05% Triton X-100。
注:表 2中显示了原抗体的推荐稀释。
| 抗体类型 | 抗体 | 克隆性 | 宿主物种 | 物种反应性 | 稀释 |
| 主要 | ER_ | 多克隆 | 兔 | 人类 | 1:100 |
| 鼠标 | |||||
| 海龟 | |||||
| 卡皮巴拉 | |||||
| ER+ | 多克隆 | 兔 | 人类 | ||
| 猴子 | |||||
| 大 鼠 | |||||
| 鼠标 | |||||
| 羊 | |||||
| 猪 | |||||
| GPER | 多克隆 | 兔 | 人类 | ||
| 大 鼠 | |||||
| 鼠标 | |||||
| 二 次 | DyLight 650 | 多克隆 | 山羊 | 兔 | 1:250 |
表2:抗体特性。
- 在黑暗中4°C下孵育原抗体过夜。
- 取出抗体溶液,洗涤液(50 mM Tris-HCl,pH 7.4;150 mM NaCl;0.05% Tween 20),5分钟。重复此步骤三次。
- 加入20-50 μL的DyLight 650二次抗体稀释在1%牛血清白蛋白(含有50 mM Tris-HCl,pH 7.4,150 mM NaCl,0.05%Triton X-100)。在黑暗中室温下与染料结合的二次抗体孵育1小时。
注:表 2显示了推荐稀释的二次抗体。 - 取出抗体溶液并在洗涤液中清洗(50 mM Tris-HCl,pH 7.4,150 mM NaCl,0.05% Tween 20),5 分钟。重复此步骤三次。
- 加入稀释在50 mM Tris-HCl中2%的DiOC6(3),pH 7.4,150 mM NaCl,在黑暗中室温下孵育10分钟。
- 取出溶液并在洗涤液中清洗(50 mM Tris-HCl,pH 7.4,150 mM NaCl,0.05% Tween 20),5 分钟。重复此步骤三次。
- 直接在结肠部分加入几滴含有DAPI的甘油液体,并小心地盖上盖板。在4°C下孵育结肠部分至少24小时。
注:使用盖板覆盖组织时,避免气泡。 - 在共聚焦显微镜下分析结肠部分,具有 20 倍或 63 倍的目标,并使用专用软件浸入油。
注:表3列出了本研究中使用的氟铬的特性。
| 氟霍米霍类型 | 波长(nm) | 染料 | |
| 励 磁 | 排放 | ||
| DAPI | 405 | 460 – 480 | 蓝色 |
| 迪奥克6 (3) | 485 | 538 – 595 | 绿色 |
| DyLight 650 | 654 | 660 – 680 | 红 |
表3:氟铬的特性。
结果
TNBS诱发克罗恩病小鼠结肠的宏观特征
图2显示了从对照和TNBS处理小鼠身上拍摄的结肠的代表性图像。在具有TNBS诱导的克罗恩病模型的小鼠中,结肠的长度减少,而结肠的宽度增加。
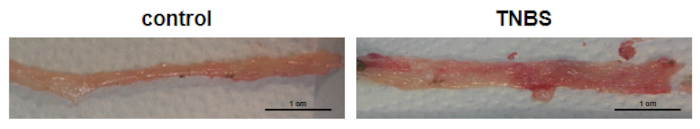
图2:从对照小鼠(对照)和TNBS治疗小?...
讨论
IBD病理生理学检查有许多动物模型,包括遗传、免疫或自发模型,以及化学诱导模型15。在几种类型动物模型中,如本协议中描述的TNBS诱导模型等化学诱导模型相对便宜且易于获得。TNBS诱导的结肠炎的鼠型具有与CD病理基础相关的几种临床症状。带诱导性结肠炎的动物的特点是粪便形成不一致,腹泻和体重减轻。然而,这并不意味着该模型可用于专门研究CD病因。TNBS诱导模型被?...
披露声明
作者没有什么可透露的。
致谢
由于洛兹大学当局的财政支助,这项工作发表得有:科学研究副校长、国家和国际合作副校长和生物和环境保护学院院长。达米安·杰塞尼克得到波兰国家科学中心的赠款(2017/24/T/NZ5/00045和2015/17/N/NZ5/00336)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Animals | |||
| BALB/C mice | University of Lodz | NA | |
| Equipment | |||
| Caliper | VWR | 62379-531 | |
| Cardboard block | NA | NA | |
| Confocal microscope - TCS SP8 | Leica Biosystems | NA | |
| Fully automated rotary microtome - RM2255 | Leica Biosystems | NA | |
| Glass slide | Thermo Scientific | J1800BMNT | |
| Heated Paraffin Embedding Module - EG1150 H | Leica Biosystems | NA | |
| Histological box | Marfour | LN.138747 | |
| Hydrophobic pen | Sigma-Aldrich | Z377821 | |
| Laboratory balance | Radwag | WL-104-0048 | |
| LAS X software | Leica Biosystems | NA | |
| Metal mold | Marfour | CP.5105 | |
| Sterile gauze | NA | NA | |
| Sterile scissor | NA | NA | |
| Sterile tweezer | NA | NA | |
| Tissue processor - TP1020 | Leica Biosystems | NA | |
| Reagents | |||
| 2, 4, 6-trinitrobenzene sulfonic acid | Sigma-Aldrich | 92822 | |
| Bovine serum albumin | Sigma-Aldrich | A3294 | |
| DiOC6 (3) | Sigma-Aldrich | 318426 | |
| DyLight 650 secondary antibody | Abcam | ab96886 | |
| ERα primary antibody | Abcam | ab75635 | |
| ERβ primary antibody | Abcam | ab3576 | |
| Ethanol | Avantor Performance Materials Poland | 396480111 | |
| Formaldehyde | Avantor Performance Materials Poland | 432173111 | |
| GPER primary antibody | Abcam | ab39742 | |
| Hydrochloric acid | Avantor Performance Materials Poland | 575283421 | |
| Hydrogen peroxidase | Avantor Performance Materials Poland | 885193111 | |
| isoflurane (forane) | Baxter | 1001936040 | |
| Normal goat serum | Gibco | 16210064 | |
| Paraffin | Leica Biosystems | 39602012 | |
| Petrie dish | Nest Scientific | 705001 | |
| Phosphate buffer saline | Sigma-Aldrich | P3813 | |
| Physiological saline | Sigma-Aldrich | 7982 | |
| Primocin (antibiotic) | Invitrogen | ant-pm-1 | |
| ProLong Diamond Antifage Mountant with DAPI (glycerol-based liquid with DAPI) | Invitrogen | P36971 | |
| Sodium chloride | Chempur | WE/231-598-3 | |
| Sodium citrate | Avantor Performance Materials Poland | 795780429 | |
| Tris | Avantor Performance Materials Poland | 853470115 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| Xylene | Avantor Performance Materials Poland | BA0860119 |
参考文献
- Zhang, Y. Z., Li, Y. Y. Inflammatory bowel disease: pathogenesis. World Journal of Gastroenterology. 20 (1), 91-99 (2014).
- Morris, G. P., et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 96 (3), 795-803 (1989).
- Okayasu, I., et al. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 98 (3), 694-702 (1990).
- Boirivant, M., Fuss, I. J., Chu, A., Strober, W. Oxazolone colitis: a murine model of T helper cell type 2 colitis treatable with antibodies to interleukin 4. Journal of Experimental Medicine. 188 (10), 1929-1939 (1998).
- Morrissey, P. J., Charrier, K., Braddy, S., Liggitt, D., Watson, J. D. CD4+ T cells that express high levels of CD45RB induce wasting disease when transferred into congenic severe combined immunodeficient mice. Disease development is prevented by cotransfer of purified CD4+ T cells. Journal of Experimental Medicine. 178 (1), 237-244 (1993).
- Kühn, R., Löhler, J., Rennick, D., Rajewsky, K., Müller, W. Interleukin-10-deficient mice develop chronic enterocolitis. Cell. 75 (2), 263-274 (1993).
- Sundberg, J. P., Elson, C. O., Bedigian, H., Birkenmeier, E. H. Spontaneous, heritable colitis in a new substrain of C3H/HeJ mice. Gastroenterology. 107 (6), 1726-1735 (1994).
- Harnish, D. C., et al. Beneficial effects of estrogen treatment in the HLA-B27 transgenic rat model of inflammatory bowel disease. American Journal of Physiology Gastrointestinal and Liver Physiology. 286 (1), 118-125 (2004).
- Pierdominici, M., et al. Linking estrogen receptor β expression with inflammatory bowel disease activity. Oncotarget. 6 (38), 40443-40451 (2015).
- Włodarczyk, M., et al. G protein-coupled receptor 30 (GPR30) expression pattern in inflammatory bowel disease patients suggests its key role in the inflammatory process. A preliminary study. Journal of Gastrointestinal and Liver Diseases. 26 (1), 29-35 (2017).
- Mohammad, I., et al. Estrogen receptor α contributes to T cell-mediated autoimmune inflammation by promoting T cell activation and proliferation. Science Signaling. 11 (526), eaap9415 (2018).
- Jacenik, D., et al. G protein-coupled estrogen receptor mediates anti-inflammatory action in Crohn's disease. Scientific Reports. 9 (1), 6749 (2019).
- Prossnitz, E. R., Barton, M. The G protein-coupled estrogen receptor GPER in health and disease. Nature Review Endocrinology. 7 (12), 715-726 (2011).
- Yaşar, P., Ayaz, G., User, S. D., Güpür, G., Muyan, M. Molecular mechanisms of estrogen-estrogen receptor signaling. Reproductive Medicine and Biology. 16 (1), 4-20 (2016).
- Pizarro, T. T., Arseneau, K. O., Bamias, G., Cominelli, F. Mouse models for the study of Crohn's disease. Trends in Molecular Medicine. 9 (5), 218-222 (2003).
- Neurath, M. F., Fuss, I., Kelsall, B. L., Stüber, E., Strober, W. Antibodies to interleukin 12 abrogate established experimental colitis in mice. Journal of Experimental Medicine. 182 (5), 1281-1290 (1995).
- Ikeda, M., et al. Simvastatin attenuates trinitrobenzene sulfonic acid-induced colitis, but not oxazalone-induced colitis. Digestive Diseases and Sciences. 53 (7), 1869-1875 (2007).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral Maxillofacial Pathology. 16 (3), 400-405 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。