È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Visualizzazione dei recettori degli estrogeni nei coloni dei topi con la malattia di Crohn indotta da TNBS utilizzando l'immunofluorescenza
In questo articolo
Riepilogo
Il protocollo presenta un modello murino completo convalidato dalla TNBS della malattia di Crohn e metodi per la visualizzazione dei recettori estrogeni mediante immunosofochimica utilizzando l'immunofluorescenza delle sezioni del colon fissato in formalina incorporate nella paraffina.
Abstract
La malattia di Crohn è il tipo più diagnosticato di malattia infiammatoria intestinale. L'infiammazione cronica in via di sviluppo nell'intestino porta al disturbo della peristalsi e al danno della mucosa intestinale e sembra essere associato ad un aumento del rischio di trasformazione neoplastica del colon. Sempre più prove indicano che gli estrogeni e i recettori degli estrogeni influenzano non solo i tessuti ormone-sensibili, ma anche altri tessuti non direttamente correlati agli estrogeni, come i polmoni o il colon. Qui, descriviamo il protocollo per la colorazione dell'immunofluorescenza di successo dei recettori degli estrogeni nel colon ottenuti da un modello murino della malattia di Crohn indotta da TNBS. Viene fornito un protocollo dettagliato per l'induzione della malattia di Crohn nella preparazione di topi e intestini, nonché una procedura immunohistochimica passo-passo utilizzando sezioni intestinali incorporate con paraffina fissata a formalina. I metodi descritti non sono solo utili per il rilevamento del recettore degli estrogeni e l'indagine di segnalazione degli estrogeni in vivo, ma possono anche essere applicati per altre proteine che possono essere coinvolte nello sviluppo della colite.
Introduzione
La malattia di Crohn (CD) è una malattia infiammatoria intestinale (IBD) manifestata come infiammazione cronica intestinale. L'eziologia del CD è poco compresa, ma ci sono alcuni fattori principali che sembrano essere responsabili dello sviluppo del CD, tra cui il microbiota intestinale, e fattori genetici e ambientali, come la dieta o lo stress1. Per una migliore comprensione della patogenesi della malattia di Crohn, sono stati utilizzati diversi modelli di infiammazione intestinale2,3,4,5,6,7.7 In questo articolo, presentiamo risultati ottenuti da un modello di murino indotto da 2,4,6 trinitrobenzene (TNBS) di CD.
È stato documentato che gli estrogeni sono in grado di modulare l'infiammazione intestinale cronica8,9,10,11,12. L'attività biologica degli estrogeni è mediata dai recettori cognati, tra cui i recettori degli estrogeni nucleari (ER), cioè l'ER (gene ESR1)e l'ER (gene ESR2),così come il recettore degli estrogeni accoppiato alle proteine G, vale a dire GPER (gene GPER1), indicato come ER13,14. Ci sono diversi metodi per determinare il livello di recettori degli estrogeni, ma solo pochi possono essere utilizzati per visualizzarli nell'intestino.
L'immunohistochimica (IHC) è un metodo ampiamente utilizzato negli studi clinici e di base per la rilevazione di alcuni antigeni nelle cellule o nei tessuti con anticorpi coniugati fluorocro. IHC sembra essere un metodo importante nella visualizzazione della struttura tissutale, così come nell'identificazione e localizzazione di proteine specifiche, che può essere cruciale per comprendere lo sviluppo della colite. Qui, presentiamo un protocollo completo e convalidato per la visualizzazione immunohistochimica dei recettori degli estrogeni nell'intestino utilizzando l'immunofluorescenza.
Protocollo
Gli studi sugli animali sono stati condotti con il consenso del Comitato Etico Locale (28/EB29/2016) in conformità con la direttiva 2010/63/EU del Parlamento europeo e del Consiglio del 22 settembre 2010 e raccomandazioni istituzionali.
1. Modello murino indotto dalla TNBS della malattia di Crohn
NOTA: Questo protocollo utilizza topi maschi BALB/C di peso di 25-28 g. Gli animali sono alloggiati a una temperatura costante (22-24 gradi centigradi) e, relativa umidità 55 - 5%, e mantenuti in un ciclo di luce / buio di 12 h con accesso gratuito a pellet chow standard e tap acqua ad libitum.
- Posizionare il mouse nella camera di induzione e chiudere saldamente il coperchio. Anestesizzare brevemente il mouse con isoflurane (25% O2 con portata O2 a 1,5-2 L/min).
NOTA: la frequenza respiratoria deve rimanere ritmica e più lenta del normale e non deve cambiare in risposta a uno stimolo nocivo. - Instillare 4 mg di TNBS in 0,1 mL di 30% etanolo in 0.9% NaCl o 0.1 mL di 30% etanolo in 0.9% NaCl come un controllo del veicolo nel colon distale attraverso un catetere.
NOTA: Il catetere deve essere introdotto con attenzione circa 3 cm nell'ano. - Monitorare il mouse ogni giorno dal secondo giorno all'otto per i parametri clinici tra cui il peso corporeo, sanguinamento rettale, consistenza delle feci e mortalità.
- L'ottavo giorno, eutanasia il topo dalla lussazione cervicale.
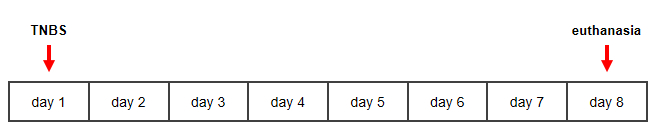
Figura 1: Sequenza temporale per il modello murino indotto da TNBS della malattia di Crohn. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Separazione e valutazione macroscopica del colon
NOTA: Un giorno prima della separazione del colon, diluire 100 L di antibiotico in 1 mL di salina buffer fosfato (PBS) e lasciare a 4 gradi durante la notte.
- Pulire la pelle sull'addome utilizzando 75% etanolo e garza sterile.
- Tagliare la parete addominale dallo sterno all'ano usando forbici sterili e pinzette.
- Tagliare il colon il più vicino possibile all'ano e cecum.
- Posizionare il colon sul piatto Petri. Tagliare il colon lungo dall'ano fino alla fine cecum. Pulire e lavare il colon 2-4 volte in soluzione fredda antibiotico-PBS.
- Eseguire la valutazione macroscopica utilizzando una pinza secondo la tabella 1.
NOTA: L'adesione ai tessutie l'erithema/emorragia, ilsangue fecale e ladiarrea, sono soggetti a valutazione visiva.# * L'adesione tissutale valuta utilizzando una scala a tre punti (0: colon senza aderente tissutale, 1: colon con adesione ai tessuti moderata, 2: colon con ampia adesione tissutale); -in base all'assenza (0) o alla presenza (1) di erithema/emorragia, sangue fecale e diarrea.
| Adezione | L'erithema/emorragia# | Sangue fecale | Diarrea# | Lunghezza dell'ulcera | Spessore del colon | Lunghezza del colon |
| punti (0 – 2) | punti (0 – 1) | punti (0 – 1) | punti (0 – 1) | cm/punti | mm/punti | cm/punti |
| 0 – assente | 0 – assente | 0 – assente | 0 – assente | 0,5 cm - 0,5 punti | n mm - n punti | 0 – <10% più corto del controllo |
| 1 – moderato | 1 – presente | 1 – presente | 0,5 – feci leggere/sciolte | 1 – dal 10 al 20% più corto del controllo | ||
| 2 – presente | 1 – presente | 2 – oltre il 20% più corto del controllo |
Tabella 1: punteggio macroscopico dell'intestino dei topi con modello indotto da TNBS della malattia di Crohn.
- Convertire la lunghezza dell'ulcera in centimetri in una scala a punti, cioè ogni 0,5 cm di ulcera viene conteggiata come 0,5 punti. Convertire lo spessore dei due punti in millimetri in una scala di punti, cioè ogni n mm corrisponde a n punti.
- Convertire la lunghezza dei due punti in centimetri su una scala di tre punti. La lunghezza del colon ottenuta da ogni topo con la malattia di Crohn indotta da TNBS viene valutata in relazione alla lunghezza media del colon per il gruppo di controllo (0: <10% più corto del controllo, 1: dal 10 al 20% più corto del controllo, 2: oltre il 20% più corto controllo).
- Calcolare il punteggio macroscopico totale in base all'equazione: Punteggio macroscopico totale - adesione (punti) - erithema/emorragia (punti) - sangue fecale (punti) - diarrea (punti) , lunghezza dell'ulcera (punti) , spessore del colon (punti) , lunghezza del colon (punti).
3. Preparazione del campione di colon
- Tagliare i due punti in frammenti di 1-2 cm e posizionare ciascuno sulla spugna in una cassetta istologica opportunamente etichettata.
NOTA: le spugne per le cassette istologiche impediscono il ripiegamento dei due punti durante la disidratazione e l'incubazione in paraffina liquida. - Mettere il frammento del colon nel 4% di formaldeide e incubare per almeno 24 h a 4 gradi centigradi.
- Preparare e programmare il processore tissutale per 1 h di incubazione in 50%, 70%, 90%, 95%, 100% etanolo, xilene/100% etanolo (1:1; v/v solo), così come per almeno 3 h di incubazione in paraffina liquida.
NOTA: La disidratazione deve essere eseguita in concentrazioni crescenti di etanolo e xilene, ma la concentrazione di etanolo può essere modificata. La miscela di xilene/etanolo è raccomandata ma non richiesta. - Trasferire il frammento del colon in una scatola istologica e posizionarlo nel processore di tessuto pre-programmato.
- Eseguire il processore di tessuto.
- Dopo i passaggi di incubazione, posizionare il frammento del colon in uno stampo metallico in modo che le due estremità del colon siano in posizione eretta e riempino un terzo dello stampo con paraffina liquida.
- Posizionare lo stampo nell'area di raffreddamento (-5 gradi centigradi) per alcuni secondi, quindi spostare lo stampo nell'area di riscaldamento (70 gradi centigradi). Posizionare nella parte inferiore della scatola istologica e coprire l'intero frammento del colon con paraffina liquida.
- Lasciare lo stampo metallico con il frammento del colon in paraffina per alcuni minuti nell'area di raffreddamento. Rimuovere lo stampo metallico dal blocco di paraffina e incubare per almeno 24 h a 4 gradi centigradi.
- Rimuovere la paraffina in eccesso dal blocco e inserirla in un microtoma rotativo completamente automatizzato.
NOTA: Il blocco di paraffina può essere conservato a -20 gradi centigradi per alcuni minuti prima di questo passaggio. - Tagliare il frammento del colon in 5 sezioni m.
- Trasferire la sezione del colon in un bagno d'acqua preriscaldato a 40 gradi centigradi.
- Utilizzare lo scivolo di vetro etichettato per rimuovere la sezione del colon dal bagno d'acqua.
NOTA: le sezioni del colon galleggiano sull'acqua. Mettere lo scivolo di vetro etichettato nell'acqua sotto la sezione del colon e ritirare con attenzione lo scivolo di vetro. - Lasciare lo scivolo di vetro per 24 ore a temperatura ambiente. Per un deposito a lungo termine, tenere lo scivolo di vetro a 4 gradi centigradi dopo 24 h di incubazione a temperatura ambiente.
4. Immunoistochimica con colorazione immunofluorescenza
NOTA: Non lasciare asciugare la sezione del colon in nessun asordio durante la procedura.
- Rimuovere la paraffina incubando il vetrino di vetro in xilene per 5 min. Ripetere questo passaggio tre volte.
- Posizionare lo scivolo di vetro in xilene/100% etanolo (1:1; v/v) per 5 min. Ripetere questo passaggio tre volte.
- Reidratare la sezione del colon in una serie di concentrazioni decrescenti di etanolo, vale a dire 70%, 50%, 30% e 10% di etanolo per 5 min. Ripeti ogni passaggio tre volte.
- Sciacquare lo scivolo di vetro sotto l'acqua corrente per 5 min.
- Preriscaldare il buffer di recupero dell'antigene (10 mM di citrato di sodio; 0,05% Tween 20, pH 6,0) a 95-98 gradi centigradi e riscaldare lo scivolo di vetro in una soluzione di recupero dell'antigene bollente per 10 min.
NOTA: il passaggio di recupero dell'antigene è facoltativo ma consigliato. La soluzione di smascheramento deve essere ottimizzata a seconda dell'anticorpo utilizzato nell'esperimento. - Disegnare un cerchio intorno alla sezione del colon utilizzando una penna idrofobica.
NOTA: questo passaggio è facoltativo ma consigliato. La penna idrofobica previene lo spreco di reagenti mantenendo il liquido raggruppato in un piccolo volume all'interno segnato il cerchio. - Incubare la sezione nella soluzione d'acqua 3% di perossidasi di idrogeno per 10 min.
- Lavare in soluzione di lavaggio (50 mM Tris-HCl, pH 7.4; 150 mM NaCl; 0.05% Tween 20) per 5 min.
- Incubare in soluzione di blocco (5% siero di capra normale; 50 mM Tris-HCl, pH 7.4; 150 mM NaCl; 0.05% Triton X-100) per 1 h a temperatura ambiente.
NOTA: Nella soluzione di blocco, il siero normale deve provenire dalla stessa specie dell'anticorpo secondario. Nelle fasi in cui è necessaria l'incubazione, posizionare il vetrino di vetro in una camera di umidità per evitare un'eccessiva evaporazione. - Togliere la soluzione di blocco e aggiungere 20-50 l dell'anticorpo primario contro l'eRB, ER o GPER diluito in albumina siero bovina dell'1% con 50 mM Tris-HCl, pH 7.4, 150 mM NaCl, 0,05% Triton X-100.
NOTA: Le diluizioni raccomandate degli anticorpi primari sono riportate nella tabella 2.
| Tipo di anticorpo | Anticorpo contro | Clonality | Specie ospitante | Reattività delle specie | Diluizione |
| Primario | L'ERz | Policlonale | Coniglio | Umano | 1:100 |
| Mouse | |||||
| Tartaruga | |||||
| Capibara | |||||
| ERz | Policlonale | Coniglio | Umano | ||
| Scimmia | |||||
| Ratto | |||||
| Mouse | |||||
| Pecora | |||||
| Maiale | |||||
| GPER | Policlonale | Coniglio | Umano | ||
| Ratto | |||||
| Mouse | |||||
| Secondario | DyLight 650 | Policlonale | Capra | Coniglio | 1:250 |
Tabella 2: Caratteristiche degli anticorpi.
- Incubare con anticorpo primario durante la notte a 4 gradi centigradi al buio.
- Rimuovere la soluzione anticorpale e lavare in soluzione di lavaggio (50 mM Tris-HCl, pH 7.4; 150 mM NaCl; 0.05% Tween 20) per 5 min. Ripetete questo passaggio tre volte.
- Aggiungere 20-50 l di DyLight 650 anticorpo secondario diluito in albumina siero bovina dell'1% (contenente 50 mM Tris-HCl, pH 7.4, 150 mM NaCl, 0.05% Triton X-100). Incubare con anticorpo secondario coniugato con tintura per 1 h a temperatura ambiente nel buio.
NOTA: la diluizione raccomandata dell'anticorpo secondario è illustrata nella tabella 2. - Rimuovere la soluzione anticorpale e lavare in soluzione di lavaggio (50 mM Tris-HCl, pH 7.4, 150 mM NaCl, 0.05% Tween 20) per 5 min. Ripetete questo passaggio tre volte.
- Aggiungere il 2% DiOC6(3) diluito in 50 mM Tris-HCl, pH 7.4, 150 mM NaCl e incubare per 10 min a temperatura ambiente al buio.
- Rimuovere la soluzione e lavare in soluzione di lavaggio (50 mM MM Tris-HCl, pH 7.4, 150 mM NaCl, 0.05% Tween 20) per 5 min. Ripetere questo passaggio tre volte.
- Aggiungere alcune gocce di liquido a base di glicerolo con DAPI direttamente sulla sezione del colon e coprire con attenzione con uno scivolo di copertura. Incubare la sezione del colon per almeno 24 h a 4 gradi centigradi.
NOTA: Evitare bolle d'aria quando si copre il tessuto con il vetrino di copertura. - Analizzare la sezione del colon al microscopio confocale con obiettivi 20x o 63x e l'immersione dell'olio utilizzando un software dedicato.
NOTA: La tabella 3 elenca le caratteristiche dei fluorocromi utilizzati in questo studio.
| Tipo Fluorochome | Lunghezza d'onda (nm) | Tintura | |
| Eccitazione | Emissione | ||
| Dapi | 405 | 460 – 480 | Blu |
| DiOC6 (3) | 485 | 538 – 595 | Verde |
| DyLight 650 | 654 | 660 – 680 | Rosso |
Tabella 3: Caratteristiche dei fluorocromi.
Risultati
Caratteristiche macroscopiche dei colon nei topi con la malattia di Crohn indotta da TNBS
Le immagini rappresentative dei due punti presi dal controllo e dei topi trattati con TNBS sono mostrate nella Figura 2. Nei topi con un modello indotto da TNBS della malattia di Crohn, la lunghezza del colon è ridotta mentre la larghezza del colon è aumentata.
Discussione
Ci sono numerosi modelli animali per l'esame di fisiologia IBD, compresi i modelli genetici, immunologici o spontanei, così come i modelli chimicamente indotti15. Tra i diversi tipi di modelli animali di colite, modelli indotti chimicamente come il modello indotto da TNBS descritti in questo protocollo, sono relativamente economici e facili da ottenere. Il modello murino indotto dalla TNBS della colite ha diversi sintomi clinici legati alla base patologica del CD. Gli animali con colite indotta s...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il lavoro è stato pubblicato grazie al sostegno finanziario delle autorità dell'Università di Lodz: Vice-Rettore per la Ricerca Scientifica, Vice-Rettore per la Cooperazione Nazionale e Internazionale e Preside della Facoltà di Biologia e Protezione Ambientale. Damian Jacenik è stata sostenuta da sovvenzioni (2017/24/T/N'N'5/00045 e 2015/17/N/N/N'N/00336) del Centro Nazionale di Scienze, Polonia.
Materiali
| Name | Company | Catalog Number | Comments |
| Animals | |||
| BALB/C mice | University of Lodz | NA | |
| Equipment | |||
| Caliper | VWR | 62379-531 | |
| Cardboard block | NA | NA | |
| Confocal microscope - TCS SP8 | Leica Biosystems | NA | |
| Fully automated rotary microtome - RM2255 | Leica Biosystems | NA | |
| Glass slide | Thermo Scientific | J1800BMNT | |
| Heated Paraffin Embedding Module - EG1150 H | Leica Biosystems | NA | |
| Histological box | Marfour | LN.138747 | |
| Hydrophobic pen | Sigma-Aldrich | Z377821 | |
| Laboratory balance | Radwag | WL-104-0048 | |
| LAS X software | Leica Biosystems | NA | |
| Metal mold | Marfour | CP.5105 | |
| Sterile gauze | NA | NA | |
| Sterile scissor | NA | NA | |
| Sterile tweezer | NA | NA | |
| Tissue processor - TP1020 | Leica Biosystems | NA | |
| Reagents | |||
| 2, 4, 6-trinitrobenzene sulfonic acid | Sigma-Aldrich | 92822 | |
| Bovine serum albumin | Sigma-Aldrich | A3294 | |
| DiOC6 (3) | Sigma-Aldrich | 318426 | |
| DyLight 650 secondary antibody | Abcam | ab96886 | |
| ERα primary antibody | Abcam | ab75635 | |
| ERβ primary antibody | Abcam | ab3576 | |
| Ethanol | Avantor Performance Materials Poland | 396480111 | |
| Formaldehyde | Avantor Performance Materials Poland | 432173111 | |
| GPER primary antibody | Abcam | ab39742 | |
| Hydrochloric acid | Avantor Performance Materials Poland | 575283421 | |
| Hydrogen peroxidase | Avantor Performance Materials Poland | 885193111 | |
| isoflurane (forane) | Baxter | 1001936040 | |
| Normal goat serum | Gibco | 16210064 | |
| Paraffin | Leica Biosystems | 39602012 | |
| Petrie dish | Nest Scientific | 705001 | |
| Phosphate buffer saline | Sigma-Aldrich | P3813 | |
| Physiological saline | Sigma-Aldrich | 7982 | |
| Primocin (antibiotic) | Invitrogen | ant-pm-1 | |
| ProLong Diamond Antifage Mountant with DAPI (glycerol-based liquid with DAPI) | Invitrogen | P36971 | |
| Sodium chloride | Chempur | WE/231-598-3 | |
| Sodium citrate | Avantor Performance Materials Poland | 795780429 | |
| Tris | Avantor Performance Materials Poland | 853470115 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| Xylene | Avantor Performance Materials Poland | BA0860119 |
Riferimenti
- Zhang, Y. Z., Li, Y. Y. Inflammatory bowel disease: pathogenesis. World Journal of Gastroenterology. 20 (1), 91-99 (2014).
- Morris, G. P., et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 96 (3), 795-803 (1989).
- Okayasu, I., et al. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 98 (3), 694-702 (1990).
- Boirivant, M., Fuss, I. J., Chu, A., Strober, W. Oxazolone colitis: a murine model of T helper cell type 2 colitis treatable with antibodies to interleukin 4. Journal of Experimental Medicine. 188 (10), 1929-1939 (1998).
- Morrissey, P. J., Charrier, K., Braddy, S., Liggitt, D., Watson, J. D. CD4+ T cells that express high levels of CD45RB induce wasting disease when transferred into congenic severe combined immunodeficient mice. Disease development is prevented by cotransfer of purified CD4+ T cells. Journal of Experimental Medicine. 178 (1), 237-244 (1993).
- Kühn, R., Löhler, J., Rennick, D., Rajewsky, K., Müller, W. Interleukin-10-deficient mice develop chronic enterocolitis. Cell. 75 (2), 263-274 (1993).
- Sundberg, J. P., Elson, C. O., Bedigian, H., Birkenmeier, E. H. Spontaneous, heritable colitis in a new substrain of C3H/HeJ mice. Gastroenterology. 107 (6), 1726-1735 (1994).
- Harnish, D. C., et al. Beneficial effects of estrogen treatment in the HLA-B27 transgenic rat model of inflammatory bowel disease. American Journal of Physiology Gastrointestinal and Liver Physiology. 286 (1), 118-125 (2004).
- Pierdominici, M., et al. Linking estrogen receptor β expression with inflammatory bowel disease activity. Oncotarget. 6 (38), 40443-40451 (2015).
- Włodarczyk, M., et al. G protein-coupled receptor 30 (GPR30) expression pattern in inflammatory bowel disease patients suggests its key role in the inflammatory process. A preliminary study. Journal of Gastrointestinal and Liver Diseases. 26 (1), 29-35 (2017).
- Mohammad, I., et al. Estrogen receptor α contributes to T cell-mediated autoimmune inflammation by promoting T cell activation and proliferation. Science Signaling. 11 (526), eaap9415 (2018).
- Jacenik, D., et al. G protein-coupled estrogen receptor mediates anti-inflammatory action in Crohn's disease. Scientific Reports. 9 (1), 6749 (2019).
- Prossnitz, E. R., Barton, M. The G protein-coupled estrogen receptor GPER in health and disease. Nature Review Endocrinology. 7 (12), 715-726 (2011).
- Yaşar, P., Ayaz, G., User, S. D., Güpür, G., Muyan, M. Molecular mechanisms of estrogen-estrogen receptor signaling. Reproductive Medicine and Biology. 16 (1), 4-20 (2016).
- Pizarro, T. T., Arseneau, K. O., Bamias, G., Cominelli, F. Mouse models for the study of Crohn's disease. Trends in Molecular Medicine. 9 (5), 218-222 (2003).
- Neurath, M. F., Fuss, I., Kelsall, B. L., Stüber, E., Strober, W. Antibodies to interleukin 12 abrogate established experimental colitis in mice. Journal of Experimental Medicine. 182 (5), 1281-1290 (1995).
- Ikeda, M., et al. Simvastatin attenuates trinitrobenzene sulfonic acid-induced colitis, but not oxazalone-induced colitis. Digestive Diseases and Sciences. 53 (7), 1869-1875 (2007).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral Maxillofacial Pathology. 16 (3), 400-405 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon