É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Visualização de receptores de estrogênio em cólons de camundongos com doença de Crohn induzida pelo TNBS usando imunofluorescência
Neste Artigo
Resumo
O protocolo apresenta um modelo completo de murina induzida por TNBS da doença de Crohn e métodos para visualização de receptores de estrogênio por imunohistoquímica usando imunofluorescência de seções de cólon fixas de formalina embutidas em parafina.
Resumo
A doença de Crohn é o tipo mais diagnosticado de doença inflamatória intestinal. A inflamação crônica que se desenvolve no intestino leva à desordem da peristalse e aos danos da mucosa intestinal e parece estar associada a um risco aumentado de transformação neoplásica do cólon. O acúmulo de evidências indica que os estrogênios e receptores de estrogênio afetam não apenas tecidos sensíveis a hormônios, mas também outros tecidos não diretamente relacionados a estrogênios, como os pulmões ou cólon. Aqui, descrevemos o protocolo para a bem sucedida coloração de imunofluorescência de receptores de estrogênio no cólon obtido susceptência de um modelo murina da doença de Crohn induzida pelo TNBS. Um protocolo detalhado para a indução da doença de Crohn em camundongos e preparação do intestino é fornecido, bem como um procedimento imunohistoquímico passo a passo usando seções de intestino parafina fixado formalina. Os métodos descritos não só são úteis para a detecção de receptores de estrogênio e a investigação de sinalização de estrogênio in vivo, mas também podem ser aplicados para outras proteínas que podem estar envolvidas no desenvolvimento de colite.
Introdução
A doença de Crohn (CD) é uma doença inflamatória intestinal (DII) manifestada como inflamação crônica do intestino. A etiologia do CD é pouco compreendida, mas existem alguns fatores importantes que parecem ser responsáveis pelo desenvolvimento do CD, incluindo a microbiota intestinal, e fatores genéticos e ambientais, como dieta ou estresse1. Para uma melhor compreensão da patogênese da doença de Crohn, vários modelos de inflamação intestinal têm sido utilizados2,3,4,5,6,7. Neste artigo, apresentamos resultados obtidos a partir de um modelo de murina induzida por 2,4,6-trinitrobbenzeno (TNBS) do modelo de CD.
Foi documentado que os estrogênios são capazes de modular a inflamação intestinal crônica8,,9,10,11,12. A atividade biológica dos estrogênios é mediada por receptores cognatos, entre os quais estão receptores de estrogênio nuclear (ERs), ou seja, ERα (gene ESR1) e ERβ (gene ESR2),bem como receptor esgota do g acoplado à proteína, ou seja, GPER (gene GPER1),referido como ER13,14. Existem vários métodos para determinar o nível dos receptores de estrogênio, mas apenas alguns podem ser usados para visualizá-los no intestino.
A imunohistoquímica (IHC) é um método amplamente utilizado em estudos clínicos e básicos para a detecção de certos antígenos em células ou tecidos com anticorpos florocromos conjugados. O IHC parece ser um importante método na visualização da estrutura tecidual, bem como na identificação e localização de proteínas específicas, o que pode ser crucial para a compreensão do desenvolvimento da colite. Aqui, apresentamos um protocolo completo e validado para visualização imunohistoquímica de receptores de estrogênio no intestino usando imunofluorescência.
Protocolo
Os estudos em animais foram realizados com o consentimento do Comitê Deética Local (28/ŁB29/2016) em conformidade com a Diretiva 2010/63/UE do Parlamento Europeu e do Conselho de 22 de Setembro de 2010, e recomendações institucionais.
1. Modelo de murina induzida pelo TNBS da doença de Crohn
NOTA: Este protocolo utiliza camundongos machos BALB/C pesando 25-28 g. Os animais estão alojados a uma temperatura constante (22-24 °C) e, umidade relativa de 55 ± 5%, e mantidos em um ciclo claro/escuro de 12 h com acesso livre a pelotas de chow padrão e água da torneira ad libitum.
- Coloque o mouse na câmara de indução e feche bem a tampa. Anestesiar o mouse brevemente com isoflurano (25% O2 com taxa de fluxo O2 a 1,5-2 L/min).
NOTA: A taxa respiratória deve permanecer rítmica e mais lenta do que o normal e não deve mudar em resposta a um estímulo nocivo. - Instill 4 mg de TNBS em 0,1 mL de 30% de etanol em 0,9% NaCl ou 0,1 mL de 30% de etanol em 0,9% NaCl como controle veicular no cólon distal através de um cateter.
NOTA: O cateter deve ser cuidadosamente introduzido aproximadamente 3 cm no ânus. - Monitore o camundongo diariamente do segundo ao oitavo dia para parâmetros clínicos, incluindo peso corporal, sangramento retal, consistência das fezes e mortalidade.
- No oitavo dia, eutanize o rato por luxação cervical.
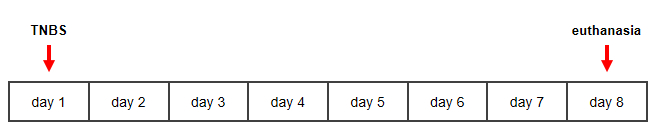
Figura 1: Linha do tempo para o modelo de murina induzido por TNBS da doença de Crohn. Clique aqui para ver uma versão maior desta figura.
2. Separação e avaliação macroscópica do cólon
NOTA: Um dia antes da separação do cólon, diluir 100 μL de antibiótico em 1 mL de salino tampão fosfato (PBS) e sair a 4 °C durante a noite.
- Limpe a pele sobre o abdômen usando 75% de etanol e gaze estéril.
- Corte a parede abdominal do osso do peito ao ânus usando tesouras e pinças estéreis.
- Corte o cólon o mais próximo possível do ânus e do ceco.
- Coloque o cólon na placa de Petri. Corte o cólon junto do ânus até a extremidade do ceco. Limpe e lave o cólon 2-4 vezes em solução de antibiótico-PBS frio.
- Realizar avaliação macroscópica usando uma pinça de acordo com a Tabela 1.
NOTA: Adesão ao tecido* e eritema/hemorragia#,sangue fecal# e diarreia# estão sujeitos à avaliação visual. * A adesão tecidual avalia utilizando uma escala de três pontos (0: cólon sem adesão tecidual, 1: cólon com adesão moderada do tecido, 2: cólon com extensa adesão tecidual); #baseado na ausência (0) ou presença (1) de eritema/hemorragia, sangue fecal e diarreia.
| Adesão* | Eritema/ hemorragia# | Sangue fecal# | Diarréia | Comprimento da úlcera | Espessura do cólon | Comprimento do cólon |
| pontos (0 – 2) | pontos (0 – 1) | pontos (0 – 1) | pontos (0 – 1) | cm/pontos | mm/pontos | cm/pontos |
| 0 – ausente | 0 – ausente | 0 – ausente | 0 – ausente | 0,5 cm = 0,5 ponto | n mm = n pontos | 0 – <10% menor que o controle |
| 1 – moderado | 1 – presente | 1 – presente | 0,5 – fezes leves/soltas | 1 – de 10 a 20% menor que o controle | ||
| 2 – presente | 1 – presente | 2 – mais de 20% mais curto que o controle |
Tabela 1: Pontuação macroscópica do intestino de camundongos com modelo induzido por TNBS da doença de Crohn.
- Converta o comprimento da úlcera em centímetros para uma escala de ponto, ou seja, cada 0,5 cm de úlcera é contado como 0,5 ponto. Converta a espessura do cólon em milímetros em uma escala de pontos, ou seja, cada n mm corresponde a n pontos.
- Converta o comprimento do cólon em centímetros em uma escala de três pontos. O comprimento do cólon obtido de cada rato com a doença de Crohn induzida pelo TNBS é avaliado em relação ao comprimento médio do cólon para o grupo controle (0: <10% menor que o controle, 1: de 10 a 20% menor que o controle, 2: mais de 20% mais curto que o controle).
- Calcular o escore macroscópico total de acordo com a equação: Escore macroscópico total = adesão (pontos) + eritema/hemorragia (pontos) + sangue fecal (pontos) + diarreia (pontos) + comprimento da úlcera (pontos) + espessura do cólon (pontos) + comprimento do cólon (pontos).
3. Preparação da amostra de cólon
- Corte o cólon em fragmentos de 1-2 cm e coloque cada um na esponja em um histológico devidamente rotulado.
NOTA: Esponjas para histológicas evitam a dobra do cólon durante a desidratação e a incubação na parafina líquida. - Coloque o fragmento do cólon em 4% de formaldeído e incubar por pelo menos 24 h a 4 °C.
- Preparar e programar o processador de tecidos para 1h de incubação em 50%, 70%, 90%, 95%, 100% etanol, xileno/100% etanol (1:1; v/v), e xileno apenas, bem como para pelo menos 3h de incubação em parafina líquida.
NOTA: A desidratação deve ser realizada no aumento das concentrações de etanol e xileno, mas a concentração de etanol pode ser modificada. A mistura de xileno/etanol é recomendada, mas não necessária. - Transfira o fragmento do cólon para uma caixa histológica e coloque no processador de tecido pré-programado.
- Execute o processador de tecido.
- Após os passos de incubação, coloque o fragmento de cólon em um molde metálico para que as duas extremidades do cólon estejam em posição vertical e preencha um terço do molde com parafina líquida.
- Coloque o molde na área de resfriamento (-5 °C) por alguns segundos e, em seguida, mova o molde para a área de aquecimento (70 °C). Coloque na parte inferior da caixa histológica e cubra todo o fragmento de cólon com parafina líquida.
- Deixe o molde metálico com o fragmento de cólon na parafina por alguns minutos na área de resfriamento. Retire o molde metálico do bloco de parafina e incuba por pelo menos 24 h a 4 °C.
- Remova o excesso de parafina do bloco e insira-o em um microtome rotativo totalmente automatizado.
NOTA: O bloco de parafina pode ser armazenado a -20 °C por alguns minutos antes desta etapa. - Corte o fragmento do cólon em seções de 5 μm.
- Transfira a seção do cólon para um banho de água pré-aquecido a 40 °C.
- Use a lâmina de vidro etiquetada para remover a seção de cólon do banho de água.
NOTA: As seções de cólon flutuam sobre a água. Coloque a lâmina de vidro etiquetada na água a seção do cólon e retire cuidadosamente a lâmina de vidro. - Deixe a lâmina de vidro por 24 h em temperatura ambiente. Para armazenamento a longo prazo, mantenha a lâmina de vidro a 4 °C após 24 h de incubação à temperatura ambiente.
4. Imunohistoquímica com coloração de imunofluorescência
NOTA: Não permita que a seção do cólon seque em nenhuma etapa durante o procedimento.
- Remova a parafina incubando o deslizamento de vidro em xileno por 5 min. Repita este passo três vezes.
- Coloque a lâmina de vidro em xileno/100% etanol (1:1; v/v) por 5 min. Repita esta etapa três vezes.
- Reidratar a seção de cólon em uma série de concentrações de etanol decrescentes, ou seja, 70%, 50%, 30% e 10% etanol por 5 min. Repita cada passo três vezes.
- Enxágüe a lâmina de vidro em água corrente por 5 min.
- Tampão de recuperação de antígeno pré-aquecimento (citrato de sódio de 10 mM; 0,05% Tween 20, pH 6.0) a 95-98 °C e aqueça a lâmina de vidro em solução de recuperação de antígeno fervente por 10 min.
NOTA: A etapa de recuperação de antígenos é opcional, mas recomendada. A solução de desmascaramento deve ser otimizada dependendo do anticorpo usado no experimento. - Desenhe um círculo ao redor da seção de cólon usando uma caneta hidrofóbica.
NOTA: Esta etapa é opcional, mas recomendada. A caneta hidrofóbica evita o desperdício de reagentes mantendo o líquido agrupado em um pequeno volume dentro marcado pelo círculo. - Incubar a seção em 3% de solução de água de peroxidase de hidrogênio por 10 min.
- Lave na solução de lavagem (50 mM Tris-HCl, pH 7.4; 150 mM NaCl; 0,05% Tween 20) por 5 min.
- Incubar na solução de bloqueio (5% de soro de cabra normal; 50 mM Tris-HCl, pH 7.4; 150 mM NaCl; 0,05% Triton X-100) por 1h à temperatura ambiente.
NOTA: Na solução de bloqueio, o soro normal deve ser da mesma espécie do anticorpo secundário. Nos estágios em que a incubação é necessária, coloque o deslizamento de vidro em uma câmara de umidade para evitar evaporação excessiva. - Remova a solução de bloqueio e adicione 20-50 μL de anticorpo primário contra ERα, ERβ ou GPER diluído em albumina de soro bovino de 1% com 50 mM Tris-HCl, pH 7.4, 150 mM NaCl, 0,05% Triton X-100.
NOTA: As diluições recomendadas dos anticorpos primários são mostradas na Tabela 2.
| Tipo de anticorpo | Anticorpo contra | Clonalidade | Espécies hospedeiras | Reatividade de espécies | Diluição |
| Primária | ERα | Polyclonal | Coelho | Humano | 1:100 |
| Mouse | |||||
| Tartaruga | |||||
| Capivara | |||||
| ERβ | Polyclonal | Coelho | Humano | ||
| Macaco | |||||
| Rato | |||||
| Mouse | |||||
| Ovelhas | |||||
| Porco | |||||
| GPER | Polyclonal | Coelho | Humano | ||
| Rato | |||||
| Mouse | |||||
| Secundário | DyLight 650 | Polyclonal | Cabra | Coelho | 1:250 |
Tabela 2: Características dos anticorpos.
- Incubar com anticorpo primário durante a noite a 4 °C na escuridão.
- Remova a solução de anticorpos e lave na solução de lavagem (50 mM Tris-HCl, pH 7.4; 150 mM NaCl; 0,05% Tween 20) por 5 min. Repita esta etapa três vezes.
- Adicione 20-50 μL de anticorpo secundário DyLight 650 diluído em albumina de soro bovino de 1% (contendo 50 mM Tris-HCl, pH 7.4, 150 mM NaCl, 0,05% Triton X-100). Incubar com anticorpo secundário conjugado com tintura por 1 h à temperatura ambiente na escuridão.
NOTA: A diluição recomendada do anticorpo secundário é mostrada na Tabela 2. - Remova a solução de anticorpos e lave na solução de lavagem (50 mM Tris-HCl, pH 7.4, 150 mM NaCl, 0,05% Tween 20) por 5 min. Repita esta etapa três vezes.
- Adicione 2% de DiOC6(3) diluído em 50 mM Tris-HCl, pH 7.4, 150 mM NaCl e incubar por 10 min à temperatura ambiente na escuridão.
- Remova a solução e lave na solução de lavagem (50 mM Tris-HCl, pH 7.4, 150 mM NaCl, 0,05% Tween 20) por 5 min. Repita esta etapa três vezes.
- Adicione algumas gotas de líquido à base de glicerol com DAPI diretamente na seção do cólon e cubra cuidadosamente com um slide de cobertura. Incubar a seção de cólon por pelo menos 24 h a 4 °C.
NOTA: Evite bolhas de ar ao cobrir o tecido com a lâmina da tampa. - Analise a seção de cólon microscópio confocal com objetivos de 20x ou 63x e imersão em óleo usando software dedicado.
NOTA: A Tabela 3 lista características dos fluorocromos utilizados neste estudo.
| Tipo fluorochome | Comprimento de onda (nm) | Tintura | |
| Excitação | Emissão | ||
| DAPI | 405 | 460 – 480 | Azul |
| DioC6 (3) | 485 | 538 – 595 | Verde |
| DyLight 650 | 654 | 660 – 680 | Vermelho |
Tabela 3: Características dos fluorocromos.
Resultados
Características macroscópicas de cólons em camundongos com doença de Crohn induzida pelo TNBS
Imagens representativas de cólons retirados do controle e camundongos tratados com TNBS são mostradas na Figura 2. Em camundongos com um modelo induzido por TNBS da doença de Crohn, o comprimento do cólon é reduzido enquanto a largura do cólon é aumentada.
Discussão
Existem inúmeros modelos animais para o exame de fisiopatologia do IBD, incluindo modelos genéticos, imunológicos ou espontâneos, bem como modelos quimicamente induzidos15. Entre os vários tipos de modelos animais de colite, modelos quimicamente induzidos, como o modelo induzido pelo TNBS descrito neste protocolo, são relativamente baratos e fáceis de obter. O modelo de murina induzida pelo TNBS tem vários sintomas clínicos relacionados à base patológica do CD. Animais com colite induzi...
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
O trabalho foi publicado graças ao apoio financeiro das autoridades da Universidade de Lodz: Vice-Reitor de Pesquisa Científica, Vice-Reitor de Cooperação Nacional e Internacional e Reitor da Faculdade de Biologia e Proteção Ambiental. Damian Jacenik foi apoiado por subsídios (2017/24/T/NZ5/00045 e 2015/17/N/NZ5/00336) do National Science Centre, Polônia.
Materiais
| Name | Company | Catalog Number | Comments |
| Animals | |||
| BALB/C mice | University of Lodz | NA | |
| Equipment | |||
| Caliper | VWR | 62379-531 | |
| Cardboard block | NA | NA | |
| Confocal microscope - TCS SP8 | Leica Biosystems | NA | |
| Fully automated rotary microtome - RM2255 | Leica Biosystems | NA | |
| Glass slide | Thermo Scientific | J1800BMNT | |
| Heated Paraffin Embedding Module - EG1150 H | Leica Biosystems | NA | |
| Histological box | Marfour | LN.138747 | |
| Hydrophobic pen | Sigma-Aldrich | Z377821 | |
| Laboratory balance | Radwag | WL-104-0048 | |
| LAS X software | Leica Biosystems | NA | |
| Metal mold | Marfour | CP.5105 | |
| Sterile gauze | NA | NA | |
| Sterile scissor | NA | NA | |
| Sterile tweezer | NA | NA | |
| Tissue processor - TP1020 | Leica Biosystems | NA | |
| Reagents | |||
| 2, 4, 6-trinitrobenzene sulfonic acid | Sigma-Aldrich | 92822 | |
| Bovine serum albumin | Sigma-Aldrich | A3294 | |
| DiOC6 (3) | Sigma-Aldrich | 318426 | |
| DyLight 650 secondary antibody | Abcam | ab96886 | |
| ERα primary antibody | Abcam | ab75635 | |
| ERβ primary antibody | Abcam | ab3576 | |
| Ethanol | Avantor Performance Materials Poland | 396480111 | |
| Formaldehyde | Avantor Performance Materials Poland | 432173111 | |
| GPER primary antibody | Abcam | ab39742 | |
| Hydrochloric acid | Avantor Performance Materials Poland | 575283421 | |
| Hydrogen peroxidase | Avantor Performance Materials Poland | 885193111 | |
| isoflurane (forane) | Baxter | 1001936040 | |
| Normal goat serum | Gibco | 16210064 | |
| Paraffin | Leica Biosystems | 39602012 | |
| Petrie dish | Nest Scientific | 705001 | |
| Phosphate buffer saline | Sigma-Aldrich | P3813 | |
| Physiological saline | Sigma-Aldrich | 7982 | |
| Primocin (antibiotic) | Invitrogen | ant-pm-1 | |
| ProLong Diamond Antifage Mountant with DAPI (glycerol-based liquid with DAPI) | Invitrogen | P36971 | |
| Sodium chloride | Chempur | WE/231-598-3 | |
| Sodium citrate | Avantor Performance Materials Poland | 795780429 | |
| Tris | Avantor Performance Materials Poland | 853470115 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| Xylene | Avantor Performance Materials Poland | BA0860119 |
Referências
- Zhang, Y. Z., Li, Y. Y. Inflammatory bowel disease: pathogenesis. World Journal of Gastroenterology. 20 (1), 91-99 (2014).
- Morris, G. P., et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 96 (3), 795-803 (1989).
- Okayasu, I., et al. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 98 (3), 694-702 (1990).
- Boirivant, M., Fuss, I. J., Chu, A., Strober, W. Oxazolone colitis: a murine model of T helper cell type 2 colitis treatable with antibodies to interleukin 4. Journal of Experimental Medicine. 188 (10), 1929-1939 (1998).
- Morrissey, P. J., Charrier, K., Braddy, S., Liggitt, D., Watson, J. D. CD4+ T cells that express high levels of CD45RB induce wasting disease when transferred into congenic severe combined immunodeficient mice. Disease development is prevented by cotransfer of purified CD4+ T cells. Journal of Experimental Medicine. 178 (1), 237-244 (1993).
- Kühn, R., Löhler, J., Rennick, D., Rajewsky, K., Müller, W. Interleukin-10-deficient mice develop chronic enterocolitis. Cell. 75 (2), 263-274 (1993).
- Sundberg, J. P., Elson, C. O., Bedigian, H., Birkenmeier, E. H. Spontaneous, heritable colitis in a new substrain of C3H/HeJ mice. Gastroenterology. 107 (6), 1726-1735 (1994).
- Harnish, D. C., et al. Beneficial effects of estrogen treatment in the HLA-B27 transgenic rat model of inflammatory bowel disease. American Journal of Physiology Gastrointestinal and Liver Physiology. 286 (1), 118-125 (2004).
- Pierdominici, M., et al. Linking estrogen receptor β expression with inflammatory bowel disease activity. Oncotarget. 6 (38), 40443-40451 (2015).
- Włodarczyk, M., et al. G protein-coupled receptor 30 (GPR30) expression pattern in inflammatory bowel disease patients suggests its key role in the inflammatory process. A preliminary study. Journal of Gastrointestinal and Liver Diseases. 26 (1), 29-35 (2017).
- Mohammad, I., et al. Estrogen receptor α contributes to T cell-mediated autoimmune inflammation by promoting T cell activation and proliferation. Science Signaling. 11 (526), eaap9415 (2018).
- Jacenik, D., et al. G protein-coupled estrogen receptor mediates anti-inflammatory action in Crohn's disease. Scientific Reports. 9 (1), 6749 (2019).
- Prossnitz, E. R., Barton, M. The G protein-coupled estrogen receptor GPER in health and disease. Nature Review Endocrinology. 7 (12), 715-726 (2011).
- Yaşar, P., Ayaz, G., User, S. D., Güpür, G., Muyan, M. Molecular mechanisms of estrogen-estrogen receptor signaling. Reproductive Medicine and Biology. 16 (1), 4-20 (2016).
- Pizarro, T. T., Arseneau, K. O., Bamias, G., Cominelli, F. Mouse models for the study of Crohn's disease. Trends in Molecular Medicine. 9 (5), 218-222 (2003).
- Neurath, M. F., Fuss, I., Kelsall, B. L., Stüber, E., Strober, W. Antibodies to interleukin 12 abrogate established experimental colitis in mice. Journal of Experimental Medicine. 182 (5), 1281-1290 (1995).
- Ikeda, M., et al. Simvastatin attenuates trinitrobenzene sulfonic acid-induced colitis, but not oxazalone-induced colitis. Digestive Diseases and Sciences. 53 (7), 1869-1875 (2007).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral Maxillofacial Pathology. 16 (3), 400-405 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados