Method Article
同时筛查1型糖尿病和多种自身免疫性疾病的高通量电化学发光7重检测
* 这些作者具有相同的贡献
摘要
我们模拟了一个简单的多重ECL检测,将7种自身抗体检测组合在一起。该测定能够同时筛查 T1D 和多种其他自身免疫性疾病,包括乳糜泻、自身免疫性甲状腺疾病和自身免疫性多腺综合征 1。
摘要
胰岛自身抗体(IAbs)广泛用于1型糖尿病(T1D)的诊断和预测。胰岛素 (IAA)、谷氨酸脱羧酶-65 (GADA)、胰岛素瘤抗原-2 (IA-2A) 和锌转运蛋白-8 (ZnT8A) 的四种主要 IAb 在疾病预测中同样重要。目前,高达40%的T1D诊断患者继续发展为其他自身免疫性疾病。不幸的是,目前使用单一自身抗体进行测量的筛选方法对于大规模筛选研究来说既费力又低效。我们最近开发了一种简单的多重电化学发光(ECL)测定来解决这些当前问题。该测定将所有 7 种自身抗体测试组合到一个孔中。每个孔包括三个 IAb(IAA、GADA 和 IA-2A)、甲状腺过氧化物酶 (TPOA) 和甲状腺球蛋白 (ThGA) 自身抗体以检测自身免疫性甲状腺疾病、组织谷氨酰胺转移酶 (TGA) 自身抗体(用于乳糜泻)和自身免疫性多腺综合征 (APS-1) 的干扰素 α 自身抗体 (IFNαA);所有这些都同时筛查T1D和其他相关的自身免疫性疾病。多重ECL检测基于单个ECL检测平台,而是使用多重板将多种自身抗体检测(最多10个)组合到一个孔中。与单一ECL测定的主要区别在于,在液相中形成的每个抗体-抗原复合物通过多重板上的接头系统被限制在每个孔的特定点上。在本研究中,7-Plex ECL 测定针对标准放射性结合测定 (RBA) 和单次 ECL 测定进行了验证,使用大量新诊断的 T1D 患者和年龄匹配的健康对照,从而具有出色的测定灵敏度和特异性。
引言
1型糖尿病(T1D)是一种严重的慢性疾病,最常见于儿童期。目前,美国约有 140 万人患有 T1D;引人注目的是,全球T1D的发病率以每年3-5%的速度稳步增长,并且在过去二十年中翻了一番,特别是在幼儿中1,2。血液循环中的胰岛自身抗体(IAbs)是目前最可靠的生物标志物。IAbs可能在临床T1D发展前数年出现3。目前,四种主要的IAb广泛用于T1D诊断和风险筛查,包括胰岛素自身抗体(IAA),谷氨酸脱羧酶-65(GADA),胰岛素瘤抗原-2(IA-2A)和锌转运蛋白-8(ZnT8A)。这四个IAb在预测T1D发展方面同样重要。T1D 的分类最近被重新定义为存在任何 4 个 IAb 中的 ≥2 个,血糖代谢正常,作为疾病 14 期。
在年轻人的糖尿病自身免疫研究(DAISY)中,发现四分之一有T1D风险的儿童可能会进展为胰岛,乳糜泻,甲状腺或类风湿自身免疫,更引人注目的是,大约40%被诊断患有T1D的患者最终会发展为额外的自身免疫性疾病5,6,7.自身抗体的鉴定对于预测和诊断这些自身免疫性疾病至关重要,应为患者提供更好的临床护理。目前还没有简单且廉价的方法来筛查这些多种自身免疫性疾病。目前使用标准放射性结合测定(RBA)和单一自身抗体测量的筛选方法对于大规模筛选来说既费力又低效。
在这里,我们将描述新开发的简单多重ECL检测,我们已经使用单个ECL检测平台8,9,10,11对其进行了验证。多重 ECL 检测将 7 种自身抗体检测结合到一个孔中,仅使用 15 μL 血清,能够同时筛查 T1D 和多种相关自身免疫性疾病,包括乳糜泻、自身免疫性甲状腺疾病和 APS-1。当时尚未开发ZnT8A ECL测定,因此未包含在多重测定中。多重ECL检测为一般人群筛查T1D和多种自身免疫性疾病提供了出色的工具。
研究方案
该研究方案得到了科罗拉多州多个机构审查委员会的批准。
1. 缓冲液制备
- 制作标记缓冲液(2x PBS,pH 7.9)。使用 400 mL 蒸馏去离子 (DD) 水,加入 100 mL 的 10x PBS。要调节溶液的pH值,请加入NaOH直至达到7.9。
- 通过将 1 mg 生物素溶解到先前创建的 588 μL 标记缓冲液中,创建 3 mM 生物素。通过将 150 nmol的 Ru 磺基-NHS 溶解到 50 μL 标记缓冲液中,制成 3 mM Ru 磺基-NHS。
- 通过取 500 mL 的 1x PBS 并向溶液中加入 5 g 牛血清白蛋白 (BSA) 来制作抗原缓冲液 (1% BSA)。准备0.5M乙酸溶液。使用Trizma碱制备1M Tris-HCl缓冲液,并将pH调节至9.0。
- 对于包衣缓冲液(3%阻断剂A),取500 mL 1x PBS并加入15 g阻断剂A.通过将5000 mL 1x PBS与2.5 mL吐温20混合来制备洗涤缓冲液(0.05%吐温20,PBST)。通过加入 500 mL DD 水和 500 mL 含有表面活性剂的 4x 读取缓冲液 T 来创建读数缓冲液(含表面活性剂的 2x 读取缓冲液 T)。
注意:为了保持测定之间的一致性,重要的是生物素和Ru Sulfo-NHS溶液都是在标记程序之前创建的,而不是创建和存储以备将来使用。
2. 分别用生物素和Ru磺基-NHS标记每种抗原蛋白
注意:要获得更有效的标记反应,请使用≥0.5mg / mL的抗原蛋白浓度。
- 计算每种抗原蛋白的摩尔数以及生物素和Ru磺基-NHS的摩尔数。在抗原蛋白中加入适量的生物素或Ru磺基-NHS抗原蛋白,按抗原蛋白与生物素或如磺基-NHS的摩尔比进行标记反应。
- 对于分子量较小(≤10 kDa)的抗原,例如胰岛素原蛋白,请使用1:5的摩尔比(抗原:生物素和Ru磺基-NHS)。对于分子量较大(>50 kDa)的抗原,例如GAD蛋白,使用1:20的摩尔比。对于具有中等分子量(10-50 kDa)的抗原,请使用在1:5-1:20之间调整的摩尔比。
- 对于生物素和Ru Sulfo-NHS,将每个抗原重量除以其相应的分子量,以获得每个抗原摩尔数。将摩尔数除以浓度以获得生物素的体积。对Ru Sulfo-NHS重复此操作。
- 使用适当的摩尔比将抗原蛋白与生物素混合,在步骤2.2中测定。然后对Ru Sulfo-NHS做同样的事情。
注意:为了提高标记反应的效率,缓冲液系统中的任何还原性化学物质(如Tris或甘氨酸)都需要通过施胶离心柱交换到pH 7.9的2x PBS缓冲液中。生物素和Ru Sulfo-NHS的标记协议是相同的。 - 用铝箔覆盖反应管,并在室温(RT)下孵育1小时。用箔纸覆盖反应管的原因是生物素和Ru磺基-NHS试剂都对光敏感。
- 在反应管孵育时灌注2 mL或5 mL离心柱(离心柱的大小由上传到色谱柱上的体积决定)。用2x PBS缓冲液填充离心柱,然后每次以1,000 x g 离心2分钟,共三次。
- 反应管完成孵育后停止标记反应。要停止反应,通过将标记的抗原蛋白通过离心柱一次来纯化标记的抗原蛋白。然后将色谱柱以1,000 x g 离心2分钟。
- 通过将存在的抗原蛋白的量除以最终体积来计算总标记抗原浓度。每管等分50μL纯化的标记抗原蛋白,并将等分试样储存在-80°C以备长期使用。
注意:重要的是要注意,每次离心柱通过抗原蛋白时,都会有大约90-95%的保留率。
3.确定测定(棋盘测定)中两种标记抗原的最佳浓度和比例
注意:由于该7-Plex测定中的ECL-IAA测定需要对血清样品进行酸处理,因此每种抗原的棋盘测定在与标记的抗原混合物孵育之前必须经过此步骤。
- 在运行多重测定之前,分别对每种抗原应用棋盘测定。步骤 3.2-3.6 将使用 GAD65 作为示例。
- 计算标记的GAD65蛋白的稀释度。生物素化GAD65的第一个混合物溶液的推荐目标浓度为2000 ng / mL,Ru磺基-NHS标记的GAD65为1000 ng / mL。如果储备溶液中生物素化和Ru磺基-NHS标记的GAD65的浓度均为1.0μg/ μL,则560μL工作溶液中生物素化GAD65所需的体积将为1.12μL,700μL工作溶液中标记的GAD65的Ru磺基-NHS所需的体积将为0.7μL。
- 将 1.12 μL 生物素化 GAD65 蛋白与 240 μL 链霉亲和素偶联接头 1 混合在一个试管中和 160 μL 1% BSA 中。将混合物在室温下孵育30分钟。向管中加入 160 μL 终止溶液,并将混合物在室温下再孵育 30 分钟。
- 进行连续稀释。将 280 μL 混合物放入新管中,加入 280 μL 终止液以 1:2 稀释。准备几个新管。重复此步骤以运行生物素标记的GAD65抗原的水平连续稀释(参考先前的出版物12)。
- 将 0.7 μL Ru 磺基-NHS 标记的 GAD65 (1 μg/μL) 蛋白与 700 μL 终止溶液混合。然后将 350 μL 混合物放入新试管中,加入 350 μL 终止液以 1:2 稀释。准备几个新管,重复此步骤以对Ru磺基-NHS标记的GAD65抗原进行垂直连续稀释。
- 制备两个血清样品,一个样品对 GADA 高度阳性,一个样品对 GADA 呈阴性,每个样品的体积为 0.75 mL。将 15 μL 阳性血清等分到 96 孔 PCR 板左半部分的每个孔中。将 15 μL 阴性血清等分到 96 孔 PCR 板右半部分的每个孔中。
- 向每个孔中加入 18 μL 0.5 M 乙酸并混合。在室温下孵育45分钟。 准备一个新的96孔PCR板。根据系列稀释液,向每个孔中加入 17.5 μL 生物素标记的抗原和 17.5 μL 的 Ru Sulfo-NHS 标记的抗原(参见之前的出版物12)。
- 继续步骤5.2至9.1中描述的其余测定步骤。
- 确定高正样本的信号与相应的负样本信号的比值。通过确定正负信号比例最高或接近最高比率的点,选择生物素标记抗原和Ru Sulfo-NHS标记抗原的最佳浓度。在此比率计算中,请考虑从负样本获得的低背景信号。
注意:来自棋盘测定的Ru Sulfo-NHS和生物素标记抗原蛋白的最佳浓度如下所示:GAD65为30 ng / mL和200 ng / mL,胰岛素原为120 ng / mL和120 ng / mL,IA-2为10 ng / mL和42 ng / mL,TG为80 ng / mL和80 ng / mL,TPO为8 ng / mL和16 ng / mL, ThG 为 31 ng/mL 和 31 ng/mL,IFNα 为 12 ng/mL 和 12 ng/mL。
4. 创建混合接头偶联抗原溶液
- 根据棋盘测定选择每种抗原的最佳浓度。将生物素和Ru磺基-NHS标记的抗原稀释至合理的工作浓度。
- 将不同的接头与每种独特的生物素化抗原蛋白结合。对于一个 96 孔板测定,将 4 μL 生物素化的 GAD65、TPO、tTG、ThG、胰岛素原、IFN-α 和 IA-2 蛋白与 240 μL 链霉亲和素偶联接头 1、2、3、4、8、9 和 10 混合到单独的管中(图 1)。然后每管加入 156 μL PBS/1% BSA。将混合物在室温下孵育30分钟。
- 向每个试管中加入 160 μL 终止溶液,并在室温下再孵育 30 分钟。从每个试管中取出 400 μL 接头偶联抗原,并将所有 7 种抗原组合在一起。加入 1.2 mL 终止液,然后将 4 μL 标记的 GAD65、TPO、tTG、ThG、胰岛素原、IFN-α 和 IA-2 抗原加入混合物中。现在抗原溶液已准备好用于测定。
5. 用标记的抗原孵育血清样品
注意:由于此 7-Plex 测定中的 ECL-IAA 测定需要对血清样品进行酸处理,因此每种血清都需要在与标记的抗原混合物孵育以进行此 7-Plex 测定之前进行酸处理步骤。
- 将每孔 15 μL 血清分装用于 96 孔 PCR 板。向每个孔中加入 18 μL 0.5 M 乙酸并混合。在室温下孵育45分钟。 准备一个新的 96 孔 PCR 板并将 35 μL 抗原溶液等分到每个孔中。
- 当板仍在孵育时,向抗原板中的每个孔中加入 13 μL 1 M Tris pH 9.0 缓冲液。在每个孔的侧面添加缓冲液以限制Tris缓冲液和抗原的混合。孵育完成后,取 25 μL 酸处理的血清,并立即将其移液到抗原板上的每个孔中。搅拌溶液并用PCR密封箔覆盖板以避免光照。
- 在室温下,将板放在摇床上,以低速设置,1小时。之后,将板储存在4°C,让板孵育18-24小时。
6. 准备多重板
- 从4°C冰箱中取出一个多重板,让板进入室温。多重板处于室温状态后,向每个孔中加入 150 μL 3% 阻断剂 A。用密封箔覆盖多重板。将板在4°C冰箱中孵育过夜。
注意:检测第 1 天包括步骤 4 至 6。
7. 将血清/抗原转入多重平板
- 第二天,将纸巾放在桌子上,然后从冰箱中取出孵育多重板。清空板中的所有缓冲液。为此,将板倒置并将其拍在准备好的纸巾上,直到任何孔中都没有缓冲液。
- 通过向每个孔中加入 150 μL PBST 来清洗多重板。如步骤 7.1 中所述,丢弃缓冲区,并重复此步骤三次。将 30 μL 血清/抗原孵育到多重板的每个孔中。用箔纸覆盖板以限制其暴露在光线下。将板放在设置为低速的摇板器上,在室温下放置1小时。
8.清洗板并加入读取缓冲液
- 通过将平板倒置并甩出溶液,从多重平板中取出血清/抗原孵育物。向所有孔中加入 150 μL PBST,并通过再次将板倒置并轻弹溶液从板中取出缓冲液。重复此步骤三次。第三次洗涤完成后,向每个孔中加入 150 μL 读数缓冲液。
注意:气泡会干扰酶标仪机器准确分析印版结果的能力,应不惜一切代价避免。
9. 读取板并分析数据
- 在读板器上对准备好的板进行计数,以每秒计数(CPS)为单位读取所有值。
- 使用从酶标仪机获得的抗体水平计算测定的相对指数,公式如下:
指数值 = [CPS(样本)- CPS(负标准)] / [CPS(正标准)- CPS(负标准)]。 - 使用已确定的临界值确定哪些抗体结果为阴性或阳性。
注意:检测第 2 天包括步骤 7 至 9。
结果
测定结果的分析如表1、表2和表3所示。读数值来自同一孔内 10 个点的数据。如测定方案中所述,根据其相应的内部阳性和阴性对照计算每个样品的指数值。表1中显示了错误重复的示例,并导致了表3中的最终索引计算错误。必须检查所有原始计数值,以避免任何误报或假阴性结果。
7 多重 ECL 测定使用来自 1026 名新诊断的 T1D 患者和 1022 名年龄和性别匹配的健康对照受试者的大量样本进行了验证。将 1026 名 T1D 患者的 7-Plex ECL 测定的自身抗体水平与我们相应的已建立的单次 ECL 测定的水平进行比较,如图 2 所示,以及每个相应的单一标准 RBA 和 ELISA 的水平如图 3 所示。除甲状腺自身抗体(其中使用第95个百分位数)外,所有自身抗体检测的检测特异性在99个百分 位数处相同,所有三种检测方法(7-Plex ECL,单ECL,RBA或ELISA)的1022个健康对照,如 表4所示。 GADA、IA-2A、IAA、TPOA、ThGA、TGA和IFNαA的测定间CV分别为6.4%、4.5%、9.1%、4.9%、5.7%、11.3%和5.9%。
在每种测定的临界临界值附近发现了7种自身抗体中每种抗体的少量不一致样品(图2 和 图3)。11 个对照样品(11/1022,1.1%)仅在 7-Plex 测定中发现多种自身抗体阳性,在每次相应的单次测定中发现阴性。同样,它发生在T1D患者的9个样本中(9/1026,0.9%)。此外,在单次ECL测定和RBA中均观察到的10个高阳性TPOA和1个ThGA在7-Plex测定中被遗漏。当这些样品进一步稀释时,这些样品在7-Plex测定中转化为阳性。一般来说,7-Plex ECL测定涵盖了单次ECL测定或RBA中100%的阳性,其测定特异性与 表4所示相同。
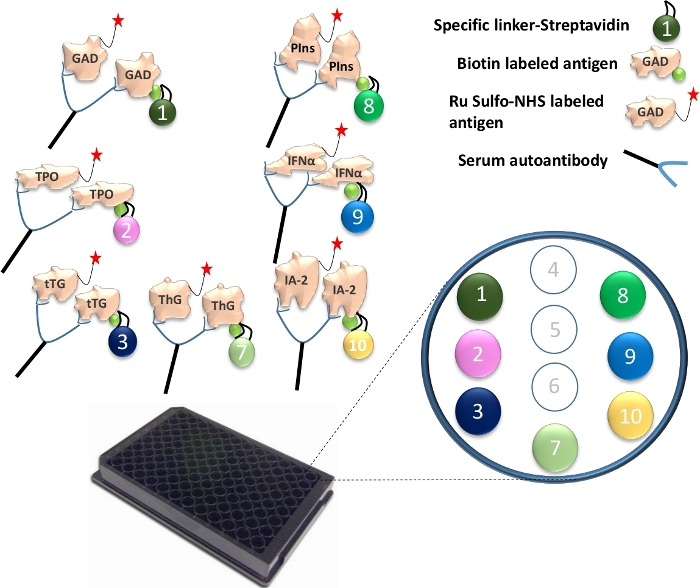
图 1:多效 ECL 测定的图示。
血清中的自身抗体会将Ru Sulfo-NHSged抗原桥接到生物素化抗原。这与特异性接头偶联,形成抗原-抗体-抗原-接头的复合物。复合物被捕获到板上,并通过每个特定的接头被限制到其特定位置。图中说明了7种不同抗原蛋白的特异性偶联接头数。抗体信号的检测是使用Ru Sulfo-NHS标记的抗原和电化学发光完成的。该图来自Gu, Y. et al.13。 请点击此处查看此图的大图。
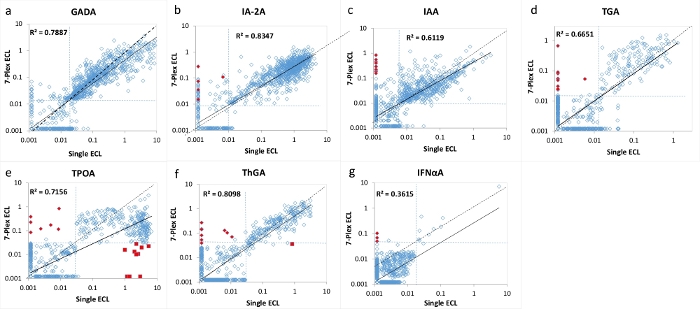
图 2:单次 ECL 测定和 7 重 ECL 测定之间 1026 例新发 T1D 患者中 7 种自身抗体水平的比较。
图A、B、C、D、E、F和G分别显示了GADA、IA-2A、IAA、TGA、TPOA、ThGA和IFNαA的自身抗体水平比较。虚线表示每种自身抗体测定的测定截止值。对于每种测定,临界值设置为1022个年龄匹配的健康对照的第99个百分位数(TPOA和ThGA除外,它们设置为第95个百分位数),如表4所示,来自单次和多重ECL测定的1022个年龄匹配的健康对照。在 7-Plex ECL 检测中,红色闭合钻石被标记为"假"阳性,占研究队列的 <1%,并且在单个 ECL 和 RBA 中均被验证为阴性。在由"prozone"现象引起的7-Plex ECL测定中,红色接近方块被标记为"假"阴性,主要发生在TPOA测定中,占研究队列的<1%。讨论部分讨论了这两种假阳性和假阴性结果。该图来自Gu, Y. et al.13。请点击此处查看此图的大图。
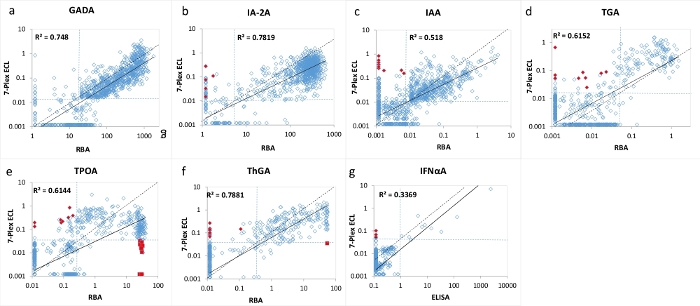
图 3:1026 例新发 T1D 患者中 7 种自身抗体水平的比较,RBA(IFNαA 的 ELISA)和 7 重 ECL 测定。
图A、B、C、D、E、F和G分别比较了GADA、IA-2A、IAA、TGA、TPOA、ThGA和IFNαA的自身抗体水平。虚线表示每种自身抗体测定的测定截止值,RBA 和 7-Plex ECL 测定的特异性集相同,如 表 4 所示,来自 1022 名年龄匹配的健康对照。红色闭合菱形和方块表示 7-Plex ECL 测定中出现的"假"阳性和"假"阴性,如图 2 所示。该图来自Gu, Y. et al.13。 请点击此处查看此图的大图。
| 1 | 2 | 3 | 4 | 5 | 6 | ||
| 一个 | 5580 | 5674 | 105 | 117 | 125 | 139 | 接头-1 |
| 100 | 108 | 102 | 102 | 3956 | 3745 | 链接器-2 | |
| 115 | 124 | 107 | 116 | 113 | 124 | 接头-3 | |
| 67 | 64 | 68 | 61 | 65 | 69 | 链接器-4 | |
| 89 | 87 | 98 | 92 | 90 | 80 | 链接器-5 | |
| 87 | 71 | 89 | 87 | 61 | 72 | 链接器-6 | |
| 94 | 82 | 79 | 85 | 2154 | 2280 | 链接器-7 | |
| 75 | 66 | 1628 | 1594 | 81 | 83 | 链接器-8 | |
| 98 | 103 | 71 | 84 | 69 | 85 | 链接器-9 | |
| 102 | 118 | 93 | 98 | 113 | 99 | 链接器-10 | |
| B | 324 | 337 | 147 | 148 | 5426 | 5366 | 接头-1 |
| 101 | 102 | 93 | 88 | 86 | 74 | 链接器-2 | |
| 111 | 119 | 119 | 123 | 66 | 72 | 接头-3 | |
| 72 | 65 | 59 | 68 | 74 | 67 | 链接器-4 | |
| 81 | 98 | 83 | 92 | 79 | 72 | 链接器-5 | |
| 90 | 84 | 93 | 86 | 70 | 76 | 链接器-6 | |
| 101 | 105 | 101 | 97 | 956 | 944 | 链接器-7 | |
| 82 | 83 | 189 | 204 | 97 | 90 | 链接器-8 | |
| 92 | 83 | 78 | 64 | 82 | 78 | 链接器-9 | |
| 83 | 79 | 88 | 93 | 4722 | 4965 | 链接器-10 | |
| C | 110 | 110 | 87 | 81 | 2114 | 2365 | 接头-1 |
| 5526 | 5680 | 88 | 70 | 86 | 93 | 链接器-2 | |
| 114 | 132 | 67 | 71 | 3326 | 3284 | 接头-3 | |
| 64 | 62 | 88 | 74 | 64 | 80 | 链接器-4 | |
| 94 | 82 | 86 | 75 | 89 | 76 | 链接器-5 | |
| 77 | 87 | 75 | 63 | 70 | 86 | 链接器-6 | |
| 77 | 86 | 71 | 84 | 138 | 121 | 链接器-7 | |
| 73 | 86 | 80 | 79 | 59 | 73 | 链接器-8 | |
| 86 | 74 | 5064 | 4923 | 88 | 86 | 链接器-9 | |
| 105 | 113 | 85 | 80 | 124 | 114 | 链接器-10 | |
| D | 98 | 88 | 92 | 84 | 136 | 127 | 接头-1 |
| 288 | 291 | 86 | 86 | 558 | 564 | 链接器-2 | |
| 109 | 101 | 74 | 73 | 141 | 127 | 接头-3 | |
| 78 | 66 | 66 | 55 | 74 | 66 | 链接器-4 | |
| 79 | 83 | 79 | 86 | 96 | 91 | 链接器-5 | |
| 83 | 86 | 96 | 89 | 86 | 73 | 链接器-6 | |
| 87 | 89 | 77 | 87 | 841 | 855 | 链接器-7 | |
| 74 | 72 | 60 | 72 | 90 | 95 | 链接器-8 | |
| 68 | 75 | 331 | 328 | 2460 | 2580 | 链接器-9 | |
| 86 | 98 | 80 | 75 | 123 | 133 | 链接器-10 | |
| E | 101 | 114 | 101 | 106 | 532 | 548 | 接头-1 |
| 101 | 96 | 110 | 104 | 682 | 675 | 链接器-2 | |
| 6015 | 5988 | 124 | 126 | 101 | 98 | 接头-3 | |
| 66 | 71 | 82 | 71 | 80 | 62 | 链接器-4 | |
| 102 | 97 | 99 | 80 | 83 | 110 | 链接器-5 | |
| 82 | 67 | 81 | 80 | 60 | 85 | 链接器-6 | |
| 85 | 95 | 52 | 84 | 245 | 221 | 链接器-7 | |
| 72 | 78 | 82 | 74 | 486 | 503 | 链接器-8 | |
| 77 | 97 | 97 | 77 | 56 | 66 | 链接器-9 | |
| 114 | 104 | 5726 | 5814 | 259 | 253 | 链接器-10 | |
| F | 119 | 120 | 133 | 118 | 112 | 96 | 接头-1 |
| 101 | 91 | 100 | 95 | 96 | 82 | 链接器-2 | |
| 406 | 395 | 111 | 123 | 2127 | 101 | 接头-3 | |
| 72 | 60 | 86 | 72 | 79 | 83 | 链接器-4 | |
| 76 | 85 | 96 | 99 | 89 | 103 | 链接器-5 | |
| 88 | 78 | 91 | 83 | 89 | 95 | 链接器-6 | |
| 104 | 97 | 87 | 102 | 56 | 66 | 链接器-7 | |
| 76 | 77 | 79 | 93 | 69 | 75 | 链接器-8 | |
| 85 | 71 | 95 | 100 | 83 | 71 | 链接器-9 | |
| 131 | 131 | 358 | 364 | 92 | 86 | 链接器-10 | |
| G | 90 | 95 | 85 | 82 | 105 | 107 | 接头-1 |
| 99 | 86 | 77 | 76 | 1250 | 1174 | 链接器-2 | |
| 119 | 123 | 120 | 118 | 112 | 108 | 接头-3 | |
| 76 | 83 | 77 | 80 | 86 | 76 | 链接器-4 | |
| 88 | 86 | 86 | 93 | 107 | 92 | 链接器-5 | |
| 73 | 73 | 71 | 82 | 84 | 75 | 链接器-6 | |
| 5210 | 5173 | 72 | 69 | 76 | 85 | 链接器-7 | |
| 80 | 81 | 79 | 82 | 100 | 101 | 链接器-8 | |
| 96 | 97 | 89 | 83 | 65 | 83 | 链接器-9 | |
| 98 | 103 | 86 | 88 | 1933 | 1979 | 链接器-10 | |
| H | 114 | 124 | 81 | 86 | 299 | 295 | 接头-1 |
| 107 | 92 | 69 | 72 | 4256 | 4388 | 链接器-2 | |
| 114 | 123 | 125 | 129 | 501 | 536 | 接头-3 | |
| 77 | 70 | 67 | 64 | 74 | 62 | 链接器-4 | |
| 92 | 110 | 81 | 84 | 77 | 71 | 链接器-5 | |
| 87 | 79 | 72 | 76 | 83 | 81 | 链接器-6 | |
| 328 | 341 | 84 | 80 | 88 | 97 | 链接器-7 | |
| 75 | 84 | 75 | 90 | 74 | 83 | 链接器-8 | |
| 73 | 79 | 78 | 76 | 84 | 70 | 链接器-9 | |
| 113 | 120 | 81 | 76 | 2372 | 2350 | 链接器-10 | |
表1:7重ECL测定的分析:原始CPS计数(板的左半部分)。 从检测板(板的左半部分)获取原始CPS计数,并且每个样品一式两份。在板的每一行(A-H)下,有10行读数值,代表来自同一孔内10个点的数据,对应于标记的每个接头编号。错误重复项的示例以灰色突出显示,如第 F 链接器 3 行第 5 列和第 6 行所示。
| 表1A行 | 表1A列 | 链接器 1 | 链接器 2 | 链接器 3 | 链接器 7 | 链接器 8 | 链接器 9 | 链接器 10 | |
| 一个 | 1-2 | 嘎达电脑 | 5627 | 104 | 120 | 88 | 71 | 101 | 110 |
| B | 1-2 | 嘎达低电脑 | 331 | 102 | 115 | 103 | 83 | 88 | 81 |
| C | 1-2 | 嘟电脑 | 110 | 5603 | 123 | 82 | 80 | 80 | 109 |
| D | 1-2 | TPOA 低电脑 | 93 | 290 | 105 | 88 | 73 | 72 | 92 |
| E | 1-2 | TGA 电脑 | 108 | 99 | 6002 | 90 | 75 | 87 | 109 |
| F | 1-2 | TG 低电脑 | 120 | 96 | 401 | 101 | 77 | 78 | 131 |
| G | 1-2 | 太嘎嘎电脑 | 93 | 93 | 121 | 5192 | 81 | 97 | 101 |
| H | 1-2 | 太高低电脑 | 119 | 100 | 119 | 335 | 80 | 76 | 117 |
| 一个 | 3-4 | IAA 电脑 | 111 | 102 | 112 | 82 | 1611 | 78 | 96 |
| B | 3-4 | 低位电脑 | 148 | 91 | 121 | 99 | 197 | 71 | 91 |
| C | 3-4 | IFNaA 电脑 | 84 | 79 | 69 | 78 | 80 | 4994 | 83 |
| D | 3-4 | IFNaA 低位电脑 | 88 | 86 | 74 | 82 | 66 | 330 | 78 |
| E | 3-4 | IA-2A 电脑 | 104 | 107 | 125 | 68 | 78 | 87 | 5770 |
| F | 3-4 | IA-2A 低位电脑 | 126 | 98 | 117 | 95 | 86 | 98 | 361 |
| G | 3-4 | 数控 | 84 | 77 | 119 | 71 | 81 | 86 | 87 |
| H | 3-4 | 数控 | 84 | 71 | 127 | 82 | 78 | 77 | 79 |
| 一个 | 5-6 | 样本1 | 132 | 3851 | 119 | 2217 | 82 | 77 | 106 |
| B | 5-6 | 样本2 | 5396 | 80 | 69 | 950 | 94 | 80 | 4844 |
| C | 5-6 | 样本3 | 2240 | 90 | 3305 | 130 | 66 | 87 | 119 |
| D | 5-6 | 样本4 | 132 | 561 | 134 | 848 | 93 | 2520 | 128 |
| E | 5-6 | 样本5 | 540 | 679 | 100 | 233 | 495 | 61 | 256 |
| F | 5-6 | 样本6 | 104 | 89 | 1114 | 61 | 72 | 77 | 89 |
| G | 5-6 | 样本7 | 106 | 1212 | 110 | 81 | 101 | 74 | 1957 |
| H | 5-6 | 样本8 | 297 | 4322 | 519 | 93 | 79 | 77 | 2361 |
表2:7重ECL测定的分析:表1数据的排列,标记为7个接头。重新排列表1中的数据,删除链接器4至6(未使用),并根据表1的每个重复读数计算平均值。内标高低阳性对照的值,对应于每个自身抗体测定,由特定接头限制,以深粗体显示。PC,阳性对照。常闭,正常控制。
| 性别与发展指数 | TPOA指数 | TGA指数 | 钝化钝指数 | IAA指数 | IFNaA指数 | IA-2A指数 | |
| 嘎达电脑 | 1.000 | 0.005 | 0.000 | 0.003 | -0.006 | 0.003 | 0.004 |
| 嘎达低电脑 | 0.045 | 0.005 | -0.001 | 0.006 | 0.002 | 0.000 | -0.001 |
| IAA 电脑 | 0.005 | 1.000 | 0.001 | 0.002 | -0.001 | -0.001 | 0.004 |
| 低位电脑 | 0.002 | 0.039 | -0.002 | 0.003 | -0.005 | -0.003 | 0.001 |
| IA-2A 电脑 | 0.004 | 0.004 | 1.000 | 0.004 | -0.004 | 0.000 | 0.004 |
| IA-2A 低位电脑 | 0.007 | 0.004 | 0.048 | 0.006 | -0.002 | -0.002 | 0.008 |
| TGA 电脑 | 0.002 | 0.003 | 0.000 | 1.000 | 0.000 | 0.002 | 0.002 |
| TG 低电脑 | 0.006 | 0.004 | 0.000 | 0.052 | -0.001 | -0.002 | 0.005 |
| 嘟电脑 | 0.005 | 0.005 | -0.001 | 0.002 | 1.000 | -0.002 | 0.001 |
| TPOA 低电脑 | 0.012 | 0.003 | 0.000 | 0.006 | 0.076 | -0.003 | 0.001 |
| 太嘎嘎电脑 | 0.000 | 0.000 | -0.008 | 0.001 | 0.000 | 1.000 | -0.001 |
| 太高低电脑 | 0.001 | 0.002 | -0.008 | 0.002 | -0.009 | 0.050 | -0.002 |
| IFNaA 电脑 | 0.004 | 0.006 | 0.001 | 0.000 | -0.002 | 0.000 | 1.000 |
| IFNaA 低位电脑 | 0.008 | 0.004 | 0.000 | 0.005 | 0.004 | 0.002 | 0.048 |
| 数控 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 数控 | 0.000 | -0.001 | 0.001 | 0.002 | -0.002 | -0.002 | -0.001 |
| 样本1 | 0.009 | 0.683 | 0.000 | 0.419 | 0.001 | -0.002 | 0.003 |
| 样本2 | 0.958 | 0.001 | -0.008 | 0.172 | 0.009 | -0.001 | 0.837 |
| 样本3 | 0.389 | 0.002 | 0.542 | 0.012 | -0.009 | 0.000 | 0.006 |
| 样本4 | 0.009 | 0.088 | 0.003 | 0.152 | 0.008 | 0.496 | 0.007 |
| 样本5 | 0.082 | 0.109 | -0.003 | 0.032 | 0.271 | -0.005 | 0.030 |
| 样本6 | 0.004 | 0.002 | 0.169 | -0.002 | -0.006 | -0.002 | 0.000 |
| 样本7 | 0.004 | 0.205 | -0.002 | 0.002 | 0.013 | -0.002 | 0.329 |
| 样本8 | 0.039 | 0.768 | 0.068 | 0.004 | -0.001 | -0.002 | 0.400 |
表3:7重ECL测定的分析:指数值的结果。 按照测定方案中所述,根据其相应的内部阳性和阴性对照计算所有 7 种自身抗体测定的每个样品的指数值。任何大于临界值的指数值都被定义为正结果,以深色粗体显示。sample6 的 TGA 指数值以灰色突出显示,因为它是由 表 1 中 F 链接器 3 行第 5 列和第 6 行中显示的错误重复引起的错误。
| 嘎达 | IA-2A | 国际航空管理局 | .TGA | TPOA | 太嘎 | IFNαA* | ||||||||
| 森斯 | 规范 | 森斯 | 规范 | 森斯 | 规范 | 森斯 | 规范 | 森斯 | 规范 | 森斯 | 规范 | 森斯 | 规范 | |
| 澳洲联储 | 73.4% | 98.5% | 75.2% | 99.0% | 47.7% | 99.1% | 12.9% | 99.0% | 23.9% | 95.2% | 19.3% | 94.7% | 1.0% | 99.6% |
| 单个 ECL | 71.6% | 99.1% | 73.6% | 99.3% | 48.3% | 99.7% | 16.0% | 98.9% | 26.3% | 94.9% | 20.6% | 95.1% | 0.8% | 99.2% |
| 7 重 ECL | 71.2% | 98.9% | 77.3% | 98.9% | 49.5% | 98.9% | 16.5% | 98.7% | 26.1% | 94.7% | 21.1% | 94.7% | 1.7% | 99.1% |
表 4:与相应的单次 ECL 测定和 RBA 或 ELISA * 相比,在 7 重 ECL 测定中,1026 名 T1D 患者和 1022 名对照的测定敏感性和特异性,年龄和性别匹配。使用1022年龄和性别匹配的健康对照,将每种自身抗体的不同测定(RBA,单ECL和7-Plex ECL)设置为相似的特异性。研究对照队列的特异性结果在TPOA和ThGA中设定在95%左右,其他5种测定的特异性结果设定为99%。*星号标记 ELISA 的 IFNαA 测定,而其他是 RBA。
讨论
在众多针对 1 型糖尿病的国家和国际临床试验中,单一 ECL 测定检测胰岛自身抗体和乳糜泻谷氨酰胺转移酶 (TGA) 自身抗体的性能已得到证实8,9,10,11。在这些试验中,当根据现有的"金"标准RBA进行评估时,该测定提高了自身抗原检测的灵敏度和特异性。在单次ECL测定和RBA14,15,16,17之间区分高亲和力和高风险胰岛自身抗体与低风险,低亲和力信号时,可以看到增强的疾病特异性。在单一ECL检测的基础上,我们提出了一种新的高通量多重ECL自身抗体检测,使我们能够同时筛查T1D以及几种适用的自身免疫性疾病。
多重ECL检测使用多重板,可将多达10种自身抗体检测组合到一个孔中。在本研究中,将7种自身抗体测定组合在一起。自身抗体包括 3 种 IAb(IAA、GADA 和 IA-2A)、2 种自身免疫性甲状腺疾病自身抗体(TPOA 和 ThGA)、乳糜泻自身抗体 (TGA) 和 APS-1 干扰素 α 自身抗体 (IFNαA)。通常,该测定机制基于先前发表的9,10,12,18的单一ECL测定,并进行了一些修改。多重ECL检测与单一ECL检测的主要区别在于,在液相中形成的每个抗体-抗原复合物都被限制在特定的接头上(图1)。生物素标记的抗原与链霉亲和素偶联物一起孵育,链霉亲和素是用于形成特异性抗原-接头复合物的接头。抗体-抗原免疫复合物在与患者血清孵育后形成,并通过多重板每个孔上的特异性接头系统捕获到特定点上。Ru Sulfo-NHS标记的抗原被抗体捕获,同时提供电化学发光信号。酶标仪可以检测来自每个孔中的点光源的多达 10 个不同信号。为了在进行长期研究时保持板之间的自身抗体测定一致,我们建议使用相同的接头。
在建立多重ECL检测之前,需要分别在多重板上优化每种自身抗体的单次ECL检测,并在常规ECL板上针对RBA和单ECL检测进行验证。为了增强棋盘格测定,对多重板上的相关自身抗体测定,使用了高阳性患者和阴性患者样本。进行棋盘测定后,计算7种自身抗体测定中每种最理想的Ru Sulfo-NHS和生物素标记抗原浓度。下面显示了这些浓度:GAD65为30 ng/mL和200 ng/mL,胰岛素原为120 ng/mL和120 ng/mL,IA-2为10 ng/mL和42 ng/mL,TG为80 ng/mL和80 ng/mL,TPO为8 ng/mL和16 ng/mL,ThG为31 ng/mL和31 ng/mL, IFNα 13 分别为 12 ng/mL 和 12 ng/mL。将所有测定组合在一起后,可能需要根据实际多重测定的结果进一步调整棋盘测定中某些抗原的浓度。
由于IAA包含在目前的多重ECL测定中,因此在将血清与抗原孵育之前,必须对血清样品进行酸处理,如先前的研究12所述。通常,当在多重检测中加入额外的自身抗体时,检测背景会受到影响,并且来自孔中一个点的极高信号可能会通过串扰阻碍附近斑点的结果。因此,对于最高阳性样品,每个自身抗体的最大CPS需要限制为20,000个计数,或更低。据我们所知,为了减少涉及的串扰量,在设计斑点图时,应将背景较低的自身抗体与计数频率较高的斑点分开。
在每次测定中内部使用高阳性和阴性对照,以计算被测未知样品的准确指数。为了准确评估和监测测定的灵敏度,使用了设置在测定上限附近的低阳性对照。这些标准阳性和阴性对照以批量和等分试样形式创建以供长期使用,并储存在-20°C或更低温度下,以确保测定之间的一致性。出于质量保证的目的,每次检测中都运行两次样品,然后重新运行每个阳性结果,并在第二天通过新的ECL检测来确认样品。如果对第一和第二验证性测定有任何分歧,则需要进行第三次测定。在进行的三种测定中,一致的两种测定的结果(例如,+,+或-,-)决定了样品的最终结果(阳性或阴性)。
在过去十年中,许多研究小组正在寻求一种利用多重方法将多种自身抗体检测组合成一个孔以筛选大量人群的高通量检测。有一些研究正在使用不同类型的技术进行多重自身抗体检测19,20,21,22,但在研究T1D时,这些检测的灵敏度和特异性与当前的"黄金"标准RBA没有可比性。所使用的这些不同类型的平台未通过国际胰岛自身抗体标准化计划(IASP)研讨会或通过在临床试验中测试大型队列进行验证。在德国最近进行的基于一般人群的筛查中,Kronus 分发的高通量联合检测 3 Screen ICATM ELISA 正被用作一线筛查的工具,以检测三种 IAb、GADA、IA-2A 和 ZnT8A,以实现儿童 T1D23 的早期诊断。3 筛选 ELISA 测定法可在 3 个分离的孔中测量 3 种自身抗体,消耗大量血清,或在混合所有 3 种检测的单个孔中测量 3 种自身抗体。如果 3 屏幕 ELISA 测定中的一个孔呈阳性,则无法区分存在三种自身抗体中的哪一个。该测定的最大缺点是无法包括IAA测量。正如IASP讲习班所证明的那样,ELISA进行的所有IAA结果都不具有可接受的敏感性和特异性24。IAA通常是第一个出现的IAb,在幼儿中患病率很高。与IAA一起进行IAb筛查对儿童是必要的,在没有IAA评估社区T1D风险的情况下进行这种筛查是不可接受的。此外,没有已发表的研究或数据显示 Kronus IAb 试剂盒检测更具 T1D 疾病特异性,能够区分高风险和低风险 IAb。在本研究中,7-Plex ECL测定使用大量新诊断的T1D13患者进行了验证。与当前标准RBA和成熟的单一ECL检测相比,7-Plex检测能够以相同的检测特异性保持100%的阳性性(表4)。目前,与标准RBA并行的4-Plex ECL测定正在应用于正在进行的大型临床试验:儿童自身免疫筛查(ASK)研究。该试验对丹佛大都会区普通人群中的儿童进行T1D和乳糜泻筛查。与ASK研究中使用的标准RBA相比,多重ECL测定显示出出色的灵敏度和更高的疾病特异性,与我们之前使用单个ECL研究的报告相同25。此外,与相应的 4 次 ECL 和 RBA 单次检测相比,我们的 4-Plex ECL 检测表明,劳动力、成本和血清量显著减少了 70%。使用多重ECL测定,我们可以用不同的数字定制每个孔,代表不同的自身抗体(最多10种),以测试特定于特定临床位置需求的不同自身免疫性疾病。
本研究显示,对于使用多重板的多重ECL测定,观察到一些局限性。与抗原一起孵育的血清的最终稀释度无法调整,以产生组合在单个孔中的每个自身抗体测定的最佳条件。观察到来自T1D患者的9个样本(9/1026)对特定自身抗体有假阴性结果。在7-Plex ECL测定中,7个假阴性是TPOA,2个是ThGA,但在单一ECL测定和RBA中都表现出高阳性结果(图2 和 3)。在所有9个样品进一步稀释后,它们在多重板上呈阳性。这个结果是由我们所说的"prozone"现象引起的。这种现象导致样品显示假阴性结果,因为高抗体滴度会影响抗原抗体晶格的形成。在设置多重检测时,对于每种联合自身抗体,建议对具有非常高滴度的样品进行预测试,以确定用于抗原孵育的血清的可选稀释度。或者,应选择具有类似优化条件的自身抗体检测以形成组合检测,从中对每种自身抗体获得最佳检测灵敏度和特异性。在本研究中,来自健康正常对照的7个样品(7/1022)在7-Plex测定中导致多种自身抗体的假阳性,但是在运行单个ECL测定和RBA(图2 和 3)后,发现这些自身抗体在两种测定中均为阴性。对于这些小样本子集,多重平板上发生这些假阳性结果的原因目前尚不清楚。对于多重ECL检测的当前应用,所有阳性样品都重复其相应的单一ECL检测以确认阳性,从而消除了多重ECL检测中的假阳性误差。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了NIH拨款DK32083,JDRF拨款2-SRA-2015-51-Q-R和2-SRA-2018-533-S-B的支持。
材料
| Name | Company | Catalog Number | Comments |
| 4 °C refrigerator | |||
| –80 °C and -20 °C freezers | |||
| 96-well Plate Shaker | Wallac - Delfi | ||
| 96-well round bottom plate | Fisher | 8408220 | |
| Acetic acid solution | Fisher | ||
| Aluminum foil | |||
| Antigen proteins | |||
| Human GAD65 full length protein | Diamyd | ||
| Human ThG full length protein | BioMart | ||
| Human TPO full length protein | BioMart | ||
| IA-2 intracellular domain protein | BioMart | ||
| IFN-α protein | Abcam | ||
| Proinsulin protein | AmideBio | ||
| tTG protein | DiaRect | ||
| Biotin | Sigma | ||
| Bottle-Top 500 mL , Filter Units | Fisher | 0974064A or B | |
| Bovine Serum Albumin | Sigma | A-7906 | |
| Distilled deionized (DD) water | |||
| HCl | Fisher | ||
| Ice maker | |||
| Ice trays | |||
| MSD Sector | Perkin-Elmer | ||
| Multi-channel pipette | |||
| NaOH | |||
| Paper tower | |||
| PBS | |||
| pH meter | |||
| Pipette-Aid | |||
| Pipettes/tips | |||
| Ru Sulfo-NHS | MSD (R91AN) | ||
| Trizma Base | Fisher | BP152-5 | |
| Tween 20 | Sigma | P-1379 | |
| Uplex Development Kit | MSD | ||
| 96-well UPlex plate | MSD | ||
| Blocker A | MSD | R93AA | |
| Linker-Streptavidin | MSD | ||
| Read buffer | MSD | R92TC | |
| Stop Solution | MSD | ||
| Vortex mixer | |||
| ZeBa Column | Pierce | 89892 |
参考文献
- Harjutsalo, V., Sjoberg, L., Tuomilehto, J. Time trends in the incidence of type 1 diabetes in Finnish children: a cohort study. Lancet. 371 (9626), 1777-1782 (2008).
- Vehik, K., et al. Increasing incidence of type 1 diabetes in 0- to 17-year-old Colorado youth. Diabetes Care. 30 (3), 503-509 (2007).
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Insel, R. A., et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 38 (10), 1964-1974 (2015).
- Barker, J. M., et al. Autoantibody "subspecificity" in type 1 diabetes: risk for organ-specific autoimmunity clusters in distinct groups. Diabetes Care. 28 (4), 850-855 (2005).
- Triolo, T. M., et al. Additional Autoimmune Disease Found in 33% of Patients at Type 1 Diabetes Onset. Diabetes Care. 34 (5), 1211-1213 (2011).
- de Graaff, L. C., Smit, J. W., Radder, J. K. Prevalence and clinical significance of organ-specific autoantibodies in type 1 diabetes mellitus. Netherlands Journal of Medicine. 65 (7), 235-247 (2007).
- Yu, L., et al. Proinsulin/Insulin autoantibodies measured with electrochemiluminescent assay are the earliest indicator of prediabetic islet autoimmunity. Diabetes Care. 36 (8), 2266-2270 (2013).
- Yu, L., et al. Distinguishing persistent insulin autoantibodies with differential risk: nonradioactive bivalent proinsulin/insulin autoantibody assay. Diabetes. 61 (1), 179-186 (2012).
- Miao, D., et al. GAD65 autoantibodies detected by electrochemiluminescence assay identify high risk for type 1 diabetes. Diabetes. 62 (12), 4174-4178 (2013).
- Gu, Y., Zhao, Z., High, H., Yang, T., Yu, L. Islet Autoantibody Detection by Electrochemiluminescence (ECL) Assay. Journal of Clinical & Cellular Immunology. 8 (6), (2017).
- Gu, Y., et al. Electrochemiluminescence Assays for Human Islet Autoantibodies. Journal of Visualized Experiments. (133), e57227 (2018).
- Gu, Y., et al. High-throughput multiplexed autoantibody detection to screen type 1 diabetes and multiple autoimmune diseases simultaneously. Ebiomedicine. 47, 365-372 (2019).
- Dongmei, M., A, K. S., Li Zh, K., Michelle, G., Ling, J., Taylor, A. Electrochemiluminescence Assays for Insulin and Glutamic Acid Decarboxylase Autoantibodies Improve Prediction of Type 1 Diabetes Risk. Diabetes Technology & Therapeutics. 17 (2), 119-127 (2015).
- Steck, A. K., et al. ECL-IAA and ECL-GADA Can Identify High-Risk Single Autoantibody-Positive Relatives in the TrialNet Pathway to Prevention Study. Diabetes Technology & Therapeutics. 18 (7), 410-414 (2016).
- Fouts, A., et al. Do Electrochemiluminescence Assays Improve Prediction of Time to Type 1 Diabetes in Autoantibody-Positive TrialNet Subjects. Diabetes Care. 39 (10), 1738-1744 (2016).
- Sosenko, J. M., et al. The Use of Electrochemiluminescence Assays to Predict Autoantibody and Glycemic Progression Toward Type 1 Diabetes in Individuals with Single Autoantibodies. Diabetes Technology & Therapeutics. 19 (3), 183-187 (2017).
- Zhao, Z., et al. Higher Sensitivity and Earlier Identification of Celiac Disease Autoimmunity by a Nonradioactive Assay for Transglutaminase Autoantibodies. Journal of Immunology Research. 2016, 5 (2016).
- Zhang, B., Kumar, R. B., Dai, H., Feldman, B. J. A plasmonic chip for biomarker discovery and diagnosis of type 1 diabetes. Nature Medicine. 20 (8), 948-953 (2014).
- Tsai, C. T., Robinson, P. V., Spencer, C. A., Bertozzi, C. R. Ultrasensitive Antibody Detection by Agglutination-PCR (ADAP). American Chemical Society Central Science. 2 (3), 139-147 (2016).
- Yim, S. W., et al. Four-color alternating-laser excitation single-molecule fluorescence spectroscopy for next-generation biodetection assays. Clinical chemistry. 58 (4), 707-716 (2012).
- Bale, S. S., et al. A highly sensitive microsphere-based assay for early detection of Type I diabetes. Technology. 02 (03), 200-205 (2014).
- Ziegler, A. G., et al. 3 Screen ELISA for High-Throughput Detection of Beta Cell Autoantibodies in Capillary Blood. Diabetes Technology & Therapeutics. 18 (11), 687-693 (2016).
- Schlosser, M., et al. Diabetes Antibody Standardization Program: evaluation of assays for insulin autoantibodies. Diabetologia. 53 (12), 2611-2620 (2010).
- Zhao, Z., et al. A multiplex assay combining insulin, GAD, IA-2 and transglutaminase autoantibodies to facilitate screening for pre-type 1 diabetes and celiac disease. Journal of Immunological Methods. 430, 28-32 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。