Method Article
Um ensaio de eletroquimioluminescência de alto rendimento 7-plex rastreando simultaneamente diabetes tipo 1 e múltiplas doenças autoimunes
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Modelamos um ensaio de ECL multiplexado simples que combina 7 ensaios de autoanticorpos juntos. O ensaio é capaz de rastrear DM1 e várias outras doenças autoimunes, simultaneamente, incluindo doença celíaca, doença tireoidiana autoimune e síndrome poliglandular autoimune 1.
Resumo
Os autoanticorpos das ilhotas (IAbs) são amplamente utilizados no diagnóstico e predição do diabetes tipo 1 (DM1). Quatro IAbs principais para insulina (IAA), glutamato descarboxilase-65 (GADA), insulinoma antígeno-2 (IA-2A) e transportador de zinco-8 (ZnT8A) são igualmente importantes na predição da doença. Atualmente, até 40% dos pacientes diagnosticados com DM1 desenvolvem outros distúrbios autoimunes. Infelizmente, os métodos de triagem atuais que usam um único autoanticorpo para medição são trabalhosos e ineficientes para estudos de triagem em larga escala. Recentemente, desenvolvemos um ensaio simples de eletroquimioluminescência multiplexada (ECL) para abordar esses problemas atuais. O ensaio combina todos os 7 testes de autoanticorpos em um poço. Cada poço inclui três IAbs (IAA, GADA, e IA-2A), autoanticorpos para a peroxidase da tireoide (TPOA) e globulina tireoidiana (ThGA) para detectar doença autoimune da tireoide, autoanticorpos para transglutaminase tecidual (TGA) para doença celíaca e autoanticorpos para interferon alfa (IFNαA) para síndrome poliglandular autoimune-1 (APS-1); todos os quais rastreiam o DM1 e outras doenças autoimunes relevantes, simultaneamente. O ensaio de ECL multiplex é baseado na única plataforma de ensaio de ECL, mas em vez disso usa a placa multiplex combinando vários ensaios de autoanticorpos, até 10, em um único poço. A principal diferença em relação ao ensaio único de ECL é que cada complexo anticorpo-antígeno formado na fase fluida é contido em um ponto específico em cada poço através de um sistema de ligação na placa multiplex. O ensaio de ECL 7-Plex, no presente estudo, é validado em relação aos ensaios padrão de radioligação (RBA) e ensaios de ECL únicos, usando uma grande coorte de pacientes com DM1 recém-diagnosticados e controles saudáveis pareados por idade, resultando em excelente sensibilidade e especificidade do ensaio.
Introdução
O diabetes tipo 1 (DM1) é uma doença crônica grave que é mais comum na infância. Atualmente, cerca de 1,4 milhão de pessoas têm o DM1 nos Estados Unidos; surpreendentemente, a incidência de DM1 está aumentando constantemente a 3-5% a cada ano em todo o mundo e dobrou nas últimas duas décadas, especialmente em crianças pequenas 1,2. Os autoanticorpos das ilhotas (IAbs) na circulação sanguínea são o biomarcador mais confiável no momento. Os IAbs podem aparecer anos antes do desenvolvimento clínico do DM13. Atualmente, quatro IAbs principais são amplamente utilizados no diagnóstico de DM1 e triagem de risco, incluindo autoanticorpos contra insulina (IAA), glutamato descarboxilase-65 (GADA), insulinoma antígeno-2 (IA-2A) e transportador de zinco-8 (ZnT8A). Esses quatro IAbs são igualmente importantes na predição do desenvolvimento do DM1. A classificação do DM1 foi redefinida recentemente como a presença de ≥2 de quaisquer 4 IAbs com metabolismo normal da glicose como o estágio da doença 14.
No Diabetes Autoimmunity Study in the Young (DAISY), foi revelado que uma em cada quatro crianças em risco de DM1 provavelmente progrediria para autoimunidade de ilhotas, celíacas, tireoides ou reumatoides e, mais surpreendentemente, aproximadamente 40% dos pacientes que foram diagnosticados com DM1 eventualmente desenvolveram uma condição autoimune adicional 5,6,7 . A identificação de autoanticorpos é essencial para a predição e diagnóstico dessas doenças autoimunes e deve proporcionar um melhor atendimento clínico aos pacientes. Não há uma maneira fácil e barata no momento de rastrear essas múltiplas condições autoimunes. Os métodos de triagem atuais usando o ensaio de radioligação padrão (RBA), com uma única medida de autoanticorpos, são trabalhosos e ineficientes para uma triagem em larga escala.
Aqui, descreveremos o recém-desenvolvido ensaio de ECL multiplexado simples, que autenticamos usando uma única plataforma de ensaio de ECL 8,9,10,11. O ensaio de ECL multiplex combina 7 testes de autoanticorpos em um único poço, usando apenas 15 μL de soro, e é capaz de rastrear DM1 e múltiplas doenças autoimunes relevantes simultaneamente, incluindo doença celíaca, doença autoimune da tireoide e SAF-1. Um ensaio de ECL ZnT8A não havia sido desenvolvido na época e não foi incluído no ensaio multiplexado. O ensaio de ECL multiplex fornece uma excelente ferramenta para alto rendimento na triagem da população em geral para DM1 e múltiplas doenças autoimunes.
Protocolo
O protocolo de pesquisa foi aprovado pelo Colorado Multiple Institutional Review Board.
1. Preparação do tampão
- Faça o tampão de rotulagem (2x PBS, pH 7,9). Usando 400 mL de água destilada deionizada (DD), adicione 100 mL de 10x PBS. Para ajustar o pH da solução, adicione NaOH até atingir 7,9.
- Crie biotina de 3 mM dissolvendo 1 mg de biotina em 588 μL de tampão de marcação criado anteriormente. Faça 3 mM Ru Sulfo-NHS dissolvendo 150 nmol de Ru Sulfo-NHS em 50 μL de tampão de rotulagem.
- Fazer o tampão antigénio (1% BSA) tomando 500 ml de 1x PBS e adicionando 5 g de albumina sérica bovina (BSA) à solução. Preparar 0,5 M de solução de ácido acético. Prepare o tampão Tris-HCl de 1 M usando a Base Trizma e ajustando o pH para 9,0.
- Para o tampão de revestimento (Bloqueador A a 3%), tome 500 mL de PBS 1x e adicione 15 g de Bloqueador A. Prepare o tampão de lavagem (0,05% Tween 20, PBST) misturando 5000 mL de PBS 1x com 2,5 mL de Tween 20. Crie um buffer de leitura (2x Read Buffer T com surfactante) adicionando 500 mL de água DD e 500 mL de 4x Read Buffer T com surfactante.
NOTA: Para manter a consistência entre os ensaios, é importante que as soluções de biotina e Ru Sulfo-NHS sejam criadas imediatamente antes do procedimento de rotulagem e não sejam criadas e armazenadas para uso futuro.
2. Marcação de cada proteína antigénica com biotina e Ru Sulfo-NHS separadamente
NOTA: Para ter uma reação de marcação mais eficaz, use uma concentração de proteína de antígeno de ≥0,5 mg/mL.
- Calcule o número molar de cada proteína antigénica e os números molares da biotina e Ru Sulfo-NHS. Adicione uma quantidade adequada de biotina ou Ru Sulfo-NHS à proteína do antígeno para a reação de marcação de acordo com a proporção molar da proteína do antígeno para a biotina ou Ru Sulfo-NHS.
- Para o antígeno que tem o menor peso molecular (≤10 kDa), como a proteína proinsulina, use uma proporção molar de 1:5 (antígeno: biotina e Ru Sulfo-NHS). Para o antígeno que tem o maior peso molecular (>50 kDa), como a proteína GAD, use uma proporção molar de 1:20. Para o antígeno que tem um peso molecular médio (10-50 kDa), use uma razão molar ajustada entre 1:5-1:20.
- Tanto para a biotina quanto para o Ru Sulfo-NHS, divida o peso de cada antígeno por seus pesos moleculares correspondentes para obter o número molar do antígeno para cada um. Divida o número molar pela concentração para obter o volume de biotina. Repita isso para Ru Sulfo-NHS.
- Misturar a proteína antigénica com biotina utilizando a razão molar adequada, determinada no passo 2.2. Em seguida, faça o mesmo para Ru Sulfo-NHS.
NOTA: Para a eficiência da reação de rotulagem, quaisquer produtos químicos redutores como Tris ou glicina no sistema tampão precisam ser trocados por 2x tampão PBS, pH 7,9 pela coluna de rotação de dimensionamento. Os protocolos de rotulagem para biotina e Ru Sulfo-NHS são idênticos. - Cubra os tubos de reação com papel alumínio e incube-os à temperatura ambiente (RT) por 1 h. A razão que cobre os tubos de reação com papel alumínio é porque tanto a biotina quanto os reagentes Ru Sulfo-NHS são sensíveis à luz.
- Pressione a coluna de spin de 2 mL ou 5 mL enquanto os tubos de reação estão incubando (o tamanho da coluna de spin é determinado pelo volume carregado na coluna). Encha a coluna de rotação com 2x buffer PBS e, em seguida, centrifuga-a a 1.000 x g por 2 min de cada vez, para um total de três vezes.
- Pare a reação de marcação após os tubos de reação terem terminado de incubar. Para parar a reação, purifique a proteína do antígeno marcada, passando-a através da coluna de spin uma vez. Em seguida, centrifugar a coluna a 1.000 x g por 2 min.
- Calcular a concentração total de antígenos marcados dividindo a quantidade de proteína do antígeno presente pelo volume final. Aliquot 50 μL da proteína do antigénio marcada purificada por tubo e armazenar as alíquotas a -80 °C para utilização a longo prazo.
NOTA: É importante estar ciente de que, para cada vez que a coluna de spin passa a proteína do antígeno, haverá cerca de uma taxa de retenção de 90-95%.
3. Definir a melhor concentração e proporções para os dois antígenos marcados para o ensaio (ensaio quadriculado)
NOTA: Uma vez que o ensaio ECL-IAA neste ensaio 7-Plex requer tratamento ácido de amostras de soro, o ensaio quadriculado para cada antígeno deve passar por esta etapa antes de incubar com a mistura de antígeno marcada.
- Aplique o ensaio quadriculado para cada antígeno separadamente antes de executar o ensaio multiplex. As etapas 3.2-3.6 usarão o GAD65 como exemplo.
- Calcular a diluição da proteína GAD65 marcada. A concentração alvo recomendada da primeira solução de mistura de GAD65 biotinilado é de 2000 ng/mL e Ru Sulfo-NHS marcada com GAD65 é de 1000 ng/mL. Se a concentração de GAD65 biotinilado e marcado com Ru Sulfo-NHS em solução de estoque for de 1,0 μg/μL, o volume necessário para GAD65 biotinilado em 560 μL de solução de trabalho será de 1,12 μL e o volume necessário para Ru Sulfo-NHS rotulado GAD65 em 700 μL de solução de trabalho será de 0,7 μL.
- Misture 1,12 μL de proteína GAD65 biotinilada com 240 μL de ligante conjugado com estreptavidina 1 em um tubo e 160 μL de BSA a 1%. Incubar a mistura à temperatura ambiente durante 30 min. Adicionar 160 μL de solução de paragem ao tubo e incubar a mistura à temperatura ambiente durante mais 30 minutos.
- Faça uma diluição em série. Tomar 280 μL da mistura para um novo tubo e adicionar 280 μL de solução de paragem para fazer uma diluição de 1:2. Prepare vários tubos novos. Repita esta etapa para executar uma diluição serial horizontal para o antígeno GAD65 marcado com biotina (consulte a publicação anterior12).
- Misture 0,7 μL da proteína GAD65 (1 μg/μL) marcada com Ru Sulfo-NHS com 700 μL de solução stop. Em seguida, tome 350 μL da mistura para um novo tubo e adicione 350 μL de solução de parada para fazer uma diluição de 1:2. Prepare vários tubos novos, repita esta etapa para executar uma diluição serial vertical para o antígeno GAD65 marcado com Ru Sulfo-NHS.
- Preparar duas amostras de soro, uma amostra altamente positiva para GADA e uma amostra negativa para GADA, cada uma com um volume de 0,75 mL. Aliquota de 15 μL de soro positivo em cada poço na metade esquerda da placa de PCR de 96 poços. Aliquota de 15 μL de soro negativo em cada poço na metade direita da placa de PCR de 96 poços.
- Adicionar 18 μL de ácido acético 0,5 M em cada alvéolo e misturar. Incubar por 45 min no RT. Prepare uma nova placa de PCR de 96 poços. Adicionar 17,5 μL do antígeno marcado com biotina e 17,5 μL do antígeno marcado com Ru Sulfo-NHS em cada poço de acordo com as diluições seriadas (consulte a publicação anterior12).
- Continue o restante das etapas de ensaio descritas nas etapas 5.2 a 9.1.
- Determine a relação de sinal das amostras positivas altas contra os sinais de amostra negativos correspondentes. Selecione a melhor concentração para o antígeno marcado com biotina e o antígeno marcado com Ru Sulfo-NHS, identificando o ponto que tem a maior ou perto da maior proporção de sinal positivo para negativo. Neste cálculo da razão, considere o sinal de fundo baixo obtido a partir das amostras negativas.
NOTA: As concentrações óptimas de Ru Sulfo-NHS e proteínas antigénicas marcadas com biotina dos ensaios quadriculados são apresentadas abaixo: 30 ng/ml e 200 ng/ml para GAD65, 120 ng/ml e 120 ng/ml para proinsulina, 10 ng/ml e 42 ng/ml para IA-2, 80 ng/ml e 80 ng/ml para TG, 8 ng/ml e 16 ng/ml para TPO, 31 ng/mL e 31 ng/mL para ThG, e 12 ng/mL e 12 ng/mL para IFNα.
4. Criar a solução de antígeno acoplado ao ligador misto
- Selecione a concentração ideal para cada antígeno com base no ensaio quadriculado. Diluir a biotina e o antígeno marcado com Ru Sulfo-NHS para a concentração racional de trabalho.
- Ligue diferentes ligadores a cada uma das proteínas de antígeno exclusivamente biotiniladas. Para um ensaio de placa de 96 poços, misture 4 μL de proteína biotinilada GAD65, TPO, tTG, ThG, proinsulina, IFN-α e IA-2 com 240 μL de ligante conjugado com estreptavidina 1, 2, 3, 4, 8, 9 e 10 em tubo separado (Figura 1). Em seguida, adicione 156 μL de PBS/1% BSA por tubo. Incubar a mistura à temperatura ambiente durante 30 min.
- Adicionar 160 μL de solução de paragem em cada tubo e incubá-los à temperatura ambiente durante mais 30 minutos. Pegue 400 μL de antígeno acoplado ao ligador de cada tubo e combine todos os 7 antígenos juntos. Adicionar 1,2 mL de solução stop e, em seguida, adicionar 4 μL de Ru Sulfo-NHS marcado GAD65, TPO, tTG, ThG, proinsulina, IFN-α e antígeno IA-2 à mistura. Agora a solução de antígeno está pronta para ser usada no ensaio.
5. Incubar amostras de soro com o antigénio marcado
NOTA: Uma vez que o ensaio ECL-IAA neste ensaio 7-Plex requer tratamento ácido de amostras de soro, cada soro requer a etapa de tratamento ácido antes de incubar com mistura de antígeno marcada para este ensaio 7-Plex.
- Aliquota de 15 μL de soro por poço para uma placa de PCR de 96 poços. Adicionar 18 μL de ácido acético 0,5 M em cada alvéolo e misturar. Incubar por 45 min no RT. Prepare uma nova placa de PCR de 96 poços e alíquota de 35 μL de solução de antígeno em cada poço.
- Enquanto a placa ainda está incubando, adicione 13 μL de 1 M Tris pH 9,0 tampão a cada poço na placa de antígeno. Adicione tampão ao lado de cada poço para limitar a mistura de tampão Tris e antígeno. Após a conclusão da incubação, tome 25 μL do soro tratado com ácido e pipete-o imediatamente em cada poço na placa de antígeno. Agite a solução e cubra a placa com folha de vedação por PCR para evitar a exposição à luz.
- No RT, coloque a placa em um agitador, ajustado a uma velocidade baixa, por 1 h. Depois, conservar a placa a 4 °C e deixar incubar a placa durante 18-24 h.
6. Prepare a placa multiplex
- Pegue uma placa multiplex do refrigerador de 4 °C e deixe a placa chegar ao RT. Uma vez que a placa multiplex esteja em RT, adicione 150 μL de 3% de Bloqueador A a cada poço. Cubra a placa multiplex com folha de vedação. Incubar a placa num frigorífico a 4 °C durante a noite.
NOTA: O Dia de Ensaio 1 inclui as Etapas 4 a 6.
7. Transferir soro/antígeno incuba para a placa multiplex
- No dia seguinte, coloque toalhas de papel sobre a mesa e retire a placa multiplex de incubação da geladeira. Esvazie todo o buffer da placa. Para fazer isso, vire a placa de cabeça para baixo e bata-a nas toalhas de papel preparadas até que não haja tampão presente em nenhum dos poços.
- Lave a placa multiplex adicionando 150 μL de PBST em cada poço. Descarte o buffer, como mencionado na etapa 7.1., e repita essa etapa três vezes. Adicione 30 μL de incubados de soro/antígeno em cada poço na placa multiplex. Cubra a placa com papel alumínio para limitar sua exposição à luz. Coloque a placa sobre um agitador de placas, ajustado para uma velocidade baixa, a RT por 1 h.
8. Lave a placa e adicione o tampão de leitura
- Remova as incubações de soro/antígeno da placa multiplex, segurando a placa de cabeça para baixo e sacudindo a solução. Adicionar 150 μL de PBST em todos os poços e remover o tampão da placa, segurando novamente a placa de cabeça para baixo e sacudindo a solução. Repita esta etapa três vezes. Após a conclusão da terceira lavagem, adicione 150 μL de tampão de leitura em cada poço.
NOTA: As bolhas de ar interferem na capacidade da máquina leitora de placas de analisar com precisão os resultados da placa e devem ser evitadas a todo custo.
9. Leia a placa e analise os dados
- Conte a placa preparada na máquina leitora de placas, lendo todos os valores em contagens por segundo (CPS).
- Calcule o índice relativo para o ensaio, utilizando os níveis de anticorpos obtidos da máquina leitora de placas, com a seguinte equação:
Valor do índice = [CPS (amostra) - CPS (padrão negativo)] / [CPS (padrão positivo) - CPS (padrão negativo)]. - Determine quais resultados de anticorpos são negativos ou positivos usando os pontos de corte que foram estabelecidos.
NOTA: O Dia 2 do Ensaio inclui as Etapas 7 a 9.
Resultados
A análise dos resultados dos ensaios foi apresentada na Tabela 1, Tabela 2 e Tabela 3. Os valores de leitura vêm dos dados dos 10 pontos dentro do mesmo poço. Os valores do índice para cada amostra foram calculados em relação aos seus controles internos positivos e negativos correspondentes, conforme descrito no protocolo de ensaio. Exemplos de duplicatas incorretas são mostrados na Tabela 1 e causaram o erro de cálculo do índice final na Tabela 3. Todos os valores brutos de contagem devem ser verificados para evitar resultados falsos positivos ou falsos negativos.
O ensaio de ECL 7-multiplexado foi validado usando uma grande coorte de amostras de 1026 pacientes recém-diagnosticados com DM1 e 1022 indivíduos de controle saudáveis pareados por idade e sexo. Os níveis de autoanticorpos do ensaio 7-Plex ECL para 1026 pacientes com DM1 foram comparados com os níveis de cada um dos nossos ensaios de ECL únicos estabelecidos correspondentes, conforme mostrado na Figura 2 , e de cada RBA e ELISA padrão único, conforme mostrado na Figura 3. As especificidades do ensaio foram configuradas idênticas aos percentis 99 para todos os ensaios de autoanticorpos, exceto para os autoanticorpos da tireoide (ondeo percentil 95 foi usado), de 1022 controles saudáveis para todos os três métodos de ensaio (7-Plex ECL, ECL única, RBA ou ELISA), conforme listado na Tabela 4. Os CVs inter-ensaio de GADA, IA-2A, IAA, TPOA, ThGA, TGA e IFNαA são 6,4%, 4,5%, 9,1%, 4,9%, 5,7%, 11,3% e 5,9%, respectivamente.
Um pequeno número de amostras discordantes para cada um dos 7 autoanticorpos foi encontrado em torno da borda dos pontos de corte para cada ensaio (Figura 2 e Figura 3). Onze amostras de controle (11/1022, 1,1%) foram encontradas com múltiplos autoanticorpos positivos apenas no ensaio 7-Plex e negativos em cada ensaio único correspondente. Da mesma forma, ocorreu em 9 amostras de pacientes com DM1 (9/1026, 0,9%). Além disso, 10 TPOA positivos altos e um ThGA na coorte de pacientes que foram observados tanto no ensaio de ECL único quanto no RBA foram perdidos no ensaio 7-Plex. Essas amostras foram convertidas positivamente no ensaio 7-Plex quando foram diluídas. Em geral, 100% da positividade no ensaio de ECL único ou RBA foram cobertos no ensaio de ECL 7-Plex, com a mesma especificidade do ensaio ilustrada na Tabela 4.
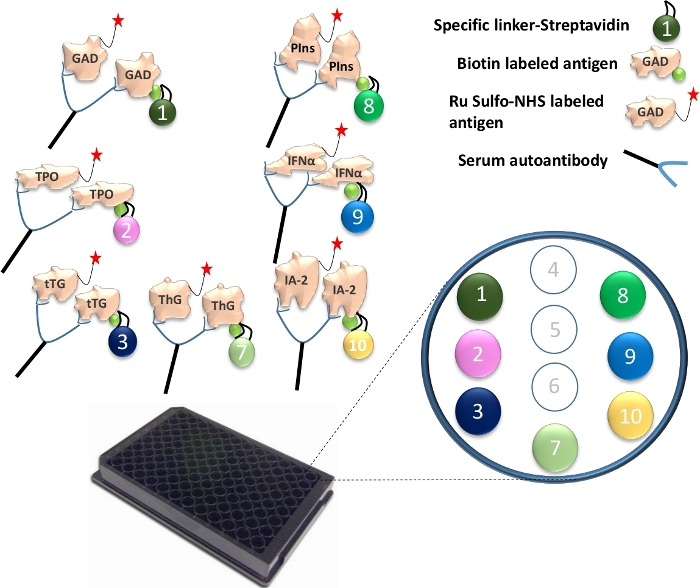
Figura 1: Ilustração do ensaio Mutiplex ECL.
Os autoanticorpos no soro farão a ponte entre o antígeno Ru Sulfo-NHSged e o antígeno biotinilado. Isso é acoplado a um ligador específico para formar um complexo de antígeno-anticorpo-antígeno-ligador. Os complexos são capturados na placa e são contidos em seus pontos específicos através de cada ligador específico. Os números do ligador especificamente acoplados, para as 7 diferentes proteínas do antígeno, são ilustrados. A detecção de sinais de anticorpos é realizada usando antígenos marcados com Ru Sulfo-NHS com eletroquimioluminescência. A figura é de Gu, Y. et al.13. Por favor, clique aqui para ver uma versão maior desta figura.
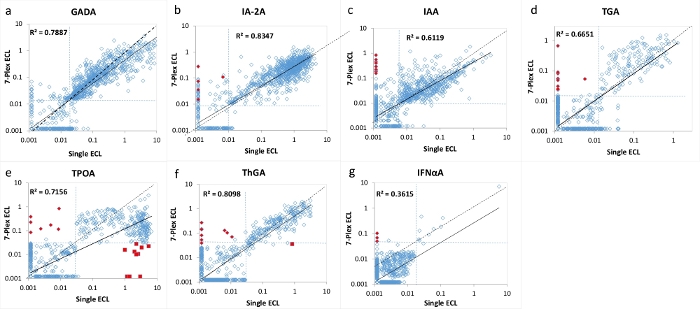
Figura 2: Comparação de 7 níveis de autoanticorpos em 1026 pacientes de início recente com DM1 entre o ensaio de ECL único e o ensaio de ECL 7-Plex.
Os painéis a, b, c, d, e, f e g exibem comparações dos níveis de autoanticorpos para GADA, IA-2A, IAA, TGA, TPOA, ThGA e IFNαA, respectivamente. As linhas pontilhadas representam os pontos de corte do ensaio para cada ensaio de autoanticorpos. Os pontos de corte foram ajustados para o percentil 99 de 1022 controles saudáveis pareados por idade para cada ensaio (exceto TPOA e ThGA, que foram ajustados para opercentil 95), como mostrado na Tabela 4, a partir de 1022 controles saudáveis pareados por idade para ensaios de ECL simples e múltiplos. Os diamantes vermelhos fechados são marcados como "falsos" positivos no ensaio de ECL 7-Plex, <1% da coorte estudada, e foram validados como negativos tanto na ECL única quanto na RBA. Os quadrados próximos vermelhos são marcados como 'falsos' negativos no ensaio de ECL 7-Plex causado pelo fenômeno 'prozona', ocorrendo principalmente no ensaio TPOA em <1% da coorte estudada. Ambos os resultados falsos positivos e falsos negativos são discutidos na seção de discussão. A figura é de Gu, Y. et al.13. Por favor, clique aqui para ver uma versão maior desta figura.
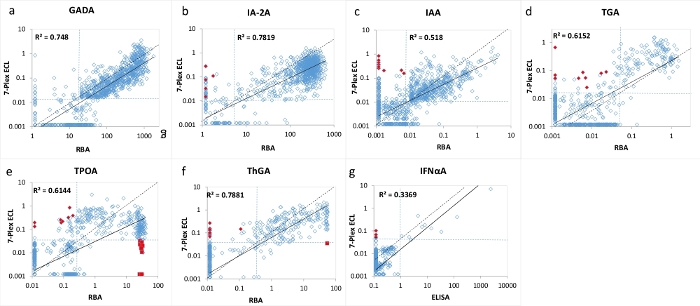
Figura 3: Comparação de 7 níveis de autoanticorpos em 1026 pacientes de início recente com DM1 entre o RBA (ELISA para IFNαA) e o ensaio 7-Plex ECL.
Os painéis a, b, c, d, e, f e g apresentam comparações dos níveis de autoanticorpos para GADA, IA-2A, IAA, TGA, TPOA, ThGA e IFNαA, respectivamente. As linhas pontilhadas representam os pontos de corte do ensaio para cada ensaio de autoanticorpos, a mesma especificidade definida para a RBA e o ensaio de ECL 7-Plex, como mostrado na Tabela 4, a partir de controles saudáveis pareados por 1022 anos. Diamantes e quadrados vermelhos fechados representam "falsos" positivos e "falsos" negativos que aparecem no ensaio ECL 7-Plex, o mesmo é mostrado na Figura 2. A figura é de Gu, Y. et al.13. Por favor, clique aqui para ver uma versão maior desta figura.
| 1 | 2 | 3 | 4 | 5 | 6 | ||
| Um | 5580 | 5674 | 105 | 117 | 125 | 139 | vinculador-1 |
| 100 | 108 | 102 | 102 | 3956 | 3745 | vinculador-2 | |
| 115 | 124 | 107 | 116 | 113 | 124 | vinculador-3 | |
| 67 | 64 | 68 | 61 | 65 | 69 | vinculador-4 | |
| 89 | 87 | 98 | 92 | 90 | 80 | vinculador-5 | |
| 87 | 71 | 89 | 87 | 61 | 72 | vinculador-6 | |
| 94 | 82 | 79 | 85 | 2154 | 2280 | vinculador-7 | |
| 75 | 66 | 1628 | 1594 | 81 | 83 | vinculador-8 | |
| 98 | 103 | 71 | 84 | 69 | 85 | vinculador-9 | |
| 102 | 118 | 93 | 98 | 113 | 99 | vinculador-10 | |
| B | 324 | 337 | 147 | 148 | 5426 | 5366 | vinculador-1 |
| 101 | 102 | 93 | 88 | 86 | 74 | vinculador-2 | |
| 111 | 119 | 119 | 123 | 66 | 72 | vinculador-3 | |
| 72 | 65 | 59 | 68 | 74 | 67 | vinculador-4 | |
| 81 | 98 | 83 | 92 | 79 | 72 | vinculador-5 | |
| 90 | 84 | 93 | 86 | 70 | 76 | vinculador-6 | |
| 101 | 105 | 101 | 97 | 956 | 944 | vinculador-7 | |
| 82 | 83 | 189 | 204 | 97 | 90 | vinculador-8 | |
| 92 | 83 | 78 | 64 | 82 | 78 | vinculador-9 | |
| 83 | 79 | 88 | 93 | 4722 | 4965 | vinculador-10 | |
| C | 110 | 110 | 87 | 81 | 2114 | 2365 | vinculador-1 |
| 5526 | 5680 | 88 | 70 | 86 | 93 | vinculador-2 | |
| 114 | 132 | 67 | 71 | 3326 | 3284 | vinculador-3 | |
| 64 | 62 | 88 | 74 | 64 | 80 | vinculador-4 | |
| 94 | 82 | 86 | 75 | 89 | 76 | vinculador-5 | |
| 77 | 87 | 75 | 63 | 70 | 86 | vinculador-6 | |
| 77 | 86 | 71 | 84 | 138 | 121 | vinculador-7 | |
| 73 | 86 | 80 | 79 | 59 | 73 | vinculador-8 | |
| 86 | 74 | 5064 | 4923 | 88 | 86 | vinculador-9 | |
| 105 | 113 | 85 | 80 | 124 | 114 | vinculador-10 | |
| D | 98 | 88 | 92 | 84 | 136 | 127 | vinculador-1 |
| 288 | 291 | 86 | 86 | 558 | 564 | vinculador-2 | |
| 109 | 101 | 74 | 73 | 141 | 127 | vinculador-3 | |
| 78 | 66 | 66 | 55 | 74 | 66 | vinculador-4 | |
| 79 | 83 | 79 | 86 | 96 | 91 | vinculador-5 | |
| 83 | 86 | 96 | 89 | 86 | 73 | vinculador-6 | |
| 87 | 89 | 77 | 87 | 841 | 855 | vinculador-7 | |
| 74 | 72 | 60 | 72 | 90 | 95 | vinculador-8 | |
| 68 | 75 | 331 | 328 | 2460 | 2580 | vinculador-9 | |
| 86 | 98 | 80 | 75 | 123 | 133 | vinculador-10 | |
| E | 101 | 114 | 101 | 106 | 532 | 548 | vinculador-1 |
| 101 | 96 | 110 | 104 | 682 | 675 | vinculador-2 | |
| 6015 | 5988 | 124 | 126 | 101 | 98 | vinculador-3 | |
| 66 | 71 | 82 | 71 | 80 | 62 | vinculador-4 | |
| 102 | 97 | 99 | 80 | 83 | 110 | vinculador-5 | |
| 82 | 67 | 81 | 80 | 60 | 85 | vinculador-6 | |
| 85 | 95 | 52 | 84 | 245 | 221 | vinculador-7 | |
| 72 | 78 | 82 | 74 | 486 | 503 | vinculador-8 | |
| 77 | 97 | 97 | 77 | 56 | 66 | vinculador-9 | |
| 114 | 104 | 5726 | 5814 | 259 | 253 | vinculador-10 | |
| F | 119 | 120 | 133 | 118 | 112 | 96 | vinculador-1 |
| 101 | 91 | 100 | 95 | 96 | 82 | vinculador-2 | |
| 406 | 395 | 111 | 123 | 2127 | 101 | vinculador-3 | |
| 72 | 60 | 86 | 72 | 79 | 83 | vinculador-4 | |
| 76 | 85 | 96 | 99 | 89 | 103 | vinculador-5 | |
| 88 | 78 | 91 | 83 | 89 | 95 | vinculador-6 | |
| 104 | 97 | 87 | 102 | 56 | 66 | vinculador-7 | |
| 76 | 77 | 79 | 93 | 69 | 75 | vinculador-8 | |
| 85 | 71 | 95 | 100 | 83 | 71 | vinculador-9 | |
| 131 | 131 | 358 | 364 | 92 | 86 | vinculador-10 | |
| G | 90 | 95 | 85 | 82 | 105 | 107 | vinculador-1 |
| 99 | 86 | 77 | 76 | 1250 | 1174 | vinculador-2 | |
| 119 | 123 | 120 | 118 | 112 | 108 | vinculador-3 | |
| 76 | 83 | 77 | 80 | 86 | 76 | vinculador-4 | |
| 88 | 86 | 86 | 93 | 107 | 92 | vinculador-5 | |
| 73 | 73 | 71 | 82 | 84 | 75 | vinculador-6 | |
| 5210 | 5173 | 72 | 69 | 76 | 85 | vinculador-7 | |
| 80 | 81 | 79 | 82 | 100 | 101 | vinculador-8 | |
| 96 | 97 | 89 | 83 | 65 | 83 | vinculador-9 | |
| 98 | 103 | 86 | 88 | 1933 | 1979 | vinculador-10 | |
| H | 114 | 124 | 81 | 86 | 299 | 295 | vinculador-1 |
| 107 | 92 | 69 | 72 | 4256 | 4388 | vinculador-2 | |
| 114 | 123 | 125 | 129 | 501 | 536 | vinculador-3 | |
| 77 | 70 | 67 | 64 | 74 | 62 | vinculador-4 | |
| 92 | 110 | 81 | 84 | 77 | 71 | vinculador-5 | |
| 87 | 79 | 72 | 76 | 83 | 81 | vinculador-6 | |
| 328 | 341 | 84 | 80 | 88 | 97 | vinculador-7 | |
| 75 | 84 | 75 | 90 | 74 | 83 | vinculador-8 | |
| 73 | 79 | 78 | 76 | 84 | 70 | vinculador-9 | |
| 113 | 120 | 81 | 76 | 2372 | 2350 | vinculador-10 | |
Tabela 1: Análise do ensaio de ECL de 7 plexos: contagens brutas de CPS (metade esquerda da placa). As contagens brutas de CPS são adquiridas a partir de uma placa de ensaio (a metade esquerda da placa) e cada amostra é realizada em duplicata. Sob cada linha da placa (A-H), há 10 linhas de valores de leitura representando os dados dos 10 pontos dentro do mesmo poço, correspondendo a cada número de vinculador conforme marcado. Exemplos de duplicatas incorretas são destacados em cinza, como visto na linha F-linker 3-colunas 5 e 6.
| Linha da Tabela 1A | Coluna da Tabela 1A | vinculador 1 | vinculador 2 | vinculador 3 | vinculador 7 | vinculador 8 | vinculador 9 | vinculador 10 | |
| Um | 1-2 | GADA PC | 5627 | 104 | 120 | 88 | 71 | 101 | 110 |
| B | 1-2 | GADA Baixo PC | 331 | 102 | 115 | 103 | 83 | 88 | 81 |
| C | 1-2 | TPOA PC | 110 | 5603 | 123 | 82 | 80 | 80 | 109 |
| D | 1-2 | TPOA Baixo PC | 93 | 290 | 105 | 88 | 73 | 72 | 92 |
| E | 1-2 | TGA PC | 108 | 99 | 6002 | 90 | 75 | 87 | 109 |
| F | 1-2 | TG Baixo PC | 120 | 96 | 401 | 101 | 77 | 78 | 131 |
| G | 1-2 | ThGA PC | 93 | 93 | 121 | 5192 | 81 | 97 | 101 |
| H | 1-2 | ThGA PC baixo | 119 | 100 | 119 | 335 | 80 | 76 | 117 |
| Um | 3-4 | IAA PC | 111 | 102 | 112 | 82 | 1611 | 78 | 96 |
| B | 3-4 | IAA Baixo PC | 148 | 91 | 121 | 99 | 197 | 71 | 91 |
| C | 3-4 | IFNaA PC | 84 | 79 | 69 | 78 | 80 | 4994 | 83 |
| D | 3-4 | IFNaA Baixo PC | 88 | 86 | 74 | 82 | 66 | 330 | 78 |
| E | 3-4 | Computador IA-2A | 104 | 107 | 125 | 68 | 78 | 87 | 5770 |
| F | 3-4 | IA-2A Baixo PC | 126 | 98 | 117 | 95 | 86 | 98 | 361 |
| G | 3-4 | NC | 84 | 77 | 119 | 71 | 81 | 86 | 87 |
| H | 3-4 | NC | 84 | 71 | 127 | 82 | 78 | 77 | 79 |
| Um | 5-6 | amostra1 | 132 | 3851 | 119 | 2217 | 82 | 77 | 106 |
| B | 5-6 | amostra2 | 5396 | 80 | 69 | 950 | 94 | 80 | 4844 |
| C | 5-6 | amostra3 | 2240 | 90 | 3305 | 130 | 66 | 87 | 119 |
| D | 5-6 | amostra4 | 132 | 561 | 134 | 848 | 93 | 2520 | 128 |
| E | 5-6 | amostra5 | 540 | 679 | 100 | 233 | 495 | 61 | 256 |
| F | 5-6 | amostra6 | 104 | 89 | 1114 | 61 | 72 | 77 | 89 |
| G | 5-6 | amostra7 | 106 | 1212 | 110 | 81 | 101 | 74 | 1957 |
| H | 5-6 | amostra8 | 297 | 4322 | 519 | 93 | 79 | 77 | 2361 |
Tabela 2: Análise do ensaio de ECL de 7 plexos: disposição dos dados da Tabela 1, marcados como 7 ligadores. Os dados da Tabela 1 foram reorganizados, sendo excluídos os vinculadores 4 a 6 (não utilizados), e os valores médios foram calculados a partir de cada leitura duplicada da Tabela 1. Os valores dos controles positivos altos e baixos de padrão interno, correspondentes a cada ensaio de autoanticorpos, contidos por um determinado ligador, estão em negrito escuro. PC, controle positivo. NC, controle normal.
| Índice GAD | TPOA-Índice | Índice TGA | ThGA-Índice | IAA-Índice | IFNaA-Índice | Índice IA-2A | |
| GADA PC | 1.000 | 0.005 | 0.000 | 0.003 | -0.006 | 0.003 | 0.004 |
| GADA Baixo PC | 0.045 | 0.005 | -0.001 | 0.006 | 0.002 | 0.000 | -0.001 |
| IAA PC | 0.005 | 1.000 | 0.001 | 0.002 | -0.001 | -0.001 | 0.004 |
| IAA Baixo PC | 0.002 | 0.039 | -0.002 | 0.003 | -0.005 | -0.003 | 0.001 |
| Computador IA-2A | 0.004 | 0.004 | 1.000 | 0.004 | -0.004 | 0.000 | 0.004 |
| IA-2A Baixo PC | 0.007 | 0.004 | 0.048 | 0.006 | -0.002 | -0.002 | 0.008 |
| TGA PC | 0.002 | 0.003 | 0.000 | 1.000 | 0.000 | 0.002 | 0.002 |
| TG Baixo PC | 0.006 | 0.004 | 0.000 | 0.052 | -0.001 | -0.002 | 0.005 |
| TPOA PC | 0.005 | 0.005 | -0.001 | 0.002 | 1.000 | -0.002 | 0.001 |
| TPOA Baixo PC | 0.012 | 0.003 | 0.000 | 0.006 | 0.076 | -0.003 | 0.001 |
| ThGA PC | 0.000 | 0.000 | -0.008 | 0.001 | 0.000 | 1.000 | -0.001 |
| ThGA PC baixo | 0.001 | 0.002 | -0.008 | 0.002 | -0.009 | 0.050 | -0.002 |
| IFNaA PC | 0.004 | 0.006 | 0.001 | 0.000 | -0.002 | 0.000 | 1.000 |
| IFNaA Baixo PC | 0.008 | 0.004 | 0.000 | 0.005 | 0.004 | 0.002 | 0.048 |
| NC | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| NC | 0.000 | -0.001 | 0.001 | 0.002 | -0.002 | -0.002 | -0.001 |
| amostra1 | 0.009 | 0.683 | 0.000 | 0.419 | 0.001 | -0.002 | 0.003 |
| amostra2 | 0.958 | 0.001 | -0.008 | 0.172 | 0.009 | -0.001 | 0.837 |
| amostra3 | 0.389 | 0.002 | 0.542 | 0.012 | -0.009 | 0.000 | 0.006 |
| amostra4 | 0.009 | 0.088 | 0.003 | 0.152 | 0.008 | 0.496 | 0.007 |
| amostra5 | 0.082 | 0.109 | -0.003 | 0.032 | 0.271 | -0.005 | 0.030 |
| amostra6 | 0.004 | 0.002 | 0.169 | -0.002 | -0.006 | -0.002 | 0.000 |
| amostra7 | 0.004 | 0.205 | -0.002 | 0.002 | 0.013 | -0.002 | 0.329 |
| amostra8 | 0.039 | 0.768 | 0.068 | 0.004 | -0.001 | -0.002 | 0.400 |
Tabela 3: Análise do ensaio de ECL de 7 plexos: resultados dos valores do índice. Os valores do índice para cada amostra para todos os 7 ensaios de autoanticorpos foram calculados em relação aos seus controles internos positivos e negativos correspondentes, conforme descrito no protocolo de ensaio. Qualquer valor de índice maior que o valor de corte foi definido como um resultado positivo, mostrado em negrito escuro. O valor do índice TGA da amostra6 foi destacado em cinza, pois é um erro causado por duplicatas incorretas mostradas na linha F-linker 3-colunas 5 e 6 da Tabela 1.
| GADA | IA-2A | IAA | .TGA | TPOA | ThGA | IFNαA* | ||||||||
| Sens | Especificação | Sens | Especificação | Sens | Especificação | Sens | Especificação | Sens | Especificação | Sens | Especificação | Sens | Especificação | |
| RBA | 73.4% | 98.5% | 75.2% | 99.0% | 47.7% | 99.1% | 12.9% | 99.0% | 23.9% | 95.2% | 19.3% | 94.7% | 1.0% | 99.6% |
| Único ECL | 71.6% | 99.1% | 73.6% | 99.3% | 48.3% | 99.7% | 16.0% | 98.9% | 26.3% | 94.9% | 20.6% | 95.1% | 0.8% | 99.2% |
| ECL 7-Plex | 71.2% | 98.9% | 77.3% | 98.9% | 49.5% | 98.9% | 16.5% | 98.7% | 26.1% | 94.7% | 21.1% | 94.7% | 1.7% | 99.1% |
Tabela 4: Sensibilidade e especificidade do ensaio entre 1026 pacientes com DM1 e 1022 controles, pareados para idade e sexo, em um ensaio de ECL de 7 plexos, em comparação com o ensaio de ECL único correspondente e RBA ou ELISA*. Three diferentes ensaios (RBA, ECL único e 7-Plex ECL) para cada autoanticorpo foram ajustados para especificidades semelhantes usando os controles saudáveis pareados por idade e sexo 1022. O desfecho de especificidade da coorte controle estudada foi estabelecido em torno de 95% para TPOA e ThGA e em 99% para os outros 5 ensaios. *Asterisk marca o ensaio IFNαA para ELISA, enquanto outros são RBA.
Discussão
Em numerosos ensaios clínicos nacionais e internacionais para diabetes tipo 1, o desempenho do ensaio único de ECL para detectar autoanticorpos de ilhotas e autoanticorpos para transglutaminase (TGA) para doença celíaca tem sido comprovado 8,9,10,11. Ao longo dessas trilhas, este ensaio aumentou a sensibilidade e a especificidade para a detecção de autoantígenos quando avaliado em relação ao RBA padrão 'ouro' existente. A especificidade aumentada da doença pode ser observada quando se discriminam autoanticorpos de ilhotas de alta afinidade e alto risco de sinais de baixo risco e baixa afinidade, entre o ensaio de ECL único e a RBA14,15,16,17. Com base no único ensaio de ECL, apresentamos um novo ensaio de autoanticorpos de ECL multiplexado de alto rendimento, para nos permitir rastrear o DM1, bem como várias doenças autoimunes aplicáveis ao mesmo tempo.
O ensaio de ECL multiplex usa a placa multiplex, que pode combinar até 10 ensaios de autoanticorpos em um único poço. Para o presente estudo, 7 ensaios de autoanticorpos são combinados. Os autoanticorpos compreendem 3 IAbs (IAA, GADA, e IA-2A), 2 autoanticorpos autoimunes da doença tireoidiana (TPOA e ThGA), autoanticorpos da doença celíaca (TGA) e autoanticorpos APS-1 para interferon alfa (IFNαA). O mecanismo de ensaio é, em geral, baseado em um único ensaio de ECL como publicado anteriormente 9,10,12,18 com algumas modificações. A principal diferença de um ensaio de ECL multiplex de um único ensaio de ECL é que cada complexo anticorpo-antígeno formado na fase fluida é restrito a um ligador específico (Figura 1). O antígeno marcado com biotina é incubado com a estreptavidina conjugada, um ligador usado para formar um complexo específico antígeno-ligador. O complexo imune anticorpo-antígeno se forma após a incubação com soro do paciente e é capturado em um local específico através do sistema ligador específico em cada poço da placa multiplex. O antígeno marcado com Ru Sulfo-NHS capturado por anticorpos ao mesmo tempo fornece o sinal com eletroquimioluminescência. A máquina leitora de placas pode detectar até 10 sinais diferentes das fontes pontuais localizadas em cada poço. Para manter os ensaios de autoanticorpos consistentes entre as placas e durante a realização de estudos de longo prazo, sugerimos que o mesmo ligador seja usado.
Antes de configurar um ensaio de ECL multiplex, os ensaios de ECL único para cada autoanticorpo precisam ser otimizados em uma placa multiplex, respectivamente, e validados em relação aos ensaios de RBA e ECL único em uma placa ECL regular. Para aprimorar o ensaio quadriculado, para o ensaio de autoanticorpos relacionados na placa multiplex, um paciente positivo alto e uma amostra de paciente negativa foram usados. Após a realização do ensaio quadriculado, as concentrações mais ideais para o antígeno marcado com Ru Sulfo-NHS e biotina foram calculadas para cada um dos 7 ensaios de autoanticorpos. Apresentam-se estas concentrações: 30 ng/ml e 200 ng/ml para GAD65, 120 ng/ml e 120 ng/ml para proinsulina, 10 ng/ml e 42 ng/ml para IA-2, 80 ng/ml e 80 ng/ml para TG, 8 ng/ml e 16 ng/ml para TPO, 31 ng/ml e 31 ng/ml para ThG, 31 ng/ml para ThG, e 12 ng/mL e 12 ng/mL, respectivamente, para IFNα13. As concentrações de alguns dos antígenos do ensaio quadriculado podem precisar ser ajustadas de acordo com os resultados no ensaio multiplex real depois de combinar todos os ensaios.
Como o IAA está incluído no presente ensaio de ECL multiplex, o tratamento ácido de amostras de soro é obrigatório antes da incubação do soro com antígeno, conforme relatado no estudo anterior12. Geralmente, quando um autoanticorpo extra é adicionado a um ensaio multiplex, o fundo do ensaio é afetado e um sinal extremamente alto de um ponto, no poço, pode obstruir os resultados de pontos próximos via crosstalk. Portanto, o CPS máximo precisa ser limitado a 20.000 contagens para cada autoanticorpo, ou menos, para as amostras positivas mais altas. Do nosso conhecimento, a fim de reduzir a quantidade de crosstalk envolvido, os autoanticorpos que têm um fundo inferior devem ser separados, ao projetar o mapa de pontos, longe de pontos com maior frequência de contagens.
Controles positivos e negativos altos foram usados internamente em cada ensaio para calcular um índice preciso para as amostras desconhecidas que estavam sendo testadas. Para avaliar e monitorar com precisão a sensibilidade do ensaio, foram utilizados controles positivos baixos, ajustados perto do limite superior do ensaio. Esses controles positivos e negativos padrão foram criados a granel e alíquota para uso a longo prazo e armazenados a -20 °C ou menos, para consistência entre os ensaios. Para fins de garantia de qualidade, as amostras foram executadas duas vezes em cada ensaio e cada resultado positivo foi repetido e confirmado pela execução da amostra em um novo ensaio de ECL no dia seguinte. Se houvesse alguma discordância com o primeiro e o segundo ensaio confirmatório, um terceiro ensaio era necessário. Dos três ensaios realizados, os resultados dos dois ensaios que concordam (por exemplo, +, + ou -,-), determinaram o resultado final (positivo ou negativo) da amostra.
Na última década, muitos grupos de estudo estão buscando um ensaio de alto rendimento utilizando o método multiplex para combinar vários ensaios de autoanticorpos juntos em um poço para rastrear grandes populações. Existem alguns estudos que estão utilizando diferentes tipos de tecnologias para realizar ensaios de autoanticorpos multiplex 19,20,21,22, mas não há comparação para nenhum desses ensaios em sensibilidade e especificidade com o atual padrão 'ouro' RBA, quando se estuda DM1. Esses diferentes tipos de plataformas usadas não são validados através do workshop internacional Islet Autoantibody Standardization Program (IASP) ou através do teste de grandes coortes em ensaios clínicos. Em uma recente triagem geral de base populacional na Alemanha, um ensaio combinado de alto rendimento, 3 Screen ICATM ELISA distribuído pela Kronus, está sendo usado como uma ferramenta para triagem de primeira linha para detectar três IAbs, GADA, IA-2A e ZnT8A, para alcançar o diagnóstico precoce de DM1infantil 23. O ensaio ELISA de 3 telas mede 3 autoanticorpos em 3 poços separados, consumindo um grande volume de soro, ou em um único poço com todos os 3 ensaios misturados. Se um poço no ensaio ELISA de 3 telas for positivo, não será possível distinguir qual dos três autoanticorpos está presente. A maior desvantagem deste ensaio é a sua incapacidade de incluir a medição IAA. Todos os resultados do IAA realizados pelo ELISA, comprovados em oficinas do IASP, não apresentam sensibilidade e especificidade aceitáveis24. IAA é geralmente o primeiro IAb a aparecer e tem uma alta prevalência entre crianças pequenas. O rastreamento de IAb, com IAA, é necessário para crianças e não é considerado aceitável realizar esse rastreamento sem IAA para avaliar o risco de DM1 na comunidade. Além disso, não há estudos ou dados publicados que mostrem o ensaio do kit Kronus IAb como sendo mais específico da doença T1D e capaz de discriminar IAbs de alto risco de baixo risco. O ensaio de ECL 7-Plex, no presente estudo, foi validado por meio de uma grande coorte de pacientes recém-diagnosticados comDM13 13. Em comparação com o RBA padrão atual e o ensaio de ECL único bem estabelecido, o ensaio 7-Plex é capaz de reter 100% de positividade com a mesma especificidade do ensaio (Tabela 4). Atualmente, o ensaio de ECL 4-Plex, paralelo com o RBA padrão, está sendo aplicado a um grande ensaio clínico em andamento: o estudo Autoimmunity Screening for Kids (ASK). Este estudo rastreia crianças na população em geral, da área metropolitana de Denver, para DM1 e doença celíaca. Em comparação com a RBA padrão usada no estudo ASK, o ensaio de ECL multiplex está mostrando excelente sensibilidade e uma maior especificidade da doença, idêntica aos nossos relatórios anteriores usando o estudo único ECL25. Além disso, nosso ensaio de ECL 4-Plex demonstrou uma redução pronunciada no trabalho de parto, custo e volume sérico em 70%, em comparação com os 4 ensaios únicos correspondentes para ECL e RBA. Usando o ensaio de ECL multiplexado, podemos personalizar cada poço com números diferentes, representando diferentes autoanticorpos (até 10), para testar diferentes doenças autoimunes que são específicas para as necessidades de um determinado local clínico.
Existem algumas limitações observadas, mostradas no presente estudo, para um ensaio de ECL multiplexada utilizando a placa multiplex. A diluição final do soro, incubada com antígeno, não pode ser ajustada para produzir as condições mais ideais para cada ensaio de autoanticorpos que é combinado em um único poço. Nove amostras (9/1026), de pacientes com DM1, apresentaram um resultado falso negativo para determinados autoanticorpos. Dos falsos negativos, 7 foram para TPOA e 2 para ThGA, no ensaio de 7-Plex ECL, mas resultados positivos elevados foram exibidos tanto no ensaio de ECL único quanto no RBA (Figuras 2 e 3). Após posterior diluição de todas as 9 amostras, elas se tornaram positivas na placa multiplex. Esse resultado é causado pelo que descrevemos como o fenômeno da "prozona". Esse fenômeno faz com que a amostra apresente um resultado falso negativo porque os altos títulos de anticorpos estão afetando a formação de redes antígeno-anticorpo. Ao configurar um ensaio multiplex, recomenda-se que as amostras com títulos muito elevados, para cada um dos autoanticorpos combinados, tenham pré-testes executados para identificar a diluição opcional do soro para incubação de antígenos. Alternativamente, ensaios de autoanticorpos com condições otimizadas semelhantes devem ser selecionados para formar um ensaio combinado a partir do qual a melhor sensibilidade e especificidade do ensaio é alcançada para cada autoanticorpo. No presente estudo, 7 amostras (7/1022), de controles normais saudáveis, resultaram em falsos positivos para múltiplos autoanticorpos no ensaio 7-Plex, mas após a execução de um único ensaio de ECL e RBA (Figura 2 e 3) esses autoanticorpos foram considerados negativos em ambos os ensaios. As razões por trás desses resultados falso-positivos que ocorrem na placa multiplex, para esse pequeno subconjunto de amostras, são atualmente desconhecidas. Para a aplicação atual do ensaio de ECL multiplex, todas as amostras positivas são repetidas com seu ensaio de ECL único correspondente para confirmar a positividade, o que remove esse erro falso positivo do ensaio de ECL multiplex.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo NIH grant DK32083, JDRF Grants 2-SRA-2015-51-Q-R e 2-SRA-2018-533-S-B.
Materiais
| Name | Company | Catalog Number | Comments |
| 4 °C refrigerator | |||
| –80 °C and -20 °C freezers | |||
| 96-well Plate Shaker | Wallac - Delfi | ||
| 96-well round bottom plate | Fisher | 8408220 | |
| Acetic acid solution | Fisher | ||
| Aluminum foil | |||
| Antigen proteins | |||
| Human GAD65 full length protein | Diamyd | ||
| Human ThG full length protein | BioMart | ||
| Human TPO full length protein | BioMart | ||
| IA-2 intracellular domain protein | BioMart | ||
| IFN-α protein | Abcam | ||
| Proinsulin protein | AmideBio | ||
| tTG protein | DiaRect | ||
| Biotin | Sigma | ||
| Bottle-Top 500 mL , Filter Units | Fisher | 0974064A or B | |
| Bovine Serum Albumin | Sigma | A-7906 | |
| Distilled deionized (DD) water | |||
| HCl | Fisher | ||
| Ice maker | |||
| Ice trays | |||
| MSD Sector | Perkin-Elmer | ||
| Multi-channel pipette | |||
| NaOH | |||
| Paper tower | |||
| PBS | |||
| pH meter | |||
| Pipette-Aid | |||
| Pipettes/tips | |||
| Ru Sulfo-NHS | MSD (R91AN) | ||
| Trizma Base | Fisher | BP152-5 | |
| Tween 20 | Sigma | P-1379 | |
| Uplex Development Kit | MSD | ||
| 96-well UPlex plate | MSD | ||
| Blocker A | MSD | R93AA | |
| Linker-Streptavidin | MSD | ||
| Read buffer | MSD | R92TC | |
| Stop Solution | MSD | ||
| Vortex mixer | |||
| ZeBa Column | Pierce | 89892 |
Referências
- Harjutsalo, V., Sjoberg, L., Tuomilehto, J. Time trends in the incidence of type 1 diabetes in Finnish children: a cohort study. Lancet. 371 (9626), 1777-1782 (2008).
- Vehik, K., et al. Increasing incidence of type 1 diabetes in 0- to 17-year-old Colorado youth. Diabetes Care. 30 (3), 503-509 (2007).
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Insel, R. A., et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 38 (10), 1964-1974 (2015).
- Barker, J. M., et al. Autoantibody "subspecificity" in type 1 diabetes: risk for organ-specific autoimmunity clusters in distinct groups. Diabetes Care. 28 (4), 850-855 (2005).
- Triolo, T. M., et al. Additional Autoimmune Disease Found in 33% of Patients at Type 1 Diabetes Onset. Diabetes Care. 34 (5), 1211-1213 (2011).
- de Graaff, L. C., Smit, J. W., Radder, J. K. Prevalence and clinical significance of organ-specific autoantibodies in type 1 diabetes mellitus. Netherlands Journal of Medicine. 65 (7), 235-247 (2007).
- Yu, L., et al. Proinsulin/Insulin autoantibodies measured with electrochemiluminescent assay are the earliest indicator of prediabetic islet autoimmunity. Diabetes Care. 36 (8), 2266-2270 (2013).
- Yu, L., et al. Distinguishing persistent insulin autoantibodies with differential risk: nonradioactive bivalent proinsulin/insulin autoantibody assay. Diabetes. 61 (1), 179-186 (2012).
- Miao, D., et al. GAD65 autoantibodies detected by electrochemiluminescence assay identify high risk for type 1 diabetes. Diabetes. 62 (12), 4174-4178 (2013).
- Gu, Y., Zhao, Z., High, H., Yang, T., Yu, L. Islet Autoantibody Detection by Electrochemiluminescence (ECL) Assay. Journal of Clinical & Cellular Immunology. 8 (6), (2017).
- Gu, Y., et al. Electrochemiluminescence Assays for Human Islet Autoantibodies. Journal of Visualized Experiments. (133), e57227 (2018).
- Gu, Y., et al. High-throughput multiplexed autoantibody detection to screen type 1 diabetes and multiple autoimmune diseases simultaneously. Ebiomedicine. 47, 365-372 (2019).
- Dongmei, M., A, K. S., Li Zh, K., Michelle, G., Ling, J., Taylor, A. Electrochemiluminescence Assays for Insulin and Glutamic Acid Decarboxylase Autoantibodies Improve Prediction of Type 1 Diabetes Risk. Diabetes Technology & Therapeutics. 17 (2), 119-127 (2015).
- Steck, A. K., et al. ECL-IAA and ECL-GADA Can Identify High-Risk Single Autoantibody-Positive Relatives in the TrialNet Pathway to Prevention Study. Diabetes Technology & Therapeutics. 18 (7), 410-414 (2016).
- Fouts, A., et al. Do Electrochemiluminescence Assays Improve Prediction of Time to Type 1 Diabetes in Autoantibody-Positive TrialNet Subjects. Diabetes Care. 39 (10), 1738-1744 (2016).
- Sosenko, J. M., et al. The Use of Electrochemiluminescence Assays to Predict Autoantibody and Glycemic Progression Toward Type 1 Diabetes in Individuals with Single Autoantibodies. Diabetes Technology & Therapeutics. 19 (3), 183-187 (2017).
- Zhao, Z., et al. Higher Sensitivity and Earlier Identification of Celiac Disease Autoimmunity by a Nonradioactive Assay for Transglutaminase Autoantibodies. Journal of Immunology Research. 2016, 5 (2016).
- Zhang, B., Kumar, R. B., Dai, H., Feldman, B. J. A plasmonic chip for biomarker discovery and diagnosis of type 1 diabetes. Nature Medicine. 20 (8), 948-953 (2014).
- Tsai, C. T., Robinson, P. V., Spencer, C. A., Bertozzi, C. R. Ultrasensitive Antibody Detection by Agglutination-PCR (ADAP). American Chemical Society Central Science. 2 (3), 139-147 (2016).
- Yim, S. W., et al. Four-color alternating-laser excitation single-molecule fluorescence spectroscopy for next-generation biodetection assays. Clinical chemistry. 58 (4), 707-716 (2012).
- Bale, S. S., et al. A highly sensitive microsphere-based assay for early detection of Type I diabetes. Technology. 02 (03), 200-205 (2014).
- Ziegler, A. G., et al. 3 Screen ELISA for High-Throughput Detection of Beta Cell Autoantibodies in Capillary Blood. Diabetes Technology & Therapeutics. 18 (11), 687-693 (2016).
- Schlosser, M., et al. Diabetes Antibody Standardization Program: evaluation of assays for insulin autoantibodies. Diabetologia. 53 (12), 2611-2620 (2010).
- Zhao, Z., et al. A multiplex assay combining insulin, GAD, IA-2 and transglutaminase autoantibodies to facilitate screening for pre-type 1 diabetes and celiac disease. Journal of Immunological Methods. 430, 28-32 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados