Method Article
Un test di elettrochemiluminescenza 7-plex ad alta produttività che esegue simultaneamente lo screening per il diabete di tipo 1 e le malattie autoimmuni multiple
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Modelliamo un semplice test ECL multiplex che combina 7 saggi di autoanticorpi insieme. Il test è in grado di eseguire lo screening per il T1D e molte altre malattie autoimmuni, contemporaneamente, tra cui la celiachia, la malattia autoimmune della tiroide e la sindrome polighiandolare autoimmune 1.
Abstract
Gli autoanticorpi delle isole (IAbs) sono ampiamente utilizzati nella diagnosi e nella previsione del diabete di tipo 1 (T1D). Quattro principali IAb all'insulina (IAA), glutammato decarbossilasi-65 (GADA), insulinoma antigene-2 (IA-2A) e trasportatore di zinco-8 (ZnT8A) sono ugualmente importanti nella previsione della malattia. Attualmente, fino al 40% dei pazienti con diagnosi di T1D continua a sviluppare altri disturbi autoimmuni. Sfortunatamente, gli attuali metodi di screening che utilizzano un singolo autoanticorpo per la misurazione sono laboriosi e inefficienti per studi di screening su larga scala. Recentemente abbiamo sviluppato un semplice test di elettrochemiluminescenza multipla (ECL) per affrontare questi problemi attuali. Il test combina tutti e 7 i test degli autoanticorpi in un unico pozzetto. Ogni pozzetto include tre IAb (IAA, GADA e IA-2A), autoanticorpi contro la perossidasi tiroidea (TPOA) e la globulina tiroidea (ThGA) per rilevare la malattia autoimmune della tiroide, autoanticorpi contro la transglutaminasi tissutale (TGA) per la celiachia e autoanticorpi contro l'interferone alfa (IFNαA) per la sindrome polighiandolare autoimmune-1 (APS-1); tutti i quali schermano il T1D e altre malattie autoimmuni rilevanti, contemporaneamente. Il test ECL multiplex si basa sulla singola piattaforma di analisi ECL, ma utilizza invece la piastra multiplex che combina più saggi autoanticorpali, fino a 10, in un singolo pozzetto. La principale differenza rispetto al singolo test ECL è che ogni complesso anticorpo-antigene formato nella fase fluida viene trattenuto su un punto specifico su ciascun pozzetto attraverso un sistema linker sulla piastra multiplex. Il test ECL 7-Plex, nel presente studio, è convalidato rispetto ai saggi standard di radio-legame (RBA) e ai singoli saggi ECL, utilizzando un'ampia coorte di pazienti T1D di nuova diagnosi e controlli sani di pari età, con conseguente eccellente sensibilità e specificità del test.
Introduzione
Il diabete di tipo 1 (T1D) è una grave malattia cronica che è più comune durante l'infanzia. Attualmente, circa 1,4 milioni di persone hanno il T1D negli Stati Uniti; sorprendentemente, l'incidenza del T1D è in costante aumento del 3-5% ogni anno in tutto il mondo ed è raddoppiata negli ultimi due decenni, specialmente nei bambini piccoli 1,2. Gli autoanticorpi delle isole (IAbs) nella circolazione sanguigna sono attualmente il biomarcatore più affidabile. Gli IAbs possono comparire anni prima che il T1D clinico si sviluppi3. Attualmente, quattro principali IAb sono ampiamente utilizzati nella diagnosi di T1D e nello screening del rischio, tra cui gli autoanticorpi contro l'insulina (IAA), la glutammato decarbossilasi-65 (GADA), l'antigene dell'insulinoma-2 (IA-2A) e il trasportatore di zinco-8 (ZnT8A). Questi quattro IAb sono ugualmente importanti nella previsione dello sviluppo di T1D. La classificazione del T1D è stata recentemente ridefinita come la presenza di ≥2 di ogni 4 IAb con un normale metabolismo del glucosio come stadio della malattia 14.
Nel Diabetes Autoimmunity Study in the Young (DAISY), è stato rivelato che un bambino su quattro a rischio di T1D aveva probabilità di progredire verso l'autoimmunità delle isole, della celiachia, della tiroide o reumatoide e, cosa più sorprendente, circa il 40% dei pazienti a cui è stato diagnosticato il T1D alla fine sviluppa un'ulteriore condizione autoimmune 5,6,7 . L'identificazione degli autoanticorpi è essenziale per la previsione e la diagnosi di queste malattie autoimmuni e dovrebbe fornire una migliore assistenza clinica ai pazienti. Al momento non esiste un modo semplice ed economico per lo screening di queste molteplici condizioni autoimmuni. Gli attuali metodi di screening che utilizzano il saggio standard di radio-legame (RBA), con una singola misurazione degli autoanticorpi, sono laboriosi e inefficienti per uno screening su larga scala.
Qui, descriveremo il test ECL multiplexato semplice di nuova concezione, che abbiamo autenticato utilizzando una singola piattaforma di analisi ECL 8,9,10,11. Il test ECL multiplex combina 7 test autoanticorpali in un unico pozzetto, utilizzando solo 15 μL di siero, ed è in grado di eseguire lo screening per T1D e più malattie autoimmuni rilevanti contemporaneamente tra cui celiachia, malattia autoimmune della tiroide e APS-1. Un test ECL ZnT8A non era stato sviluppato al momento e non è stato incluso nel test multiplexato. Il test ECL multiplex fornisce uno strumento eccellente per l'elevata produttività nello screening della popolazione generale per T1D e malattie autoimmuni multiple.
Protocollo
Il protocollo di ricerca è stato approvato dal Colorado Multiple Institutional Review Board.
1. Preparazione del buffer
- Fare il tampone di etichettatura (2x PBS, pH 7,9). Utilizzando 400 ml di acqua distillata deionizzata (DD), aggiungere 100 ml di 10x PBS. Per regolare il pH della soluzione, aggiungere NaOH fino a raggiungere 7,9.
- Creare 3 mM di biotina sciogliendo 1 mg di biotina in 588 μL di tampone di etichettatura precedentemente creato. Produrre 3 mM Ru Sulfo-NHS sciogliendo 150 nmol di Ru Sulfo-NHS in 50 μL di tampone di etichettatura.
- Fare il tampone antigene (1% BSA) prendendo 500 ml di 1x PBS e aggiungendo 5 g di albumina sierica bovina (BSA) alla soluzione. Preparare 0,5 M di soluzione di acido acetico. Preparare il tampone Tris-HCl 1 M utilizzando Trizma Base e regolando il pH a 9,0.
- Per il tampone di rivestimento (3% Blocker A), prelevare 500 mL di 1x PBS e aggiungere 15 g di Blocker A. Preparare il tampone di lavaggio (0,05 % Tween 20, PBST) mescolando 5000 mL di 1x PBS con 2,5 mL di Tween 20. Creare un buffer di lettura (2x Read Buffer T con tensioattivo) aggiungendo 500 mL di acqua DD e 500 mL di 4x Read Buffer T con tensioattivo.
NOTA: Per mantenere la coerenza tra i saggi è importante che entrambe le soluzioni di biotina e Ru Sulfo-NHS siano create appena prima della procedura di etichettatura e non vengano create e conservate per un uso futuro.
2. Etichettatura di ogni proteina dell'antigene con biotina e Ru Sulfo-NHS separatamente
NOTA: Per avere una reazione di marcatura più efficace, utilizzare una concentrazione di proteina dell'antigene di ≥0,5 mg / ml.
- Calcolare il numero molare di ciascuna proteina dell'antigene e il numero molare della biotina e del Ru Sulfo-NHS. Aggiungere una quantità adeguata di biotina o Ru Sulfo-NHS alla proteina dell'antigene per la reazione di etichettatura in base al rapporto molare della proteina dell'antigene alla biotina o Ru Sulfo-NHS.
- Per l'antigene che ha il peso molecolare più piccolo (≤10 kDa), come la proteina proinsulina, utilizzare un rapporto molare di 1:5 (antigene: biotina e Ru Sulfo-NHS). Per l'antigene che ha il peso molecolare maggiore (>50 kDa), come la proteina GAD, utilizzare un rapporto molare di 1:20. Per l'antigene che ha un peso molecolare medio (10-50 kDa), utilizzare un rapporto molare regolato tra 1:5-1:20.
- Sia per la biotina che per il Ru Sulfo-NHS, dividere ogni peso dell'antigene per i rispettivi pesi molecolari per ottenere il numero molare dell'antigene per ciascuno. Dividere il numero molare per la concentrazione per ottenere il volume per la biotina. Ripeti questo per Ru Sulfo-NHS.
- Mescolare la proteina dell'antigene con la biotina usando il rapporto molare corretto, determinato al punto 2.2. Quindi fai lo stesso per Ru Sulfo-NHS.
NOTA: Per l'efficienza della reazione di etichettatura, qualsiasi sostanza chimica riducente come Tris o glicina nel sistema tampone deve essere sostituita con 2x tampone PBS, pH 7,9 dalla colonna di spin di dimensionamento. I protocolli di etichettatura per biotina e Ru Sulfo-NHS sono identici. - Coprire i tubi di reazione con un foglio di alluminio e incubarli a temperatura ambiente (RT) per 1 ora. Il motivo per cui copre i tubi di reazione con un foglio è perché sia la biotina che i reagenti Ru Sulfo-NHS sono sensibili alla luce.
- Innescare la colonna di spin da 2 mL o 5 mL mentre i tubi di reazione sono in incubazione (la dimensione della colonna di spin è determinata dal volume caricato sulla colonna). Riempire la colonna di rotazione con 2x tampone PBS e quindi centrifugarla a 1.000 x g per 2 minuti ogni volta, per un totale di tre volte.
- Interrompere la reazione di etichettatura dopo che i tubi di reazione hanno terminato l'incubazione. Per fermare la reazione, purificare la proteina dell'antigene marcata facendola passare attraverso la colonna di spin una volta. Quindi centrifugare la colonna a 1.000 x g per 2 minuti.
- Calcolare la concentrazione totale di antigene marcato dividendo la quantità di proteina dell'antigene presente per il volume finale. Aliquot 50 μL della proteina dell'antigene marcata purificata per provetta e conservare le aliquote a -80 °C per un uso a lungo termine.
NOTA: È importante essere consapevoli del fatto che per ogni volta che la colonna di spin passa attraverso la proteina dell'antigene, ci sarà un tasso di ritenzione del 90-95%.
3. Definire la migliore concentrazione e i rapporti per i due antigeni marcati per il test (test a scacchiera)
NOTA: Poiché il test ECL-IAA in questo test 7-Plex richiede un trattamento acido dei campioni di siero, il test a scacchiera per ciascun antigene deve passare attraverso questa fase prima di incubare con la miscela di antigene marcata.
- Applicare il test a scacchiera per ciascun antigene separatamente prima di eseguire il test multiplex. I passaggi 3.2-3.6 utilizzeranno GAD65 come esempio.
- Calcolare la diluizione della proteina GAD65 marcata. La concentrazione mirata raccomandata della prima soluzione di miscela di GAD65 biotinilato è 2000 ng / mL e Ru Sulfo-NHS marcato GAD65 è 1000 ng / mL. Se la concentrazione di GAD65 biotinilato e Ru Sulfo-NHS marcato GAD65 in soluzione madre è 1,0 μg/μL, il volume necessario per GAD65 biotinilato in 560 μL di soluzione di lavoro sarà 1,12 μL e il volume necessario per Ru Sulfo-NHS marcato GAD65 in 700 μL di soluzione di lavoro sarà 0,7 μL.
- Mescolare 1,12 μL di proteina GAD65 biotinilata con 240 μL di linker 1 coniugato con streptavidina in una provetta e 160 μL di BSA all'1%. Incubare la miscela a temperatura ambiente per 30 min. Aggiungere 160 μL di soluzione di arresto al tubo e incubare la miscela a temperatura ambiente per altri 30 minuti.
- Fare una diluizione seriale. Prelevare 280 μL della miscela in un nuovo tubo e aggiungere 280 μL di soluzione di arresto per ottenere una diluizione 1:2. Preparare diversi nuovi tubi. Ripetere questo passaggio per eseguire una diluizione seriale orizzontale per l'antigene GAD65 marcato con biotina (fare riferimento alla precedente pubblicazione12).
- Mescolare 0,7 μL di proteina GAD65 (1 μg/μL) marcata con Ru Sulfo-NHS con 700 μL di soluzione di stop. Quindi prendere 350 μL della miscela in un nuovo tubo e aggiungere 350 μL di soluzione di arresto per fare una diluizione 1:2. Preparare diversi nuovi provette, ripetere questo passaggio per eseguire una diluizione seriale verticale per l'antigene GAD65 marcato Ru Sulfo-NHS.
- Preparare due campioni di siero, un campione altamente positivo per GADA e un campione negativo per GADA, ciascuno con un volume di 0,75 ml. Aliquot 15 μL di siero positivo in ogni pozzetto sulla metà sinistra della piastra PCR a 96 pozzetti. Aliquot 15 μL di siero negativo in ogni pozzetto sulla metà destra della piastra PCR a 96 pozzetti.
- Aggiungere 18 μL di acido acetico 0,5 M in ciascun pozzetto e mescolare. Incubare per 45 minuti a RT. Preparare una nuova piastra PCR a 96 pozzetti. Aggiungere 17,5 μL dell'antigene marcato con biotina e 17,5 μL dell'antigene marcato con Ru Sulfo-NHS in ciascun pozzetto secondo le diluizioni seriali (fare riferimento alla precedente pubblicazione12).
- Continuare le altre fasi del test descritte nei passaggi da 5.2 a 9.1.
- Determinare il rapporto di segnale tra i campioni positivi elevati rispetto ai corrispondenti segnali del campione negativo. Selezionare la migliore concentrazione per l'antigene marcato con biotina e l'antigene marcato Ru Sulfo-NHS identificando il punto che ha il rapporto più alto o vicino al più alto di segnale positivo e negativo. In questo calcolo del rapporto, si consideri il segnale di fondo basso ottenuto dai campioni negativi.
NOTA: Le concentrazioni ottimali di Ru Sulfo-NHS e proteine antigene marcate con biotina dai saggi a scacchiera sono mostrate di seguito: 30 ng / mL e 200 ng / mL per GAD65, 120 ng / mL e 120 ng / mL per proinsulina, 10 ng / mL e 42 ng / mL per IA-2, 80 ng / mL e 80 ng / mL per TG, 8 ng / mL e 16 ng / mL per TPO, 31 ng/mL e 31 ng/mL per ThG, e 12 ng/mL e 12 ng/mL per IFNα.
4. Creare la soluzione di antigene accoppiato a linker misto
- Selezionare la concentrazione ottimale per ciascun antigene in base al test a scacchiera. Diluire l'antigene marcato con biotina e Ru Sulfo-NHS alla concentrazione di lavoro razionale.
- Legare diversi linker a ciascuna delle proteine dell'antigene unicamente biotinilate. Per un test su piastra a 96 pozzetti, mescolare 4 μL di GAD65, TPO, tTG, ThG, proinsulina, proteina IFN-α e IA-2 con 240 μL di linker 1, 2, 3, 4, 8, 9 e 10 coniugati con streptavidina in una provetta separata (Figura 1). Quindi aggiungere 156 μL di PBS/1% BSA per provetta. Incubare la miscela a temperatura ambiente per 30 min.
- Aggiungere 160 μL di soluzione di arresto in ogni tubo e incubarli a temperatura ambiente per altri 30 minuti. Prelevare 400 μL di antigene accoppiato al linker da ciascuna provetta e combinare tutti e 7 gli antigeni insieme. Aggiungere 1,2 mL di soluzione di arresto e quindi aggiungere 4 μL di Ru Sulfo-NHS marcato GAD65, TPO, tTG, ThG, proinsulina, IFN-α e antigene IA-2 alla miscela. Ora la soluzione di antigene è pronta per essere utilizzata nel test.
5. Incubare campioni di siero con l'antigene marcato
NOTA: Poiché il test ECL-IAA in questo test 7-Plex richiede il trattamento acido dei campioni di siero, ogni siero richiede la fase di trattamento acido prima di incubare con miscela di antigene marcata per questo test 7-Plex.
- Aliquot 15 μL di siero per pozzetto per una piastra PCR a 96 pozzetti. Aggiungere 18 μL di acido acetico 0,5 M in ciascun pozzetto e mescolare. Incubare per 45 minuti a RT. Preparare una nuova piastra PCR a 96 pozzetti e aliquote 35 μL di soluzione di antigene in ciascun pozzetto.
- Mentre la piastra è ancora in incubazione, aggiungere 13 μL di tampone 1 M Tris pH 9,0 a ciascun pozzetto nella piastra dell'antigene. Aggiungere tampone sul lato di ciascun pozzetto per limitare la miscelazione di tampone Tris e antigene. Al termine dell'incubazione, prelevare 25 μL del siero trattato con acido e pipettarlo immediatamente in ogni pozzetto sulla piastra dell'antigene. Agitare la soluzione e coprire la piastra con un foglio sigillante PCR per evitare l'esposizione alla luce.
- A RT, mettere la piastra su uno shaker, impostato a bassa velocità, per 1 ora. Successivamente, conservare la piastra a 4 °C e lasciarla incubare per 18-24 ore.
6. Preparare la piastra multiplex
- Prelevare una piastra multiplex dal frigorifero a 4 °C e lasciare che la piastra arrivi a RT. Una volta che la piastra multiplex è a RT, aggiungere 150 μL di 3% Blocker A a ciascun pozzetto. Coprire la piastra multiplex con un foglio sigillante. Incubare la piastra in frigorifero a 4 °C durante la notte.
NOTA: il giorno 1 del test include i passaggi da 4 a 6.
7. Trasferire siero/antigene incubati nella piastra multiplex
- Il giorno seguente, metti i tovaglioli di carta sul tavolo e prendi la piastra multiplex di incubazione dal frigorifero. Svuotare tutto il buffer dalla piastra. Per fare questo, capovolgere il piatto e picchiettarlo sui tovaglioli di carta preparati fino a quando non è presente alcun tampone in nessuno dei pozzetti.
- Lavare la piastra multiplex aggiungendo 150 μL di PBST in ogni pozzetto. Eliminare il buffer, come indicato nel passaggio 7.1., e ripetere questo passaggio tre volte. Aggiungere 30 μL di siero/antigene incubato in ogni pozzetto nella piastra multiplex. Coprire la piastra con un foglio per limitare l'esposizione alla luce. Posizionare la piastra su uno scuotipia, impostato a bassa velocità, a RT per 1 ora.
8. Lavare la piastra e aggiungere il buffer di lettura
- Rimuovere il siero/antigene incubato dalla piastra multiplex tenendo la piastra capovolta e facendo scorrere la soluzione. Aggiungere 150 μL di PBST in tutti i pozzetti e rimuovere il tampone dalla piastra tenendo nuovamente la piastra capovolta e facendo uscire la soluzione. Ripetere questo passaggio tre volte. Al termine del terzo lavaggio, aggiungere 150 μL di tampone di lettura in ciascun pozzetto.
NOTA: le bolle d'aria interferiscono con la capacità della macchina per il lettore di lastre di analizzare accuratamente i risultati della piastra e dovrebbero essere evitate a tutti i costi.
9. Leggere la targa e analizzare i dati
- Contare la piastra preparata sulla macchina del lettore di piastre, leggendo tutti i valori in conteggi al secondo (CPS).
- Calcolare l'indice relativo per il saggio, utilizzando i livelli di anticorpi ottenuti dalla macchina lettore di piastre, con la seguente equazione:
Valore indice = [CPS (campione) - CPS (standard negativo)] / [CPS (standard positivo) - CPS (standard negativo)]. - Determinare quali risultati anticorpali sono negativi o positivi utilizzando i cut-off che sono stati stabiliti.
NOTA: il giorno 2 del test include i passaggi da 7 a 9.
Risultati
L'analisi dei risultati del test è stata mostrata nelle Tabelle 1, Tabella 2 e Tabella 3. I valori di lettura provengono dai dati dei 10 punti all'interno dello stesso pozzo. I valori indice per ciascun campione sono stati calcolati rispetto ai corrispondenti controlli interni positivi e negativi come descritto nel protocollo di analisi. Esempi di duplicati non validi sono mostrati nella tabella 1 e hanno causato l'errore di calcolo dell'indice finale nella tabella 3. Tutti i valori di conteggio non elaborati devono essere controllati per evitare risultati falsi positivi o falsi negativi.
Il test ECL 7-multiplexed è stato convalidato utilizzando un'ampia coorte di campioni provenienti da 1026 pazienti di nuova diagnosi con T1D e 1022 soggetti di controllo sani abbinati per età e sesso. I livelli di autoanticorpi del test 7-Plex ECL per 1026 pazienti T1D sono stati confrontati con i livelli di ciascuno dei nostri corrispondenti test ECL singoli stabiliti come mostrato in Figura 2 e da ciascun RBA e ELISA standard corrispondente come mostrato in Figura 3. Le specificità del test sono state impostate identiche al 99° percentile per tutti i test degli autoanticorpi ad eccezione degli autoanticorpi tiroidei (dove è stato utilizzato il 95° percentile ), di 1022 controlli sani per tutti e tre i metodi di analisi (7-Plex ECL, singolo ECL, RBA o ELISA) come elencato nella Tabella 4. I CV inter-test di GADA, IA-2A, IAA, TPOA, ThGA, TGA e IFNαA sono rispettivamente 6,4%, 4,5%, 9,1%, 4,9%, 5,7%, 11,3% e 5,9%.
Un piccolo numero di campioni discordanti per ciascuno dei 7 autoanticorpi è stato trovato intorno al limite dei cut-off per ciascun test (Figura 2 e Figura 3). Undici campioni di controllo (11/1022, 1,1%) sono risultati autoanticorpali multipli positivi solo nel test 7-Plex e negativi in ogni singolo test corrispondente. Allo stesso modo, è successo in 9 campioni dei pazienti T1D (9/1026, 0,9%). Inoltre, 10 TPOA positivi elevati e un ThGA nella coorte di pazienti che sono stati osservati sia nel singolo test ECL che RBA sono stati persi nel test 7-Plex. Questi campioni sono stati convertiti positivi nel test 7-Plex quando sono stati ulteriormente diluiti. In generale, il 100% della positività nel singolo test ECL o RBA è stato coperto nel test ECL 7-Plex, con la stessa specificità del test illustrata nella Tabella 4.
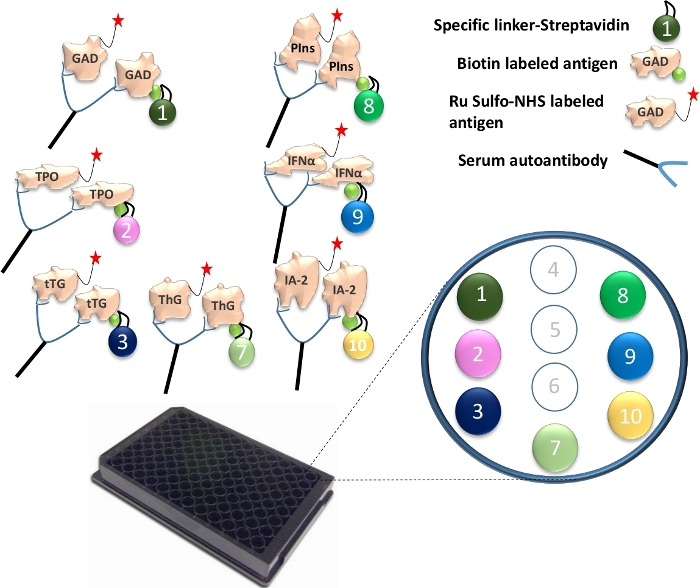
Figura 1: Illustrazione del saggio Mutiplex ECL.
Gli autoanticorpi nel siero collegheranno l'antigene Ru Sulfo-NHSged all'antigene biotinilato. Questo è accoppiato con un linker specifico per formare un complesso di antigene-anticorpo-antigene-linker. I complessi vengono catturati sulla piastra e sono trattenuti ai loro punti specifici attraverso ogni linker specifico. Vengono illustrati i numeri dei linker specificamente accoppiati, per le 7 diverse proteine dell'antigene. Il rilevamento dei segnali anticorpali viene effettuato utilizzando antigeni marcati con Ru Sulfo-NHS con elettrochemiluminescenza. La figura è tratta da Gu, Y. et al.13. Fare clic qui per visualizzare una versione ingrandita di questa figura.
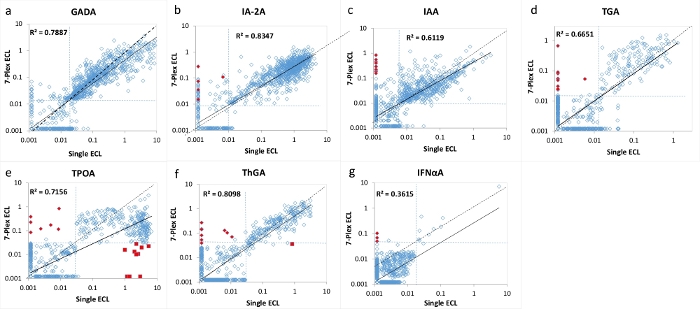
Figura 2: Confronto di 7 livelli di autoanticorpi in 1026 pazienti con T1D di nuova insorgenza tra il singolo test ECL e il test 7-Plex ECL.
I pannelli a, b, c, d, e, f e g mostrano confronti dei livelli di autoanticorpi rispettivamente per GADA, IA-2A, IAA, TGA, TPOA, ThGA e IFNαA. Le linee tratteggiate rappresentano i cut-off del test per ciascun test degli autoanticorpi. I cut-off sono stati impostati al 99° percentile di 1022 controlli sani di pari età per ciascun test (ad eccezione di TPOA e ThGA che sono stati impostati al 95° percentile), come mostrato nella Tabella 4, da 1022 controlli sani abbinati all'età per saggi ECL sia singoli che multiplex. I diamanti rossi chiusi sono contrassegnati come "falsi" positivi nel test 7-Plex ECL, il <1% della coorte studiata, e sono stati convalidati come negativi sia nella singola ECL che nella RBA. I quadrati rossi sono contrassegnati come negativi "falsi" nel test ECL 7-Plex causati dal fenomeno "prozona", che si verifica principalmente nel test TPOA nel <1% della coorte studiata. Entrambi questi risultati falsi positivi e falsi negativi sono discussi nella sezione di discussione. La figura è tratta da Gu, Y. et al.13. Fare clic qui per visualizzare una versione ingrandita di questa figura.
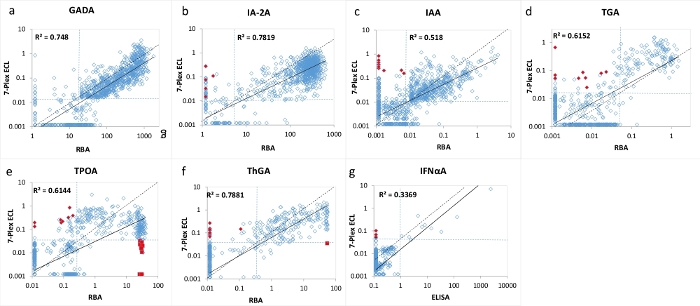
Figura 3: Confronto di 7 livelli di autoanticorpi in 1026 pazienti con T1D di nuova insorgenza tra il RBA (ELISA per IFNαA) e il test 7-Plex ECL.
I pannelli a, b, c, d, e, f e g presentano confronti dei livelli di autoanticorpi rispettivamente per GADA, IA-2A, IAA, TGA, TPOA, ThGA e IFNαA. Le linee tratteggiate rappresentano i cut-off del test per ciascun test degli autoanticorpi, la stessa specificità impostata sia per RBA che per il test ECL 7-Plex, come mostrato nella Tabella 4, da 1022 controlli sani abbinati all'età. I diamanti e i quadrati chiusi rossi rappresentano i "falsi" positivi e i "falsi" negativi che appaiono nel test 7-Plex ECL, lo stesso è mostrato nella Figura 2. La figura è tratta da Gu, Y. et al.13. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| 1 | 2 | 3 | 4 | 5 | 6 | ||
| Un | 5580 | 5674 | 105 | 117 | 125 | 139 | Linker-1 |
| 100 | 108 | 102 | 102 | 3956 | 3745 | Linker-2 | |
| 115 | 124 | 107 | 116 | 113 | 124 | Linker-3 | |
| 67 | 64 | 68 | 61 | 65 | 69 | Linker-4 | |
| 89 | 87 | 98 | 92 | 90 | 80 | Linker-5 | |
| 87 | 71 | 89 | 87 | 61 | 72 | Linker-6 | |
| 94 | 82 | 79 | 85 | 2154 | 2280 | Linker-7 | |
| 75 | 66 | 1628 | 1594 | 81 | 83 | Linker-8 | |
| 98 | 103 | 71 | 84 | 69 | 85 | Linker-9 | |
| 102 | 118 | 93 | 98 | 113 | 99 | Linker-10 | |
| B | 324 | 337 | 147 | 148 | 5426 | 5366 | Linker-1 |
| 101 | 102 | 93 | 88 | 86 | 74 | Linker-2 | |
| 111 | 119 | 119 | 123 | 66 | 72 | Linker-3 | |
| 72 | 65 | 59 | 68 | 74 | 67 | Linker-4 | |
| 81 | 98 | 83 | 92 | 79 | 72 | Linker-5 | |
| 90 | 84 | 93 | 86 | 70 | 76 | Linker-6 | |
| 101 | 105 | 101 | 97 | 956 | 944 | Linker-7 | |
| 82 | 83 | 189 | 204 | 97 | 90 | Linker-8 | |
| 92 | 83 | 78 | 64 | 82 | 78 | Linker-9 | |
| 83 | 79 | 88 | 93 | 4722 | 4965 | Linker-10 | |
| C | 110 | 110 | 87 | 81 | 2114 | 2365 | Linker-1 |
| 5526 | 5680 | 88 | 70 | 86 | 93 | Linker-2 | |
| 114 | 132 | 67 | 71 | 3326 | 3284 | Linker-3 | |
| 64 | 62 | 88 | 74 | 64 | 80 | Linker-4 | |
| 94 | 82 | 86 | 75 | 89 | 76 | Linker-5 | |
| 77 | 87 | 75 | 63 | 70 | 86 | Linker-6 | |
| 77 | 86 | 71 | 84 | 138 | 121 | Linker-7 | |
| 73 | 86 | 80 | 79 | 59 | 73 | Linker-8 | |
| 86 | 74 | 5064 | 4923 | 88 | 86 | Linker-9 | |
| 105 | 113 | 85 | 80 | 124 | 114 | Linker-10 | |
| D | 98 | 88 | 92 | 84 | 136 | 127 | Linker-1 |
| 288 | 291 | 86 | 86 | 558 | 564 | Linker-2 | |
| 109 | 101 | 74 | 73 | 141 | 127 | Linker-3 | |
| 78 | 66 | 66 | 55 | 74 | 66 | Linker-4 | |
| 79 | 83 | 79 | 86 | 96 | 91 | Linker-5 | |
| 83 | 86 | 96 | 89 | 86 | 73 | Linker-6 | |
| 87 | 89 | 77 | 87 | 841 | 855 | Linker-7 | |
| 74 | 72 | 60 | 72 | 90 | 95 | Linker-8 | |
| 68 | 75 | 331 | 328 | 2460 | 2580 | Linker-9 | |
| 86 | 98 | 80 | 75 | 123 | 133 | Linker-10 | |
| E | 101 | 114 | 101 | 106 | 532 | 548 | Linker-1 |
| 101 | 96 | 110 | 104 | 682 | 675 | Linker-2 | |
| 6015 | 5988 | 124 | 126 | 101 | 98 | Linker-3 | |
| 66 | 71 | 82 | 71 | 80 | 62 | Linker-4 | |
| 102 | 97 | 99 | 80 | 83 | 110 | Linker-5 | |
| 82 | 67 | 81 | 80 | 60 | 85 | Linker-6 | |
| 85 | 95 | 52 | 84 | 245 | 221 | Linker-7 | |
| 72 | 78 | 82 | 74 | 486 | 503 | Linker-8 | |
| 77 | 97 | 97 | 77 | 56 | 66 | Linker-9 | |
| 114 | 104 | 5726 | 5814 | 259 | 253 | Linker-10 | |
| F | 119 | 120 | 133 | 118 | 112 | 96 | Linker-1 |
| 101 | 91 | 100 | 95 | 96 | 82 | Linker-2 | |
| 406 | 395 | 111 | 123 | 2127 | 101 | Linker-3 | |
| 72 | 60 | 86 | 72 | 79 | 83 | Linker-4 | |
| 76 | 85 | 96 | 99 | 89 | 103 | Linker-5 | |
| 88 | 78 | 91 | 83 | 89 | 95 | Linker-6 | |
| 104 | 97 | 87 | 102 | 56 | 66 | Linker-7 | |
| 76 | 77 | 79 | 93 | 69 | 75 | Linker-8 | |
| 85 | 71 | 95 | 100 | 83 | 71 | Linker-9 | |
| 131 | 131 | 358 | 364 | 92 | 86 | Linker-10 | |
| G | 90 | 95 | 85 | 82 | 105 | 107 | Linker-1 |
| 99 | 86 | 77 | 76 | 1250 | 1174 | Linker-2 | |
| 119 | 123 | 120 | 118 | 112 | 108 | Linker-3 | |
| 76 | 83 | 77 | 80 | 86 | 76 | Linker-4 | |
| 88 | 86 | 86 | 93 | 107 | 92 | Linker-5 | |
| 73 | 73 | 71 | 82 | 84 | 75 | Linker-6 | |
| 5210 | 5173 | 72 | 69 | 76 | 85 | Linker-7 | |
| 80 | 81 | 79 | 82 | 100 | 101 | Linker-8 | |
| 96 | 97 | 89 | 83 | 65 | 83 | Linker-9 | |
| 98 | 103 | 86 | 88 | 1933 | 1979 | Linker-10 | |
| H | 114 | 124 | 81 | 86 | 299 | 295 | Linker-1 |
| 107 | 92 | 69 | 72 | 4256 | 4388 | Linker-2 | |
| 114 | 123 | 125 | 129 | 501 | 536 | Linker-3 | |
| 77 | 70 | 67 | 64 | 74 | 62 | Linker-4 | |
| 92 | 110 | 81 | 84 | 77 | 71 | Linker-5 | |
| 87 | 79 | 72 | 76 | 83 | 81 | Linker-6 | |
| 328 | 341 | 84 | 80 | 88 | 97 | Linker-7 | |
| 75 | 84 | 75 | 90 | 74 | 83 | Linker-8 | |
| 73 | 79 | 78 | 76 | 84 | 70 | Linker-9 | |
| 113 | 120 | 81 | 76 | 2372 | 2350 | Linker-10 | |
Tabella 1: Analisi del saggio ECL 7-plex: conteggi CPS grezzi (metà sinistra della piastra). I conteggi CPS grezzi vengono acquisiti da una piastra di analisi (la metà sinistra della piastra) e ogni campione viene eseguito in duplicato. Sotto ogni riga della piastra (A-H), ci sono 10 linee di valori di lettura che rappresentano i dati dei 10 punti all'interno dello stesso pozzo, corrispondenti a ciascun numero di linker contrassegnato. Esempi di duplicati errati sono evidenziati in grigio, come si vede nella riga F-linker 3-colonne 5 e 6.
| Riga della tabella 1A | Colonna della tabella 1A | linker 1 | linker 2 | linker 3 | linker 7 | linker 8 | linker 9 | linker 10 | |
| Un | 1-2 | GADA PC | 5627 | 104 | 120 | 88 | 71 | 101 | 110 |
| B | 1-2 | GADA PC basso | 331 | 102 | 115 | 103 | 83 | 88 | 81 |
| C | 1-2 | TPOA PC | 110 | 5603 | 123 | 82 | 80 | 80 | 109 |
| D | 1-2 | TPOA PC basso | 93 | 290 | 105 | 88 | 73 | 72 | 92 |
| E | 1-2 | TGA PC | 108 | 99 | 6002 | 90 | 75 | 87 | 109 |
| F | 1-2 | TG PC basso | 120 | 96 | 401 | 101 | 77 | 78 | 131 |
| G | 1-2 | ThGA PC | 93 | 93 | 121 | 5192 | 81 | 97 | 101 |
| H | 1-2 | ThGA PC basso | 119 | 100 | 119 | 335 | 80 | 76 | 117 |
| Un | 3-4 | IAA PC | 111 | 102 | 112 | 82 | 1611 | 78 | 96 |
| B | 3-4 | IAA PC basso | 148 | 91 | 121 | 99 | 197 | 71 | 91 |
| C | 3-4 | IFNaA PC | 84 | 79 | 69 | 78 | 80 | 4994 | 83 |
| D | 3-4 | IFNaA PC basso | 88 | 86 | 74 | 82 | 66 | 330 | 78 |
| E | 3-4 | IA-2A PC | 104 | 107 | 125 | 68 | 78 | 87 | 5770 |
| F | 3-4 | IA-2A PC basso | 126 | 98 | 117 | 95 | 86 | 98 | 361 |
| G | 3-4 | NC | 84 | 77 | 119 | 71 | 81 | 86 | 87 |
| H | 3-4 | NC | 84 | 71 | 127 | 82 | 78 | 77 | 79 |
| Un | 5-6 | esempio1 | 132 | 3851 | 119 | 2217 | 82 | 77 | 106 |
| B | 5-6 | esempio2 | 5396 | 80 | 69 | 950 | 94 | 80 | 4844 |
| C | 5-6 | esempio3 | 2240 | 90 | 3305 | 130 | 66 | 87 | 119 |
| D | 5-6 | esempio4 | 132 | 561 | 134 | 848 | 93 | 2520 | 128 |
| E | 5-6 | esempio5 | 540 | 679 | 100 | 233 | 495 | 61 | 256 |
| F | 5-6 | esempio6 | 104 | 89 | 1114 | 61 | 72 | 77 | 89 |
| G | 5-6 | campione7 | 106 | 1212 | 110 | 81 | 101 | 74 | 1957 |
| H | 5-6 | esempio8 | 297 | 4322 | 519 | 93 | 79 | 77 | 2361 |
Tabella 2: Analisi del saggio ECL 7-plex: disposizione dei dati della Tabella 1, contrassegnati come 7 linker. I dati della Tabella 1 sono stati riorganizzati, con i linker da 4 a 6 (non utilizzati) eliminati e i valori medi sono stati calcolati da ogni lettura duplicata della Tabella 1. I valori dei controlli positivi standard interni alti e bassi, corrispondenti a ciascun test di autoanticorpi, trattenuti da un particolare linker, sono in grassetto scuro. PC, controllo positivo. NC, controllo normale.
| Indice GAD | Indice TPOA | TGA-Indice | Indice ThGA | Indice IAA | Indice IFNaA | Indice IA-2A | |
| GADA PC | 1.000 | 0.005 | 0.000 | 0.003 | -0.006 | 0.003 | 0.004 |
| GADA PC basso | 0.045 | 0.005 | -0.001 | 0.006 | 0.002 | 0.000 | -0.001 |
| IAA PC | 0.005 | 1.000 | 0.001 | 0.002 | -0.001 | -0.001 | 0.004 |
| IAA PC basso | 0.002 | 0.039 | -0.002 | 0.003 | -0.005 | -0.003 | 0.001 |
| IA-2A PC | 0.004 | 0.004 | 1.000 | 0.004 | -0.004 | 0.000 | 0.004 |
| IA-2A PC basso | 0.007 | 0.004 | 0.048 | 0.006 | -0.002 | -0.002 | 0.008 |
| TGA PC | 0.002 | 0.003 | 0.000 | 1.000 | 0.000 | 0.002 | 0.002 |
| TG PC basso | 0.006 | 0.004 | 0.000 | 0.052 | -0.001 | -0.002 | 0.005 |
| TPOA PC | 0.005 | 0.005 | -0.001 | 0.002 | 1.000 | -0.002 | 0.001 |
| TPOA PC basso | 0.012 | 0.003 | 0.000 | 0.006 | 0.076 | -0.003 | 0.001 |
| ThGA PC | 0.000 | 0.000 | -0.008 | 0.001 | 0.000 | 1.000 | -0.001 |
| ThGA PC basso | 0.001 | 0.002 | -0.008 | 0.002 | -0.009 | 0.050 | -0.002 |
| IFNaA PC | 0.004 | 0.006 | 0.001 | 0.000 | -0.002 | 0.000 | 1.000 |
| IFNaA PC basso | 0.008 | 0.004 | 0.000 | 0.005 | 0.004 | 0.002 | 0.048 |
| NC | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| NC | 0.000 | -0.001 | 0.001 | 0.002 | -0.002 | -0.002 | -0.001 |
| esempio1 | 0.009 | 0.683 | 0.000 | 0.419 | 0.001 | -0.002 | 0.003 |
| esempio2 | 0.958 | 0.001 | -0.008 | 0.172 | 0.009 | -0.001 | 0.837 |
| esempio3 | 0.389 | 0.002 | 0.542 | 0.012 | -0.009 | 0.000 | 0.006 |
| esempio4 | 0.009 | 0.088 | 0.003 | 0.152 | 0.008 | 0.496 | 0.007 |
| esempio5 | 0.082 | 0.109 | -0.003 | 0.032 | 0.271 | -0.005 | 0.030 |
| esempio6 | 0.004 | 0.002 | 0.169 | -0.002 | -0.006 | -0.002 | 0.000 |
| campione7 | 0.004 | 0.205 | -0.002 | 0.002 | 0.013 | -0.002 | 0.329 |
| esempio8 | 0.039 | 0.768 | 0.068 | 0.004 | -0.001 | -0.002 | 0.400 |
Tabella 3: Analisi del saggio ECL 7-plex: risultati dei valori dell'indice. I valori indice per ciascun campione per tutti e 7 i test degli autoanticorpi sono stati calcolati rispetto ai corrispondenti controlli interni positivi e negativi come descritto nel protocollo di analisi. Qualsiasi valore di indice maggiore del valore limite è stato definito come risultato positivo, mostrato in grassetto scuro. Il valore dell'indice TGA del campione6 è stato evidenziato in grigio in quanto è un errore causato da duplicati errati mostrati nella riga F-linker 3-colonne 5 e 6 nella Tabella 1.
| GADA | IA-2A | IAA | .TGA | TPOA | ThGA | IFNαA* | ||||||||
| Sens | Spec | Sens | Spec | Sens | Spec | Sens | Spec | Sens | Spec | Sens | Spec | Sens | Spec | |
| RBA | 73.4% | 98.5% | 75.2% | 99.0% | 47.7% | 99.1% | 12.9% | 99.0% | 23.9% | 95.2% | 19.3% | 94.7% | 1.0% | 99.6% |
| ECL singolo | 71.6% | 99.1% | 73.6% | 99.3% | 48.3% | 99.7% | 16.0% | 98.9% | 26.3% | 94.9% | 20.6% | 95.1% | 0.8% | 99.2% |
| 7-Plex ECL | 71.2% | 98.9% | 77.3% | 98.9% | 49.5% | 98.9% | 16.5% | 98.7% | 26.1% | 94.7% | 21.1% | 94.7% | 1.7% | 99.1% |
Tabella 4: Sensibilità e specificità del test tra 1026 pazienti con T1D e 1022 controlli, abbinati sia per età che per sesso, in un test ECL 7-plex, rispetto al corrispondente test ECL singolo e RBA o ELISA*. Three diversi saggi (RBA, singolo ECL e 7-Plex ECL) per ciascun autoanticorpo sono stati impostati su specificità simili utilizzando i controlli sani abbinati all'età e al sesso 1022. L'esito di specificità della coorte di controllo studiata è stato fissato intorno al 95% per TPOA e ThGA e al 99% per gli altri 5 test. *L'asterisco indica il test IFNαA per ELISA, mentre altri sono RBA.
Discussione
In numerosi studi clinici nazionali e internazionali per il diabete di tipo 1, le prestazioni del singolo saggio ECL per rilevare gli autoanticorpi delle isole e gli autoanticorpi alla transglutaminasi (TGA) per la celiachia, sono state confermate 8,9,10,11. Nel corso di queste tracce, questo test ha aumentato la sensibilità e la specificità per il rilevamento dell'autoantigene quando valutato rispetto all'attuale RBA "gold" standard. La maggiore specificità della malattia può essere vista quando si discriminano gli autoanticorpi delle isole ad alta affinità e ad alto rischio da segnali a basso rischio e bassa affinità, tra il singolo test ECL e la RBA14,15,16,17. Sulla base del singolo test ECL, presentiamo un nuovo test di autoanticorpi ECL multiplex ad alto rendimento, per consentirci di eseguire lo screening del T1D e di diverse malattie autoimmuni applicabili allo stesso tempo.
Il test ECL multiplex utilizza la piastra multiplex, che può combinare fino a 10 saggi di autoanticorpi in un unico pozzetto. Per il presente studio, 7 saggi di autoanticorpi sono combinati insieme. Gli autoanticorpi comprendono 3 IAb (IAA, GADA e IA-2A), 2 autoanticorpi per la malattia autoimmune della tiroide (TPOA e ThGA), autoanticorpi per la celiachia (TGA) e autoanticorpi APS-1 contro l'interferone alfa (IFNαA). Il meccanismo di analisi è, in generale, basato su un singolo test ECL come precedentemente pubblicato 9,10,12,18 con alcune modifiche. La principale differenza di un test ECL multiplex da un singolo test ECL è che ogni complesso anticorpo-antigene formato nella fase fluida è vincolato a un linker specifico (Figura 1). L'antigene marcato con biotina viene incubato con la streptavidina coniugata, un linker utilizzato per formare uno specifico complesso antigene-linker. Il complesso immunitario anticorpo-antigene si forma dopo l'incubazione con il siero del paziente e viene catturato in un punto specifico attraverso il sistema di linker specifico su ciascun pozzetto della piastra multiplex. L'antigene marcato Ru Sulfo-NHS catturato dagli anticorpi allo stesso tempo fornisce il segnale con elettrochemiluminescenza. La macchina lettore di piastre può rilevare fino a 10 segnali diversi dalle sorgenti spot situate in ciascun pozzetto. Per mantenere i test degli autoanticorpi coerenti tra le piastre e durante la conduzione di studi a lungo termine, suggeriamo di utilizzare lo stesso linker.
Prima di impostare un test ECL multiplex, i singoli saggi ECL per ciascun autoanticorpo devono essere ottimizzati su una piastra multiplex, rispettivamente, e convalidati sia rispetto ai test RBA che a quelli ECL singoli su una piastra ECL regolare. Per migliorare il test a scacchiera, al relativo test di autoanticorpi sulla piastra multiplex, sono stati utilizzati un campione di paziente altamente positivo e un campione di paziente negativo. Dopo che è stato condotto il test a scacchiera, le concentrazioni più ideali per Ru Sulfo-NHS e l'antigene marcato con biotina sono state calcolate per ciascuno dei 7 saggi di autoanticorpi. Quanto segue mostra queste concentrazioni: 30 ng/mL e 200 ng/mL per GAD65, 120 ng/mL e 120 ng/mL per la proinsulina, 10 ng/mL e 42 ng/mL per IA-2, 80 ng/mL e 80 ng/mL per TG, 8 ng/mL e 16 ng/mL per TPO, 31 ng/mL e 31 ng/mL per ThG, e 12 ng/mL e 12 ng/mL rispettivamente per IFNα13. Potrebbe essere necessario regolare ulteriormente le concentrazioni di alcuni degli antigeni del test a scacchiera in base ai risultati del test multiplex effettivo dopo aver combinato tutti i test insieme.
Poiché l'IAA è inclusa nel presente test ECL multiplex, il trattamento acido dei campioni di siero è obbligatorio prima di incubare il siero con l'antigene, come riportato nel precedente studio12. Generalmente, quando un autoanticorpo extra viene aggiunto a un test multiplex, lo sfondo del test è influenzato e un segnale estremamente alto da un punto, nel pozzo, può ostruire i risultati dei punti vicini tramite diafonia. Pertanto, il CPS massimo deve essere limitato a 20.000 conteggi per ciascun autoanticorpo, o inferiore, per i campioni positivi più alti. Dalle nostre conoscenze, al fine di ridurre la quantità di diafonia coinvolta, gli autoanticorpi che hanno uno sfondo inferiore dovrebbero essere separati, quando si progetta la mappa spot, lontano dai punti con una maggiore frequenza di conteggi.
Elevati controlli positivi e negativi sono stati utilizzati internamente in ogni test per calcolare un indice accurato per i campioni sconosciuti sottoposti a test. Per valutare e monitorare accuratamente la sensibilità del test, sono stati utilizzati controlli positivi bassi, impostati vicino al limite superiore del test. Questi controlli standard positivi e negativi sono stati creati in blocco e in aliquote per uso a lungo termine e conservati a -20 °C o meno, per coerenza tra i saggi. Ai fini della garanzia della qualità, i campioni sono stati eseguiti due volte in ogni test e ogni risultato positivo è stato rieseguito e confermato eseguendo il campione in un nuovo test ECL il giorno successivo. In caso di disaccordo con il primo e il secondo test di conferma, era necessario un terzo test. Dei tre test condotti, i risultati dei due test che concordano (ad esempio, +, + o -,-), hanno determinato il risultato finale (positivo o negativo) del campione.
Nell'ultimo decennio, molti gruppi di studio stanno cercando un test ad alto rendimento utilizzando il metodo multiplex per combinare più saggi autoanticorpali insieme in un unico pozzo per lo screening di grandi popolazioni. Ci sono alcuni studi che utilizzano diversi tipi di tecnologie per condurre saggi di autoanticorpi multiplex 19,20,21,22, ma non c'è confronto per nessuno di questi test in sensibilità e specificità rispetto all'attuale RBA "gold" standard, quando si studia T1D. Questi diversi tipi di piattaforme utilizzate non sono convalidate attraverso il workshop internazionale Islet Autoantibody Standardization Program (IASP) o attraverso test di grandi coorti in studi clinici. In un recente screening generale basato sulla popolazione in Germania, un test combinato ad alto rendimento, 3 Screen ICATM ELISA distribuito da Kronus, viene utilizzato come strumento per lo screening di prima linea per rilevare tre IAb, GADA, IA-2A e ZnT8A, per ottenere una diagnosi precoce del T1D23 infantile. Il test ELISA a 3 schermi misura 3 autoanticorpi in 3 pozzetti separati, consumando un grande volume di siero, o in un singolo pozzetto con tutti e 3 i saggi miscelati. Se un pozzetto nel test ELISA a 3 schermi è positivo, non si è in grado di distinguere quale dei tre autoanticorpi è presente. Il più grande svantaggio di questo test è la sua incapacità di includere la misurazione IAA. Tutti i risultati IAA eseguiti da ELISA, come dimostrato nei workshop IASP, non hanno una sensibilità e specificità accettabili24. IAA è di solito il primo IAb a comparire e ha un'alta prevalenza tra i bambini piccoli. Lo screening IAb, con IAA, è necessario per i bambini e non è ritenuto accettabile condurre questo screening senza IAA per valutare il rischio di T1D nella comunità. Inoltre, non ci sono studi o dati pubblicati che dimostrino che il test del kit Kronus IAb sia più specifico per la malattia T1D e in grado di discriminare IAb ad alto rischio da IAb a basso rischio. Il test ECL 7-Plex, nel presente studio, è stato convalidato utilizzando un'ampia coorte di pazienti di nuova diagnosi conT1D 13. Rispetto all'attuale RBA standard e al consolidato test ECL singolo, il test 7-Plex è in grado di mantenere il 100% di positività con la stessa specificità del test (Tabella 4). Attualmente, il test 4-Plex ECL, parallelo allo standard RBA, viene applicato a un ampio studio clinico in corso: lo studio Autoimmunity Screening for Kids (ASK). Questo studio esamina i bambini nella popolazione generale, dell'area metropolitana di Denver, per T1D e celiachia. Rispetto all'RBA standard utilizzato nello studio ASK, il test ECL multiplex sta mostrando un'eccellente sensibilità e una maggiore specificità della malattia, identica ai nostri precedenti rapporti utilizzando il singolo studio ECL25. Inoltre, il nostro test ECL 4-Plex ha dimostrato una marcata riduzione del travaglio, dei costi e del volume sierico del 70%, rispetto ai corrispondenti 4 test singoli per ECL e RBA. Utilizzando il test ECL multiplexato, possiamo personalizzare ogni pozzetto con numeri diversi, che rappresentano diversi autoanticorpi (fino a 10), per testare diverse malattie autoimmuni specifiche per le esigenze di una particolare sede clinica.
Ci sono alcune limitazioni osservate, mostrate nel presente studio, per un test ECL multiplex utilizzando la piastra multiplex. La diluizione finale del siero, incubato con antigene, non può essere regolata per produrre le condizioni ottimali per ogni singolo test di autoanticorpi combinato in un singolo pozzetto. Nove campioni (9/1026), da pazienti T1D, sono stati osservati per avere un risultato falso negativo per particolari autoanticorpi. 7 dei falsi negativi erano per TPOA e 2 erano per ThGA, nel test 7-Plex ECL, ma sono stati esposti risultati positivi sia nel singolo test ECL che nella RBA (Figura 2 e 3). Dopo un'ulteriore diluizione di tutti e 9 i campioni, sono diventati positivi sulla piastra multiplex. Questo risultato è causato da quello che descriviamo come il fenomeno "prozona". Questo fenomeno fa sì che il campione mostri un risultato falso negativo perché gli alti titoli anticorpali stanno influenzando la formazione dei reticoli antigene-anticorpo. Quando si imposta un test multiplex, si raccomanda di eseguire campioni con titoli molto elevati, per ciascuno degli autoanticorpi combinati, per eseguire test preliminari per identificare la diluizione facoltativa del siero per l'incubazione dell'antigene. In alternativa, devono essere selezionati saggi di autoanticorpi con condizioni ottimizzate simili per formare un test combinato da cui si ottiene la migliore sensibilità e specificità del saggio per ciascun autoanticorpo. Nel presente studio, 7 campioni (7/1022), da controlli normali sani, hanno determinato falsi positivi per più autoanticorpi nel test 7-Plex, ma dopo aver eseguito un singolo test ECL e RBA (Figura 2 e 3) questi autoanticorpi sono risultati negativi in entrambi i test. Le ragioni alla base di questi risultati falsi positivi che si verificano sulla piastra multiplex, per questo piccolo sottoinsieme di campioni, sono attualmente sconosciute. Per l'applicazione corrente del test ECL multiplex, tutti i campioni positivi vengono ripetuti con il loro corrispondente test ECL singolo per confermare la positività, che rimuove questo errore falso positivo dal test ECL multiplex.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla sovvenzione NIH DK32083, JDRF Grants 2-SRA-2015-51-Q-R e 2-SRA-2018-533-S-B.
Materiali
| Name | Company | Catalog Number | Comments |
| 4 °C refrigerator | |||
| –80 °C and -20 °C freezers | |||
| 96-well Plate Shaker | Wallac - Delfi | ||
| 96-well round bottom plate | Fisher | 8408220 | |
| Acetic acid solution | Fisher | ||
| Aluminum foil | |||
| Antigen proteins | |||
| Human GAD65 full length protein | Diamyd | ||
| Human ThG full length protein | BioMart | ||
| Human TPO full length protein | BioMart | ||
| IA-2 intracellular domain protein | BioMart | ||
| IFN-α protein | Abcam | ||
| Proinsulin protein | AmideBio | ||
| tTG protein | DiaRect | ||
| Biotin | Sigma | ||
| Bottle-Top 500 mL , Filter Units | Fisher | 0974064A or B | |
| Bovine Serum Albumin | Sigma | A-7906 | |
| Distilled deionized (DD) water | |||
| HCl | Fisher | ||
| Ice maker | |||
| Ice trays | |||
| MSD Sector | Perkin-Elmer | ||
| Multi-channel pipette | |||
| NaOH | |||
| Paper tower | |||
| PBS | |||
| pH meter | |||
| Pipette-Aid | |||
| Pipettes/tips | |||
| Ru Sulfo-NHS | MSD (R91AN) | ||
| Trizma Base | Fisher | BP152-5 | |
| Tween 20 | Sigma | P-1379 | |
| Uplex Development Kit | MSD | ||
| 96-well UPlex plate | MSD | ||
| Blocker A | MSD | R93AA | |
| Linker-Streptavidin | MSD | ||
| Read buffer | MSD | R92TC | |
| Stop Solution | MSD | ||
| Vortex mixer | |||
| ZeBa Column | Pierce | 89892 |
Riferimenti
- Harjutsalo, V., Sjoberg, L., Tuomilehto, J. Time trends in the incidence of type 1 diabetes in Finnish children: a cohort study. Lancet. 371 (9626), 1777-1782 (2008).
- Vehik, K., et al. Increasing incidence of type 1 diabetes in 0- to 17-year-old Colorado youth. Diabetes Care. 30 (3), 503-509 (2007).
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Insel, R. A., et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 38 (10), 1964-1974 (2015).
- Barker, J. M., et al. Autoantibody "subspecificity" in type 1 diabetes: risk for organ-specific autoimmunity clusters in distinct groups. Diabetes Care. 28 (4), 850-855 (2005).
- Triolo, T. M., et al. Additional Autoimmune Disease Found in 33% of Patients at Type 1 Diabetes Onset. Diabetes Care. 34 (5), 1211-1213 (2011).
- de Graaff, L. C., Smit, J. W., Radder, J. K. Prevalence and clinical significance of organ-specific autoantibodies in type 1 diabetes mellitus. Netherlands Journal of Medicine. 65 (7), 235-247 (2007).
- Yu, L., et al. Proinsulin/Insulin autoantibodies measured with electrochemiluminescent assay are the earliest indicator of prediabetic islet autoimmunity. Diabetes Care. 36 (8), 2266-2270 (2013).
- Yu, L., et al. Distinguishing persistent insulin autoantibodies with differential risk: nonradioactive bivalent proinsulin/insulin autoantibody assay. Diabetes. 61 (1), 179-186 (2012).
- Miao, D., et al. GAD65 autoantibodies detected by electrochemiluminescence assay identify high risk for type 1 diabetes. Diabetes. 62 (12), 4174-4178 (2013).
- Gu, Y., Zhao, Z., High, H., Yang, T., Yu, L. Islet Autoantibody Detection by Electrochemiluminescence (ECL) Assay. Journal of Clinical & Cellular Immunology. 8 (6), (2017).
- Gu, Y., et al. Electrochemiluminescence Assays for Human Islet Autoantibodies. Journal of Visualized Experiments. (133), e57227 (2018).
- Gu, Y., et al. High-throughput multiplexed autoantibody detection to screen type 1 diabetes and multiple autoimmune diseases simultaneously. Ebiomedicine. 47, 365-372 (2019).
- Dongmei, M., A, K. S., Li Zh, K., Michelle, G., Ling, J., Taylor, A. Electrochemiluminescence Assays for Insulin and Glutamic Acid Decarboxylase Autoantibodies Improve Prediction of Type 1 Diabetes Risk. Diabetes Technology & Therapeutics. 17 (2), 119-127 (2015).
- Steck, A. K., et al. ECL-IAA and ECL-GADA Can Identify High-Risk Single Autoantibody-Positive Relatives in the TrialNet Pathway to Prevention Study. Diabetes Technology & Therapeutics. 18 (7), 410-414 (2016).
- Fouts, A., et al. Do Electrochemiluminescence Assays Improve Prediction of Time to Type 1 Diabetes in Autoantibody-Positive TrialNet Subjects. Diabetes Care. 39 (10), 1738-1744 (2016).
- Sosenko, J. M., et al. The Use of Electrochemiluminescence Assays to Predict Autoantibody and Glycemic Progression Toward Type 1 Diabetes in Individuals with Single Autoantibodies. Diabetes Technology & Therapeutics. 19 (3), 183-187 (2017).
- Zhao, Z., et al. Higher Sensitivity and Earlier Identification of Celiac Disease Autoimmunity by a Nonradioactive Assay for Transglutaminase Autoantibodies. Journal of Immunology Research. 2016, 5 (2016).
- Zhang, B., Kumar, R. B., Dai, H., Feldman, B. J. A plasmonic chip for biomarker discovery and diagnosis of type 1 diabetes. Nature Medicine. 20 (8), 948-953 (2014).
- Tsai, C. T., Robinson, P. V., Spencer, C. A., Bertozzi, C. R. Ultrasensitive Antibody Detection by Agglutination-PCR (ADAP). American Chemical Society Central Science. 2 (3), 139-147 (2016).
- Yim, S. W., et al. Four-color alternating-laser excitation single-molecule fluorescence spectroscopy for next-generation biodetection assays. Clinical chemistry. 58 (4), 707-716 (2012).
- Bale, S. S., et al. A highly sensitive microsphere-based assay for early detection of Type I diabetes. Technology. 02 (03), 200-205 (2014).
- Ziegler, A. G., et al. 3 Screen ELISA for High-Throughput Detection of Beta Cell Autoantibodies in Capillary Blood. Diabetes Technology & Therapeutics. 18 (11), 687-693 (2016).
- Schlosser, M., et al. Diabetes Antibody Standardization Program: evaluation of assays for insulin autoantibodies. Diabetologia. 53 (12), 2611-2620 (2010).
- Zhao, Z., et al. A multiplex assay combining insulin, GAD, IA-2 and transglutaminase autoantibodies to facilitate screening for pre-type 1 diabetes and celiac disease. Journal of Immunological Methods. 430, 28-32 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon