Method Article
1型糖尿病と複数の自己免疫疾患を同時にスクリーニングするハイスループット電気化学発光7-Plexアッセイ
* これらの著者は同等に貢献しました
要約
7つの自己抗体アッセイを組み合わせた単純なマルチプレックスECLアッセイをモデル化します。このアッセイは、T1Dと、セリアック病、自己免疫性甲状腺疾患、自己免疫性多腺症候群など、他の複数の自己免疫疾患を同時にスクリーニングすることができます1。
要約
膵島自己抗体(IAbs)は、1型糖尿病(T1D)の診断と予測に広く使用されています。インスリンに対する4つの主要なIAb(IAA)、グルタミン酸デカルボキシラーゼ-65(GADA)、インスリノーマ抗原-2(IA-2A)、および亜鉛トランスポーター-8(ZnT8A)は、疾患予測において等しく重要です。現在、T1Dと診断された患者の最大40%が他の自己免疫疾患を発症しています。残念ながら、測定に単一の自己抗体を使用する現在のスクリーニング方法は、大規模なスクリーニング研究には手間がかかり、非効率的です。私たちは最近、これらの現在の問題に対処するために、単純なマルチプレックス電気化学発光(ECL)アッセイを開発しました。このアッセイは、7つの自己抗体検査すべてを1つのウェルにまとめたものです。各ウェルには、3つのIAbs(IAA、GADA、およびIA-2A)、自己免疫性甲状腺疾患を検出するための甲状腺ペルオキシダーゼ(TPOA)および甲状腺グロブリン(ThGA)に対する自己抗体、セリアック病に対する組織トランスグルタミナーゼ(TGA)に対する自己抗体、および自己免疫性多腺症候群-1(APS-1)に対するインターフェロンアルファ(IFNαA)に対する自己抗体が含まれる。これらはすべて、T1Dおよび他の関連する自己免疫疾患を同時にスクリーニングします。マルチプレックスECLアッセイは、単一のECLアッセイプラットフォームに基づいていますが、代わりに、最大10個の複数の自己抗体アッセイを1つのウェルに組み合わせたマルチプレックスプレートを使用します。単一のECLアッセイとの主な違いは、液相で形成された各抗体-抗原複合体が、マルチプレックスプレート上のリンカーシステムを介して各ウェルの特定のスポットに拘束されることです。本研究では、7-Plex ECLアッセイは、新たに診断されたT1D患者と年齢が一致した健康な対照の大規模なコホートを使用して、標準的な放射性結合アッセイ(RBA)および単一のECLアッセイに対して検証され、優れたアッセイ感度と特異性をもたらします。
概要
1型糖尿病(T1D)は、小児期に最も一般的な深刻な慢性疾患です。現在、米国では約140万人がT1Dを持っています。驚くべきことに、T1Dの発生率は世界中で毎年3〜5%で着実に増加しており、特に幼児では過去20年間で2倍になっています1,2。血液循環における膵島自己抗体(IAbs)は、現在最も信頼性の高いバイオマーカーです。IAbsは、臨床T1Dが発症する数年前に現れる可能性があります3。現在、インスリンに対する自己抗体(IAA)、グルタミン酸デカルボキシラーゼ-65(GADA)、インスリノーマ抗原-2(IA-2A)、亜鉛トランスポーター-8(ZnT8A)を含む4つの主要なIAbがT1D診断およびリスクスクリーニングに広く使用されています。これらの4つのIAbは、T1Dの発達を予測する上で等しく重要です。T1Dの分類は、最近、疾患ステージ1として正常なグルコース代謝を有する任意の4つのIAbのうち≥2の存在として再定義されました4。
若者の糖尿病自己免疫研究(DAISY)では、T1Dのリスクがある子供の4人に1人が膵島、セリアック、甲状腺、またはリウマチの自己免疫に進行する可能性があり、さらに驚くべきことに、T1Dと診断された患者の約40%が最終的に追加の自己免疫状態を発症することが明らかになりました5,6,7.自己抗体の同定は、これらの自己免疫疾患の予測と診断に不可欠であり、患者により良い臨床ケアを提供する必要があります。現在、これらの複数の自己免疫状態をスクリーニングするための簡単で安価な方法はありません。標準的な放射性結合アッセイ(RBA)を用いた現在のスクリーニング方法は、単一の自己抗体測定を伴うため、大規模なスクリーニングには手間がかかり、非効率的です。
ここでは、我々が単一のECLアッセイプラットフォーム8,9,10,11を用いて認証した、新たに開発された簡易マルチプレックスECLアッセイについて説明する。マルチプレックスECLアッセイは、わずか15 μLの血清を使用して7つの自己抗体検査を1つのウェルに組み合わせ、セリアック病、自己免疫性甲状腺疾患、APS-1を含むT1Dおよび複数の関連する自己免疫疾患を同時にスクリーニングすることができます。ZnT8A ECLアッセイは当時開発されておらず、マルチプレックスアッセイには含まれていませんでした。マルチプレックスECLアッセイは、T1Dおよび複数の自己免疫疾患の一般集団スクリーニングにおけるハイスループットのための優れたツールを提供します。
プロトコル
研究プロトコルは、コロラド州複数の施設内審査委員会によって承認されました。
1. バッファー調製
- 標識バッファー(2x PBS、pH 7.9)を作ります。400 mLの蒸留脱イオン(DD)水を使用して、100 mLの10x PBSを追加します。溶液のpHを調整するには、7.9に達するまでNaOHを追加します。
- 1 mgのビオチンを以前に作成した588 μLの標識バッファーに溶解して、3 mMのビオチンを作成します。150 nmolのRuスルホ-NHSを50 μLの標識バッファーに溶解して、3 mM Ruスルホ-NHSを作成します。
- 500 mLの1x PBSを服用し、5 gのウシ血清アルブミン(BSA)を溶液に加えることにより、抗原バッファー(1%BSA)を作ります。0.5 Mの酢酸溶液を調製します。トリズマ塩基を用いて1 Mトリス塩酸緩衝液を調製し、pHを9.0に調整します。
- コーティングバッファー(3%ブロッカーA)には、500 mLの1x PBSを取り、15 gのブロッカーAを加えます。 5000 mLの1x PBSと2.5 mLのTween 20を混合して、洗浄バッファー(0.05%トゥイーン20、PBST)を調製します。500 mLのDD水と500 mLの界面活性剤を含む4xリードバッファーTを加えて、読み取りバッファー(界面活性剤を含む2x読み取りバッファーT)を作成します。
注:アッセイ間の一貫性を保つには、ビオチン溶液とRu Sulfo-NHS溶液の両方が標識手順の直前に作成され、将来の使用のために作成および保存されないことが重要です。
2.各抗原タンパク質をビオチンとRuスルホ-NHSで別々に標識する
注:より効果的な標識反応を行うには、抗原タンパク質濃度≥0.5 mg/mLを使用してください。
- 各抗原タンパク質のモル数とビオチンとRuスルホ-NHSのモル数を算出する。抗原タンパク質とビオチンまたはRuスルホ-NHSのモル比に応じて、標識反応のために抗原タンパク質にビオチンまたはRuスルホ-NHSを適量添加します。
- プロインスリンタンパク質など、分子量が小さい(≤10 kDa)抗原の場合は、1:5のモル比を使用します(抗原:ビオチンとRuスルホ-NHS)。GADタンパク質など、分子量が大きい(>50 kDa)抗原の場合は、1:20のモル比を使用します。中分子量(10〜50 kDa)の抗原の場合は、1:5〜1:20の間で調整されたモル比を使用します。
- ビオチンとRu Sulfo-NHSの両方について、各抗原重量を対応する分子量で割って、それぞれの抗原モル数を取得します。モル数を濃度で割って、ビオチンの体積を求めます。Ruスルホ-NHSについてもこれを繰り返します。
- ステップ2.2で決定した適切なモル比を使用して、抗原タンパク質とビオチンを混合します。次に、Ruスルホ-NHSについても同じことを行います。
注:標識反応を効率化するために、バッファーシステム内のトリスやグリシンなどの還元性化学物質は、サイジングスピンカラムによって2x PBSバッファー、pH 7.9に交換する必要があります。ビオチンとRuスルホ-NHSの標識プロトコルは同じです。 - 反応管をアルミホイルで覆い、室温(RT)で1時間インキュベートします。反応チューブをホイルで覆う理由は、ビオチンおよびRuスルホ-NHS試薬の両方が光感受性であるためです。
- 反応チューブのインキュベーション中に2 mLまたは5 mLのスピンカラムをプライミングします(スピンカラムのサイズは、カラムにアップロードされた容量によって決まります)。スピンカラムに2x PBSバッファーを充填し、1,000 x g で毎回2分間、合計3回遠心分離します。
- 反応チューブのインキュベーションが終了したら、標識反応を停止します。反応を停止するには、標識抗原タンパク質をスピンカラムに一度通して精製します。次に、カラムを1,000 x g で2分間遠心分離します。
- 存在する抗原タンパク質の量を最終体積で割ることにより、総標識抗原濃度を計算します。精製標識抗原タンパク質をチューブあたり50 μL分注し、長期間使用するために-80°Cで保存します。
注:スピンカラムが抗原タンパク質を通過するたびに、約90〜95%の保持率があることに注意することが重要です。
3. アッセイに最適な2つの標識抗原の濃度と比率を定義します(チェッカーボードアッセイ)
注:この7-PlexアッセイのECL-IAAアッセイは血清サンプルの酸処理を必要とするため、各抗原のチェッカーボードアッセイは、標識抗原混合物とインキュベートする前にこのステップを経る必要があります。
- マルチプレックスアッセイを実行する前に、各抗原に対してチェッカーボードアッセイを個別に適用します。手順 3.2 から 3.6 では、例として GAD65 を使用します。
- 標識GAD65タンパク質の希釈率を計算します。ビオチン化GAD65の最初の混合溶液の推奨目標濃度は2000 ng / mLであり、Ruスルホ-NHS標識GAD65は1000 ng / mLです。原液中のビオチン化GAD65とRuスルホ-NHS標識GAD65の両方の濃度が1.0 μg/μLの場合、560 μLの作業溶液中のビオチン化GAD65に必要な容量は1.12 μLになり、700 μLの作業溶液中のRuスルホ-NHS標識GAD65に必要な容量は0.7 μLになります。
- 1.12 μLのビオチン化GAD65タンパク質と240 μLのストレプトアビジン結合リンカー1を1本のチューブと160 μLの1%BSAで混合します。混合物を室温で30分間インキュベートする。160 μLの停止液をチューブに加え、室温でさらに30分間インキュベートします。
- 連続希釈を行います。280 μLの混合物を新しいチューブに入れ、280 μLのストップ溶液を加えて1:2に希釈します。いくつかの新しいチューブを準備します。このステップを繰り返して、ビオチン標識GAD65抗原の水平段階希釈を実行する(前の文献12を参照されたい)。
- 0.7 μLのRuスルホ-NHS標識GAD65(1 μg/μL)タンパク質を700 μLの停止液と混合します。次に、350 μLの混合物を新しいチューブに入れ、350 μLのストップ溶液を加えて1:2に希釈します。いくつかの新しいチューブを準備し、このステップを繰り返して、Ru Sulfo-NHS標識GAD65抗原の垂直段階希釈を実行します。
- 2つの血清サンプルを準備し、1つのサンプルはGADAに対して非常に陽性で、もう1つのサンプルはGADAに対して陰性であり、それぞれ0.75mLの容量を有する。15 μLの陽性血清を96ウェルPCRプレートの左半分のすべてのウェルに分注します。15 μLの陰性血清を96ウェルPCRプレートの右半分のすべてのウェルに分注します。
- 18 μLの0.5 M酢酸を各ウェルに加え、混合します。RTで45分間インキュベートし、新しい96ウェルPCRプレートを準備します。段階希釈に従って、17.5 μLのビオチン標識抗原および17.5 μLのRu Sulfo-NHS標識抗原を各ウェルに加える(前報12を参照)。
- ステップ5.2から9.1で説明されている残りのアッセイステップを続行します。
- 対応する負のサンプル信号に対する高い陽性サンプルからの信号比を決定します。陽性シグナルと陰性シグナルの比率が最も高いかまたは最も高いに近い点を特定することにより、ビオチン標識抗原およびRu Sulfo−NHS標識抗原に対する最適濃度を選択する。この比率計算では、負のサンプルから得られた低バックグラウンド信号を考慮します。
注:チェッカーボードアッセイからのRuスルホ-NHSおよびビオチン標識抗原タンパク質の最適濃度を以下に示します:GAD65の場合は30 ng / mLおよび200 ng / mL、プロインスリンの場合は120 ng / mLおよび120 ng / mL、IA-2の場合は10 ng / mLおよび42 ng / mL、TGの場合は80 ng / mLおよび80 ng / mL、TPOの場合は8 ng / mLおよび16 ng / mL、 ThGの場合は31 ng / mLおよび31 ng / mL、IFNαの場合は12 ng / mLおよび12 ng / mL。
4. 混合リンカー共役抗原溶液の作成
- チェッカーボードアッセイに基づいて各抗原の最適濃度を選択します。ビオチンおよびRuスルホ-NHS標識抗原を合理的な使用濃度に希釈します。
- それぞれ固有のビオチン化抗原タンパク質に異なるリンカーを結合します。1回の96ウェルプレートアッセイでは、4 μLのビオチン化GAD65、TPO、tTG、ThG、プロインスリン、IFN-αおよびIA-2タンパク質を240 μLのストレプトアビジン結合リンカー1、2、3、4、8、9、および10と混合します(図1)。次に、チューブあたり156 μLのPBS/1%BSAを追加します。混合物を室温で30分間インキュベートする。
- 160 μLのストップ溶液を各チューブに加え、室温でさらに30分間インキュベートします。各チューブから400 μLのリンカー共役抗原を採取し、7つの抗原すべてを結合します。1.2 mLの停止溶液を加え、次に4 μLのRu Sulfo-NHS標識GAD65、TPO、tTG、ThG、プロインスリン、IFN-αおよびIA-2抗原を混合物に加えます。これで、抗原溶液をアッセイに使用する準備が整いました。
5. 血清サンプルを標識抗原でインキュベートする
注:この7-PlexアッセイのECL-IAAアッセイでは血清サンプルの酸処理が必要なため、この7-Plexアッセイの標識抗原混合物とインキュベートする前に、各血清に酸処理ステップが必要です。
- 96ウェルPCRプレートに1ウェルあたり15 μLの血清を分注します。18 μLの0.5 M酢酸を各ウェルに加え、混合します。RTで45分間インキュベートします。 新しい96ウェルPCRプレートを準備し、35 μLの抗原溶液を各ウェルに分注します。
- プレートがまだインキュベートされている間に、抗原プレートのすべてのウェルに13 μLの1 M Tris pH 9.0バッファーを追加します。各ウェルの側面にバッファーを追加して、Trisバッファーと抗原の混合を制限します。インキュベーションが完了したら、25 μLの酸処理血清を取り、すぐに抗原プレート上のすべてのウェルにピペットで入れます。溶液を攪拌し、光への暴露を避けるためにPCRシーリングホイルでプレートを覆います。
- RTで、プレートを低速に設定したシェーカーに1時間置きます。その後、プレートを4°Cで保存し、プレートを18〜24時間インキュベートします。
6.マルチプレックスプレートを準備します
- 4°Cの冷蔵庫からマルチプレックスプレートを取り出し、プレートをRTにします。マルチプレックスプレートがRTになったら、150 μLの3%ブロッカーAを各ウェルに加えます。マルチプレックスプレートをシーリングホイルで覆います。プレートを4°Cの冷蔵庫で一晩インキュベートします。
注:アッセイ1日目には、ステップ4から6が含まれます。
7. 血清/抗原インキュベートをマルチプレックスプレートに移す
- 翌日、ペーパータオルをテーブルの上に置き、冷蔵庫からインキュベーションマルチプレックスプレートを取り出します。プレートからすべてのバッファーを空にします。これを行うには、プレートを逆さまにして、どのウェルにもバッファーがなくなるまで、準備したペーパータオルの上に軽くたたきます。
- 150 μLのPBSTをすべてのウェルに加えて、マルチプレックスプレートを洗浄します。手順 7.1 で説明したようにバッファーを破棄し、この手順を 3 回繰り返します。30 μLの血清/抗原インキュベートをマルチプレックスプレートのすべてのウェルに追加します。プレートをホイルで覆い、光への露出を制限します。プレートを低速に設定したプレートシェーカーにRTで1時間置きます。
8.プレートを洗浄し、読み取りバッファーを追加します
- 血清/抗原インキュベートをマルチプレックスプレートから取り出し、プレートを逆さまにして溶液をはじきます。150 μLのPBSTをすべてのウェルに加え、プレートを逆さまにして溶液をはじき出すことで、プレートからバッファーを除去します。この手順を 3 回繰り返します。3回目の洗浄が完了したら、150 μLのリーディングバッファーを各ウェルに加えます。
注意: 気泡は、プレートの結果を正確に分析するプレートリーダーマシンの能力を妨げるため、絶対に避ける必要があります。
9.プレートの読み取りとデータの分析
- 準備したプレートをプレートリーダーマシンでカウントし、すべての値をカウント/秒(CPS)で読み取ります。
- プレートリーダーマシンから得られた抗体レベルを使用して、アッセイの相対インデックスを次の式で計算します。
インデックス値 = [CPS (サンプル) - CPS (負の標準値)] / [CPS (正の標準) - CPS (負の標準)]。 - 確立されたカットオフを使用して、どの抗体結果が陰性または陽性であるかを判断します。
注:アッセイ2日目には、ステップ7から9が含まれます。
結果
アッセイ結果の解析結果を表1、表2及び表3に示した。読み取り値は、同じウェル内の10個のスポットからのデータから取得されます。各サンプルのインデックス値は、アッセイプロトコルに記載されているように、対応する内部ポジティブおよびネガティブコントロールに対して計算されました。不適切な重複の例を表 1 に示し、表 3 の最終的なインデックス計算エラーの原因となりました。すべての生のカウント値は、誤検知または偽陰性の結果を回避するためにチェックする必要があります。
7マルチプレックスECLアッセイは、T1Dと新たに診断された1026人の患者と、年齢と性別が一致した健康な対照被験者1022人のサンプルの大規模なコホートを使用して検証されました。1026人のT1D患者に対する7-Plex ECLアッセイからの自己抗体のレベルを、図2に示すように、対応する確立された各単一ECLアッセイのレベル、および図3に示すように対応する各単一標準RBAおよびELISAのレベルと比較しました。アッセイの特異性は、表4にリストされているように、3つのアッセイ方法(7-Plex ECL、単一ECL、RBAまたはELISA)すべてについて、甲状腺自己抗体(95パーセンタイルが使用された)を除くすべての自己抗体アッセイの99パーセンタイルで同一に設定されました。GADA、IA-2A、IAA、TPOA、ThGA、TGA、およびIFNαAのアッセイ間CVは、それぞれ6.4%、4.5%、9.1%、4.9%、5.7%、11.3%および5.9%である。
7つの自己抗体のそれぞれについて、各アッセイのカットオフの境界線付近に少数の不一致サンプルが見出された(図2 および 図3)。11の対照サンプル(11/1022、1.1%)は、7-Plexアッセイでのみ陽性であり、対応する各単一アッセイで陰性である複数の自己抗体が見つかりました。同様に、それはT1D患者の9つのサンプルで起こりました(9/1026、0.9%)。さらに、単一のECLアッセイとRBAの両方で見られた患者コホートの10の高陽性TPOAと1つのThGAは、7-Plexアッセイでは見逃されました。これらのサンプルは、さらに希釈したときに7-Plexアッセイで陽性に変換されました。一般に、単一のECLアッセイまたはRBAにおける陽性の100%は、 表4に例示されるのと同じアッセイ特異性を有する7-Plex ECLアッセイでカバーされた。
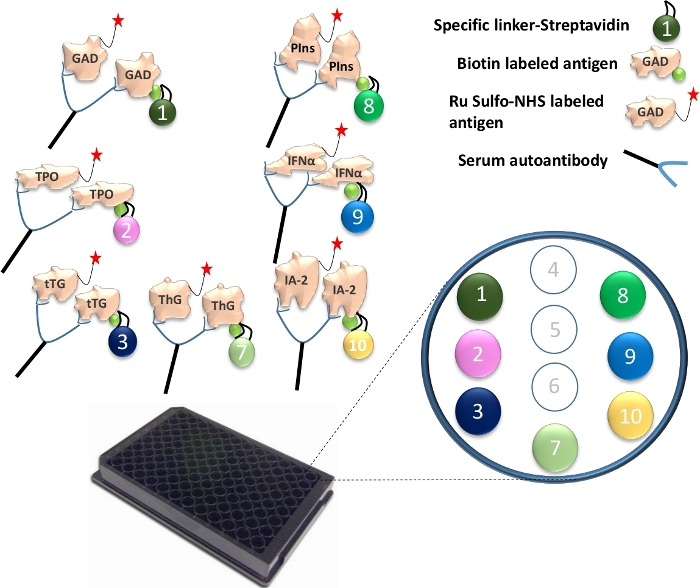
図1:マルチプレックスECLアッセイの図。
血清中の自己抗体は、Ruスルホ-NHSged抗原をビオチン化抗原に架橋します。これを特異的リンカーと結合させて、抗原-抗体-抗原-リンカーの複合体を形成する。複合体はプレート上に捕捉され、それぞれの特定のリンカーを介して特定のスポットに拘束されます。特異的に結合されたリンカー番号を、7つの異なる抗原タンパク質について、例示する。抗体シグナルの検出は、電気化学発光を伴うRu Sulfo-NHS標識抗原を用いて達成される。図はGu, Y. et al.13からのものです。 この図の拡大版を表示するには、ここをクリックしてください。
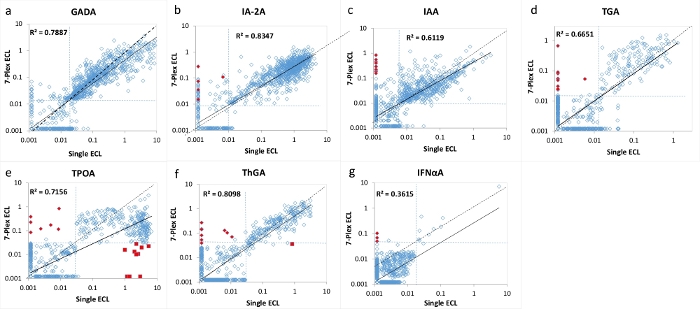
図2:T1Dの新規発症患者1026人の7つの自己抗体レベルの単一ECLアッセイと7-Plex ECLアッセイの比較。
パネルa、b、c、d、e、f、およびgは、それぞれGADA、IA-2A、IAA、TGA、TPOA、ThGA、およびIFNαAについての自己抗体レベルの比較を表示する。点線は、各自己抗体アッセイのアッセイカットオフを表す。カットオフは、シングルおよびマルチプレックスECLアッセイの両方について、1022の年齢が一致した健康な対照から、各アッセイの1022の年齢を一致させた健常対照の99パーセンタイルに設定されました(95パーセンタイルに設定されたTPOAおよびThGAを除く)。赤いクローズドダイヤモンドは、7-Plex ECLアッセイでは「偽」陽性としてマークされており、研究されたコホートの<1%であり、単一のECLとRBAの両方で陰性として検証されました。赤い近い四角は、「プロゾーン」現象によって引き起こされる7-Plex ECLアッセイで「偽」陰性としてマークされており、主に研究されたコホートの<1%のTPOAアッセイで発生します。これらの偽陽性と偽陰性の両方については、ディスカッションセクションで説明します。図はGu, Y. et al.13からのものです。この図の拡大版を表示するには、ここをクリックしてください。
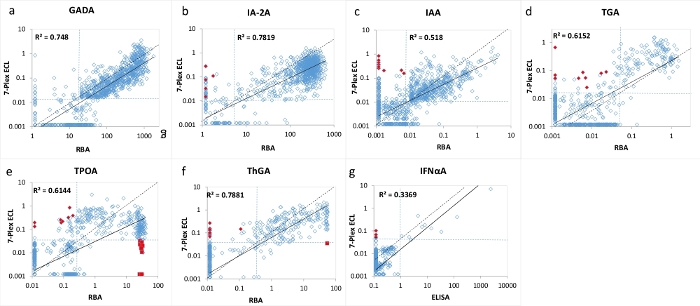
図3:1026人のT1D新規発症患者における7つの自己抗体レベルのRBA(IFNαAのELISA)と7-Plex ECLアッセイの比較。
パネルa、b、c、d、e、f、およびgは、それぞれGADA、IA-2A、IAA、TGA、TPOA、ThGA、およびIFNαAについての自己抗体レベルの比較を提示する。点線は、各自己抗体アッセイについてのアッセイカットオフを表し、 表4に示すように、RBAおよび7−Plex ECLアッセイの両方について同じ特異性セットを、1022年齢一致健常対照から表した。赤い閉じたひし形と四角形は、7-Plex ECLアッセイで現れる「偽」陽性と「偽」陰性を表し、 同じことが図2に示されています。図はGu, Y. et al.13からのものです。 この図の拡大版を表示するには、ここをクリックしてください。
| 1 | 2 | 3 | 4 | 5 | 6 | ||
| ある | 5580 | 5674 | 105 | 117 | 125 | 139 | リンカー-1 |
| 100 | 108 | 102 | 102 | 3956 | 3745 | リンカー-2 | |
| 115 | 124 | 107 | 116 | 113 | 124 | リンカー-3 | |
| 67 | 64 | 68 | 61 | 65 | 69 | リンカー-4 | |
| 89 | 87 | 98 | 92 | 90 | 80 | リンカー-5 | |
| 87 | 71 | 89 | 87 | 61 | 72 | リンカー-6 | |
| 94 | 82 | 79 | 85 | 2154 | 2280 | リンカー-7 | |
| 75 | 66 | 1628 | 1594 | 81 | 83 | リンカー-8 | |
| 98 | 103 | 71 | 84 | 69 | 85 | リンカー-9 | |
| 102 | 118 | 93 | 98 | 113 | 99 | リンカー-10 | |
| B | 324 | 337 | 147 | 148 | 5426 | 5366 | リンカー-1 |
| 101 | 102 | 93 | 88 | 86 | 74 | リンカー-2 | |
| 111 | 119 | 119 | 123 | 66 | 72 | リンカー-3 | |
| 72 | 65 | 59 | 68 | 74 | 67 | リンカー-4 | |
| 81 | 98 | 83 | 92 | 79 | 72 | リンカー-5 | |
| 90 | 84 | 93 | 86 | 70 | 76 | リンカー-6 | |
| 101 | 105 | 101 | 97 | 956 | 944 | リンカー-7 | |
| 82 | 83 | 189 | 204 | 97 | 90 | リンカー-8 | |
| 92 | 83 | 78 | 64 | 82 | 78 | リンカー-9 | |
| 83 | 79 | 88 | 93 | 4722 | 4965 | リンカー-10 | |
| C | 110 | 110 | 87 | 81 | 2114 | 2365 | リンカー-1 |
| 5526 | 5680 | 88 | 70 | 86 | 93 | リンカー-2 | |
| 114 | 132 | 67 | 71 | 3326 | 3284 | リンカー-3 | |
| 64 | 62 | 88 | 74 | 64 | 80 | リンカー-4 | |
| 94 | 82 | 86 | 75 | 89 | 76 | リンカー-5 | |
| 77 | 87 | 75 | 63 | 70 | 86 | リンカー-6 | |
| 77 | 86 | 71 | 84 | 138 | 121 | リンカー-7 | |
| 73 | 86 | 80 | 79 | 59 | 73 | リンカー-8 | |
| 86 | 74 | 5064 | 4923 | 88 | 86 | リンカー-9 | |
| 105 | 113 | 85 | 80 | 124 | 114 | リンカー-10 | |
| D | 98 | 88 | 92 | 84 | 136 | 127 | リンカー-1 |
| 288 | 291 | 86 | 86 | 558 | 564 | リンカー-2 | |
| 109 | 101 | 74 | 73 | 141 | 127 | リンカー-3 | |
| 78 | 66 | 66 | 55 | 74 | 66 | リンカー-4 | |
| 79 | 83 | 79 | 86 | 96 | 91 | リンカー-5 | |
| 83 | 86 | 96 | 89 | 86 | 73 | リンカー-6 | |
| 87 | 89 | 77 | 87 | 841 | 855 | リンカー-7 | |
| 74 | 72 | 60 | 72 | 90 | 95 | リンカー-8 | |
| 68 | 75 | 331 | 328 | 2460 | 2580 | リンカー-9 | |
| 86 | 98 | 80 | 75 | 123 | 133 | リンカー-10 | |
| E | 101 | 114 | 101 | 106 | 532 | 548 | リンカー-1 |
| 101 | 96 | 110 | 104 | 682 | 675 | リンカー-2 | |
| 6015 | 5988 | 124 | 126 | 101 | 98 | リンカー-3 | |
| 66 | 71 | 82 | 71 | 80 | 62 | リンカー-4 | |
| 102 | 97 | 99 | 80 | 83 | 110 | リンカー-5 | |
| 82 | 67 | 81 | 80 | 60 | 85 | リンカー-6 | |
| 85 | 95 | 52 | 84 | 245 | 221 | リンカー-7 | |
| 72 | 78 | 82 | 74 | 486 | 503 | リンカー-8 | |
| 77 | 97 | 97 | 77 | 56 | 66 | リンカー-9 | |
| 114 | 104 | 5726 | 5814 | 259 | 253 | リンカー-10 | |
| F | 119 | 120 | 133 | 118 | 112 | 96 | リンカー-1 |
| 101 | 91 | 100 | 95 | 96 | 82 | リンカー-2 | |
| 406 | 395 | 111 | 123 | 2127 | 101 | リンカー-3 | |
| 72 | 60 | 86 | 72 | 79 | 83 | リンカー-4 | |
| 76 | 85 | 96 | 99 | 89 | 103 | リンカー-5 | |
| 88 | 78 | 91 | 83 | 89 | 95 | リンカー-6 | |
| 104 | 97 | 87 | 102 | 56 | 66 | リンカー-7 | |
| 76 | 77 | 79 | 93 | 69 | 75 | リンカー-8 | |
| 85 | 71 | 95 | 100 | 83 | 71 | リンカー-9 | |
| 131 | 131 | 358 | 364 | 92 | 86 | リンカー-10 | |
| G | 90 | 95 | 85 | 82 | 105 | 107 | リンカー-1 |
| 99 | 86 | 77 | 76 | 1250 | 1174 | リンカー-2 | |
| 119 | 123 | 120 | 118 | 112 | 108 | リンカー-3 | |
| 76 | 83 | 77 | 80 | 86 | 76 | リンカー-4 | |
| 88 | 86 | 86 | 93 | 107 | 92 | リンカー-5 | |
| 73 | 73 | 71 | 82 | 84 | 75 | リンカー-6 | |
| 5210 | 5173 | 72 | 69 | 76 | 85 | リンカー-7 | |
| 80 | 81 | 79 | 82 | 100 | 101 | リンカー-8 | |
| 96 | 97 | 89 | 83 | 65 | 83 | リンカー-9 | |
| 98 | 103 | 86 | 88 | 1933 | 1979 | リンカー-10 | |
| H | 114 | 124 | 81 | 86 | 299 | 295 | リンカー-1 |
| 107 | 92 | 69 | 72 | 4256 | 4388 | リンカー-2 | |
| 114 | 123 | 125 | 129 | 501 | 536 | リンカー-3 | |
| 77 | 70 | 67 | 64 | 74 | 62 | リンカー-4 | |
| 92 | 110 | 81 | 84 | 77 | 71 | リンカー-5 | |
| 87 | 79 | 72 | 76 | 83 | 81 | リンカー-6 | |
| 328 | 341 | 84 | 80 | 88 | 97 | リンカー-7 | |
| 75 | 84 | 75 | 90 | 74 | 83 | リンカー-8 | |
| 73 | 79 | 78 | 76 | 84 | 70 | リンカー-9 | |
| 113 | 120 | 81 | 76 | 2372 | 2350 | リンカー-10 | |
表1:7プレックスECLアッセイの分析:生のCPSカウント(プレートの左半分)。 生のCPSカウントはアッセイプレート(プレートの左半分)から取得され、各サンプルは重複して実行されます。プレート(A〜H)の各行の下には、同じウェル内の10個のスポットからのデータを表す10行の読み取り値があり、マークされた各リンカー番号に対応する。不正な重複の例は、行 F リンカー 3 列 5 および 6 に示すように、灰色で強調表示されます。
| 表1Aの行 | 表1Aの列 | リンカ 1 | リンカ 2 | リンカ 3 | リンカー 7 | リンカー 8 | リンカー 9 | リンカ 10 | |
| ある | 1-2 | ガダパソコン | 5627 | 104 | 120 | 88 | 71 | 101 | 110 |
| B | 1-2 | ガダローPC | 331 | 102 | 115 | 103 | 83 | 88 | 81 |
| C | 1-2 | TPOA PC | 110 | 5603 | 123 | 82 | 80 | 80 | 109 |
| D | 1-2 | TPOAローPC | 93 | 290 | 105 | 88 | 73 | 72 | 92 |
| E | 1-2 | TGA PC | 108 | 99 | 6002 | 90 | 75 | 87 | 109 |
| F | 1-2 | TG ロー PC | 120 | 96 | 401 | 101 | 77 | 78 | 131 |
| G | 1-2 | ThGA PC | 93 | 93 | 121 | 5192 | 81 | 97 | 101 |
| H | 1-2 | ThGAローPC | 119 | 100 | 119 | 335 | 80 | 76 | 117 |
| ある | 3-4 | ティッカー | 111 | 102 | 112 | 82 | 1611 | 78 | 96 |
| B | 3-4 | IAAローPC | 148 | 91 | 121 | 99 | 197 | 71 | 91 |
| C | 3-4 | IFNaA PC | 84 | 79 | 69 | 78 | 80 | 4994 | 83 |
| D | 3-4 | IFNaA 低パソコン | 88 | 86 | 74 | 82 | 66 | 330 | 78 |
| E | 3-4 | IA-2A パソコン | 104 | 107 | 125 | 68 | 78 | 87 | 5770 |
| F | 3-4 | IA-2A ローパソコン | 126 | 98 | 117 | 95 | 86 | 98 | 361 |
| G | 3-4 | ノースカロライナ州 | 84 | 77 | 119 | 71 | 81 | 86 | 87 |
| H | 3-4 | ノースカロライナ州 | 84 | 71 | 127 | 82 | 78 | 77 | 79 |
| ある | 5-6 | サンプル1 | 132 | 3851 | 119 | 2217 | 82 | 77 | 106 |
| B | 5-6 | サンプル2 | 5396 | 80 | 69 | 950 | 94 | 80 | 4844 |
| C | 5-6 | サンプル3 | 2240 | 90 | 3305 | 130 | 66 | 87 | 119 |
| D | 5-6 | サンプル4 | 132 | 561 | 134 | 848 | 93 | 2520 | 128 |
| E | 5-6 | サンプル5 | 540 | 679 | 100 | 233 | 495 | 61 | 256 |
| F | 5-6 | サンプル6 | 104 | 89 | 1114 | 61 | 72 | 77 | 89 |
| G | 5-6 | サンプル7 | 106 | 1212 | 110 | 81 | 101 | 74 | 1957 |
| H | 5-6 | サンプル8 | 297 | 4322 | 519 | 93 | 79 | 77 | 2361 |
表2:7プレックスECLアッセイの分析:7リンカーとしてマークされた表1データの配置。表1のデータを再配置し、リンカー4〜6(未使用)を削除し、表1の各重複読み取り値から平均値を算出した。特定のリンカーによって拘束された各自己抗体アッセイに対応する内部標準の高および低ポジティブコントロールの値は、濃い太字で示されています。PC、ポジティブコントロール。NC、ノーマルコントロール。
| GADインデックス | TPOA-Index | TGAインデックス | ThGA-インデックス | IAAインデックス | IFNaA-Index | IA-2A-インデックス | |
| ガダパソコン | 1.000 | 0.005 | 0.000 | 0.003 | -0.006 | 0.003 | 0.004 |
| ガダローPC | 0.045 | 0.005 | -0.001 | 0.006 | 0.002 | 0.000 | -0.001 |
| ティッカー | 0.005 | 1.000 | 0.001 | 0.002 | -0.001 | -0.001 | 0.004 |
| IAAローPC | 0.002 | 0.039 | -0.002 | 0.003 | -0.005 | -0.003 | 0.001 |
| IA-2A パソコン | 0.004 | 0.004 | 1.000 | 0.004 | -0.004 | 0.000 | 0.004 |
| IA-2A ローパソコン | 0.007 | 0.004 | 0.048 | 0.006 | -0.002 | -0.002 | 0.008 |
| TGA PC | 0.002 | 0.003 | 0.000 | 1.000 | 0.000 | 0.002 | 0.002 |
| TG ロー PC | 0.006 | 0.004 | 0.000 | 0.052 | -0.001 | -0.002 | 0.005 |
| TPOA PC | 0.005 | 0.005 | -0.001 | 0.002 | 1.000 | -0.002 | 0.001 |
| TPOAローPC | 0.012 | 0.003 | 0.000 | 0.006 | 0.076 | -0.003 | 0.001 |
| ThGA PC | 0.000 | 0.000 | -0.008 | 0.001 | 0.000 | 1.000 | -0.001 |
| ThGAローPC | 0.001 | 0.002 | -0.008 | 0.002 | -0.009 | 0.050 | -0.002 |
| IFNaA PC | 0.004 | 0.006 | 0.001 | 0.000 | -0.002 | 0.000 | 1.000 |
| IFNaA 低パソコン | 0.008 | 0.004 | 0.000 | 0.005 | 0.004 | 0.002 | 0.048 |
| ノースカロライナ州 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| ノースカロライナ州 | 0.000 | -0.001 | 0.001 | 0.002 | -0.002 | -0.002 | -0.001 |
| サンプル1 | 0.009 | 0.683 | 0.000 | 0.419 | 0.001 | -0.002 | 0.003 |
| サンプル2 | 0.958 | 0.001 | -0.008 | 0.172 | 0.009 | -0.001 | 0.837 |
| サンプル3 | 0.389 | 0.002 | 0.542 | 0.012 | -0.009 | 0.000 | 0.006 |
| サンプル4 | 0.009 | 0.088 | 0.003 | 0.152 | 0.008 | 0.496 | 0.007 |
| サンプル5 | 0.082 | 0.109 | -0.003 | 0.032 | 0.271 | -0.005 | 0.030 |
| サンプル6 | 0.004 | 0.002 | 0.169 | -0.002 | -0.006 | -0.002 | 0.000 |
| サンプル7 | 0.004 | 0.205 | -0.002 | 0.002 | 0.013 | -0.002 | 0.329 |
| サンプル8 | 0.039 | 0.768 | 0.068 | 0.004 | -0.001 | -0.002 | 0.400 |
表3:7プレックスECLアッセイの分析:指標値の結果。 7つの自己抗体アッセイ全てについての各サンプルのインデックス値は、アッセイプロトコルに記載されているように、それらの対応する内部陽性および陰性対照に対して計算した。カットオフ値より大きいインデックス値は、濃い太字で示され、正の結果として定義されました。sample6のTGAインデックス値は、 表1のFリンカー3列目5列目と6行目に示されている不正な重複が原因で発生したエラーであるため、灰色で強調表示されています。
| ガダ | IA-2A | ティッカー | .TGA | ティッカー | ティッカー | IFNαA* | ||||||||
| センス | 仕様 | センス | 仕様 | センス | 仕様 | センス | 仕様 | センス | 仕様 | センス | 仕様 | センス | 仕様 | |
| ティッカー | 73.4% | 98.5% | 75.2% | 99.0% | 47.7% | 99.1% | 12.9% | 99.0% | 23.9% | 95.2% | 19.3% | 94.7% | 1.0% | 99.6% |
| シングル ECL | 71.6% | 99.1% | 73.6% | 99.3% | 48.3% | 99.7% | 16.0% | 98.9% | 26.3% | 94.9% | 20.6% | 95.1% | 0.8% | 99.2% |
| 7 プレックス ECL | 71.2% | 98.9% | 77.3% | 98.9% | 49.5% | 98.9% | 16.5% | 98.7% | 26.1% | 94.7% | 21.1% | 94.7% | 1.7% | 99.1% |
表4:7プレックスECLアッセイにおける1026人のT1D患者と1022人の対照者におけるアッセイの感度と特異度を、対応する単一のECLアッセイおよびRBAまたはELISA*と比較した、年齢と性別の両方で一致させました。各自己抗体について異なるアッセイ(RBA、単一ECLおよび7-Plex ECL)を、1022年齢および性別が一致した健常対照を用いて同様の特異性に設定した。研究した対照コホートからの特異性の結果は、TPOAとThGAで約95%、他の5つのアッセイで99%に設定されました。*アスタリスクはELISAのIFNαAアッセイを示し、その他はRBAです。
ディスカッション
1型糖尿病に関する多数の国内および国際的な臨床試験において、セリアック病のトランスグルタミナーゼ(TGA)に対する膵島自己抗体および自己抗体を検出するための単一ECLアッセイの性能が実証されています8、9、10、11。これらのトレイルを通じて、このアッセイは、既存の「ゴールド」スタンダードRBAに対して評価した場合、自己抗原検出の感度と特異性を高めました。疾患特異性の増強は、単一のECLアッセイとRBA14,15,16,17との間で、低リスク、低親和性のシグナルから高親和性および高リスクの膵島自己抗体を区別するときに見ることができます。単一のECLアッセイに基づいて、T1Dといくつかの適用可能な自己免疫疾患を同時にスクリーニングできるようにするために、新しいハイスループットマルチプレックスECL自己抗体アッセイを提示します。
マルチプレックスECLアッセイは、最大10個の自己抗体アッセイを1つのウェルに組み合わせることができるマルチプレックスプレートを使用します。本研究では、7つの自己抗体アッセイを組み合わせています。自己抗体は、3つのIAbs(IAA、GADA、およびIA-2A)、2つの自己免疫性甲状腺疾患自己抗体(TPOAおよびThGA)、セリアック病自己抗体(TGA)、およびインターフェロンアルファに対するAPS-1自己抗体(IFNαA)で構成されています。アッセイ機構は、一般に、以前に公開された9、10、12、18のような単一のECLアッセイに基づいており、いくつかの修正が加えられている。マルチプレックスECLアッセイと単一のECLアッセイの主な違いは、液相で形成される各抗体抗原複合体が特定のリンカーに拘束されることです(図1)。ビオチン標識抗原は、特定の抗原リンカー複合体を形成するために使用されるリンカーであるストレプトアビジン結合体と共にインキュベートされる。抗体-抗原免疫複合体は、患者血清とのインキュベーション後に形成され、マルチプレックスプレートの各ウェル上の特異的リンカーシステムを介して特定のスポットに捕捉されます。抗体によって捕捉されたRuスルホ−NHS標識抗原は、同時に電気化学発光を伴うシグナルを提供する。プレートリーダーマシンは、各ウェルにあるスポットソースから最大10の異なる信号を検出できます。プレート間で自己抗体アッセイの一貫性を保つため、また長期研究を実施するために、同じリンカーを使用することをお勧めします。
マルチプレックスECLアッセイを設定する前に、各自己抗体の単一ECLアッセイをそれぞれマルチプレックスプレート上で最適化し、通常のECLプレート上のRBAアッセイと単一ECLアッセイの両方に対して検証する必要があります。チェッカーボードアッセイを強化するために、マルチプレックスプレート上の関連する自己抗体アッセイに、陽性の高い患者および陰性の患者サンプルを使用した。チェッカーボードアッセイを実施した後、Ru Sulfo−NHSおよびビオチン標識抗原に対する最も理想的な濃度を、7つの自己抗体アッセイのそれぞれについて計算したところである。以下はこれらの濃度を示しています:GAD65の場合は30 ng / mLおよび200 ng / mL、プロインスリンの場合は120 ng / mLおよび120 ng / mL、IA-2の場合は10 ng / mLおよび42 ng / mL、TGの場合は80 ng / mLおよび80 ng / mL、TPOの場合は8 ng / mLおよび16 ng / mL、ThGの場合は31 ng / mLおよび31 ng / mL、 IFNα 13についてはそれぞれ12 ng/mLおよび12 ng/mLです。チェッカーボードアッセイからのいくつかの抗原の濃度は、すべてのアッセイを組み合わせた後、実際のマルチプレックスアッセイの結果に応じてさらに調整する必要がある場合があります。
IAAは本マルチプレックスECLアッセイに含まれているため、以前の研究12で報告されているように、血清を抗原とインキュベートする前に血清サンプルの酸処理が必須です。一般に、追加の自己抗体をマルチプレックスアッセイに追加すると、アッセイのバックグラウンドが影響を受け、ウェル内の1つのスポットからの非常に高いシグナルがクロストークを介して近くのスポットの結果を妨げる可能性があります。したがって、最大CPSは、自己抗体ごとに20,000カウントに制限する必要があり、最も高い陽性サンプルについてはそれ以下である必要があります。我々の知る限り、関与するクロストークの量を減らすために、スポットマップを設計する際に、バックグラウンドの低い自己抗体を、カウント頻度の高いスポットから遠く離れて分離する必要があります。
高い陽性および陰性対照は、試験対象の未知のサンプルの正確な指標を計算するために、すべてのアッセイで内部的に使用されました。アッセイの感度を正確に評価および監視するために、アッセイの上限近くに設定された低ポジティブコントロールを使用しました。これらの標準的なポジティブコントロールとネガティブコントロールは、長期間使用するためにバルクおよびアリコートで作成され、アッセイ間の一貫性のために-20°C以下で保存されました。品質保証の目的で、サンプルはすべてのアッセイで2回実行され、すべての陽性結果が再実行され、翌日新しいECLアッセイでサンプルを実行することによって確認されました。1回目および2回目の確認アッセイに不一致があった場合は、3回目のアッセイが必要でした。実施された3つのアッセイのうち、一致する2つのアッセイの結果(例えば、+、+または-,-)を、試料の最終結果(陽性または陰性)と決定した。
過去10年間で、多くの研究グループは、複数の自己抗体アッセイを1つのウェルに組み合わせて大規模な集団をスクリーニングするマルチプレックス法を利用したハイスループットアッセイを求めています。マルチプレックス自己抗体アッセイを実施するために異なるタイプの技術を使用しているいくつかの研究があります19、20、21、22、しかし、T1Dを研究する場合、感度と特異性において現在の「ゴールド」スタンダードRBAと比較することはできません。使用されるこれらの異なるタイプのプラットフォームは、国際的な膵島自己抗体標準化プログラム(IASP)ワークショップや臨床試験での大規模なコホートのテストを通じて検証されていません。ドイツでの最近の一般集団ベースのスクリーニングでは、Kronusが配布するハイスループット複合アッセイである3 Screen ICATM ELISAが、小児T1D23の早期診断を達成するために、3つのIAb、GADA、IA-2A、およびZnT8Aを検出するための一次スクリーニングのツールとして使用されています。3-Screen ELISAアッセイは、3つの分離されたウェル(大量の血清を消費する)、または3つのアッセイすべてが混合された単一のウェルのいずれかで3つの自己抗体を測定します。3-Screen ELISAアッセイの1つのウェルが陽性の場合、3つの自己抗体のどれが存在するかを区別することはできません。このアッセイの最大の欠点は、IAA測定を含めることができないことです。IASPワークショップで証明されているように、ELISAによって実行されたすべてのIAA結果は、許容できる感度と特異性を持っていません24。IAAは通常、最初に出現したIAbであり、幼児の間で高い有病率を示しています。IAbスクリーニングは、IAAとともに、子供に必要であり、コミュニティにおけるT1Dリスクを評価するためにIAAなしでこのスクリーニングを実施することは受け入れられないとみなされます。さらに、Kronus IAbキットアッセイがよりT1D疾患特異的であり、高リスクと低リスクIAbを区別できることを示す発表された研究またはデータはありません。本研究では、7-Plex ECLアッセイは、T1D13と新たに診断された患者の大規模なコホートを使用して検証されました。現在の標準的なRBAおよび十分に確立された単一ECLアッセイと比較して、7-Plexアッセイは同じアッセイ特異性で100%の陽性を保持することができます(表4)。現在、4-Plex ECLアッセイは、標準RBAと並行して、進行中の大規模な臨床試験である子供のための自己免疫スクリーニング(ASK)研究に適用されています。この試験では、デンバー大都市圏の一般集団の子供たちを1型糖尿病とセリアック病についてスクリーニングします。ASK試験で使用された標準的なRBAと比較して、マルチプレックスECLアッセイは、単一のECL試験を使用した以前の報告と同じ、優れた感度とより高い疾患特異性を示しています25。さらに、当社の4-Plex ECLアッセイは、ECLおよびRBAの対応する4つの単一アッセイと比較して、人件費、コスト、および血清量の顕著な減少を示しました。マルチプレックスECLアッセイを使用すると、異なる自己抗体(最大10個)を表す異なる番号で各ウェルをカスタマイズして、特定の臨床現場のニーズに固有のさまざまな自己免疫疾患を検査できます。
本研究で示されているように、マルチプレックスプレートを使用したマルチプレックスECLアッセイにはいくつかの制限が観察されています。抗原とともにインキュベートした血清の最終希釈は、単一のウェルに組み合わせたすべての自己抗体アッセイに最適な条件が得られるように調整することはできません。T1D患者からの9つのサンプル(9/1026)は、特定の自己抗体に対して偽陰性の結果を有することが観察された。7-Plex ECLアッセイでは、偽陰性のうち7件はTPOAで、2件はThGAであったが、単一のECLアッセイとRBAの両方で高い陽性結果が示された(図2 & 3)。9つのサンプルすべてをさらに希釈した後、マルチプレックスプレート上で陽性になりました。この結果は、私たちが「プロゾーン」現象と呼んでいるものによって引き起こされます。この現象により、高い抗体価が抗原抗体格子の形成に影響を与えているため、サンプルは偽陰性の結果を示します。マルチプレックスアッセイを設定する場合、結合した自己抗体のそれぞれについて非常に高い力価を持つサンプルは、抗原インキュベーション用の血清の任意の希釈を特定するために事前テストを実行することをお勧めします。あるいは、同様の最適化された条件を有する自己抗体アッセイを選択して、各自己抗体について最良のアッセイ感度および特異性が達成される複合アッセイを形成するべきである。本研究では、健康な正常対照からの7つのサンプル(7/1022)は、7-Plexアッセイで複数の自己抗体の偽陽性をもたらしましたが、単一のECLアッセイとRBA(図2 と 3)を実行した後、これらの自己抗体は両方のアッセイで陰性であることがわかりました。これらのサンプルの小さなサブセットについて、マルチプレックスプレートで発生するこれらの偽陽性結果の背後にある理由は、現在不明です。マルチプレックスECLアッセイの現在のアプリケーションでは、すべての陽性サンプルを対応する単一のECLアッセイで繰り返して陽性を確認し、マルチプレックスECLアッセイからこの偽陽性エラーを取り除きます。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、NIH助成金DK32083、JDRF助成金2-SRA-2015-51-Q-Rおよび2-SRA-2018-533-S-Bによってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 4 °C refrigerator | |||
| –80 °C and -20 °C freezers | |||
| 96-well Plate Shaker | Wallac - Delfi | ||
| 96-well round bottom plate | Fisher | 8408220 | |
| Acetic acid solution | Fisher | ||
| Aluminum foil | |||
| Antigen proteins | |||
| Human GAD65 full length protein | Diamyd | ||
| Human ThG full length protein | BioMart | ||
| Human TPO full length protein | BioMart | ||
| IA-2 intracellular domain protein | BioMart | ||
| IFN-α protein | Abcam | ||
| Proinsulin protein | AmideBio | ||
| tTG protein | DiaRect | ||
| Biotin | Sigma | ||
| Bottle-Top 500 mL , Filter Units | Fisher | 0974064A or B | |
| Bovine Serum Albumin | Sigma | A-7906 | |
| Distilled deionized (DD) water | |||
| HCl | Fisher | ||
| Ice maker | |||
| Ice trays | |||
| MSD Sector | Perkin-Elmer | ||
| Multi-channel pipette | |||
| NaOH | |||
| Paper tower | |||
| PBS | |||
| pH meter | |||
| Pipette-Aid | |||
| Pipettes/tips | |||
| Ru Sulfo-NHS | MSD (R91AN) | ||
| Trizma Base | Fisher | BP152-5 | |
| Tween 20 | Sigma | P-1379 | |
| Uplex Development Kit | MSD | ||
| 96-well UPlex plate | MSD | ||
| Blocker A | MSD | R93AA | |
| Linker-Streptavidin | MSD | ||
| Read buffer | MSD | R92TC | |
| Stop Solution | MSD | ||
| Vortex mixer | |||
| ZeBa Column | Pierce | 89892 |
参考文献
- Harjutsalo, V., Sjoberg, L., Tuomilehto, J. Time trends in the incidence of type 1 diabetes in Finnish children: a cohort study. Lancet. 371 (9626), 1777-1782 (2008).
- Vehik, K., et al. Increasing incidence of type 1 diabetes in 0- to 17-year-old Colorado youth. Diabetes Care. 30 (3), 503-509 (2007).
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Insel, R. A., et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 38 (10), 1964-1974 (2015).
- Barker, J. M., et al. Autoantibody "subspecificity" in type 1 diabetes: risk for organ-specific autoimmunity clusters in distinct groups. Diabetes Care. 28 (4), 850-855 (2005).
- Triolo, T. M., et al. Additional Autoimmune Disease Found in 33% of Patients at Type 1 Diabetes Onset. Diabetes Care. 34 (5), 1211-1213 (2011).
- de Graaff, L. C., Smit, J. W., Radder, J. K. Prevalence and clinical significance of organ-specific autoantibodies in type 1 diabetes mellitus. Netherlands Journal of Medicine. 65 (7), 235-247 (2007).
- Yu, L., et al. Proinsulin/Insulin autoantibodies measured with electrochemiluminescent assay are the earliest indicator of prediabetic islet autoimmunity. Diabetes Care. 36 (8), 2266-2270 (2013).
- Yu, L., et al. Distinguishing persistent insulin autoantibodies with differential risk: nonradioactive bivalent proinsulin/insulin autoantibody assay. Diabetes. 61 (1), 179-186 (2012).
- Miao, D., et al. GAD65 autoantibodies detected by electrochemiluminescence assay identify high risk for type 1 diabetes. Diabetes. 62 (12), 4174-4178 (2013).
- Gu, Y., Zhao, Z., High, H., Yang, T., Yu, L. Islet Autoantibody Detection by Electrochemiluminescence (ECL) Assay. Journal of Clinical & Cellular Immunology. 8 (6), (2017).
- Gu, Y., et al. Electrochemiluminescence Assays for Human Islet Autoantibodies. Journal of Visualized Experiments. (133), e57227 (2018).
- Gu, Y., et al. High-throughput multiplexed autoantibody detection to screen type 1 diabetes and multiple autoimmune diseases simultaneously. Ebiomedicine. 47, 365-372 (2019).
- Dongmei, M., A, K. S., Li Zh, K., Michelle, G., Ling, J., Taylor, A. Electrochemiluminescence Assays for Insulin and Glutamic Acid Decarboxylase Autoantibodies Improve Prediction of Type 1 Diabetes Risk. Diabetes Technology & Therapeutics. 17 (2), 119-127 (2015).
- Steck, A. K., et al. ECL-IAA and ECL-GADA Can Identify High-Risk Single Autoantibody-Positive Relatives in the TrialNet Pathway to Prevention Study. Diabetes Technology & Therapeutics. 18 (7), 410-414 (2016).
- Fouts, A., et al. Do Electrochemiluminescence Assays Improve Prediction of Time to Type 1 Diabetes in Autoantibody-Positive TrialNet Subjects. Diabetes Care. 39 (10), 1738-1744 (2016).
- Sosenko, J. M., et al. The Use of Electrochemiluminescence Assays to Predict Autoantibody and Glycemic Progression Toward Type 1 Diabetes in Individuals with Single Autoantibodies. Diabetes Technology & Therapeutics. 19 (3), 183-187 (2017).
- Zhao, Z., et al. Higher Sensitivity and Earlier Identification of Celiac Disease Autoimmunity by a Nonradioactive Assay for Transglutaminase Autoantibodies. Journal of Immunology Research. 2016, 5 (2016).
- Zhang, B., Kumar, R. B., Dai, H., Feldman, B. J. A plasmonic chip for biomarker discovery and diagnosis of type 1 diabetes. Nature Medicine. 20 (8), 948-953 (2014).
- Tsai, C. T., Robinson, P. V., Spencer, C. A., Bertozzi, C. R. Ultrasensitive Antibody Detection by Agglutination-PCR (ADAP). American Chemical Society Central Science. 2 (3), 139-147 (2016).
- Yim, S. W., et al. Four-color alternating-laser excitation single-molecule fluorescence spectroscopy for next-generation biodetection assays. Clinical chemistry. 58 (4), 707-716 (2012).
- Bale, S. S., et al. A highly sensitive microsphere-based assay for early detection of Type I diabetes. Technology. 02 (03), 200-205 (2014).
- Ziegler, A. G., et al. 3 Screen ELISA for High-Throughput Detection of Beta Cell Autoantibodies in Capillary Blood. Diabetes Technology & Therapeutics. 18 (11), 687-693 (2016).
- Schlosser, M., et al. Diabetes Antibody Standardization Program: evaluation of assays for insulin autoantibodies. Diabetologia. 53 (12), 2611-2620 (2010).
- Zhao, Z., et al. A multiplex assay combining insulin, GAD, IA-2 and transglutaminase autoantibodies to facilitate screening for pre-type 1 diabetes and celiac disease. Journal of Immunological Methods. 430, 28-32 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved