Method Article
Высокопроизводительный электрохемилюминесцентный 7-plex анализ одновременно скрининг на диабет 1 типа и множественные аутоиммунные заболевания
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы моделируем простой мультиплексированный анализ ECL, который объединяет 7 анализов аутоантител вместе. Анализ способен проводить скрининг на СД1 и множество других аутоиммунных заболеваний одновременно, включая целиакию, аутоиммунное заболевание щитовидной железы и аутоиммунный полигландулярный синдром 1.
Аннотация
Островковые аутоантитела (IAbs) широко используются в диагностике и прогнозировании диабета 1 типа (T1D). Четыре основных IAbs к инсулину (IAA), глутаматдекарбоксилазе-65 (GADA), антигену инсулиномы-2 (IA-2A) и транспортеру цинка-8 (ZnT8A) одинаково важны для прогнозирования заболеваний. В настоящее время до 40% пациентов с диагнозом СД1 продолжают развивать другие аутоиммунные расстройства. К сожалению, современные методы скрининга с использованием одного аутоантитела для измерения являются трудоемкими и неэффективными для крупномасштабных скрининговых исследований. Недавно мы разработали простой мультиплексированный электрохемилюминесцентный анализ (ECL) для решения этих текущих проблем. Анализ объединяет все 7 тестов аутоантител в одну лунку. Каждая скважина включает в себя три IAb (IAA, GADA и IA-2A), аутоантитела к тиреоидной пероксидазе (TPOA) и глобулину щитовидной железы (ThGA) для выявления аутоиммунного заболевания щитовидной железы, аутоантитела к тканевой трансглутаминазе (TGA) для целиакии и аутоантитела к интерферону альфа (IFNαA) для аутоиммунного полигландулярного синдрома-1 (APS-1); все из которых скрининг на СД1 и другие соответствующие аутоиммунные заболевания, одновременно. Мультиплексный анализ ECL основан на одной платформе анализа ECL, но вместо этого использует мультиплексную пластину, объединяющую несколько анализов аутоантител, до 10, в одну лунку. Основное отличие от одиночного анализа ECL заключается в том, что каждый комплекс антитело-антиген, образующийся в жидкой фазе, удерживается на определенном месте на каждой скважине через линкерную систему на мультиплексной пластине. Анализ 7-Plex ECL в настоящем исследовании проверяется на основе стандартных радиосвязывающих анализов (RBA) и одиночных анализов ECL с использованием большой когорты недавно диагностированных пациентов с СД1 и соответствующих возрасту здоровых контрольных групп, что приводит к отличной чувствительности и специфичности анализа.
Введение
Диабет 1 типа (СД1) является серьезным хроническим заболеванием, которое наиболее распространено в детском возрасте. В настоящее время около 1,4 миллиона человек имеют СД1 в Соединенных Штатах; Поразительно, что заболеваемость СД1 неуклонно растет на 3-5% каждый год во всем мире и удвоилась за последние два десятилетия, особенно у детей младшего возраста 1,2. Островковые аутоантитела (IAbs) в кровообращении являются наиболее надежным биомаркером в настоящее время. IAbs может появиться за несколько лет до того, как клинический T1D разовьется3. В настоящее время четыре основных IAb широко используются в диагностике СД1 и скрининге риска, включая аутоантитела к инсулину (IAA), глутаматдекарбоксилазе-65 (GADA), антиген инсулиномы-2 (IA-2A) и транспортер цинка-8 (ZnT8A). Эти четыре IAb одинаково важны для прогнозирования развития T1D. Классификация T1D была недавно переопределена как наличие ≥2 любых 4 IAbs с нормальным метаболизмом глюкозы как стадия заболевания 14.
В исследовании диабета аутоиммунитета у молодых (DAISY) было выявлено, что каждый четвертый ребенок, подверженный риску СД1, вероятно, прогрессировал до островкового, целиакии, щитовидной железы или ревматоидного аутоиммунитета и, что более поразительно, примерно у 40% пациентов, у которых был диагностирован СД1, в конечном итоге развивается дополнительное аутоиммунное состояние 5,6,7. . Идентификация аутоантител имеет важное значение для прогнозирования и диагностики этих аутоиммунных заболеваний и должна обеспечивать лучшую клиническую помощь пациентам. В настоящее время не существует простого и недорогого способа скрининга этих множественных аутоиммунных состояний. Современные методы скрининга с использованием стандартного радиосвязывающего анализа (RBA) с одним измерением аутоантител являются трудоемкими и неэффективными для крупномасштабного скрининга.
Здесь мы будем описывать недавно разработанный простой мультиплексированный анализ ECL, который мы аутентифицировали с использованием одной платформы анализа ECL 8,9,10,11. Мультиплексный анализ ECL объединяет 7 тестов аутоантител в одну лунку, используя только 15 мкл сыворотки, и способен одновременно проводить скрининг на СД1 и несколько соответствующих аутоиммунных заболеваний, включая целиакию, аутоиммунное заболевание щитовидной железы и APS-1. Анализ ZnT8A ECL не был разработан в то время и не был включен в мультиплексированный анализ. Мультиплексный анализ ECL обеспечивает отличный инструмент для высокой пропускной способности в общем скрининге населения на СД1 и множественные аутоиммунные заболевания.
протокол
Протокол исследования был одобрен Колорадским советом по множественному институциональному обзору.
1. Подготовка буфера
- Создайте буфер маркировки (2x PBS, pH 7.9). Используя 400 мл дистиллированной деионизированной (DD) воды, добавьте 100 мл 10x PBS. Чтобы отрегулировать рН раствора, добавляют NaOH до тех пор, пока он не достигнет 7,9.
- Создание 3 мМ биотина путем растворения 1 мг биотина в 588 мкл ранее созданного буфера маркировки. Получают 3 мМ Ru Sulfo-NHS путем растворения 150 нмоль Ru Sulfo-NHS в 50 мкл буфера маркировки.
- Сделайте буфер антигена (1% BSA), взяв 500 мл 1x PBS и добавив 5 г бычьего сывороточного альбумина (BSA) в раствор. Приготовить 0,5 М раствора уксусной кислоты. Подготовьте 1 М буфера Tris-HCl с помощью Trizma Base и регулируя рН до 9,0.
- Для буфера покрытия (3% Blocker A) возьмите 500 мл 1x PBS и добавьте 15 г Blocker A. Подготовьте буфер промывки (0,05 % Tween 20, PBST), смешав 5000 мл 1x PBS с 2,5 мл Tween 20. Создайте буфер считывания (2x Read Buffer T с поверхностно-активным веществом), добавив 500 мл воды DD и 500 мл 4x Read Buffer T с поверхностно-активным веществом.
ПРИМЕЧАНИЕ: Для обеспечения согласованности между анализами важно, чтобы растворы биотина и Ru Sulfo-NHS создавались непосредственно перед процедурой маркировки и не создавались и хранились для будущего использования.
2. Маркировка каждого белка антигена биотином и Ru Sulfo-NHS отдельно
ПРИМЕЧАНИЕ: Чтобы иметь более эффективную реакцию маркировки, используйте концентрацию белка антигена ≥0,5 мг / мл.
- Рассчитайте молярное число каждого белка антигена и молярные числа биотина и Ru Sulfo-NHS. Добавьте надлежащее количество биотина или Ru Sulfo-NHS к белку антигена для маркировки реакции в соответствии с молярным отношением белка антигена к биотину или Ru Sulfo-NHS.
- Для антигена, который имеет меньшую молекулярную массу (≤10 кДа), такого как белок проинсулина, используют молярное соотношение 1:5 (антиген: биотин и Ru Sulfo-NHS). Для антигена, который имеет большую молекулярную массу (>50 кДа), такого как белок GAD, используют молярное соотношение 1:20. Для антигена, который имеет среднюю молекулярную массу (10-50 кДа), используйте молярное соотношение, скорректированное между 1:5-1:20.
- Как для биотина, так и для Ru Sulfo-NHS, разделите вес каждого антигена на соответствующие им молекулярные массы, чтобы получить молярное число антигена для каждого из них. Разделите молярное число на концентрацию, чтобы получить объем для биотина. Повторите это для Ru Sulfo-NHS.
- Смешайте белок антигена с биотином, используя правильное молярное соотношение, определенное на этапе 2.2. Затем сделайте то же самое для Ru Sulfo-NHS.
ПРИМЕЧАНИЕ: Для эффективности реакции маркировки любые восстанавливающие химические вещества, такие как Tris или глицин в буферной системе, должны быть заменены на 2x буфер PBS, pH 7,9 с помощью размерной спиновой колонки. Протоколы маркировки биотина и Ru Sulfo-NHS идентичны. - Накройте реакционные трубки алюминиевой фольгой и инкубируйте их при комнатной температуре (RT) в течение 1 ч. Причина, покрывающая реакционные трубки фольгой, заключается в том, что и биотин, и реагенты Ru Sulfo-NHS чувствительны к свету.
- Загрунтуйте спиновую колонну объемом 2 мл или 5 мл во время инкубации реакционных трубок (размер спиновой колонны определяется объемом, загруженным на колонну). Заполните столбик спина 2x PBS буфером, а затем центрифугируйте его при 1000 x g в течение 2 минут каждый раз, в общей сложности три раза.
- Прекратите реакцию маркировки после того, как реакционные трубки закончат инкубацию. Чтобы остановить реакцию, очистите меченый белок антигена, пропустив его через спиновую колонку один раз. Затем центрифугируют колонну при 1000 х г в течение 2 мин.
- Рассчитайте общую концентрацию меченого антигена, разделив количество присутствующего белка антигена на конечный объем. Aliquot 50 мкл очищенного меченого антигенного белка на пробирку и хранить аликвоты при -80 °C для длительного использования.
ПРИМЕЧАНИЕ: Важно знать, что каждый раз, когда спин-колонка пропускает белок антигена, скорость удержания будет составлять около 90-95%.
3. Определите наилучшую концентрацию и соотношение для двух меченых антигенов для анализа (шахматного анализа)
ПРИМЕЧАНИЕ: Поскольку анализ ECL-IAA в этом анализе 7-Plex требует кислотной обработки образцов сыворотки, шахматный анализ для каждого антигена должен пройти этот этап перед инкубацией с меченой смесью антигенов.
- Примените шахматный анализ для каждого антигена отдельно перед запуском мультиплексного анализа. В шагах 3.2-3.6 в качестве примера будет использоваться GAD65.
- Рассчитайте разбавление меченого белка GAD65. Рекомендуемая целевая концентрация первого раствора смеси биотинилированного GAD65 составляет 2000 нг/мл, а Ru Sulfo-NHS с маркировкой GAD65 составляет 1000 нг/мл. Если концентрация как биотинилированных, так и Ru Sulfo-NHS с маркировкой GAD65 в исходном растворе составляет 1,0 мкг/мкл, объем, необходимый для биотинилированного GAD65 в 560 мкл рабочего раствора, составит 1,12 мкл, а объем, необходимый для Ru Sulfo-NHS с маркировкой GAD65 в 700 мкл рабочего раствора, составит 0,7 мкл.
- Смешайте 1,12 мкл биотинилированного белка GAD65 с 240 мкл стрептавидин-конъюгированного линкера 1 в одной пробирке и 160 мкл 1% BSA. Инкубировать смесь при комнатной температуре в течение 30 мин. Добавить в пробирку 160 мкл стоп-раствора и инкубировать смесь при комнатной температуре еще 30 мин.
- Сделайте последовательное разбавление. Возьмите 280 мкл смеси в новую пробирку и добавьте 280 мкл стоп-раствора, чтобы сделать разбавление 1:2. Подготовьте несколько новых тюбиков. Повторите этот шаг, чтобы запустить горизонтальное последовательное разведение биотина, меченного антигеном GAD65 (см. предыдущую публикацию12).
- Смешайте 0,7 мкл белка Ru Sulfo-NHS с маркировкой GAD65 (1 мкг/мкл) с 700 мкл стоп-раствора. Затем возьмите 350 мкл смеси в новую пробирку и добавьте 350 мкл стоп-раствора, чтобы сделать разбавление 1:2. Подготовьте несколько новых пробирок, повторите этот шаг, чтобы запустить вертикальное последовательное разведение для антигена Ru Sulfo-NHS с маркировкой GAD65.
- Подготовьте два образца сыворотки, один образец высокоположительный для GADA и один образец отрицательный для GADA, каждый из которых имеет объем 0,75 мл. Аликвота 15 мкл положительной сыворотки в каждую лунку на левой половине 96-луночной ПЦР-пластины. Аликвота 15 мкл отрицательной сыворотки в каждую лунку на правой половине 96-луночной ПЦР-пластины.
- Добавьте 18 мкл 0,5 М уксусной кислоты в каждую лунку и перемешайте. Инкубируйте в течение 45 мин на RT. Приготовьте новую 96-луночную ПЦР-пластину. Добавьте 17,5 мкл меченого биотином антигена и 17,5 мкл меченого антигена Ru Sulfo-NHS в каждую лунку в соответствии с серийными разведениями (см. предыдущую публикацию12).
- Продолжите остальные этапы анализа, описанные в шагах с 5.2 по 9.1.
- Определите отношение сигналов от высокоположительных образцов к соответствующим отрицательным сигналам образца. Выберите наилучшую концентрацию для меченого биотином антигена и меченого антигена Ru Sulfo-NHS, определив точку, которая имеет самое высокое или близкое к самому высокому соотношение положительного и отрицательного сигнала. При расчете этого соотношения учитывайте низкий фоновый сигнал, полученный от отрицательных образцов.
ПРИМЕЧАНИЕ: Оптимальные концентрации белков антигена, меченных Ru Sulfo-NHS и биотином, из шахматных анализов показаны ниже: 30 нг/мл и 200 нг/мл для GAD65, 120 нг/мл и 120 нг/мл для проинсулина, 10 нг/мл и 42 нг/мл для IA-2, 80 нг/мл и 80 нг/мл для ТГ, 8 нг/мл и 16 нг/мл для ТПО, 31 нг/мл и 31 нг/мл для ThG и 12 нг/мл и 12 нг/мл для IFNα.
4. Создание смешанного раствора антигена, связанного с линкером
- Подберите оптимальную концентрацию для каждого антигена на основе шахматного анализа. Разбавляют биотин и меченый антиген Ru Sulfo-NHS до рациональной рабочей концентрации.
- Связывают различные линкеры с каждым из уникальных биотинилированных белков антигена. Для одного 96-луночного пластинчатого анализа смешайте 4 мкл биотинилированного GAD65, TPO, tTG, ThG, проинсулина, IFN-α и белка IA-2 с 240 мкл стрептавидин-конъюгированного линкера 1, 2, 3, 4, 8, 9 и 10 в отдельную трубку (рисунок 1). Затем добавьте 156 мкл PBS/1% BSA на пробирку. Инкубировать смесь при комнатной температуре в течение 30 мин.
- Добавьте в каждую пробирку по 160 мкл стоп-раствора и инкубируйте их при комнатной температуре еще 30 мин. Возьмите 400 мкл антигена, связанного с линкером, из каждой трубки и объедините все 7 антигенов вместе. Добавьте 1,2 мл стоп-раствора, а затем добавьте в смесь 4 мкл Ru Sulfo-NHS с маркировкой GAD65, TPO, tTG, ThG, проинсулин, IFN-α и антиген IA-2. Теперь раствор антигена готов к использованию в анализе.
5. Инкубация образцов сыворотки с меченым антигеном
ПРИМЕЧАНИЕ: Поскольку анализ ECL-IAA в этом анализе 7-Plex требует кислотной обработки образцов сыворотки, каждая сыворотка требует стадии кислотной обработки перед инкубацией с меченой смесью антигенов для этого анализа 7-Plex.
- Aliquot 15 мкл сыворотки на лунку для 96-луночной ПЦР-пластины. Добавьте 18 мкл 0,5 М уксусной кислоты в каждую лунку и перемешайте. Инкубировать в течение 45 мин на РТ. Приготовьте новую 96-луночную ПЦР-пластину и аликвоту 35 мкл раствора антигена в каждую лунку.
- Пока пластина все еще инкубируется, добавьте 13 мкл буфера 1 M Tris pH 9.0 к каждой лунке в антигенной пластине. Добавьте буфер в сторону каждой лунки, чтобы ограничить смешивание буфера Tris и антигена. После того, как инкубация будет завершена, возьмите 25 мкл сыворотки, обработанной кислотой, и немедленно вставьте ее в каждую лунку на антигенной пластине. Перемешайте раствор и накройте пластину герметизирующей фольгой ПЦР, чтобы избежать воздействия света.
- На RT поставьте пластину на шейкер, установленный на низкой скорости, на 1 ч. После этого храните пластину при температуре 4 °C и дайте плите высиживаться в течение 18-24 ч.
6. Подготовьте мультиплексную пластину
- Возьмите мультиплексную пластину из холодильника с температурой 4 °C и дайте пластине поступить в RT. Как только мультиплексная пластина окажется на RT, добавьте 150 мкл 3% блокатора A к каждой скважине. Накройте мультиплексную пластину уплотнительной пленкой. Инкубируйте пластину в холодильнике с температурой 4 °C в течение ночи.
ПРИМЕЧАНИЕ: День анализа 1 включает шаги с 4 по 6.
7. Перенос инкубации сыворотки/антигена в мультиплексную пластину
- На следующий день положите бумажные полотенца на стол и достаньте из холодильника инкубационную мультиплексную тарелку. Очистите весь буфер от пластины. Для этого переверните тарелку вверх ногами и похлопайте ее по подготовленным бумажным полотенцам до тех пор, пока ни в одной из лунок не останется буфера.
- Вымойте мультиплексную пластину, добавив 150 мкл PBST в каждую лунку. Удалите буфер, как указано в шаге 7.1., и повторите этот шаг три раза. Добавьте 30 мкл инкубационных сывороток/антигенов в каждую лунку мультиплексной пластины. Накройте пластину фольгой, чтобы ограничить ее воздействие света. Поместите пластину на пластинчатый шейкер, настроенный на низкую скорость, при RT в течение 1 ч.
8. Вымойте пластину и добавьте буфер чтения
- Удалите инкубаторы сыворотки/антигена из мультиплексной пластины, удерживая пластину вверх ногами и выбрасывая раствор. Добавьте 150 мкл PBST во все скважины и извлеките буфер из пластины, снова удерживая пластину вверх ногами и выбрасывая раствор. Повторите этот шаг три раза. После завершения третьей промывки добавьте 150 мкл буфера считывания в каждую скважину.
ПРИМЕЧАНИЕ: Пузырьки воздуха мешают способности машины для считывания пластин точно анализировать результаты пластины, и их следует избегать любой ценой.
9. Чтение пластины и анализ данных
- Подсчитайте подготовленную пластину на машине считывателя пластин, считывая все значения в подсчетах в секунду (CPS).
- Рассчитайте относительный индекс для анализа, используя уровни антител, полученные от пластинчатого считывателя, со следующим уравнением:
Значение индекса = [CPS (образец) - CPS (отрицательный стандарт)] / [CPS (положительный стандарт) - CPS (отрицательный стандарт)]. - Определите, какие результаты антител являются отрицательными или положительными, используя установленные отсечки.
ПРИМЕЧАНИЕ: День анализа 2 включает шаги с 7 по 9.
Результаты
Анализ результатов анализа показан в таблице 1, таблице 2 и таблице 3. Значения считывания исходят из данных из 10 точек в одной скважине. Значения индекса для каждого образца были рассчитаны с соответствующими внутренними положительными и отрицательными контрольными значениями, как описано в протоколе анализа. Примеры плохих дубликатов приведены в таблице 1 и вызвали окончательную ошибку расчета индекса в таблице 3. Все необработанные значения подсчета должны быть проверены, чтобы избежать ложноположительных или ложноотрицательных результатов.
7-мультиплексированный анализ ECL был проверен с использованием большой когорты образцов от 1026 недавно диагностированных пациентов с СД1 и 1022 здоровых контрольных субъектов в возрасте и полу. Уровни аутоантител из анализа 7-Plex ECL для 1026 пациентов с T1D сравнивали с уровнями из каждого из наших соответствующих установленных одиночных анализов ECL, как показано на рисунке 2 , и из каждого соответствующего стандарта RBA и ELISA, как показано на рисунке 3. Специфика анализа была установлена идентичной на99-м процентилях для всех анализов аутоантител, за исключением аутоантител щитовидной железы (где использовался 95-й процентиль), из 1022 здоровых контрольных групп для всех трех методов анализа (7-Plex ECL, один ECL, RBA или ELISA), как указано в таблице 4. Межпробирные резюме GADA, IA-2A, IAA, TPOA, ThGA, TGA и IFNαA составляют 6,4%, 4,5%, 9,1%, 4,9%, 5,7%, 11,3% и 5,9% соответственно.
Небольшое количество дискордантных образцов для каждого из 7 аутоантител было обнаружено вокруг границы отсечек для каждого анализа (рисунок 2 и рисунок 3). Одиннадцать контрольных образцов (11/1022, 1,1%) были обнаружены множественные аутоантитела положительные только в 7-Plex анализе и отрицательные в каждом соответствующем отдельном анализе. Аналогично это произошло в 9 образцах пациентов с СД1 (9/1026, 0,9%). Кроме того, 10 высоких положительных TPOA и один ThGA в когорте пациентов, которые были замечены как в одном анализе ECL, так и в RBA, были пропущены в анализе 7-Plex. Эти образцы были преобразованы положительными в 7-Plex анализе, когда они были дополнительно разбавлены. В целом, 100% позитивности в одиночном анализе ECL или RBA были покрыты в 7-Plex ECL анализе с той же специфичностью анализа, что и в таблице 4.
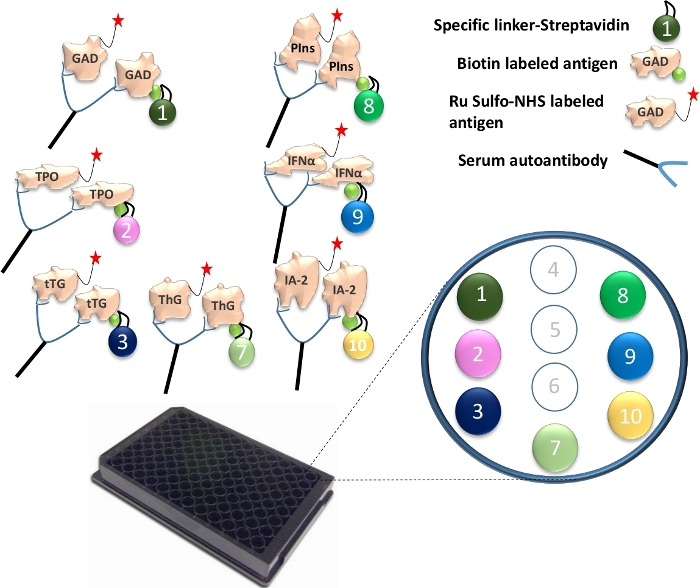
Рисунок 1: Иллюстрация анализа Mutiplex ECL.
Аутоантитела в сыворотке крови соединят антиген Ru Sulfo-NHSged с биотинилированным антигеном. Это сочетается со специфическим линкером, образующим комплекс антиген-антитело-антиген-линкер. Комплексы захватываются на пластину и удерживаются до их конкретных мест через каждый конкретный линкер. Проиллюстрированы специфически связанные номера линкера для 7 различных белков антигенов. Обнаружение сигналов антител осуществляется с помощью меченых антигенов Ru Sulfo-NHS с электрохемилюминесценцией. Рисунок взят из Gu, Y. et al.13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
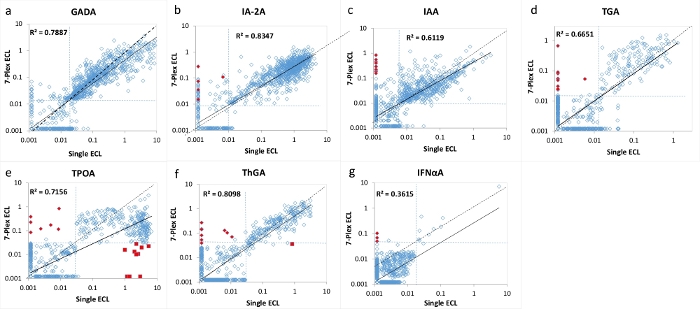
Рисунок 2: Сравнение 7 уровней аутоантител у 1026 новых пациентов с СД1 между одним анализом ECL и анализом 7-Plex ECL.
Панели a, b, c, d, e, f и g отображают сравнение уровней аутоантител для GADA, IA-2A, IAA, TGA, TPOA, ThGA и IFNαA соответственно. Пунктирные линии представляют собой отсечки анализа для каждого анализа аутоантител. Отсечки были установлены на99-й процентиль 1022 соответствующих возрасту здоровых контрольных групп для каждого анализа (за исключением TPOA и ThGA, которые были установлены на95-й процентиль), как показано в таблице 4, из 1022 возрастных сопоставимых здоровых контрольных групп как для одиночных, так и для мультиплексных анализов ECL. Красные закрытые алмазы помечены как «ложные» положительные результаты в анализе 7-Plex ECL, <1% изученной когорты, и они были подтверждены как отрицательные как в одном ECL, так и в RBA. Красные замкнутые квадраты помечены как «ложные» отрицательные результаты в анализе 7-Plex ECL, вызванном феноменом «prozone», в основном встречающимся в анализе TPOA в <1% изученной когорты. Оба этих ложноположительных и ложноотрицательных результата обсуждаются в разделе обсуждения. Рисунок взят из Gu, Y. et al.13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
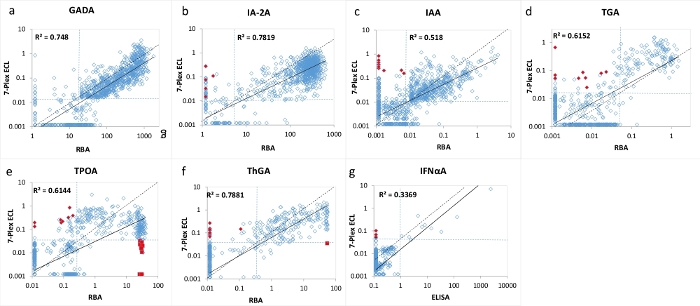
Рисунок 3: Сравнение 7 уровней аутоантител у 1026 новых пациентов с СД1 между РБА (ИФА для IFNαA) и 7-плексным анализом ECL.
Панели a, b, c, d, e, f и g представляют сравнение уровней аутоантител для GADA, IA-2A, IAA, TGA, TPOA, ThGA и IFNαA, соответственно. Пунктирные линии представляют собой отсечки анализа для каждого анализа аутоантитела, одинаковый набор специфичности как для RBA, так и для анализа ECL 7-Plex, как показано в таблице 4, из 1022 возрастных соответствующих здоровых контрольных групп. Красные замкнутые алмазы и квадраты представляют собой «ложные» положительные и «ложные» отрицательные результаты, появляющиеся в анализе ECL 7-Plex, то же самое показано на рисунке 2. Рисунок взят из Gu, Y. et al.13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| 1 | 2 | 3 | 4 | 5 | 6 | ||
| A | 5580 | 5674 | 105 | 117 | 125 | 139 | линкер-1 |
| 100 | 108 | 102 | 102 | 3956 | 3745 | линкер-2 | |
| 115 | 124 | 107 | 116 | 113 | 124 | линкер-3 | |
| 67 | 64 | 68 | 61 | 65 | 69 | линкер-4 | |
| 89 | 87 | 98 | 92 | 90 | 80 | линкер-5 | |
| 87 | 71 | 89 | 87 | 61 | 72 | линкер-6 | |
| 94 | 82 | 79 | 85 | 2154 | 2280 | линкер-7 | |
| 75 | 66 | 1628 | 1594 | 81 | 83 | линкер-8 | |
| 98 | 103 | 71 | 84 | 69 | 85 | линкер-9 | |
| 102 | 118 | 93 | 98 | 113 | 99 | линкер-10 | |
| B | 324 | 337 | 147 | 148 | 5426 | 5366 | линкер-1 |
| 101 | 102 | 93 | 88 | 86 | 74 | линкер-2 | |
| 111 | 119 | 119 | 123 | 66 | 72 | линкер-3 | |
| 72 | 65 | 59 | 68 | 74 | 67 | линкер-4 | |
| 81 | 98 | 83 | 92 | 79 | 72 | линкер-5 | |
| 90 | 84 | 93 | 86 | 70 | 76 | линкер-6 | |
| 101 | 105 | 101 | 97 | 956 | 944 | линкер-7 | |
| 82 | 83 | 189 | 204 | 97 | 90 | линкер-8 | |
| 92 | 83 | 78 | 64 | 82 | 78 | линкер-9 | |
| 83 | 79 | 88 | 93 | 4722 | 4965 | линкер-10 | |
| C | 110 | 110 | 87 | 81 | 2114 | 2365 | линкер-1 |
| 5526 | 5680 | 88 | 70 | 86 | 93 | линкер-2 | |
| 114 | 132 | 67 | 71 | 3326 | 3284 | линкер-3 | |
| 64 | 62 | 88 | 74 | 64 | 80 | линкер-4 | |
| 94 | 82 | 86 | 75 | 89 | 76 | линкер-5 | |
| 77 | 87 | 75 | 63 | 70 | 86 | линкер-6 | |
| 77 | 86 | 71 | 84 | 138 | 121 | линкер-7 | |
| 73 | 86 | 80 | 79 | 59 | 73 | линкер-8 | |
| 86 | 74 | 5064 | 4923 | 88 | 86 | линкер-9 | |
| 105 | 113 | 85 | 80 | 124 | 114 | линкер-10 | |
| D | 98 | 88 | 92 | 84 | 136 | 127 | линкер-1 |
| 288 | 291 | 86 | 86 | 558 | 564 | линкер-2 | |
| 109 | 101 | 74 | 73 | 141 | 127 | линкер-3 | |
| 78 | 66 | 66 | 55 | 74 | 66 | линкер-4 | |
| 79 | 83 | 79 | 86 | 96 | 91 | линкер-5 | |
| 83 | 86 | 96 | 89 | 86 | 73 | линкер-6 | |
| 87 | 89 | 77 | 87 | 841 | 855 | линкер-7 | |
| 74 | 72 | 60 | 72 | 90 | 95 | линкер-8 | |
| 68 | 75 | 331 | 328 | 2460 | 2580 | линкер-9 | |
| 86 | 98 | 80 | 75 | 123 | 133 | линкер-10 | |
| E | 101 | 114 | 101 | 106 | 532 | 548 | линкер-1 |
| 101 | 96 | 110 | 104 | 682 | 675 | линкер-2 | |
| 6015 | 5988 | 124 | 126 | 101 | 98 | линкер-3 | |
| 66 | 71 | 82 | 71 | 80 | 62 | линкер-4 | |
| 102 | 97 | 99 | 80 | 83 | 110 | линкер-5 | |
| 82 | 67 | 81 | 80 | 60 | 85 | линкер-6 | |
| 85 | 95 | 52 | 84 | 245 | 221 | линкер-7 | |
| 72 | 78 | 82 | 74 | 486 | 503 | линкер-8 | |
| 77 | 97 | 97 | 77 | 56 | 66 | линкер-9 | |
| 114 | 104 | 5726 | 5814 | 259 | 253 | линкер-10 | |
| F | 119 | 120 | 133 | 118 | 112 | 96 | линкер-1 |
| 101 | 91 | 100 | 95 | 96 | 82 | линкер-2 | |
| 406 | 395 | 111 | 123 | 2127 | 101 | линкер-3 | |
| 72 | 60 | 86 | 72 | 79 | 83 | линкер-4 | |
| 76 | 85 | 96 | 99 | 89 | 103 | линкер-5 | |
| 88 | 78 | 91 | 83 | 89 | 95 | линкер-6 | |
| 104 | 97 | 87 | 102 | 56 | 66 | линкер-7 | |
| 76 | 77 | 79 | 93 | 69 | 75 | линкер-8 | |
| 85 | 71 | 95 | 100 | 83 | 71 | линкер-9 | |
| 131 | 131 | 358 | 364 | 92 | 86 | линкер-10 | |
| G | 90 | 95 | 85 | 82 | 105 | 107 | линкер-1 |
| 99 | 86 | 77 | 76 | 1250 | 1174 | линкер-2 | |
| 119 | 123 | 120 | 118 | 112 | 108 | линкер-3 | |
| 76 | 83 | 77 | 80 | 86 | 76 | линкер-4 | |
| 88 | 86 | 86 | 93 | 107 | 92 | линкер-5 | |
| 73 | 73 | 71 | 82 | 84 | 75 | линкер-6 | |
| 5210 | 5173 | 72 | 69 | 76 | 85 | линкер-7 | |
| 80 | 81 | 79 | 82 | 100 | 101 | линкер-8 | |
| 96 | 97 | 89 | 83 | 65 | 83 | линкер-9 | |
| 98 | 103 | 86 | 88 | 1933 | 1979 | линкер-10 | |
| H | 114 | 124 | 81 | 86 | 299 | 295 | линкер-1 |
| 107 | 92 | 69 | 72 | 4256 | 4388 | линкер-2 | |
| 114 | 123 | 125 | 129 | 501 | 536 | линкер-3 | |
| 77 | 70 | 67 | 64 | 74 | 62 | линкер-4 | |
| 92 | 110 | 81 | 84 | 77 | 71 | линкер-5 | |
| 87 | 79 | 72 | 76 | 83 | 81 | линкер-6 | |
| 328 | 341 | 84 | 80 | 88 | 97 | линкер-7 | |
| 75 | 84 | 75 | 90 | 74 | 83 | линкер-8 | |
| 73 | 79 | 78 | 76 | 84 | 70 | линкер-9 | |
| 113 | 120 | 81 | 76 | 2372 | 2350 | линкер-10 | |
Таблица 1: Анализ 7-плексного анализа ECL: необработанные подсчеты CPS (левая половина пластины). Необработанные подсчеты CPS получаются из пробирной пластины (левая половина пластины), и каждый образец выполняется в двух экземплярах. Под каждой строкой пластины (A-H) находятся 10 строк значений считывания, представляющих данные из 10 пятен в одном колодце, соответствующих каждому номеру компоновщика, как отмечено. Примеры плохих дубликатов выделены серым цветом, как видно в строке F-linker 3-columns 5 и 6.
| Строка таблицы 1А | Колонка таблицы 1А | компоновщик 1 | компоновщик 2 | компоновщик 3 | компоновщик 7 | компоновщик 8 | компоновщик 9 | компоновщик 10 | |
| A | 1-2 | ГАДА ПК | 5627 | 104 | 120 | 88 | 71 | 101 | 110 |
| B | 1-2 | GADA Низкий ПК | 331 | 102 | 115 | 103 | 83 | 88 | 81 |
| C | 1-2 | ТПОА ПК | 110 | 5603 | 123 | 82 | 80 | 80 | 109 |
| D | 1-2 | TPOA Низкий ПК | 93 | 290 | 105 | 88 | 73 | 72 | 92 |
| E | 1-2 | TGA ПК | 108 | 99 | 6002 | 90 | 75 | 87 | 109 |
| F | 1-2 | TG Low PC | 120 | 96 | 401 | 101 | 77 | 78 | 131 |
| G | 1-2 | ThGA ПК | 93 | 93 | 121 | 5192 | 81 | 97 | 101 |
| H | 1-2 | Пк с низким thGA | 119 | 100 | 119 | 335 | 80 | 76 | 117 |
| A | 3-4 | IAA ПК | 111 | 102 | 112 | 82 | 1611 | 78 | 96 |
| B | 3-4 | IAA Низкий ПК | 148 | 91 | 121 | 99 | 197 | 71 | 91 |
| C | 3-4 | ИФНаА ПК | 84 | 79 | 69 | 78 | 80 | 4994 | 83 |
| D | 3-4 | IFNaA Низкий ПК | 88 | 86 | 74 | 82 | 66 | 330 | 78 |
| E | 3-4 | ИА-2А ПК | 104 | 107 | 125 | 68 | 78 | 87 | 5770 |
| F | 3-4 | IA-2A Низкий ПК | 126 | 98 | 117 | 95 | 86 | 98 | 361 |
| G | 3-4 | ЧПУ | 84 | 77 | 119 | 71 | 81 | 86 | 87 |
| H | 3-4 | ЧПУ | 84 | 71 | 127 | 82 | 78 | 77 | 79 |
| A | 5-6 | пример1 | 132 | 3851 | 119 | 2217 | 82 | 77 | 106 |
| B | 5-6 | образец2 | 5396 | 80 | 69 | 950 | 94 | 80 | 4844 |
| C | 5-6 | пример3 | 2240 | 90 | 3305 | 130 | 66 | 87 | 119 |
| D | 5-6 | образец4 | 132 | 561 | 134 | 848 | 93 | 2520 | 128 |
| E | 5-6 | пример5 | 540 | 679 | 100 | 233 | 495 | 61 | 256 |
| F | 5-6 | образец6 | 104 | 89 | 1114 | 61 | 72 | 77 | 89 |
| G | 5-6 | образец7 | 106 | 1212 | 110 | 81 | 101 | 74 | 1957 |
| H | 5-6 | образец8 | 297 | 4322 | 519 | 93 | 79 | 77 | 2361 |
Таблица 2: Анализ 7-плексного анализа ECL: расположение данных таблицы 1, обозначенных как 7 компоновщиков. Данные из таблицы 1 были перегруппированы, при этом компоновщики 4-6 (не использовались) были удалены, а средние значения были рассчитаны на основе каждого дублирования показаний из таблицы 1. Значения внутреннего стандарта высокого и низкого положительного контроля, соответствующие каждому анализу аутоантител, сдерживаемому конкретным линкером, выделены темным жирным шрифтом. ПК, положительный контроль. NC, нормальный контроль.
| GAD-Индекс | ТПОА-индекс | TGA-индекс | ThGA-Индекс | IAA-Индекс | ИФНаА-Индекс | Индекс ИА-2А | |
| ГАДА ПК | 1.000 | 0.005 | 0.000 | 0.003 | -0.006 | 0.003 | 0.004 |
| GADA Низкий ПК | 0.045 | 0.005 | -0.001 | 0.006 | 0.002 | 0.000 | -0.001 |
| IAA ПК | 0.005 | 1.000 | 0.001 | 0.002 | -0.001 | -0.001 | 0.004 |
| IAA Низкий ПК | 0.002 | 0.039 | -0.002 | 0.003 | -0.005 | -0.003 | 0.001 |
| ИА-2А ПК | 0.004 | 0.004 | 1.000 | 0.004 | -0.004 | 0.000 | 0.004 |
| IA-2A Низкий ПК | 0.007 | 0.004 | 0.048 | 0.006 | -0.002 | -0.002 | 0.008 |
| TGA ПК | 0.002 | 0.003 | 0.000 | 1.000 | 0.000 | 0.002 | 0.002 |
| TG Low PC | 0.006 | 0.004 | 0.000 | 0.052 | -0.001 | -0.002 | 0.005 |
| ТПОА ПК | 0.005 | 0.005 | -0.001 | 0.002 | 1.000 | -0.002 | 0.001 |
| TPOA Низкий ПК | 0.012 | 0.003 | 0.000 | 0.006 | 0.076 | -0.003 | 0.001 |
| ThGA ПК | 0.000 | 0.000 | -0.008 | 0.001 | 0.000 | 1.000 | -0.001 |
| Пк с низким thGA | 0.001 | 0.002 | -0.008 | 0.002 | -0.009 | 0.050 | -0.002 |
| ИФНаА ПК | 0.004 | 0.006 | 0.001 | 0.000 | -0.002 | 0.000 | 1.000 |
| IFNaA Низкий ПК | 0.008 | 0.004 | 0.000 | 0.005 | 0.004 | 0.002 | 0.048 |
| ЧПУ | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| ЧПУ | 0.000 | -0.001 | 0.001 | 0.002 | -0.002 | -0.002 | -0.001 |
| пример1 | 0.009 | 0.683 | 0.000 | 0.419 | 0.001 | -0.002 | 0.003 |
| образец2 | 0.958 | 0.001 | -0.008 | 0.172 | 0.009 | -0.001 | 0.837 |
| пример3 | 0.389 | 0.002 | 0.542 | 0.012 | -0.009 | 0.000 | 0.006 |
| образец4 | 0.009 | 0.088 | 0.003 | 0.152 | 0.008 | 0.496 | 0.007 |
| пример5 | 0.082 | 0.109 | -0.003 | 0.032 | 0.271 | -0.005 | 0.030 |
| образец6 | 0.004 | 0.002 | 0.169 | -0.002 | -0.006 | -0.002 | 0.000 |
| образец7 | 0.004 | 0.205 | -0.002 | 0.002 | 0.013 | -0.002 | 0.329 |
| образец8 | 0.039 | 0.768 | 0.068 | 0.004 | -0.001 | -0.002 | 0.400 |
Таблица 3: Анализ 7-плексного анализа ECL: результаты значений индекса. Значения индексов для каждой выборки для всех 7 анализов аутоантител были рассчитаны по их соответствующим внутренним положительным и отрицательным контрольным элементам, как описано в протоколе анализа. Любое значение индекса, превышающее пороговое значение, определялось как положительный результат, выделенный жирным шрифтом. Значение TGA-индекса sample6 было выделено серым цветом, так как это ошибка, вызванная плохими дубликатами, показанными в строке F-linker 3-columns 5 и 6 в таблице 1.
| ГАДА | ИА-2А | МАА | .TGA | ТПОА | ТГА | ИФНА* | ||||||||
| Сенс | Спекуляция | Сенс | Спекуляция | Сенс | Спекуляция | Сенс | Спекуляция | Сенс | Спекуляция | Сенс | Спекуляция | Сенс | Спекуляция | |
| РБА | 73.4% | 98.5% | 75.2% | 99.0% | 47.7% | 99.1% | 12.9% | 99.0% | 23.9% | 95.2% | 19.3% | 94.7% | 1.0% | 99.6% |
| Одноместный ECL | 71.6% | 99.1% | 73.6% | 99.3% | 48.3% | 99.7% | 16.0% | 98.9% | 26.3% | 94.9% | 20.6% | 95.1% | 0.8% | 99.2% |
| 7-Plex ECL | 71.2% | 98.9% | 77.3% | 98.9% | 49.5% | 98.9% | 16.5% | 98.7% | 26.1% | 94.7% | 21.1% | 94.7% | 1.7% | 99.1% |
Таблица 4: Чувствительность и специфичность анализа среди 1026 пациентов с СД1 и 1022 контрольных групп, подобранных как по возрасту, так и по полу, в 7-плексном анализе ECL по сравнению с соответствующим одиночным анализом ECL и RBA или ELISA*. Различные анализы (RBA, одиночный ECL и 7-Plex ECL) для каждого аутоантитела были установлены на сходные специфичности с использованием 1022 возрастных и половых соответствий здоровых контрольных групп. Исход специфичности из изученной контрольной когорты был установлен около 95% для TPOA и ThGA и на уровне 99% для 5 других анализов. *Звездочкой отмечен анализ IFNαA для ИФА, в то время как другие являются RBA.
Обсуждение
В многочисленных национальных и международных клинических испытаниях диабета 1 типа эффективность одного анализа ECL для выявления островковых аутоантител и аутоантител к трансглутаминазе (TGA) при целиакии была подтверждена 8,9,10,11. На протяжении всех этих следов этот анализ увеличил чувствительность и специфичность для обнаружения аутоантигенов при оценке по существующему «золотому» стандарту RBA. Повышенную специфичность заболевания можно рассматривать при распознавании аутоантител с высоким сродством и высоким риском по сигналам низкого риска и низкого сродства между одним анализом ECL и RBA 14,15,16,17. Основываясь на одном анализе ECL, мы представляем новый высокопроизводительный мультиплексированный анализ аутоантител ECL, чтобы позволить нам одновременно проводить скрининг на СД1, а также на несколько применимых аутоиммунных заболеваний.
Мультиплексный анализ ECL использует мультиплексную пластину, которая может объединять до 10 анализов аутоантител в одну лунку. Для настоящего исследования 7 анализов аутоантител объединены вместе. Аутоантитела состоят из 3 IAbs (IAA, GADA и IA-2A), 2 аутоиммунных аутоантител заболевания щитовидной железы (TPOA и ThGA), аутоантител целиакии (TGA) и аутоантител APS-1 к интерферону альфа (IFNαA). Механизм анализа, как правило, основан на одном анализе ECL, как ранее опубликовано 9,10,12,18 с некоторыми модификациями. Основное отличие мультиплексного анализа ECL от одного ECL-анализа заключается в том, что каждый комплекс антитело-антиген, образующийся в жидкой фазе, удерживается специфическим линкером (рисунок 1). Меченый биотином антиген инкубируют с конъюгированным стрептавидином, линкером, используемым для формирования специфического комплекса антиген-линкер. Иммунный комплекс антитело-антиген образуется после инкубации с сывороткой пациента и захватывается на определенное место через специфическую линкерную систему на каждой лунке мультиплексной пластины. Ru Sulfo-NHS меченый антиген, захваченный антителами, одновременно обеспечивает сигнал электрохемилюминесценцией. Пластинчатая считывающая машина может обнаруживать до 10 различных сигналов от точечных источников, расположенных в каждой скважине. Чтобы анализы аутоантител были последовательными между пластинами и при проведении долгосрочных исследований, мы предлагаем использовать один и тот же линкер.
Перед настройкой мультиплексного анализа ECL одиночные анализы ECL для каждого аутоантитела должны быть оптимизированы на мультиплексной пластине, соответственно, и проверены на соответствие как RBA, так и одиночным ECL анализам на обычной пластине ECL. Для усиления шахматного анализа, к соответствующему анализу аутоантитела на мультиплексной пластине использовали образец с высоким положительным результатом пациента и отрицательный образец пациента. После того, как был проведен шахматный анализ, наиболее идеальные концентрации для Ru Sulfo-NHS и биотина меченого антигена были рассчитаны для каждого из 7 анализов аутоантител. Ниже показаны эти концентрации: 30 нг/мл и 200 нг/мл для GAD65, 120 нг/мл и 120 нг/мл для проинсулина, 10 нг/мл и 42 нг/мл для IA-2, 80 нг/мл и 80 нг/мл для ТГ, 8 нг/мл и 16 нг/мл для ТПО, 31 нг/мл и 31 нг/мл для ТГГ, 31 нг/мл и 31 нг/мл для ТГ, и 12 нг/мл и 12 нг/мл соответственно для IFNα13. Концентрации некоторых антигенов из шахматного анализа, возможно, потребуется дополнительно скорректировать в соответствии с результатами фактического мультиплексного анализа после объединения всех анализов вместе.
Поскольку IAA включен в настоящий мультиплексный анализ ECL, кислотная обработка образцов сыворотки является обязательной перед инкубацией сыворотки с антигеном, как сообщалось в предыдущем исследовании12. Как правило, когда дополнительное аутоантитело добавляется к мультиплексному анализу, фон анализа затрагивается, и чрезвычайно высокий сигнал из одного места в колодце может препятствовать результатам близлежащих пятен через перекрестные помехи. Поэтому максимальный CPS должен быть ограничен 20 000 подсчетов для каждого аутоантитела или ниже для самых высоких положительных образцов. Насколько нам известно, чтобы уменьшить количество перекрестных помех, аутоантитела, которые имеют более низкий фон, должны быть отделены при разработке карты пятен вдали от пятен с более высокой частотой подсчетов.
Высокие положительные и отрицательные контрольные показатели использовались внутри каждого анализа для расчета точного индекса для неизвестных тестируемых образцов. Для точной оценки и мониторинга чувствительности анализа использовались низкие положительные контрольные значения, установленные вблизи верхнего предела анализа. Эти стандартные положительные и отрицательные контрольные элементы были созданы в объеме и аликвоте для длительного использования и хранились при -20 °C или ниже для согласованности между анализами. В целях обеспечения качества образцы были проведены дважды в каждом анализе, и каждый положительный результат был повторен и подтвержден путем запуска образца в новом анализе ECL на следующий день. Если возникали какие-либо разногласия с первым и вторым подтверждающим анализом, требовался третий анализ. Из трех проведенных анализов результаты двух анализов, которые согласуются (например, +, + или -,-), определили конечный результат (положительный или отрицательный) образца.
В последнее десятилетие многие исследовательские группы ищут высокопроизводительный анализ с использованием мультиплексного метода для объединения нескольких анализов аутоантител вместе в одну скважину для скрининга больших популяций. Есть несколько исследований, которые используют различные типы технологий для проведения мультиплексных анализов аутоантител 19,20,21,22, но нет никакого сравнения ни для одного из этих анализов по чувствительности и специфичности с текущим «золотым» стандартом RBA при изучении T1D. Эти различные типы используемых платформ не проверяются в ходе международного семинара по программе стандартизации аутоантител на островках (IASP) или путем тестирования больших когорт в клинических испытаниях. В недавнем общепопуляционном скрининге в Германии высокопроизводительный комбинированный анализ 3 Screen ICATM, распространяемый Kronus, используется в качестве инструмента для скрининга первой линии для выявления трех IAbs, GADA, IA-2A и ZnT8A для достижения ранней диагностики детского T1D23. 3-экранный ИФА-анализ измеряет 3 аутоантитела либо в 3 разделенных лунках, потребляющих большой объем сыворотки, либо в одной лунке со всеми 3 смешанными анализами. Если один из них в 3-экранном ИФА-анализе положительный, он не может различить, какое из трех аутоантител присутствует. Самым большим недостатком этого анализа является его неспособность включить измерение IAA. Все результаты IAA, выполненные с помощью ИФА, как доказано на семинарах IASP, не имеют приемлемой чувствительности и специфичности24. IAA обычно является первым IAb, который появляется и имеет высокую распространенность среди маленьких детей. Скрининг IAb с IAA необходим для детей, и считается неприемлемым проводить этот скрининг без IAA для оценки риска СД1 в сообществе. Кроме того, нет опубликованных исследований или данных, которые показывают, что анализ набора Kronus IAb более специфичен для заболевания СД1 и способен различать высокий риск от IAbs низкого риска. Анализ 7-Plex ECL в настоящем исследовании был подтвержден с использованием большой когорты недавно диагностированных пациентов с T1D13. По сравнению с текущим стандартным RBA и хорошо зарекомендовавшим себя одиночным анализом ECL, 7-Plex-анализ способен сохранять 100% позитивность с той же специфичностью анализа (таблица 4). В настоящее время анализ 4-Plex ECL, параллельный стандартному RBA, применяется к текущему крупному клиническому испытанию: исследованию Autoimmunity Screening for Kids (ASK). Это исследование проверяет детей в общей популяции, в столичном районе Денвера, на СД1 и целиакию. По сравнению со стандартным RBA, используемым в исследовании ASK, мультиплексный анализ ECL демонстрирует отличную чувствительность и более высокую специфичность заболевания, идентичную нашим предыдущим отчетам с использованием одного исследования ECL25. Кроме того, наш 4-plex ECL-анализ продемонстрировал выраженное снижение трудозатрат, затрат и объема сыворотки на 70% по сравнению с соответствующими 4-ми разовыми анализами для ECL и RBA. Используя мультиплексированный анализ ECL, мы можем настроить каждую скважину с различными числами, представляющими разные аутоантитела (до 10), для тестирования на различные аутоиммунные заболевания, которые специфичны для потребностей конкретного клинического местоположения.
Существуют некоторые ограничения, наблюдаемые в настоящем исследовании, для мультиплексированного анализа ECL с использованием мультиплексной пластины. Окончательное разведение сыворотки, инкубированной с антигеном, не может быть скорректировано таким образом, чтобы получить наиболее оптимальные условия для каждого отдельного анализа аутоантител, который объединен в одной лунке. Было обнаружено, что девять образцов (9/1026) от пациентов с СД1 имели ложноотрицательный результат для определенных аутоантител. 7 ложноотрицательных результатов были для TPOA и 2 для ThGA, в анализе 7-Plex ECL, но высокие положительные результаты были продемонстрированы как в одном анализе ECL, так и в RBA (рисунок 2 и 3). После дальнейшего разбавления всех 9 образцов они стали положительными на мультиплексной пластине. Этот результат вызван тем, что мы называем феноменом «прозоны». Это явление приводит к тому, что образец показывает ложноотрицательный результат, потому что высокие титры антител влияют на образование решеток антиген-антитело. При настройке мультиплексного анализа образцы с очень высокими титрами для каждого из комбинированных аутоантител рекомендуется провести предварительные тесты для выявления необязательного разведения сыворотки для инкубации антигена. Альтернативно, анализы аутоантител с аналогичными оптимизированными условиями должны быть выбраны для формирования комбинированного анализа, из которого достигается наилучшая чувствительность и специфичность анализа для каждого аутоантитела. В настоящем исследовании 7 образцов (7/1022) из здоровых нормальных контрольных групп привели к ложноположительным результатам для нескольких аутоантител в анализе 7-Plex, но после проведения одного анализа ECL и RBA (рисунок 2 и 3) эти аутоантитела были отрицательными в обоих анализах. Причины этих ложноположительных результатов, происходящих на мультиплексной пластине для этих небольших подмножеств образцов, в настоящее время неизвестны. Для текущего применения мультиплексного анализа ECL все положительные образцы повторяются с соответствующим одиночным анализом ECL для подтверждения позитивности, что устраняет эту ложноположительную ошибку из мультиплексного анализа ECL.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом NIH DK32083, грантами JDRF 2-SRA-2015-51-Q-R и 2-SRA-2018-533-S-B.
Материалы
| Name | Company | Catalog Number | Comments |
| 4 °C refrigerator | |||
| –80 °C and -20 °C freezers | |||
| 96-well Plate Shaker | Wallac - Delfi | ||
| 96-well round bottom plate | Fisher | 8408220 | |
| Acetic acid solution | Fisher | ||
| Aluminum foil | |||
| Antigen proteins | |||
| Human GAD65 full length protein | Diamyd | ||
| Human ThG full length protein | BioMart | ||
| Human TPO full length protein | BioMart | ||
| IA-2 intracellular domain protein | BioMart | ||
| IFN-α protein | Abcam | ||
| Proinsulin protein | AmideBio | ||
| tTG protein | DiaRect | ||
| Biotin | Sigma | ||
| Bottle-Top 500 mL , Filter Units | Fisher | 0974064A or B | |
| Bovine Serum Albumin | Sigma | A-7906 | |
| Distilled deionized (DD) water | |||
| HCl | Fisher | ||
| Ice maker | |||
| Ice trays | |||
| MSD Sector | Perkin-Elmer | ||
| Multi-channel pipette | |||
| NaOH | |||
| Paper tower | |||
| PBS | |||
| pH meter | |||
| Pipette-Aid | |||
| Pipettes/tips | |||
| Ru Sulfo-NHS | MSD (R91AN) | ||
| Trizma Base | Fisher | BP152-5 | |
| Tween 20 | Sigma | P-1379 | |
| Uplex Development Kit | MSD | ||
| 96-well UPlex plate | MSD | ||
| Blocker A | MSD | R93AA | |
| Linker-Streptavidin | MSD | ||
| Read buffer | MSD | R92TC | |
| Stop Solution | MSD | ||
| Vortex mixer | |||
| ZeBa Column | Pierce | 89892 |
Ссылки
- Harjutsalo, V., Sjoberg, L., Tuomilehto, J. Time trends in the incidence of type 1 diabetes in Finnish children: a cohort study. Lancet. 371 (9626), 1777-1782 (2008).
- Vehik, K., et al. Increasing incidence of type 1 diabetes in 0- to 17-year-old Colorado youth. Diabetes Care. 30 (3), 503-509 (2007).
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Insel, R. A., et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 38 (10), 1964-1974 (2015).
- Barker, J. M., et al. Autoantibody "subspecificity" in type 1 diabetes: risk for organ-specific autoimmunity clusters in distinct groups. Diabetes Care. 28 (4), 850-855 (2005).
- Triolo, T. M., et al. Additional Autoimmune Disease Found in 33% of Patients at Type 1 Diabetes Onset. Diabetes Care. 34 (5), 1211-1213 (2011).
- de Graaff, L. C., Smit, J. W., Radder, J. K. Prevalence and clinical significance of organ-specific autoantibodies in type 1 diabetes mellitus. Netherlands Journal of Medicine. 65 (7), 235-247 (2007).
- Yu, L., et al. Proinsulin/Insulin autoantibodies measured with electrochemiluminescent assay are the earliest indicator of prediabetic islet autoimmunity. Diabetes Care. 36 (8), 2266-2270 (2013).
- Yu, L., et al. Distinguishing persistent insulin autoantibodies with differential risk: nonradioactive bivalent proinsulin/insulin autoantibody assay. Diabetes. 61 (1), 179-186 (2012).
- Miao, D., et al. GAD65 autoantibodies detected by electrochemiluminescence assay identify high risk for type 1 diabetes. Diabetes. 62 (12), 4174-4178 (2013).
- Gu, Y., Zhao, Z., High, H., Yang, T., Yu, L. Islet Autoantibody Detection by Electrochemiluminescence (ECL) Assay. Journal of Clinical & Cellular Immunology. 8 (6), (2017).
- Gu, Y., et al. Electrochemiluminescence Assays for Human Islet Autoantibodies. Journal of Visualized Experiments. (133), e57227 (2018).
- Gu, Y., et al. High-throughput multiplexed autoantibody detection to screen type 1 diabetes and multiple autoimmune diseases simultaneously. Ebiomedicine. 47, 365-372 (2019).
- Dongmei, M., A, K. S., Li Zh, K., Michelle, G., Ling, J., Taylor, A. Electrochemiluminescence Assays for Insulin and Glutamic Acid Decarboxylase Autoantibodies Improve Prediction of Type 1 Diabetes Risk. Diabetes Technology & Therapeutics. 17 (2), 119-127 (2015).
- Steck, A. K., et al. ECL-IAA and ECL-GADA Can Identify High-Risk Single Autoantibody-Positive Relatives in the TrialNet Pathway to Prevention Study. Diabetes Technology & Therapeutics. 18 (7), 410-414 (2016).
- Fouts, A., et al. Do Electrochemiluminescence Assays Improve Prediction of Time to Type 1 Diabetes in Autoantibody-Positive TrialNet Subjects. Diabetes Care. 39 (10), 1738-1744 (2016).
- Sosenko, J. M., et al. The Use of Electrochemiluminescence Assays to Predict Autoantibody and Glycemic Progression Toward Type 1 Diabetes in Individuals with Single Autoantibodies. Diabetes Technology & Therapeutics. 19 (3), 183-187 (2017).
- Zhao, Z., et al. Higher Sensitivity and Earlier Identification of Celiac Disease Autoimmunity by a Nonradioactive Assay for Transglutaminase Autoantibodies. Journal of Immunology Research. 2016, 5 (2016).
- Zhang, B., Kumar, R. B., Dai, H., Feldman, B. J. A plasmonic chip for biomarker discovery and diagnosis of type 1 diabetes. Nature Medicine. 20 (8), 948-953 (2014).
- Tsai, C. T., Robinson, P. V., Spencer, C. A., Bertozzi, C. R. Ultrasensitive Antibody Detection by Agglutination-PCR (ADAP). American Chemical Society Central Science. 2 (3), 139-147 (2016).
- Yim, S. W., et al. Four-color alternating-laser excitation single-molecule fluorescence spectroscopy for next-generation biodetection assays. Clinical chemistry. 58 (4), 707-716 (2012).
- Bale, S. S., et al. A highly sensitive microsphere-based assay for early detection of Type I diabetes. Technology. 02 (03), 200-205 (2014).
- Ziegler, A. G., et al. 3 Screen ELISA for High-Throughput Detection of Beta Cell Autoantibodies in Capillary Blood. Diabetes Technology & Therapeutics. 18 (11), 687-693 (2016).
- Schlosser, M., et al. Diabetes Antibody Standardization Program: evaluation of assays for insulin autoantibodies. Diabetologia. 53 (12), 2611-2620 (2010).
- Zhao, Z., et al. A multiplex assay combining insulin, GAD, IA-2 and transglutaminase autoantibodies to facilitate screening for pre-type 1 diabetes and celiac disease. Journal of Immunological Methods. 430, 28-32 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены