Method Article
Ein Hochdurchsatz-Elektrochemilumineszenz-7-Plex-Assay zum gleichzeitigen Screening auf Typ-1-Diabetes und mehrere Autoimmunerkrankungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir modellieren einen einfachen Multiplex-ECL-Assay, der 7 Autoantikörper-Assays miteinander kombiniert. Der Test ist in der Lage, gleichzeitig auf T1D und mehrere andere Autoimmunerkrankungen zu untersuchen, einschließlich Zöliakie, Autoimmunerkrankungen der Schilddrüse und autoimmunes polyglanduläres Syndrom 1.
Zusammenfassung
Inselautoantikörper (IAbs) werden häufig bei der Diagnose und Vorhersage von Typ-1-Diabetes (T1D) eingesetzt. Vier wichtige IAbs zu Insulin (IAA), Glutamat-Decarboxylase-65 (GADA), Insulinom-Antigen-2 (IA-2A) und Zinktransporter-8 (ZnT8A) sind bei der Krankheitsvorhersage gleichermaßen wichtig. Derzeit entwickeln bis zu 40% der Patienten, bei denen T1D diagnostiziert wurde, andere Autoimmunerkrankungen. Leider sind aktuelle Screening-Methoden, die einen einzigen Autoantikörper zur Messung verwenden, für groß angelegte Screening-Studien mühsam und ineffizient. Wir haben kürzlich einen einfachen Multiplex-Elektrochemilumineszenz-Assay (ECL) entwickelt, um diese aktuellen Probleme anzugehen. Der Assay kombiniert alle 7 Autoantikörpertests in einer Vertiefung. Jede Vertiefung enthält drei IAbs (IAA, GADA und IA-2A), Autoantikörper gegen Schilddrüsenperoxidase (TPOA) und Schilddrüsenglobulin (ThGA) zum Nachweis von Autoimmunerkrankungen der Schilddrüse, Autoantikörper gegen Gewebetransglutaminase (TGA) für Zöliakie und Autoantikörper gegen Interferon alpha (IFNαA) für autoimmunes polyglanduläres Syndrom-1 (APS-1); alle suchen gleichzeitig nach T1D und anderen relevanten Autoimmunerkrankungen. Der Multiplex-ECL-Assay basiert auf der Single-ECL-Assay-Plattform, verwendet jedoch stattdessen die Multiplex-Platte, die mehrere Autoantikörper-Assays bis zu 10 in einer einzigen Vertiefung kombiniert. Der Hauptunterschied zum einzelnen ECL-Assay besteht darin, dass jeder in der Fluidphase gebildete Antikörper-Antigen-Komplex durch ein Linkersystem auf der Multiplexplatte an eine bestimmte Stelle in jeder Vertiefung zurückgehalten wird. Der 7-Plex-ECL-Assay in der vorliegenden Studie wurde gegen Standard-Radiobindungstests (RBA) und einzelne ECL-Assays validiert, wobei eine große Kohorte neu diagnostizierter T1D-Patienten und altersentsprechende gesunde Kontrollen verwendet wurde, was zu einer ausgezeichneten Assay-Sensitivität und -Spezifität führt.
Einleitung
Typ-1-Diabetes (T1D) ist eine schwere chronische Erkrankung, die am häufigsten in der Kindheit auftritt. Derzeit haben rund 1,4 Millionen Menschen den T1D in den Vereinigten Staaten; Auffallend ist, dass die Inzidenz von T1D weltweit jedes Jahr stetig um 3-5% zunimmt und sich in den letzten zwei Jahrzehnten verdoppelt hat, insbesondere bei Kleinkindern 1,2. Inselautoantikörper (IAbs) im Blutkreislauf sind derzeit der zuverlässigste Biomarker. Das IAbs kann Jahre vor der Entwicklung des klinischen T1D auftreten3. Derzeit werden vier wichtige IAbs häufig in der T1D-Diagnose und im Risikoscreening eingesetzt, darunter Autoantikörper gegen Insulin (IAA), Glutamatdecarboxylase-65 (GADA), Insulinom-Antigen-2 (IA-2A) und Zinktransporter-8 (ZnT8A). Diese vier IAbs sind gleichermaßen wichtig für die Vorhersage der T1D-Entwicklung. Die Klassifizierung von T1D wurde kürzlich neu definiert als das Vorhandensein von ≥2 von 4 beliebigen IAbs mit einem normalen Glukosestoffwechsel als Krankheitsstadium 14.
In der Diabetes Autoimmunity Study in the Young (DAISY) wurde festgestellt, dass eines von vier Kindern mit einem Risiko für T1D wahrscheinlich zu Insel-, Zöliakie-, Schilddrüsen- oder rheumatoider Autoimmunität fortschreitet, und auffälliger ist, dass etwa 40% der Patienten, bei denen T1D diagnostiziert wurde, schließlich eine zusätzliche Autoimmunerkrankung entwickeln 5,6,7 . Die Identifizierung von Autoantikörpern ist für die Vorhersage und Diagnose dieser Autoimmunerkrankungen unerlässlich und sollte eine bessere klinische Versorgung der Patienten ermöglichen. Es gibt derzeit keine einfache und kostengünstige Möglichkeit, nach diesen multiplen Autoimmunerkrankungen zu suchen. Aktuelle Screening-Methoden mit Standard-Radiobindungsassay (RBA) mit einer einzigen Autoantikörpermessung sind mühsam und ineffizient für ein groß angelegtes Screening.
Hier werden wir den neu entwickelten einfachen Multiplex-ECL-Assay beschreiben, den wir mit einer einzigen ECL-Assay-Plattform 8,9,10,11 authentifiziert haben. Der Multiplex-ECL-Assay kombiniert 7 Autoantikörpertests in einer einzigen Vertiefung mit nur 15 μL Serum und ist in der Lage, gleichzeitig auf T1D und mehrere relevante Autoimmunerkrankungen zu untersuchen, einschließlich Zöliakie, Autoimmunerkrankungen der Schilddrüse und APS-1. Ein ZnT8A ECL-Assay war zu diesem Zeitpunkt noch nicht entwickelt worden und wurde nicht in den Multiplex-Assay aufgenommen. Der Multiplex-ECL-Assay bietet ein hervorragendes Werkzeug für den Hochdurchsatz beim allgemeinen Screening auf T1D und multiple Autoimmunerkrankungen.
Protokoll
Das Forschungsprotokoll wurde vom Colorado Multiple Institutional Review Board genehmigt.
1. Puffervorbereitung
- Machen Sie den Beschriftungspuffer (2x PBS, pH 7,9). Mit 400 ml destilliertem entionisiertem (DD) Wasser 100 mL 10x PBS hinzufügen. Um den pH-Wert der Lösung einzustellen, fügen Sie NaOH hinzu, bis es 7,9 erreicht.
- Erzeugen Sie 3 mM Biotin, indem Sie 1 mg Biotin in 588 μL zuvor erzeugten Markierungspuffer auflösen. Machen Sie 3 mM Ru Sulfo-NHS, indem Sie 150 nmol Ru Sulfo-NHS in 50 μL Markierungspuffer auflösen.
- Stellen Sie den Antigenpuffer (1% BSA) her, indem Sie 500 ml 1x PBS nehmen und 5 g Rinderserumalbumin (BSA) zur Lösung geben. Bereiten Sie 0,5 M Essigsäurelösung vor. Bereiten Sie 1 M Tris-HCl-Puffer mit Trizma Base vor und stellen Sie den pH-Wert auf 9,0 ein.
- Für den Beschichtungspuffer (3% Blocker A) nehmen Sie 500 ml 1x PBS und fügen Sie 15 g Blocker A hinzu. Bereiten Sie den Waschpuffer (0,05 % Tween 20, PBST) vor, indem Sie 5000 mL 1x PBS mit 2,5 mL Tween 20 mischen. Erstellen Sie Lesepuffer (2x Lesepuffer T mit Tensid) durch Zugabe von 500 mL DD-Wasser und 500 ml 4x Lesepuffer T mit Tensid.
HINWEIS: Um die Konsistenz zwischen den Assays zu wahren, ist es wichtig, dass sowohl die Biotin- als auch die Ru-Sulfo-NHS-Lösungen kurz vor dem Markierungsverfahren hergestellt und nicht für die zukünftige Verwendung erstellt und gelagert werden.
2. Markierung jedes Antigenproteins mit Biotin und Ru Sulfo-NHS separat
HINWEIS: Um eine effektivere Markierungsreaktion zu erzielen, verwenden Sie eine Antigenproteinkonzentration von ≥0,5 mg / ml.
- Berechnen Sie die molare Zahl jedes Antigenproteins und die molaren Zahlen des Biotins und Ru Sulfo-NHS. Fügen Sie eine angemessene Menge an Biotin oder Ru Sulfo-NHS zum Antigenprotein hinzu, um die Reaktion entsprechend dem molaren Verhältnis von Antigenprotein zu Biotin oder Ru Sulfo-NHS zu markieren.
- Für das Antigen mit dem kleineren Molekulargewicht (≤10 kDa), wie Proinsulinprotein, verwenden Sie ein molares Verhältnis von 1:5 (Antigen: Biotin und Ru Sulfo-NHS). Für das Antigen mit dem größeren Molekulargewicht (>50 kDa), wie das GAD-Protein, verwenden Sie ein molares Verhältnis von 1:20. Verwenden Sie für das Antigen mit einem mittleren Molekulargewicht (10-50 kDa) ein Molverhältnis, das zwischen 1:5-1:20 eingestellt ist.
- Sowohl für das Biotin als auch für Ru Sulfo-NHS dividieren Sie jedes Antigengewicht durch das entsprechende Molekulargewicht, um die Antigenmolarzahl für jedes zu erhalten. Teilen Sie die molare Zahl durch die Konzentration, um das Volumen für Biotin zu erhalten. Wiederholen Sie dies für Ru Sulfo-NHS.
- Mischen Sie das Antigenprotein mit Biotin unter Verwendung des richtigen molaren Verhältnisses, das in Schritt 2.2 bestimmt wird. Dann machen Sie dasselbe für Ru Sulfo-NHS.
HINWEIS: Für die Effizienz der Markierungsreaktion müssen alle reduzierenden Chemikalien wie Tris oder Glycin im Puffersystem durch die Größenspinsäule in 2x PBS-Puffer, pH 7,9 ausgetauscht werden. Die Kennzeichnungsprotokolle für Biotin und Ru Sulfo-NHS sind identisch. - Die Reaktionsröhrchen mit Aluminiumfolie abdecken und bei Raumtemperatur (RT) 1 h inkubieren. Der Grund, warum die Reaktionsröhrchen mit Folie bedeckt sind, ist, dass sowohl Biotin- als auch Ru-Sulfo-NHS-Reagenzien lichtempfindlich sind.
- Grundieren Sie die 2-ml- oder 5-ml-Spinsäule, während die Reaktionsröhrchen inkubieren (die Größe der Spinsäule wird durch das auf die Säule hochgeladene Volumen bestimmt). Füllen Sie die Spin-Säule mit 2x PBS-Puffer und zentrifugieren Sie sie dann bei 1.000 x g für jeweils 2 min, insgesamt dreimal.
- Stoppen Sie die Markierungsreaktion, nachdem die Reaktionsröhrchen inkubiert sind. Um die Reaktion zu stoppen, reinigen Sie das markierte Antigenprotein, indem Sie es einmal durch die Spinsäule leiten. Dann zentrifugieren Sie die Säule bei 1.000 x g für 2 min.
- Berechnen Sie die gesamte markierte Antigenkonzentration, indem Sie die Menge des vorhandenen Antigenproteins durch das Endvolumen dividieren. Aliquot 50 μL des gereinigt markierten Antigenproteins pro Röhrchen und speichern Sie die Aliquots bei -80 °C für die Langzeitanwendung.
HINWEIS: Es ist wichtig zu wissen, dass für jedes Mal, wenn die Spinsäule das Antigenprotein passiert, eine Retentionsrate von etwa 90-95% besteht.
3. Definieren Sie die beste Konzentration und das beste Verhältnis für die beiden markierten Antigene für den Assay (Schachbrett-Assay)
HINWEIS: Da der ECL-IAA-Assay in diesem 7-Plex-Assay eine saure Behandlung von Serumproben erfordert, muss der Schachbretttest für jedes Antigen diesen Schritt durchlaufen, bevor er mit der markierten Antigenmischung inkubiert wird.
- Wenden Sie den Schachbretttest für jedes Antigen separat an, bevor Sie den Multiplex-Test durchführen. In den Schritten 3.2-3.6 wird GAD65 als Beispiel verwendet.
- Berechnen Sie die Verdünnung des markierten GAD65-Proteins. Die empfohlene Zielkonzentration der ersten Mischungslösung von biotinyliertem GAD65 beträgt 2000 ng/ml und Ru Sulfo-NHS markiert GAD65 beträgt 1000 ng/ml. Wenn die Konzentration von biotinyliertem und Ru Sulfo-NHS-markiertem GAD65 in Stammlösung 1,0 μg/μL beträgt, beträgt das für biotinyliertes GAD65 in 560 μL Arbeitslösung benötigte Volumen 1,12 μL und das Volumen, das für Ru Sulfo-NHS mit GAD65 in 700 μL Arbeitslösung benötigt wird, 0,7 μL.
- Mischen Sie 1,12 μL biotinyliertes GAD65-Protein mit 240 μL Streptavidin-konjugiertem Linker 1 in einem Röhrchen und 160 μL 1% BSA. Inkubieren Sie die Mischung bei Raumtemperatur für 30 min. 160 μL Stopplösung in das Röhrchen geben und die Mischung bei Raumtemperatur für weitere 30 min inkubieren.
- Machen Sie eine serielle Verdünnung. Nehmen Sie 280 μL der Mischung in ein neues Röhrchen und fügen Sie 280 μL Stopplösung hinzu, um eine 1:2-Verdünnung herzustellen. Bereiten Sie mehrere neue Rohre vor. Wiederholen Sie diesen Schritt, um eine horizontale serielle Verdünnung für Biotin-markiertes GAD65-Antigen durchzuführen (siehe vorherige Veröffentlichung12).
- Mischen Sie 0,7 μL Ru Sulfo-NHS markiertes GAD65 (1 μg/μL) Protein mit 700 μL Stopplösung. Dann nehmen Sie 350 μL der Mischung in ein neues Röhrchen und fügen Sie 350 μL Stopplösung hinzu, um eine 1:2-Verdünnung herzustellen. Bereiten Sie mehrere neue Röhrchen vor und wiederholen Sie diesen Schritt, um eine vertikale serielle Verdünnung für Ru Sulfo-NHS-markiertes GAD65-Antigen durchzuführen.
- Bereiten Sie zwei Serumproben vor, eine sehr positive Probe für GADA und eine negative Probe für GADA, jede mit einem Volumen von 0,75 ml. Aliquot 15 μL positives Serum in jede Vertiefung auf der linken Hälfte der 96-Well-PCR-Platte. Aliquot 15 μL negatives Serum in jede Vertiefung auf der rechten Hälfte der 96-Well-PCR-Platte.
- 18 μL 0,5 M Essigsäure in jede Vertiefung geben und mischen. Inkubieren Sie für 45 min bei RT. Bereiten Sie eine neue 96-Well-PCR-Platte vor. Fügen Sie 17,5 μL des mit Biotin markierten Antigens und 17,5 μL des Ru Sulfo-NHS-markierten Antigens entsprechend den seriellen Verdünnungen in jede Vertiefung hinzu (siehe vorherige Publikation12).
- Fahren Sie mit den restlichen Analyseschritten fort, die in Schritt 5.2 bis 9.1 beschrieben sind.
- Bestimmen Sie das Signalverhältnis aus den hohen positiven Abtastungen gegen die entsprechenden negativen Abtastsignale. Wählen Sie die beste Konzentration für das Biotin-markierte Antigen und das Ru Sulfo-NHS-markierte Antigen, indem Sie den Punkt identifizieren, der das höchste oder nahe am höchsten Verhältnis von positivem zu negativem Signal aufweist. Berücksichtigen Sie bei dieser Verhältnisberechnung das niedrige Hintergrundsignal, das aus den negativen Proben erhalten wird.
HINWEIS: Die optimalen Konzentrationen von Ru Sulfo-NHS und Biotin-markierten Antigenproteinen aus Schachbrett-Assays sind unten dargestellt: 30 ng/ml und 200 ng/ml für GAD65, 120 ng/ml und 120 ng/ml für Proinsulin, 10 ng/ml und 42 ng/ml für IA-2, 80 ng/ml und 80 ng/ml für TG, 8 ng/ml und 16 ng/ml für TPO, 31 ng/ml und 31 ng/ml für ThG und 12 ng/ml und 12 ng/ml für IFNα.
4. Erstellen Sie die gemischte Linker-gekoppelte Antigenlösung
- Wählen Sie die optimale Konzentration für jedes Antigen basierend auf dem Schachbrett-Assay. Verdünnen Sie das Biotin- und Ru-Sulfo-NHS-markierte Antigen auf die rationale Arbeitskonzentration.
- Binden Sie verschiedene Linker an jedes der einzigartig biotinylierten Antigenproteine. Für einen 96-Well-Plattentest werden 4 μL biotinyliertes GAD65-, TPO-, tTG-, ThG-, Proinsulin-, IFN-α- und IA-2-Protein mit 240 μL Streptavidin-konjugiertem Linker 1, 2, 3, 4, 8, 9 und 10 in ein separates Röhrchen gemischt (Abbildung 1). Dann fügen Sie 156 μL PBS/1% BSA pro Röhrchen hinzu. Inkubieren Sie die Mischung bei Raumtemperatur für 30 min.
- Geben Sie 160 μL Stopplösung in jedes Röhrchen und inkubieren Sie sie bei Raumtemperatur für weitere 30 Minuten. Nehmen Sie 400 μL Linker-gekoppeltes Antigen aus jedem Röhrchen und kombinieren Sie alle 7 Antigene miteinander. Fügen Sie 1,2 ml Stopplösung hinzu und fügen Sie dann 4 μL Ru Sulfo-NHS-markiertes GAD65-, TPO-, tTG-, ThG-, Proinsulin-, IFN-α- und IA-2-Antigen zu der Mischung hinzu. Jetzt ist die Antigenlösung bereit, im Assay verwendet zu werden.
5. Serumproben mit dem markierten Antigen inkubieren
HINWEIS: Da der ECL-IAA-Assay in diesem 7-Plex-Assay eine saure Behandlung von Serumproben erfordert, erfordert jedes Serum den Säurebehandlungsschritt, bevor es mit einer markierten Antigenmischung für diesen 7-Plex-Assay inkubiert wird.
- Aliquot 15 μL Serum pro Vertiefung für eine 96-Well-PCR-Platte. 18 μL 0,5 M Essigsäure in jede Vertiefung geben und mischen. Inkubieren Sie für 45 min bei RT. Bereiten Sie eine neue 96-Well-PCR-Platte vor und aliquot 35 μL Antigenlösung in jede Vertiefung.
- Während die Platte noch inkubiert, fügen Sie 13 μL 1 M Tris pH 9,0-Puffer in jede Vertiefung in der Antigenplatte hinzu. Fügen Sie Puffer an der Seite jeder Vertiefung hinzu, um die Vermischung von Tris-Puffer und Antigen zu begrenzen. Nach Abschluss der Inkubation nehmen Sie 25 μL des säurebehandelten Serums und pipetten es sofort in jede Vertiefung auf der Antigenplatte. Rühren Sie die Lösung und bedecken Sie die Platte mit PCR-Siegelfolie, um Lichteinwirkung zu vermeiden.
- Bei RT legen Sie die Platte für 1 h auf einen Shaker, der auf eine niedrige Geschwindigkeit eingestellt ist. Anschließend die Platte bei 4 °C lagern und 18-24 h inkubieren lassen.
6. Bereiten Sie die Multiplexplatte vor
- Nehmen Sie eine Multiplexplatte aus dem 4 °C heißen Kühlschrank und lassen Sie die Platte zu RT kommen. Sobald die Multiplexplatte bei RT ist, fügen Sie 150 μL 3% Blocker A zu jeder Vertiefung hinzu. Decken Sie die Multiplexplatte mit Dichtfolie ab. Die Platte über Nacht in einem 4 °C heißen Kühlschrank anbrüten.
HINWEIS: Analysetag 1 umfasst die Schritte 4 bis 6.
7. Serum/Antigen in die Multiplexplatte überführen
- Am nächsten Tag legen Sie Papierhandtücher auf den Tisch und nehmen Sie die Brut-Multiplexplatte aus dem Kühlschrank. Entleeren Sie den gesamten Puffer aus der Platte. Um dies zu tun, drehen Sie den Teller auf den Kopf und klopfen Sie ihn auf die vorbereiteten Papiertücher, bis in keinem der Brunnen Puffer vorhanden ist.
- Waschen Sie die Multiplexplatte, indem Sie 150 μL PBST in jede Vertiefung geben. Verwerfen Sie den Puffer, wie in Schritt 7.1. erwähnt, und wiederholen Sie diesen Schritt dreimal. Geben Sie 30 μL Serum/Antigen-Inkubate in jede Vertiefung in der Multiplexplatte. Decken Sie die Platte mit Folie ab, um die Lichteinwirkung zu begrenzen. Stellen Sie die Platte auf einen Plattenschüttler, der auf eine niedrige Geschwindigkeit eingestellt ist, bei RT für 1 h.
8. Waschen Sie die Platte und fügen Sie Lesepuffer hinzu
- Entfernen Sie die Serum-/Antigen-Inkubate von der Multiplexplatte, indem Sie die Platte kopfüber halten und die Lösung herausstreichen. Geben Sie 150 μL PBST in alle Vertiefungen und entfernen Sie den Puffer von der Platte, indem Sie die Platte erneut auf den Kopf stellen und die Lösung herausstreichen. Wiederholen Sie diesen Schritt dreimal. Nachdem die dritte Wäsche abgeschlossen ist, fügen Sie 150 μL Reading-Puffer in jede Vertiefung hinzu.
HINWEIS: Luftblasen beeinträchtigen die Fähigkeit des Plattenlesers, die Ergebnisse der Platte genau zu analysieren, und sollten um jeden Preis vermieden werden.
9. Lesen Sie die Platte und analysieren Sie die Daten
- Zählen Sie die vorbereitete Platte auf dem Plattenlesegerät und lesen Sie alle Werte in Zählungen pro Sekunde (CPS) ab.
- Berechnen Sie den relativen Index für den Assay unter Verwendung der Antikörperspiegel, die von der Plattenlesemaschine erhalten wurden, mit der folgenden Gleichung:
Indexwert = [CPS (Stichprobe) - CPS (negativer Standard)] / [CPS (positiver Standard) - CPS (negativer Standard)]. - Bestimmen Sie, welche Antikörperergebnisse negativ oder positiv sind, indem Sie die festgelegten Grenzwerte verwenden.
HINWEIS: Untersuchungstag 2 umfasst die Schritte 7 bis 9.
Ergebnisse
Die Analyse der Untersuchungsergebnisse wurde in Tabelle 1, Tabelle 2 und Tabelle 3 gezeigt. Die Messwerte stammen aus den Daten der 10 Punkte innerhalb desselben Bohrlochs. Die Indexwerte für jede Probe wurden anhand der entsprechenden internen Positiv- und Negativkontrollen berechnet, wie im Assay-Protokoll beschrieben. Beispiele für fehlerhafte Duplikate sind in Tabelle 1 aufgeführt und verursachten den endgültigen Indexberechnungsfehler in Tabelle 3. Alle Rohzählwerte müssen überprüft werden, um falsch positive oder falsch negative Ergebnisse zu vermeiden.
Der 7-multiplexte ECL-Test wurde anhand einer großen Kohorte von Proben von 1026 neu diagnostizierten Patienten mit T1D und 1022 mit Alter und Geschlecht übereinstimmenden gesunden Kontrollpersonen validiert. Die Konzentrationen von Autoantikörpern aus dem 7-Plex-ECL-Assay für 1026 T1D-Patienten wurden mit den Konzentrationen aus jedem unserer entsprechenden etablierten Einzel-ECL-Assays verglichen, wie in Abbildung 2 gezeigt, und aus jedem entsprechenden einzelnen Standard-RBA und ELISA, wie in Abbildung 3 gezeigt. Die Assay-Spezifitäten wurden bei 99. Perzentilen für alle Autoantikörper-Assays mit Ausnahme von Schilddrüsen-Autoantikörpern (wo das 95. Perzentil verwendet wurde) von 1022 gesunden Kontrollen für alle drei Assay-Methoden (7-Plex-ECL, Single ECL, RBA oder ELISA) identisch aufgestellt, wie in Tabelle 4 aufgeführt. Die Inter-Assay-CVs von GADA, IA-2A, IAA, TPOA, ThGA, TGA und IFNαA betragen 6,4%, 4,5%, 9,1%, 4,9%, 5,7%, 11,3% bzw. 5,9%.
Eine kleine Anzahl von diskordanten Proben für jeden der 7 Autoantikörper wurde um die Grenze der Cut-offs für jeden Assay gefunden (Abbildung 2 und Abbildung 3). Elf Kontrollproben (11/1022, 1,1%) wurden nur im 7-Plex-Assay als multiple Autoantikörper positiv und in jedem entsprechenden Einzelassay negativ befunden. In ähnlicher Weise geschah es in 9 Proben der T1D-Patienten (9/1026, 0,9%). Darüber hinaus wurden 10 hoch positive TPOA und eine ThGA in der Patientenkohorte, die sowohl im einzelnen ECL-Assay als auch in der RBA beobachtet wurden, im 7-Plex-Assay übersehen. Diese Proben wurden im 7-Plex-Assay positiv umgewandelt, wenn sie weiter verdünnt wurden. Im Allgemeinen wurden 100 % der Positivität im einzelnen ECL-Assay oder RBA im 7-Plex-ECL-Assay abgedeckt, mit der gleichen Assay-Spezifität wie in Tabelle 4 dargestellt.
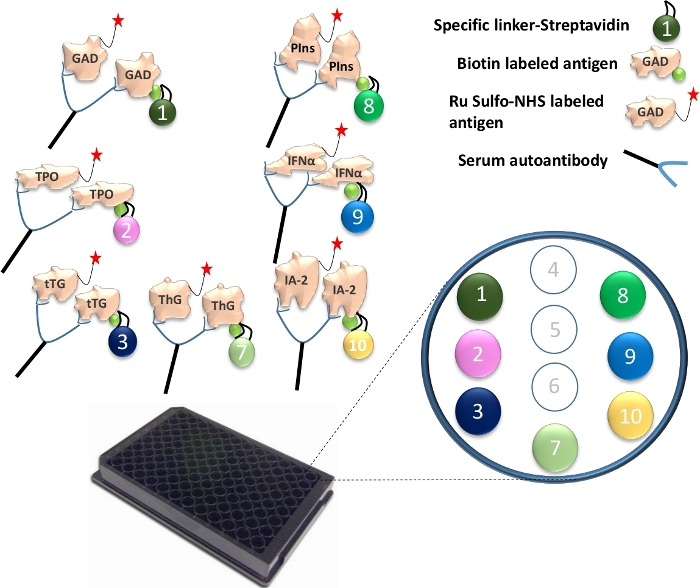
Abbildung 1: Illustration des Mutiplex ECL-Assays.
Autoantikörper im Serum überbrücken das Ru-Sulfo-NHSged-Antigen zum biotinylierten Antigen. Dies wird mit einem spezifischen Linker gekoppelt, um einen Komplex von Antigen-Antikörper-Antigen-Linkern zu bilden. Die Komplexe werden auf der Platte erfasst und durch jeden spezifischen Linker an ihren spezifischen Stellen festgehalten. Die spezifisch gekoppelten Linkernummern für die 7 verschiedenen Antigenproteine sind dargestellt. Der Nachweis von Antikörpersignalen erfolgt unter Verwendung von Ru Sulfo-NHS-markierten Antigenen mit Elektrochemilumineszenz. Die Abbildung stammt aus Gu, Y. et al.13. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
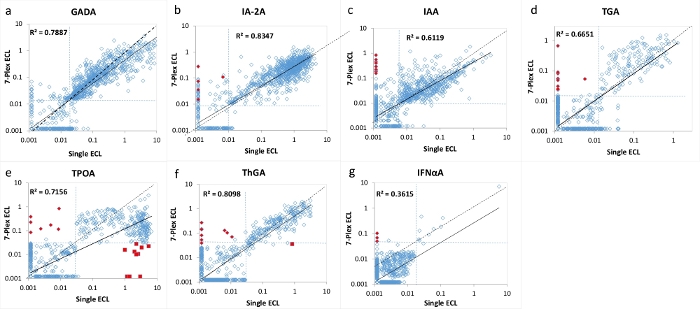
Abbildung 2: Vergleich von 7 Autoantikörperspiegeln bei 1026 neu auftretenden Patienten mit T1D zwischen dem einzelnen ECL-Assay und dem 7-Plex-ECL-Assay.
Die Panels a, b, c, d, e, f und g zeigen Vergleiche der Autoantikörperspiegel für GADA, IA-2A, IAA, TGA, TPOA, ThGA bzw. IFNαA. Die gestrichelten Linien stellen die Assay-Cut-offs für jeden Autoantikörper-Assay dar. Die Cut-offs wurden auf das 99. Perzentil von 1022 altersangepassten gesunden Kontrollen für jeden Assay festgelegt (mit Ausnahme von TPOA und ThGA, die auf das 95. Perzentil festgelegt wurden), wie in Tabelle 4 gezeigt, von 1022 altersentsprechenden gesunden Kontrollen für Einzel- und Multiplex-ECL-Assays. Rote geschlossene Diamanten werden im 7-Plex-ECL-Assay als "falsch" positiv markiert, <1% der untersuchten Kohorte, und sie wurden sowohl in der einzelnen ECL als auch in der RBA als negativ validiert. Rote geschlossene Quadrate werden im 7-Plex-ECL-Assay als "falsche" Negative markiert, die durch das "Prozone"-Phänomen verursacht werden und hauptsächlich im TPOA-Assay bei <1% der untersuchten Kohorte auftreten. Sowohl diese falsch positiven als auch diese falsch negativen Ergebnisse werden im Diskussionsabschnitt diskutiert. Die Abbildung stammt aus Gu, Y. et al.13. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
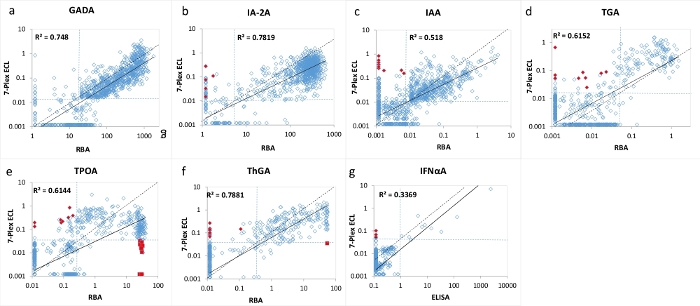
Abbildung 3: Vergleich von 7 Autoantikörperspiegeln bei 1026 neu auftretenden Patienten mit T1D zwischen dem RBA (ELISA für IFNαA) und dem 7-Plex ECL-Assay.
Die Panels a, b, c, d, e, f und g zeigen Vergleiche der Autoantikörperspiegel für GADA, IA-2A, IAA, TGA, TPOA, ThGA bzw. IFNαA. Die gestrichelten Linien stellen die Assay-Cut-offs für jeden Autoantikörper-Assay dar, die gleiche Spezifität, die sowohl für RBA als auch für den 7-Plex-ECL-Assay festgelegt wurde, wie in Tabelle 4 gezeigt, von 1022 altersgerechten gesunden Kontrollen. Rote geschlossene Diamanten und Quadrate stellen "falsche" Positive und "falsche" Negative dar, die im 7-Plex-ECL-Test erscheinen, dasselbe ist in Abbildung 2 dargestellt. Die Abbildung stammt aus Gu, Y. et al.13. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| 1 | 2 | 3 | 4 | 5 | 6 | ||
| Ein | 5580 | 5674 | 105 | 117 | 125 | 139 | Linker-1 |
| 100 | 108 | 102 | 102 | 3956 | 3745 | Linker-2 | |
| 115 | 124 | 107 | 116 | 113 | 124 | Linker-3 | |
| 67 | 64 | 68 | 61 | 65 | 69 | Linker-4 | |
| 89 | 87 | 98 | 92 | 90 | 80 | Linker-5 | |
| 87 | 71 | 89 | 87 | 61 | 72 | Linker-6 | |
| 94 | 82 | 79 | 85 | 2154 | 2280 | Linker-7 | |
| 75 | 66 | 1628 | 1594 | 81 | 83 | Linker-8 | |
| 98 | 103 | 71 | 84 | 69 | 85 | Linker-9 | |
| 102 | 118 | 93 | 98 | 113 | 99 | Linker-10 | |
| B | 324 | 337 | 147 | 148 | 5426 | 5366 | Linker-1 |
| 101 | 102 | 93 | 88 | 86 | 74 | Linker-2 | |
| 111 | 119 | 119 | 123 | 66 | 72 | Linker-3 | |
| 72 | 65 | 59 | 68 | 74 | 67 | Linker-4 | |
| 81 | 98 | 83 | 92 | 79 | 72 | Linker-5 | |
| 90 | 84 | 93 | 86 | 70 | 76 | Linker-6 | |
| 101 | 105 | 101 | 97 | 956 | 944 | Linker-7 | |
| 82 | 83 | 189 | 204 | 97 | 90 | Linker-8 | |
| 92 | 83 | 78 | 64 | 82 | 78 | Linker-9 | |
| 83 | 79 | 88 | 93 | 4722 | 4965 | Linker-10 | |
| C | 110 | 110 | 87 | 81 | 2114 | 2365 | Linker-1 |
| 5526 | 5680 | 88 | 70 | 86 | 93 | Linker-2 | |
| 114 | 132 | 67 | 71 | 3326 | 3284 | Linker-3 | |
| 64 | 62 | 88 | 74 | 64 | 80 | Linker-4 | |
| 94 | 82 | 86 | 75 | 89 | 76 | Linker-5 | |
| 77 | 87 | 75 | 63 | 70 | 86 | Linker-6 | |
| 77 | 86 | 71 | 84 | 138 | 121 | Linker-7 | |
| 73 | 86 | 80 | 79 | 59 | 73 | Linker-8 | |
| 86 | 74 | 5064 | 4923 | 88 | 86 | Linker-9 | |
| 105 | 113 | 85 | 80 | 124 | 114 | Linker-10 | |
| D | 98 | 88 | 92 | 84 | 136 | 127 | Linker-1 |
| 288 | 291 | 86 | 86 | 558 | 564 | Linker-2 | |
| 109 | 101 | 74 | 73 | 141 | 127 | Linker-3 | |
| 78 | 66 | 66 | 55 | 74 | 66 | Linker-4 | |
| 79 | 83 | 79 | 86 | 96 | 91 | Linker-5 | |
| 83 | 86 | 96 | 89 | 86 | 73 | Linker-6 | |
| 87 | 89 | 77 | 87 | 841 | 855 | Linker-7 | |
| 74 | 72 | 60 | 72 | 90 | 95 | Linker-8 | |
| 68 | 75 | 331 | 328 | 2460 | 2580 | Linker-9 | |
| 86 | 98 | 80 | 75 | 123 | 133 | Linker-10 | |
| E | 101 | 114 | 101 | 106 | 532 | 548 | Linker-1 |
| 101 | 96 | 110 | 104 | 682 | 675 | Linker-2 | |
| 6015 | 5988 | 124 | 126 | 101 | 98 | Linker-3 | |
| 66 | 71 | 82 | 71 | 80 | 62 | Linker-4 | |
| 102 | 97 | 99 | 80 | 83 | 110 | Linker-5 | |
| 82 | 67 | 81 | 80 | 60 | 85 | Linker-6 | |
| 85 | 95 | 52 | 84 | 245 | 221 | Linker-7 | |
| 72 | 78 | 82 | 74 | 486 | 503 | Linker-8 | |
| 77 | 97 | 97 | 77 | 56 | 66 | Linker-9 | |
| 114 | 104 | 5726 | 5814 | 259 | 253 | Linker-10 | |
| F | 119 | 120 | 133 | 118 | 112 | 96 | Linker-1 |
| 101 | 91 | 100 | 95 | 96 | 82 | Linker-2 | |
| 406 | 395 | 111 | 123 | 2127 | 101 | Linker-3 | |
| 72 | 60 | 86 | 72 | 79 | 83 | Linker-4 | |
| 76 | 85 | 96 | 99 | 89 | 103 | Linker-5 | |
| 88 | 78 | 91 | 83 | 89 | 95 | Linker-6 | |
| 104 | 97 | 87 | 102 | 56 | 66 | Linker-7 | |
| 76 | 77 | 79 | 93 | 69 | 75 | Linker-8 | |
| 85 | 71 | 95 | 100 | 83 | 71 | Linker-9 | |
| 131 | 131 | 358 | 364 | 92 | 86 | Linker-10 | |
| G | 90 | 95 | 85 | 82 | 105 | 107 | Linker-1 |
| 99 | 86 | 77 | 76 | 1250 | 1174 | Linker-2 | |
| 119 | 123 | 120 | 118 | 112 | 108 | Linker-3 | |
| 76 | 83 | 77 | 80 | 86 | 76 | Linker-4 | |
| 88 | 86 | 86 | 93 | 107 | 92 | Linker-5 | |
| 73 | 73 | 71 | 82 | 84 | 75 | Linker-6 | |
| 5210 | 5173 | 72 | 69 | 76 | 85 | Linker-7 | |
| 80 | 81 | 79 | 82 | 100 | 101 | Linker-8 | |
| 96 | 97 | 89 | 83 | 65 | 83 | Linker-9 | |
| 98 | 103 | 86 | 88 | 1933 | 1979 | Linker-10 | |
| H | 114 | 124 | 81 | 86 | 299 | 295 | Linker-1 |
| 107 | 92 | 69 | 72 | 4256 | 4388 | Linker-2 | |
| 114 | 123 | 125 | 129 | 501 | 536 | Linker-3 | |
| 77 | 70 | 67 | 64 | 74 | 62 | Linker-4 | |
| 92 | 110 | 81 | 84 | 77 | 71 | Linker-5 | |
| 87 | 79 | 72 | 76 | 83 | 81 | Linker-6 | |
| 328 | 341 | 84 | 80 | 88 | 97 | Linker-7 | |
| 75 | 84 | 75 | 90 | 74 | 83 | Linker-8 | |
| 73 | 79 | 78 | 76 | 84 | 70 | Linker-9 | |
| 113 | 120 | 81 | 76 | 2372 | 2350 | Linker-10 | |
Tabelle 1: Analyse des 7-Plex-ECL-Assays: rohe CPS-Zahlen (linke Hälfte der Platte). Die CPS-Rohzählungen werden von einer Assay-Platte (der linken Hälfte der Platte) erfasst und jede Probe wird in doppelter Ausführung durchgeführt. Unter jeder Zeile der Platte (A-H) befinden sich 10 Zeilen mit Lesewerten, die die Daten der 10 Punkte innerhalb desselben Brunnens darstellen und jeder markierten Linkernummer entsprechen. Beispiele für fehlerhafte Duplikate sind grau hervorgehoben, wie in Zeile F-Linker 3-Spalten 5 und 6 zu sehen ist.
| Zeile der Tabelle 1A | Spalte der Tabelle 1A | Linker 1 | Linker 2 | Linker 3 | Linker 7 | Linker 8 | Linker 9 | Linker 10 | |
| Ein | 1-2 | GADA PC | 5627 | 104 | 120 | 88 | 71 | 101 | 110 |
| B | 1-2 | GADA Low PC | 331 | 102 | 115 | 103 | 83 | 88 | 81 |
| C | 1-2 | TPOA PC | 110 | 5603 | 123 | 82 | 80 | 80 | 109 |
| D | 1-2 | TPOA Low PC | 93 | 290 | 105 | 88 | 73 | 72 | 92 |
| E | 1-2 | TGA PC | 108 | 99 | 6002 | 90 | 75 | 87 | 109 |
| F | 1-2 | TG Low PC | 120 | 96 | 401 | 101 | 77 | 78 | 131 |
| G | 1-2 | ThGA PC | 93 | 93 | 121 | 5192 | 81 | 97 | 101 |
| H | 1-2 | ThGA Low PC | 119 | 100 | 119 | 335 | 80 | 76 | 117 |
| Ein | 3-4 | IAA PC | 111 | 102 | 112 | 82 | 1611 | 78 | 96 |
| B | 3-4 | IAA Low PC | 148 | 91 | 121 | 99 | 197 | 71 | 91 |
| C | 3-4 | IFNaA PC | 84 | 79 | 69 | 78 | 80 | 4994 | 83 |
| D | 3-4 | IFNaA Low PC | 88 | 86 | 74 | 82 | 66 | 330 | 78 |
| E | 3-4 | IA-2A PC | 104 | 107 | 125 | 68 | 78 | 87 | 5770 |
| F | 3-4 | IA-2A Niedriger PC | 126 | 98 | 117 | 95 | 86 | 98 | 361 |
| G | 3-4 | NC | 84 | 77 | 119 | 71 | 81 | 86 | 87 |
| H | 3-4 | NC | 84 | 71 | 127 | 82 | 78 | 77 | 79 |
| Ein | 5-6 | Beispiel1 | 132 | 3851 | 119 | 2217 | 82 | 77 | 106 |
| B | 5-6 | Beispiel2 | 5396 | 80 | 69 | 950 | 94 | 80 | 4844 |
| C | 5-6 | Beispiel3 | 2240 | 90 | 3305 | 130 | 66 | 87 | 119 |
| D | 5-6 | Beispiel4 | 132 | 561 | 134 | 848 | 93 | 2520 | 128 |
| E | 5-6 | Beispiel5 | 540 | 679 | 100 | 233 | 495 | 61 | 256 |
| F | 5-6 | Beispiel6 | 104 | 89 | 1114 | 61 | 72 | 77 | 89 |
| G | 5-6 | Beispiel7 | 106 | 1212 | 110 | 81 | 101 | 74 | 1957 |
| H | 5-6 | Beispiel8 | 297 | 4322 | 519 | 93 | 79 | 77 | 2361 |
Tabelle 2: Analyse des 7-Plex-ECL-Assays: Anordnung der Daten der Tabelle 1, markiert als 7 Linker. Die Daten aus Tabelle 1 wurden neu angeordnet, wobei die Linker 4 bis 6 (nicht verwendet) gestrichen wurden, und Mittelwerte wurden aus jedem Duplikat aus Tabelle 1 berechnet. Die Werte der internen Standard-High- und Low-Positivkontrollen, die jedem Autoantikörpertest entsprechen, die durch einen bestimmten Linker zurückgehalten werden, sind dunkel fett gedruckt. PC, Positivkontrolle. NC, normale Steuerung.
| GAD-Index | TPOA-Index | TGA-Index | ThGA-Index | IAA-Index | IFNaA-Index | IA-2A-Index | |
| GADA PC | 1.000 | 0.005 | 0.000 | 0.003 | -0.006 | 0.003 | 0.004 |
| GADA Low PC | 0.045 | 0.005 | -0.001 | 0.006 | 0.002 | 0.000 | -0.001 |
| IAA PC | 0.005 | 1.000 | 0.001 | 0.002 | -0.001 | -0.001 | 0.004 |
| IAA Low PC | 0.002 | 0.039 | -0.002 | 0.003 | -0.005 | -0.003 | 0.001 |
| IA-2A PC | 0.004 | 0.004 | 1.000 | 0.004 | -0.004 | 0.000 | 0.004 |
| IA-2A Niedriger PC | 0.007 | 0.004 | 0.048 | 0.006 | -0.002 | -0.002 | 0.008 |
| TGA PC | 0.002 | 0.003 | 0.000 | 1.000 | 0.000 | 0.002 | 0.002 |
| TG Low PC | 0.006 | 0.004 | 0.000 | 0.052 | -0.001 | -0.002 | 0.005 |
| TPOA PC | 0.005 | 0.005 | -0.001 | 0.002 | 1.000 | -0.002 | 0.001 |
| TPOA Low PC | 0.012 | 0.003 | 0.000 | 0.006 | 0.076 | -0.003 | 0.001 |
| ThGA PC | 0.000 | 0.000 | -0.008 | 0.001 | 0.000 | 1.000 | -0.001 |
| ThGA Low PC | 0.001 | 0.002 | -0.008 | 0.002 | -0.009 | 0.050 | -0.002 |
| IFNaA PC | 0.004 | 0.006 | 0.001 | 0.000 | -0.002 | 0.000 | 1.000 |
| IFNaA Low PC | 0.008 | 0.004 | 0.000 | 0.005 | 0.004 | 0.002 | 0.048 |
| NC | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| NC | 0.000 | -0.001 | 0.001 | 0.002 | -0.002 | -0.002 | -0.001 |
| Beispiel1 | 0.009 | 0.683 | 0.000 | 0.419 | 0.001 | -0.002 | 0.003 |
| Beispiel2 | 0.958 | 0.001 | -0.008 | 0.172 | 0.009 | -0.001 | 0.837 |
| Beispiel3 | 0.389 | 0.002 | 0.542 | 0.012 | -0.009 | 0.000 | 0.006 |
| Beispiel4 | 0.009 | 0.088 | 0.003 | 0.152 | 0.008 | 0.496 | 0.007 |
| Beispiel5 | 0.082 | 0.109 | -0.003 | 0.032 | 0.271 | -0.005 | 0.030 |
| Beispiel6 | 0.004 | 0.002 | 0.169 | -0.002 | -0.006 | -0.002 | 0.000 |
| Beispiel7 | 0.004 | 0.205 | -0.002 | 0.002 | 0.013 | -0.002 | 0.329 |
| Beispiel8 | 0.039 | 0.768 | 0.068 | 0.004 | -0.001 | -0.002 | 0.400 |
Tabelle 3: Analyse des 7-plex-ECL-Assays: Ergebnisse der Indexwerte. Die Indexwerte für jede Probe für alle 7 Autoantikörper-Assays wurden gegen die entsprechenden internen Positiv- und Negativkontrollen berechnet, wie im Assay-Protokoll beschrieben. Jeder Indexwert, der größer als der Cut-off-Wert war, wurde als positives Ergebnis definiert und dunkel fett dargestellt. Der TGA-Indexwert von Beispiel6 wurde grau hervorgehoben, da es sich um einen Fehler handelt, der durch fehlerhafte Duplikate verursacht wird, die in Zeile F-Linker 3-Spalten 5 und 6 in Tabelle 1 angezeigt werden.
| GADA | IA-2A | IAA | .TGA | TPOA | ThGA | IFNαA* | ||||||||
| Sens | Spekulation | Sens | Spekulation | Sens | Spekulation | Sens | Spekulation | Sens | Spekulation | Sens | Spekulation | Sens | Spekulation | |
| RBA | 73.4% | 98.5% | 75.2% | 99.0% | 47.7% | 99.1% | 12.9% | 99.0% | 23.9% | 95.2% | 19.3% | 94.7% | 1.0% | 99.6% |
| Einzelne ECL | 71.6% | 99.1% | 73.6% | 99.3% | 48.3% | 99.7% | 16.0% | 98.9% | 26.3% | 94.9% | 20.6% | 95.1% | 0.8% | 99.2% |
| 7-Plex ECL | 71.2% | 98.9% | 77.3% | 98.9% | 49.5% | 98.9% | 16.5% | 98.7% | 26.1% | 94.7% | 21.1% | 94.7% | 1.7% | 99.1% |
Tabelle 4: Assay-Sensitivität und -Spezifität bei 1026 T1D-Patienten und 1022 Kontrollen, abgestimmt nach Alter und Geschlecht, in einem 7-Plex-ECL-Assay im Vergleich zum entsprechenden einzelnen ECL-Assay und RBA oder ELISA*. Die verschiedenen Assays (RBA, Single ECL und 7-Plex ECL) für jeden Autoantikörper wurden unter Verwendung der 1022 alters- und geschlechtsangepassten gesunden Kontrollen auf ähnliche Besonderheiten eingestellt. Das Spezifitätsergebnis der untersuchten Kontrollkohorte lag bei 95% für TPOA und ThGA und bei 99% für die 5 anderen Assays. *Sternchen markiert den IFNαA-Assay für ELISA, während andere RBA sind.
Diskussion
In zahlreichen nationalen und internationalen klinischen Studien für Typ-1-Diabetes wurde die Leistung des einzelnen ECL-Assays zum Nachweis von Inselautoantikörpern und Autoantikörpern gegen Transglutaminase (TGA) bei Zöliakie untermauert 8,9,10,11. Während dieser Trails hat dieser Assay die Sensitivität und Spezifität für den Autoantigennachweis erhöht, wenn er mit dem bestehenden "Gold"-Standard RBA bewertet wird. Die erhöhte Krankheitsspezifität kann beobachtet werden, wenn zwischen dem einzelnen ECL-Assay und dem RBA14,15,16,17 Inselautoantikörper mit hoher Affinität und Signalen mit niedrigem Risiko und niedrigem Risiko unterschieden werden. Aufbauend auf dem einzelnen ECL-Assay entwickeln wir einen neuen Multiplex-ECL-Autoantikörper-Assay mit hohem Durchsatz, der es uns ermöglicht, gleichzeitig nach T1D sowie mehreren anwendbaren Autoimmunerkrankungen zu suchen.
Der Multiplex-ECL-Assay verwendet die Multiplexplatte, die bis zu 10 Autoantikörper-Assays in einer einzigen Vertiefung kombinieren kann. Für die vorliegende Studie werden 7 Autoantikörper-Assays miteinander kombiniert. Die Autoantikörper bestehen aus 3 IAbs (IAA, GADA und IA-2A), 2 Autoimmun-Autoantikörpern für Schilddrüsenerkrankungen (TPOA und ThGA), Zöliakie-Autoantikörpern (TGA) und APS-1-Autoantikörpern gegen Interferon alpha (IFNαA). Der Assay-Mechanismus basiert im Allgemeinen auf einem einzigen ECL-Assay, wie zuvor veröffentlicht 9,10,12,18 mit einigen Modifikationen. Der Hauptunterschied eines Multiplex-ECL-Assays zu einem einzelnen ECL-Assay besteht darin, dass jeder in der Fluidphase gebildete Antikörper-Antigen-Komplex auf einen bestimmten Linker beschränkt ist (Abbildung 1). Das Biotin-markierte Antigen wird mit dem konjugierten Streptavidin inkubiert, einem Linker, der zur Bildung eines spezifischen Antigen-Linker-Komplexes verwendet wird. Antikörper-Antigen-Immunkomplex bildet sich nach Inkubation mit Patientenserum und wird durch das spezifische Linkersystem auf jeder Vertiefung der Multiplexplatte an einer bestimmten Stelle eingefangen. Ru Sulfo-NHS markiertes Antigen, das gleichzeitig von Antikörpern eingefangen wird, liefert das Signal mit Elektrochemilumineszenz. Die Plattenlesmaschine kann bis zu 10 verschiedene Signale von den Punktquellen in jedem Bohrloch erkennen. Um Autoantikörper-Assays zwischen den Platten und bei der Durchführung von Langzeitstudien konsistent zu halten, empfehlen wir, dass derselbe Linker verwendet wird.
Vor der Einrichtung eines Multiplex-ECL-Assays müssen einzelne ECL-Assays für jeden Autoantikörper auf einer Multiplexplatte optimiert und sowohl gegen RBA- als auch gegen einzelne ECL-Assays auf einer regulären ECL-Platte validiert werden. Zur Verbesserung des Schachbrett-Assays wurden zum zugehörigen Autoantikörper-Assay auf der Multiplexplatte eine hochpositive Patienten- und eine negative Patientenprobe verwendet. Nachdem der Schachbretttest durchgeführt wurde, wurden die idealsten Konzentrationen für Ru Sulfo-NHS und Biotin-markiertes Antigen für jeden der 7 Autoantikörper-Assays berechnet. Im Folgenden sind diese Konzentrationen dargestellt: 30 ng/ml und 200 ng/ml für GAD65, 120 ng/ml und 120 ng/ml für Proinsulin, 10 ng/ml und 42 ng/ml für IA-2, 80 ng/ml und 80 ng/ml für TG, 8 ng/ml und 16 ng/ml für TPO, 31 ng/ml und 31 ng/ml für ThG, und 12 ng/ml bzw. 12 ng/ml für IFNα13. Die Konzentrationen einiger Antigene aus dem Schachbretttest müssen möglicherweise entsprechend den Ergebnissen des tatsächlichen Multiplex-Assays weiter angepasst werden, nachdem alle Assays kombiniert wurden.
Da IAA im vorliegenden Multiplex-ECL-Assay enthalten ist, ist eine saure Behandlung von Serumproben obligatorisch, bevor das Serum mit Antigen inkubiert wird, wie in der vorherigen Studieberichtet 12. Wenn einem Multiplex-Assay ein zusätzlicher Autoantikörper hinzugefügt wird, wird im Allgemeinen der Assay-Hintergrund beeinflusst, und ein extrem hohes Signal von einem Punkt im Bohrloch kann die Ergebnisse nahegelegener Spots durch Übersprechen behindern. Daher muss das maximale CPS auf 20.000 Zählungen für jeden Autoantikörper oder niedriger für die höchsten positiven Proben begrenzt werden. Um das Übersprechen zu reduzieren, sollten unseres Wissens Autoantikörper mit niedrigerem Hintergrund beim Entwurf der Spotkarte weit entfernt von Spots mit einer höheren Häufigkeit von Zählungen getrennt werden.
Hohe Positiv- und Negativkontrollen wurden intern in jedem Assay verwendet, um einen genauen Index für die unbekannten getesteten Proben zu berechnen. Um die Empfindlichkeit des Assays genau zu beurteilen und zu überwachen, wurden niedrige Positivkontrollen verwendet, die nahe der oberen Grenze des Assays lagen. Diese Standard-Positiv- und Negativkontrollen wurden in loser Schüttung und aliquot für den Langzeitgebrauch erstellt und bei -20 °C oder darunter gelagert, um die Konsistenz zwischen den Assays zu gewährleisten. Zur Qualitätssicherung wurden die Proben zweimal in jedem Assay durchgeführt, und jedes positive Ergebnis wurde wiederholt und bestätigt, indem die Probe am nächsten Tag in einem neuen ECL-Assay durchgeführt wurde. Wenn es Unstimmigkeiten mit dem ersten und zweiten Bestätigungstest gab, war ein dritter Assay erforderlich. Von den drei durchgeführten Assays bestimmten die Ergebnisse der beiden übereinstimmenden Assays (z. B. +, + oder -,-) das Endergebnis (positiv oder negativ) der Probe.
In den letzten zehn Jahren suchen viele Studiengruppen nach einem Hochdurchsatz-Assay, der die Multiplex-Methode verwendet, um mehrere Autoantikörper-Assays zu einem Bohrloch zu kombinieren, um große Populationen zu screenen. Es gibt einige Studien, die verschiedene Arten von Technologien verwenden, um Multiplex-Autoantikörper-Assays 19,20,21,22 durchzuführen, aber es gibt keinen Vergleich für einen dieser Assays in Sensitivität und Spezifität mit dem aktuellen "Gold"-Standard RBA, wenn T1D untersucht wird. Diese verschiedenen Arten von Plattformen werden nicht durch den internationalen Workshop des Islet Autoantibody Standardization Program (IASP) oder durch das Testen großer Kohorten in klinischen Studien validiert. In einem kürzlich in Deutschland durchgeführten allgemeinbevölkerungsbasierten Screening wird ein kombinierter Hochdurchsatz-Assay, der von Kronus vertriebene 3 Screen ICATM ELISA, als Werkzeug für das Erstlinien-Screening zum Nachweis von drei IAbs, GADA, IA-2A und ZnT8A verwendet, um eine Frühdiagnose von T1D23 im Kindesalter zu erreichen. Der 3-Screen-ELISA-Assay misst 3 Autoantikörper entweder in 3 getrennten Vertiefungen, wobei ein großes Serumvolumen verbraucht wird, oder in einer einzigen Vertiefung, wobei alle 3 Assays gemischt sind. Wenn eine Vertiefung im 3-Screen-ELISA-Assay positiv ist, kann man nicht unterscheiden, welche von drei Autoantikörpern vorhanden sind. Der größte Nachteil dieses Assays ist seine Unfähigkeit, IAA-Messungen einzubeziehen. Alle mit ELISA durchgeführten IAA-Ergebnisse, wie in IASP-Workshops nachgewiesen, weisen keine akzeptable Sensitivität und Spezifität auf24. IAA ist in der Regel die erste IAb, die erscheint und hat eine hohe Prävalenz bei kleinen Kindern. IAb-Screening mit IAA ist für Kinder notwendig und es wird nicht als akzeptabel angesehen, dieses Screening ohne IAA durchzuführen, um das T1D-Risiko in der Gemeinschaft zu bewerten. Darüber hinaus gibt es keine veröffentlichten Studien oder Daten, die zeigen, dass der Kronus IAb-Kit-Assay eher T1D-krankheitsspezifisch ist und in der Lage ist, ein hohes Risiko von einem IAbs mit niedrigem Risiko zu unterscheiden. Der 7-Plex ECL-Assay in der vorliegenden Studie wurde anhand einer großen Kohorte neu diagnostizierter Patienten mit T1D13 validiert. Im Vergleich zum aktuellen Standard-RBA- und etablierten Einzel-ECL-Assay ist der 7-Plex-Assay in der Lage, eine 100%ige Positivität bei gleicher Assay-Spezifität beizubehalten (Tabelle 4). Derzeit wird der 4-Plex ECL-Assay parallel zum Standard-RBA in einer laufenden großen klinischen Studie angewendet: Autoimmunity Screening for Kids (ASK) Studie. Diese Studie untersucht Kinder in der allgemeinen Bevölkerung der Metropolregion Denver auf T1D und Zöliakie. Im Vergleich zur Standard-RBA, die in der ASK-Studie verwendet wurde, zeigt der Multiplex-ECL-Test eine ausgezeichnete Sensitivität und eine höhere Krankheitsspezifität, identisch mit unseren früheren Berichten mit der einzelnen ECL-Studie25. Darüber hinaus zeigte unser 4-Plex ECL-Assay eine deutliche Reduzierung der Arbeit, der Kosten und des Serumvolumens um 70% im Vergleich zu den entsprechenden 4 Einzeltests für ECL und RBA. Mit dem gemultiplexten ECL-Assay können wir jede Vertiefung mit unterschiedlichen Zahlen anpassen, die verschiedene Autoantikörper (bis zu 10) repräsentieren, um auf verschiedene Autoimmunerkrankungen zu testen, die spezifisch für die Bedürfnisse eines bestimmten klinischen Ortes sind.
Es wurden einige Einschränkungen beobachtet, die in der vorliegenden Studie für einen gemultiplexten ECL-Assay unter Verwendung der Multiplexplatte gezeigt wurden. Die endgültige Verdünnung des mit Antigen inkubierten Serums kann nicht so eingestellt werden, dass sie die optimalsten Bedingungen für jeden einzelnen Autoantikörpertest liefert, der in einer einzigen Vertiefung kombiniert wird. Bei neun Proben (9/1026) von T1D-Patienten wurde ein falsch negatives Ergebnis für bestimmte Autoantikörper beobachtet. 7 der falsch negativen Ergebnisse waren für TPOA und 2 für ThGA im 7-Plex-ECL-Assay, aber sowohl im einzelnen ECL-Assay als auch im RBA wurden hohe positive Ergebnisse gezeigt (Abbildung 2 & 3). Nach weiterer Verdünnung aller 9 Proben wurden sie auf der Multiplexplatte positiv. Dieses Ergebnis wird durch das verursacht, was wir als "Prozone" -Phänomen bezeichnen. Dieses Phänomen führt dazu, dass die Probe ein falsch negatives Ergebnis zeigt, da die hohen Antikörpertiter die Bildung von Antigen-Antikörper-Gittern beeinflussen. Bei der Einrichtung eines Multiplex-Assays wird empfohlen, Proben mit sehr hohen Titern für jeden der kombinierten Autoantikörper Vortests durchführen zu lassen, um die optionale Verdünnung des Serums für die Antigeninkubation zu identifizieren. Alternativ sollten Autoantikörper-Assays mit ähnlich optimierten Bedingungen ausgewählt werden, um einen kombinierten Assay zu bilden, aus dem die beste Assay-Sensitivität und Spezifität für jeden Autoantikörper erreicht wird. In der vorliegenden Studie führten 7 Proben (7/1022) von gesunden Normalkontrollen zu falsch positiven Ergebnissen für mehrere Autoantikörper im 7-Plex-Assay, aber nach Durchführung eines einzigen ECL-Assays und RBA (Abbildung 2 & 3) wurden diese Autoantikörper in beiden Assays als negativ befunden. Die Gründe für diese falsch positiven Ergebnisse, die auf der Multiplexplatte für diese kleine Untergruppe von Proben auftreten, sind derzeit unbekannt. Für die aktuelle Anwendung des Multiplex-ECL-Assays werden alle positiven Proben mit ihrem entsprechenden einzelnen ECL-Assay wiederholt, um die Positivität zu bestätigen, wodurch dieser falsch positive Fehler aus dem Multiplex-ECL-Assay entfernt wird.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde durch NIH Grant DK32083, JDRF Grants 2-SRA-2015-51-Q-R und 2-SRA-2018-533-S-B unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 4 °C refrigerator | |||
| –80 °C and -20 °C freezers | |||
| 96-well Plate Shaker | Wallac - Delfi | ||
| 96-well round bottom plate | Fisher | 8408220 | |
| Acetic acid solution | Fisher | ||
| Aluminum foil | |||
| Antigen proteins | |||
| Human GAD65 full length protein | Diamyd | ||
| Human ThG full length protein | BioMart | ||
| Human TPO full length protein | BioMart | ||
| IA-2 intracellular domain protein | BioMart | ||
| IFN-α protein | Abcam | ||
| Proinsulin protein | AmideBio | ||
| tTG protein | DiaRect | ||
| Biotin | Sigma | ||
| Bottle-Top 500 mL , Filter Units | Fisher | 0974064A or B | |
| Bovine Serum Albumin | Sigma | A-7906 | |
| Distilled deionized (DD) water | |||
| HCl | Fisher | ||
| Ice maker | |||
| Ice trays | |||
| MSD Sector | Perkin-Elmer | ||
| Multi-channel pipette | |||
| NaOH | |||
| Paper tower | |||
| PBS | |||
| pH meter | |||
| Pipette-Aid | |||
| Pipettes/tips | |||
| Ru Sulfo-NHS | MSD (R91AN) | ||
| Trizma Base | Fisher | BP152-5 | |
| Tween 20 | Sigma | P-1379 | |
| Uplex Development Kit | MSD | ||
| 96-well UPlex plate | MSD | ||
| Blocker A | MSD | R93AA | |
| Linker-Streptavidin | MSD | ||
| Read buffer | MSD | R92TC | |
| Stop Solution | MSD | ||
| Vortex mixer | |||
| ZeBa Column | Pierce | 89892 |
Referenzen
- Harjutsalo, V., Sjoberg, L., Tuomilehto, J. Time trends in the incidence of type 1 diabetes in Finnish children: a cohort study. Lancet. 371 (9626), 1777-1782 (2008).
- Vehik, K., et al. Increasing incidence of type 1 diabetes in 0- to 17-year-old Colorado youth. Diabetes Care. 30 (3), 503-509 (2007).
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Insel, R. A., et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 38 (10), 1964-1974 (2015).
- Barker, J. M., et al. Autoantibody "subspecificity" in type 1 diabetes: risk for organ-specific autoimmunity clusters in distinct groups. Diabetes Care. 28 (4), 850-855 (2005).
- Triolo, T. M., et al. Additional Autoimmune Disease Found in 33% of Patients at Type 1 Diabetes Onset. Diabetes Care. 34 (5), 1211-1213 (2011).
- de Graaff, L. C., Smit, J. W., Radder, J. K. Prevalence and clinical significance of organ-specific autoantibodies in type 1 diabetes mellitus. Netherlands Journal of Medicine. 65 (7), 235-247 (2007).
- Yu, L., et al. Proinsulin/Insulin autoantibodies measured with electrochemiluminescent assay are the earliest indicator of prediabetic islet autoimmunity. Diabetes Care. 36 (8), 2266-2270 (2013).
- Yu, L., et al. Distinguishing persistent insulin autoantibodies with differential risk: nonradioactive bivalent proinsulin/insulin autoantibody assay. Diabetes. 61 (1), 179-186 (2012).
- Miao, D., et al. GAD65 autoantibodies detected by electrochemiluminescence assay identify high risk for type 1 diabetes. Diabetes. 62 (12), 4174-4178 (2013).
- Gu, Y., Zhao, Z., High, H., Yang, T., Yu, L. Islet Autoantibody Detection by Electrochemiluminescence (ECL) Assay. Journal of Clinical & Cellular Immunology. 8 (6), (2017).
- Gu, Y., et al. Electrochemiluminescence Assays for Human Islet Autoantibodies. Journal of Visualized Experiments. (133), e57227 (2018).
- Gu, Y., et al. High-throughput multiplexed autoantibody detection to screen type 1 diabetes and multiple autoimmune diseases simultaneously. Ebiomedicine. 47, 365-372 (2019).
- Dongmei, M., A, K. S., Li Zh, K., Michelle, G., Ling, J., Taylor, A. Electrochemiluminescence Assays for Insulin and Glutamic Acid Decarboxylase Autoantibodies Improve Prediction of Type 1 Diabetes Risk. Diabetes Technology & Therapeutics. 17 (2), 119-127 (2015).
- Steck, A. K., et al. ECL-IAA and ECL-GADA Can Identify High-Risk Single Autoantibody-Positive Relatives in the TrialNet Pathway to Prevention Study. Diabetes Technology & Therapeutics. 18 (7), 410-414 (2016).
- Fouts, A., et al. Do Electrochemiluminescence Assays Improve Prediction of Time to Type 1 Diabetes in Autoantibody-Positive TrialNet Subjects. Diabetes Care. 39 (10), 1738-1744 (2016).
- Sosenko, J. M., et al. The Use of Electrochemiluminescence Assays to Predict Autoantibody and Glycemic Progression Toward Type 1 Diabetes in Individuals with Single Autoantibodies. Diabetes Technology & Therapeutics. 19 (3), 183-187 (2017).
- Zhao, Z., et al. Higher Sensitivity and Earlier Identification of Celiac Disease Autoimmunity by a Nonradioactive Assay for Transglutaminase Autoantibodies. Journal of Immunology Research. 2016, 5 (2016).
- Zhang, B., Kumar, R. B., Dai, H., Feldman, B. J. A plasmonic chip for biomarker discovery and diagnosis of type 1 diabetes. Nature Medicine. 20 (8), 948-953 (2014).
- Tsai, C. T., Robinson, P. V., Spencer, C. A., Bertozzi, C. R. Ultrasensitive Antibody Detection by Agglutination-PCR (ADAP). American Chemical Society Central Science. 2 (3), 139-147 (2016).
- Yim, S. W., et al. Four-color alternating-laser excitation single-molecule fluorescence spectroscopy for next-generation biodetection assays. Clinical chemistry. 58 (4), 707-716 (2012).
- Bale, S. S., et al. A highly sensitive microsphere-based assay for early detection of Type I diabetes. Technology. 02 (03), 200-205 (2014).
- Ziegler, A. G., et al. 3 Screen ELISA for High-Throughput Detection of Beta Cell Autoantibodies in Capillary Blood. Diabetes Technology & Therapeutics. 18 (11), 687-693 (2016).
- Schlosser, M., et al. Diabetes Antibody Standardization Program: evaluation of assays for insulin autoantibodies. Diabetologia. 53 (12), 2611-2620 (2010).
- Zhao, Z., et al. A multiplex assay combining insulin, GAD, IA-2 and transglutaminase autoantibodies to facilitate screening for pre-type 1 diabetes and celiac disease. Journal of Immunological Methods. 430, 28-32 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten