需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
评估流和拉伸下生物材料的炎症和再生能力的多奎生物反应器
* 这些作者具有相同的贡献
摘要
本协议的目标是在管状电喷脚手架中执行人类巨噬细胞和肌纤维细胞的动态共生,以研究物质驱动的组织再生,使用生物反应器,使剪切应力和循环拉伸脱钩。
摘要
从转化的角度来看,使用可再吸附生物材料直接在体内诱导再生是一种有吸引力的策略。这种材料在植入时会引起炎症反应,这是随后材料吸收和新组织再生的驱动因素。这一战略,也被称为原位组织工程,旨在获得心血管置换,如组织工程血管移植。炎症和再生过程都由脚手架上的局部生物力学线索(即拉伸和剪切应力)决定。在这里,我们详细描述了定制开发的生物反应器的使用,这种反应器能够使管状脚手架上的拉伸和剪切应力脱钩。这允许系统和标准化地评估管状脚手架在控制良好的机械负载的影响下的炎症和再生能力,我们利用人类巨噬细胞和肌纤维细胞进行动态共培养实验来证明这一点。详细讨论了该方法的关键实际步骤:生物反应器的建造和建立、脚手架和细胞播种的制备、拉伸和剪切流的应用和维护以及样品采集分析。
引言
心血管组织工程(TE)正在作为替代治疗选择,目前使用的永久心血管假肢(如血管移植,心脏瓣膜置换),这是不理想的大组患者1,2,3,4。许多抢手的应用包括组织工程血管移植 (TEVG)5,6和心脏瓣膜 (TEHV)7,8.最常见的是,心血管TE方法利用可重新吸收的生物材料(无论是天然的还是合成的),作为新组织形成的有启发性的支架。新组织的形成可以完全在体外设计,通过用细胞播种脚手架,并在植入前在生物反应器中培养(体外TE)9、10、11或直接就地植入,在原位植入合成脚手架时无需预先培养,以诱导体内(原位TE)12、13、14等新组织的形成。对于体外和原位心血管TE方法,成功的功能再生主要取决于宿主对植入结构的免疫反应和适当的生物力学负荷。
生物力学负荷对心血管TE的重要性是众所周知的。在心血管植入物中,填充脚手架的细胞暴露于循环拉伸和剪切压力,这些压力是血友病环境引起的。许多研究已经报告了(循环)拉伸对基质成分形成的刺激作用,如胶原蛋白16,17,18,19,糖氨酸(GAGs)20,和弹性蛋白21,22,由各种细胞类型。例如,黄等人证明,双轴拉伸利用血管生物反应器23,提高了胶原蛋白和弹性蛋白在体外特威格斯中的沉积和组织。虽然重点通常在于拉伸作为主要负载,但这些研究通常使用流驱动的生物反应器,其中样本也暴露在剪切流中。虽然对剪切应力对3D组织形成和炎症的孤立影响知之甚少,但提供了一些数据。例如,Hinderer等人和Eoh等人证明,剪切流除了3D脚手架微结构外,对于人类血管平滑肌肉细胞在体外模型系统24、25中形成成熟的弹性蛋白非常重要。总之,这些发现说明了环伸和剪切应激对心血管TE的相关性。
TE植入物成败的另一个重要决定因素是宿主对植入移植物26的免疫反应。这对于物质驱动的原位TE策略尤其重要,它实际上依赖于对脚手架的急性炎症反应来启动细胞流入和内源性组织形成和重塑的后续过程。巨噬菌体是功能组织再生的关键启动器,28、29、30等多项研究表明。类似于伤口愈合,组织的再生是由巨噬细胞和组织产生细胞之间的寄生虫信号,如成纤维细胞和肌纤维细胞31,32,33。除了协调新的组织沉积外,巨噬细胞还参与外来脚手架材料34、35的主动吸收。因此,体外对生物材料的宏年反应已被确定为植入物36、37、38体内成功的预测参数。
植入式脚手架的宏观反应取决于脚手架的设计特征,如材料组成和微观结构35,39,40。除了脚手架属性外,对脚手架及其与肌纤维细胞的相声的宏法响应也受到血液动力载荷的影响。例如,环状拉伸被证明是巨噬细胞表型41,42,43,44和细胞因子43,44,45,46在3D电子喷支架分泌物的重要调节剂。Battiston等人利用巨噬细胞和血管平滑肌肉细胞的共培养系统证明,巨噬细胞的存在导致弹性蛋白和GAG水平增加,中度循环拉伸水平(1.07-1.10)刺激胶原蛋白I和弹性蛋白47的沉积。在以往的著作中,我们已经证明剪切应力是单核细胞招募到3D电喷支架48,49,剪切应力和循环拉伸影响人类单核细胞和间质频闪细胞50之间的寄生虫信号的重要决定因素。Fahy等人证明,剪切流增加了人类单核细胞51的亲炎细胞因子的分泌。
综合起来,上述证据表明,对血液机载荷的充分理解和控制对心血管TE至关重要,因此必须考虑炎症反应来实现这一点。许多生物反应器以前曾被描述为体外52,53,54,55,56,57,58或前体内59,60,61心血管组织培养。然而,所有这些系统都旨在尽可能模仿生理血液机载量条件。虽然这在体外创建心血管组织或维持前体内培养物方面具有很高的价值,但此类系统不允许系统地研究个体线索的个体影响。这是因为在这些生物反应器中应用循环拉伸和剪切应力是由相同的加压流驱动的,而加压流与它们有着内在的联系。虽然用于精确多提示机械操作的微系统已用于 2D 基材62或 3D 水凝胶设置63,64,但此类设置不允许纳入弹性 3D 生物材料脚手架。
在这里,我们介绍了管状生物反应器系统的应用,该系统独特地实现了剪切应力和循环拉伸的脱钩,并有助于机械地研究其个体和组合效应。该系统允许测试各种组织工程血管移植物(例如,合成或自然起源,不同的微结构,各种孔隙)。为了有效地将剪切应力和拉伸的应用脱钩,生物反应器使用的关键概念是(1) 使用独特的泵系统分离剪切应力和拉伸控制,(2) 以计算驱动尺寸的"从内到外"方式刺激脚手架。通过使用流泵将流量应用于管状脚手架的外表面,而脚手架的周长则通过使用单独的应变泵来扩展安装脚手架的硅胶管。硅胶管和包含构造的玻璃管的尺寸是使用计算流体动力学模拟仔细选择和验证的,以确保脚手架上的剪切应力(由于流量)和环状拉伸(由于管膨胀)不会显著影响彼此。这种从内到外的设计有几个实用的理由。如果拉伸由发光流体压力(类似于生理负荷)施加,则固有要求样品设计无泄漏。此外,拉伸样品所需的压力将完全由样品刚度决定,样本刚度可能因样品而异,并且随着时间的推移,很难控制样品的拉伸。这种生物反应器将组织工程移植物安装在硅胶管周围,并允许在移植物的外壁上应用壁切变应力 (WSS),并从内部给移植物加压。这样,样品之间和样品内部的同等装载条件可以保证,而且,样品允许泄漏,就像多孔血管支架19一样。这种从内到外的生物反应器是专门用来系统研究剪切和/或拉伸的影响,而不是在体外进行原生血管的工程,而传统的血管生物反应器设置更适合于此。有关生物反应器设计图纸 的图 1A-B 及其相应的 表 1, 了解生物反应器主要组件背后的功能描述和原理。
生物反应器的使用是根据我们小组最近的一系列研究证明的,其中我们调查了剪切应力和循环拉伸对可再吸附电喷支架中炎症和组织形成的个体和组合影响,用于原位心血管组织19、43、44。为此,我们使用单体或共培养中的人类巨噬细胞和肌纤维细胞来模拟原位再生级联的各个阶段。我们已经证明,人类巨噬细胞的细胞因子分泌明显受到循环拉伸和剪切应力的影响,通过parcrine信号和直接接触19、43、44,通过这些脚手架中的人类肌纤维细胞影响基质沉积和组织。值得注意的是,这些研究表明,在剪切应力和拉伸的结合应用的情况下,对组织形成和炎症的影响要么由两个负载之一主导,要么有两个负载的协同效应。这些发现说明了将两个负载脱钩以更好地了解机械环境对 TE 过程的贡献的相关性。这一理解可用于系统地优化相关血液动力负荷系统中的脚手架设计参数。此外,来自这些控制良好的环境的机械数据可以作为正在开发的数字模型的输入,以预测原位组织重塑的过程,正如最近为TEVG65或TEHV66报告的那样,以进一步提高预测能力。
研究方案
在本协议中描述的研究中,从周围血液狂热的外周涂层中分离出的原发性人类巨噬细胞和在冠状旁路手术后从鼻静脉中分离出来的人类肌纤维细胞已经使用了44种。这些狂热的外套是从健康、匿名的志愿者那里获得的,他们提供了书面知情同意,并得到了桑昆研究机构医学伦理委员会的批准。使用人类静脉皂细胞(HVSCs)是根据荷兰医学会联合会(FMWV)制定的"人类组织适当二次使用规范"。
1. 建立生物反应器前的一般准备和必要行动
注:有关各自隔离和栽培协议的细节,请参阅先前的工作19,43,44。协议中的所有计算都作为单核细胞和肌纤维细胞共同培养实验的示例,该实验以 8 个血液机载脚手架和 2 个静态控件(n=10)为种子。
- 开始细胞隔离和细胞培养。单核细胞和肌纤维细胞共同培养样品的播种密度(播种比为2:1)分别为30×106单核细胞/厘米3和15×106肌纤维细胞/厘米3。
注:电喷材料孔隙度高(>90%)。为了估计每个移植所需的细胞数量,脚手架的体积是用空心圆柱体体积的公式计算的:π*(厚度)2*长度≈0.04厘米3。每次移植的细胞总量为1.2×106 个单核细胞和0.6×106 个肌纤维细胞。对于10个样本,至少需要12个×10个6 个单核细胞和6个×10个6 肌纤维细胞:从最多 +10+15% 的细胞开始,以解释可能的管道错误。 - 分解细胞培养介质,用于涉及生物反应器的实验。
- 为共同培养准备介质,包括RPMI-1640:aDMEM(1:1),辅以10%的胎儿牛血清、1%的青霉素-链霉素和0.5%的L-谷氨酰胺。
- 将介质过夜 (O/N) 放在细胞培养瓶的孵化器中,并配有过滤盖以除气。
- 用密封盖替换滤盖,并在 4 °C 下存放。
- 使用前,在介质中加入0.25毫克/mL L-抗坏坏葡萄酸2磷酸盐(维生素C)。
注:对于计算,每个流量培养室所需的介质量为 50 mL。每周刷新介质三次;25 mL 旧介质被 25 mL 新鲜介质所取代。对于10个样本;播种后,总共需要500 mL新鲜介质,每次后续介质变化,总共使用250 mL新鲜介质。在改变介质之前,应始终准备中等新鲜,特别是维生素C。
- 准备同位素电喷脚手架(3毫米光度直径,200μm壁厚度),如范哈芬等人所述19(图1G-I)。简言之,管状多丙酮双苏雷亚 (PCL-BU) 脚手架由 15% (w/w) 氯仿聚合物溶液的电夹产生。聚合物溶液在室温和 30% 相对湿度下为电喷,流速为 40 μL/min,距离旋转圆柱形目标(+3 mm,500 rpm)16 厘米,在电夹喷嘴上施加电压为 16 kV,在目标上应用电压为 -1 kV。
注:虽然PCL-BU移植物用于这些实验,但这种生物反应器(例如,不同的合成或自然起源、不同的微结构、不同的孔隙)可以安装各种各样的弹性组织工程移植物)- 从曼德雷尔中取出电子喷头脚手架。
- 在 15 mL 管的盖子上打个小洞,将曼德雷尔"抱住"在管子的中心,防止它接触管子的墙壁。
- 将带电喷头脚手架的曼德雷尔放在猎鹰管中,并装满去离子水。
- 将管 O/N 冻结在 -20 °C 下。
- 将管子置于室温(RT)中,几分钟后取出气管,将电喷头移植到冰层中。
- 让冰完全解冻,从解冻的水中取出电喷管,并"悬挂"垂直干燥数小时。确保脚手架不会在自身重量下"坍塌"。
- 真空 O/N 下的干脚手架。
- 使用扫描电子显微镜 (SEM) 对电子喷头移植物的小样本进行成像,以评估其微观结构(例如光纤形态、纤维直径)。示例研究中的移植物具有同位素纤维方向和 5 μm 的光纤直径(图 1H°I)。
- 从曼德雷尔中取出电子喷头脚手架。
- 在开始实验的前一天,将装满去离子水的液压水库放在孵化器中。用白色 Luer 帽关闭流文化室的所有八个连接。连接到压缩空气系统并插入压力传感器。运行应变泵(参见步骤 5.6) O/N,以便小规模扩展特氟隆波纹管。
注:确保所有必要的材料和设备都清洁和/或自动清理(参见允许将材料自动清理的 材料表、注释/说明栏),根据制造商的协议或步骤 7.3+7.6 中描述。 - 确保协议其余部分的工作条件无菌。
- 在无菌层压流动柜中执行步骤 2/5.3(设置系统)、步骤 6.3(中等变化)和步骤 7.1-7.2(血管结构的收获)。
- 将不直接需要的材料放在封闭的培养皿中,以保持一切尽可能干净。
- 通过用 70% 乙醇浸泡纸巾,并擦拭生物反应器组件和层压流柜的表面,定期清洁或干燥材料表面。
2. 设置生物反应器
注:在层压流柜中执行步骤 2。
- 将电子喷头脚手架切成大约 25 毫米长的管子,并在使用前记录它们(例如,长度的照片,初始质量的平衡重量)。
- 净化电喷支架。
- 将电喷头脚手架倾斜在井板或培养皿中,一个开口面向紫外线 (UV) 光源,使紫外线 (253.7 nm) 照亮脚手架内部。
- 将电子喷射支架暴露在紫外线下 5 分钟。
- 转动所有脚手架,为另一个开口重复紫外线照明。
注:在此步骤之后,仅在需要时触摸电喷支架。始终使用干净的钳子或干净的手套。 - 以储存在 70% 中的流动培养室的玻璃管为例,用超纯水清洗玻璃管,干燥,并放入一个大的封闭的 Petri 盘中。
注:以下步骤,尤其是步骤 2.3-2.5,最好由两名实验者执行。
- 将电子喷头脚手架安装到硅胶管上。
- 将 5-0 前列针连接到硅胶管的一端,将缝合线穿过管子的一侧和另一侧,留下两条横跨管子横截面的相反绷紧的缝合线。在管子的两侧做一个小结,同时压缩结点的管子,并在两个结上留下大约10厘米的电线。在两根10厘米长的电线的末端打第三个结。
- 切断缝合针和所有可能伸出并损坏电子喷头脚手架内部的自由线。将硅胶管的边缘切成三角形,以帮助将硅胶管拉过电喷支架。
- 将电子喷头脚手架浸入 30% 乙醇中(这用作额外的净化步骤,并有助于将电子喷头脚手架滑过硅管),并将电子喷头脚手架放置在 10 厘米的自由电线上。实验者A通过轻轻地拉动硅胶管和10厘米缝合线的结来伸展硅胶管,而实验者B则用带光滑内尖的钳子轻轻地将电子喷头脚手架滑过硅胶管,以防止脚手架损坏。
- 慢慢释放硅胶管上的拉伸,同时用钳子平滑电喷支架。将硅胶管上的电喷支架浸入超纯水中两次。
注意:电喷支架可能会出现一些皱纹。在将脚手架固定到第 2.5.3 步的压力管道之前,这种皱纹会在应用预伸过程中消失。 - 其他电子喷头脚手架重复步骤 2.3.2 和 2.3.3。根据硅胶管的长度,多个电子喷头脚手架可以安装在同一个硅胶管上。
- 当所有的电喷头脚手架都安装在硅胶管上时,将硅胶管切开脚手架,长度相同(5.5厘米):在一边,靠近电喷底架的末端,在另一侧,留下+2+3厘米的自由硅胶管。
- 将 5-0 前列针连接到硅胶管的一端,将缝合线穿过管子的一侧和另一侧,留下两条横跨管子横截面的相反绷紧的缝合线。在管子的两侧做一个小结,同时压缩结点的管子,并在两个结上留下大约10厘米的电线。在两根10厘米长的电线的末端打第三个结。
- 构建流文化室的底部隔间(图1A-B)。
- 取包含流口的底部隔间的上部,用男性 Luer 插头关闭流插座。
- 将带孔的压力导管推过底部隔间,并在压力导管的下端放置硅胶 O 环以防止泄漏。将底部隔间的下部拧到底部隔间的上部,以确保压力导管的安全。确保压力导管的下刻槽比底部隔间适配器衬垫边缘高出约 3/5 mm;这将稍后"保持"缝合线的紧结,固定在硅胶管上的电喷头脚手架。
注意:如果压力导管可以轻松上下操纵,则表示底部隔间安全性不好。重复步骤 2.4.2 以防止后期泄漏(图 2D)。
- 用电喷头脚手架将硅胶管固定到压力管上。
- 用电喷头脚手架将硅胶管拉过压力管。
- 在压力导管上雕刻槽的位置,用电喷架下端的缝合线打结。在对面打第二个结,用电喷管紧紧固定硅胶管。
警告:这是关键的一步。确保结准确"落"入压力导管的刻槽中,防止水从水库渗入流文化室。如果不确定,尝试在凹槽的预期位置上方或下方的多个位置拧紧缝合线,以确保最后的结正好在刻槽处(图 2A)。 - 将剪刀夹放在硅胶管的上端,向上伸展硅胶管(这将直接测试第一个结,如果有可能将硅胶管与电喷支架一起移动到压力管上,则不够紧固)。有了拉力,硅胶管就预拉伸了。为了确保硅胶管在不同样品之间保持一致,在剪刀夹上安装一把尺子。将剪刀夹向上拉,直到尺子的下端达到脚手架下端的高度。
注:保持每个样品的预拉伸大致相同(+5%)很重要,原因有二:(1) 如果硅胶管预拉伸,则加压时会导致样品长度的同质膨胀:(2) 预拉伸会影响硅胶的机械性能,因此所有样品的弹性条件应相同,以确保样品之间的拉伸条件相等。 - 轻轻拉动电子喷头脚手架,去除电子喷头脚手架上的皱纹。再次,在两侧打两个结,在压力导管上刻槽的位置,在脚手架的上端用缝合线。
- 松开剪刀夹,用刀切掉多余的硅胶管,留下20%的螺丝带,用硅胶管覆盖,以防止鼻锥安装在螺丝上时泄漏。
注:所有动态示例重复步骤 2.4 和 2.5。 - 对于静态控制样品,将安装在硅胶管上的电子喷头脚手架固定在压力导管上,不要有孔。这些管道可以单独保存在 15 mL 管中,直到播种(第 4 步),无需安装在流培养室隔间中。
- 用电喷头脚手架将部分构造的流文化室暴露在紫外线下10分钟,以净化其污染。将带电喷底架的流培养室转到另一侧,并重复紫外线照射 10 分钟。
- 将鼻锥拧在压力导管的螺丝线上,并带有动态样品的孔。
- 确保硅胶管的顶端与鼻锥相适应,防止以后的泄漏。如果硅胶管太多,用刀子切掉多余的管子。
- 将部分构造的流文化室放在一个大的培养皿中,并将鼻锥指向紫外光源。应用紫外线照明 5 分钟。
- 用流动文化室的玻璃管和顶舱完成流动文化室的建设(图1A B)。
- 通过将压力导管浸入有机管和电子喷头脚手架中 30% 乙醇中,然后两次浸入超纯水,预先弄湿电喷底架。
- 将玻璃管放在压力管上,轻轻推入底部隔间并轻轻固定。
- 取包含流入口的顶部隔间,放置硅胶 O 环、流直发器和适配器衬套,按正确顺序排列(图 1A-B),放在玻璃管的开端,轻轻固定。
- 拧在顶部隔间的流动入口上的白色 Luer 盖。
- 从底部隔间的流口取下男性 Luer 插头,用乙醇浸泡的纸巾清洁周围的表面。
- 将一个带10mL超纯水的注射器放在水流口,打开顶部隔间上的白色Luer盖,用超纯水填充腔室。再次关闭白色 Luer 盖,取下注射器,用乙醇再次清洁,并用男性 Luer 插头关闭流口。
注:所有流文化室重复步骤 2.6 至 2.8。 - 对于静态控件,在 15 mL 管中加入 10 mL 超纯水,将样品安装在压力管道上,没有孔洞。
- 将所有流动培养室置于孵化器中。在细胞播种前一天,用培养介质代替超纯水,就像第 2.8.5 步和 2.8.6 步中描述的那样(请务必用直接放在流口的乙醇浸泡纸巾收集"旧"超纯水)。
[协议可以暂停在此处]
3. 流量泵设置的准备工作
注:在层压流柜中执行步骤 3。
- 收集所有泵设置材料并准备使用。
注:实验者将提交制造商的协议,详细描述通过流体单元的阀门设置泵、流体单元和中管。- 将泵设置为 200 mbar 容量。
- 将 60 mL 水库的储层拧到流体单元。
- 用浸泡在乙醇中的纸巾清洁可重复使用的橡胶空气过滤器,确保空气过滤器保持干燥。
- 将 60 mL 储层放置在储层支架中,并将标准中管通过流体单元的阀门放置。将中管与较大的内径连接,将女性 Luer 锁耦合器连接到封闭的环中。
- 用软管夹紧压中管,直接在储层下面。
- 每 60 mL 水库向水库灌装 25 mL 的培养介质。释放软管夹,让介质进入管子。
- 用橡胶空气过滤器关闭中型储层,将流泵设置放在孵化器中直到第 4 步。
4. 细胞播种使用纤维蛋白作为细胞载体
注:在层压流柜中执行步骤 4。
- 为细胞播种步骤准备纤维蛋白凝胶。有关详细信息,请参阅 Mol 等人67 对于纤维蛋白凝胶,纤维蛋白原溶液的最终浓度应为 10 毫克/mL(蛋白质库存的纯度正确),血栓溶液的最终浓度应为 10 U/mL。
- 在带红色盖子的塑料容器中称重 50 毫克(足够 10 个样品)之前,先将纤维蛋白原解冻至 RT。
- 添加细胞培养介质来制备纤维蛋白原溶液(浓度为 10 毫克/毫升,对蛋白质库存的纯度正确)。将过滤器与 0.2 μm 注射器过滤器混合并过滤,将纤维蛋白原溶液消毒成无菌 15 mL 管。将过滤过的纤维蛋白原溶液保留在冰上。
注意:避免提前准备纤维蛋白原溶液太久,否则纤维蛋白原可能会自发凝固。 - 解冻血栓,在细胞培养介质中和冰上放置血栓溶液(浓度为10U/mL)。准备每个样品的 20 μL 血栓 + 细胞溶液。对于 n=10 样本,需要 200 μL;因此,准备 250 μL 血栓溶液,以解释可能的管道错误。
- 从培养瓶中收集和计数细胞。将细胞混合在所需的比例和数量(1.2 × 106 单核细胞和 0.6 × 106 肌纤维细胞每个脚手架)。确保有足够的细胞用于 n+1 样本,以纠正管道错误。离心机在 350 × g 10 分钟在 Rt. 删除超高。
- 使悬浮细胞和血栓的混合物。
- 对于每个示例,请使用 20 μL 的血栓液溶液。对于 n=10 样本,在细胞颗粒中加入 200 μL 血栓并混合。测量细胞悬浮(细胞 + 血栓)的体积,并计算如何均匀地划分所有 10 个脚手架(例如,如果血栓和细胞悬浮的体积为 260 μL,则每个电喷样本将接收 260 μL/10 样本 = 26 μL 血栓 + 细胞悬浮)。
- 由于脚手架的播种分两步进行,因此准备两个 1.5 mL 微富管,每个脚手架将保留一半的细胞悬架(在上一步的示例计算中:准备两个具有 13 μL 血栓 + 细胞悬架的管子)。放在冰上
注:以下步骤,尤其是第4.4步,最好由两名实验者执行。
- 用真空干燥预湿的电喷脚手架,为细胞播种做好准备。
- 将玻璃巴斯德管道连接到层压流柜的真空系统,并放置在空的 50 mL 管中进行无菌临时存储。
- 从培养箱中取出流培养室,从流口取下男性Luer插头,打开白色Luer盖后取下介质,并在流口前放置乙醇浸泡纸巾。
- 取下顶部隔间和玻璃管,放在无菌的培养皿中临时存放。
- 将真空巴斯德管道放在电喷支架上,并尽可能多地移除介质。
警告:真空非常轻轻地干燥电子支架。而不是在脚手架上来回线性运动,将真空管道放置在多个位置。将巴斯德管道顶部的真空管夹在手指之间,以便更好地控制。 - 将纤维蛋白原溶液与血栓和细胞悬浮物(例如,将 13 μL 的纤维蛋白原与 13 μL 血栓素 + 细胞悬浮物混合)。为了确保纤维蛋白聚合在脚手架上,而不是在微富格管中,用烟斗管管住纤维素,将烟斗轮转动为血栓的"额外体积"-细胞悬架,在带细胞悬浮液的微富格管中上下一次管道混合。
- 直接同质地将溶液滴到电喷支架的全长上。建议实验者A滴注纤维蛋白混合物,而实验者B则拿着底部隔间,电喷头脚手架安装在压力导管上。
- 带细胞的纤维蛋白滴在电喷支架上后,实验者B缓慢地将脚手架从左向右向上和向下移动,以进一步将细胞均匀地分隔在脚手架上。
- 在电喷架的另一侧重复步骤 4.4.5 - 4.4.7。
- 通过小心地将玻璃管(防止纤维蛋白粘附和凝固到玻璃管的内侧),再次安装流文化室,并推回流文化室的顶部隔间。将种子结构直接放置在孵化器的流动培养室中,而没有任何介质或磷酸盐缓冲盐水 (PBS)。
- 所有动态示例重复步骤 4.4.1 至 4.4.9。对于安装在没有孔的压管上的静态样品,种子根据步骤 4.4.14.4.8 进行,然后放置在 15 mL 管中。
- 让纤维蛋白在孵化器中聚合60分钟。
[协议可以在这里暂停 30 至 60 分钟。
- 聚合后,将流培养室(动态样品)或 15 mL 管(静态样品)填充介质。
5. 开始实验前生物反应器和流泵系统的耦合
注:在层压流柜中执行步骤 5.1 至 5.3。
- 取带流培养室和流体单元的托盘,在层压流柜内装有填充的中型储层和连接的中管。
- 将流培养室放置在生物反应器基座上,用于装载循环拉伸和组合血态载荷的实验组(图1E)。
- 将流培养室倒置,用带细管的注射器从下面填充压力导管(这可以是任何类型的,只要它是灵活和薄的,在这个实验中,一个10厘米长,0.15毫米内径线连接到针)。
- 将细管放在压力导管内,当压力导管中充满超纯水时,通过逐渐将水从注射器中推出,同时将导线从压力导管中拉出,以确保压力导管内没有气泡。
- 将流培养室放在生物反应器基座上的八根螺丝线之一上。在生物反应器基座和白色 Luer 连接器之间放置硅胶 O 环,以防止可能的泄漏,并从底部隔间拧紧白色 Luer 连接器。
- 对于所有周期性拉伸样品,重复步骤 5.2.2 和 5.2.3。
- 将除静态控制以外的所有实验组的流培养室与流泵系统连接起来。
- 将软管夹放在中管上。取下覆盖流文化室顶部隔间的流入口的白色 Luer 盖。取出中管的雌性Luer耦合器,将中管一侧与顶部隔间的流入口连接起来,将中管的另一侧与底部隔间的流口连接起来。
- 对于所有流文化室重复步骤 5.3.1。此时,生物反应器和流培养室充满介质并连接到流系统。
- 对于静态控制样品,使用剪刀夹将样品垂直放置在带滤盖的细胞培养瓶中。将细胞培养瓶填充中等,并放置在孵化器中。
- 将整个设置从层压流柜转移到孵化器,并将流体单元连接到气压管和电缆。
- 启动软件,并初始化流泵。逐个启动样本的介质流。
- 检查流体单元的阀门是否在咔嗒作响。
- 从中管中取出软管夹。
- 使用 100 mbar 和 10s 切换时间启动流泵。
- 仔细检查流量方向是否有可能泄漏或气泡。任何被封住的气泡都可以通过倒置流文化室来消除。
注意:确保中型水库的中等水平是平衡的,防止空气吸入系统和气泡在流文化室,并不允许水库干涸(图2C)。 - 对于所有流体单元逐一重复步骤 5.5。
- 初始化应变泵。
- 通过气动缸上的空气入口将气动驱动泵与压缩空气连接起来。将下部空气出口与蓝色管子连接起来以供空气使用(图1F)。
- 打开 LabVIEW 软件,运行 LabVIEW 脚本和压缩气压应用系统,如 Van Kelle 等人68所描述的那样,进入位移和频率(从低频 0.2 Hz 开始)。当特氟隆波纹管处于最低水平时,暂停泵。
- 将压力传感器放在液压储层上的压力传感器入口中。
- 将泵设置更改为所需的设置(对于 1.5 Pa,使用 150 mbar,切换时间为 10s)。
- 启动应变泵,并应用首选设置(例如,0.5 Hz,1.05 拉伸)。
6. 运行实验多日:在文化和中等替换期间对剪切和拉伸的监测
- 计算脚手架墙上的 WSS。
- 每隔一天记录一次流量幅度(详情请参阅流量泵制造商手册)。简言之,观察流体单元储层切换 10s 之间的中型储层(mL)的液位变化。进行至少五次测量,计算平均值,乘以 6 以获得 mL/min 的流量Q。
- 流由通过环形通道的 Poiseuille 流描述。假设培养基作为牛顿流体,按方程1计算脚手架壁上的 WSS, r 1。
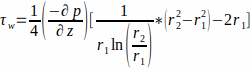 (1)
(1)
其中WSS +w在脚手架壁(r1;这里r1 = 1.7 毫米),由稳定的状态流,由施加的压力p和玻璃管r2 的内部半径(这里r2 =2.3毫米)决定。轴向的压力梯度假定在流入口和流口之间均匀,由方程2(图1J)给出。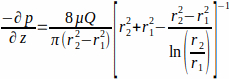 (2)
(2)
动态粘度 μ( 此处假设中粘度为恒定 ,μ 1 ×0-3 Pa+s 在 37 °C 下)和 Q 应用流量。
- 每隔一天监测一次涂在脚手架上的伸展。
- 将黑暗背景放在流动文化室后面,以增加脚手架和背景之间的对比度。将 LED 灯对齐,指向脚手架,以帮助脚手架的可视化。
- 用高速摄像机拍摄脚手架的延时照片,频率为 30 Hz,频率为 6s(即 3 个拉伸周期)。
注意:如果摄像机允许,较低的录制频率可能就足够了。但是,未确定最小要求的频率。 - 手动从图像中确定脚手架的最小和最大直径。
- 计算电喷支架的最小和最大外径,根据方程 3 计算最大延伸。
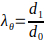 (3)
(3)
其中,圆周伸展(+)是由脚手架的外径(d1)与其初始直径d0之间的比率给出的。
- 适合中等蒸发,每周刷新介质三次。
- 停止并脱钩流系统和应变泵的电缆。
- 将软管夹放在中管上。
- 根据中储层上的体积指示标记确定中蒸发量。
- 将托盘与生物反应器和流体单元一起转移到层压流柜中。
- 拆下中型储层的橡胶空气过滤器;添加自动裂压超纯水,以补偿中等蒸发量。再次关闭中型水库,并再次连接到泵,将介质与超纯水混合。
- 重复步骤 6.3.1 至 6.3.5。再次取出橡胶空气过滤器,取出 25 mL 的培养介质,在 RT 以 300 × g 旋转 5 分钟。
- 收集 1.5 mL 超高分子,并存储在 -30 °C 分析分泌剖面(用于酶相关免疫吸附检测 (ELISA) 分析)。
- 收集超纳特所需的体积,用于寄生虫信号研究,使用超纳特作为条件介质43。
- 在中型水库中加入 25 mL 的新鲜介质。
- 将橡胶空气过滤器放回中型储层上。
- 将完整的设置放回孵化器中;将所有电缆和空气管连接到泵和应变泵。释放软管夹并重复步骤 5.4 至 5.8。
- 检查连接到泵的干燥瓶中的硅干燥珠是否湿润(白色外观),并在需要时用干硅珠(橙色外观)替换。
7. 结束实验、样品收集和设备清洁和存储
- 在实验的最后一天,正确选择第 6.3.11 6.3.5 步中描述的中等蒸发,并逐一采集样本。
- 要逐一采集样品,需要暂停几次流泵和应变泵。将软管夹放在中管上。暂时停止流泵和应变泵。断开一个流培养室与生物反应器基座分离:代之以生物反应器基座上的白色 Luer 帽。将流培养室和流体单元带到层压流柜。再次启动流泵和应变泵,将血液动力负荷施加到其他样品上,直到收获。
- 通过 ELISA 从介质储层收集介质,用于对基因进行辅助细胞因子生产分析。
- 脱钩流单元和收获管结构。根据所需的切割方案进行节。部分构造可存储在 4 °C(在 3.7% 甲醛中固定 15 分钟后,在 PBS 中清洗 3 x 5 分钟)或 -30 °C(液氮中夹紧后),直到进一步分析。
- 清洁生物反应器和泵组件。此外,材料 表中还提到了每个项目的建议清洁方法。
- 用 70% 乙醇清洁橡胶空气过滤器。小心不要滋润内部过滤器!
- 收集所有单独的组件:中管、中储层、玻璃管、公露耳塞和雌性Luer锁、白色Luer帽、压力管、鼻锥、硅胶O环、适配器衬里、流直器(不包括泵、流体单元、橡胶空气过滤器、生物反应器基座)和自来水冲洗。
- 将 O/N 放在 0.1% 的二甲基硫酸钠中,放归去离子水中。
注意:不要使用超纯水,因为部件可能会生锈。 - 用自来水和洗碗皂冲洗。
- 浸入去离子水中,其次是70%乙醇两次,其次是去离子水。
- 将所有材料单独放在纸巾上,晾干。使用有压力的空气干燥管。
- 用浸泡在 70% 乙醇中的纸巾清洁所有非自动组织材料。这包括橡胶空气过滤器(请记住空气过滤器应保持干燥)和生物反应器基座(铁氟龙波纹管和气动气缸)。
- 高压灭菌流体室(包括硅胶 O 环)、中型管、中储层(无橡胶空气过滤器)、男性 Luer 插头和女性 Luer 耦合器、白色 Luer 帽、软管夹和标准设备(例如钳子、夹紧剪刀)
- 为了在下一个实验中方便使用,请将一个完整的流体腔的单独组件组合在一个可自动包装盒中。
- 从水库取水。用70%乙醇清洁,然后是去离子水。让它干燥。用去离子水和几滴水浴保存消毒剂补充。
- 将玻璃管存放在 70% 乙醇的流动培养室中。
- 将潮湿的二氧化硅干燥珠(白色外观)放在烤箱 O/N 的 120 °C 下,让它们干燥(橙色外观),并存放在密封的烧瓶中。
结果
该生物反应器的开发是为了研究剪切应激和循环拉伸对血管组织生长和3D生物材料脚手架改造的个体和组合效应。生物反应器的设计允许在各种装载条件下培养多达8个血管结构(图1A)。血管结构位于流动培养室(图1B),其中周长伸展和WSS都可以独立控制。流文化室的顶部隔间持有一个流直发器,以相对较短的沉降长度(图1C)?...
讨论
此处描述的生物反应器允许系统地评估剪切应力和循环拉伸对管状可重新吸附脚手架的炎症和组织再生的个体贡献和综合影响。这种方法还使血管构造能够进行各种各样的分析,在具有代表性的结果部分就说明了这一点。这些结果表明,不同的血液机载系统(即剪切和拉伸的不同组合)对 TEVG 结构的生长和改造都有独特的影响。这些见解通过这个体外平台收集,有助于优化新开发的原地 TEVG 的脚?...
披露声明
作者没有什么可透露的。
致谢
这项研究得到了ZonMw的资助,作为LSH 2Treat计划(436001003)和荷兰肾脏基金会(14a2d507)的一部分。N.A.K.感谢欧洲研究理事会(851960)的支持。我们感谢荷兰科学研究组织(024.003.013)资助的引力计划"材料驱动再生"。
材料
| Name | Company | Catalog Number | Comments |
| advanced Dulbecco’s modified EagleMedium (aDMEM) | Gibco | 12491-015 | cell culture medium for fibroblasts |
| Aqua Stabil | Julabo | 8940012 | prevent microorganism growth in bioreactor-hydraulic reservoir |
| Bovine fibrinogen | Sigma | F8630 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Bovine thrombin | Sigma | T4648 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Centrifuge | Eppendorf | 5804 | to spin down cells and conditioned medium |
| Clamp scissor - "kelly forceps" | Almedic | P-422 | clamp the silicone tubing and apply pre-stretch to the scaffold so the scaffold can be sutured into the engraved groove (autoclave at step 1, step 7) |
| CO2 cell culture incubators | Sanyo | MCO-170AIC-PE | for cell culturing |
| Compressed air reservoir | Festo | CRVZS-5 | smoothing air pressure fluctuations and create time delays for pressure build-up |
| Custom Matlab script to calculate the maximum stretches | Matlab | R2017. The Mathworks, Natick, MA | calculate the minimum and maximum outer diameter of the electrospun scaffold |
| Data acquisition board | National Instruments | BNC-2090 | data processing in between amplifier system and computer |
| Ethanol | VWR | VWRK4096-9005 | to keep sterile working conditions |
| Fetal bovine calf serum (FBS) | Greiner | 758087 | cell culture medium supplement; serum-supplement |
| Flow culture chamber compartments, consisting of a pressure conduit with engraved grooves and small holes to apply pressure on silicone tubing, a screw thread, nose cone, top compartment with flow inlet and bottom compartment flow outlet, adapter bushing | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | flow culture chamber compartments (autoclave at step 1, step 7) |
| Glass Pasteur pipet | Assistant | HE40567002 | apply vacuum on electrospun scaffold (autoclave at step 1) |
| Glass tubes of the flow culture chamber | Custon made, Equipment & Prototype Center, Eindhoven University of Technology | n.a. | part of the flow culture chamber (clean and store in 70% ethanol, at step 1 and 7) |
| GlutaMax | Gibco | 35050061 | cell culture medium amino acid supplement, minimizes ammonia build-up |
| High speed camera | MotionScope | M-5 | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| High speed camera lens - Micro-NIKKOR 55mm f/2.8 - lens | Nikon | JAA616AB | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| Hose clip | ibidi GmbH | 10821 | block medium flow (autoclave at step 1, step 7) |
| Hydraulic reservoir with 8 screw threads for 8 flow culture chambers | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to apply pressure to the silicone mounted constructs (clean outside with a paper tissue with 70% ethanol, rinse reservoir with 70% ethanol followed by demi water, at step 1 and 7) |
| Ibidi pump system (8x) including ibidi pump, PumpControl software, fluidic unit, perfusion set (medium tubing), air pressure tubing, drying bottles with orange silica beads | ibidi GmbH | 10902 | set up used to control the flow in the flow culture chambers. Note 1: the ibidi pumps were modified by the manufacturer to enable 200 mbar capacity. Note 2: can be replaced by pump system of other manufacturer, as long as same flow regimes can be applied. |
| Knives (no.10 sterile blades, individual foil pack) and scalpel handle (stainless steel, individually wrapped) | Swann Morton | 0301; 0933 | to cut the silicone tubing in the correct size for the scaffold and to cut the suture material |
| LabVIEW Software | National Instruments | version 2018 | to control the stretch applied to the scaffolds |
| Laminar flow biosafety cabinet with UV light | Labconco | 302310001 | to ensure sterile working conditions. The UV is used to decontaminate everything that cannot be autoclaved, or touched after autoclaving |
| Large and small petri dishes | Greiner | 664-160 | for sterile working conditions |
| L-ascorbic acid 2-phosphate (vitamin C) | Sigma | A8960 | cell culture medium supplement, important for collagen production |
| LED light cold source KL2500 | Zeiss | Schott AG | to aid in visualization for the time lapse of the scaffolds during monitoring of the stretch |
| Luer (female and male) locks and connectors, white luer caps | ibidi GmbH | various, see (https://ibidi.com/26-flow-accessories) | to close or connect parts of the bioreactor and the ibidi pump (autoclave at step 1, step 7) |
| Measuring amplifier (PICAS) | PEEKEL instruments B.V. | n.a. | to amplify the signal from the pressure sensor and feedback to LabView |
| Medium reservoir (large syringes 60 mL) and reservoir holders | ibidi GmbH | 10974 | medium reservoir (autoclave at step 1, step 7) |
| Medium tubing with 4.25 mm outer diameter and 1 mm inner diameter | Rubber BV | 1805 | to allow for a larger flow rate, the ibidi medium tubing with larger diameter is used. Note: the part of medium tubing guided through the fluidic unit valves are the same as the default ibidi medium tubing |
| Motion Studio Software | Idtvision | 2.15.00 | to make the high speed time lapse images for stretch monitoring |
| Needle (19G) | BD Microlance | 301700 | together with thin flexible tubing used to fill the hydraulic reservoir with ultrapure water without adding air bubbles |
| Needle driver | Adson | 2429218 | to handle the needle of the nylon suture through the silicone tube (autoclave at step 1, step 7) |
| Paper tissues | Kleenex | 38044001 | for cleaning of the equipment with 70% ethanol |
| Parafilm | Sigma | P7793-1EA | quick fix if leakage occurs |
| Penicillin/streptomycin (P/S) | Lonza | DE17-602E | cell culture medium supplement; prevent bacterial contamination |
| Phosphate Buffered Saline (PBS) | Sigma | P4417-100TAB | for storage and washing steps (autoclave at step 1) |
| Plastic containers (60 mL) with red screw caps | Greiner | 206202 | to prepare the fibrinogen solution |
| Pneumatic cylinder | Festo | AEVC-20-10-I-P | to actuate the Teflon bellow (clean with a paper tissue with 70% ethanol at step 1 and 7) |
| Polycaprolactone bisurea (PCL-BU) tubular scaffolds (3 mm inner diameter, 200 µm wall thickness, 20 mm length) | SyMO-Chem, Eindhoven, The Netherlands | n.a. | produced using electrospinning from 15% (w/w) chloroform (Sigma; 372978) polymer solutions. See Van Haaften et al Tissue Engineering Part C (2018) for more details |
| Pressure conduit without holes (for static control) | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to mount electrospun tubes on silicon tubing (autoclave at step 1, step 7) |
| Pressure sensor and transducer | BD | TC-XX and P 10 EZ | the air pressure going to the pneumatic actuated pump is raised until it reaches the set pressure |
| Proportional air pressure control valve and pressure sensor | Festo | MPPES-3-1/8-2-010, 159596 | provides compressed air to the pneumatic actuated pump |
| Roswell Park Memorial Institute 1640 (RPMI-1640) | Gibco | A1049101 | cell culture medium for monocyte/macrophage |
| Safe lock Eppendorf tubes (1.5 mL) | Eppendorf | 30120086 | multiple applications (autoclave at step 1) |
| Sodium dodecyl sulfate solution 20% | Sigma | 5030 | Used to clean materials, at a concentration of 0.1%. |
| Silicone O-rings | Technirub | 1250S | to prevent leakage (autoclave at step 1, step 7) |
| Silicone tubing (2.8 mm outer diameter, 400 um wall thickness) | Rubber BV | 1805 | to mount the electrospun tubes on the pressure conduits (autoclave at step 1) |
| Sterile tube (15 mL) | Falcon | 352095 | multiple applications |
| Suture, 5-0 prolene with pre-attached taper point needle | Ethicon, Johnson&Johnson | EH7404H | Prolene suture wire 5-0 (75cm length, TF taper point needle, 1/2 circle, 13 mm needle length) |
| Syringe (24 mL) | B. Braun Melsungen AG | 2057932 | to add the ultrapure water or medium to the hydraulic reservoir or flow culture chamber |
| Syringe filter (0.2 µm) | Satorius | 17597-K | to filter the fibrinogen solution |
| T150 cell culture flask with filter cap | Nunc | 178983 | to degas culture medium |
| T75 Cell culture flask with filter cap | Nunc | 156499 | to culture static control samples |
| Teflon bellow | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to load the hydraulic reservoir (clean outside with a paper tissue with 70% ethanol at step 1 and 7) |
| Tray (stainless steel) | PolarWare | 15-248 | for easy transport of the fluidic culture chambers and the bioreactor from incubator to laminar flow cabinet and back (clean with a paper tissue with 70% ethanol before and after use) |
| Tweezers | Wironit | 4910 | sterile handling of individual parts (autoclave at step 1 and 7) |
| Ultrapure water | Stakpure | Omniapure UV 18200002 | to correct for medium evaporation, mixed with aqua stabil mixed and used as hydraulic fluid. (autoclave ultrapure water at step 1) |
| UV light | Philips | TUV 30W/G30 T8 | for decontamination of grafts and bioreactor parts before seeding |
参考文献
- Chlupác, J., Filová, E., Bacáková, L. Blood vessel replacement: 50 years of development and tissue engineering paradigms in vascular surgery. Physiological Research. 58, 119-139 (2009).
- Huygens, S. A., et al. Bioprosthetic aortic valve replacement in elderly patients: Meta-analysis and microsimulation. The Journal of Thoracic and Cardiovascular Surgery. 157 (6), 2189-2197 (2019).
- Huygens, S. A., et al. Contemporary outcomes after surgical aortic valve replacement with bioprostheses and allografts: a systematic review and meta-analysis. European Journal of Cardio-Thoracic Surgery. 50 (4), 605-616 (2016).
- Loh, S. A., et al. Mid- and long-term results of the treatment of infrainguinal arterial occlusive disease with precuffed expanded polytetrafluoroethylene grafts compared with vein grafts. Annals of Vascular Surgery. 27 (2), 208-217 (2013).
- Tara, S., et al. Vessel bioengineering. Circulation Journal. 78 (1), 12-19 (2014).
- Huang, A. H., Niklason, L. E. Engineering of arteries in vitro. Cellular and Molecular Life Sciences. 71 (11), 2103-2118 (2014).
- Bouten, C. V. C., Smits, A. I. P. M., Baaijens, F. P. T. Can we grow valves inside the heart? Perspective on material-based in situ heart valve tissue engineering. Frontiers in Cardiovascular Medicine. 5, 54 (2018).
- Fioretta, E. S., et al. Next-generation tissue-engineered heart valves with repair, remodelling and regeneration capacity. Nature Reviews Cardiology. , (2020).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Science Translational Medicine. 11 (485), (2019).
- Gutowski, P., et al. Arterial reconstruction with human bioengineered acellular blood vessels in patients with peripheral arterial disease. Journal of Vascular Surgery. , (2020).
- Syedain, Z., et al. Tissue engineering of acellular vascular grafts capable of somatic growth in young lambs. Nature Communications. 7 (12951), 12951 (2016).
- Sugiura, T., et al. Tissue-engineered vascular grafts in children with congenital heart disease: intermediate term follow-up. Seminars in Thoracic and Cardiovascular Surgery. 30 (2), 175-179 (2018).
- Kluin, J., et al. In situ heart valve tissue engineering using a bioresorbable elastomeric implant - material design to 12 months follow-up in sheep. Biomaterials. 125, 101-117 (2017).
- Fioretta, E. S., et al. Differential leaflet remodeling of bone marrow cell pre-seeded versus nonseeded bioresorbable transcatheter pulmonary valve replacements. JACC. Basic to Translational Science. 5 (1), 15-31 (2020).
- Van Haaften, E. E., Bouten, C. V. C., Kurniawan, N. A. Vascular mechanobiology: towards control of. Cells. , 1-24 (2017).
- De Jonge, N., et al. Matrix production and organization by endothelial colony forming cells in mechanically strained engineered tissue constructs. PLoS ONE. 8 (9), 73161 (2013).
- Schmidt, J. B., Chen, K., Tranquillo, R. T. Effects of intermittent and incremental cyclic stretch on ERK signaling and collagen production in engineered tissue. Cellular and Molecular Bioengineering. 9 (1), 55-64 (2016).
- Luo, J., et al. Tissue-engineered vascular grafts with advanced mechanical strength from human iPSCs. Cell Stem Cell. 26 (2), 251-261 (2020).
- Van Haaften, E. E., et al. Decoupling the effect of shear stress and stretch on tissue growth and remodeling in a vascular graft. Tissue Engineering Part C: Methods. 24 (7), 418-429 (2018).
- Gupta, V., Tseng, H., Lawrence, B. D., Jane Grande-Allen, K. Effect of cyclic mechanical strain on glycosaminoglycan and proteoglycan synthesis by heart valve cells. Acta Biomaterialia. 5 (2), 531-540 (2009).
- Lin, S., Mequanint, K. Bioreactor-induced mesenchymal progenitor cell differentiation and elastic fiber assembly in engineered vascular tissues. Acta Biomaterialia. 59, 200-209 (2017).
- Venkataraman, L., Bashur, C. A., Ramamurthi, A. Impact of cyclic stretch on induced elastogenesis within collagenous conduits. Tissue Engineering. Part A. 20 (9-10), 1403-1415 (2014).
- Huang, A. H., et al. Biaxial stretch improves elastic fiber maturation, collagen arrangement, and mechanical properties in engineered arteries. Tissue Engineering Part C Methods. 22 (6), 524-533 (2016).
- Hinderer, S., et al. In vitro elastogenesis: instructing human vascular smooth muscle cells to generate an elastic fiber-containing extracellular matrix scaffold. Biomedical Materials. 10 (3), 034102 (2015).
- Eoh, J. H., et al. Enhanced elastin synthesis and maturation in human vascular smooth muscle tissue derived from induced-pluripotent stem cells. Acta Biomaterialia. 52, 49-59 (2017).
- Smits, A. I. P. M., Bouten, C. V. C. Tissue engineering meets immunoengineering: Prospective on personalized in situ tissue engineering strategies. Current Opinion in Biomedical Engineering. 6, 17-26 (2018).
- Wissing, T. B., Bonito, V., Bouten, C. V. C., Smits, A. I. P. M. Biomaterial-driven in situ cardiovascular tissue engineering-a multi-disciplinary perspective. npj Regenerative Medicine. 2 (1), 18 (2017).
- Hibino, N., et al. A critical role for macrophages in neovessel formation and the development of stenosis in tissue-engineered vascular grafts. The FASEB Journal. 25 (12), 4253-4263 (2011).
- Godwin, J. W., Pinto, A. R., Rosenthal, N. A. Macrophages are required for adult salamander limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9415-9420 (2013).
- Godwin, J. W., Debuque, R., Salimova, E., Rosenthal, N. A. Heart regeneration in the salamander relies on macrophage-mediated control of fibroblast activation and the extracellular landscape. npj Regenerative Medicine. 2 (1), 22 (2017).
- McBane, J. E., Cai, K., Labow, R. S., Santerre, J. P. Co-culturing monocytes with smooth muscle cells improves cell distribution within a degradable polyurethane scaffold and reduces inflammatory cytokines. Acta Biomaterialia. 8 (2), 488-501 (2012).
- Battiston, K. G., Ouyang, B., Labow, R. S., Simmons, C. A., Santerre, J. P. Monocyte/macrophage cytokine activity regulates vascular smooth muscle cell function within a degradable polyurethane scaffold. Acta Biomaterialia. 10 (3), 1146-1155 (2014).
- Ploeger, D. T., et al. Cell plasticity in wound healing: paracrine factors of M1/ M2 polarized macrophages influence the phenotypical state of dermal fibroblasts. Cell Communication and Signaling. 11 (1), 29 (2013).
- McBane, J. E., Santerre, J. P., Labow, R. S. The interaction between hydrolytic and oxidative pathways in macrophage-mediated polyurethane degradation. Journal of Biomedical Materials Research. Part A. 82 (4), 984-994 (2007).
- Wissing, T. B., et al. Macrophage-driven biomaterial degradation depends on scaffold microarchitecture. Frontiers in Bioengineering and Biotechnology. 7, 87 (2019).
- Wolf, M. T., Vodovotz, Y., Tottey, S., Brown, B. N., Badylak, S. F. Predicting in vivo responses to biomaterials via combined in vitro and in silico analysis. Tissue Engineering Part C: Methods. 21 (2), 148-159 (2015).
- Grotenhuis, N., Bayon, Y., Lange, J. F., Van Osch, G. J. V. M., Bastiaansen-Jenniskens, Y. M. A culture model to analyze the acute biomaterial-dependent reaction of human primary macrophages. Biochemical and Biophysical Research Communications. 433 (1), 115-120 (2013).
- Jannasch, M., et al. A comparative multi-parametric in vitro model identifies the power of test conditions to predict the fibrotic tendency of a biomaterial. Scientific Reports. 7 (1), 1689 (2017).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- McWhorter, F. Y., Davis, C. T., Liu, W. F. Physical and mechanical regulation of macrophage phenotype and function. Cellular and Molecular Life Sciences. 72 (7), 1303-1316 (2014).
- Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Strain-dependent modulation of macrophage polarization within scaffolds. Biomaterials. 35 (18), 4919-4928 (2014).
- Dziki, J. L., et al. The effect of mechanical loading upon extracellular matrix bioscaffold-mediated skeletal muscle remodeling. Tissue Engineering. Part A. 24 (1-2), 34-46 (2018).
- Wissing, T. B., et al. Hemodynamic loads distinctively impact the secretory profile of biomaterial-activated macrophages - implications for in situ vascular tissue engineering. Biomaterials Science. 8 (1), 132-147 (2020).
- Van Haaften, E. E., Wissing, T. B., Kurniawan, N. A., Smits, A. I. P. M., Bouten, C. V. C. Human in vitro model mimicking material-driven vascular regeneration reveals how cyclic stretch and shear stress differentially modulate inflammation and matrix deposition. Advanced Biosystems. 4 (6), 1900249 (2020).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Bonito, V., de Kort, B. J., Bouten, C. V. C., Smits, A. I. P. M. Cyclic strain affects macrophage cytokine secretion and extracellular matrix turnover in electrospun scaffolds. Tissue Engineering Part A. 25 (17-18), 1310-1325 (2019).
- Battiston, K. G., Labow, R. S., Simmons, C. A., Santerre, J. P. Immunomodulatory polymeric scaffold enhances extracellular matrix production in cell co-cultures under dynamic mechanical stimulation. Acta Biomaterialia. 24, 74-86 (2015).
- Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. A mesofluidics-based test platform for systematic development of scaffolds for in situ cardiovascular tissue engineering. Tissue Engineering Part C: Methods. 18 (6), 475-485 (2012).
- Smits, A. I. P. M., Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. T. Shear flow affects selective monocyte recruitment into MCP-1-loaded scaffolds. Journal of Cellular and Molecular Medicine. 18 (11), 2176-2188 (2014).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Fahy, N., Menzel, U., Alini, M., Stoddart, M. J. Shear and dynamic compression modulates the inflammatory phenotype of human monocytes in vitro. Frontiers in Immunology. 10, 383 (2019).
- Pennings, I., et al. Layer-specific cell differentiation in bi-layered vascular grafts under flow perfusion. Biofabrication. 12 (1), 015009 (2019).
- Wang, J., et al. Ex vivo blood vessel bioreactor for analysis of the biodegradation of magnesium stent models with and without vessel wall integration. Acta Biomater. 50, 546-555 (2017).
- Huang, A. H., et al. Design and use of a novel bioreactor for regeneration of biaxially stretched tissue-engineered vessels. Tissue Engineering. Part C, Methods. 21 (8), 841-851 (2015).
- Huang, A. H., Niklason, L. E. Engineering biological-based vascular grafts using a pulsatile bioreactor. Journal of Visualized Experiments. (52), e2646 (2011).
- Bono, N., et al. A Dual-mode bioreactor system for tissue engineered vascular models. Annals of Biomedical Engineering. 45 (6), 1496-1510 (2017).
- Wolf, F., et al. VascuTrainer: a mobile and disposable bioreactor system for the conditioning of tissue-engineered vascular grafts. Annals of Biomedical Engineering. 46 (4), 616-626 (2018).
- Ramaswamy, S., et al. A novel bioreactor for mechanobiological studies of engineered heart valve tissue formation under pulmonary arterial physiological flow conditions. Journal of Biomechanical Engineering. 136 (12), 121009 (2014).
- Piola, M., et al. A compact and automated ex vivo vessel culture system for the pulsatile pressure conditioning of human saphenous veins. Journal of Tissue Engineering and Regenerative Medicine. 10 (3), 204-215 (2016).
- Vanerio, N., Stijnen, M., de Mol, B. A. J. M., Kock, L. M. An innovative ex vivo vascular bioreactor as comprehensive tool to study the behavior of native blood vessels under physiologically relevant conditions. Journal of Engineering and Science in Medical Diagnostics and Therapy. 2 (4), (2019).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplantation. 27 (9), 1375-1389 (2018).
- Sinha, R., et al. A medium throughput device to study the effects of combinations of surface strains and fluid-flow shear stresses on cells. Lab on a Chip. 15 (2), 429-439 (2015).
- Beca, B. M., Sun, Y., Wong, E., Moraes, C., Simmons, C. A. Dynamic bioreactors with integrated microfabricated devices for mechanobiological screening. Tissue Engineering Part C: Methods. 25 (10), 581-592 (2019).
- Liu, H., Usprech, J., Sun, Y., Simmons, C. A. A microfabricated platform with hydrogel arrays for 3D mechanical stimulation of cells. Acta Biomaterialia. 34, 113-124 (2016).
- Szafron, J. M., Ramachandra, A. B., Breuer, C. K., Marsden, A. L., Humphrey, J. D. Optimization of tissue-engineered vascular graft design using computational modeling. Tissue Engineering Part C: Methods. 25 (10), 561-570 (2019).
- Emmert, M. Y., et al. Computational modeling guides tissue-engineered heart valve design for long-term in vivo performance in a translational sheep model. Science Translational Medicine. 10 (440), (2018).
- Mol, A., et al. Fibrin as a cell carrier in cardiovascular tissue engineering applications. Biomaterials. 26 (16), 3113-3121 (2005).
- van Kelle, M. A. J., et al. A Bioreactor to identify the driving mechanical stimuli of tissue growth and remodeling. Tissue Engineering Part C: Methods. 23 (6), (2017).
- van den Broek, C. N., et al. Medium with blood-analog mechanical properties for cardiovascular tissue culturing. Biorheology. 45 (6), 651-661 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。