Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un bioréacteur multi-cue pour évaluer la capacité inflammatoire et régénératrice des biomatériaux sous écoulement et étirement
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’objectif de ce protocole est d’exécuter une co-culture dynamique de macrophages humains et de myofibroblastes dans des échafaudages tubulaires électrospunés pour étudier la régénération tissulaire entraînée par les matériaux, à l’aide d’un bioréacteur qui permet le découplage de la contrainte de cisaillement et de l’étirement cyclique.
Résumé
L’utilisation de biomatériaux résorbables pour induire la régénération directement dans le corps est une stratégie attrayante d’un point de vue translationnel. Ces matériaux induisent une réponse inflammatoire lors de l’implantation, qui est le moteur de la résorption ultérieure du matériau et de la régénération de nouveaux tissus. Cette stratégie, également connue sous le nom d’ingénierie tissulaire in situ, est poursuivie pour obtenir des remplacements cardiovasculaires tels que des greffes vasculaires modifiées par des tissus. Les processus inflammatoires et régénératifs sont déterminés par les signaux biomécaniques locaux sur l’échafaudage (c.-à-d. contrainte d’étirement et de cisaillement). Ici, nous décrivons en détail l’utilisation d’un bioréacteur développé sur mesure qui permet de manière unique le découplage de la contrainte d’étirement et de cisaillement sur un échafaudage tubulaire. Cela permet l’évaluation systématique et standardisée de la capacité inflammatoire et régénératrice des échafaudages tubulaires sous l’influence de charges mécaniques bien contrôlées, que nous démontrons sur la base d’une expérience de co-culture dynamique utilisant des macrophages et des myofibroblastes humains. Les principales étapes pratiques de cette approche – la construction et la mise en place du bioréacteur, la préparation des échafaudages et de l’ensemencement des cellules, l’application et le maintien de l’écoulement d’étirement et de cisaillement, et la récolte d’échantillons pour analyse – sont discutées en détail.
Introduction
L’ingénierie tissulaire cardiovasculaire (TE) est poursuivie comme une option de traitement alternative aux prothèses cardiovasculaires permanentes actuellement utilisées (par exemple, greffes vasculaires, remplacements de valves cardiaques), qui sont sous-optimales pour de grandes cohortes de patients1,2,3,4. Les applications très recherchées comprennent les greffes vasculaires d’ingénierie tissulaire (TEVG)5,6 et les valves cardiaques (TEHV)7,8. Le plus souvent, les méthodologies d’ÉT cardiovasculaire utilisent des biomatériaux résorbables (naturels ou synthétiques) qui servent d’échafaudage instructif pour la formation du nouveau tissu. La formation de nouveaux tissus peut soit être conçue complètement in vitro, en ensemencant l’échafaudage avec des cellules et en le cultivant dans un bioréacteur avant l’implantation (TE in vitro)9,10,11, soit directement in situ, dans laquelle l’échafaudage synthétique est implanté sans pré-culture afin d’induire la formation de nouveaux tissus directement dans le corps (TE in situ)12,13,14. Pour les approches cardiovasculaires TE in vitro et in situ, la régénération fonctionnelle réussie dépend principalement de la réponse immunitaire de l’hôte à la construction implantée et de la charge biomécanique appropriée.
L’importance de la charge biomécanique pour les TE cardiovasculaires est bien reconnue15. Dans le cas des implants cardiovasculaires, les cellules qui peuplent l’échafaudage sont exposées à des contraintes d’étirement et de cisaillement cycliques résultant de l’environnement hémodynamique. De nombreuses études ont rapporté l’effet stimulant de l’étirement (cyclique) sur la formation de composants de la matrice,tels que le collagène16,17,18,19, glycosaminoglycanes (GAGs)20, etl’élastine 21,22, par divers types de cellules. Par exemple, Huang et al. ont démontré que l’étirement biaxial élevait le dépôt et l’organisation du collagène et de l’élastine dans les TEVG in vitro en utilisant un bioréacteur vasculaire23. Bien que l’accent soit généralement mis sur l’étirement en tant que charge dominante, ces études utilisent souvent des bioréacteurs pilotés par écoulement dans lesquels l’échantillon est également exposé à un écoulement de cisaillement. Bien que l’on sache relativement peu de choses sur l’influence isolée des contraintes de cisaillement sur la formation des tissus et l’inflammation en 3D, certaines données sont disponibles. Par exemple, Hinderer et al. et Eoh et al. ont démontré que le flux de cisaillement, en plus d’une microstructure d’échafaudage 3D, était important pour la formation d’élastine mature par les cellules musculaires lisses vasculaires humaines dans un système de modèle in vitro24,25. Dans l’ensemble, ces résultats illustrent la pertinence de l’étirement cyclique et du stress de cisaillement pour l’ET cardiovasculaire.
Un autre déterminant important du succès ou de l’échec des implants TE est la réponse immunitaire de l’hôte au greffon implanté26. Ceci est particulièrement important pour les stratégies TE in situ axées sur les matériaux, qui reposent en fait sur la réponse inflammatoire aiguë à l’échafaudage pour lancer les processus ultérieurs d’afflux cellulaire et de formation et de remodelage des tissus endogènes27. Le macrophage est un initiateur critique de la régénération fonctionnelle des tissus, ce qui a été démontré par de multiples études28,29,30. Analogue à la cicatrisation des plaies, la régénération des tissus est régie par la signalisation paracrine entre les macrophages et les cellules productrices de tissus telles que les fibroblastes et les myofibroblastes31,32,33. En plus de coordonner les nouveaux dépôts tissulaires, les macrophages sont impliqués dans la résorption active des échafaudages étrangers34,35. A ce titre, la réponse in vitro des macrophages à un biomatériau a été identifiée comme un paramètre prédictif du succès in vivo des implants36,37,38.
La réponse des macrophages à un échafaudage implanté dépend des caractéristiques de conception de l’échafaudage telles que la composition du matériau et la microstructure35,39,40. En plus des propriétés de l’échafaudage, la réponse des macrophages à un échafaudage et leur diaphonie avec les myofibroblastes sont également affectées par les charges hémodynamiques. Par exemple, l’étirement cyclique s’est avéré être un modulateur important du phénotype des macrophages41,42,43,44 et de la sécrétion de cytokines 43 ,44,45,46 dans les échafaudages électrospunés 3D. En utilisant un système de co-culture de macrophages et de cellules musculaires lisses vasculaires, Battiston et al. ont démontré que la présence de macrophages entraînait une augmentation des niveaux d’élastine et de GAG et que des niveaux modérés d’étirement cyclique (1,07-1,10) stimulaient le dépôt de collagène I et d’élastine47. Dans des travaux antérieurs, nous avons démontré que le stress de cisaillement est un déterminant important pour le recrutement des monocytes dans les échafaudages électro filés3D 48,49, et que le stress de cisaillement et l’étirement cyclique ont un impact sur la signalisation paracrine entre les monocytes humains et les cellules stromales mésenchymateuses50. Fahy et al. ont démontré que le flux de cisaillement augmentait la sécrétion de cytokines pro-inflammatoires par les monocytes humains51.
Pris ensemble, les preuves ci-dessus montrent qu’une compréhension et un contrôle adéquats des charges hémodynamiques sont cruciaux pour l’ÉT cardiovasculaire, et qu’il est important de prendre en compte la réponse inflammatoire pour y parvenir. De nombreux bioréacteurs ont été décrits précédemment pour la culture in vitro52,53,54,55,56,57,58 ou ex vivo59,60,61 de tissus cardiovasculaires. Cependant, tous ces systèmes sont conçus pour imiter autant que possible les conditions physiologiques de charge hémodynamique. Bien que cela soit très utile dans le but de créer des tissus cardiovasculaires in vitro ou de maintenir des cultures ex vivo, de tels systèmes ne permettent pas d’études systématiques sur les effets individuels d’indices individuels. En effet, l’application de la contrainte d’étirement et de cisaillement cyclique dans ces bioréacteurs est entraînée par le même écoulement sous pression, qui les lie intrinsèquement. Alors que des microsystèmes permettant une manipulation mécanique multi-signaux précise ont été décrits pour les substrats2D 62 ou les configurations d’hydrogel 3D63,64, de telles configurations ne permettent pas l’incorporation d’échafaudages de biomatériaux élastomères 3D.
Nous présentons ici l’application d’un système de bioréacteur tubulaire qui permet de manière unique le découplage de la contrainte de cisaillement et de l’étirement cyclique et aide à étudier mécaniquement leurs effets individuels et combinés. Ce système permet de tester une grande variété de greffes vasculaires d’ingénierie tissulaire (par exemple, origine synthétique ou naturelle, micro-architecture différente, porosités diverses). Pour découpler efficacement l’application de la contrainte de cisaillement et de l’étirement, les concepts clés utilisés par le bioréacteur sont (1) la séparation du contrôle de la contrainte de cisaillement et de l’étirement à l’aide de systèmes de pompage distincts et (2) la stimulation des échafaudages de manière « à l’envers » avec des dimensions pilotées par calcul. L’écoulement est appliqué sur la surface extérieure de l’échafaudage tubulaire à l’utilisation d’une pompe à débit, tandis que l’étirement circonférentiel de l’échafaudage est induit par l’expansion d’un tube en silicone sur lequel l’échafaudage est monté à l’utilisation d’une pompe de contrainte séparée. Les dimensions du tube en silicone et du tube en verre qui contient la construction sont soigneusement choisies et validées à l’aide de simulations computationnelles de la dynamique des fluides, afin de s’assurer que la contrainte de cisaillement sur l’échafaudage (due à l’écoulement) et l’étirement circonférentiel (dû à l’expansion du tube) ne s’affectent pas de manière significative. Cette conception à l’envers a plusieurs justifications pratiques. Si l’étirement est appliqué par la pression du fluide luminal (similaire à la charge physiologique), il nécessite intrinsèquement que le plan d’échantillonnage soit exempt de fuites. De plus, la pression requise pour étirer l’échantillon serait entièrement déterminée par la rigidité de l’échantillon, qui peut varier d’un échantillon à l’autre et à l’intérieur d’un échantillon au fil du temps, ce qui rend difficile le contrôle de l’étirement. Ce bioréacteur monte la greffe de tissu autour d’un tube en silicone et permet l’application de contraintes de cisaillement de la paroi (WSS) sur la paroi externe de la greffe et met la greffe sous pression de l’intérieur. De cette façon, des conditions de charge égales entre les échantillons et à l’intérieur des échantillons au fil du temps peuvent être assurées, et de plus, les échantillons sont autorisés à fuir, comme c’est le cas pour les échafaudages vasculaires poreux19. Ce bioréacteur à l’envers est spécifiquement destiné à des études systématiques sur les effets du cisaillement et / ou de l’étirement, plutôt qu’à l’ingénierie d’un vaisseau sanguin de type natif in vitro, pour lequel les configurations de bioréacteur vasculaire traditionnelles sont plus appropriées. Voir la figure 1A–B pour les dessins de conception du bioréacteur et le tableau 1 correspondant pour une description fonctionnelle et une justification des principaux composants du bioréacteur.
L’utilisation du bioréacteur est démontrée sur la base d’une série d’études récentes de notre groupe dans lesquelles nous avons étudié les influences individuelles et combinées du stress de cisaillement et de l’étirement cyclique sur l’inflammation et la formation de tissus dans des échafaudages électrospunables résorbables pour les tissus cardiovasculaires in situ19,43,44. À cette fin, nous avons utilisé des macrophages humains et des myofibroblastes en monoculture ou en co-culture pour simuler les différentes phases de la cascade régénérative in situ. Nous avons démontré que la sécrétion de cytokines par les macrophages humains est nettement affectée par l’étirement cyclique et la contrainte de cisaillement, affectant le dépôt et l’organisation de la matrice par les myofibroblastes humains dans ces échafaudages, à la fois via la signalisation paracrine et le contact direct19,43,44. Notamment, ces études ont révélé que dans le cas de l’application combinée de contrainte de cisaillement et d’étirement, les effets sur la formation tissulaire et l’inflammation sont soit dominés par l’une des deux charges, soit il existe des effets synergiques des deux charges. Ces résultats illustrent la pertinence du découplage des deux charges pour mieux comprendre la contribution de l’environnement mécanique sur les processus TE. Cette compréhension peut être appliquée pour optimiser systématiquement les paramètres de conception des échafaudages dans les régimes de charge hémodynamique pertinents. En outre, les données mécanistes de ces environnements bien contrôlés peuvent servir d’entrée pour des modèles numériques en cours de développement pour prédire l’évolution du remodelage tissulaire in situ, comme cela a été récemment rapporté pour les TEVG65 ou TEHV66,afin d’améliorer encore la capacité prédictive.
Access restricted. Please log in or start a trial to view this content.
Protocole
Dans les études décrites dans ce protocole, des macrophages humains primaires isolés des manteaux bouffants du sang périphérique et des myofibroblastes humains isolés de la veine saphène après une chirurgie de pontage coronaire ont été utilisés44. Les manteaux bouffants ont été obtenus auprès de volontaires en bonne santé et anonymes qui ont fourni un consentement éclairé écrit, qui a été approuvé par le Comité d’éthique médicale de l’établissement de recherche Sanquin. L’utilisation de cellules de vena saphena humaines (HVSC) était conforme au « Code d’utilisation secondaire appropriée des tissus humains » développé par la Fédération des sociétés médicales (FMWV) aux Pays-Bas.
1. Préparatifs généraux et actions requises avant la mise en place du bioréacteur
REMARQUE: Pour plus de détails sur les protocoles d’isolement et de culture respectifs, veuillez vous référer aux travaux précédents19,43,44. Tous les calculs du protocole sont donnés comme exemples pour une expérience de co-culture avec des monocytes et des myofibroblastes, ensemencés dans 8 échafaudages chargés hémodynamiquement et 2 témoins statiques (n = 10).
- Commencer l’isolement cellulaire et la culture cellulaire. Les densités d’ensemencement pour les échantillons de monocytes et de myofibroblastes co-cultivés (avec un rapport d’ensemencement de 2:1) sont respectivement de 30 ×10 6 monocytes/cm3 et de 15 ×10 6 myofibroblastes/cm3.
REMARQUE: Le matériau électropuné a une porosité élevée (>90%). Pour estimer le nombre requis de cellules par greffe, le volume de l’échafaudage est calculé avec la formule du volume d’un cylindre creux: π * (épaisseur)2* longueur ≈ 0,04 cm3. La quantité totale de cellules par greffe est de 1,2 × 106 monocytes et 0,6 × 106 myofibroblastes. Pour 10 échantillons, au moins 12 × 106 monocytes et 6 × 106 myofibroblastes sont nécessaires; commencez avec jusqu’à ~ 10 à 15 % de cellules en plus pour tenir compte des erreurs de pipetage possibles. - Dégazez le milieu de culture cellulaire qui sera utilisé pour des expériences impliquant le bioréacteur.
- Préparer le milieu pour les co-cultures, qui se compose de RPMI-1640:aDMEM (1:1), complété par 10% de sérum bovin fœtal, 1% de pénicilline-streptomycine et 0,5% de L-glutamine.
- Placer le milieu pendant la nuit (O/N) dans un incubateur dans une fiole de culture cellulaire avec bouchon filtrant pour dégazer.
- Remplacez le bouchon du filtre par un bouchon étanche à l’air et conservez-le à 4 °C.
- Juste avant utilisation, ajouter 0,25 mg/mL d’acide L-ascorbique 2-phosphate (vitamine C) au milieu.
REMARQUE: Pour les calculs, la quantité de milieu requise par chambre de culture d’écoulement est de 50 mL. Rafraîchissez le médium trois fois par semaine; L’ancien milieu de 25 mL est remplacé par un milieu frais de 25 mL. Pour 10 échantillons; après l’ensemencement, un total de 500 mL de milieu frais est nécessaire et, pour chaque changement de milieu subséquent, un total de 250 mL de milieu frais est utilisé. Préparez toujours un milieu frais, en particulier de la vitamine C doit être ajoutée juste avant de changer le milieu.
- Préparer des échafaudages électropunés isotropes (diamètre luminal de 3 mm, épaisseur de paroi de 200 μm) tels que décrits par Van Haaften et al.19 (Figure 1G–I). En bref, les échafaudages tubulaires en polycaprolactone bisurée (PCL-BU) sont produits par électrofilage à partir de solutions de chloroforme-polymère à 15% (p /p). Les solutions polymères sont électrofilées à température ambiante et à 30 % d’humidité relative, à un débit de 40 μL/min, à une distance de 16 cm de la cible cylindrique rotative (Ø 3 mm, 500 tr/min), et une tension appliquée de 16 kV sur la buse d’électrofilage et de -1 kV sur la cible.
REMARQUE: Bien que des greffes PCL-BU aient été utilisées pour ces expériences, une grande variété de greffes d’ingénierie tissulaire élastomère peuvent être montées dans ce bioréacteur (par exemple, d’origine synthétique ou naturelle différente, de microarchitecture différente, de porosités différentes)- Retirez les échafaudages électropunés du mandrin.
- Faites un petit trou dans le capuchon d’un tube de 15 mL pour « maintenir » le mandrin au centre et l’empêcher de toucher la paroi du tube.
- Placez le mandrin avec l’échafaudage électropuné dans le tube de faucon et remplissez-le d’eau désionisée.
- Congeler les tubes O/N à -20 °C.
- Placez les tubes à température ambiante (RT) et retirez les mandrins après quelques minutes, en laissant les greffons électrofilés dans la glace.
- Laissez la glace dégeler complètement, retirez le tube électropuné de l’eau décongelée et « suspendez»pour sécher verticalement pendant plusieurs heures. Assurez-vous que les échafaudages ne s’effondrent pas sous leur propre poids.
- Échafaudages secs sous vide O/N.
- Imagez un petit échantillon des greffons électropunés à l’aide de la microscopie électronique à balayage (MEB) pour évaluer leur microstructure (p. ex., morphologie des fibres, diamètre des fibres). Les greffons dans les exemples d’études ont une orientation de fibre isotrope et un diamètre de fibre de 5 μm(Figure 1H–I).
- Retirez les échafaudages électropunés du mandrin.
- Un jour avant de commencer l’expérience, placez le réservoir hydraulique rempli d’eau désionisée dans l’incubateur. Fermez les huit connexions pour les chambres de culture d’écoulement avec des bouchons Luer blancs. Connectez-vous au système d’air comprimé et insérez le capteur de pression. Exécutez la pompe de contrainte (voir l’étape 5.6) O/N pour permettre une petite expansion du soufflet en téflon.
REMARQUE : Assurez-vous que tous les matériaux et équipements nécessaires sont nettoyés et/ou autoclavés (voir la colonne Tableau des matériaux,Commentaires/Description pour lesquels les matériaux peuvent être autoclavés), conformément au protocole du fabricant ou comme décrit aux étapes 7.3 à 7.6. - Assurer des conditions de travail stériles pour le reste du protocole.
- Effectuez les étapes 2 à 5.3 (configuration du système), l’étape 6.3 (changement de milieu) et les étapes 7.1 à 7.2 (récolte de constructions vasculaires) dans une armoire à flux laminaire stérile.
- Placez des matériaux qui ne sont pas directement nécessaires pour les étapes suivantes dans des boîtes de Petri fermées afin de garder tout aussi propre que possible.
- Nettoyez ou séchez régulièrement les surfaces des matériaux en trempant un mouchoir en papier avec 70% d’éthanol et essuyez les surfaces des composants du bioréacteur et de l’armoire à flux laminaire.
2. Mise en place du bioréacteur
REMARQUE : Effectuez l’étape 2 dans une armoire à flux laminaire.
- Coupez les échafaudages électropunés dans des tubes d’environ 25 mm de longueur et documentez-les avant utilisation (p. ex., photographiez la longueur, pesez avec la balance pour la masse initiale).
- Décontaminer les échafaudages électropunés.
- Placez les échafaudages électropunés inclinés dans une plaque de puits ou une boîte de Petri, avec une ouverture face à la source de lumière ultraviolette (UV), pour permettre à la lumière UV (253,7 nm) d’éclairer l’intérieur des échafaudages.
- Exposez les échafaudages électropunés à la lumière UV pendant 5 min.
- Tournez tous les échafaudages et répétez l’éclairage UV pour l’autre ouverture.
REMARQUE: Après cette étape, ne touchez l’échafaudage électrospuné qu’en cas de besoin. Utilisez toujours une pince à épiler propre ou des gants propres. - Prenez les tubes de verre des chambres de culture en flux qui sont stockés dans 70%, lavez les tubes de verre dans de l’eau ultrapure, séchez-les et placez-les dans une grande boîte de Petri fermée.
REMARQUE: Les étapes suivantes, en particulier les étapes 2.3 à 2.5, sont idéalement effectuées par deux expérimentateurs.
- Montez les échafaudages électropunés sur le tube en silicone.
- Fixez la suture de prolène 5-0 à une extrémité du tube en silicone en prenant la suture d’un côté du tube et de l’autre, en laissant deux sutures tendues opposées couvrant la section transversale du tube. Faites un petit nœud des deux côtés du tube tout en comprimant le tube au locus des nœuds et laissez environ 10 cm de fil sur les deux nœuds. Faites un troisième nœud à l’extrémité des deux fils restants de 10 cm.
- Coupez l’aiguille de suture et tous les fils libres qui pourraient sortir et endommager l’intérieur de l’échafaudage électrofilé. Coupez les bords du tube en silicone en une forme triangulaire pour aider à tirer le tube en silicone à travers l’échafaudage électropuné.
- Trempez l’échafaudage électrofilé dans de l’éthanol à 30% (cela sert d’étape de décontamination supplémentaire et aide à faire glisser l’échafaudage électrofilé sur le tube de silicium) et placez l’échafaudage électrofilé sur le fil libre de 10 cm. L’expérimentateur A étire le tube en silicone en tirant doucement sur le tube en silicone et le nœud du fil de suture de 10 cm, tandis que l’expérimentateur B fait glisser doucement l’échafaudage électrofilé sur le tube en silicone à l’aide d’une pince à épier avec une pointe intérieure lisse pour éviter d’endommager les échafaudages.
- Relâchez lentement l’étirement sur le tube en silicone, tout en lissant simultanément l’échafaudage électro filé avec une pince à épiler. Trempez deux fois l’échafaudage électropuné sur le tube en silicone dans de l’eau ultrapure.
REMARQUE: Il est possible qu’un certain froissement de l’échafaudage électrospuné se produise. Ces rides disparaîtront pendant le pré-étirement appliqué juste avant de fixer les échafaudages aux conduits de pression à l’étape 2.5.3. - Répétez les étapes 2.3.2 et 2.3.3 pour les autres échafaudages électropunés. Selon la longueur du tube en silicone, plusieurs échafaudages électrospunés peuvent être montés sur le même tube en silicone.
- Lorsque tous les échafaudages électropunés sont montés sur le tube en silicone, coupez le tube en silicone autour des échafaudages, le tout à la même longueur (5,5 cm); d’un côté, près de l’extrémité de l’échafaudage électropuné, de l’autre côté, laissant ~ 2–3 cm de tube en silicone libre.
- Fixez la suture de prolène 5-0 à une extrémité du tube en silicone en prenant la suture d’un côté du tube et de l’autre, en laissant deux sutures tendues opposées couvrant la section transversale du tube. Faites un petit nœud des deux côtés du tube tout en comprimant le tube au locus des nœuds et laissez environ 10 cm de fil sur les deux nœuds. Faites un troisième nœud à l’extrémité des deux fils restants de 10 cm.
- Construire le compartiment inférieur de la chambre de culture d’écoulement (Figure 1A–B).
- Prenez la partie supérieure du compartiment inférieur contenant la sortie de débit et fermez la sortie de débit avec un bouchon Luer mâle.
- Poussez le conduit de pression avec des trous à travers le compartiment inférieur et placez un joint torique en silicone autour de l’extrémité inférieure du conduit de pression pour éviter les fuites. Vissez la partie inférieure du compartiment inférieur à la partie supérieure du compartiment inférieur pour fixer le conduit de pression. Assurez-vous que la rainure gravée inférieure du conduit de pression se trouve à environ 3 à 5 mm au-dessus du bord de la bague de l’adaptateur du compartiment inférieur; cela « maintiendra » plus tard le nœud serré du fil de suture, fixant l’échafaudage électrofilé sur le tube en silicone.
REMARQUE: Si le conduit de pression peut être facilement manœuvré de haut en bas, cela indique que le compartiment inférieur n’est pas bien fixé. Répétez l’étape 2.4.2 pour éviter les fuites dans les étapes ultérieures(Figure 2D).
- Fixez le tube en silicone avec l’échafaudage électropuné au conduit de pression.
- Tirez le tube en silicone avec l’échafaudage électrofilé sur le conduit de pression.
- Faites un nœud avec le fil de suture à l’extrémité inférieure de l’échafaudage électrofilé à l’emplacement de la rainure gravée sur le conduit de pression. Faites un deuxième nœud du côté opposé pour fixer fermement le tube en silicone avec la greffe électropunée.
ATTENTION : Il s’agit d’une étape critique. Assurez-vous que le nœud « tombe » exactement dans la rainure gravée du conduit de pression pour éviter toute fuite de l’eau du réservoir hydraulique vers les chambres de culture d’écoulement. Si vous n’êtes pas sûr, essayez de serrer le fil de suture à plusieurs positions, au-dessus ou au-dessous de l’emplacement prévu de la rainure, pour vous assurer que les nœuds finaux sont exactement à la rainure gravée (Figure 2A). - Placez la pince à ciseaux à l’extrémité supérieure du tube en silicone et étirez le tube en silicone vers le haut (cela testera directement le premier nœud, s’il est possible de déplacer le tube en silicone avec l’échafaudage électrospuné sur le conduit de pression, il n’a pas été suffisamment serré). Avec la force de traction, le tube en silicone est pré-étiré. Pour vous assurer que le tube en silicone est cohérent entre les différents échantillons, fixez une règle à la pince à ciseaux. Tirez la pince à ciseaux vers le haut jusqu’à ce que l’extrémité inférieure de la règle atteigne la hauteur de l’extrémité inférieure de l’échafaudage.
REMARQUE: Il est important de garder le pré-étirement dans chaque échantillon à peu près le même (~ 5%) pour deux raisons: (1) si le tube en silicone est pré-étiré, il en résultera une expansion plus homogène sur toute la longueur de l’échantillon lorsqu’il est sous pression; (2) le pré-étirement aura un impact sur les propriétés mécaniques du silicone, il devrait donc être le même pour tous les échantillons afin de garantir des conditions d’étirement égales entre les échantillons. - Enlevez les rides dans l’échafaudage électropuné en tirant doucement sur l’échafaudage électropuné. Encore une fois, faites deux nœuds des deux côtés avec un fil de suture à l’extrémité supérieure de l’échafaudage à l’emplacement de la rainure supérieure gravée sur le conduit de pression.
- Relâchez la pince à ciseaux et coupez l’excès de tube en silicone avec un couteau, en laissant 20 à 30% du filetage de vis recouvert de tube en silicone, pour éviter les fuites lorsque le cône de nez est monté sur le filetage de la vis.
REMARQUE : Répétez les étapes 2.4 et 2.5 pour tous les échantillons dynamiques. - Pour les échantillons de contrôle statique, fixez l’échafaudage électropun monté sur le tube en silicone sur des conduits de pression sans trous. Ces conduits peuvent être conservés séparément dans un tube de 15 mL jusqu’à l’ensemencement (étape 4) et n’ont pas besoin d’être montés dans les compartiments de la chambre de culture en flux.
- Décontaminer les chambres de culture d’écoulement partiellement construites avec un échafaudage électropuné en l’exposant à la lumière UV pendant 10 minutes. Tournez les chambres de culture d’écoulement avec des échafaudages électro filés de l’autre côté et répétez l’exposition à la lumière UV pendant 10 minutes.
- Vissez les cônes de nez sur le filetage des conduits de pression avec des trous pour les échantillons dynamiques.
- Assurez-vous que l’extrémité supérieure du tube en silicone s’insère dans le cône de nez pour éviter les fuites dans les étapes ultérieures. S’il y a trop de tubes en silicone, coupez l’excès de tubes avec un couteau.
- Placez les chambres de culture d’écoulement partiellement construites dans une grande boîte de Pétri et pointez le cône de nez vers la source de lumière UV. Appliquez l’éclairage UV pendant 5 min.
- Construction complète de la chambre de culture d’écoulement avec le tube de verre et le compartiment supérieur de la chambre de culture d’écoulement (Figure 1A–B).
- Pré-mouillez les échafaudages électropunés en trempant le conduit de pression avec le tube en silicone et l’échafaudage électropuné dans de l’éthanol à 30%, suivi d’un plongeon dans de l’eau ultrapure deux fois.
- Placez le tube de verre sur le conduit de pression, poussez doucement dans le compartiment inférieur et fixez-le doucement.
- Prenez le compartiment supérieur contenant l’entrée d’écoulement, placez un joint torique en silicone, le redresseur d’écoulement et la bague de l’adaptateur dans le bon ordre(Figure 1A à B), placez-lesur l’extrémité ouverte du tube en verre et fixez-le doucement.
- Vissez un bouchon Luer blanc sur l’entrée d’écoulement du compartiment supérieur.
- Retirez le bouchon Luer mâle de la sortie d’écoulement du compartiment inférieur et nettoyez la surface qui l’entoure avec un mouchoir en papier imbibé d’éthanol.
- Placez une seringue contenant 10 mL d’eau ultrapure dans la sortie d’écoulement, ouvrez le capuchon Luer blanc sur le compartiment supérieur et remplissez la chambre d’eau ultrapure. Refermissez le capuchon Luer blanc, retirez la seringue, nettoyez à nouveau avec de l’éthanol et fermez la sortie de débit avec un bouchon Luer mâle.
REMARQUE : Répétez les étapes 2.6 à 2.8 pour toutes les chambres de culture d’écoulement. - Pour les commandes statiques, ajouter 10 mL d’eau ultrapure aux tubes de 15 mL contenant les échantillons montés sur les conduits de pression sans trous.
- Placez toutes les chambres de culture d’écoulement dans l’incubateur. Remplacer l’eau ultrapure par un milieu de culture un jour avant l’ensemencement cellulaire de la même manière que celle décrite aux étapes 2.8.5 et 2.8.6 (assurez-vous de recueillir l'« ancienne » eau ultrapure avec un mouchoir en papier imbibé d’éthanol placé directement sur la sortie du flux).
[Le protocole peut être mis en pause ici]
3. Préparatifs pour la configuration de la pompe de débit
REMARQUE: Effectuez l’étape 3 dans une armoire à flux laminaire.
- Collectez tous les matériaux de configuration de la pompe et préparez-vous à l’utilisation.
REMARQUE: Les expérimentateurs sont renvoyés au protocole du fabricant pour une description détaillée de la mise en place de la pompe, des unités fluidiques et du tube moyen à travers les vannes de l’unité fluidique.- Réglez la pompe sur une capacité de 200 mbar.
- Vissez les porte-réservoirs de 60 mL aux unités fluidiques.
- Nettoyez les filtres à air en caoutchouc réutilisables avec un mouchoir en papier imbibé d’éthanol, assurez-vous que le filtre à air reste sec.
- Placez les réservoirs de 60 mL dans les réservoirs et placez le tuyau de milieu standard à travers les vannes de l’unité fluidique. Connectez le tube moyen avec un diamètre intérieur plus grand avec des coupleurs de verrouillage Luer femelles dans une boucle fermée.
- Serrez le tube moyen avec un clip de tuyau, directement sous les réservoirs.
- Remplissez les réservoirs avec 25 mL de milieu de culture par réservoir de 60 mL. Relâchez le clip du tuyau et laissez le fluide pénétrer dans le tube.
- Fermez les réservoirs de fluide avec les filtres à air en caoutchouc et placez la configuration de la pompe de débit dans l’incubateur jusqu’à l’étape 4.
4. Ensemencement cellulaire utilisant la fibrine comme transporteur cellulaire
REMARQUE: Effectuez l’étape 4 dans une armoire à flux laminaire.
- Préparez le gel de fibrine pour l’étape d’ensemencement cellulaire. Pour plus de détails, voir Mol et al.67 Pour le gel de fibrine, la solution de fibrinogène doit avoir une concentration finale de 10 mg/mL (ce qui est correct pour la pureté du stock protéique), et la solution de thrombine doit avoir une concentration finale de 10 U/mL.
- Décongeler le fibrinogène en RT, avant de peser ~50 mg (assez pour 10 échantillons) dans un récipient en plastique avec un couvercle rouge.
- Ajouter le milieu de culture cellulaire pour préparer la solution de fibrinogène (à une concentration de 10 mg/mL, correcte pour la pureté du stock de protéines). Bien mélanger et filtrer pour stériliser la solution de fibrinogène avec un filtre à seringue de 0,2 μm dans un tube stérile de 15 mL. Conservez la solution de fibrinogène filtrée sur de la glace.
REMARQUE: Évitez de préparer la solution de fibrinogène trop longtemps à l’avance, sinon le fibrinogène peut coaguler spontanément. - Décongeler la thrombine et fabriquer une solution de thrombine (à une concentration de 10 U/mL) dans un milieu de culture cellulaire et la placer sur de la glace. Préparer une solution de thrombine + cellules de 20 μL par échantillon. Pour n = 10 échantillons, 200 μL sont nécessaires; par conséquent, préparez une solution de thrombine de 250 μL pour tenir compte des erreurs de pipetage possibles.
- Recueillir et compter les cellules des flacons de culture. Mélanger les cellules dans le rapport et la quantité désirés (1,2 × 106 monocytes et 0,6 × 106 myofibroblastes par échafaudage). Assurez-vous qu’il y a suffisamment de cellules pour que les échantillons n+1 corrigent les erreurs de pipetage. Centrifuger à 350 × g pendant 10 min à RT. Retirer le surnageant.
- Faites un mélange des cellules en suspension et de la thrombine.
- Pour chaque échantillon, utiliser 20 μL de la solution de thrombine. Pour n = 10 échantillons, ajouter 200 μL de thrombine à la pastille cellulaire et mélanger. Mesurez le volume de la suspension cellulaire (cellules + thrombine) et calculez comment diviser uniformément sur les 10 échafaudages (par exemple, si la suspension de thrombine + cellules a un volume de 260 μL, chaque échantillon électro filé recevra 260 μL / 10 échantillons = 26 μL de thrombine + suspension cellulaire).
- Comme l’ensemencement des échafaudages s’effectue en deux étapes, préparez deux tubes de microfuge de 1,5 mL qui contiendront la moitié de la suspension cellulaire pour chaque échafaudage (dans l’exemple de calcul de l’étape précédente: préparez deux tubes avec 13 μL de thrombine + suspension cellulaire). Placer sur la glace.
REMARQUE: Les étapes suivantes, en particulier l’étape 4.4, sont idéalement effectuées par deux expérimentateurs.
- Séchez les échafaudages électro filés pré-mouillés avec le vide pour préparer l’ensemencement des cellules.
- Connectez une pipette Pasteur en verre au système de vide de l’armoire à flux laminaire et placez-la dans un tube vide de 50 mL pour un stockage temporaire stérile.
- Prenez les chambres de culture d’écoulement de l’incubateur, retirez le bouchon Luer mâle de la sortie d’écoulement et retirez le milieu après avoir ouvert le bouchon Luer blanc et placé un mouchoir en papier imbibé d’éthanol devant la sortie d’écoulement.
- Retirez le compartiment supérieur et le tube de verre, et placez-les dans une boîte de Petri stérile pour un stockage temporaire.
- Placez la pipette Pasteur sous vide sur l’échafaudage électrospuné et retirez autant de fluide que possible.
ATTENTION : Séchez l’échafaudage électro filé sous vide très doucement. Au lieu d’un mouvement linéaire de va-et-vient sur l’échafaudage, placez la pipette à vide à plusieurs endroits. Serrez le tube à vide sur le dessus de la pipette du Pasteur entre les doigts pour un meilleur contrôle. - Mélanger la solution de fibrinogène dans un rapport de 1:1 avec la suspension de thrombine + cellules (par exemple, mélanger 13 μL de fibrinogène avec 13 μL de thrombine + suspension cellulaire). Pour vous assurer que la fibrine polymérise dans l’échafaudage et non dans le tube de microfuge, pipet le fibrinogène, tournez la roue de pipet pour le « volume supplémentaire » de la suspension de thrombine + cellule, et pipetez de haut en bas une fois dans le tube de microfuge avec suspension cellulaire pour mélanger.
- Égoutter directement de manière homogène la solution sur toute la longueur de l’échafaudage électropuné. Il est conseillé que l’expérimentateur A goutte à goutte le mélange de fibrine, tandis que l’expérimentateur B maintient le compartiment inférieur avec l’échafaudage électro filé monté sur le conduit de pression.
- Une fois que la fibrine avec les cellules est égouttée sur l’échafaudage électrospuné, l’expérimentateur B déplace lentement l’échafaudage, de gauche à droite et de haut en bas, pour diviser les cellules uniformément sur l’échafaudage.
- Répétez les étapes 4.4.5 - 4.4.7 de l’autre côté de l’échafaudage électropuné.
- Remontez la chambre de culture d’écoulement en plaçant soigneusement le tube de verre (empêchez le collage et la coagulation de la fibrine sur le côté interne du tube de verre) et repoussez le compartiment supérieur de la chambre de culture d’écoulement. Placez directement la construction ensemencée sans milieu ni solution saline tamponnée au phosphate (PBS) dans la chambre de culture en flux de l’incubateur.
- Répétez les étapes 4.4.1 à 4.4.9 pour tous les échantillons dynamiques. Pour les échantillons statiques montés sur des conduits de pression sans trous, ensemencer selon les étapes 4.4.1 à 4.4.8 et placer dans un tube de 15 mL par la suite.
- Laisser la fibrine polymériser pendant 60 min dans l’incubateur.
[Le protocole peut être mis en pause ici pendant 30 à 60 minutes.]
- Après polymérisation, remplir les chambres de culture en flux (échantillons dynamiques) ou les tubes de 15 mL (échantillons statiques) avec un milieu.
5. Couplage des systèmes de bioréacteur et de pompe à débit avant le début de l’expérience
REMARQUE : Effectuez les étapes 5.1 à 5.3 dans une armoire à flux laminaire.
- Prenez le plateau transportant les chambres de culture d’écoulement et les unités fluidiques avec des réservoirs de milieu remplis et des tubes de milieu connectés à l’intérieur des armoires d’écoulement laminaire.
- Positionner les chambres de culture en flux sur la base du bioréacteur pour les groupes expérimentaux chargés d’étirement cyclique et de charges hémodynamiques combinées (Figure 1E).
- Inclinez la chambre de culture d’écoulement à l’envers et remplissez le conduit de pression par le bas avec de l’eau ultrapure à l’aide d’une seringue avec des tubes minces (cela peut être de tout type, tant qu’il est flexible et mince, dans cette expérience, un fil de 10 cm de long et de 0,15 mm de diamètre intérieur a été attaché à l’aiguille).
- Placez le tube mince à l’intérieur du conduit de pression et, pendant que le conduit de pression est rempli d’eau ultrapure en poussant progressivement l’eau hors de la seringue, retirez le fil du conduit de pression simultanément, pour vous assurer qu’il n’y a pas de bulles d’air à l’intérieur du conduit de pression.
- Placez la chambre de culture d’écoulement sur l’un des huit filetages de vis sur la base du bioréacteur. Placez un joint torique en silicone entre la base du bioréacteur et le connecteur Luer blanc pour éviter d’éventuelles fuites, et serrez le connecteur Luer blanc du compartiment inférieur.
- Répétez les étapes 5.2.2 et 5.2.3 pour tous les échantillons étirés cycliquement.
- Connectez les chambres de culture d’écoulement pour tous les groupes expérimentaux, à l’exception de la commande statique, au système de pompe de débit.
- Placez un clip de tuyau sur le tube moyen. Retirez le capuchon Luer blanc qui recouvre l’entrée d’écoulement du compartiment supérieur de la chambre de culture d’écoulement. Retirez l’attelage Luer femelle du tube moyen et connectez le tube moyen d’un côté avec l’entrée d’écoulement sur le compartiment supérieur et de l’autre côté du tube moyen avec sortie d’écoulement dans le compartiment inférieur.
- Répétez l’étape 5.3.1 pour toutes les chambres de culture d’écoulement. À ce stade, le bioréacteur et les chambres de culture d’écoulement sont remplis de milieu et connectés aux systèmes d’écoulement.
- Pour les échantillons de contrôle statique, placez les échantillons verticalement dans une fiole de culture cellulaire avec capuchon filtrant à l’aide de la pince à ciseaux. Remplissez la fiole de culture cellulaire avec un milieu et placez-la dans l’incubateur.
- Transférez la configuration complète de l’armoire à flux laminaire à l’incubateur et connectez les unités fluidiques au tube de pression d’air et au câble électrique.
- Démarrez le logiciel et initialisez les pompes de débit. Démarrez le débit moyen pour les échantillons un par un.
- Vérifiez si les vannes de l’unité fluidique cliquent.
- Retirez la pince du tuyau du tuyau moyen.
- Démarrez la pompe à débit avec 100 mbar et un temps de commutation de 10 s.
- Vérifiez soigneusement le sens de l’écoulement pour détecter d’éventuelles fuites ou bulles d’air. Toutes les bulles d’air piégées peuvent être éliminées en retournant la chambre de culture d’écoulement à l’envers.
REMARQUE: Assurez-vous que les niveaux moyens dans les réservoirs moyens sont équilibrés, afin d’éviter l’aspiration de l’air dans le système et les bulles d’air dans les chambres de culture d’écoulement, et de ne pas laisser les réservoirs s’assécher (Figure 2C). - Répétez l’étape 5.5 pour toutes les unités fluidiques une par une.
- Initialisez la pompe de déformation.
- Connectez la pompe actionnée pneumatiquement via l’entrée d’air du cylindre pneumatique à l’air comprimé. Connectez la sortie d’air inférieure avec le tube bleu pour l’air sortant (Figure 1F).
- Ouvrez le logiciel LabVIEW, exécutez le script LabVIEW et le système d’application de pression d’air comprimé, comme décrit par Van Kelle et al.68,entrez le déplacement et la fréquence (commencez par une basse fréquence de 0,2 Hz). Mettez la pompe en pause lorsque le soufflet en téflon est à son niveau le plus bas.
- Placez le capteur de pression dans l’entrée du capteur de pression sur le réservoir hydraulique.
- Modifiez les paramètres de la pompe aux réglages souhaités (pour 1,5 Pa, utilisez 150 mbar, temps de commutation de 10 s).
- Démarrez la pompe de déformation et appliquez le réglage préféré (par exemple, 0,5 Hz, 1,05 étirement).
6. Exécution de l’expérience pendant plusieurs jours; Surveillance du cisaillement et de l’étirement pendant la culture et le remplacement du milieu
- Calculez le WSS au niveau du mur de l’échafaudage.
- Enregistrez l’amplitude du débit tous les deux jours (voir le manuel du fabricant de la pompe de débit pour plus de détails). En bref, observez le changement des niveaux de liquide (en mL) dans les réservoirs moyens entre la commutation du réservoir de l’unité fluidique pendant 10 s. Effectuez au moins cinq mesures, calculez la valeur moyenne et multipliez par 6 pour obtenir le débit Q en mL/min.
- L’écoulement est décrit par un écoulement de Poiseuille à travers un canal annulaire. En supposant que le milieu de culture soit un fluide newtonien, calculer le WSS à la paroi de l’échafaudage, r1, par l’équation 1.
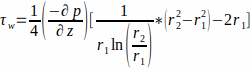 (1)
(1)
où le WSS τw au niveau de la paroi de l’échafaudage (r1 ; ici r1 = 1,7 mm), résultant d’un écoulement à l’état d’équilibre, est déterminé par la pression appliquée p et le rayon intérieur du tube de verre r2 (ici r2 = 2,3 mm). Le gradient de pression dans la direction axiale est supposé être uniforme entre l’entrée et la sortie de l’écoulement et est donné par l’équation 2(figure 1J).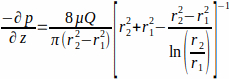 (2)
(2)
avec μ la viscosité dynamique (ici la viscosité moyenne a été supposée constante, μ = 0,7 × 10-3 Pa∙s à 37 °C) et Q le débit appliqué.
- Surveillez l’étirement appliqué aux échafaudages tous les deux jours.
- Placez un fond sombre derrière la chambre de culture d’écoulement pour augmenter le contraste entre l’échafaudage et l’arrière-plan. Positionnez les lampes lumineuses LED, pointant vers l’échafaudage, pour aider à la visualisation de l’échafaudage.
- Prenez des photos en accéléré de l’échafaudage à une fréquence de 30 Hz pendant 6 s (c.-à-d. 3 cycles d’étirement) avec une caméra haute vitesse.
REMARQUE: Une fréquence d’enregistrement plus basse peut suffire si la caméra le permet. Cependant, la fréquence minimale requise n’a pas été déterminée. - Déterminez manuellement le diamètre minimum et maximum de l’échafaudage à partir des images.
- Calculez le diamètre extérieur minimum et maximal de l’échafaudage électropuné pour calculer les étirements maximaux selon l’équation 3.
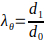 (3)
(3)
où l’étirement circonférentiel (λθ) est donné par le rapport entre le diamètre extérieur de l’échafaudage, d1, et son diamètre initial, d0.
- Corriger l’évaporation moyenne et rafraîchir le milieu trois fois par semaine.
- Arrêtez et découplez les câbles des systèmes d’écoulement et de la pompe de contrainte.
- Placez des clips de tuyau sur le tube moyen.
- Déterminer la quantité de milieu évaporée en fonction des marques de l’indicateur de volume sur les réservoirs moyens.
- Transférer le plateau avec le bioréacteur et les unités fluidiques dans l’armoire à flux laminaire.
- Retirez les filtres à air en caoutchouc des réservoirs moyens; ajouter de l’eau ultrapure autoclavée pour compenser le volume évaporé du milieu. Refermer les réservoirs de milieu et se connecter à nouveau à la pompe pour mélanger le milieu avec l’eau ultrapure.
- Répétez les étapes 6.3.1 à 6.3.5. Retirez à nouveau les filtres à air en caoutchouc, retirez 25 mL de milieu de culture et faites tourner à 300 × g pendant 5 min à TA.
- Prélever 1,5 mL de surnageant et conserver à -30 °C pour l’analyse des profils sécrétoires (pour analyse avec dosage immuno-enzymatique (ELISA)).
- Recueillir le volume souhaité de surnageant pour les études de signalisation paracrine, en utilisant le surnageant comme milieu conditionné43.
- Ajouter 25 mL de milieu frais aux réservoirs moyens.
- Replacez les filtres à air en caoutchouc sur les réservoirs moyens.
- Replacez l’installation complète dans l’incubateur; connectez tous les câbles et les tubes d’air à la pompe et à la pompe de contrainte. Relâchez les clips du tuyau et répétez les étapes 5.4 à 5.8.
- Vérifiez si les billes de séchage de silice dans les bouteilles de séchage reliées à la pompe sont humides (aspect blanc) et remplacez-les par des billes de silice sèches si nécessaire (aspect orange).
7. Fin de l’expérience, collecte d’échantillons et nettoyage et stockage de l’équipement
- Le dernier jour de l’expérience, corrigez l’évaporation du milieu comme décrit aux étapes 6.3.1 à 6.3.5 et récoltez les échantillons un par un.
- Pour récolter les échantillons un par un, la pompe de débit et la pompe de contrainte doivent être mises en pause plusieurs fois. Placez un clip de tuyau sur un tube moyen. Arrêtez temporairement la pompe de débit et la pompe de déformation. Déconnecter une chambre de culture à écoulement de la base du bioréacteur; remplacer par un capuchon Luer blanc sur la base du bioréacteur. Prenez la chambre de culture d’écoulement et l’unité fluidique dans l’armoire d’écoulement laminaire. Redémarrez la pompe de débit et la pompe de contrainte pour appliquer la charge hémodynamique aux autres échantillons jusqu’à la récolte.
- Collecter le milieu des réservoirs du milieu pour l’analyse de la production de cytokines paracrines via ELISA.
- Découpler les unités d’écoulement et la construction tubulaire de récolte. Section selon le schéma de coupe souhaité. Certaines parties de la construction peuvent être stockées à 4 °C (après 15 min de fixation dans 3,7 % de formaldéhyde et 3 x 5 min de lavage dans du PBS) ou à -30 °C (après congélation instantanée dans de l’azote liquide) jusqu’à une analyse plus approfondie.
- Nettoyez les composants du bioréacteur et de la pompe. De plus, la méthode de nettoyage conseillée par article est mentionnée dans le tableau des matériaux.
- Nettoyez les filtres à air en caoutchouc avec 70% d’éthanol. Faites très attention à ne pas humidifier le filtre intérieur !
- Recueillir tous les composants séparés : tubes moyens, réservoirs moyens, tubes en verre, bouchons Luer mâles et serrures Luer femelles, bouchons Luer blancs, conduits de pression, cônes de nez, joints toriques en silicone, bagues d’adaptateur, redresseurs d’écoulement (à l’exclusion des pompes, des unités fluidiques, des filtres à air en caoutchouc, de la base du bioréacteur) et rincer à l’eau courante du robinet.
- Placer O/N dans du dodécylsulfate de sodium à 0,1 % dans de l’eau désionisée.
REMARQUE: N’utilisez pas d’eau ultrapure car les pièces pourraient rouiller. - Rincer à l’eau du robinet et au savon à vaisselle.
- Immerger dans de l’eau désionisée, suivie de 70% d’éthanol deux fois, suivie d’eau désionisée.
- Placez tous les matériaux séparément sur les mouchoirs en papier et laissez-les sécher. Utilisez de l’air sous pression pour sécher les tubes.
- Nettoyez tous les matériaux non autoclavables avec un mouchoir en papier imbibé d’éthanol à 70%. Cela inclut le filtre à air en caoutchouc (gardez à l’esprit que le filtre à air doit rester sec) et la base du bioréacteur (soufflet en téflon et cylindre pneumatique).
- Autoclavez les composants de la chambre fluidique (y compris le joint torique en silicone), le tube moyen, les réservoirs moyens (sans le filtre à air en caoutchouc), les bouchons Luer mâles et les coupleurs Luer femelles, les bouchons Luer blancs, les clips de tuyau et l’équipement standard (par exemple, pinces à épiler, ciseaux de serrage)
- Pour une utilisation pratique lors des prochaines expériences, combinez les composants séparés pour une chambre fluidique complète dans une boîte autoclavable.
- Retirez l’eau du réservoir hydraulique. Nettoyer avec 70% d’éthanol, suivi d’eau désionisée. Laissez sécher. Remplissez avec de l’eau désionisée et quelques gouttes de désinfectant préservant le bain-marie.
- Stockez les tubes de verre pour la chambre de culture en flux dans de l’éthanol à 70%.
- Placer les billes de séchage de silice humide (aspect blanc) dans le four O/N à 120 °C pour les laisser sécher (aspect orange), et conserver dans une fiole hermétique.
Access restricted. Please log in or start a trial to view this content.
Résultats
Ce bioréacteur a été développé pour étudier les effets individuels et combinés du stress de cisaillement et de l’étirement cyclique sur la croissance et le remodelage des tissus vasculaires dans les échafaudages de biomatériaux 3D. La conception du bioréacteur permet de cultiver jusqu’à huit constructions vasculaires dans diverses conditions de charge(Figure 1A). Les constructions vasculaires sont positionnées dans une chambre de culture en flux(Figure 1...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le bioréacteur décrit ici permet l’évaluation systématique des contributions de l’individu et des effets combinés de la contrainte de cisaillement et de l’étirement cyclique sur l’inflammation et la régénération tissulaire dans les échafaudages tubulaires résorbables. Cette approche permet également d’effectuer une grande variété d’analyses sur des constructions vasculaires, comme l’illustre la section des résultats représentatifs. Ces résultats montrent l’impact distinctif des différent...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude est soutenue financièrement par ZonMw dans le cadre du programme LSH 2Treat (436001003) et de la Dutch Kidney Foundation (14a2d507). N.A.K. reconnaît le soutien du Conseil européen de la recherche (851960). Nous remercions le programme gravitation « Materials Driven Regeneration », financé par l’Organisation néerlandaise pour la recherche scientifique (024.003.013).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| advanced Dulbecco’s modified EagleMedium (aDMEM) | Gibco | 12491-015 | cell culture medium for fibroblasts |
| Aqua Stabil | Julabo | 8940012 | prevent microorganism growth in bioreactor-hydraulic reservoir |
| Bovine fibrinogen | Sigma | F8630 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Bovine thrombin | Sigma | T4648 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Centrifuge | Eppendorf | 5804 | to spin down cells and conditioned medium |
| Clamp scissor - "kelly forceps" | Almedic | P-422 | clamp the silicone tubing and apply pre-stretch to the scaffold so the scaffold can be sutured into the engraved groove (autoclave at step 1, step 7) |
| CO2 cell culture incubators | Sanyo | MCO-170AIC-PE | for cell culturing |
| Compressed air reservoir | Festo | CRVZS-5 | smoothing air pressure fluctuations and create time delays for pressure build-up |
| Custom Matlab script to calculate the maximum stretches | Matlab | R2017. The Mathworks, Natick, MA | calculate the minimum and maximum outer diameter of the electrospun scaffold |
| Data acquisition board | National Instruments | BNC-2090 | data processing in between amplifier system and computer |
| Ethanol | VWR | VWRK4096-9005 | to keep sterile working conditions |
| Fetal bovine calf serum (FBS) | Greiner | 758087 | cell culture medium supplement; serum-supplement |
| Flow culture chamber compartments, consisting of a pressure conduit with engraved grooves and small holes to apply pressure on silicone tubing, a screw thread, nose cone, top compartment with flow inlet and bottom compartment flow outlet, adapter bushing | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | flow culture chamber compartments (autoclave at step 1, step 7) |
| Glass Pasteur pipet | Assistant | HE40567002 | apply vacuum on electrospun scaffold (autoclave at step 1) |
| Glass tubes of the flow culture chamber | Custon made, Equipment & Prototype Center, Eindhoven University of Technology | n.a. | part of the flow culture chamber (clean and store in 70% ethanol, at step 1 and 7) |
| GlutaMax | Gibco | 35050061 | cell culture medium amino acid supplement, minimizes ammonia build-up |
| High speed camera | MotionScope | M-5 | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| High speed camera lens - Micro-NIKKOR 55mm f/2.8 - lens | Nikon | JAA616AB | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| Hose clip | ibidi GmbH | 10821 | block medium flow (autoclave at step 1, step 7) |
| Hydraulic reservoir with 8 screw threads for 8 flow culture chambers | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to apply pressure to the silicone mounted constructs (clean outside with a paper tissue with 70% ethanol, rinse reservoir with 70% ethanol followed by demi water, at step 1 and 7) |
| Ibidi pump system (8x) including ibidi pump, PumpControl software, fluidic unit, perfusion set (medium tubing), air pressure tubing, drying bottles with orange silica beads | ibidi GmbH | 10902 | set up used to control the flow in the flow culture chambers. Note 1: the ibidi pumps were modified by the manufacturer to enable 200 mbar capacity. Note 2: can be replaced by pump system of other manufacturer, as long as same flow regimes can be applied. |
| Knives (no.10 sterile blades, individual foil pack) and scalpel handle (stainless steel, individually wrapped) | Swann Morton | 0301; 0933 | to cut the silicone tubing in the correct size for the scaffold and to cut the suture material |
| LabVIEW Software | National Instruments | version 2018 | to control the stretch applied to the scaffolds |
| Laminar flow biosafety cabinet with UV light | Labconco | 302310001 | to ensure sterile working conditions. The UV is used to decontaminate everything that cannot be autoclaved, or touched after autoclaving |
| Large and small petri dishes | Greiner | 664-160 | for sterile working conditions |
| L-ascorbic acid 2-phosphate (vitamin C) | Sigma | A8960 | cell culture medium supplement, important for collagen production |
| LED light cold source KL2500 | Zeiss | Schott AG | to aid in visualization for the time lapse of the scaffolds during monitoring of the stretch |
| Luer (female and male) locks and connectors, white luer caps | ibidi GmbH | various, see (https://ibidi.com/26-flow-accessories) | to close or connect parts of the bioreactor and the ibidi pump (autoclave at step 1, step 7) |
| Measuring amplifier (PICAS) | PEEKEL instruments B.V. | n.a. | to amplify the signal from the pressure sensor and feedback to LabView |
| Medium reservoir (large syringes 60 mL) and reservoir holders | ibidi GmbH | 10974 | medium reservoir (autoclave at step 1, step 7) |
| Medium tubing with 4.25 mm outer diameter and 1 mm inner diameter | Rubber BV | 1805 | to allow for a larger flow rate, the ibidi medium tubing with larger diameter is used. Note: the part of medium tubing guided through the fluidic unit valves are the same as the default ibidi medium tubing |
| Motion Studio Software | Idtvision | 2.15.00 | to make the high speed time lapse images for stretch monitoring |
| Needle (19G) | BD Microlance | 301700 | together with thin flexible tubing used to fill the hydraulic reservoir with ultrapure water without adding air bubbles |
| Needle driver | Adson | 2429218 | to handle the needle of the nylon suture through the silicone tube (autoclave at step 1, step 7) |
| Paper tissues | Kleenex | 38044001 | for cleaning of the equipment with 70% ethanol |
| Parafilm | Sigma | P7793-1EA | quick fix if leakage occurs |
| Penicillin/streptomycin (P/S) | Lonza | DE17-602E | cell culture medium supplement; prevent bacterial contamination |
| Phosphate Buffered Saline (PBS) | Sigma | P4417-100TAB | for storage and washing steps (autoclave at step 1) |
| Plastic containers (60 mL) with red screw caps | Greiner | 206202 | to prepare the fibrinogen solution |
| Pneumatic cylinder | Festo | AEVC-20-10-I-P | to actuate the Teflon bellow (clean with a paper tissue with 70% ethanol at step 1 and 7) |
| Polycaprolactone bisurea (PCL-BU) tubular scaffolds (3 mm inner diameter, 200 µm wall thickness, 20 mm length) | SyMO-Chem, Eindhoven, The Netherlands | n.a. | produced using electrospinning from 15% (w/w) chloroform (Sigma; 372978) polymer solutions. See Van Haaften et al Tissue Engineering Part C (2018) for more details |
| Pressure conduit without holes (for static control) | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to mount electrospun tubes on silicon tubing (autoclave at step 1, step 7) |
| Pressure sensor and transducer | BD | TC-XX and P 10 EZ | the air pressure going to the pneumatic actuated pump is raised until it reaches the set pressure |
| Proportional air pressure control valve and pressure sensor | Festo | MPPES-3-1/8-2-010, 159596 | provides compressed air to the pneumatic actuated pump |
| Roswell Park Memorial Institute 1640 (RPMI-1640) | Gibco | A1049101 | cell culture medium for monocyte/macrophage |
| Safe lock Eppendorf tubes (1.5 mL) | Eppendorf | 30120086 | multiple applications (autoclave at step 1) |
| Sodium dodecyl sulfate solution 20% | Sigma | 5030 | Used to clean materials, at a concentration of 0.1%. |
| Silicone O-rings | Technirub | 1250S | to prevent leakage (autoclave at step 1, step 7) |
| Silicone tubing (2.8 mm outer diameter, 400 um wall thickness) | Rubber BV | 1805 | to mount the electrospun tubes on the pressure conduits (autoclave at step 1) |
| Sterile tube (15 mL) | Falcon | 352095 | multiple applications |
| Suture, 5-0 prolene with pre-attached taper point needle | Ethicon, Johnson&Johnson | EH7404H | Prolene suture wire 5-0 (75cm length, TF taper point needle, 1/2 circle, 13 mm needle length) |
| Syringe (24 mL) | B. Braun Melsungen AG | 2057932 | to add the ultrapure water or medium to the hydraulic reservoir or flow culture chamber |
| Syringe filter (0.2 µm) | Satorius | 17597-K | to filter the fibrinogen solution |
| T150 cell culture flask with filter cap | Nunc | 178983 | to degas culture medium |
| T75 Cell culture flask with filter cap | Nunc | 156499 | to culture static control samples |
| Teflon bellow | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to load the hydraulic reservoir (clean outside with a paper tissue with 70% ethanol at step 1 and 7) |
| Tray (stainless steel) | PolarWare | 15-248 | for easy transport of the fluidic culture chambers and the bioreactor from incubator to laminar flow cabinet and back (clean with a paper tissue with 70% ethanol before and after use) |
| Tweezers | Wironit | 4910 | sterile handling of individual parts (autoclave at step 1 and 7) |
| Ultrapure water | Stakpure | Omniapure UV 18200002 | to correct for medium evaporation, mixed with aqua stabil mixed and used as hydraulic fluid. (autoclave ultrapure water at step 1) |
| UV light | Philips | TUV 30W/G30 T8 | for decontamination of grafts and bioreactor parts before seeding |
Références
- Chlupác, J., Filová, E., Bacáková, L. Blood vessel replacement: 50 years of development and tissue engineering paradigms in vascular surgery. Physiological Research. 58, Suppl 2 119-139 (2009).
- Huygens, S. A., et al. Bioprosthetic aortic valve replacement in elderly patients: Meta-analysis and microsimulation. The Journal of Thoracic and Cardiovascular Surgery. 157 (6), 2189-2197 (2019).
- Huygens, S. A., et al. Contemporary outcomes after surgical aortic valve replacement with bioprostheses and allografts: a systematic review and meta-analysis. European Journal of Cardio-Thoracic Surgery. 50 (4), 605-616 (2016).
- Loh, S. A., et al. Mid- and long-term results of the treatment of infrainguinal arterial occlusive disease with precuffed expanded polytetrafluoroethylene grafts compared with vein grafts. Annals of Vascular Surgery. 27 (2), 208-217 (2013).
- Tara, S., et al. Vessel bioengineering. Circulation Journal. 78 (1), 12-19 (2014).
- Huang, A. H., Niklason, L. E. Engineering of arteries in vitro. Cellular and Molecular Life Sciences. 71 (11), 2103-2118 (2014).
- Bouten, C. V. C., Smits, A. I. P. M., Baaijens, F. P. T. Can we grow valves inside the heart? Perspective on material-based in situ heart valve tissue engineering. Frontiers in Cardiovascular Medicine. 5, 54(2018).
- Fioretta, E. S., et al. Next-generation tissue-engineered heart valves with repair, remodelling and regeneration capacity. Nature Reviews Cardiology. , (2020).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Science Translational Medicine. 11 (485), (2019).
- Gutowski, P., et al. Arterial reconstruction with human bioengineered acellular blood vessels in patients with peripheral arterial disease. Journal of Vascular Surgery. , (2020).
- Syedain, Z., et al. Tissue engineering of acellular vascular grafts capable of somatic growth in young lambs. Nature Communications. 7 (12951), 12951(2016).
- Sugiura, T., et al. Tissue-engineered vascular grafts in children with congenital heart disease: intermediate term follow-up. Seminars in Thoracic and Cardiovascular Surgery. 30 (2), 175-179 (2018).
- Kluin, J., et al. In situ heart valve tissue engineering using a bioresorbable elastomeric implant - material design to 12 months follow-up in sheep. Biomaterials. 125, 101-117 (2017).
- Fioretta, E. S., et al. Differential leaflet remodeling of bone marrow cell pre-seeded versus nonseeded bioresorbable transcatheter pulmonary valve replacements. JACC. Basic to Translational Science. 5 (1), 15-31 (2020).
- Van Haaften, E. E., Bouten, C. V. C., Kurniawan, N. A. Vascular mechanobiology: towards control of. Cells. , 1-24 (2017).
- De Jonge, N., et al. Matrix production and organization by endothelial colony forming cells in mechanically strained engineered tissue constructs. PLoS ONE. 8 (9), 73161(2013).
- Schmidt, J. B., Chen, K., Tranquillo, R. T. Effects of intermittent and incremental cyclic stretch on ERK signaling and collagen production in engineered tissue. Cellular and Molecular Bioengineering. 9 (1), 55-64 (2016).
- Luo, J., et al. Tissue-engineered vascular grafts with advanced mechanical strength from human iPSCs. Cell Stem Cell. 26 (2), 251-261 (2020).
- Van Haaften, E. E., et al. Decoupling the effect of shear stress and stretch on tissue growth and remodeling in a vascular graft. Tissue Engineering Part C: Methods. 24 (7), 418-429 (2018).
- Gupta, V., Tseng, H., Lawrence, B. D., Jane Grande-Allen, K. Effect of cyclic mechanical strain on glycosaminoglycan and proteoglycan synthesis by heart valve cells. Acta Biomaterialia. 5 (2), 531-540 (2009).
- Lin, S., Mequanint, K. Bioreactor-induced mesenchymal progenitor cell differentiation and elastic fiber assembly in engineered vascular tissues. Acta Biomaterialia. 59, 200-209 (2017).
- Venkataraman, L., Bashur, C. A., Ramamurthi, A. Impact of cyclic stretch on induced elastogenesis within collagenous conduits. Tissue Engineering. Part A. 20 (9-10), 1403-1415 (2014).
- Huang, A. H., et al. Biaxial stretch improves elastic fiber maturation, collagen arrangement, and mechanical properties in engineered arteries. Tissue Engineering Part C Methods. 22 (6), 524-533 (2016).
- Hinderer, S., et al. In vitro elastogenesis: instructing human vascular smooth muscle cells to generate an elastic fiber-containing extracellular matrix scaffold. Biomedical Materials. 10 (3), 034102(2015).
- Eoh, J. H., et al. Enhanced elastin synthesis and maturation in human vascular smooth muscle tissue derived from induced-pluripotent stem cells. Acta Biomaterialia. 52, 49-59 (2017).
- Smits, A. I. P. M., Bouten, C. V. C. Tissue engineering meets immunoengineering: Prospective on personalized in situ tissue engineering strategies. Current Opinion in Biomedical Engineering. 6, 17-26 (2018).
- Wissing, T. B., Bonito, V., Bouten, C. V. C., Smits, A. I. P. M. Biomaterial-driven in situ cardiovascular tissue engineering-a multi-disciplinary perspective. npj Regenerative Medicine. 2 (1), 18(2017).
- Hibino, N., et al. A critical role for macrophages in neovessel formation and the development of stenosis in tissue-engineered vascular grafts. The FASEB Journal. 25 (12), 4253-4263 (2011).
- Godwin, J. W., Pinto, A. R., Rosenthal, N. A. Macrophages are required for adult salamander limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9415-9420 (2013).
- Godwin, J. W., Debuque, R., Salimova, E., Rosenthal, N. A. Heart regeneration in the salamander relies on macrophage-mediated control of fibroblast activation and the extracellular landscape. npj Regenerative Medicine. 2 (1), 22(2017).
- McBane, J. E., Cai, K., Labow, R. S., Santerre, J. P. Co-culturing monocytes with smooth muscle cells improves cell distribution within a degradable polyurethane scaffold and reduces inflammatory cytokines. Acta Biomaterialia. 8 (2), 488-501 (2012).
- Battiston, K. G., Ouyang, B., Labow, R. S., Simmons, C. A., Santerre, J. P. Monocyte/macrophage cytokine activity regulates vascular smooth muscle cell function within a degradable polyurethane scaffold. Acta Biomaterialia. 10 (3), 1146-1155 (2014).
- Ploeger, D. T., et al. Cell plasticity in wound healing: paracrine factors of M1/ M2 polarized macrophages influence the phenotypical state of dermal fibroblasts. Cell Communication and Signaling. 11 (1), 29(2013).
- McBane, J. E., Santerre, J. P., Labow, R. S. The interaction between hydrolytic and oxidative pathways in macrophage-mediated polyurethane degradation. Journal of Biomedical Materials Research. Part A. 82 (4), 984-994 (2007).
- Wissing, T. B., et al. Macrophage-driven biomaterial degradation depends on scaffold microarchitecture. Frontiers in Bioengineering and Biotechnology. 7, 87(2019).
- Wolf, M. T., Vodovotz, Y., Tottey, S., Brown, B. N., Badylak, S. F. Predicting in vivo responses to biomaterials via combined in vitro and in silico analysis. Tissue Engineering Part C: Methods. 21 (2), 148-159 (2015).
- Grotenhuis, N., Bayon, Y., Lange, J. F., Van Osch, G. J. V. M., Bastiaansen-Jenniskens, Y. M. A culture model to analyze the acute biomaterial-dependent reaction of human primary macrophages. Biochemical and Biophysical Research Communications. 433 (1), 115-120 (2013).
- Jannasch, M., et al. A comparative multi-parametric in vitro model identifies the power of test conditions to predict the fibrotic tendency of a biomaterial. Scientific Reports. 7 (1), 1689(2017).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- McWhorter, F. Y., Davis, C. T., Liu, W. F. Physical and mechanical regulation of macrophage phenotype and function. Cellular and Molecular Life Sciences. 72 (7), 1303-1316 (2014).
- Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Strain-dependent modulation of macrophage polarization within scaffolds. Biomaterials. 35 (18), 4919-4928 (2014).
- Dziki, J. L., et al. The effect of mechanical loading upon extracellular matrix bioscaffold-mediated skeletal muscle remodeling. Tissue Engineering. Part A. 24 (1-2), 34-46 (2018).
- Wissing, T. B., et al. Hemodynamic loads distinctively impact the secretory profile of biomaterial-activated macrophages - implications for in situ vascular tissue engineering. Biomaterials Science. 8 (1), 132-147 (2020).
- Van Haaften, E. E., Wissing, T. B., Kurniawan, N. A., Smits, A. I. P. M., Bouten, C. V. C. Human in vitro model mimicking material-driven vascular regeneration reveals how cyclic stretch and shear stress differentially modulate inflammation and matrix deposition. Advanced Biosystems. 4 (6), 1900249(2020).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Bonito, V., de Kort, B. J., Bouten, C. V. C., Smits, A. I. P. M. Cyclic strain affects macrophage cytokine secretion and extracellular matrix turnover in electrospun scaffolds. Tissue Engineering Part A. 25 (17-18), 1310-1325 (2019).
- Battiston, K. G., Labow, R. S., Simmons, C. A., Santerre, J. P. Immunomodulatory polymeric scaffold enhances extracellular matrix production in cell co-cultures under dynamic mechanical stimulation. Acta Biomaterialia. 24, 74-86 (2015).
- Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. A mesofluidics-based test platform for systematic development of scaffolds for in situ cardiovascular tissue engineering. Tissue Engineering Part C: Methods. 18 (6), 475-485 (2012).
- Smits, A. I. P. M., Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. T. Shear flow affects selective monocyte recruitment into MCP-1-loaded scaffolds. Journal of Cellular and Molecular Medicine. 18 (11), 2176-2188 (2014).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Fahy, N., Menzel, U., Alini, M., Stoddart, M. J. Shear and dynamic compression modulates the inflammatory phenotype of human monocytes in vitro. Frontiers in Immunology. 10, 383(2019).
- Pennings, I., et al. Layer-specific cell differentiation in bi-layered vascular grafts under flow perfusion. Biofabrication. 12 (1), 015009(2019).
- Wang, J., et al. Ex vivo blood vessel bioreactor for analysis of the biodegradation of magnesium stent models with and without vessel wall integration. Acta Biomater. 50, 546-555 (2017).
- Huang, A. H., et al. Design and use of a novel bioreactor for regeneration of biaxially stretched tissue-engineered vessels. Tissue Engineering. Part C, Methods. 21 (8), 841-851 (2015).
- Huang, A. H., Niklason, L. E. Engineering biological-based vascular grafts using a pulsatile bioreactor. Journal of Visualized Experiments. (52), e2646(2011).
- Bono, N., et al. A Dual-mode bioreactor system for tissue engineered vascular models. Annals of Biomedical Engineering. 45 (6), 1496-1510 (2017).
- Wolf, F., et al. VascuTrainer: a mobile and disposable bioreactor system for the conditioning of tissue-engineered vascular grafts. Annals of Biomedical Engineering. 46 (4), 616-626 (2018).
- Ramaswamy, S., et al. A novel bioreactor for mechanobiological studies of engineered heart valve tissue formation under pulmonary arterial physiological flow conditions. Journal of Biomechanical Engineering. 136 (12), 121009(2014).
- Piola, M., et al. A compact and automated ex vivo vessel culture system for the pulsatile pressure conditioning of human saphenous veins. Journal of Tissue Engineering and Regenerative Medicine. 10 (3), 204-215 (2016).
- Vanerio, N., Stijnen, M., de Mol, B. A. J. M., Kock, L. M. An innovative ex vivo vascular bioreactor as comprehensive tool to study the behavior of native blood vessels under physiologically relevant conditions. Journal of Engineering and Science in Medical Diagnostics and Therapy. 2 (4), (2019).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplantation. 27 (9), 1375-1389 (2018).
- Sinha, R., et al. A medium throughput device to study the effects of combinations of surface strains and fluid-flow shear stresses on cells. Lab on a Chip. 15 (2), 429-439 (2015).
- Beca, B. M., Sun, Y., Wong, E., Moraes, C., Simmons, C. A. Dynamic bioreactors with integrated microfabricated devices for mechanobiological screening. Tissue Engineering Part C: Methods. 25 (10), 581-592 (2019).
- Liu, H., Usprech, J., Sun, Y., Simmons, C. A. A microfabricated platform with hydrogel arrays for 3D mechanical stimulation of cells. Acta Biomaterialia. 34, 113-124 (2016).
- Szafron, J. M., Ramachandra, A. B., Breuer, C. K., Marsden, A. L., Humphrey, J. D. Optimization of tissue-engineered vascular graft design using computational modeling. Tissue Engineering Part C: Methods. 25 (10), 561-570 (2019).
- Emmert, M. Y., et al. Computational modeling guides tissue-engineered heart valve design for long-term in vivo performance in a translational sheep model. Science Translational Medicine. 10 (440), (2018).
- Mol, A., et al. Fibrin as a cell carrier in cardiovascular tissue engineering applications. Biomaterials. 26 (16), 3113-3121 (2005).
- van Kelle, M. A. J., et al. A Bioreactor to identify the driving mechanical stimuli of tissue growth and remodeling. Tissue Engineering Part C: Methods. 23 (6), (2017).
- van den Broek, C. N., et al. Medium with blood-analog mechanical properties for cardiovascular tissue culturing. Biorheology. 45 (6), 651-661 (2008).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon