Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un biorreactor multipíca para evaluar la capacidad inflamatoria y regenerativa de los biomateriales bajo flujo y estiramiento
* Estos autores han contribuido por igual
En este artículo
Resumen
El objetivo de este protocolo es ejecutar un cocultivo dinámico de macrófagos humanos y miofibroblastos en andamios electrospun tubulares para investigar la regeneración de tejidos impulsada por materiales, utilizando un biorreactor que permite el desacoplamiento del esfuerzo de cizallamiento y el estiramiento cíclico.
Resumen
El uso de biomateriales reabsorbibles para inducir la regeneración directamente en el cuerpo es una estrategia atractiva desde una perspectiva traslacional. Tales materiales inducen una respuesta inflamatoria tras la implantación, que es el impulsor de la resorción posterior del material y la regeneración de nuevos tejidos. Esta estrategia, también conocida como ingeniería de tejidos in situ, se persigue para obtener reemplazos cardiovasculares como injertos vasculares de ingeniería tisular. Tanto los procesos inflamatorios como los regenerativos están determinados por las señales biomecánicas locales en el andamio (es decir, estiramiento y esfuerzo por cizallamiento). Aquí, describimos en detalle el uso de un biorreactor desarrollado a medida que permite de manera única el desacoplamiento de la tensión de estiramiento y cizallamiento en un andamio tubular. Esto permite la evaluación sistemática y estandarizada de la capacidad inflamatoria y regenerativa de los andamios tubulares bajo la influencia de cargas mecánicas bien controladas, que demostramos sobre la base de un experimento de cocultivo dinámico utilizando macrófagos humanos y miofibroblastos. Los pasos prácticos clave en este enfoque: la construcción y configuración del biorreactor, la preparación de los andamios y la siembra de células, la aplicación y el mantenimiento del flujo de estiramiento y cizallamiento, y la recolección de muestras para el análisis, se discuten en detalle.
Introducción
La ingeniería de tejidos cardiovasculares (TE) se está llevando a cabo como una opción de tratamiento alternativa a las prótesis cardiovasculares permanentes utilizadas actualmente (por ejemplo, injertos vasculares, reemplazos de válvulas cardíacas), que son subóptimas para grandes cohortes de pacientes1,2,3,4. Las aplicaciones muy buscadas incluyen injertos vasculares de ingeniería tisular (TEVG)5,6 y válvulas cardíacas (TEHV)7,8. La mayoría de las veces, las metodologías cardiovasculares de TE hacen uso de biomateriales reabsorbibles (ya sean naturales o sintéticos) que sirven como un andamio instructivo para que se forme el nuevo tejido. La formación de nuevo tejido puede ser diseñada completamente in vitro, sesementando el andamio con células y culturando en un biorreactor antes de la implantación (TE in vitro)9,10,11,o directamente in situ, en el que el andamio sintético se implanta sin precultivo para inducir la formación de nuevo tejido directamente en el cuerpo (TE in situ)12,13,14. Para los enfoques de TE cardiovascular in vitro e in situ, la regeneración funcional exitosa depende predominantemente tanto de la respuesta inmune del huésped a la construcción implantada como de la carga biomecánica adecuada.
La importancia de la carga biomecánica para la TE cardiovascular es bien reconocida15. En el caso de los implantes cardiovasculares, las células que pueblan el andamio están expuestas a estiramientos cíclicos y tensiones de cizallamiento que surgen como resultado del entorno hemodinámico. Numerosos estudios han reportado el efecto estimulante del estiramiento (cíclico) en la formación de componentes de la matriz, como el colágeno16,17,18,19,glicosaminoglicanos (GAG)20y elastina21, 22,por varios tipos de células. Por ejemplo, Huang et al. demostraron que el estiramiento biaxial elevaba la deposición y organización de colágeno y elastina en TEVG in vitro mediante el uso de un biorreactor vascular23. Si bien el énfasis generalmente se encuentra en el estiramiento como la carga dominante, estos estudios a menudo hacen uso de biorreactores impulsados por flujo en los que la muestra también está expuesta al flujo de cizalla. Aunque se sabe relativamente poco sobre la influencia aislada de las tensiones de cizallamiento en la formación de tejidos y la inflamación en 3D, hay algunos datos disponibles. Por ejemplo, Hinderer et al. y Eoh et al. demostraron que el flujo de cizallamiento, además de una microestructura de andamio 3D, era importante para la formación de elastina madura por células del músculo liso vascular humano en un sistema modelo in vitro24,25. En conjunto, estos hallazgos ilustran la relevancia tanto del estiramiento cíclico como del estrés cizallamiento para la TE cardiovascular.
Otro determinante importante para el éxito o fracaso de los implantes TE es la respuesta inmune del huésped al injerto implantado26. Esto es particularmente importante para las estrategias de TE in situ impulsadas por materiales, que en realidad se basan en la respuesta inflamatoria aguda al andamio para iniciar los procesos posteriores de afluencia celular y formación y remodelación endógena de tejidos27. El macrófago es un iniciador crítico de la regeneración funcional del tejido, lo que ha sido demostrado por múltiples estudios28,29,30. Análoga a la cicatrización de heridas, la regeneración del tejido se rige por la señalización paracrina entre los macrófagos y las células productoras de tejido como los fibroblastos y los miofibroblastos31,32,33. Además de coordinar la nueva deposición de tejido, los macrófagos están involucrados en la reabsorción activa de material de andamio extraño34,35. Como tal, la respuesta in vitro de los macrófagos a un biomaterial se ha identificado como un parámetro predictivo para el éxito in vivo de los implantes36,37,38.
La respuesta de los macrófagos a un andamio implantado depende de las características de diseño del andamio, como la composición del material y la microestructura35,39,40. Además de las propiedades del andamio, la respuesta de los macrófagos a un andamio y su diafonía con miofibroblastos también se ve afectada por las cargas hemodinámicas. Por ejemplo, se demostró que el estiramiento cíclico es un importante modulador del fenotipo de macrófagos41,42,43,44 y la secreción de citoquinas43,44,45,46 en andamios electrospun 3D. Utilizando un sistema de coculto de macrófagos y células del músculo liso vascular, Battiston et al. demostraron que la presencia de macrófagos condujo a un aumento de los niveles de elastina y GAG y que los niveles moderados de estiramiento cíclico (1.07-1.10) estimularon la deposición de colágeno I y elastina47. En trabajos anteriores, hemos demostrado que el esfuerzo por cizallamiento es un determinante importante para el reclutamiento de monocitos en andamios electrospun 3D48,49,y que tanto el esfuerzo por cizallamiento como el estiramiento cíclico afectan la señalización paracrina entre los monocitos humanos y las células del estroma mesenquimal50. Fahy et al. demostraron que el flujo de cizallado aumentaba la secreción de citoquinas proinflamatorias por los monocitos humanos51.
En conjunto, la evidencia anterior muestra que una comprensión adecuada y el control sobre las cargas hemodinámicas es crucial para la TE cardiovascular, y que es importante considerar la respuesta inflamatoria para lograrlo. Se han descrito previamente numerosos biorreactores para el cultivo in vitro52,53,54,55,56,57,58 o ex vivo59,60,61 de tejidos cardiovasculares. Sin embargo, todos estos sistemas están diseñados para imitar las condiciones fisiológicas de carga hemodinámica tanto como sea posible. Si bien esto es muy valioso para el propósito de crear tejidos cardiovasculares in vitro o mantener cultivos ex vivo, tales sistemas no permiten estudios sistemáticos sobre los efectos individuales de las señales individuales. Esto se debe a que la aplicación tanto del estiramiento cíclico como del esfuerzo de cizallamiento en estos biorreactores es impulsada por el mismo flujo presurizado, que los une intrínsecamente. Si bien se han descrito microsistemas que permiten una manipulación mecánica multi-cue precisa para sustratos 2D62 o configuraciones de hidrogel3D 63,64, tales configuraciones no permiten la incorporación de andamios elastoméricos de biomateriales 3D.
Aquí, presentamos la aplicación de un sistema de biorreactor tubular que permite de manera única el desacoplamiento del esfuerzo por cizallamiento y el estiramiento cíclico y ayuda a investigar mecánicamente sus efectos individuales y combinados. Este sistema permite probar una amplia variedad de injertos vasculares de ingeniería tisular (por ejemplo, de origen sintético o natural, diferentes microarquicturas, varias porosidades). Para desacoplar eficazmente la aplicación de la tensión de cizallamiento y el estiramiento, los conceptos clave que utiliza el biorreactor son (1) la separación del control de la tensión de cizallamiento y el estiramiento utilizando distintos sistemas de bomba y (2) la estimulación de los andamios de una manera "de adentro hacia afuera" con dimensiones impulsadas computacionalmente. El flujo se aplica en la superficie exterior del andamio tubular mediante el uso de una bomba de flujo, mientras que el estiramiento circunferencial del andamio se induce mediante la expansión de un tubo de silicona en el que se monta el andamio mediante el uso de una bomba de deformación separada. Las dimensiones del tubo de silicona y el tubo de vidrio que contiene la construcción se eligen y validan cuidadosamente utilizando simulaciones computacionales de dinámica de fluidos, para garantizar que la tensión de cizallamiento en el andamio (debido al flujo) y el estiramiento circunferencial (debido a la expansión del tubo) no se afecten significativamente entre sí. Este diseño de adentro hacia afuera tiene varias razones prácticas. Si el estiramiento se aplica por la presión del fluido luminal (similar a la carga fisiológica), inherentemente requiere que el diseño de la muestra esté libre de fugas. Además, la presión requerida para estirar la muestra estaría completamente determinada por la rigidez de la muestra, que puede variar entre muestras y dentro de una muestra a lo largo del tiempo, lo que dificulta el control del estiramiento. Este biorreactor monta el injerto de ingeniería tisular alrededor de un tubo de silicona y permite la aplicación de tensión de cizallamiento de pared (WSS) en la pared externa del injerto y presuriza el injerto desde el interior. De esta manera, se pueden garantizar condiciones de carga iguales entre muestras y dentro de las muestras a lo largo del tiempo, y además, se permite que las muestras estén permeables, como es común para los andamios vasculares porosos19. Este biorreactor de adentro hacia afuera está específicamente diseñado para estudios sistemáticos sobre los efectos del cizallamiento y / o estiramiento, en lugar de la ingeniería de un vaso sanguíneo nativo in vitro, para el cual las configuraciones tradicionales de biorreactores vasculares son más adecuadas. Consulte la Figura 1A-B para los dibujos de diseño del biorreactor, y su correspondiente Tabla 1 para una descripción funcional y una justificación detrás de los principales componentes del biorreactor.
El uso del biorreactor está demostrado sobre la base de una serie de estudios recientes de nuestro grupo en los que investigamos las influencias individuales y combinadas del esfuerzo cizallador y el estiramiento cíclico sobre la inflamación y la formación de tejido en andamios electrospúdicos reabsorbibles para tejido cardiovascular in situ19,43,44. Con ese fin, utilizamos macrófagos humanos y miofibroblastos, ya sea en monocultivo o en cocultivo para simular las diversas fases de la cascada regenerativa in situ. Hemos demostrado que la secreción de citoquinas por parte de los macrófagos humanos se ve claramente afectada tanto por el estiramiento cíclico como por el esfuerzo de cizallamiento, afectando la deposición de la matriz y la organización por miofibroblastos humanos en estos andamios, tanto a través de la señalización paracrina como del contacto directo19,43,44. En particular, estos estudios revelaron que en el caso de la aplicación combinada de esfuerzo por cizallamiento y estiramiento, los efectos sobre la formación de tejidos y la inflamación están dominados por una de las dos cargas, o hay efectos sinérgicos de ambas cargas. Estos hallazgos ilustran la relevancia de desacoplamiento de ambas cargas para obtener una mejor comprensión de la contribución del entorno mecánico en los procesos de TE. Esta comprensión se puede aplicar para optimizar sistemáticamente los parámetros de diseño de andamios en regímenes de carga hemodinámicos relevantes. Además, los datos mecanicistas de tales entornos bien controlados pueden servir como entrada para los modelos numéricos que se están desarrollando para predecir el curso de la remodelación de tejidos in situ, como se informó recientemente para teVGs65 o TEHVs66,para mejorar aún más la capacidad predictiva.
Protocolo
En los estudios descritos en este protocolo, se han utilizado macrófagos humanos primarios aislados de capas buffy de sangre periférica y miofibroblastos humanos aislados de la vena safena después de la cirugía coronaria de derivación44. Los abrigos buffy se obtuvieron de voluntarios sanos y anónimos que proporcionaron un consentimiento informado por escrito, que fue aprobado por el Comité de Ética Médica Institucional de Investigación sanquin. El uso de células de vena safena humana (HVSC) fue de acuerdo con el "Código de Uso Secundario Adecuado de Tejidos Humanos" desarrollado por la Federación de Sociedades Médicas (FMWV) en los Países Bajos.
1. Preparativos generales y acciones requeridas antes de configurar el biorreactor
NOTA: Para obtener detalles sobre los respectivos protocolos de aislamiento y cultivo, consulte el trabajo anterior19,43,44. Todos los cálculos en el protocolo se dan como ejemplos para un experimento de co-cultivo con monocitos y miofibroblastos, sembrados en 8 andamios cargados hemodinámicamente y 2 controles estáticos (n = 10).
- Iniciar el aislamiento celular y el cultivo celular. Las densidades de siembra para las muestras cocultos de monocitos y miofibroblastos (con una relación de siembra de 2:1) son de 30 × 106 monocitos/cm3 y 15 × 106 miofibroblastos/cm3, respectivamente.
NOTA: El material electrospun tiene una alta porosidad (>90%). Para estimar el número requerido de células por injerto, el volumen del andamio se calcula con la fórmula para el volumen de un cilindro hueco: π * (grosor)2* longitud ≈ 0.04 cm3. La cantidad total de células por injerto es de 1,2 ×10 6 monocitos y 0,6 × 106 miofibroblastos. Para 10 muestras, se requieren al menos 12 ×10 6 monocitos y 6 × 106 miofibroblastos; comience con hasta ~ 10-15% más celdas para tener en cuenta posibles errores de pipeteo. - Desgasifica el medio de cultivo celular que se utilizará para experimentos con el biorreactor.
- Preparar el medio para los cocultivos, que consiste en RPMI-1640:aDMEM (1:1), suplementado con 10% de suero fetal bovino, 1% de penicilina-estreptomicina y 0,5% de L-glutamina.
- Coloque el medio durante la noche (O/N) en una incubadora en un matraz de cultivo celular con tapa de filtro para desgasificación.
- Reemplace la tapa del filtro por una tapa hermética y guárdelo a 4 °C.
- Justo antes de usar, agregue 0.25 mg / ml de ácido L-ascórbico 2-fosfato (vitamina C) al medio.
NOTA: Para los cálculos, la cantidad de medio requerido por cámara de cultivo de flujo es de 50 ml. Refresque el medio tres veces por semana; El medio antiguo de 25 ml se reemplaza por un medio fresco de 25 ml. Para 10 muestras; después de la siembra, se requiere un total de 500 ml de medio fresco, y para cada cambio de medio posterior, se utiliza un total de 250 ml de medio fresco. Siempre prepare medio fresco, especialmente, la vitamina C debe agregarse justo antes de cambiar el medio.
- Preparar andamios electrospun isotrópicos (diámetro luminal de 3 mm, espesor de pared de 200 μm) según lo descrito por Van Haaften et al.19 (Figura 1G-I). En resumen, los andamios tubulares de policaprolactona bisurea (PCL-BU) se producen mediante electrospinning a partir de soluciones de polímero de cloroformo al 15% (p/p). Las soluciones poliméricas son electrospun a temperatura ambiente y 30% de humedad relativa, a un caudal de 40 μL/min, 16 cm de distancia del objetivo cilíndrico giratorio (Ø 3 mm, 500 rpm), y una tensión aplicada de 16 kV en la boquilla de electrospinning y -1 kV en el objetivo.
NOTA: Aunque se utilizaron injertos pcL-BU para estos experimentos, se puede montar una amplia variedad de injertos de ingeniería de tejido elastomérico en este biorreactor (por ejemplo, de diferente origen sintético o natural, diferente microarquitectura, diferentes porosidades)- Retire los andamios electrospun del mandril.
- Haga un pequeño orificio en la tapa de un tubo de 15 ml para "sujetar" el mandril en el centro y evitar que toque la pared del tubo.
- Coloque el mandril con el andamio electrospun en el tubo de halcón y llénelo con agua desionizada.
- Congelar los tubos O/N a -20 °C.
- Coloque los tubos a temperatura ambiente (RT) y saque los mandriales después de unos minutos, dejando los injertos de electrospun en el hielo.
- Deje que el hielo se descongele por completo, retire el tubo electrospun del agua descongelada y "cuelgue" para que se seque verticalmente durante varias horas. Asegúrese de que los andamios no "colapsen" por su propio peso.
- Andamios secos al vacío O/N.
- Imagine una pequeña muestra de los injertos electrospun utilizando microscopía electrónica de barrido (SEM) para evaluar su microestructura (por ejemplo, morfología de la fibra, diámetro de la fibra). Los injertos en los estudios de ejemplo tienen una orientación de fibra isotrópica y un diámetro de fibra de 5 μm (Figura 1H-I).
- Retire los andamios electrospun del mandril.
- Un día antes de comenzar el experimento, coloque el depósito hidráulico lleno de agua desionizada en la incubadora. Cierre las ocho conexiones para las cámaras de cultivo de flujo con tapas Luer blancas. Conéctese al sistema de aire comprimido e inserte el sensor de presión. Ejecute la bomba de deformación (consulte el paso 5.6) O/N para permitir una pequeña expansión del fuelle de teflón.
NOTA: Asegúrese de que todos los materiales y equipos necesarios estén limpios y/o en autoclave (consulte la Tabla de materiales,la columna Comentarios/Descripción para la cual se permite que los materiales se autoclave), de acuerdo con el protocolo del fabricante o como se describe en los pasos 7.3–7.6. - Asegurar condiciones de trabajo estériles para el resto del protocolo.
- Realice los pasos 2–5.3 (configuración del sistema), paso 6.3 (cambio de medio) y pasos 7.1–7.2 (cosecha de construcciones vasculares) en un gabinete de flujo laminar estéril.
- Coloque los materiales que no sean directamente necesarios para los pasos posteriores en placas de Petri cerradas para mantener todo lo más limpio posible.
- Limpie o seque las superficies de material regularmente remojando un pañuelo de papel con etanol al 70% y limpie las superficies de los componentes del biorreactor y el gabinete de flujo laminar.
2. Configuración del biorreactor
NOTA: Realice el paso 2 en un gabinete de flujo laminar.
- Cortar los andamios electrospun en tubos de aproximadamente 25 mm de longitud y documentarlos antes de su uso (por ejemplo, fotografía de la longitud, pesar con equilibrio para la masa inicial).
- Descontaminar los andamios electrospun.
- Coloque los andamios electrospun inclinados en una placa de pozo o placa de Petri, con una abertura frente a la fuente de luz ultravioleta (UV), para permitir que la luz UV (253.7 nm) ilumine el interior de los andamios.
- Exponga los andamios electrospun a la luz UV durante 5 minutos.
- Gire todos los andamios y repita la iluminación UV para la otra abertura.
NOTA: Después de este paso, solo toque el andamio electrospun cuando sea necesario. Use siempre pinzas limpias o guantes limpios. - Tome los tubos de vidrio de las cámaras de cultivo de flujo que se almacenan en un 70%, lave los tubos de vidrio en agua ultrapura, séquelos y colóquelos en una placa de Petri grande y cerrada.
NOTA: Los siguientes pasos, especialmente los pasos 2.3 a 2.5, son idealmente realizados por dos experimentadores.
- Monte los andamios electrospun en el tubo de silicona.
- Conecte la sutura de proleno 5-0 a un extremo del tubo de silicona tomando la sutura a través de un lado del tubo y fuera del otro, dejando dos suturas tensas opuestas que abarcan la sección transversal del tubo. Haga un pequeño nudo a ambos lados del tubo mientras comprime el tubo en el locus de los nudos y deje aproximadamente 10 cm de alambre en ambos nudos. Haga un tercer nudo al final de los dos cables sobrantes de 10 cm.
- Corte la aguja de sutura y todos los hilos libres que puedan sobresaldr y dañar el interior del andamio electrohilado. Corte los bordes del tubo de silicona en una forma triangular para ayudar a tirar del tubo de silicona a través del andamio electrospun.
- Sumerja el andamio electrospun en etanol al 30% (esto sirve como paso de descontaminación adicional y ayuda a deslizar el andamio electrospun sobre el tubo de silicio) y coloque el andamio electrospun sobre el cable libre de 10 cm. El experimentador A estira el tubo de silicona tirando suavemente tanto del tubo de silicona como del nudo del cable de sutura de 10 cm, mientras que el experimentador B desliza suavemente el andamio electrospun sobre el tubo de silicona usando pinzas con una punta interna lisa para evitar daños en los andamios.
- Suelte lentamente el estiramiento en el tubo de silicona, mientras al mismo tiempo alisa el andamio electrospun con pinzas. Sumerja el andamio electrospun en el tubo de silicona en agua ultrapura dos veces.
NOTA: Es posible que se produzca alguna arruga del andamio electrospun. Esta arruga desaparecerá durante el pre-estiramiento aplicado justo antes de fijar los andamios a los conductos de presión en el paso 2.5.3. - Repita los pasos 2.3.2 y 2.3.3 para los demás andamios electrospun. Dependiendo de la longitud del tubo de silicona, se pueden montar múltiples andamios electrospun en el mismo tubo de silicona.
- Cuando todos los andamios electrospun estén montados en el tubo de silicona, corte el tubo de silicona alrededor de los andamios, todo a la misma longitud (5,5 cm); en un lado, cerca del extremo del andamio electrospun, en el otro lado, dejando ~ 2–3 cm de tubo de silicona libre.
- Conecte la sutura de proleno 5-0 a un extremo del tubo de silicona tomando la sutura a través de un lado del tubo y fuera del otro, dejando dos suturas tensas opuestas que abarcan la sección transversal del tubo. Haga un pequeño nudo a ambos lados del tubo mientras comprime el tubo en el locus de los nudos y deje aproximadamente 10 cm de alambre en ambos nudos. Haga un tercer nudo al final de los dos cables sobrantes de 10 cm.
- Construir el compartimento inferior de la cámara de cultivo de flujo (Figura 1A-B).
- Tome la parte superior del compartimento inferior que contiene la toma de flujo y cierre la toma de flujo con un enchufe Luer macho.
- Empuje el conducto de presión con orificios a través del compartimento inferior y coloque una junta tórica de silicona alrededor del extremo inferior del conducto de presión para evitar fugas. Atornille la parte inferior del compartimento inferior a la parte superior del compartimento inferior para asegurar el conducto de presión. Asegúrese de que la ranura grabada inferior del conducto de presión esté aproximadamente 3–5 mm por encima del borde del casquillo adaptador del compartimento inferior; esto más tarde "sostendrá" el nudo apretado del cable de sutura, fijando el andamio electrospun sobre el tubo de silicona.
NOTA: Si el conducto de presión se puede maniobrar fácilmente hacia arriba y hacia abajo, indica que el compartimento inferior no está bien asegurado. Repita el paso 2.4.2 para evitar fugas en etapas posteriores(Figura 2D).
- Asegure el tubo de silicona con el andamio electrospun al conducto de presión.
- Tire del tubo de silicona con el andamio electrospun sobre el conducto de presión.
- Haga un nudo con el cable de sutura en el extremo inferior del andamio electrospun en la ubicación de la ranura grabada en el conducto de presión. Haga un segundo nudo en el lado opuesto para asegurar firmemente el tubo de silicona con el injerto de electrospú.
PRECAUCIÓN: Este es un paso crítico. Asegúrese de que el nudo "caiga" exactamente en la ranura grabada del conducto de presión para evitar fugas de agua desde el depósito hidráulico a las cámaras de cultivo de flujo. Si no está seguro, intente apretar el cable de sutura en varias posiciones, por encima o por debajo de la ubicación esperada de la ranura, para asegurarse de que los nudos finales estén exactamente en la ranura grabada (Figura 2A). - Coloque la abrazadera de tijera en el extremo superior del tubo de silicona y estire el tubo de silicona hacia arriba (esto probará directamente el primer nudo, si es posible mover el tubo de silicona con el andamio electrospun sobre el conducto de presión, no se apretó lo suficientemente bien). Con la fuerza de tracción, el tubo de silicona se estira previamente. Para asegurarse de que el tubo de silicona sea consistente entre las diferentes muestras, conecte una regla a la abrazadera de tijera. Tire de la abrazadera de tijera hacia arriba hasta que el extremo inferior de la regla alcance la altura del extremo inferior del andamio.
NOTA: Es importante mantener el pre-estiramiento en cada muestra aproximadamente igual (~5%) por dos razones: (1) si el tubo de silicona está pre-estirado, resultará en una expansión más homogénea a lo largo de la longitud de la muestra cuando se presurice; (2) el pre-estiramiento afectará las propiedades mecánicas de la silicona, por lo tanto, debe ser el mismo en todas las muestras para garantizar condiciones de estiramiento iguales entre las muestras. - Elimine las arrugas en el andamio electrospun tirando suavemente del andamio electrospun. Nuevamente, haga dos nudos a ambos lados con un cable de sutura en el extremo superior del andamio en la ubicación de la ranura grabada superior en el conducto de presión.
- Suelte la abrazadera de tijera y corte el exceso de tubos de silicona con un cuchillo, dejando el 20-30% de la rosca del tornillo cubierta con tubos de silicona, para evitar fugas cuando el cono de la nariz está montado en la rosca del tornillo.
NOTA: Repita los pasos 2.4 y 2.5 para todas las muestras dinámicas. - Para las muestras de control estático, asegure el andamio electrospun montado en el tubo de silicona en conductos de presión sin agujeros. Estos conductos se pueden mantener por separado en un tubo de 15 ml hasta la siembra (paso 4) y no es necesario montarlos en los compartimentos de la cámara de cultivo de flujo.
- Descontaminar las cámaras de cultivo de flujo parcialmente construidas con andamio electrospun exponiéndolo a la luz UV durante 10 min. Gire las cámaras de cultivo de flujo con andamios electroespón hacia el otro lado y repita la exposición a la luz UV durante 10 minutos.
- Atornille los conos de la nariz en la rosca de tornillo de los conductos de presión con orificios para las muestras dinámicas.
- Asegúrese de que el extremo superior del tubo de silicona encaje en el cono de la nariz para evitar fugas en etapas posteriores. Si hay demasiados tubos de silicona, corte el exceso de tubos con un cuchillo.
- Coloque las cámaras de cultivo de flujo parcialmente construidas en una gran placa de Petri y apunte el cono de la nariz hacia la fuente de luz UV. Aplique iluminación UV durante 5 min.
- Construcción completa de la cámara de cultivo de flujo con el tubo de vidrio y el compartimento superior de la cámara de cultivo de flujo (Figura 1A-B).
- Moje previamente los andamios electrospun sumergiendo el conducto de presión con el tubo de silicona y el andamio electrospun en etanol al 30%, seguido de una inmersión en agua ultrapura dos veces.
- Coloque el tubo de vidrio sobre el conducto de presión, empuje suavemente en el compartimento inferior y asegúrelo suavemente.
- Tome el compartimento superior que contiene la entrada de flujo, coloque una junta tórica de silicona, el enderezador de flujo y el casquillo del adaptador en el orden correcto(Figura 1A-B),y colóquelo sobre el extremo abierto del tubo de vidrio y asegúrelo suavemente.
- Atornille una tapa Luer blanca en la entrada de flujo del compartimento superior.
- Retire el tapón Luer macho de la salida de flujo del compartimento inferior y limpie la superficie a su alrededor con un pañuelo de papel empapado en etanol.
- Coloque una jeringa con 10 ml de agua ultrapura en la salida de flujo, abra la tapa luer blanca en el compartimento superior y llene la cámara con agua ultrapura. Cierre de nuevo la tapa blanca de Luer, retire la jeringa, limpie de nuevo con etanol y cierre la salida de flujo con un tapón Luer macho.
NOTA: Repita los pasos 2.6 a 2.8 para todas las cámaras de cultivo de flujo. - Para los controles estáticos, agregue 10 ml de agua ultrapura a los tubos de 15 ml que contienen las muestras montadas en los conductos de presión sin agujeros.
- Coloque todas las cámaras de cultivo de flujo en la incubadora. Reemplace el agua ultrapura con medio de cultivo un día antes de la siembra celular de la misma manera que se describe en los pasos 2.8.5 y 2.8.6 (asegúrese de recoger el agua ultrapura "vieja" con un pañuelo de papel empapado en etanol colocado directamente en la salida de flujo).
[El protocolo se puede pausar aquí]
3. Preparativos para la configuración de la bomba de flujo
NOTA: Realice el paso 3 en un gabinete de flujo laminar.
- Recoja todos los materiales de configuración de la bomba y prepárese para su uso.
NOTA: Los experimentadores se remite al protocolo del fabricante para obtener una descripción detallada de la configuración de la bomba, las unidades fluídicas y los tubos medianos a través de las válvulas de la unidad fluídica.- Fije la bomba a una capacidad de 200 mbar.
- Atornille los soportes del depósito para depósitos de 60 ml a las unidades fluídicas.
- Limpie los filtros de aire de goma reutilizables con un pañuelo de papel empapado en etanol, asegúrese de que el filtro de aire permanezca seco.
- Coloque los depósitos de 60 ml en los soportes del depósito y coloque el tubo medio estándar a través de las válvulas de la unidad fluídica. Conecte el tubo medio con un diámetro interior más grande con acopladores de bloqueo Luer hembra en un bucle cerrado.
- Sujete el tubo mediano con un clip de manguera, directamente debajo de los depósitos.
- Llene los reservorios con 25 mL de medio de cultivo por cada 60 mL de reservorio. Suelte el clip de la manguera y deje que el medio entre en el tubo.
- Cierre los depósitos medianos con los filtros de aire de goma y coloque la configuración de la bomba de flujo en la incubadora hasta el paso 4.
4. Siembra celular usando fibrina como portador celular
NOTA: Realice el paso 4 en un gabinete de flujo laminar.
- Prepare el gel de fibrina para el paso de siembra celular. Para más detalles, ver Mol et al.67 Para el gel de fibrina, la solución de fibrinógeno debe tener una concentración final de 10 mg/ml (correcta para la pureza del stock de proteínas), y la solución de trombina debe tener una concentración final de 10 U/ml.
- Descongele el fibrinógeno a RT, antes de pesar ~ 50 mg (suficiente para 10 muestras) en un recipiente de plástico con una tapa roja.
- Añadir medio de cultivo celular para preparar la solución de fibrinógeno (a una concentración de 10 mg/ml, correcta para la pureza de la culata proteica). Mezcle bien y filtre para esterilizar la solución de fibrinógeno con un filtro de jeringa de 0,2 μm en un tubo estéril de 15 ml. Mantenga la solución de fibrinógeno filtrado en hielo.
NOTA: Evite preparar la solución de fibrinógeno con demasiada anticipación, de lo contrario el fibrinógeno puede coagularse espontáneamente. - Descongele la trombina y haga una solución de trombina (a una concentración de 10 U/mL) en el medio de cultivo celular y colóquela en hielo. Preparar 20 μL de solución de trombina + células por muestra. Para n=10 muestras, se necesitan 200 μL; por lo tanto, prepare una solución de trombina de 250 μL para tener en cuenta los posibles errores de pipeteo.
- Recoger y contar las células de los matraces de cultivo. Mezclar las células en la proporción y cantidad deseada (1,2 × 106 monocitos y 0,6 × 106 miofibroblastos por andamio). Asegúrese de que haya suficientes celdas para muestras n + 1 para corregir los errores de pipeteo. Centrifugar a 350 × g durante 10 min en RT. Retire el sobrenadante.
- Haga una mezcla de las células suspendidas y la trombina.
- Para cada muestra, utilice 20 μL de la solución de trombina. Para n = 10 muestras, agregue 200 μL de trombina al pellet celular y mezcle. Mida el volumen de la suspensión celular (células + trombina) y calcule cómo dividir uniformemente en los 10 andamios (por ejemplo, si la trombina + suspensión celular tiene un volumen de 260 μL, cada muestra de electrospún recibirá 260 μL / 10 muestras = 26 μL de trombina + suspensión celular).
- Como la siembra de los andamios se realiza en dos pasos, prepare dos tubos de microfugio de 1,5 ml que sostendrán la mitad de la suspensión celular para cada andamio (en el cálculo de ejemplo del paso anterior: prepare dos tubos con 13 μL de trombina + suspensión celular). Colocar sobre hielo.
NOTA: Los siguientes pasos, especialmente el paso 4.4, son idealmente realizados por dos experimentadores.
- Seque los andamios electrospun previamente humedados con vacío para prepararse para la siembra de celdas.
- Conecte una pipeta Pasteur de vidrio al sistema de vacío del gabinete de flujo laminar y colóquela en un tubo vacío de 50 ml para su almacenamiento temporal estéril.
- Tome las cámaras de cultivo de flujo de la incubadora, retire el tapón Luer macho de la salida de flujo y retire el medio después de abrir la tapa luer blanca y colocar un pañuelo de papel empapado en etanol frente a la salida de flujo.
- Despegue el compartimento superior y el tubo de vidrio, y colóquese en una placa de Petri estéril para su almacenamiento temporal.
- Coloque la pipeta Pasteur de vacío en el andamio electrospun y retire la mayor cantidad de medio posible.
PRECAUCIÓN: Seque al vacío el andamio electrospun muy suavemente. En lugar de un movimiento lineal de ida y vuelta sobre el andamio, coloque la pipeta de vacío en múltiples ubicaciones. Sujete el tubo de vacío en la parte superior de la pipeta de Pasteur entre los dedos para un mejor control. - Mezclar la solución de fibrinógeno en una proporción de 1:1 con la trombina + suspensión celular (por ejemplo, mezclar 13 μL de fibrinógeno con 13 μL de trombina + suspensión celular). Para asegurarse de que la fibrina polimeriza en el andamio y no en el tubo de microfugio, pipetee el fibrinógeno, gire la rueda de pipeta para el "volumen adicional" de la suspensión de trombina + celda, y pipetee hacia arriba y hacia abajo una vez en el tubo de microfugio con suspensión de celda para mezclar.
- Gotee directamente homogéneamente la solución sobre toda la longitud del andamio electrospun. Se aconseja que el experimentador A gotee la mezcla de fibrina, mientras que el experimentador B sostiene el compartimento inferior con el andamio electrospun montado en el conducto de presión.
- Después de que la fibrina con las células gotea sobre el andamio electrospun, el experimentador B mueve lentamente el andamio, de izquierda a derecha y hacia arriba y hacia abajo, para dividir aún más las células uniformemente sobre el andamio.
- Repita el paso 4.4.5 - 4.4.7 en el otro lado del andamio electrospun.
- Vuelva a montar la cámara de cultivo de flujo colocando cuidadosamente el tubo de vidrio (evite que la fibrina se pegue y coagule en el lado interno del tubo de vidrio) y empuje hacia atrás el compartimento superior de la cámara de cultivo de flujo. Coloque directamente la construcción secuencada sin ningún medio o solución salina tamponada con fosfato (PBS) en la cámara de cultivo de flujo en la incubadora.
- Repita los pasos 4.4.1–4.4.9 para todas las muestras dinámicas. Para las muestras estáticas montadas en conductos de presión sin agujeros, sembrar de acuerdo con los pasos 4.4.1–4.4.8, y colocar en un tubo de 15 ml después.
- Deje polimerizar la fibrina durante 60 minutos en la incubadora.
[El protocolo se puede pausar aquí durante 30–60 min.]
- Después de la polimerización, llene las cámaras de cultivo de flujo (muestras dinámicas) o los tubos de 15 ml (muestras estáticas) con medio.
5. Acoplamiento de los sistemas de biorreactor y bomba de flujo antes de comenzar el experimento
NOTA: Realice los pasos 5.1 a 5.3 en un gabinete de flujo laminar.
- Tome la bandeja que transporta las cámaras de cultivo de flujo y las unidades fluídicas con depósitos medios llenos y tubos medianos conectados dentro de los gabinetes de flujo laminar.
- Posicionar las cámaras de cultivo de flujo en la base del biorreactor para los grupos experimentales cargados con estiramiento cíclico y con cargas hemodinámicas combinadas (Figura 1E).
- Incline la cámara de cultivo de flujo boca abajo y llene el conducto de presión desde abajo con agua ultrapura usando una jeringa con tubos delgados (esto puede ser de cualquier tipo, siempre que sea flexible y delgado, en este experimento, se unió a la aguja un alambre de 10 cm de largo y 0,15 mm de diámetro interior).
- Coloque el tubo delgado dentro del conducto de presión, y mientras el conducto de presión se llena con agua ultrapura empujando gradualmente el agua fuera de la jeringa, extraiga el cable fuera del conducto de presión simultáneamente, para asegurarse de que no haya burbujas de aire dentro del conducto de presión.
- Coloque la cámara de cultivo de flujo en una de las ocho roscas de tornillo en la base del biorreactor. Coloque una junta tórica de silicona entre la base del biorreactor y el conector Luer blanco para evitar posibles fugas, y apriete el conector Luer blanco desde el compartimento inferior.
- Repita los pasos 5.2.2 y 5.2.3 para todas las muestras estiradas cíclicamente.
- Conecte las cámaras de cultivo de flujo para todos los grupos experimentales, excepto el control estático, al sistema de bomba de flujo.
- Coloque un clip de manguera en el tubo mediano. Retire la tapa Luer blanca que cubre la entrada de flujo del compartimento superior de la cámara de cultivo de flujo. Retire el acoplador Luer hembra del tubo mediano y conecte el tubo mediano por un lado con la entrada de flujo en el compartimento superior, y el otro lado del tubo medio con salida de flujo en el compartimento inferior.
- Repita el paso 5.3.1 para todas las cámaras de cultivo de flujo. En este punto, el biorreactor y las cámaras de cultivo de flujo se llenan con medio y se conectan a los sistemas de flujo.
- Para las muestras de control estático, coloque las muestras verticalmente en un matraz de cultivo celular con tapa de filtro utilizando la abrazadera de tijera. Llene el matraz de cultivo celular con medio y colóquelo en la incubadora.
- Transfiera la configuración completa del gabinete de flujo laminar a la incubadora y conecte las unidades fluídicas al tubo de presión de aire y al cable eléctrico.
- Inicie el software e inicialice las bombas de flujo. Inicie el flujo medio para las muestras una por una.
- Compruebe si las válvulas de la unidad fluídica están haciendo clic.
- Retire la abrazadera de la manguera del tubo medio.
- Arranque la bomba de flujo con 100 mbar y 10 s de tiempo de conmutación.
- Compruebe cuidadosamente la dirección del flujo para detectar posibles fugas o burbujas de aire. Cualquier burbuja de aire atrapada se puede eliminar girando la cámara de cultivo de flujo al revés.
NOTA: Asegúrese de que los niveles medios en los depósitos medios estén equilibrados, para evitar la succión de aire en el sistema y las burbujas de aire en las cámaras de cultivo de flujo, y para no permitir que los depósitos se sequen (Figura 2C). - Repita el paso 5.5 para todas las unidades fluídicas una por una.
- Inicialice la bomba de deformación.
- Conecte la bomba accionada neumática a través de la entrada de aire en el cilindro neumático al aire comprimido. Conecte la salida de aire inferior con el tubo azul para la salida de aire (Figura 1F).
- Abra el software LabVIEW, ejecute el script LabVIEW y el sistema de aplicación de presión de aire comprimido, como lo describen Van Kelle et al.68,ingrese el desplazamiento y la frecuencia (comience con una frecuencia baja de 0.2 Hz). Pausa la bomba cuando el fuelle de teflón esté en su nivel más bajo.
- Coloque el sensor de presión en la entrada del sensor de presión en el depósito hidráulico.
- Cambie la configuración de la bomba a la configuración deseada (para 1.5 Pa, use 150 mbar, tiempo de conmutación de 10 s).
- Encienda la bomba de deformación y aplique el ajuste preferido (por ejemplo, estiramiento de 0,5 Hz, 1,05).
6. Ejecutar el experimento durante varios días; Monitoreo de cizallamiento y estiramiento durante el cultivo y reemplazo de medio
- Calcule el WSS en la pared del andamio.
- Registre la magnitud del flujo cada dos días (consulte el manual del fabricante de la bomba de flujo para obtener más detalles). En resumen, observe el cambio en los niveles de líquido (en ml) en los depósitos medios entre la conmutación del depósito de la unidad fluídica durante 10 s. Realice al menos cinco mediciones, calcule el valor medio y multiplique por 6 para obtener el caudal Q en ml/min.
- El flujo se describe mediante un flujo de Poiseuille a través de un canal anular. Asumiendo el medio de cultivo como un fluido newtoniano, calcule el WSS en la pared del andamio, r 1 ,mediantela ecuación 1.
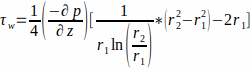 (1)
(1)
donde el WSS τw en la pared del andamio (r1; aquí r1 = 1,7 mm), resultante de un flujo en estado estacionario, está determinado por la presión aplicada p y el radio interior del tubo de vidrio r2 (aquí r2 = 2,3 mm). Se supone que el gradiente de presión en la dirección axial es uniforme entre la entrada de flujo y la salida de flujo y está dado por la Ecuación 2(Figura 1J).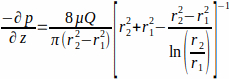 (2)
(2)
con μ la viscosidad dinámica (aquí se asumió viscosidad media constante, μ = 0,7 × 10-3 Pa∙s a 37 °C) y Q el caudal aplicado.
- Controle el estiramiento aplicado a los andamios cada dos días.
- Coloque un fondo oscuro detrás de la cámara de cultivo de flujo para aumentar el contraste entre el andamio y el fondo. Coloque las lámparas de luz LED, apuntando hacia el andamio, para ayudar a la visualización del andamio.
- Tome fotografías de lapso de tiempo del andamio a una frecuencia de 30 Hz durante 6 s (es decir, 3 ciclos de estiramiento) con una cámara de alta velocidad.
NOTA: Una frecuencia de grabación más baja puede ser suficiente si la cámara lo permite. Sin embargo, no se determinó la frecuencia mínimamente requerida. - Determine manualmente el diámetro mínimo y máximo del andamio a partir de las imágenes.
- Calcule el diámetro exterior mínimo y máximo del andamio electrospun para calcular los estiramientos máximos de acuerdo con la Ecuación 3.
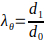 (3)
(3)
donde el estiramiento circunferencial (λθ) viene dado por la relación entre el diámetro exterior del andamio, d1, y su diámetro inicial, d0.
- Correcto para la evaporación media y refrescar el medio tres veces por semana.
- Detenga y desacople los cables para los sistemas de flujo y la bomba de deformación.
- Coloque los clips de manguera en el tubo mediano.
- Determine cuánto medio se evaporó en función de las marcas del indicador de volumen en los depósitos medios.
- Transfiera la bandeja con el biorreactor y las unidades fluídicas al gabinete de flujo laminar.
- Retire los filtros de aire de goma de los depósitos medianos; agregue agua ultrapura en autoclave para compensar el volumen evaporado del medio. Cierre de nuevo los depósitos medianos y conéctelos de nuevo a la bomba para mezclar el medio con el agua ultrapura.
- Repita los pasos 6.3.1–6.3.5. Retire los filtros de aire de goma nuevamente, saque 25 ml de medio de cultivo y gire hacia abajo a 300 × g durante 5 minutos en RT.
- Recolectar 1,5 ml de sobrenadante y almacenar a -30 °C para el análisis de perfiles secretores (para análisis con ensayo de inmunoabsorción ligado a enzimas (ELISA)).
- Recoger el volumen deseado de sobrenadante para estudios de señalización paracrina, utilizando el sobrenadante como medio condicionado43.
- Añadir 25 ml de medio fresco a los depósitos medianos.
- Vuelva a colocar los filtros de aire de goma en los depósitos medianos.
- Coloque la configuración completa de nuevo en la incubadora; conecte todos los cables y tubos de aire a la bomba y a la bomba de deformación. Suelte los clips de la manguera y repita los pasos 5.4 a 5.8.
- Compruebe si las perlas de secado de sílice en las botellas de secado conectadas a la bomba están húmedas (apariencia blanca), y reemplácelas con perlas de sílice secas si es necesario (apariencia naranja).
7. Finalización del experimento, recolección de muestras y limpieza y almacenamiento de equipos
- En el último día del experimento, corrija la evaporación media como se describe en los pasos 6.3.1–6.3.5, y coseche las muestras una por una.
- Para cosechar las muestras una por una, la bomba de flujo y la bomba de deformación deben detenerse varias veces. Coloque un clip de manguera en tubos medianos. Detenga temporalmente la bomba de flujo y la bomba de deformación. Desconecte una cámara de cultivo de flujo de la base del biorreactor; reemplace por una tapa Luer blanca en la base del biorreactor. Lleve la cámara de cultivo de flujo y la unidad fluídica al gabinete de flujo laminar. Vuelva a poner en marcha la bomba de flujo y la bomba de deformación para aplicar la carga hemodinámica a las otras muestras hasta la recolección.
- Recolectar medio de los reservorios del medio para el análisis de producción de citoquinas paracrinas a través de ELISA.
- Unidades de flujo de desacoplamiento y construcción tubular de cosecha. Sección según el esquema de corte deseado. Las partes de la construcción se pueden almacenar a 4 °C (después de 15 min de fijación en formaldehído al 3,7% y 3 x 5 min de lavado en PBS) o -30 °C (después de la congelación por instantánea en nitrógeno líquido) hasta un análisis adicional.
- Limpie los componentes del biorreactor y de la bomba. Además, el método de limpieza recomendado por artículo se menciona en la Tabla de materiales.
- Limpie los filtros de aire de goma con etanol al 70%. ¡Tenga mucho cuidado de no humedecer el filtro interior!
- Recoja todos los componentes separados: tubos medianos, depósitos medianos, tubos de vidrio, tapones Luer macho y cerraduras Luer hembra, tapas Luer blancas, conductos de presión, conos nasales, juntas tóricas de silicona, bujes adaptadores, alisadores de flujo (excluyendo bombas, unidades fluídicas, filtros de aire de goma, la base del biorreactor) y enjuague en agua corriente del grifo.
- Coloque O/N en dodecilsulfato de sodio al 0,1% en agua desionizada.
NOTA: No use agua ultrapura ya que las piezas podrían oxidarse. - Enjuague con agua del grifo y jabón para lavar platos.
- Sumergir en agua desionizada, seguido de etanol al 70% dos veces, seguido de agua desionizada.
- Coloque todos los materiales por separado sobre los pañuelos de papel y déjelos secar. Use aire a presión para secar los tubos.
- Limpie todos los materiales no autoclavables con un pañuelo de papel empapado en etanol al 70%. Esto incluye el filtro de aire de goma (tenga en cuenta que el filtro de aire debe permanecer seco) y la base del biorreactor (fuelle de teflón y cilindro neumático).
- Autoclave los componentes de la cámara fluídica (incluida la junta tórica de silicona), el tubo medio, los depósitos medios (sin el filtro de aire de goma), los tapones Luer macho y los acopladores Luer hembra, las tapas Luer blancas, los clips de manguera y el equipo estándar (por ejemplo, pinzas, tijeras de sujeción)
- Para un uso conveniente durante los próximos experimentos, combine los componentes separados para una cámara fluídica completa en una caja autoclavable.
- Retire el agua del depósito hidráulico. Limpiar con etanol al 70%, seguido de agua desionizada. Déjalo secar. Rellenar con agua desionizada y unas gotas de desinfectante para preservar el baño de agua.
- Almacene los tubos de vidrio para la cámara de cultivo de flujo en etanol al 70%.
- Coloque las perlas de secado de sílice húmedas (aspecto blanco) en el horno O/N a 120 °C para dejarlas secar (aspecto naranja) y guárdelo en un matraz hermético.
Resultados
Este biorreactor fue desarrollado para estudiar los efectos individuales y combinados del esfuerzo de cizallamiento y el estiramiento cíclico en el crecimiento y remodelación del tejido vascular en andamios de biomateriales 3D. El diseño del biorreactor permite cultivar hasta ocho construcciones vasculares bajo diversas condiciones de carga(Figura 1A). Los constructos vasculares se colocan en una cámara de cultivo de flujo(Figura 1B)en la que tanto el estira...
Discusión
El biorreactor aquí descrito permite la evaluación sistemática de las contribuciones de los efectos individuales y combinados del esfuerzo cizallador y el estiramiento cíclico sobre la inflamación y la regeneración tisular en andamios tubulares reabsorbibles. Este enfoque también permite realizar una gran variedad de análisis sobre constructos vasculares, como se ejemplifica en la sección de resultados representativos. Estos resultados muestran el impacto distintivo de los diferentes regímenes de carga hemodin?...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio cuenta con el apoyo financiero de ZonMw como parte del programa LSH 2Treat (436001003) y la Fundación Holandesa del Riñón (14a2d507). N.A.K. agradece el apoyo del Consejo Europeo de Investigación (851960). Agradecemos el Programa de Gravitación "Regeneración Impulsada por Materiales", financiado por la Organización de los Países Bajos para la Investigación Científica (024.003.013).
Materiales
| Name | Company | Catalog Number | Comments |
| advanced Dulbecco’s modified EagleMedium (aDMEM) | Gibco | 12491-015 | cell culture medium for fibroblasts |
| Aqua Stabil | Julabo | 8940012 | prevent microorganism growth in bioreactor-hydraulic reservoir |
| Bovine fibrinogen | Sigma | F8630 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Bovine thrombin | Sigma | T4648 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Centrifuge | Eppendorf | 5804 | to spin down cells and conditioned medium |
| Clamp scissor - "kelly forceps" | Almedic | P-422 | clamp the silicone tubing and apply pre-stretch to the scaffold so the scaffold can be sutured into the engraved groove (autoclave at step 1, step 7) |
| CO2 cell culture incubators | Sanyo | MCO-170AIC-PE | for cell culturing |
| Compressed air reservoir | Festo | CRVZS-5 | smoothing air pressure fluctuations and create time delays for pressure build-up |
| Custom Matlab script to calculate the maximum stretches | Matlab | R2017. The Mathworks, Natick, MA | calculate the minimum and maximum outer diameter of the electrospun scaffold |
| Data acquisition board | National Instruments | BNC-2090 | data processing in between amplifier system and computer |
| Ethanol | VWR | VWRK4096-9005 | to keep sterile working conditions |
| Fetal bovine calf serum (FBS) | Greiner | 758087 | cell culture medium supplement; serum-supplement |
| Flow culture chamber compartments, consisting of a pressure conduit with engraved grooves and small holes to apply pressure on silicone tubing, a screw thread, nose cone, top compartment with flow inlet and bottom compartment flow outlet, adapter bushing | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | flow culture chamber compartments (autoclave at step 1, step 7) |
| Glass Pasteur pipet | Assistant | HE40567002 | apply vacuum on electrospun scaffold (autoclave at step 1) |
| Glass tubes of the flow culture chamber | Custon made, Equipment & Prototype Center, Eindhoven University of Technology | n.a. | part of the flow culture chamber (clean and store in 70% ethanol, at step 1 and 7) |
| GlutaMax | Gibco | 35050061 | cell culture medium amino acid supplement, minimizes ammonia build-up |
| High speed camera | MotionScope | M-5 | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| High speed camera lens - Micro-NIKKOR 55mm f/2.8 - lens | Nikon | JAA616AB | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| Hose clip | ibidi GmbH | 10821 | block medium flow (autoclave at step 1, step 7) |
| Hydraulic reservoir with 8 screw threads for 8 flow culture chambers | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to apply pressure to the silicone mounted constructs (clean outside with a paper tissue with 70% ethanol, rinse reservoir with 70% ethanol followed by demi water, at step 1 and 7) |
| Ibidi pump system (8x) including ibidi pump, PumpControl software, fluidic unit, perfusion set (medium tubing), air pressure tubing, drying bottles with orange silica beads | ibidi GmbH | 10902 | set up used to control the flow in the flow culture chambers. Note 1: the ibidi pumps were modified by the manufacturer to enable 200 mbar capacity. Note 2: can be replaced by pump system of other manufacturer, as long as same flow regimes can be applied. |
| Knives (no.10 sterile blades, individual foil pack) and scalpel handle (stainless steel, individually wrapped) | Swann Morton | 0301; 0933 | to cut the silicone tubing in the correct size for the scaffold and to cut the suture material |
| LabVIEW Software | National Instruments | version 2018 | to control the stretch applied to the scaffolds |
| Laminar flow biosafety cabinet with UV light | Labconco | 302310001 | to ensure sterile working conditions. The UV is used to decontaminate everything that cannot be autoclaved, or touched after autoclaving |
| Large and small petri dishes | Greiner | 664-160 | for sterile working conditions |
| L-ascorbic acid 2-phosphate (vitamin C) | Sigma | A8960 | cell culture medium supplement, important for collagen production |
| LED light cold source KL2500 | Zeiss | Schott AG | to aid in visualization for the time lapse of the scaffolds during monitoring of the stretch |
| Luer (female and male) locks and connectors, white luer caps | ibidi GmbH | various, see (https://ibidi.com/26-flow-accessories) | to close or connect parts of the bioreactor and the ibidi pump (autoclave at step 1, step 7) |
| Measuring amplifier (PICAS) | PEEKEL instruments B.V. | n.a. | to amplify the signal from the pressure sensor and feedback to LabView |
| Medium reservoir (large syringes 60 mL) and reservoir holders | ibidi GmbH | 10974 | medium reservoir (autoclave at step 1, step 7) |
| Medium tubing with 4.25 mm outer diameter and 1 mm inner diameter | Rubber BV | 1805 | to allow for a larger flow rate, the ibidi medium tubing with larger diameter is used. Note: the part of medium tubing guided through the fluidic unit valves are the same as the default ibidi medium tubing |
| Motion Studio Software | Idtvision | 2.15.00 | to make the high speed time lapse images for stretch monitoring |
| Needle (19G) | BD Microlance | 301700 | together with thin flexible tubing used to fill the hydraulic reservoir with ultrapure water without adding air bubbles |
| Needle driver | Adson | 2429218 | to handle the needle of the nylon suture through the silicone tube (autoclave at step 1, step 7) |
| Paper tissues | Kleenex | 38044001 | for cleaning of the equipment with 70% ethanol |
| Parafilm | Sigma | P7793-1EA | quick fix if leakage occurs |
| Penicillin/streptomycin (P/S) | Lonza | DE17-602E | cell culture medium supplement; prevent bacterial contamination |
| Phosphate Buffered Saline (PBS) | Sigma | P4417-100TAB | for storage and washing steps (autoclave at step 1) |
| Plastic containers (60 mL) with red screw caps | Greiner | 206202 | to prepare the fibrinogen solution |
| Pneumatic cylinder | Festo | AEVC-20-10-I-P | to actuate the Teflon bellow (clean with a paper tissue with 70% ethanol at step 1 and 7) |
| Polycaprolactone bisurea (PCL-BU) tubular scaffolds (3 mm inner diameter, 200 µm wall thickness, 20 mm length) | SyMO-Chem, Eindhoven, The Netherlands | n.a. | produced using electrospinning from 15% (w/w) chloroform (Sigma; 372978) polymer solutions. See Van Haaften et al Tissue Engineering Part C (2018) for more details |
| Pressure conduit without holes (for static control) | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to mount electrospun tubes on silicon tubing (autoclave at step 1, step 7) |
| Pressure sensor and transducer | BD | TC-XX and P 10 EZ | the air pressure going to the pneumatic actuated pump is raised until it reaches the set pressure |
| Proportional air pressure control valve and pressure sensor | Festo | MPPES-3-1/8-2-010, 159596 | provides compressed air to the pneumatic actuated pump |
| Roswell Park Memorial Institute 1640 (RPMI-1640) | Gibco | A1049101 | cell culture medium for monocyte/macrophage |
| Safe lock Eppendorf tubes (1.5 mL) | Eppendorf | 30120086 | multiple applications (autoclave at step 1) |
| Sodium dodecyl sulfate solution 20% | Sigma | 5030 | Used to clean materials, at a concentration of 0.1%. |
| Silicone O-rings | Technirub | 1250S | to prevent leakage (autoclave at step 1, step 7) |
| Silicone tubing (2.8 mm outer diameter, 400 um wall thickness) | Rubber BV | 1805 | to mount the electrospun tubes on the pressure conduits (autoclave at step 1) |
| Sterile tube (15 mL) | Falcon | 352095 | multiple applications |
| Suture, 5-0 prolene with pre-attached taper point needle | Ethicon, Johnson&Johnson | EH7404H | Prolene suture wire 5-0 (75cm length, TF taper point needle, 1/2 circle, 13 mm needle length) |
| Syringe (24 mL) | B. Braun Melsungen AG | 2057932 | to add the ultrapure water or medium to the hydraulic reservoir or flow culture chamber |
| Syringe filter (0.2 µm) | Satorius | 17597-K | to filter the fibrinogen solution |
| T150 cell culture flask with filter cap | Nunc | 178983 | to degas culture medium |
| T75 Cell culture flask with filter cap | Nunc | 156499 | to culture static control samples |
| Teflon bellow | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to load the hydraulic reservoir (clean outside with a paper tissue with 70% ethanol at step 1 and 7) |
| Tray (stainless steel) | PolarWare | 15-248 | for easy transport of the fluidic culture chambers and the bioreactor from incubator to laminar flow cabinet and back (clean with a paper tissue with 70% ethanol before and after use) |
| Tweezers | Wironit | 4910 | sterile handling of individual parts (autoclave at step 1 and 7) |
| Ultrapure water | Stakpure | Omniapure UV 18200002 | to correct for medium evaporation, mixed with aqua stabil mixed and used as hydraulic fluid. (autoclave ultrapure water at step 1) |
| UV light | Philips | TUV 30W/G30 T8 | for decontamination of grafts and bioreactor parts before seeding |
Referencias
- Chlupác, J., Filová, E., Bacáková, L. Blood vessel replacement: 50 years of development and tissue engineering paradigms in vascular surgery. Physiological Research. 58, 119-139 (2009).
- Huygens, S. A., et al. Bioprosthetic aortic valve replacement in elderly patients: Meta-analysis and microsimulation. The Journal of Thoracic and Cardiovascular Surgery. 157 (6), 2189-2197 (2019).
- Huygens, S. A., et al. Contemporary outcomes after surgical aortic valve replacement with bioprostheses and allografts: a systematic review and meta-analysis. European Journal of Cardio-Thoracic Surgery. 50 (4), 605-616 (2016).
- Loh, S. A., et al. Mid- and long-term results of the treatment of infrainguinal arterial occlusive disease with precuffed expanded polytetrafluoroethylene grafts compared with vein grafts. Annals of Vascular Surgery. 27 (2), 208-217 (2013).
- Tara, S., et al. Vessel bioengineering. Circulation Journal. 78 (1), 12-19 (2014).
- Huang, A. H., Niklason, L. E. Engineering of arteries in vitro. Cellular and Molecular Life Sciences. 71 (11), 2103-2118 (2014).
- Bouten, C. V. C., Smits, A. I. P. M., Baaijens, F. P. T. Can we grow valves inside the heart? Perspective on material-based in situ heart valve tissue engineering. Frontiers in Cardiovascular Medicine. 5, 54 (2018).
- Fioretta, E. S., et al. Next-generation tissue-engineered heart valves with repair, remodelling and regeneration capacity. Nature Reviews Cardiology. , (2020).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Science Translational Medicine. 11 (485), (2019).
- Gutowski, P., et al. Arterial reconstruction with human bioengineered acellular blood vessels in patients with peripheral arterial disease. Journal of Vascular Surgery. , (2020).
- Syedain, Z., et al. Tissue engineering of acellular vascular grafts capable of somatic growth in young lambs. Nature Communications. 7 (12951), 12951 (2016).
- Sugiura, T., et al. Tissue-engineered vascular grafts in children with congenital heart disease: intermediate term follow-up. Seminars in Thoracic and Cardiovascular Surgery. 30 (2), 175-179 (2018).
- Kluin, J., et al. In situ heart valve tissue engineering using a bioresorbable elastomeric implant - material design to 12 months follow-up in sheep. Biomaterials. 125, 101-117 (2017).
- Fioretta, E. S., et al. Differential leaflet remodeling of bone marrow cell pre-seeded versus nonseeded bioresorbable transcatheter pulmonary valve replacements. JACC. Basic to Translational Science. 5 (1), 15-31 (2020).
- Van Haaften, E. E., Bouten, C. V. C., Kurniawan, N. A. Vascular mechanobiology: towards control of. Cells. , 1-24 (2017).
- De Jonge, N., et al. Matrix production and organization by endothelial colony forming cells in mechanically strained engineered tissue constructs. PLoS ONE. 8 (9), 73161 (2013).
- Schmidt, J. B., Chen, K., Tranquillo, R. T. Effects of intermittent and incremental cyclic stretch on ERK signaling and collagen production in engineered tissue. Cellular and Molecular Bioengineering. 9 (1), 55-64 (2016).
- Luo, J., et al. Tissue-engineered vascular grafts with advanced mechanical strength from human iPSCs. Cell Stem Cell. 26 (2), 251-261 (2020).
- Van Haaften, E. E., et al. Decoupling the effect of shear stress and stretch on tissue growth and remodeling in a vascular graft. Tissue Engineering Part C: Methods. 24 (7), 418-429 (2018).
- Gupta, V., Tseng, H., Lawrence, B. D., Jane Grande-Allen, K. Effect of cyclic mechanical strain on glycosaminoglycan and proteoglycan synthesis by heart valve cells. Acta Biomaterialia. 5 (2), 531-540 (2009).
- Lin, S., Mequanint, K. Bioreactor-induced mesenchymal progenitor cell differentiation and elastic fiber assembly in engineered vascular tissues. Acta Biomaterialia. 59, 200-209 (2017).
- Venkataraman, L., Bashur, C. A., Ramamurthi, A. Impact of cyclic stretch on induced elastogenesis within collagenous conduits. Tissue Engineering. Part A. 20 (9-10), 1403-1415 (2014).
- Huang, A. H., et al. Biaxial stretch improves elastic fiber maturation, collagen arrangement, and mechanical properties in engineered arteries. Tissue Engineering Part C Methods. 22 (6), 524-533 (2016).
- Hinderer, S., et al. In vitro elastogenesis: instructing human vascular smooth muscle cells to generate an elastic fiber-containing extracellular matrix scaffold. Biomedical Materials. 10 (3), 034102 (2015).
- Eoh, J. H., et al. Enhanced elastin synthesis and maturation in human vascular smooth muscle tissue derived from induced-pluripotent stem cells. Acta Biomaterialia. 52, 49-59 (2017).
- Smits, A. I. P. M., Bouten, C. V. C. Tissue engineering meets immunoengineering: Prospective on personalized in situ tissue engineering strategies. Current Opinion in Biomedical Engineering. 6, 17-26 (2018).
- Wissing, T. B., Bonito, V., Bouten, C. V. C., Smits, A. I. P. M. Biomaterial-driven in situ cardiovascular tissue engineering-a multi-disciplinary perspective. npj Regenerative Medicine. 2 (1), 18 (2017).
- Hibino, N., et al. A critical role for macrophages in neovessel formation and the development of stenosis in tissue-engineered vascular grafts. The FASEB Journal. 25 (12), 4253-4263 (2011).
- Godwin, J. W., Pinto, A. R., Rosenthal, N. A. Macrophages are required for adult salamander limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9415-9420 (2013).
- Godwin, J. W., Debuque, R., Salimova, E., Rosenthal, N. A. Heart regeneration in the salamander relies on macrophage-mediated control of fibroblast activation and the extracellular landscape. npj Regenerative Medicine. 2 (1), 22 (2017).
- McBane, J. E., Cai, K., Labow, R. S., Santerre, J. P. Co-culturing monocytes with smooth muscle cells improves cell distribution within a degradable polyurethane scaffold and reduces inflammatory cytokines. Acta Biomaterialia. 8 (2), 488-501 (2012).
- Battiston, K. G., Ouyang, B., Labow, R. S., Simmons, C. A., Santerre, J. P. Monocyte/macrophage cytokine activity regulates vascular smooth muscle cell function within a degradable polyurethane scaffold. Acta Biomaterialia. 10 (3), 1146-1155 (2014).
- Ploeger, D. T., et al. Cell plasticity in wound healing: paracrine factors of M1/ M2 polarized macrophages influence the phenotypical state of dermal fibroblasts. Cell Communication and Signaling. 11 (1), 29 (2013).
- McBane, J. E., Santerre, J. P., Labow, R. S. The interaction between hydrolytic and oxidative pathways in macrophage-mediated polyurethane degradation. Journal of Biomedical Materials Research. Part A. 82 (4), 984-994 (2007).
- Wissing, T. B., et al. Macrophage-driven biomaterial degradation depends on scaffold microarchitecture. Frontiers in Bioengineering and Biotechnology. 7, 87 (2019).
- Wolf, M. T., Vodovotz, Y., Tottey, S., Brown, B. N., Badylak, S. F. Predicting in vivo responses to biomaterials via combined in vitro and in silico analysis. Tissue Engineering Part C: Methods. 21 (2), 148-159 (2015).
- Grotenhuis, N., Bayon, Y., Lange, J. F., Van Osch, G. J. V. M., Bastiaansen-Jenniskens, Y. M. A culture model to analyze the acute biomaterial-dependent reaction of human primary macrophages. Biochemical and Biophysical Research Communications. 433 (1), 115-120 (2013).
- Jannasch, M., et al. A comparative multi-parametric in vitro model identifies the power of test conditions to predict the fibrotic tendency of a biomaterial. Scientific Reports. 7 (1), 1689 (2017).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- McWhorter, F. Y., Davis, C. T., Liu, W. F. Physical and mechanical regulation of macrophage phenotype and function. Cellular and Molecular Life Sciences. 72 (7), 1303-1316 (2014).
- Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Strain-dependent modulation of macrophage polarization within scaffolds. Biomaterials. 35 (18), 4919-4928 (2014).
- Dziki, J. L., et al. The effect of mechanical loading upon extracellular matrix bioscaffold-mediated skeletal muscle remodeling. Tissue Engineering. Part A. 24 (1-2), 34-46 (2018).
- Wissing, T. B., et al. Hemodynamic loads distinctively impact the secretory profile of biomaterial-activated macrophages - implications for in situ vascular tissue engineering. Biomaterials Science. 8 (1), 132-147 (2020).
- Van Haaften, E. E., Wissing, T. B., Kurniawan, N. A., Smits, A. I. P. M., Bouten, C. V. C. Human in vitro model mimicking material-driven vascular regeneration reveals how cyclic stretch and shear stress differentially modulate inflammation and matrix deposition. Advanced Biosystems. 4 (6), 1900249 (2020).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Bonito, V., de Kort, B. J., Bouten, C. V. C., Smits, A. I. P. M. Cyclic strain affects macrophage cytokine secretion and extracellular matrix turnover in electrospun scaffolds. Tissue Engineering Part A. 25 (17-18), 1310-1325 (2019).
- Battiston, K. G., Labow, R. S., Simmons, C. A., Santerre, J. P. Immunomodulatory polymeric scaffold enhances extracellular matrix production in cell co-cultures under dynamic mechanical stimulation. Acta Biomaterialia. 24, 74-86 (2015).
- Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. A mesofluidics-based test platform for systematic development of scaffolds for in situ cardiovascular tissue engineering. Tissue Engineering Part C: Methods. 18 (6), 475-485 (2012).
- Smits, A. I. P. M., Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. T. Shear flow affects selective monocyte recruitment into MCP-1-loaded scaffolds. Journal of Cellular and Molecular Medicine. 18 (11), 2176-2188 (2014).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Fahy, N., Menzel, U., Alini, M., Stoddart, M. J. Shear and dynamic compression modulates the inflammatory phenotype of human monocytes in vitro. Frontiers in Immunology. 10, 383 (2019).
- Pennings, I., et al. Layer-specific cell differentiation in bi-layered vascular grafts under flow perfusion. Biofabrication. 12 (1), 015009 (2019).
- Wang, J., et al. Ex vivo blood vessel bioreactor for analysis of the biodegradation of magnesium stent models with and without vessel wall integration. Acta Biomater. 50, 546-555 (2017).
- Huang, A. H., et al. Design and use of a novel bioreactor for regeneration of biaxially stretched tissue-engineered vessels. Tissue Engineering. Part C, Methods. 21 (8), 841-851 (2015).
- Huang, A. H., Niklason, L. E. Engineering biological-based vascular grafts using a pulsatile bioreactor. Journal of Visualized Experiments. (52), e2646 (2011).
- Bono, N., et al. A Dual-mode bioreactor system for tissue engineered vascular models. Annals of Biomedical Engineering. 45 (6), 1496-1510 (2017).
- Wolf, F., et al. VascuTrainer: a mobile and disposable bioreactor system for the conditioning of tissue-engineered vascular grafts. Annals of Biomedical Engineering. 46 (4), 616-626 (2018).
- Ramaswamy, S., et al. A novel bioreactor for mechanobiological studies of engineered heart valve tissue formation under pulmonary arterial physiological flow conditions. Journal of Biomechanical Engineering. 136 (12), 121009 (2014).
- Piola, M., et al. A compact and automated ex vivo vessel culture system for the pulsatile pressure conditioning of human saphenous veins. Journal of Tissue Engineering and Regenerative Medicine. 10 (3), 204-215 (2016).
- Vanerio, N., Stijnen, M., de Mol, B. A. J. M., Kock, L. M. An innovative ex vivo vascular bioreactor as comprehensive tool to study the behavior of native blood vessels under physiologically relevant conditions. Journal of Engineering and Science in Medical Diagnostics and Therapy. 2 (4), (2019).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplantation. 27 (9), 1375-1389 (2018).
- Sinha, R., et al. A medium throughput device to study the effects of combinations of surface strains and fluid-flow shear stresses on cells. Lab on a Chip. 15 (2), 429-439 (2015).
- Beca, B. M., Sun, Y., Wong, E., Moraes, C., Simmons, C. A. Dynamic bioreactors with integrated microfabricated devices for mechanobiological screening. Tissue Engineering Part C: Methods. 25 (10), 581-592 (2019).
- Liu, H., Usprech, J., Sun, Y., Simmons, C. A. A microfabricated platform with hydrogel arrays for 3D mechanical stimulation of cells. Acta Biomaterialia. 34, 113-124 (2016).
- Szafron, J. M., Ramachandra, A. B., Breuer, C. K., Marsden, A. L., Humphrey, J. D. Optimization of tissue-engineered vascular graft design using computational modeling. Tissue Engineering Part C: Methods. 25 (10), 561-570 (2019).
- Emmert, M. Y., et al. Computational modeling guides tissue-engineered heart valve design for long-term in vivo performance in a translational sheep model. Science Translational Medicine. 10 (440), (2018).
- Mol, A., et al. Fibrin as a cell carrier in cardiovascular tissue engineering applications. Biomaterials. 26 (16), 3113-3121 (2005).
- van Kelle, M. A. J., et al. A Bioreactor to identify the driving mechanical stimuli of tissue growth and remodeling. Tissue Engineering Part C: Methods. 23 (6), (2017).
- van den Broek, C. N., et al. Medium with blood-analog mechanical properties for cardiovascular tissue culturing. Biorheology. 45 (6), 651-661 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados