Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мульти-кий биореактор для оценки воспалительной и регенеративной способности биоматериалов в потоке и растяжении
* Эти авторы внесли равный вклад
В этой статье
Резюме
Целью этого протокола является выполнение динамической кокультуры макрофагов человека и миофибробластов в трубчатых электрораспыленных каркасах для исследования регенерации тканей, управляемой материалом, с использованием биореактора, который позволяет разъединять напряжение сдвига и циклическое растяжение.
Аннотация
Использование рассасывающихся биоматериалов для индуцирования регенерации непосредственно в организме является привлекательной стратегией с трансляционной точки зрения. Такие материалы вызывают воспалительную реакцию при имплантации, которая является движущей силой последующего рассасывания материала и регенерации новой ткани. Эта стратегия, также известная как тканевая инженерия in situ, преследуется для получения сердечно-сосудистых замен, таких как тканеинженерные сосудистые трансплантаты. Как воспалительные, так и регенеративные процессы определяются локальными биомеханическими сигналами на каркасе (т. Е. Напряжение растяжения и сдвига). Здесь мы подробно описываем использование специально разработанного биореактора, который уникально позволяет разъединичивать напряжение растяжения и сдвига на трубчатом каркасе. Это позволяет проводить систематическую и стандартизированную оценку воспалительной и регенеративной способности трубчатых каркасов под воздействием хорошо контролируемых механических нагрузок, что мы демонстрируем на основе динамического эксперимента по кокультуре с использованием макрофагов и миофибробластов человека. Подробно обсуждаются ключевые практические шаги в этом подходе — строительство и настройка биореактора, подготовка строительных лесов и посев клеток, применение и поддержание растяжения и сдвигового потока, а также сбор проб для анализа.
Введение
Сердечно-сосудистая тканевая инженерия (ТЭ) рассматривается в качестве альтернативного варианта лечения используемым в настоящее время постоянным сердечно-сосудистым протезам (например, сосудистым трансплантатам, заменам сердечных клапанов), которые являются неоптимальными для больших когорт пациентов1,2,3,4. К числу востребованных применений относятся тканеинженерные сосудистые трансплантаты (TEVG)5,6 и сердечные клапаны (TEHV)7,8. Чаще всего сердечно-сосудистые методологии ТЭ используют резорбируемые биоматериалы (природные или синтетические), которые служат поучительным каркасом для формирования новой ткани. Образование новой ткани может быть либо полностью спроектировано in vitro, путем засева каркаса клетками и культивирования в биореакторе перед имплантацией (in vitro TE)9,10,11,либо непосредственно in situ, в котором синтетический каркас имплантируется без предварительного культивирования, чтобы индуцировать образованиеновойткани непосредственно в организме (in situ TE)12,13,14. Как для in vitro, так и для in situ сердечно-сосудистого ПОДХОДА TE успешная функциональная регенерация в доминирующей степени зависит как от иммунного ответа хозяина на имплантированную конструкцию, так и от соответствующей биомеханической нагрузки.
Важность биомеханической нагрузки для сердечно-сосудистой ТЭ хорошо признана15. В случае сердечно-сосудистых имплантатов клетки, которые заполняют каркас, подвергаются циклическому растяжению и сдвиговым напряжениям, которые возникают в результате гемодинамической среды. Многочисленные исследования сообщали о стимулирующем влиянии (циклического) растяжения на образование компонентов матрицы, таких как коллаген16,17,18,19,гликозаминогликаны (GAGs)20и эластин21,22,различными типами клеток. Например, Huang et al. продемонстрировали, что двухосное растяжение повышает отложение и организацию коллагена и эластина в TEVG in vitro с помощью сосудистого биореактора23. В то время как акцент обычно делается на растяжении в качестве доминирующей нагрузки, в этих исследованиях часто используются биореакторы, управляемые потоком, в которых образец также подвергается сдвиговому потоку. Хотя относительно мало известно об изолированном влиянии сдвиговых напряжений на формирование тканей и воспаление в 3D, некоторые данные доступны. Например, Hinderer et al. и Eoh et al. продемонстрировали, что сдвиговой поток, в дополнение к микроструктуре 3D-каркаса, был важен для образования зрелого эластина клетками гладкой мускулатуры сосудов человека в модельной системе in vitro24,25. В целом, эти результаты иллюстрируют актуальность как циклического растяжения, так и сдвигового стресса для сердечно-сосудистой ТЭ.
Другим важным фактором, определяющим успех или неудачу имплантатов TE, является иммунный ответ хозяина на имплантированный трансплантат26. Это особенно важно для управляемых материалом стратегий IN situ TE, которые фактически полагаются на острую воспалительную реакцию на каркас, чтобы запустить последующие процессы клеточного притока и эндогенного образования и ремоделирования тканей27. Макрофаг является критическим инициатором функциональной регенерации тканей, что было показано многочисленными исследованиями28,29,30. По аналогии с заживлением ран, регенерация ткани регулируется паракринными сигналами между макрофагами и тканепродуцирующими клетками, такими как фибробласты и миофибробласты31,32,33. Помимо координации отложений новых тканей, макрофаги участвуют в активном рассасывательном рассасывание чужеродного каркасного материала34,35. Таким образом, реакция макрофагов in vitro на биоматериал была идентифицирована как прогностический параметр успеха in vivo имплантатов36,37,38.
Реакция макрофага на имплантированный каркас зависит от конструктивных особенностей каркаса, таких как состав материала и микроструктура35,39,40. В дополнение к свойствам каркаса, реакция макрофагов на каркас и их перекрестные помехи с миофибробластами также подвержена влиянию гемодинамических нагрузок. Например, было показано, что циклическое растяжение является важным модулятором фенотипа макрофагов41,42,43,44 и секреции цитокинов43,44,45,46 в 3D электроотращенные каркасы. Используя систему кокультуры макрофагов и гладкомышечных клеток сосудов, Battiston et al. продемонстрировали, что присутствие макрофагов привело к повышению уровня эластина и ГАГ и что умеренные уровни циклического растяжения (1,07–1,10) стимулировали отложение коллагена I и эластина47. В предыдущих работах мы продемонстрировали, что напряжение сдвига является важным фактором, определяющим рекрутирование моноцитов в 3D-электроспыляющие каркасы48,49,и что как напряжение сдвига, так и циклическое растяжение влияют на паракринную сигнализацию между моноцитами человека и мезенхимальными стромальными клетками50. Fahy et al. продемонстрировали, что сдвиговой поток увеличивает секрецию провоспалительных цитокинов моноцитами человека51.
Взятые вместе, приведенные выше данные показывают, что адекватное понимание и контроль гемодинамических нагрузок имеет решающее значение для сердечно-сосудистого ТЭ, и что для достижения этого важно учитывать воспалительную реакцию. Многочисленные биореакторы были описаны ранее для культуры сердечно-сосудистых тканей invitro52, 53, 54,55, 56,57,58 или ex vivo59,60,61. Однако все эти системы предназначены для того, чтобы максимально имитировать физиологические условия гемодинамической нагрузки. Хотя это очень ценно для целей создания сердечно-сосудистых тканей in vitro или поддержания культур ex vivo, такие системы не позволяют систематически проводить исследования индивидуальных эффектов отдельных сигналов. Это связано с тем, что применение как циклического растяжения, так и напряжения сдвига в этих биореакторах обусловлено тем же потоком под давлением, который неразрывно связывает их. В то время как микросистемы, которые позволяют точно манипулировать несколькими сигналами, были описаны для 2D-подложек62 или 3D-гидрогелевых установок63,64,такие установки не позволяют включать эластомерные 3D-биоматериальные каркасы.
Здесь мы представляем применение системы трубчатого биореактора, которая уникально позволяет разъединить напряжение сдвига и циклическое растяжение и помогает механистически исследовать их индивидуальные и комбинированные эффекты. Эта система позволяет тестировать широкий спектр тканеинженерных сосудистых трансплантатов (например, синтетического или природного происхождения, различной микроамхитектуры, различной пористости). Чтобы эффективно разъединить применение напряжения сдвига и растяжения, ключевыми концепциями, которые использует биореактор, являются (1) разделение контроля напряжения сдвига и растяжения с использованием различных насосных систем и (2) стимуляция лесов «наизнанку» с вычислительными размерами. Поток подается на внешнюю поверхность трубчатого каркаса с помощью проточного насоса, тогда как окружное растяжение каркаса индуцируется путем расширения силиконовой трубки, на которой установлен каркас с помощью отдельного тензометрического насоса. Размеры силиконовой трубки и стеклянной трубки, содержащей конструкцию, тщательно выбираются и проверяются с использованием вычислительного моделирования гидродинамики, чтобы гарантировать, что напряжение сдвига на каркасе (из-за потока) и окружное растяжение (из-за расширения трубы) существенно не влияют друг на друга. Этот дизайн имеет несколько практических обоснований. Если растяжение применяется давлением просветной жидкости (аналогично физиологической нагрузке), это по своей сути требует, чтобы конструкция образца была безтекания. Кроме того, давление, необходимое для растяжения образца, будет полностью определяться жесткостью образца, которая может варьироваться между образцами и внутри образца с течением времени, что затрудняет контроль растяжения. Этот биореактор монтирует тканеинженерный трансплантат вокруг силиконовой трубки и позволяет наносить напряжение сдвига стенки (WSS) на внешнюю стенку трансплантата и создавать давление на трансплантат изнутри. Таким образом, могут быть обеспечены равные условия нагрузки между образцами и внутри образцов с течением времени, и, кроме того, образцы допускаются к протекающей, как это характерно для пористых сосудистых каркасов19. Этот биореактор специально предназначен для систематических исследований эффектов сдвига и / или растяжения, а не для инженерии нативного кровеносного сосуда in vitro, для которого более подходят традиционные настройки сосудистого биореактора. См. рисунок 1A–B для проектных чертежей биореактора и соответствующую таблицу 1 для функционального описания и обоснования основных компонентов биореактора.
Применение биореактора продемонстрировано на основе серии недавних исследований нашей группы, в которых мы исследовали индивидуальные и комбинированные влияния сдвигового напряжения и циклического растяжения на воспаление и образование тканей в рассасывающихся электроспыляемых каркасах для сердечно-сосудистой ткани in situ19,43,44. С этой целью мы использовали человеческие макрофаги и миофибробласты либо в моно-, либо в кокультуре для моделирования различных фаз регенеративного каскада in situ. Мы продемонстрировали, что на секрецию цитокинов макрофагами человека отчетливо влияют как циклическое растяжение, так и напряжение сдвига, влияя на отложение матрицы и организацию миофибробластов человека в этих каркасах, как через паракринную сигнализацию, так и через прямой контакт19,43,44. Примечательно, что эти исследования показали, что в случае комбинированного применения напряжения сдвига и растяжения влияние на формирование тканей и воспаление либо преобладает одна из двух нагрузок, либо существуют синергетические эффекты обеих нагрузок. Эти результаты иллюстрируют актуальность разъединения обеих нагрузок для лучшего понимания вклада механической среды в процессы ТЭ. Это понимание может быть применено для систематической оптимизации конструктивных параметров каркасов в соответствующих режимах гемодинамической нагрузки. Кроме того, механистические данные из таких хорошо контролируемых сред могут служить исходными данными для численных моделей, которые разрабатываются для прогнозирования хода ремоделирования тканей in situ, как недавно сообщалось для TEVG65 или TEHVs66,для дальнейшего улучшения прогностической способности.
протокол
В исследованиях, описанных в этом протоколе, использовались первичные макрофаги человека, выделенные из периферической крови, и миофибробласты человека, выделенные из подкожной вены после коронарной шунтирования44. Пальто были получены от здоровых, анонимных добровольцев, которые предоставили письменное информированное согласие, которое было одобрено Научно-исследовательским комитетом по медицинской этике Санкуина. Использование клеток человеческой вены (HVSC) соответствовало «Кодексу надлежащего вторичного использования тканей человека», разработанного Федерацией медицинских обществ (FMWV) в Нидерландах.
1. Общие приготовления и необходимые действия перед установкой биореактора
ПРИМЕЧАНИЕ: Для получения подробной информации о соответствующих протоколах изоляции и культивирования, пожалуйста, обратитесь к более ранней работе19,43,44. Все расчеты в протоколе приведены в качестве примеров для эксперимента с кокультурой с моноцитами и миофибробластами, засеянными в 8 гемодинамически нагруженных каркасах и 2 статических контроле (n=10).
- Начните изоляцию клеток и культивиляцию клеток. Плотность посева совместно культивированных образцов моноцитов и миофибробластов (с соотношением посева 2:1) составляет 30 × 106 моноцитов/см3 и15 × 106 миофибробластов/см3 соответственно.
ПРИМЕЧАНИЕ: Электрораспыляемый материал имеет высокую пористость (>90%). Для оценки необходимого количества клеток на трансплантат рассчитывается объем каркаса по формуле объема полого цилиндра: π*(толщина)2*длина≈ 0,04см3. Общее количество клеток на трансплантат составляет 1,2 × 106 моноцитов и 0,6 × 106 миофибробластов. Для 10 образцов требуется не менее 12 ×10 6 моноцитов и 6 × 106 миофибробластов; начните с ~10–15% больше ячеек, чтобы учесть возможные ошибки пипетирования. - Дегазировать среду клеточной культуры, которая будет использоваться для экспериментов с участием биореактора.
- Подготовьте среду для кокультур, которая состоит из RPMI-1640:aDMEM (1:1), дополненного 10% фетальной бычим сывороткой, 1% пенициллин-стрептомицином и 0,5% L-глутамином.
- Поместите среду на ночь (O/N) в инкубатор в колбу для клеточной культуры с фильтрующим колпачком для дегазации.
- Замените крышку фильтра герметичной крышкой и храните при 4 °C.
- Непосредственно перед использованием добавьте в среду 0,25 мг/мл L-аскорбиновой кислоты 2-фосфата (витамина С).
ПРИМЕЧАНИЕ: Для расчетов количество среды, требуемое на проточную культурную камеру, составляет 50 мл. Обновляйте носитель три раза в неделю; Старая среда 25 мл заменяется свежей средой объемом 25 мл. Для 10 образцов; после посева требуется в общей сложности 500 мл свежей среды, а для каждой последующей смены среды используется в общей сложности 250 мл свежей среды. Всегда готовьте среду свежей, особенно, витамин С следует добавлять непосредственно перед сменой среды.
- Подготовьте изотропные электроотращенные каркасы (диаметр просвета 3 мм, толщина стенки 200 мкм), как описано Van Haaften et al.19 (рисунок 1G–I). Вкратце, трубчатые каркасы из поликапролактон бисмочевины (PCL-BU) производятся электроспиннингом из 15% (мас./мас.) хлороформ-полимерных растворов. Полимерные растворы представляют собой электроотверживаемость при комнатной температуре и 30% относительной влажности, при расходе 40 мкл/мин, расстоянии 16 см от вращающейся цилиндрической мишени (Ø 3 мм, 500 об/мин) и приложенном напряжении 16 кВ на электроспинизирующем сопле и -1 кВ на мишень.
ПРИМЕЧАНИЕ: Хотя для этих экспериментов использовались трансплантаты PCL-BU, в этом биореакторе может быть установлено большое разнообразие эластомерных тканевых инженерных трансплантатов (например, различного синтетического или природного происхождения, различной микроархитектура, разной пористости)- Снимите электрораскускамы с оправки.
- Сделайте небольшое отверстие в колпачке трубки 15 мл, чтобы «удерживать» оправку в центре и предотвращать ее касание стенки трубки.
- Поместите оправку с электрораскупеченным каркасом в соколиную трубку и заполните ее деионизированной водой.
- Заморозьте трубы O/N при -20 °C.
- Поместите трубки при комнатной температуре (RT) и вытащите оповорочные оздоровки через несколько минут, оставив электропрядные трансплантаты во льду.
- Дайте льду полностью оттаять, извлеките электропрядную трубку из талой воды и «повисните» вертикально в течение нескольких часов. Убедитесь, что строительные леса не «разрушаются» под собственным весом.
- Сухие строительные леса под вакуумом O/N.
- Изобразите небольшой образец электропрядных трансплантатов с помощью сканирующей электронной микроскопии (SEM) для оценки их микроструктуры (например, морфологии волокна, диаметра волокна). Трансплантаты в примерах исследований имеют изотропную ориентацию волокна и диаметр волокна 5 мкм(Рисунок 1H–I).
- Снимите электрораскускамы с оправки.
- За день до начала эксперимента поместите в инкубатор гидравлический резервуар, наполненный деионизированной водой. Закройте все восемь соединений для камер проточной культуры белыми колпачками Luer. Подключитесь к системе сжатого воздуха и вставьте датчик давления. Запустите тензометровый насос (см. шаг 5.6) O/N, чтобы обеспечить небольшое расширение сильфонового сильфона.
ПРИМЕЧАНИЕ: Убедитесь, что все необходимые материалы и оборудование очищены и/или автоклавированы (см. Таблицу материалов,колонку «Комментарии/описание», для которой материалы разрешены к автоклаву), в соответствии с протоколом производителя или как описано в шагах 7.3–7.6. - Обеспечьте стерильные условия труда для остальной части протокола.
- Выполните шаги 2–5.3 (настройка системы), шаг 6.3 (изменение среды) и шаги 7.1–7.2 (сбор сосудистых конструкций) в стерильном ламинарной проточке.
- Поместите материалы, которые непосредственно не нужны для последующих этапов, в закрытую чашку Петри, чтобы все было как можно более чистым.
- Регулярно очищайте или сухие поверхности материала, замачив бумажную салфетку 70% этанолом, и протирайте поверхности компонентов биореактора и шкафа ламинарного потока.
2. Настройка биореактора
ПРИМЕЧАНИЕ: Выполните шаг 2 в ламинарной проточной шкафу.
- Разрежьте электрораскупись каркасов на трубки длиной около 25 мм и задокументируйте их перед использованием (например, сфотографируйте по длине, взвесьте с весами для начальной массы).
- Обеззаражить электрораспись лесов.
- Поместите наклоненные электрораскушенные леса в колодезную пластину или чашку Петри с одним отверстием, обращенным к источнику ультрафиолетового (УФ) света, чтобы ультрафиолетовый свет (253,7 нм) освещал внутреннюю часть лесов.
- Подвергайте электрораскупягденные леса воздействию ультрафиолетового излучения в течение 5 минут.
- Поверните все строительные леса и повторите ультрафиолетовое освещение для другого отверстия.
ПРИМЕЧАНИЕ: После этого шага прикасайтесь к электрорасписьму, когда это необходимо, только когда это необходимо. Всегда используйте чистый пинцет или чистые перчатки. - Возьмите стеклянные трубки камер проточной культуры, которые хранятся в 70%, вымойте стеклянные трубки в сверхчистой воде, высушите и поместите в большую закрытую чашку Петри.
ПРИМЕЧАНИЕ: Следующие шаги, особенно шаги 2.3–2.5, в идеале выполняются двумя экспериментаторами.
- Установите электрораскрутные каркасы на силиконовую трубку.
- Прикрепите проленовый шов 5-0 к одному концу силиконовой трубки, взяв шов через одну сторону трубки и из другой, оставив два противоположных натянутых шва, охватывающих поперечное сечение трубки. Сделайте небольшой узел с обеих сторон трубки, сжимая трубку в локусе узлов и оставьте примерно 10 см проволоки на обоих узлах. Сделайте третий узел на конце двух оставшихся проводов по 10 см.
- Отрежьте шовную иглу и все свободные нити, которые могут торчать и повредить внутреннюю часть электрораскупясывного каркаса. Отрежьте края силиконовой трубки в треугольную форму, чтобы помочь в протягивании силиконовой трубки через электрораскуплавной каркас.
- Окуните электроспыляющий каркас в 30% этанол (это служит дополнительным этапом дезактивации и помогает скользить по электроплитым каркасам по силиконовой трубке) и поместите электроспыляющий каркас на свободный 10-сантиметровый провод. Экспериментатор А растягивает силиконовую трубку, осторожно натягивая как силиконовую трубку, так и узел 10-сантиметровой шовной проволоки, в то время как экспериментатор Б осторожно скользит электрораскушенным каркасом по силиконовой трубке с помощью пинцета с гладким внутренним наконечником, чтобы предотвратить повреждение лесов.
- Медленно отпустите растяжку на силиконовой трубке, одновременно сглаживая электрораскушенный каркас пинцетом. Окуните электрораспыляющийся каркас на силиконовую трубку в сверхчистую воду два раза.
ПРИМЕЧАНИЕ: Возможно, что происходит некоторое сморщивание электроспылявого каркаса. Это сморщивание исчезнет во время нанесенного предварительного растяжения непосредственно перед фиксацией каркасов на трубопроводах давления на этапе 2.5.3. - Повторите шаги 2.3.2 и 2.3.3 для других электрораскуплавкиваных лесов. В зависимости от длины силиконовых труб на одной и той же силиконовой трубке могут быть установлены несколько электроплиновых каркасов.
- Когда все электрораскручиваемые каркасы установлены на силиконовых трубках, разрежьте силиконовые трубки вокруг лесов, все на одинаковую длину (5,5 см); с одной стороны, близко к концу электрораскунутого каркаса, с другой стороны, оставляя ~2–3 см свободной силиконовой трубки.
- Прикрепите проленовый шов 5-0 к одному концу силиконовой трубки, взяв шов через одну сторону трубки и из другой, оставив два противоположных натянутых шва, охватывающих поперечное сечение трубки. Сделайте небольшой узел с обеих сторон трубки, сжимая трубку в локусе узлов и оставьте примерно 10 см проволоки на обоих узлах. Сделайте третий узел на конце двух оставшихся проводов по 10 см.
- Постройте нижний отсек камеры проточной культуры(рис. 1А–В).
- Возьмите верхнюю часть нижнего отсека, содержащую выходное отверстие потока, и закройте выход потока пробкой Luer.
- Протолкните напорный трубопровод с отверстиями через нижний отсек и поместите силиконовое уплотнительное кольцо вокруг нижнего конца напорного трубопровода, чтобы предотвратить утечку. Прикрутите нижнюю часть нижнего отсека к верхней части нижнего отсека, чтобы закрепить напорный трубопровод. Убедитесь, что нижняя гравированная канавка напорного трубопровода находится примерно на 3–5 мм выше края переходной втулки нижнего отсека; это позже «удержит» плотный узел шовной проволоки, закрепив электрописьковый каркас над силиконовой трубкой.
ПРИМЕЧАНИЕ: Если напорный трубопровод можно легко маневрировать вверх и вниз, это указывает на то, что нижний отсек плохо закреплен. Повторите шаг 2.4.2 для предотвращения утечки на более поздних стадиях(рисунок 2D).
- Закрепите силиконовую трубку электрорасписьем к напорным трубопроводу.
- Потяните силиконовую трубку с электрораспущенным каркасом над напорным трубопроводом.
- Сделайте узел со шовной проволокой на нижнем конце электрораскупорного каркаса в месте расположения выгравированной канавки на нажимном трубопроводе. Сделайте второй узел на противоположной стороне, чтобы плотно закрепить силиконовую трубку электропрядным трансплантатом.
ВНИМАНИЕ: Это критический шаг. Убедитесь, что узел точно «падает» в гравированную канавку напорного трубопровода, чтобы предотвратить утечку воды из гидравлического резервуара в камеры проточной культуры. Если вы не уверены, попробуйте затянуть шовную проволоку в нескольких положениях, выше или ниже ожидаемого расположения канавки, чтобы убедиться, что конечные узлы находятся точно на гравированной канавке(рисунок 2A). - Поместите ножничный зажим на верхний конец силиконовой трубки и растяните силиконовую трубку вверх (это напрямую проверит первый узел, если есть возможность переместить силиконовую трубку с электроспыляющим каркасом над напорным трубопроводом, она не была затянута достаточно хорошо). С тяговым усилием силиконовая трубка предварительно растягивается. Чтобы силиконовые трубки соответствовали различным образцам, прикрепите линейку к ножничному зажиму. Потяните ножничный зажим вверх, пока нижний конец линейки не достигнет высоты нижнего конца леса.
ПРИМЕЧАНИЕ: Важно, чтобы предварительное растяжение в каждом образце было примерно одинаковым (~5%) по двум причинам: (1) если силиконовая трубка предварительно растягивается, это приведет к более однородному расширению по длине образца под давлением; (2) предварительное растяжение будет влиять на механические свойства силикона, поэтому оно должно быть одинаковым во всех образцах, чтобы обеспечить равные условия растяжения между образцами. - Удалите морщины на электроспыливом каркасе, осторожно потянув за электроспыляемый каркас. Опять же, сделайте два узла с обеих сторон шовной проволокой на верхнем конце каркаса в месте расположения верхней гравированной канавки на напорном трубопроводе.
- Отпустите ножничный зажим и отрежьте ножом избыток силиконовой трубки, оставив 20–30% резьбы винта покрытой силиконовой трубкой, чтобы предотвратить утечку, когда носовой конус установлен на резьбе винта.
ПРИМЕЧАНИЕ: Повторите шаги 2.4 и 2.5 для всех динамических выборок. - Для статических контрольных образцов закрепите электрораспись, установленную на силиконовой трубке, на напорных трубопроводах без отверстий. Эти трубопроводы могут храниться отдельно в трубке объемом 15 мл до посева (этап 4) и не должны быть установлены в отсеках камеры проточной культуры.
- Обеззараживайте частично построенные камеры проточной культуры электрораспуклым каркасом, подвергая его воздействию ультрафиолетового излучения в течение 10 минут. Поверните камеры проточной культуры с электрораскручиваемыми каркасами на другую сторону и повторите воздействие ультрафиолетового света в течение 10 минут.
- Прикрутите носовые конусы на винтовой резьбе нажимных трубопроводов с отверстиями для динамических образцов.
- Убедитесь, что верхний конец силиконовой трубки вписывается в носовой конус, чтобы предотвратить утечку на более поздних стадиях. Если силиконовых трубок слишком много, отрежьте излишки трубки ножом.
- Поместите частично построенные камеры проточной культуры в большую чашку Петри и направьте носовой конус к источнику ультрафиолетового света. Нанесите УФ-подсветку на 5 мин.
- Полная конструкция камеры проточной культуры со стеклянной трубкой и верхним отсеком камеры проточной культуры(рисунок 1А–В).
- Предварительно смочите электрораспылительные каркасы, окунув напорный трубопровод с силиконовой трубкой и электроспыливым каркасом в 30% этанол, а затем дважды окунитесь в сверхчистую воду.
- Поместите стеклянную трубку над напорным трубопроводом, осторожно надавите на нижний отсек и аккуратно закрепите его.
- Возьмите верхний отсек, содержащий входное отверстие потока, поместите силиконовое уплотнительное кольцо, выпрямитель потока и втулку адаптера в правильномпорядке (рисунок 1A–B),поместите поверх открытого конца стеклянной трубки и аккуратно закрепите ее.
- Прикрутите белый колпачок Luer к входному отверстию верхнего отсека.
- Снимите мужскую пробку Luer с выходного отверстия из нижнего отсека и очистите поверхность вокруг нее с помощью пропитанной этанолом бумажной салфетки.
- Поместите шприц с 10 мл сверхчистой воды в выходное отверстие потока, откройте белый колпачок Luer в верхнем отсеке и наполните камеру сверхчистой водой. Снова закройте белый колпачок Luer, снимите шприц, снова очистите этанолом и закройте выход потока мужской пробкой Luer.
ПРИМЕЧАНИЕ: Повторите шаги 2.6–2.8 для всех камер проточной культуры. - Для статических элементов управления добавьте 10 мл сверхчистой воды в трубки 15 мл, в которые удерживаются образцы, установленные на напорных трубопроводах без отверстий.
- Поместите все камеры проточной культуры в инкубатор. Замените сверхчистую воду питательной средой за день до посева клеток таким же образом, как описано в шагах 2.8.5 и 2.8.6 (убедитесь, что вы собрали «старую» сверхчистую воду с пропитанной этанолом бумажной салфеткой, помещенной непосредственно на выход потока).
[Протокол может быть приостановлен здесь]
3. Подготовка к настройке протокового насоса
ПРИМЕЧАНИЕ: Выполните шаг 3 в ламинарной проточной шкафу.
- Соберите все материалы для настройки насоса и подготовьтесь к использованию.
ПРИМЕЧАНИЕ: Экспериментаторы ссылаются на протокол производителя для подробного описания настройки насоса, жидкостных блоков и средних труб через клапаны жидкостного блока.- Установите насос на мощность 200 мбар.
- Прикрутите держатели резервуаров для резервуаров по 60 мл к жидкостным блокам.
- Очистите многоразовые резиновые воздушные фильтры бумажной салфеткой, пропитанной этанолом, убедитесь, что воздушный фильтр остается сухим.
- Поместите резервуары объемом 60 мл в держатели резервуаров и поместите стандартную среднюю трубку через клапаны жидкостного блока. Соедините среднюю трубку с большим внутренним диаметром с помощью муфт с замком Luer в закрытую петлю.
- Зажмите среднюю трубку с помощью зажима шланга, непосредственно под резервуарами.
- Заполните резервуары 25 мл питательной среды на 60 мл резервуара. Отпустите зажим шланга и впустите среду в трубку.
- Закройте резервуары для среды резиновыми воздушными фильтрами и поместите установку протокового насоса в инкубатор до шага 4.
4. Посев клеток с использованием фибрина в качестве носителя клеток
ПРИМЕЧАНИЕ: Выполните шаг 4 в ламинарной проточной шкафу.
- Подготовьте фибриновый гель для этапа посева клеток. Для получения подробной информации см. Mol et al.67 Для геля фибрина раствор фибриногена должен иметь конечную концентрацию 10 мг/мл (с точностью до чистоты белкового запаса), а раствор тромбина должен иметь конечную концентрацию 10 Ед/мл.
- Разморозить фибриноген до РТ, перед взвешиванием ~50 мг (достаточно для 10 образцов) в пластиковой таре с красной крышкой.
- Добавляют клеточную культурную среду для приготовления раствора фибриногена (в концентрации 10 мг/мл, скорректировать по чистоте белкового запаса). Хорошо перемешайте и процедините для стерилизации раствора фибриногена шприцевым фильтром 0,2 мкм в стерильную трубку 15 мл. Процедить отфильтрованный раствор фибриногена на льду.
ПРИМЕЧАНИЕ: Избегайте приготовления раствора фибриногена слишком долго заранее, иначе фибриноген может сгущаться спонтанно. - Разморозить тромбин и сделать раствор тромбина (в концентрации 10 Ед/мл) в клеточной культурной среде и поместить на лед. Готовят 20 мкл раствора тромбина + клеток на образец. Для n=10 образцов необходимо 200 мкл; поэтому приготовьте 250 мкл раствора тромбина для учета возможных ошибок пипетирования.
- Соберите и подсчитайте клетки из колбы культуры. Смешайте клетки в нужном соотношении и количестве (1,2 × 106 моноцитов и 0,6 × 106 миофибробластов на каркас). Убедитесь, что для n+1 образцов достаточно ячеек для исправления ошибок пипетки. Центрифуга при 350 × г в течение 10 мин при РТ. Удалите супернатант.
- Делают смесь взвешенных клеток и тромбина.
- Для каждого образца используют 20 мкл раствора тромбина. Для n=10 образцов добавьте 200 мкл тромбина в гранулу клетки и перемешайте. Измерьте объем клеточной суспензии (клетки + тромбин) и рассчитайте, как равномерно делить по всем 10 каркасам (например, если тромбин + клеточная суспензия имеет объем 260 мкл, каждый образец электроспыли получит 260 мкл / 10 образцов = 26 мкл тромбина + клеточная суспензия).
- Поскольку посев каркасов выполняется в два этапа, подготовьте две микрофьюж-трубки по 1,5 мл, которые будут удерживать половину клеточной суспензии для каждого каркаса (в примере расчета предыдущего этапа: подготовьте две трубки с 13 мкл тромбина + клеточная суспензия). Место на льду.
ПРИМЕЧАНИЕ: Следующие шаги, особенно шаг 4.4, в идеале выполняются двумя экспериментаторами.
- Высушите предварительно смачиваемые электрораспыливающиеся каркасы вакуумом, чтобы подготовиться к посеву клеток.
- Подключите стеклянную пипетку Пастера к вакуумной системе ламинарного протока и поместите в пустую трубку объемом 50 мл для стерильного временного хранения.
- Возьмите камеры для проточной культуры из инкубатора, извлеките мужскую пробку Luer из выходного отверстия потока и удалите среду после открытия белого колпачка Luer и размещения пропитанной этанолом бумажной салфетки перед выходом потока.
- Сняйте верхний отсек и стеклянную трубку, и поместите в стерильную чашку Петри для временного хранения.
- Поместите вакуумную пипетку Пастера на электрораспыливчатый каркас и удалите как можно больше среды.
ВНИМАНИЕ: Очень осторожно высушите электропрядный каркас в вакууме. Вместо линейного движения вперед и назад над каркасом поместите вакуумную пипетку в нескольких местах. Зажмите вакуумную трубку поверх пипетки Пастера между пальцами для лучшего контроля. - Смешайте раствор фибриногена в соотношении 1:1 с тромбином + клеточной суспензией (например, смешайте 13 мкл фибриногена с 13 мкл тромбина + клеточная суспензия). Чтобы убедиться, что фибрин полимеризуется в каркасе, а не в микрофьюжной трубке, пипетируйте фибриноген, поверните колесо пипетки для «дополнительного объема» суспензии тромбина + клетки и пипетируйте вверх и вниз один раз в микрофьюжной трубке с клеточной суспензией для смешивания.
- Непосредственно однородно капают раствор по всей длине электрораспыливного каркаса. Рекомендуется, чтобы экспериментатор А капнул смесь фибрина, в то время как экспериментатор В удерживает нижний отсек с электрораспыленным каркасом, установленным на напорном трубопроводе.
- После того, как фибрин с клетками капает на электрооткинутый каркас, экспериментатор В медленно перемещает каркас слева направо, вверх и вниз, чтобы еще больше разделить клетки равномерно по каркасу.
- Повторите шаг 4.4.5 - 4.4.7 на другой стороне электрораспыляемого каркаса.
- Снова установите камеру проточной культуры, осторожно поместив стеклянную трубку (предотвратите прилипание фибрина и свертывание на внутренней стороне стеклянной трубки), и отодвиньте верхний отсек камеры проточной культуры. Непосредственно поместите семенную конструкцию без какой-либо среды или фосфатно-буферного физиологического раствора (PBS) в камеру проточной культуры в инкубаторе.
- Повторите шаги 4.4.1–4.4.9 для всех динамических образцов. Для статических образцов, установленных на трубопроводах под давлением без отверстий, семена в соответствии с этапами 4.4.1–4.4.8 и затем помещают в трубку 15 мл.
- Дайте фибрину полимеризоваться в течение 60 мин в инкубаторе.
[Протокол здесь можно приостановить на 30–60 минут.]
- После полимеризации заполните камеры проточной культуры (динамические образцы) или трубки объемом 15 мл (статические образцы) средой.
5. Соединение биореактора и систем проточные насосы перед началом эксперимента
ПРИМЕЧАНИЕ: Выполните шаги 5.1–5.3 в ламинарной проточной шкафу.
- Возьмите лоток, несущий камеры проточной культуры и жидкостные блоки с заполненными резервуарами для среды и подключенными средними трубками внутри ламинарных шкафов потока.
- Расположите камеры проточной культуры на основании биореактора для экспериментальных групп, нагруженных циклическим растяжением и с комбинированными гемодинамическими нагрузками(рис. 1Е).
- Наклоните камеру проточной культуры вверх дном, а напорный трубопровод снизу заполните сверхчистой водой с помощью шприца с тонкой трубкой (это может быть любого типа, если она гибкая и тонкая, в этом эксперименте к игле была прикреплена проволока внутреннего диаметра 10 см, внутреннего диаметра 0,15 мм).
- Поместите тонкую трубку внутрь напорного трубопровода, и пока напорный трубопровод заполняется сверхчистой водой, постепенно выталкивая воду из шприца, одновременно вытяните проволоку из напорного трубопровода, чтобы убедиться, что внутри напорного трубопровода нет пузырьков воздуха.
- Поместите камеру проточной культуры на одну из восьми резьбовых винтов на основании биореактора. Поместите силиконовое уплотнительное кольцо между основанием биореактора и белым разъемом Luer, чтобы предотвратить возможную утечку, и затяните белый разъем Luer из нижнего отсека.
- Повторите шаги 5.2.2 и 5.2.3 для всех циклически растянутых образцов.
- Подключите камеры проточной культуры для всех экспериментальных групп, кроме статического управления, к системе протокового насоса.
- Поместите зажим шланга на среднюю трубку. Снимите белый колпачок Luer, закрывающий входное отверстие верхнего отсека камеры проточной культуры. Снимите соединительную муфту Luer из средней трубки и соедините среднюю трубку с одной стороны с впускным отверстием в верхнем отсеке, а с другой стороны средней трубки с выходом потока в нижнем отсеке.
- Повторите шаг 5.3.1 для всех камер проточной культуры. В этот момент биореактор и камеры проточной культуры заполняются средой и подключаются к системам потока.
- Для статических контрольных образцов поместите образцы вертикально в колбу для клеточных культур с фильтрующим колпачком с помощью ножничного зажима. Наполните колбу для посева клеток средой и поместите в инкубатор.
- Перенесите полную установку из ламинарного проточного шкафа в инкубатор и подключите жидкостные блоки к трубке давления воздуха и электрическому кабелю.
- Запустите программное обеспечение и инициализируйте протоочиваемые насосы. Запустите поток среды для образцов один за другом.
- Проверьте, щелкают ли клапаны жидкостного блока.
- Снимите зажим шланга со средней трубки.
- Запустите протоку с 100 мбар и временем переключения 10 с.
- Тщательно проверьте направление потока на наличие возможных утечек или пузырьков воздуха. Любые захваченные пузырьки воздуха можно удалить, перевернув камеру проточной культуры вверх дном.
ПРИМЕЧАНИЕ: Убедитесь, что средние уровни в резервуарах среды сбалансированы, чтобы предотвратить всасывание воздуха в систему и пузырьки воздуха в камерах проточной культуры, и не дать резервуарам высохнуть(рисунок 2C). - Повторите шаг 5.5 для всех жидкостных блоков по одному.
- Инициализируйте тензометрный насос.
- Подключите пневматический приводной насос через воздухопускное отверстие пневматического цилиндра к сжатому воздуху. Соедините нижнее воздушное отверстие с синей трубкой для выхода воздуха(рисунок 1F).
- Откройте программное обеспечение LabVIEW, запустите скрипт LabVIEW и систему применения давления сжатого воздуха, как описано Van Kelle et al.68,введите смещение и частоту (начните с низкой частоты 0,2 Гц). Приостановите работу насоса, когда сильфон тефлона находится на самом низком уровне.
- Поместите датчик давления во вход датчика давления на гидравлическом резервуаре.
- Измените настройки насоса на нужные (для 1,5 Па, используйте 150 мбар, время переключения 10 с).
- Запустите тензометрические насосы и примените предпочтительную настройку (например, 0,5 Гц, растяжение 1,05).
6. Запуск эксперимента в течение нескольких дней; Мониторинг сдвига и растяжения при посеве и замене среды
- Рассчитайте WSS на стене строительных лесов.
- Записывайте величину потока через день (подробности см. в руководстве производителя протокового насоса). Короче говоря, наблюдайте за изменением уровня жидкости (в мл) в средних резервуарах между переключением резервуара жидкостного блока в течение 10 с. Проведите не менее пяти измерений, рассчитайте среднее значение и умножьте на 6, чтобы получить расход Q в мл/мин.
- Поток описывается потоком Пуазёйя через кольцевой канал. Предполагая, что культуральная среда является ньютоновской жидкостью, вычислите WSS на стенке каркаса, r1,по уравнению 1.
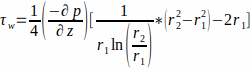 (1)
(1)
где WSS τw на стенке каркаса(r1;здесь r1 = 1,7 мм), возникающий в результате постоянного потока, определяется приложенным давлением p и внутренним радиусом стеклянной трубки r2 (здесь r2 = 2,3 мм). Предполагается, что градиент давления в осевом направлении является равномерным между входом и выходом потока и задается уравнением 2(рисунок 1J).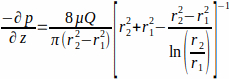 (2)
(2)
с μ динамической вязкости (здесь вязкость среды предполагалась постоянной, μ = 0,7 × 10-3 Па∙с при 37 °С) и Q приложенного расхода.
- Следите за растяжением, нанесенным на строительные леса через день.
- Поместите темный фон за камерой культуры потока, чтобы увеличить контраст между каркасом и фоном. Расположите светодиодные лампы, направленные на строительный лес, чтобы помочь визуализации строительных лесов.
- Сделайте покадровые фотографии строительных лесов на частоте 30 Гц в течение 6 с (т.е. 3 цикла растяжения) с помощью высокоскоростной камеры.
ПРИМЕЧАНИЕ: Более низкой частоты записи может быть достаточно, если камера позволяет. Однако минимально требуемая частота не была определена. - Вручную определите минимальный и максимальный диаметр каркаса по изображениям.
- Рассчитайте минимальный и максимальный внешний диаметр электроплитного каркаса для расчета максимальных растяжек в соответствии с уравнением 3.
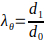 (3)
(3)
где окружное растяжение(λθ)задается отношением между внешним диаметром каркаса, d1,и его начальным диаметром, d0.
- Корректировать среднее испарение и обновлять среду три раза в неделю.
- Остановите и разъедините кабели для проточных систем и тензометрового насоса.
- Поместите зажимы шлангов на среднюю трубку.
- Определить, сколько среды испарилась, исходя из оценок индикатора объема на средних резервуарах.
- Перенесите лоток с биореактором и жидкостными блоками в ламинарный проточный шкаф.
- Снимите резиновые воздушные фильтры из резервуаров среды; добавить автоклавную сверхчистую воду, чтобы компенсировать испаривённый объем среды. Снова закройте резервуары для среды и снова подключитесь к насосу, чтобы смешать среду со сверхчистой водой.
- Повторите шаги 6.3.1–6.3.5. Снова снимите резиновые воздушные фильтры, выньте 25 мл питательной среды и открутите при 300 × г в течение 5 мин при РТ.
- Собирают 1,5 мл супернатанта и хранят при -30 °C для анализа секреторных профилей (для анализа с помощью иммуноферментного анализа (ИФА)).
- Соберите желаемый объем супернатанта для паракринных сигнальных исследований, используя супернатант в качестве условной среды43.
- Добавьте 25 мл свежей среды в резервуары среды.
- Поместите резиновые воздушные фильтры обратно на средние резервуары.
- Поместите полную настройку обратно в инкубатор; подключите все кабели и воздушные трубки к насосу и тензометру. Отпустите зажимы шланга и повторите шаги 5.4–5.8.
- Проверьте, являются ли шарики для сушки кремнезема в сушильных бутылках, подключенных к насосу, влажными (белый вид), и замените их сухими кварцевыми шариками, если это необходимо (оранжевый вид).
7. Завершение эксперимента, сбор образцов, очистка и хранение оборудования
- В последний день эксперимента скорректируйте испарение среды, как описано в шагах 6.3.1–6.3.5, и соберите образцы по одному.
- Чтобы собрать образцы один за другом, проточные насосы и тензометрические насосы необходимо несколько раз приостановить. Поместите зажим шланга на среднюю трубку. Временно остановите протоочный насос и тензометрный насос. Отсоедините одну камеру проточной культуры от основания биореактора; заменить белым колпачком Luer на основании биореактора. Отоберите камеру проточной культуры и жидкостный блок в ламинарную проточную камеру. Снова запустите проточные насосы и насос деформации, чтобы применить гемодинамическую нагрузку к другим образцам до сбора урожая.
- Соберите среду из резервуаров среды для анализа производства паракринных цитокинов с помощью ИФА.
- Разъедвляйте проточные агрегаты и трубчатую конструкцию. Сечение по нужной схеме резки. Части конструкции могут храниться при 4 °C (после 15-минутной фиксации в 3,7% формальдегиде и 3 х 5 мин промывки в PBS) или -30 °C (после замораживания в жидком азоте) до дальнейшего анализа.
- Очистите компоненты биореактора и насоса. Кроме того, рекомендуемый метод очистки каждого элемента указан в Таблице материалов.
- Очистите резиновые воздушные фильтры 70% этанолом. Будьте очень осторожны, чтобы не смочить внутренний фильтр!
- Соберите все отдельные компоненты: средние трубки, средние резервуары, стеклянные трубки, мужские заглушки Luer и женские замки Luer, белые колпачки Luer, напорные трубопроводы, носовые конусы, силиконовые уплотнители, втулки адаптера, выпрямители потока (за исключением насосов, жидкостных блоков, резиновых воздушных фильтров, основания биореактора) и промыть в проточной водопроводной воде.
- Поместите O/N в 0,1% додецилсульфата натрия в деионизированную воду.
ПРИМЕЧАНИЕ: Не используйте сверхчистую воду, так как детали могут ржаветь. - Смойте водопроводной водой и мылом для мытья посуды.
- Погрузите в деионизированную воду, затем 70% этанол два раза, а затем деионизированную воду.
- Поместите все материалы отдельно на бумажные салфетки и дайте им высохнуть. Используйте напорный воздух для сушки трубок.
- Очистите все неавтоклавируемые материалы бумажной салфеткой, пропитанной 70% этанолом. Это включает в себя резиновый воздушный фильтр (имейте в виду, что воздушный фильтр должен оставаться сухим) и основание биореактора (тефлоновый сильфон и пневматический цилиндр).
- Автоклав компонентов жидкостной камеры (включая силиконовое уплотнительное кольцо), средней трубки, резервуаров среды (без резинового воздушного фильтра), мужских пробок Luer и женских муфт Luer, белых колпачков Luer, зажимов для шлангов и стандартного оборудования (например, пинцет, зажимные ножницы)
- Для удобства использования во время следующих экспериментов объедините отдельные компоненты для одной полной жидкостной камеры в автоклавируемой коробке.
- Удалите воду из гидравлического резервуара. Очищают 70% этанолом, а затем деионизированной водой. Дайте высохнуть. Заправляйте деионизированной водой и несколькими каплями водозащищающего дезинфицирующего средства.
- Храните стеклянные трубки для камеры проточной культуры в 70% этаноле.
- Поместите влажные шарики для сушки кремнезема (белый вид) в духовку O/N при 120 °C, чтобы они высохли (оранжевый вид), и храните в герметичной колбе.
Результаты
Этот биореактор был разработан для изучения индивидуальных и комбинированных эффектов сдвигового стресса и циклического растяжения на рост и ремоделирование сосудистой ткани в 3D-каркасах биоматериала. Конструкция биореактора позволяет культивировать до восьми сосудистых конструк?...
Обсуждение
Биореактор, описанный в настоящем описании, позволяет систематически оценить вклад индивидуальных и комбинированных эффектов напряжения сдвига и циклического растяжения на воспаление и регенерацию тканей в трубчатых рассасывающихся каркасах. Этот подход также позволяет проводить ?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование финансово поддерживается ZonMw в рамках программы LSH 2Treat (436001003) и Голландского фонда почек (14a2d507). N.A.K. признает поддержку европейского исследовательского совета (851960). Мы с благодарностью отмечаем Программу гравитации «Регенерация, основанная на материалах», финансируемую Нидерландской организацией научных исследований (024.003.013).
Материалы
| Name | Company | Catalog Number | Comments |
| advanced Dulbecco’s modified EagleMedium (aDMEM) | Gibco | 12491-015 | cell culture medium for fibroblasts |
| Aqua Stabil | Julabo | 8940012 | prevent microorganism growth in bioreactor-hydraulic reservoir |
| Bovine fibrinogen | Sigma | F8630 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Bovine thrombin | Sigma | T4648 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Centrifuge | Eppendorf | 5804 | to spin down cells and conditioned medium |
| Clamp scissor - "kelly forceps" | Almedic | P-422 | clamp the silicone tubing and apply pre-stretch to the scaffold so the scaffold can be sutured into the engraved groove (autoclave at step 1, step 7) |
| CO2 cell culture incubators | Sanyo | MCO-170AIC-PE | for cell culturing |
| Compressed air reservoir | Festo | CRVZS-5 | smoothing air pressure fluctuations and create time delays for pressure build-up |
| Custom Matlab script to calculate the maximum stretches | Matlab | R2017. The Mathworks, Natick, MA | calculate the minimum and maximum outer diameter of the electrospun scaffold |
| Data acquisition board | National Instruments | BNC-2090 | data processing in between amplifier system and computer |
| Ethanol | VWR | VWRK4096-9005 | to keep sterile working conditions |
| Fetal bovine calf serum (FBS) | Greiner | 758087 | cell culture medium supplement; serum-supplement |
| Flow culture chamber compartments, consisting of a pressure conduit with engraved grooves and small holes to apply pressure on silicone tubing, a screw thread, nose cone, top compartment with flow inlet and bottom compartment flow outlet, adapter bushing | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | flow culture chamber compartments (autoclave at step 1, step 7) |
| Glass Pasteur pipet | Assistant | HE40567002 | apply vacuum on electrospun scaffold (autoclave at step 1) |
| Glass tubes of the flow culture chamber | Custon made, Equipment & Prototype Center, Eindhoven University of Technology | n.a. | part of the flow culture chamber (clean and store in 70% ethanol, at step 1 and 7) |
| GlutaMax | Gibco | 35050061 | cell culture medium amino acid supplement, minimizes ammonia build-up |
| High speed camera | MotionScope | M-5 | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| High speed camera lens - Micro-NIKKOR 55mm f/2.8 - lens | Nikon | JAA616AB | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| Hose clip | ibidi GmbH | 10821 | block medium flow (autoclave at step 1, step 7) |
| Hydraulic reservoir with 8 screw threads for 8 flow culture chambers | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to apply pressure to the silicone mounted constructs (clean outside with a paper tissue with 70% ethanol, rinse reservoir with 70% ethanol followed by demi water, at step 1 and 7) |
| Ibidi pump system (8x) including ibidi pump, PumpControl software, fluidic unit, perfusion set (medium tubing), air pressure tubing, drying bottles with orange silica beads | ibidi GmbH | 10902 | set up used to control the flow in the flow culture chambers. Note 1: the ibidi pumps were modified by the manufacturer to enable 200 mbar capacity. Note 2: can be replaced by pump system of other manufacturer, as long as same flow regimes can be applied. |
| Knives (no.10 sterile blades, individual foil pack) and scalpel handle (stainless steel, individually wrapped) | Swann Morton | 0301; 0933 | to cut the silicone tubing in the correct size for the scaffold and to cut the suture material |
| LabVIEW Software | National Instruments | version 2018 | to control the stretch applied to the scaffolds |
| Laminar flow biosafety cabinet with UV light | Labconco | 302310001 | to ensure sterile working conditions. The UV is used to decontaminate everything that cannot be autoclaved, or touched after autoclaving |
| Large and small petri dishes | Greiner | 664-160 | for sterile working conditions |
| L-ascorbic acid 2-phosphate (vitamin C) | Sigma | A8960 | cell culture medium supplement, important for collagen production |
| LED light cold source KL2500 | Zeiss | Schott AG | to aid in visualization for the time lapse of the scaffolds during monitoring of the stretch |
| Luer (female and male) locks and connectors, white luer caps | ibidi GmbH | various, see (https://ibidi.com/26-flow-accessories) | to close or connect parts of the bioreactor and the ibidi pump (autoclave at step 1, step 7) |
| Measuring amplifier (PICAS) | PEEKEL instruments B.V. | n.a. | to amplify the signal from the pressure sensor and feedback to LabView |
| Medium reservoir (large syringes 60 mL) and reservoir holders | ibidi GmbH | 10974 | medium reservoir (autoclave at step 1, step 7) |
| Medium tubing with 4.25 mm outer diameter and 1 mm inner diameter | Rubber BV | 1805 | to allow for a larger flow rate, the ibidi medium tubing with larger diameter is used. Note: the part of medium tubing guided through the fluidic unit valves are the same as the default ibidi medium tubing |
| Motion Studio Software | Idtvision | 2.15.00 | to make the high speed time lapse images for stretch monitoring |
| Needle (19G) | BD Microlance | 301700 | together with thin flexible tubing used to fill the hydraulic reservoir with ultrapure water without adding air bubbles |
| Needle driver | Adson | 2429218 | to handle the needle of the nylon suture through the silicone tube (autoclave at step 1, step 7) |
| Paper tissues | Kleenex | 38044001 | for cleaning of the equipment with 70% ethanol |
| Parafilm | Sigma | P7793-1EA | quick fix if leakage occurs |
| Penicillin/streptomycin (P/S) | Lonza | DE17-602E | cell culture medium supplement; prevent bacterial contamination |
| Phosphate Buffered Saline (PBS) | Sigma | P4417-100TAB | for storage and washing steps (autoclave at step 1) |
| Plastic containers (60 mL) with red screw caps | Greiner | 206202 | to prepare the fibrinogen solution |
| Pneumatic cylinder | Festo | AEVC-20-10-I-P | to actuate the Teflon bellow (clean with a paper tissue with 70% ethanol at step 1 and 7) |
| Polycaprolactone bisurea (PCL-BU) tubular scaffolds (3 mm inner diameter, 200 µm wall thickness, 20 mm length) | SyMO-Chem, Eindhoven, The Netherlands | n.a. | produced using electrospinning from 15% (w/w) chloroform (Sigma; 372978) polymer solutions. See Van Haaften et al Tissue Engineering Part C (2018) for more details |
| Pressure conduit without holes (for static control) | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to mount electrospun tubes on silicon tubing (autoclave at step 1, step 7) |
| Pressure sensor and transducer | BD | TC-XX and P 10 EZ | the air pressure going to the pneumatic actuated pump is raised until it reaches the set pressure |
| Proportional air pressure control valve and pressure sensor | Festo | MPPES-3-1/8-2-010, 159596 | provides compressed air to the pneumatic actuated pump |
| Roswell Park Memorial Institute 1640 (RPMI-1640) | Gibco | A1049101 | cell culture medium for monocyte/macrophage |
| Safe lock Eppendorf tubes (1.5 mL) | Eppendorf | 30120086 | multiple applications (autoclave at step 1) |
| Sodium dodecyl sulfate solution 20% | Sigma | 5030 | Used to clean materials, at a concentration of 0.1%. |
| Silicone O-rings | Technirub | 1250S | to prevent leakage (autoclave at step 1, step 7) |
| Silicone tubing (2.8 mm outer diameter, 400 um wall thickness) | Rubber BV | 1805 | to mount the electrospun tubes on the pressure conduits (autoclave at step 1) |
| Sterile tube (15 mL) | Falcon | 352095 | multiple applications |
| Suture, 5-0 prolene with pre-attached taper point needle | Ethicon, Johnson&Johnson | EH7404H | Prolene suture wire 5-0 (75cm length, TF taper point needle, 1/2 circle, 13 mm needle length) |
| Syringe (24 mL) | B. Braun Melsungen AG | 2057932 | to add the ultrapure water or medium to the hydraulic reservoir or flow culture chamber |
| Syringe filter (0.2 µm) | Satorius | 17597-K | to filter the fibrinogen solution |
| T150 cell culture flask with filter cap | Nunc | 178983 | to degas culture medium |
| T75 Cell culture flask with filter cap | Nunc | 156499 | to culture static control samples |
| Teflon bellow | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to load the hydraulic reservoir (clean outside with a paper tissue with 70% ethanol at step 1 and 7) |
| Tray (stainless steel) | PolarWare | 15-248 | for easy transport of the fluidic culture chambers and the bioreactor from incubator to laminar flow cabinet and back (clean with a paper tissue with 70% ethanol before and after use) |
| Tweezers | Wironit | 4910 | sterile handling of individual parts (autoclave at step 1 and 7) |
| Ultrapure water | Stakpure | Omniapure UV 18200002 | to correct for medium evaporation, mixed with aqua stabil mixed and used as hydraulic fluid. (autoclave ultrapure water at step 1) |
| UV light | Philips | TUV 30W/G30 T8 | for decontamination of grafts and bioreactor parts before seeding |
Ссылки
- Chlupác, J., Filová, E., Bacáková, L. Blood vessel replacement: 50 years of development and tissue engineering paradigms in vascular surgery. Physiological Research. 58, 119-139 (2009).
- Huygens, S. A., et al. Bioprosthetic aortic valve replacement in elderly patients: Meta-analysis and microsimulation. The Journal of Thoracic and Cardiovascular Surgery. 157 (6), 2189-2197 (2019).
- Huygens, S. A., et al. Contemporary outcomes after surgical aortic valve replacement with bioprostheses and allografts: a systematic review and meta-analysis. European Journal of Cardio-Thoracic Surgery. 50 (4), 605-616 (2016).
- Loh, S. A., et al. Mid- and long-term results of the treatment of infrainguinal arterial occlusive disease with precuffed expanded polytetrafluoroethylene grafts compared with vein grafts. Annals of Vascular Surgery. 27 (2), 208-217 (2013).
- Tara, S., et al. Vessel bioengineering. Circulation Journal. 78 (1), 12-19 (2014).
- Huang, A. H., Niklason, L. E. Engineering of arteries in vitro. Cellular and Molecular Life Sciences. 71 (11), 2103-2118 (2014).
- Bouten, C. V. C., Smits, A. I. P. M., Baaijens, F. P. T. Can we grow valves inside the heart? Perspective on material-based in situ heart valve tissue engineering. Frontiers in Cardiovascular Medicine. 5, 54 (2018).
- Fioretta, E. S., et al. Next-generation tissue-engineered heart valves with repair, remodelling and regeneration capacity. Nature Reviews Cardiology. , (2020).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Science Translational Medicine. 11 (485), (2019).
- Gutowski, P., et al. Arterial reconstruction with human bioengineered acellular blood vessels in patients with peripheral arterial disease. Journal of Vascular Surgery. , (2020).
- Syedain, Z., et al. Tissue engineering of acellular vascular grafts capable of somatic growth in young lambs. Nature Communications. 7 (12951), 12951 (2016).
- Sugiura, T., et al. Tissue-engineered vascular grafts in children with congenital heart disease: intermediate term follow-up. Seminars in Thoracic and Cardiovascular Surgery. 30 (2), 175-179 (2018).
- Kluin, J., et al. In situ heart valve tissue engineering using a bioresorbable elastomeric implant - material design to 12 months follow-up in sheep. Biomaterials. 125, 101-117 (2017).
- Fioretta, E. S., et al. Differential leaflet remodeling of bone marrow cell pre-seeded versus nonseeded bioresorbable transcatheter pulmonary valve replacements. JACC. Basic to Translational Science. 5 (1), 15-31 (2020).
- Van Haaften, E. E., Bouten, C. V. C., Kurniawan, N. A. Vascular mechanobiology: towards control of. Cells. , 1-24 (2017).
- De Jonge, N., et al. Matrix production and organization by endothelial colony forming cells in mechanically strained engineered tissue constructs. PLoS ONE. 8 (9), 73161 (2013).
- Schmidt, J. B., Chen, K., Tranquillo, R. T. Effects of intermittent and incremental cyclic stretch on ERK signaling and collagen production in engineered tissue. Cellular and Molecular Bioengineering. 9 (1), 55-64 (2016).
- Luo, J., et al. Tissue-engineered vascular grafts with advanced mechanical strength from human iPSCs. Cell Stem Cell. 26 (2), 251-261 (2020).
- Van Haaften, E. E., et al. Decoupling the effect of shear stress and stretch on tissue growth and remodeling in a vascular graft. Tissue Engineering Part C: Methods. 24 (7), 418-429 (2018).
- Gupta, V., Tseng, H., Lawrence, B. D., Jane Grande-Allen, K. Effect of cyclic mechanical strain on glycosaminoglycan and proteoglycan synthesis by heart valve cells. Acta Biomaterialia. 5 (2), 531-540 (2009).
- Lin, S., Mequanint, K. Bioreactor-induced mesenchymal progenitor cell differentiation and elastic fiber assembly in engineered vascular tissues. Acta Biomaterialia. 59, 200-209 (2017).
- Venkataraman, L., Bashur, C. A., Ramamurthi, A. Impact of cyclic stretch on induced elastogenesis within collagenous conduits. Tissue Engineering. Part A. 20 (9-10), 1403-1415 (2014).
- Huang, A. H., et al. Biaxial stretch improves elastic fiber maturation, collagen arrangement, and mechanical properties in engineered arteries. Tissue Engineering Part C Methods. 22 (6), 524-533 (2016).
- Hinderer, S., et al. In vitro elastogenesis: instructing human vascular smooth muscle cells to generate an elastic fiber-containing extracellular matrix scaffold. Biomedical Materials. 10 (3), 034102 (2015).
- Eoh, J. H., et al. Enhanced elastin synthesis and maturation in human vascular smooth muscle tissue derived from induced-pluripotent stem cells. Acta Biomaterialia. 52, 49-59 (2017).
- Smits, A. I. P. M., Bouten, C. V. C. Tissue engineering meets immunoengineering: Prospective on personalized in situ tissue engineering strategies. Current Opinion in Biomedical Engineering. 6, 17-26 (2018).
- Wissing, T. B., Bonito, V., Bouten, C. V. C., Smits, A. I. P. M. Biomaterial-driven in situ cardiovascular tissue engineering-a multi-disciplinary perspective. npj Regenerative Medicine. 2 (1), 18 (2017).
- Hibino, N., et al. A critical role for macrophages in neovessel formation and the development of stenosis in tissue-engineered vascular grafts. The FASEB Journal. 25 (12), 4253-4263 (2011).
- Godwin, J. W., Pinto, A. R., Rosenthal, N. A. Macrophages are required for adult salamander limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9415-9420 (2013).
- Godwin, J. W., Debuque, R., Salimova, E., Rosenthal, N. A. Heart regeneration in the salamander relies on macrophage-mediated control of fibroblast activation and the extracellular landscape. npj Regenerative Medicine. 2 (1), 22 (2017).
- McBane, J. E., Cai, K., Labow, R. S., Santerre, J. P. Co-culturing monocytes with smooth muscle cells improves cell distribution within a degradable polyurethane scaffold and reduces inflammatory cytokines. Acta Biomaterialia. 8 (2), 488-501 (2012).
- Battiston, K. G., Ouyang, B., Labow, R. S., Simmons, C. A., Santerre, J. P. Monocyte/macrophage cytokine activity regulates vascular smooth muscle cell function within a degradable polyurethane scaffold. Acta Biomaterialia. 10 (3), 1146-1155 (2014).
- Ploeger, D. T., et al. Cell plasticity in wound healing: paracrine factors of M1/ M2 polarized macrophages influence the phenotypical state of dermal fibroblasts. Cell Communication and Signaling. 11 (1), 29 (2013).
- McBane, J. E., Santerre, J. P., Labow, R. S. The interaction between hydrolytic and oxidative pathways in macrophage-mediated polyurethane degradation. Journal of Biomedical Materials Research. Part A. 82 (4), 984-994 (2007).
- Wissing, T. B., et al. Macrophage-driven biomaterial degradation depends on scaffold microarchitecture. Frontiers in Bioengineering and Biotechnology. 7, 87 (2019).
- Wolf, M. T., Vodovotz, Y., Tottey, S., Brown, B. N., Badylak, S. F. Predicting in vivo responses to biomaterials via combined in vitro and in silico analysis. Tissue Engineering Part C: Methods. 21 (2), 148-159 (2015).
- Grotenhuis, N., Bayon, Y., Lange, J. F., Van Osch, G. J. V. M., Bastiaansen-Jenniskens, Y. M. A culture model to analyze the acute biomaterial-dependent reaction of human primary macrophages. Biochemical and Biophysical Research Communications. 433 (1), 115-120 (2013).
- Jannasch, M., et al. A comparative multi-parametric in vitro model identifies the power of test conditions to predict the fibrotic tendency of a biomaterial. Scientific Reports. 7 (1), 1689 (2017).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- McWhorter, F. Y., Davis, C. T., Liu, W. F. Physical and mechanical regulation of macrophage phenotype and function. Cellular and Molecular Life Sciences. 72 (7), 1303-1316 (2014).
- Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Strain-dependent modulation of macrophage polarization within scaffolds. Biomaterials. 35 (18), 4919-4928 (2014).
- Dziki, J. L., et al. The effect of mechanical loading upon extracellular matrix bioscaffold-mediated skeletal muscle remodeling. Tissue Engineering. Part A. 24 (1-2), 34-46 (2018).
- Wissing, T. B., et al. Hemodynamic loads distinctively impact the secretory profile of biomaterial-activated macrophages - implications for in situ vascular tissue engineering. Biomaterials Science. 8 (1), 132-147 (2020).
- Van Haaften, E. E., Wissing, T. B., Kurniawan, N. A., Smits, A. I. P. M., Bouten, C. V. C. Human in vitro model mimicking material-driven vascular regeneration reveals how cyclic stretch and shear stress differentially modulate inflammation and matrix deposition. Advanced Biosystems. 4 (6), 1900249 (2020).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Bonito, V., de Kort, B. J., Bouten, C. V. C., Smits, A. I. P. M. Cyclic strain affects macrophage cytokine secretion and extracellular matrix turnover in electrospun scaffolds. Tissue Engineering Part A. 25 (17-18), 1310-1325 (2019).
- Battiston, K. G., Labow, R. S., Simmons, C. A., Santerre, J. P. Immunomodulatory polymeric scaffold enhances extracellular matrix production in cell co-cultures under dynamic mechanical stimulation. Acta Biomaterialia. 24, 74-86 (2015).
- Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. A mesofluidics-based test platform for systematic development of scaffolds for in situ cardiovascular tissue engineering. Tissue Engineering Part C: Methods. 18 (6), 475-485 (2012).
- Smits, A. I. P. M., Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. T. Shear flow affects selective monocyte recruitment into MCP-1-loaded scaffolds. Journal of Cellular and Molecular Medicine. 18 (11), 2176-2188 (2014).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Fahy, N., Menzel, U., Alini, M., Stoddart, M. J. Shear and dynamic compression modulates the inflammatory phenotype of human monocytes in vitro. Frontiers in Immunology. 10, 383 (2019).
- Pennings, I., et al. Layer-specific cell differentiation in bi-layered vascular grafts under flow perfusion. Biofabrication. 12 (1), 015009 (2019).
- Wang, J., et al. Ex vivo blood vessel bioreactor for analysis of the biodegradation of magnesium stent models with and without vessel wall integration. Acta Biomater. 50, 546-555 (2017).
- Huang, A. H., et al. Design and use of a novel bioreactor for regeneration of biaxially stretched tissue-engineered vessels. Tissue Engineering. Part C, Methods. 21 (8), 841-851 (2015).
- Huang, A. H., Niklason, L. E. Engineering biological-based vascular grafts using a pulsatile bioreactor. Journal of Visualized Experiments. (52), e2646 (2011).
- Bono, N., et al. A Dual-mode bioreactor system for tissue engineered vascular models. Annals of Biomedical Engineering. 45 (6), 1496-1510 (2017).
- Wolf, F., et al. VascuTrainer: a mobile and disposable bioreactor system for the conditioning of tissue-engineered vascular grafts. Annals of Biomedical Engineering. 46 (4), 616-626 (2018).
- Ramaswamy, S., et al. A novel bioreactor for mechanobiological studies of engineered heart valve tissue formation under pulmonary arterial physiological flow conditions. Journal of Biomechanical Engineering. 136 (12), 121009 (2014).
- Piola, M., et al. A compact and automated ex vivo vessel culture system for the pulsatile pressure conditioning of human saphenous veins. Journal of Tissue Engineering and Regenerative Medicine. 10 (3), 204-215 (2016).
- Vanerio, N., Stijnen, M., de Mol, B. A. J. M., Kock, L. M. An innovative ex vivo vascular bioreactor as comprehensive tool to study the behavior of native blood vessels under physiologically relevant conditions. Journal of Engineering and Science in Medical Diagnostics and Therapy. 2 (4), (2019).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplantation. 27 (9), 1375-1389 (2018).
- Sinha, R., et al. A medium throughput device to study the effects of combinations of surface strains and fluid-flow shear stresses on cells. Lab on a Chip. 15 (2), 429-439 (2015).
- Beca, B. M., Sun, Y., Wong, E., Moraes, C., Simmons, C. A. Dynamic bioreactors with integrated microfabricated devices for mechanobiological screening. Tissue Engineering Part C: Methods. 25 (10), 581-592 (2019).
- Liu, H., Usprech, J., Sun, Y., Simmons, C. A. A microfabricated platform with hydrogel arrays for 3D mechanical stimulation of cells. Acta Biomaterialia. 34, 113-124 (2016).
- Szafron, J. M., Ramachandra, A. B., Breuer, C. K., Marsden, A. L., Humphrey, J. D. Optimization of tissue-engineered vascular graft design using computational modeling. Tissue Engineering Part C: Methods. 25 (10), 561-570 (2019).
- Emmert, M. Y., et al. Computational modeling guides tissue-engineered heart valve design for long-term in vivo performance in a translational sheep model. Science Translational Medicine. 10 (440), (2018).
- Mol, A., et al. Fibrin as a cell carrier in cardiovascular tissue engineering applications. Biomaterials. 26 (16), 3113-3121 (2005).
- van Kelle, M. A. J., et al. A Bioreactor to identify the driving mechanical stimuli of tissue growth and remodeling. Tissue Engineering Part C: Methods. 23 (6), (2017).
- van den Broek, C. N., et al. Medium with blood-analog mechanical properties for cardiovascular tissue culturing. Biorheology. 45 (6), 651-661 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены