È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un bioreattore multi-cue per valutare la capacità infiammatoria e rigenerativa dei biomateriali sotto flusso e allungamento
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
L'obiettivo di questo protocollo è quello di eseguire una co-coltura dinamica di macrofagi e miofibroblasti umani in scaffold elettrofilari tubolari per studiare la rigenerazione tissutale guidata dal materiale, utilizzando un bioreattore che consente il disaccoppiamento dello stress da taglio e dell'allungamento ciclico.
Abstract
L'uso di biomateriali riassorbibili per indurre la rigenerazione direttamente nel corpo è una strategia interessante dal punto di vista traslazionale. Tali materiali inducono una risposta infiammatoria all'impianto, che è il motore del successivo riassorbimento del materiale e della rigenerazione di nuovo tessuto. Questa strategia, nota anche come ingegneria tissutale in situ, viene perseguita per ottenere sostituzioni cardiovascolari come innesti vascolari ingegnerizzati nei tessuti. Sia il processo infiammatorio che quello rigenerativo sono determinati dai segnali biomeccanici locali sull'impalcatura (cioè stretch e shear stress). Qui, descriviamo in dettaglio l'uso di un bioreattore sviluppato su misura che consente in modo univoco il disaccoppiamento dello stress di allungamento e taglio su un'impalcatura tubolare. Ciò consente la valutazione sistematica e standardizzata della capacità infiammatoria e rigenerativa di scaffold tubolari sotto l'influenza di carichi meccanici ben controllati, che dimostriamo sulla base di un esperimento di co-coltura dinamica utilizzando macrofagi e miofibroblasti umani. I passaggi pratici chiave in questo approccio - la costruzione e l'creazione del bioreattore, la preparazione degli scaffold e la semina cellulare, l'applicazione e la manutenzione del flusso di allungamento e taglio e la raccolta dei campioni per l'analisi - sono discussi in dettaglio.
Introduzione
L'ingegneria tissutale cardiovascolare (TE) viene perseguita come opzione di trattamento alternativa alle protesi cardiovascolari permanenti attualmente utilizzate (ad esempio, innesti vascolari, sostituzioni delle valvole cardiache), che non sono ottimali per grandi coorti dipazienti 1,2,3,4. Applicazioni molto ricercate includono innesti vascolari ingegnerizzati tissutale (TEVG)5,6 e valvole cardiache (TEHV)7,8. Molto spesso, le metodologie TE cardiovascolari fanno uso di biomateriali riassorbibili (naturali o sintetici) che fungono da impalcatura istruttiva per la formazione del nuovo tessuto. La formazione di nuovo tessuto può essere ingegnerata completamente in vitro, seminando l'impalcatura con cellule e coltivando in un bioreattore prima dell'impianto (TE in vitro)9,10,11,o direttamente in situ, in cui l'impalcatura sintetica viene impiantata senza pre-coltura al fine di indurre la formazione di nuovo tessuto direttamente nel corpo (in situ TE)12,13,14. Per gli approcci TE cardiovascolari sia in vitro che in situ, il successo della rigenerazione funzionale dipende prevalentemente sia dalla risposta immunitaria dell'ospite al costrutto impiantato che dal carico biomeccanico appropriato.
L'importanza del carico biomeccanico per il TE cardiovascolare è ben nota15. Nel caso di impianti cardiovascolari, le cellule che popolano l'impalcatura sono esposte a tensioni cicliche di allungamento e taglio che sorgono a seguito dell'ambiente emodinamico. Numerosi studi hanno riportato l'effetto stimolante dell'allungamento (ciclico) sulla formazione di componenti della matrice, come il collagene16,17,18,19,i glicosaminoglicani (GAG)20,e l'elastina21,22,da parte di vari tipi di cellule. Ad esempio, Huang et al. hanno dimostrato che l'allungamento biassiale ha elevato la deposizione e l'organizzazione di collagene ed elastina nei TEVG in vitro utilizzando un bioreattorevascolare 23. Mentre l'enfasi si trova in genere sull'allungamento come carico dominante, questi studi spesso fanno uso di bioreattori guidati dal flusso in cui il campione è anche esposto al flusso di taglio. Sebbene si sa relativamente poco sull'influenza isolata delle sollecitazioni di taglio sulla formazione dei tessuti e sull'infiammazione in 3D, alcuni dati sono disponibili. Ad esempio, Hinderer et al. e Eoh et al. hanno dimostrato che il flusso di taglio, oltre a una microstruttura 3D dello scaffold, era importante per la formazione di elastina matura da parte delle cellule muscolari lisce vascolari umane in un sistema modello in vitro24,25. Complessivamente, questi risultati illustrano la rilevanza sia dello stretching ciclico che dello stress da taglio per il TE cardiovascolare.
Un altro importante fattore determinante per il successo o il fallimento degli impianti TE è la risposta immunitaria dell'ospite all'innesto impiantato26. Ciò è particolarmente importante per le strategie TE in situ guidate dal materiale, che in realtà si basano sulla risposta infiammatoria acuta all'impalcatura per avviare i successivi processi di afflusso cellulare e formazione e rimodellamento del tessuto endogeno27. Il macrofago è un iniziatore critico della rigenerazione funzionale dei tessuti, che è stato dimostrato da più studi28,29,30. Analogamente alla guarigione delle ferite, la rigenerazione del tessuto è governata dalla segnalazione paracrina tra macrofagi e cellule produttrici di tessuti come fibroblasti e miofibroblasti31,32,33. Oltre a coordinare la deposizione di nuovi tessuti, i macrofagi sono coinvolti nel riassorbimento attivo del materiale estraneo dell'impalcatura34,35. Come tale, la risposta dei macrofagi in vitro a un biomateriale è stata identificata come parametro predittivo per il successo in vivo degli impianti36,37,38.
La risposta dei macrofagi a un'impalcatura impiantata dipende dalle caratteristiche di progettazione dell'impalcatura come la composizione del materiale e la microstruttura35,39,40. Oltre alle proprietà dell'impalcatura, anche la risposta dei macrofagi a un'impalcatura e la loro diafonia con i miofibroblasti è influenzata dai carichi emodinamici. Ad esempio, l'allungamento ciclico ha dimostrato di essere un importante modulatore del fenotipo macrofagico41,42,43,44 e della secrezione di citochine43,44,45,46 in scaffold elettrofilati 3D. Utilizzando un sistema di co-coltura di macrofagi e cellule muscolari lisce vascolari, Battiston et al. hanno dimostrato che la presenza di macrofagi ha portato ad un aumento dei livelli di elastina e GAG e che livelli moderati di allungamento ciclico (1,07-1,10) stimolano la deposizione di collagene I ed elastina47. In lavori precedenti, abbiamo dimostrato che lo stress da taglio è un determinante importante per il reclutamento di monociti negli scaffold elettrofili 3D48,49e che sia lo stress di taglio che l'allungamento ciclico influenzano la segnalazione paracrina tra monociti umani e cellule stromali mesenchimali50. Fahy et al. hanno dimostrato che il flusso di taglio ha aumentato la secrezione di citochine pro-infiammatorie da parte di monociti umani51.
Nel loro insieme, le prove di cui sopra mostrano che un'adeguata comprensione e controllo dei carichi emodinamici è cruciale per il TE cardiovascolare e che è importante considerare la risposta infiammatoria per raggiungere questo obiettivo. Numerosi bioreattori sono stati descritti in precedenza per la coltura in vitro52,53,54,55,56,57,58 o ex vivo59,60,61 di tessuti cardiovascolari. Tuttavia, tutti questi sistemi sono progettati per imitare il più possibile le condizioni di carico emodinamico fisiologico. Mentre questo è molto prezioso allo scopo di creare tessuti cardiovascolari in vitro o mantenere colture ex vivo, tali sistemi non consentono studi sistematici sugli effetti individuali dei singoli segnali. Questo perché l'applicazione sia dello stretching ciclico che dello stress di taglio in questi bioreattori è guidata dallo stesso flusso pressurizzato, che li collega intrinsecamente. Mentre i microsistemi che consentono un'accurata manipolazione meccanica multi-cue sono stati descritti per substrati2D 62 o configurazioni idrogel 3D63,64, tali configurazioni non consentono l'incorporazione di scaffold di biomateriali 3D elastomerici.
Qui presentiamo l'applicazione di un sistema di bioreattore tubolare che consente in modo univoco il disaccoppiamento dello stress di taglio e dell'allungamento ciclico e aiuta a studiare meccanicamente i loro effetti individuali e combinati. Questo sistema consente di testare un'ampia varietà di innesti vascolari di ingegneria tissutale (ad esempio, origine sintetica o naturale, diverse micro-architetture, varie porosità). Per disaccoppiare efficacemente l'applicazione dello sforzo di taglio e dell'allungamento, i concetti chiave utilizzati dal bioreattore sono (1) separazione del controllo dello sforzo di taglio e dello stiramento utilizzando sistemi di pompaggio distinti e (2) stimolazione degli scaffold in modo "inside-out" con dimensioni guidate computazionalmente. Il flusso viene applicato sulla superficie esterna dell'impalcatura tubolare attraverso l'uso di una pompa di flusso, mentre l'allungamento circonferenziale dell'impalcatura è indotto dall'espansione di un tubo di silicone su cui è montato l'impalcatura attraverso l'uso di una pompa di deformazione separata. Le dimensioni del tubo di silicone e del tubo di vetro che contiene il costrutto sono accuratamente scelte e convalidate utilizzando simulazioni fluidodinamiche computazionali, per garantire che lo sforzo di taglio sull'impalcatura (dovuto al flusso) e l'allungamento circonferenziale (dovuto all'espansione del tubo) non si influenzino in modo significativo l'un l'altro. Questo design inside-out ha diverse motivazioni pratiche. Se l'allungamento viene applicato dalla pressione del fluido luminale (simile al carico fisiologico), richiede intrinsecamente che il design del campione sia privo di perdite. Inoltre, la pressione necessaria per allungare il campione sarebbe completamente determinata dalla rigidità del campione, che può variare tra i campioni e all'interno di un campione nel tempo, rendendo difficile il controllo dell'allungamento. Questo bioreattore monta l'innesto di ingegneria tissutale attorno a un tubo di silicone e consente l'applicazione dello stress di taglio della parete (WSS) sulla parete esterna dell'innesto e pressurizza l'innesto dall'interno. In questo modo, è possibile garantire condizioni di carico uguali tra i campioni e all'interno dei campioni nel tempo e, inoltre, i campioni possono essere permeabili, come è comune per gli scaffold vascolari porosi19. Questo bioreattore inside-out è specificamente destinato a studi sistematici sugli effetti del taglio e / o dell'allungamento, piuttosto che all'ingegneria di un vaso sanguigno nativo in vitro, per il quale le tradizionali configurazioni del bioreattore vascolare sono più adatte. Vedere la Figura 1A–B per i disegni di progettazione del bioreattore e la corrispondente Tabella 1 per una descrizione funzionale e una logica alla base dei componenti principali del bioreattore.
L'uso del bioreattore è dimostrato sulla base di una serie di recenti studi del nostro gruppo in cui abbiamo studiato le influenze individuali e combinate dello stress da taglio e dell'allungamento ciclico sull'infiammazione e sulla formazione dei tessuti in scaffold elettrofilari riassorbibili per tessuto cardiovascolare in situ19,43,44. A tal fine, abbiamo utilizzato macrofagi e miofibroblasti umani in mono- o in co-coltura per simulare le varie fasi della cascata rigenerativa in situ. Abbiamo dimostrato che la secrezione di citochine da parte dei macrofagi umani è distintamente influenzata sia dallo stretching ciclico che dallo stress di taglio, influenzando la deposizione e l'organizzazione della matrice da parte dei miofibroblasti umani in questi scaffold, sia tramite segnalazione paracrina che contatto diretto19,43,44. In particolare, questi studi hanno rivelato che nel caso di applicazione combinata di sforzo di taglio e stretching, gli effetti sulla formazione e l'infiammazione dei tessuti sono dominati da uno dei due carichi, oppure ci sono effetti sinergici di entrambi i carichi. Questi risultati illustrano l'importanza del disaccoppiamento di entrambi i carichi per ottenere una migliore comprensione del contributo dell'ambiente meccanico sui processi TE. Questa comprensione può essere applicata per ottimizzare sistematicamente i parametri di progettazione dell'impalcatura nei regimi di carico emodinamico pertinenti. Inoltre, i dati meccanicistici provenienti da tali ambienti ben controllati possono servire come input per i modelli numerici che sono in fase di sviluppo per prevedere il decorso del rimodellamento tissutale in situ, come recentemente riportato per i TEVG65 o TEHV66, per migliorare ulteriormente la capacità predittiva.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Negli studi descritti in questo protocollo, sono stati utilizzati macrofagi umani primari isolati da buffy coats di sangue periferico e miofibroblasti umani isolati dalla vena safena dopo chirurgia coronarica by-pass44. I cappotti buffy sono stati ottenuti da volontari sani e anonimizzati che hanno fornito il consenso informato scritto, che è stato approvato dal Sanquin Research Institutional Medical Ethical Committee. L'uso di cellule della vena safena umana (HVSC) era conforme al "Code Proper Secondary Use of Human Tissue" sviluppato dalla Federazione delle società mediche (FMWV) nei Paesi Bassi.
1. Preparazioni generali e azioni necessarie prima di istituire il bioreattore
NOTA: Per i dettagli sui rispettivi protocolli di isolamento e coltivazione, si prega di fare riferimento ai lavori precedenti19,43,44. Tutti i calcoli nel protocollo sono forniti come esempi per un esperimento di co-coltura con monociti e miofibroblasti, seminati in 8 scaffold caricati emodinamicamente e 2 controlli statici (n = 10).
- Avviare l'isolamento cellulare e la coltura cellulare. Le densità di semina per i campioni co-coltivati di monociti e miofibroblasti (con un rapporto di semina di 2:1) sono rispettivamente di 30 ×10 6 monociti/cm3 e 15 ×10 6 miofibroblasti/cm3.
NOTA: Il materiale elettrodun ha un'elevata porosità (>90%). Per stimare il numero richiesto di cellule per innesto, il volume dell'impalcatura viene calcolato con la formula per il volume di un cilindro cavo: π * (spessore)2* lunghezza ≈ 0,04 cm3. La quantità totale di cellule per innesto è di 1,2 ×10 6 monociti e 0,6 × 106 miofibroblasti. Per 10 campioni sono necessari almeno 12 ×10 6 monociti e 6 ×10 6 miofibroblasti; iniziare con fino a ~ 10-15% in più di celle per tenere conto di possibili errori di pipettaggio. - Degas il terreno di coltura cellulare che verrà utilizzato per esperimenti che coinvolgono il bioreattore.
- Preparare il mezzo per le co-colture, che consiste in RPMI-1640: aDMEM (1: 1), integrato con il 10% di siero bovino fetale, l'1% di penicillina-streptomicina e lo 0,5% di L-glutammina.
- Posizionare il mezzo durante la notte (O/N) in un incubatore in un pallone di coltura cellulare con tappo filtrante per degassare.
- Sostituire il tappo del filtro con un tappo ermetico e conservare a 4 °C.
- Poco prima dell'uso, aggiungere 0,25 mg / mL di acido L-ascorbico 2-fosfato (vitamina C) al mezzo.
NOTA: per i calcoli, la quantità di mezzo richiesta per camera di coltura a flusso è di 50 ml. Aggiorna il mezzo tre volte a settimana; 25 mL di vecchio medio sono sostituiti da 25 mL di terreno fresco. Per 10 campioni; dopo la semina, è richiesto un totale di 500 ml di terreno fresco e, per ogni successivo cambio di mezzo, viene utilizzato un totale di 250 ml di terreno fresco. Preparare sempre medio fresco, in particolare, la vitamina C deve essere aggiunta appena prima di cambiare il mezzo.
- Preparare scaffold elettropompa isotropa (diametro luminale di 3 mm, spessore della parete di 200 μm) come descritto da Van Haaften et al.19 (Figura 1G-I). In breve, gli scaffold tubolari in policaprolattone bisurea (PCL-BU) sono prodotti mediante elettrofilatura da soluzioni cloroformio-polimeriche al 15% (p/p). Le soluzioni polimeriche sono elettrofilate a temperatura ambiente e al 30% di umidità relativa, ad una portata di 40 μL/min, a 16 cm di distanza dal bersaglio cilindrico rotante (Ø 3 mm, 500 rpm), e ad una tensione applicata di 16 kV sull'ugello di elettrofilatura e -1 kV sul target.
NOTA: Sebbene per questi esperimenti siano stati utilizzati innesti PCL-BU, in questo bioreattore è possibile montare un'ampia varietà di innesti ingegnerizzati con tessuto elastomerico (ad esempio, di diversa origine sintetica o naturale, diversa microarchitettura, diverse porosità)- Rimuovere le impalcature elettrodune dal mandrino.
- Fai un piccolo foro nel cappuccio di un tubo da 15 ml per "tenere" il mandrino al centro e impedire che tocchi la parete del tubo.
- Posizionare il mandrino con l'impalcatura elettrospun nel tubo del falco e riempirlo con acqua deionizzata.
- Congelare i tubi O/N a -20 °C.
- Posizionare i tubi a temperatura ambiente (RT) ed estrarre i mandrini dopo pochi minuti, lasciando gli innesti elettrodepressi nel ghiaccio.
- Lasciare che il ghiaccio si scongeli completamente, rimuovere il tubo elettrofilato dall'acqua scongelata e "appendere" ad asciugare verticalmente per diverse ore. Assicurati che le impalcature non "collassino" sotto il loro stesso peso.
- Ponteggi asciutti sotto vuoto O/N.
- Immagine di un piccolo campione degli innesti elettrodespun utilizzando la microscopia elettronica a scansione (SEM) per valutare la loro microstruttura (ad esempio, morfologia delle fibre, diametro della fibra). Gli innesti negli studi di esempio hanno un orientamento isotropo della fibra e un diametro della fibra di 5 μm (Figura 1H-I).
- Rimuovere le impalcature elettrodune dal mandrino.
- Un giorno prima di iniziare l'esperimento, posizionare il serbatoio idraulico pieno di acqua deionizzata nell'incubatore. Chiudere tutte e otto le connessioni per le camere di coltura a flusso con tappi Luer bianchi. Collegare al sistema di aria compressa e inserire il sensore di pressione. Eseguire la pompa di deformazione (vedere punto 5.6) O/N per consentire una piccola espansione del soffietto in teflon.
NOTA: Assicurarsi che tutti i materiali e le attrezzature necessari siano puliti e/o autoclavati (vedere Tabella dei materiali,colonna Commenti/Descrizione per i quali i materiali possono essere autoclavati), secondo il protocollo del produttore o come descritto nei passaggi 7.3-7.6. - Garantire condizioni di lavoro sterili per il resto del protocollo.
- Eseguire i passaggi 2-5.3 (impostazione del sistema), 6.3 (cambio medio) e 7.1-7.2 (raccolta dei costrutti vascolari) in un armadio a flusso laminare sterile.
- Metti i materiali che non sono direttamente necessari per i passaggi successivi in piastre di Petri chiuse per mantenere tutto il più pulito possibile.
- Pulire o asciugare regolarmente le superfici del materiale immergendo un fazzoletto di carta con il 70% di etanolo e pulire le superfici dei componenti del bioreattore e dell'armadio a flusso laminare.
2. Impostazione del bioreattore
NOTA: eseguire il passaggio 2 in un armadio a flusso laminare.
- Tagliare gli scaffold elettrodepressi in tubi di circa 25 mm di lunghezza e documentarli prima dell'uso (ad esempio, fotografare per la lunghezza, pesare con bilancia per la massa iniziale).
- Decontaminare gli scaffold elettrodosalati.
- Posizionare le impalcature elettroplo inclinate in una piastra di pozzo o in una capsula di Petri, con un'apertura rivolta verso la sorgente di luce ultravioletta (UV), per consentire alla luce UV (253,7 nm) di illuminare l'interno delle impalcature.
- Esporre gli scaffold elettrodepressi alla luce UV per 5 minuti.
- Ruotare tutte le impalcature e ripetere l'illuminazione UV per l'altra apertura.
NOTA: dopo questo passaggio, toccare l'impalcatura elettrolitica solo quando necessario. Utilizzare sempre pinzette pulite o guanti puliti. - Prendere i tubi di vetro delle camere di coltura a flusso che sono conservati nel 70%, lavare i tubi di vetro in acqua ultrapura, asciugare e metterli in una grande capsula di Petri chiusa.
NOTA: i passaggi seguenti, in particolare i passaggi 2.3-2.5, sono idealmente eseguiti da due sperimentatori.
- Montare le impalcature elettropompe sul tubo in silicone.
- Attaccare la sutura di prolene 5-0 a un'estremità del tubo in silicone prendendo la sutura attraverso un lato del tubo e fuori dall'altro, lasciando due suture tese opposte che coprono la sezione trasversale del tubo. Fai un piccolo nodo su entrambi i lati del tubo mentre comprimi il tubo al luogo dei nodi e lascia circa 10 cm di filo su entrambi i nodi. Fai un terzo nodo all'estremità dei due fili rimasti da 10 cm.
- Tagliare l'ago di sutura e tutti i fili liberi che potrebbero sporgere e danneggiare l'interno dell'impalcatura elettrofilata. Tagliare i bordi del tubo di silicone in una forma triangolare per aiutare a tirare il tubo di silicone attraverso l'impalcatura elettrofilata.
- Immergere l'impalcatura elettrofilata in etanolo al 30% (questo serve come fase di decontaminazione extra e aiuta a far scorrere l'impalcatura elettrofilata sul tubo di silicio) e posizionare l'impalcatura elettrofilata sul filo libero di 10 cm. Lo sperimentatore A allunga il tubo in silicone tirando delicatamente sia il tubo in silicone che il nodo del filo di sutura da 10 cm, mentre lo sperimentatore B fa scorrere delicatamente l'impalcatura elettrofilata sul tubo in silicone usando una pinzetta con una punta interna liscia per evitare di danneggiare le impalcature.
- Rilasciare lentamente l'allungamento sul tubo di silicone, mentre contemporaneamente leviga l'impalcatura elettrofilante con una pinzetta. Immergere l'impalcatura elettrodrata sul tubo di silicone in acqua ultrapura due volte.
NOTA: è possibile che si verifichi qualche ruga dell'impalcatura elettrospun. Questa ruga scomparirà durante il pre-allungamento applicato prima di fissare le impalcature ai condotti di pressione al punto 2.5.3. - Ripetere i passaggi 2.3.2 e 2.3.3 per gli altri scaffold elettrospaggi. A seconda della lunghezza del tubo in silicone, è possibile montare più scaffold elettrodepressi sullo stesso tubo in silicone.
- Quando tutti gli scaffold elettrodepressi sono montati sul tubo di silicone, tagliare i tubi in silicone attorno ai ponteggi, tutti alla stessa lunghezza (5,5 cm); da un lato, vicino all'estremità dell'impalcatura elettrospun, dall'altro lato, lasciando ~ 2-3 cm di tubo di silicone libero.
- Attaccare la sutura di prolene 5-0 a un'estremità del tubo in silicone prendendo la sutura attraverso un lato del tubo e fuori dall'altro, lasciando due suture tese opposte che coprono la sezione trasversale del tubo. Fai un piccolo nodo su entrambi i lati del tubo mentre comprimi il tubo al luogo dei nodi e lascia circa 10 cm di filo su entrambi i nodi. Fai un terzo nodo all'estremità dei due fili rimasti da 10 cm.
- Costruire il compartimento inferiore della camera di coltura del flusso (Figura 1A–B).
- Prendere la parte superiore del compartimento inferiore contenente l'uscita di flusso e chiudere l'uscita di flusso con una spina Luer maschio.
- Spingere il condotto di pressione con fori attraverso il compartimento inferiore e posizionare un O-ring in silicone attorno all'estremità inferiore del condotto di pressione per evitare perdite. Avvitare la parte inferiore del compartimento inferiore alla parte superiore del compartimento inferiore per fissare il condotto di pressione. Assicurarsi che la scanalatura inferiore incisa del condotto di pressione si trova a circa 3-5 mm sopra il bordo della boccola dell'adattatore del compartimento inferiore; questo in seguito "terrà" il nodo stretto del filo di sutura, fissando l'impalcatura elettrofilata sul tubo di silicone.
NOTA: se il condotto di pressione può essere facilmente manovrato su e giù, indica che il compartimento inferiore non è ben fissato. Ripetere il passaggio 2.4.2 per evitare perdite nelle fasi successive (Figura 2D).
- Fissare il tubo in silicone con l'impalcatura elettrospun al condotto di pressione.
- Tirare il tubo di silicone con l'impalcatura elettrospun sul condotto di pressione.
- Fare un nodo con il filo di sutura all'estremità inferiore dell'impalcatura elettrofilata nella posizione della scanalatura incisa sul condotto di pressione. Fai un secondo nodo sul lato opposto per fissare saldamente il tubo di silicone con l'innesto elettrosaldato.
ATTENZIONE: questo è un passaggio critico. Assicurarsi che il nodo "cada" esattamente nella scanalatura incisa del condotto di pressione per evitare perdite d'acqua dal serbatoio idraulico alle camere di coltura del flusso. Se non sei sicuro, prova a stringere il filo di sutura in diverse posizioni, sopra o sotto la posizione prevista della scanalatura, per assicurarti che i nodi finali siano esattamente alla scanalatura incisa (Figura 2A). - Posizionare il morsetto a forbice all'estremità superiore del tubo in silicone e allungare il tubo in silicone verso l'alto (questo testerà direttamente il primo nodo, se è possibile spostare il tubo in silicone con l'impalcatura elettrosalvata sul condotto di pressione, non è stato stretto abbastanza bene). Con la forza di trazione, il tubo in silicone è pre-allungato. Per garantire che il tubo in silicone sia coerente tra i diversi campioni, collegare un righello al morsetto a forbice. Tirare il morsetto a forbice verso l'alto fino a quando l'estremità inferiore del righello raggiunge l'altezza dell'estremità inferiore dell'impalcatura.
NOTA: È importante mantenere il pre-stretching in ogni campione all'incirca lo stesso (~ 5%) per due motivi: (1) se il tubo di silicone è pre-allungato, si otterrà un'espansione più omogenea lungo la lunghezza del campione quando pressurizzato; (2) il pre-stretch avrà un impatto sulle proprietà meccaniche del silicone, pertanto dovrebbe essere lo stesso su tutti i campioni per garantire condizioni di allungamento uguali tra i campioni. - Rimuovere le rughe nell'impalcatura elettrospun tirando delicatamente l'impalcatura elettrospun. Ancora una volta, fare due nodi su entrambi i lati con un filo di sutura all'estremità superiore dell'impalcatura nella posizione della scanalatura superiore incisa sul condotto di pressione.
- Rilasciare il morsetto a forbice e tagliare via l'eccesso di tubo di silicone con un coltello, lasciando il 20-30% della filettatura della vite ricoperta da tubi in silicone, per evitare perdite quando il cono del naso è montato sulla filettatura della vite.
NOTA: ripetere i passaggi 2.4 e 2.5 per tutti gli esempi dinamici. - Per i campioni di controllo statico, fissare l'impalcatura elettrospun montata sul tubo in silicone su condotti a pressione senza fori. Questi condotti possono essere tenuti separatamente in un tubo da 15 ml fino alla semina (fase 4) e non devono essere montati nei compartimenti della camera di coltura a flusso.
- Decontaminare le camere di coltura a flusso parzialmente costruite con impalcatura elettrospun esponendola alla luce UV per 10 minuti. Ruotare le camere di coltura del flusso con impalcature elettrosalte dall'altra parte e ripetere l'esposizione alla luce UV per 10 minuti.
- Avvitare i coni del naso sulla filettatura dei condotti di pressione con fori per i campioni dinamici.
- Assicurarsi che l'estremità superiore del tubo in silicone si adatti al cono del naso per evitare perdite nelle fasi successive. Se c'è troppo tubo di silicone, tagliare l'eccesso di tubo con un coltello.
- Posizionare le camere di coltura a flusso parzialmente costruite in una grande capsula di Petri e puntare il cono del naso verso la sorgente di luce UV. Applicare l'illuminazione UV per 5 minuti.
- Costruzione completa della camera di coltura del flusso con il tubo di vetro e il compartimento superiore della camera di coltura del flusso (Figura 1A–B).
- Pre-bagnare gli scaffold elettrodun immergendo il condotto di pressione con il tubo in silicone e l'impalcatura elettrospun in etanolo al 30%, seguito da un tuffo in acqua ultrapura due volte.
- Posizionare il tubo di vetro sopra il condotto a pressione e spingere delicatamente nel compartimento inferiore e fissarlo delicatamente.
- Prendere il compartimento superiore contenente l'ingresso del flusso, posizionare un O-ring in silicone, la piastra di flusso e la boccola dell'adattatore nell'ordine corretto (Figura 1A-B), e posizionare sopra l'estremità aperta del tubo di vetro e fissarlo delicatamente.
- Avvitare un cappuccio Luer bianco sull'ingresso del flusso del vano superiore.
- Rimuovere il tappo Luer maschio dall'uscita di flusso dello scomparto inferiore e pulire la superficie intorno ad esso con un fazzoletto di carta imbevuto di etanolo.
- Posizionare una siringa con 10 ml di acqua ultrapura nell'uscita del flusso, aprire il cappuccio Luer bianco sul compartimento superiore e riempire la camera con acqua ultrapura. Chiudere nuovamente il tappo Luer bianco, rimuovere la siringa, pulire nuovamente con etanolo e chiudere l'uscita di flusso con un tappo Luer maschio.
NOTA: ripetere i passaggi da 2,6 a 2,8 per tutte le camere di coltura a flusso. - Per i controlli statici, aggiungere 10 mL di acqua ultrapura ai tubi da 15 mL che contengono i campioni montati sui condotti di pressione senza fori.
- Posizionare tutte le camere di coltura del flusso nell'incubatore. Sostituire l'acqua ultrapura con un terreno di coltura un giorno prima della semina cellulare nello stesso modo descritto nei passaggi 2.8.5 e 2.8.6 (assicurarsi di raccogliere la "vecchia" acqua ultrapura con un fazzoletto di carta imbevuto di etanolo posto direttamente sull'uscita del flusso).
[Il protocollo può essere messo in pausa qui]
3. Preparativi per la configurazione della pompa di flusso
NOTA: eseguire il passaggio 3 in un armadio a flusso laminare.
- Raccogliere tutti i materiali di configurazione della pompa e prepararsi per l'uso.
NOTA: gli sperimentatori fanno riferimento al protocollo del produttore per una descrizione dettagliata dell'impostazione della pompa, delle unità fluidiche e dei tubi medi attraverso le valvole dell'unità fluidica.- Impostare la pompa su una capacità di 200 mbar.
- Avvitare i supporti del serbatoio per serbatoi da 60 ml alle unità fluidiche.
- Pulire i filtri dell'aria in gomma riutilizzabili con un fazzoletto di carta imbevuto di etanolo, assicurarsi che il filtro dell'aria rimanga asciutto.
- Posizionare i serbatoi da 60 ml nei supporti del serbatoio e posizionare il tubo medio standard attraverso le valvole dell'unità fluidica. Collegare il tubo medio con un diametro interno maggiore con accoppiatori di blocco Luer femmina in un anello chiuso.
- Bloccare il tubo medio con una clip per tubi, direttamente sotto i serbatoi.
- Riempire i serbatoi con 25 ml di terreno di coltura per 60 ml di serbatoio. Rilasciare la clip del tubo e lasciare che il mezzo entri nel tubo.
- Chiudere i serbatoi medi con i filtri dell'aria in gomma e posizionare la configurazione della pompa di flusso nell'incubatore fino al passaggio 4.
4. Semina cellulare utilizzando la fibrina come vettore cellulare
NOTA: eseguire il passaggio 4 in un armadio a flusso laminare.
- Preparare il gel di fibrina per la fase di semina cellulare. Per i dettagli, vedere Mol et al.67 Per il gel di fibrina, la soluzione di fibrinogeno deve avere una concentrazione finale di 10 mg/mL (corretta per la purezza del brodo proteico) e la soluzione di trombina deve avere una concentrazione finale di 10 U/mL.
- Scongelare il fibrinogeno a RT, prima di pesare ~ 50 mg (sufficiente per 10 campioni) in un contenitore di plastica con un coperchio rosso.
- Aggiungere il terreno di coltura cellulare per preparare la soluzione di fibrinogeno (ad una concentrazione di 10 mg/ml, corretta per la purezza del brodo proteico). Mescolare bene e filtrare per sterilizzare la soluzione di fibrinogeno con un filtro a siringa da 0,2 μm in un tubo sterile da 15 ml. Mantenere la soluzione di fibrinogeno filtrato su ghiaccio.
NOTA: Evitare di preparare la soluzione di fibrinogeno con troppo anticipo, altrimenti il fibrinogeno potrebbe coagularsi spontaneamente. - Scongelare la trombina e produrre una soluzione di trombina (ad una concentrazione di 10 U/mL) nel terreno di coltura cellulare e metterla sul ghiaccio. Preparare 20 μL di trombina + soluzione di cellule per campione. Per n=10 campioni sono necessari 200 μL; pertanto, preparare una soluzione di trombina da 250 μL per tenere conto di possibili errori di pipettaggio.
- Raccogliere e contare le cellule dai palloni di coltura. Mescolare le cellule nel rapporto e nella quantità desiderati (1,2 ×10 6 monociti e 0,6 × 106 miofibroblasti per scaffold). Assicurarsi che vi siano abbastanza celle per n+1 campioni per correggere gli errori di pipettaggio. Centrifugare a 350 × g per 10 minuti a RT. Rimuovere il surnatante.
- Fai una miscela di cellule sospese e trombina.
- Per ogni campione, utilizzare 20 μL della soluzione di trombina. Per n=10 campioni, aggiungere 200 μL di trombina al pellet cellulare e mescolare. Misurare il volume della sospensione cellulare (cellule + trombina) e calcolare come dividere uniformemente su tutti i 10 scaffold (ad esempio, se la trombina + sospensione cellulare ha un volume di 260 μL, ogni campione elettrospun riceverà 260 μL / 10 campioni = 26 μL trombina + sospensione cellulare).
- Poiché la semina degli scaffold viene eseguita in due fasi, preparare due tubi microfuge da 1,5 mL che conterranno metà della sospensione cellulare per ciascuna impalcatura (nel calcolo di esempio del passaggio precedente: preparare due tubi con 13 μL di trombina + sospensione cellulare). Mettere sul ghiaccio.
NOTA: i passaggi seguenti, in particolare il passaggio 4.4, vengono eseguiti idealmente da due sperimentatori.
- Asciugare gli scaffold elettropompati pre-bagnati con il vuoto per prepararsi alla semina cellulare.
- Collegare un pipetto Pasteur in vetro al sistema di vuoto dell'armadio a flusso laminare e posizionarlo in un tubo vuoto da 50 ml per lo stoccaggio temporaneo sterile.
- Prendere le camere di coltura del flusso dall'incubatore, rimuovere il tappo Luer maschio dall'uscita del flusso e rimuovere il mezzo dopo aver aperto il tappo Luer bianco e aver posizionato un fazzoletto di carta imbevuto di etanolo davanti all'uscita del flusso.
- Togliere lo scomparto superiore e il tubo di vetro e metterlo in una capsula di Petri sterile per la conservazione temporanea.
- Posizionare il pipetto Pasteur sottovuoto sull'impalcatura elettrosalvata e rimuovere il maggior mezzo possibile.
ATTENZIONE: Asciugare sottovuoto l'impalcatura elettrospun con molta delicatezza. Invece di un movimento lineare avanti e indietro sull'impalcatura, posizionare il pipetto del vuoto in più posizioni. Blocca il tubo sottovuoto sopra il pipetto del Pasteur tra le dita per un migliore controllo. - Mescolare la soluzione di fibrinogeno in un rapporto 1:1 con la trombina + sospensione cellulare (ad esempio, mescolare 13 μL di fibrinogeno con 13 μL di trombina + sospensione cellulare). Per assicurarsi che la fibrina polimerizzi nell'impalcatura e non nel tubo del microfugo, pipettare il fibrinogeno, girare la ruota del pipetto per il "volume extra" della sospensione della trombina + cellula e pipettare su e giù una volta nel tubo del microfugo con sospensione cellulare da miscelare.
- Gocciolare direttamente in modo omogeneo la soluzione su tutta la lunghezza dell'impalcatura elettrospun. Si consiglia allo sperimentatore A di gocciolare la miscela di fibrina, mentre lo sperimentatore B tiene il compartimento inferiore con l'impalcatura elettrospun montata sul condotto di pressione.
- Dopo che la fibrina con le cellule è stata gocciolata sull'impalcatura elettrosaldata, lo Sperimentatore B sposta lentamente l'impalcatura, da sinistra a destra e su e giù, per dividere ulteriormente le celle in modo uniforme sopra l'impalcatura.
- Ripetere i passaggi 4.4.5 - 4.4.7 sull'altro lato dell'impalcatura elettrodospun.
- Montare nuovamente la camera di coltura del flusso posizionando con cura il tubo di vetro (evitare che la fibrina si attacchi e si coaguli sul lato interno del tubo di vetro) e spinga indietro il compartimento superiore della camera di coltura del flusso. Posizionare direttamente il costrutto seminato senza alcun mezzo o soluzione salina tamponata con fosfato (PBS) nella camera di coltura a flusso nell'incubatore.
- Ripetere i passaggi 4.4.1–4.4.9 per tutti i campioni dinamici. Per i campioni statici montati su condotti a pressione senza fori, seminare secondo i passaggi 4.4.1–4.4.8 e successivamente posizionare in un tubo da 15 ml.
- Lasciare polimerizzare la fibrina per 60 minuti nell'incubatrice.
[Il protocollo può essere messo in pausa qui per 30-60 min.]
- Dopo la polimerizzazione, riempire le camere di coltura a flusso (campioni dinamici) o i tubi da 15 ml (campioni statici) con il mezzo.
5. Accoppiamento dei sistemi di bioreattore e pompa di flusso prima di iniziare l'esperimento
NOTA: eseguire i passaggi da 5.1 a 5.3 in un armadio a flusso laminare.
- Prendere il vassoio che trasporta le camere di coltura a flusso e le unità fluidiche con serbatoi medi riempiti e tubi medi collegati all'interno degli armadi a flusso laminare.
- Posizionare le camere di coltura a flusso sulla base del bioreattore per i gruppi sperimentali caricati con allungamento ciclico e con carichi emodinamici combinati (Figura 1E).
- Inclinare la camera di coltura del flusso a testa in giù e riempire il condotto di pressione dal basso con acqua ultrapura usando una siringa con tubi sottili (questo può essere di qualsiasi tipo, purché sia flessibile e sottile, in questo esperimento, un filo di 10 cm di lunghezza, 0,15 mm di diametro interno è stato attaccato all'ago).
- Posizionare il tubo sottile all'interno del condotto di pressione e, mentre il condotto di pressione viene riempito con acqua ultrapura spingendo gradualmente l'acqua fuori dalla siringa, estrarre contemporaneamente il filo dal condotto di pressione, per assicurarsi che non ci siano bolle d'aria all'interno del condotto di pressione.
- Posizionare la camera di coltura del flusso su una delle otto filettature della vite sulla base del bioreattore. Posizionare un O-ring in silicone tra la base del bioreattore e il connettore Luer bianco per evitare possibili perdite e stringere il connettore Luer bianco dal vano inferiore.
- Ripetere i passaggi 5.2.2 e 5.2.3 per tutti i campioni allungati ciclicamente.
- Collegare le camere di coltura del flusso per tutti i gruppi sperimentali, ad eccezione del controllo statico, al sistema di pompa di flusso.
- Posizionare una clip per tubi flessibili sul tubo medio. Rimuovere il cappuccio Luer bianco che copre l'ingresso del flusso del compartimento superiore della camera di coltura del flusso. Rimuovere l'accoppiatore Luer femmina del tubo medio e collegare il tubo medio su un lato con l'ingresso del flusso sul compartimento superiore e l'altro lato del tubo medio con uscita del flusso nel compartimento inferiore.
- Ripetere il passaggio 5.3.1 per tutte le camere di coltura a flusso. A questo punto, il bioreattore e le camere di coltura a flusso sono riempiti con mezzo e collegati ai sistemi di flusso.
- Per i campioni di controllo statico, posizionare i campioni verticalmente in un pallone di coltura cellulare con tappo filtrante utilizzando il morsetto a forbice. Riempire il pallone di coltura cellulare con il mezzo e metterlo nell'incubatrice.
- Trasferire la configurazione completa dall'armadio a flusso laminare all'incubatore e collegare le unità fluidiche al tubo di pressione dell'aria e al cavo elettrico.
- Avviare il software e inizializzare le pompe di flusso. Avviare il flusso medio per i campioni uno per uno.
- Controllare se le valvole dell'unità fluidica stanno facendo clic.
- Rimuovere il morsetto del tubo dal tubo medio.
- Avviare la pompa di flusso con un tempo di commutazione di 100 mbar e 10 s.
- Controllare attentamente la direzione del flusso per possibili perdite o bolle d'aria. Eventuali bolle d'aria intrappolate possono essere rimosse capovolgendo la camera di coltura del flusso.
NOTA: Assicurarsi che i livelli del mezzo nei serbatoi medi siano bilanciati, per evitare l'aspirazione di aria nel sistema e bolle d'aria nelle camere di coltura a flusso e per non consentire ai serbatoi di asciugarsi (Figura 2C). - Ripetere il passaggio 5.5 per tutte le unità fluidiche una per una.
- Inizializzare la pompa di deformazione.
- Collegare la pompa pneumatica azionata tramite l'ingresso dell'aria sul cilindro pneumatico all'aria compressa. Collegare l'uscita dell'aria inferiore con il tubo blu per l'uscita dell'aria (Figura 1F).
- Aprire il software LabVIEW, eseguire lo script LabVIEW e il sistema di applicazione della pressione dell'aria compressa, come descritto da Van Kelle et al.68, immettere spostamento e frequenza (iniziare con bassa frequenza di 0,2 Hz). Mettere in pausa la pompa quando il soffietto in teflon è al livello più basso.
- Posizionare il sensore di pressione nell'ingresso del sensore di pressione sul serbatoio idraulico.
- Modificare le impostazioni della pompa alle impostazioni desiderate (per 1,5 Pa, utilizzare 150 mbar, tempo di commutazione di 10 s).
- Avviare la pompa di deformazione e applicare l'impostazione preferita (ad esempio, 0,5 Hz, 1,05 stretch).
6. Esecuzione dell'esperimento per più giorni; Monitoraggio del taglio e dell'allungamento durante la coltura e la sostituzione del mezzo
- Calcola il WSS sulla parete dell'impalcatura.
- Registrare l'entità del flusso a giorni alterni (consultare il manuale del produttore della pompa di flusso per i dettagli). In breve, osservare la variazione dei livelli di liquido (in ml) nei serbatoi medi tra la commutazione del serbatoio dell'unità fluidica per 10 s. Eseguire almeno cinque misurazioni, calcolare il valore medio e moltiplicare per 6 per ottenere la portata Q in ml/min.
- Il flusso è descritto da un flusso di Poiseuille attraverso un canale anulare. Assumendo il terreno di coltura come un fluido newtoniano, calcolare il WSS alla parete dell'impalcatura, r1, con l'equazione 1.
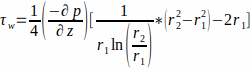 (1)
(1)
dove il WSS τw alla parete dell'impalcatura (r1; qui r1 =1,7 mm), risultante da un flusso allo stato stazionario, è determinato dalla pressione applicata p e dal raggio interno del tubo di vetro r2 (qui r2 = 2,3 mm). Si presume che il gradiente di pressione nella direzione assiale sia uniforme tra l'ingresso del flusso e l'uscita del flusso ed è dato dall'equazione 2 (Figura 1J).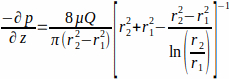 (2)
(2)
con μ la viscosità dinamica (qui si assumeva una viscosità media costante, μ = 0,7 × 10-3 Pa∙s a 37 °C) e Q la portata applicata.
- Monitorare l'allungamento applicato alle impalcature a giorni alterni.
- Posiziona uno sfondo scuro dietro la camera di coltura del flusso per aumentare il contrasto tra l'impalcatura e lo sfondo. Posizionare le lampade a LED, puntando verso l'impalcatura, per facilitare la visualizzazione dell'impalcatura.
- Scatta fotografie time-lapse dell'impalcatura a una frequenza di 30 Hz per 6 s (cioè 3 cicli di allungamento) con una fotocamera ad alta velocità.
NOTA: una frequenza di registrazione inferiore può essere sufficiente se la fotocamera lo consente. Tuttavia, la frequenza minimamente richiesta non è stata determinata. - Determinare manualmente il diametro minimo e massimo dell'impalcatura dalle immagini.
- Calcolare il diametro esterno minimo e massimo dell'impalcatura elettrofilata per calcolare gli allungamenti massimi secondo l'equazione 3.
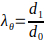 (3)
(3)
dove l'allungamento circonferenziale (λθ) è dato dal rapporto tra il diametro esterno dell'impalcatura, d1, e il suo diametro iniziale, d0.
- Correggere per l'evaporazione media e aggiornare il mezzo tre volte a settimana.
- Arrestare e disaccoppiare i cavi per i sistemi di flusso e la pompa di deformazione.
- Posizionare le clip del tubo sul tubo medio.
- Determinare la quantità di mezzo evaporato in base ai segni dell'indicatore di volume sui serbatoi medi.
- Trasferire il vassoio con il bioreattore e le unità fluidiche nell'armadio a flusso laminare.
- Rimuovere i filtri dell'aria in gomma dei serbatoi medi; aggiungere acqua ultrapura autoclavata per compensare il volume evaporato del mezzo. Chiudere nuovamente i serbatoi medi e collegarsi nuovamente alla pompa per mescolare il mezzo con l'acqua ultrapura.
- Ripetere i passaggi da 6.3.1 a 6.3.5. Rimuovere nuovamente i filtri dell'aria in gomma, es rimuovere 25 ml di terreno di coltura e girare a 300 × g per 5 minuti a RT.
- Raccogliere 1,5 mL di surnatante e conservare a -30 °C per l'analisi dei profili secretorio (per l'analisi con saggio immunoassorbente enzimatico (ELISA)).
- Raccogliere il volume desiderato di surnatante per studi di segnalazione paracrina, utilizzando il surnatante come mezzo condizionato43.
- Aggiungere 25 ml di mezzo fresco ai serbatoi medi.
- Posizionare i filtri dell'aria in gomma sui serbatoi medi.
- Posizionare la configurazione completa nell'incubatore; collegare tutti i cavi e i tubi dell'aria alla pompa e alla pompa di deformazione. Rilasciare le clip del tubo e ripetere i passaggi 5.4–5.8.
- Controllare se le perle di essiccazione della silice nei flaconi di essiccazione collegati alla pompa sono umide (aspetto bianco) e sostituirle con perle di silice asciutte se necessario (aspetto arancione).
7. Fine dell'esperimento, raccolta dei campioni e pulizia e conservazione delle apparecchiature
- L'ultimo giorno dell'esperimento, correggere l'evaporazione media come descritto nei passaggi 6.3.1-6.3.5 e raccogliere i campioni uno per uno.
- Per raccogliere i campioni uno per uno, la pompa di flusso e la pompa di deformazione devono essere messe in pausa più volte. Posizionare una clip per tubi flessibili su tubi medi. Arrestare temporaneamente la pompa di flusso e la pompa di deformazione. Scollegare una camera di coltura a flusso dalla base del bioreattore; sostituire con un cappuccio Luer bianco sulla base del bioreattore. Portare la camera di coltura del flusso e l'unità fluidica nell'armadio a flusso laminare. Avviare nuovamente la pompa di flusso e la pompa di deformazione per applicare il carico emodinamico agli altri campioni fino alla raccolta.
- Raccogliere il mezzo dai serbatoi medi per l'analisi della produzione di citochine paracrine tramite ELISA.
- Disaccoppiare le unità di flusso e raccogliere il costrutto tubolare. Sezione secondo lo schema di taglio desiderato. Parti del costrutto possono essere conservate a 4 °C (dopo 15 minuti di fissazione in 3,7% di formaldeide e 3 x 5 minuti di lavaggio in PBS) o -30 °C (dopo congelamento a scatto in azoto liquido) fino a ulteriori analisi.
- Pulire il bioreattore e i componenti della pompa. Inoltre, il metodo di pulizia consigliato per articolo è menzionato nella Tabella dei materiali.
- Pulire i filtri dell'aria in gomma con il 70% di etanolo. Fai molta attenzione a non inumidire il filtro interno!
- Raccogliere tutti i componenti separati: tubi medi, serbatoi medi, tubi di vetro, tappi Luer maschi e serrature Luer femmina, tappi Luer bianchi, condotti di pressione, coni nasali, O-ring in silicone, boccole adattatore, raddrizzatori di flusso (escluse pompe, unità fluidiche, filtri dell'aria in gomma, base del bioreattore) e risciacquare nell'acqua corrente del rubinetto.
- Posizionare O/N in dodecilsolfato di sodio allo 0,1% in acqua deionizzata.
NOTA: non utilizzare acqua ultrapura in quanto le parti potrebbero arrugginire. - Risciacquare con acqua di rubinetto e sapone per piatti.
- Immergere in acqua deionizzata, seguita da etanolo al 70% due volte, seguita da acqua deionizzata.
- Posizionare tutti i materiali separatamente su fazzoletti di carta e lasciarli asciugare. Utilizzare aria pressata per asciugare i tubi.
- Pulire tutti i materiali non autoclavabili con un fazzoletto di carta imbevuto di etanolo al 70%. Ciò include il filtro dell'aria in gomma (tenere presente che il filtro dell'aria deve rimanere asciutto) e la base del bioreattore (soffietto in teflon e cilindro pneumatico).
- Autoclave dei componenti della camera fluidica (compreso l'O-ring in silicone), del tubo medio, dei serbatoi medi (senza filtro dell'aria in gomma), dei tappi Luer maschio e degli accoppiatori Luer femmina, dei tappi Luer bianchi, delle clip per tubi flessibili e dell'equipaggiamento standard (ad esempio, pinzette, forbici di serraggio)
- Per un uso conveniente durante i prossimi esperimenti, combinare i componenti separati per una camera fluidica completa in una scatola autoclavabile.
- Rimuovere l'acqua dal serbatoio idraulico. Pulire con etanolo al 70%, seguito da acqua deionizzata. Lasciare asciugare. Riempire con acqua deionizzata e qualche goccia di disinfettante che preserva il bagno d'acqua.
- Conservare i tubi di vetro per la camera di coltura del flusso in etanolo al 70%.
- Mettere le perle umide di essiccazione della silice (aspetto bianco) nel forno O/N a 120 °C per lasciarle asciugare (aspetto arancione) e conservare in un matraccio ermetico.
Access restricted. Please log in or start a trial to view this content.
Risultati
Questo bioreattore è stato sviluppato per studiare gli effetti individuali e combinati dello stress da taglio e dell'allungamento ciclico sulla crescita e il rimodellamento del tessuto vascolare negli scaffold di biomateriale 3D. La progettazione del bioreattore consente di coltivare fino a otto costrutti vascolari in varie condizioni di carico (Figura 1A). I costrutti vascolari sono posizionati in una camera di coltura a flusso (Figura 1B) in cui sia l'allunga...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il bioreattore qui descritto consente la valutazione sistematica dei contributi degli effetti individuali e combinati dello sforzo di taglio e dell'allungamento ciclico sull'infiammazione e sulla rigenerazione dei tessuti negli scaffold tubulari riassorbibili. Questo approccio consente anche di eseguire una grande varietà di analisi su costrutti vascolari, come esemplificato nella sezione dei risultati rappresentativi. Questi risultati mostrano l'impatto distintivo dei diversi regimi di carico emodinamico (cioè diverse...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è sostenuto finanziariamente da ZonMw come parte del programma LSH 2Treat (436001003) e dalla Dutch Kidney Foundation (14a2d507). N.A.K. riconosce il sostegno del Consiglio europeo della ricerca (851960). Riconosciamo con gratitudine il programma di gravitazione "Materials Driven Regeneration", finanziato dall'Organizzazione olandese per la ricerca scientifica (024.003.013).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| advanced Dulbecco’s modified EagleMedium (aDMEM) | Gibco | 12491-015 | cell culture medium for fibroblasts |
| Aqua Stabil | Julabo | 8940012 | prevent microorganism growth in bioreactor-hydraulic reservoir |
| Bovine fibrinogen | Sigma | F8630 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Bovine thrombin | Sigma | T4648 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Centrifuge | Eppendorf | 5804 | to spin down cells and conditioned medium |
| Clamp scissor - "kelly forceps" | Almedic | P-422 | clamp the silicone tubing and apply pre-stretch to the scaffold so the scaffold can be sutured into the engraved groove (autoclave at step 1, step 7) |
| CO2 cell culture incubators | Sanyo | MCO-170AIC-PE | for cell culturing |
| Compressed air reservoir | Festo | CRVZS-5 | smoothing air pressure fluctuations and create time delays for pressure build-up |
| Custom Matlab script to calculate the maximum stretches | Matlab | R2017. The Mathworks, Natick, MA | calculate the minimum and maximum outer diameter of the electrospun scaffold |
| Data acquisition board | National Instruments | BNC-2090 | data processing in between amplifier system and computer |
| Ethanol | VWR | VWRK4096-9005 | to keep sterile working conditions |
| Fetal bovine calf serum (FBS) | Greiner | 758087 | cell culture medium supplement; serum-supplement |
| Flow culture chamber compartments, consisting of a pressure conduit with engraved grooves and small holes to apply pressure on silicone tubing, a screw thread, nose cone, top compartment with flow inlet and bottom compartment flow outlet, adapter bushing | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | flow culture chamber compartments (autoclave at step 1, step 7) |
| Glass Pasteur pipet | Assistant | HE40567002 | apply vacuum on electrospun scaffold (autoclave at step 1) |
| Glass tubes of the flow culture chamber | Custon made, Equipment & Prototype Center, Eindhoven University of Technology | n.a. | part of the flow culture chamber (clean and store in 70% ethanol, at step 1 and 7) |
| GlutaMax | Gibco | 35050061 | cell culture medium amino acid supplement, minimizes ammonia build-up |
| High speed camera | MotionScope | M-5 | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| High speed camera lens - Micro-NIKKOR 55mm f/2.8 - lens | Nikon | JAA616AB | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| Hose clip | ibidi GmbH | 10821 | block medium flow (autoclave at step 1, step 7) |
| Hydraulic reservoir with 8 screw threads for 8 flow culture chambers | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to apply pressure to the silicone mounted constructs (clean outside with a paper tissue with 70% ethanol, rinse reservoir with 70% ethanol followed by demi water, at step 1 and 7) |
| Ibidi pump system (8x) including ibidi pump, PumpControl software, fluidic unit, perfusion set (medium tubing), air pressure tubing, drying bottles with orange silica beads | ibidi GmbH | 10902 | set up used to control the flow in the flow culture chambers. Note 1: the ibidi pumps were modified by the manufacturer to enable 200 mbar capacity. Note 2: can be replaced by pump system of other manufacturer, as long as same flow regimes can be applied. |
| Knives (no.10 sterile blades, individual foil pack) and scalpel handle (stainless steel, individually wrapped) | Swann Morton | 0301; 0933 | to cut the silicone tubing in the correct size for the scaffold and to cut the suture material |
| LabVIEW Software | National Instruments | version 2018 | to control the stretch applied to the scaffolds |
| Laminar flow biosafety cabinet with UV light | Labconco | 302310001 | to ensure sterile working conditions. The UV is used to decontaminate everything that cannot be autoclaved, or touched after autoclaving |
| Large and small petri dishes | Greiner | 664-160 | for sterile working conditions |
| L-ascorbic acid 2-phosphate (vitamin C) | Sigma | A8960 | cell culture medium supplement, important for collagen production |
| LED light cold source KL2500 | Zeiss | Schott AG | to aid in visualization for the time lapse of the scaffolds during monitoring of the stretch |
| Luer (female and male) locks and connectors, white luer caps | ibidi GmbH | various, see (https://ibidi.com/26-flow-accessories) | to close or connect parts of the bioreactor and the ibidi pump (autoclave at step 1, step 7) |
| Measuring amplifier (PICAS) | PEEKEL instruments B.V. | n.a. | to amplify the signal from the pressure sensor and feedback to LabView |
| Medium reservoir (large syringes 60 mL) and reservoir holders | ibidi GmbH | 10974 | medium reservoir (autoclave at step 1, step 7) |
| Medium tubing with 4.25 mm outer diameter and 1 mm inner diameter | Rubber BV | 1805 | to allow for a larger flow rate, the ibidi medium tubing with larger diameter is used. Note: the part of medium tubing guided through the fluidic unit valves are the same as the default ibidi medium tubing |
| Motion Studio Software | Idtvision | 2.15.00 | to make the high speed time lapse images for stretch monitoring |
| Needle (19G) | BD Microlance | 301700 | together with thin flexible tubing used to fill the hydraulic reservoir with ultrapure water without adding air bubbles |
| Needle driver | Adson | 2429218 | to handle the needle of the nylon suture through the silicone tube (autoclave at step 1, step 7) |
| Paper tissues | Kleenex | 38044001 | for cleaning of the equipment with 70% ethanol |
| Parafilm | Sigma | P7793-1EA | quick fix if leakage occurs |
| Penicillin/streptomycin (P/S) | Lonza | DE17-602E | cell culture medium supplement; prevent bacterial contamination |
| Phosphate Buffered Saline (PBS) | Sigma | P4417-100TAB | for storage and washing steps (autoclave at step 1) |
| Plastic containers (60 mL) with red screw caps | Greiner | 206202 | to prepare the fibrinogen solution |
| Pneumatic cylinder | Festo | AEVC-20-10-I-P | to actuate the Teflon bellow (clean with a paper tissue with 70% ethanol at step 1 and 7) |
| Polycaprolactone bisurea (PCL-BU) tubular scaffolds (3 mm inner diameter, 200 µm wall thickness, 20 mm length) | SyMO-Chem, Eindhoven, The Netherlands | n.a. | produced using electrospinning from 15% (w/w) chloroform (Sigma; 372978) polymer solutions. See Van Haaften et al Tissue Engineering Part C (2018) for more details |
| Pressure conduit without holes (for static control) | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to mount electrospun tubes on silicon tubing (autoclave at step 1, step 7) |
| Pressure sensor and transducer | BD | TC-XX and P 10 EZ | the air pressure going to the pneumatic actuated pump is raised until it reaches the set pressure |
| Proportional air pressure control valve and pressure sensor | Festo | MPPES-3-1/8-2-010, 159596 | provides compressed air to the pneumatic actuated pump |
| Roswell Park Memorial Institute 1640 (RPMI-1640) | Gibco | A1049101 | cell culture medium for monocyte/macrophage |
| Safe lock Eppendorf tubes (1.5 mL) | Eppendorf | 30120086 | multiple applications (autoclave at step 1) |
| Sodium dodecyl sulfate solution 20% | Sigma | 5030 | Used to clean materials, at a concentration of 0.1%. |
| Silicone O-rings | Technirub | 1250S | to prevent leakage (autoclave at step 1, step 7) |
| Silicone tubing (2.8 mm outer diameter, 400 um wall thickness) | Rubber BV | 1805 | to mount the electrospun tubes on the pressure conduits (autoclave at step 1) |
| Sterile tube (15 mL) | Falcon | 352095 | multiple applications |
| Suture, 5-0 prolene with pre-attached taper point needle | Ethicon, Johnson&Johnson | EH7404H | Prolene suture wire 5-0 (75cm length, TF taper point needle, 1/2 circle, 13 mm needle length) |
| Syringe (24 mL) | B. Braun Melsungen AG | 2057932 | to add the ultrapure water or medium to the hydraulic reservoir or flow culture chamber |
| Syringe filter (0.2 µm) | Satorius | 17597-K | to filter the fibrinogen solution |
| T150 cell culture flask with filter cap | Nunc | 178983 | to degas culture medium |
| T75 Cell culture flask with filter cap | Nunc | 156499 | to culture static control samples |
| Teflon bellow | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to load the hydraulic reservoir (clean outside with a paper tissue with 70% ethanol at step 1 and 7) |
| Tray (stainless steel) | PolarWare | 15-248 | for easy transport of the fluidic culture chambers and the bioreactor from incubator to laminar flow cabinet and back (clean with a paper tissue with 70% ethanol before and after use) |
| Tweezers | Wironit | 4910 | sterile handling of individual parts (autoclave at step 1 and 7) |
| Ultrapure water | Stakpure | Omniapure UV 18200002 | to correct for medium evaporation, mixed with aqua stabil mixed and used as hydraulic fluid. (autoclave ultrapure water at step 1) |
| UV light | Philips | TUV 30W/G30 T8 | for decontamination of grafts and bioreactor parts before seeding |
Riferimenti
- Chlupác, J., Filová, E., Bacáková, L. Blood vessel replacement: 50 years of development and tissue engineering paradigms in vascular surgery. Physiological Research. 58, Suppl 2 119-139 (2009).
- Huygens, S. A., et al. Bioprosthetic aortic valve replacement in elderly patients: Meta-analysis and microsimulation. The Journal of Thoracic and Cardiovascular Surgery. 157 (6), 2189-2197 (2019).
- Huygens, S. A., et al. Contemporary outcomes after surgical aortic valve replacement with bioprostheses and allografts: a systematic review and meta-analysis. European Journal of Cardio-Thoracic Surgery. 50 (4), 605-616 (2016).
- Loh, S. A., et al. Mid- and long-term results of the treatment of infrainguinal arterial occlusive disease with precuffed expanded polytetrafluoroethylene grafts compared with vein grafts. Annals of Vascular Surgery. 27 (2), 208-217 (2013).
- Tara, S., et al. Vessel bioengineering. Circulation Journal. 78 (1), 12-19 (2014).
- Huang, A. H., Niklason, L. E. Engineering of arteries in vitro. Cellular and Molecular Life Sciences. 71 (11), 2103-2118 (2014).
- Bouten, C. V. C., Smits, A. I. P. M., Baaijens, F. P. T. Can we grow valves inside the heart? Perspective on material-based in situ heart valve tissue engineering. Frontiers in Cardiovascular Medicine. 5, 54(2018).
- Fioretta, E. S., et al. Next-generation tissue-engineered heart valves with repair, remodelling and regeneration capacity. Nature Reviews Cardiology. , (2020).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Science Translational Medicine. 11 (485), (2019).
- Gutowski, P., et al. Arterial reconstruction with human bioengineered acellular blood vessels in patients with peripheral arterial disease. Journal of Vascular Surgery. , (2020).
- Syedain, Z., et al. Tissue engineering of acellular vascular grafts capable of somatic growth in young lambs. Nature Communications. 7 (12951), 12951(2016).
- Sugiura, T., et al. Tissue-engineered vascular grafts in children with congenital heart disease: intermediate term follow-up. Seminars in Thoracic and Cardiovascular Surgery. 30 (2), 175-179 (2018).
- Kluin, J., et al. In situ heart valve tissue engineering using a bioresorbable elastomeric implant - material design to 12 months follow-up in sheep. Biomaterials. 125, 101-117 (2017).
- Fioretta, E. S., et al. Differential leaflet remodeling of bone marrow cell pre-seeded versus nonseeded bioresorbable transcatheter pulmonary valve replacements. JACC. Basic to Translational Science. 5 (1), 15-31 (2020).
- Van Haaften, E. E., Bouten, C. V. C., Kurniawan, N. A. Vascular mechanobiology: towards control of. Cells. , 1-24 (2017).
- De Jonge, N., et al. Matrix production and organization by endothelial colony forming cells in mechanically strained engineered tissue constructs. PLoS ONE. 8 (9), 73161(2013).
- Schmidt, J. B., Chen, K., Tranquillo, R. T. Effects of intermittent and incremental cyclic stretch on ERK signaling and collagen production in engineered tissue. Cellular and Molecular Bioengineering. 9 (1), 55-64 (2016).
- Luo, J., et al. Tissue-engineered vascular grafts with advanced mechanical strength from human iPSCs. Cell Stem Cell. 26 (2), 251-261 (2020).
- Van Haaften, E. E., et al. Decoupling the effect of shear stress and stretch on tissue growth and remodeling in a vascular graft. Tissue Engineering Part C: Methods. 24 (7), 418-429 (2018).
- Gupta, V., Tseng, H., Lawrence, B. D., Jane Grande-Allen, K. Effect of cyclic mechanical strain on glycosaminoglycan and proteoglycan synthesis by heart valve cells. Acta Biomaterialia. 5 (2), 531-540 (2009).
- Lin, S., Mequanint, K. Bioreactor-induced mesenchymal progenitor cell differentiation and elastic fiber assembly in engineered vascular tissues. Acta Biomaterialia. 59, 200-209 (2017).
- Venkataraman, L., Bashur, C. A., Ramamurthi, A. Impact of cyclic stretch on induced elastogenesis within collagenous conduits. Tissue Engineering. Part A. 20 (9-10), 1403-1415 (2014).
- Huang, A. H., et al. Biaxial stretch improves elastic fiber maturation, collagen arrangement, and mechanical properties in engineered arteries. Tissue Engineering Part C Methods. 22 (6), 524-533 (2016).
- Hinderer, S., et al. In vitro elastogenesis: instructing human vascular smooth muscle cells to generate an elastic fiber-containing extracellular matrix scaffold. Biomedical Materials. 10 (3), 034102(2015).
- Eoh, J. H., et al. Enhanced elastin synthesis and maturation in human vascular smooth muscle tissue derived from induced-pluripotent stem cells. Acta Biomaterialia. 52, 49-59 (2017).
- Smits, A. I. P. M., Bouten, C. V. C. Tissue engineering meets immunoengineering: Prospective on personalized in situ tissue engineering strategies. Current Opinion in Biomedical Engineering. 6, 17-26 (2018).
- Wissing, T. B., Bonito, V., Bouten, C. V. C., Smits, A. I. P. M. Biomaterial-driven in situ cardiovascular tissue engineering-a multi-disciplinary perspective. npj Regenerative Medicine. 2 (1), 18(2017).
- Hibino, N., et al. A critical role for macrophages in neovessel formation and the development of stenosis in tissue-engineered vascular grafts. The FASEB Journal. 25 (12), 4253-4263 (2011).
- Godwin, J. W., Pinto, A. R., Rosenthal, N. A. Macrophages are required for adult salamander limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9415-9420 (2013).
- Godwin, J. W., Debuque, R., Salimova, E., Rosenthal, N. A. Heart regeneration in the salamander relies on macrophage-mediated control of fibroblast activation and the extracellular landscape. npj Regenerative Medicine. 2 (1), 22(2017).
- McBane, J. E., Cai, K., Labow, R. S., Santerre, J. P. Co-culturing monocytes with smooth muscle cells improves cell distribution within a degradable polyurethane scaffold and reduces inflammatory cytokines. Acta Biomaterialia. 8 (2), 488-501 (2012).
- Battiston, K. G., Ouyang, B., Labow, R. S., Simmons, C. A., Santerre, J. P. Monocyte/macrophage cytokine activity regulates vascular smooth muscle cell function within a degradable polyurethane scaffold. Acta Biomaterialia. 10 (3), 1146-1155 (2014).
- Ploeger, D. T., et al. Cell plasticity in wound healing: paracrine factors of M1/ M2 polarized macrophages influence the phenotypical state of dermal fibroblasts. Cell Communication and Signaling. 11 (1), 29(2013).
- McBane, J. E., Santerre, J. P., Labow, R. S. The interaction between hydrolytic and oxidative pathways in macrophage-mediated polyurethane degradation. Journal of Biomedical Materials Research. Part A. 82 (4), 984-994 (2007).
- Wissing, T. B., et al. Macrophage-driven biomaterial degradation depends on scaffold microarchitecture. Frontiers in Bioengineering and Biotechnology. 7, 87(2019).
- Wolf, M. T., Vodovotz, Y., Tottey, S., Brown, B. N., Badylak, S. F. Predicting in vivo responses to biomaterials via combined in vitro and in silico analysis. Tissue Engineering Part C: Methods. 21 (2), 148-159 (2015).
- Grotenhuis, N., Bayon, Y., Lange, J. F., Van Osch, G. J. V. M., Bastiaansen-Jenniskens, Y. M. A culture model to analyze the acute biomaterial-dependent reaction of human primary macrophages. Biochemical and Biophysical Research Communications. 433 (1), 115-120 (2013).
- Jannasch, M., et al. A comparative multi-parametric in vitro model identifies the power of test conditions to predict the fibrotic tendency of a biomaterial. Scientific Reports. 7 (1), 1689(2017).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- McWhorter, F. Y., Davis, C. T., Liu, W. F. Physical and mechanical regulation of macrophage phenotype and function. Cellular and Molecular Life Sciences. 72 (7), 1303-1316 (2014).
- Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Strain-dependent modulation of macrophage polarization within scaffolds. Biomaterials. 35 (18), 4919-4928 (2014).
- Dziki, J. L., et al. The effect of mechanical loading upon extracellular matrix bioscaffold-mediated skeletal muscle remodeling. Tissue Engineering. Part A. 24 (1-2), 34-46 (2018).
- Wissing, T. B., et al. Hemodynamic loads distinctively impact the secretory profile of biomaterial-activated macrophages - implications for in situ vascular tissue engineering. Biomaterials Science. 8 (1), 132-147 (2020).
- Van Haaften, E. E., Wissing, T. B., Kurniawan, N. A., Smits, A. I. P. M., Bouten, C. V. C. Human in vitro model mimicking material-driven vascular regeneration reveals how cyclic stretch and shear stress differentially modulate inflammation and matrix deposition. Advanced Biosystems. 4 (6), 1900249(2020).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Bonito, V., de Kort, B. J., Bouten, C. V. C., Smits, A. I. P. M. Cyclic strain affects macrophage cytokine secretion and extracellular matrix turnover in electrospun scaffolds. Tissue Engineering Part A. 25 (17-18), 1310-1325 (2019).
- Battiston, K. G., Labow, R. S., Simmons, C. A., Santerre, J. P. Immunomodulatory polymeric scaffold enhances extracellular matrix production in cell co-cultures under dynamic mechanical stimulation. Acta Biomaterialia. 24, 74-86 (2015).
- Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. A mesofluidics-based test platform for systematic development of scaffolds for in situ cardiovascular tissue engineering. Tissue Engineering Part C: Methods. 18 (6), 475-485 (2012).
- Smits, A. I. P. M., Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. T. Shear flow affects selective monocyte recruitment into MCP-1-loaded scaffolds. Journal of Cellular and Molecular Medicine. 18 (11), 2176-2188 (2014).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Fahy, N., Menzel, U., Alini, M., Stoddart, M. J. Shear and dynamic compression modulates the inflammatory phenotype of human monocytes in vitro. Frontiers in Immunology. 10, 383(2019).
- Pennings, I., et al. Layer-specific cell differentiation in bi-layered vascular grafts under flow perfusion. Biofabrication. 12 (1), 015009(2019).
- Wang, J., et al. Ex vivo blood vessel bioreactor for analysis of the biodegradation of magnesium stent models with and without vessel wall integration. Acta Biomater. 50, 546-555 (2017).
- Huang, A. H., et al. Design and use of a novel bioreactor for regeneration of biaxially stretched tissue-engineered vessels. Tissue Engineering. Part C, Methods. 21 (8), 841-851 (2015).
- Huang, A. H., Niklason, L. E. Engineering biological-based vascular grafts using a pulsatile bioreactor. Journal of Visualized Experiments. (52), e2646(2011).
- Bono, N., et al. A Dual-mode bioreactor system for tissue engineered vascular models. Annals of Biomedical Engineering. 45 (6), 1496-1510 (2017).
- Wolf, F., et al. VascuTrainer: a mobile and disposable bioreactor system for the conditioning of tissue-engineered vascular grafts. Annals of Biomedical Engineering. 46 (4), 616-626 (2018).
- Ramaswamy, S., et al. A novel bioreactor for mechanobiological studies of engineered heart valve tissue formation under pulmonary arterial physiological flow conditions. Journal of Biomechanical Engineering. 136 (12), 121009(2014).
- Piola, M., et al. A compact and automated ex vivo vessel culture system for the pulsatile pressure conditioning of human saphenous veins. Journal of Tissue Engineering and Regenerative Medicine. 10 (3), 204-215 (2016).
- Vanerio, N., Stijnen, M., de Mol, B. A. J. M., Kock, L. M. An innovative ex vivo vascular bioreactor as comprehensive tool to study the behavior of native blood vessels under physiologically relevant conditions. Journal of Engineering and Science in Medical Diagnostics and Therapy. 2 (4), (2019).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplantation. 27 (9), 1375-1389 (2018).
- Sinha, R., et al. A medium throughput device to study the effects of combinations of surface strains and fluid-flow shear stresses on cells. Lab on a Chip. 15 (2), 429-439 (2015).
- Beca, B. M., Sun, Y., Wong, E., Moraes, C., Simmons, C. A. Dynamic bioreactors with integrated microfabricated devices for mechanobiological screening. Tissue Engineering Part C: Methods. 25 (10), 581-592 (2019).
- Liu, H., Usprech, J., Sun, Y., Simmons, C. A. A microfabricated platform with hydrogel arrays for 3D mechanical stimulation of cells. Acta Biomaterialia. 34, 113-124 (2016).
- Szafron, J. M., Ramachandra, A. B., Breuer, C. K., Marsden, A. L., Humphrey, J. D. Optimization of tissue-engineered vascular graft design using computational modeling. Tissue Engineering Part C: Methods. 25 (10), 561-570 (2019).
- Emmert, M. Y., et al. Computational modeling guides tissue-engineered heart valve design for long-term in vivo performance in a translational sheep model. Science Translational Medicine. 10 (440), (2018).
- Mol, A., et al. Fibrin as a cell carrier in cardiovascular tissue engineering applications. Biomaterials. 26 (16), 3113-3121 (2005).
- van Kelle, M. A. J., et al. A Bioreactor to identify the driving mechanical stimuli of tissue growth and remodeling. Tissue Engineering Part C: Methods. 23 (6), (2017).
- van den Broek, C. N., et al. Medium with blood-analog mechanical properties for cardiovascular tissue culturing. Biorheology. 45 (6), 651-661 (2008).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon